萜烯类化合物是已知最多的天然产物之一,其中包括单萜烯类、倍半萜烯类以及二萜烯类等化合物,例如柠檬醛、薄荷醇、树脂酸、角鲨烯、胡萝卜素等,是食品、医药、化妆品工业中不可或缺的原料[1]。异戊二烯(2-甲基-1,3-丁二烯)作为萜烯类化合物的重要成员,是工业上合成橡胶的重要原料,它的聚合物是一类重要的橡胶品种。此外,作为最简单萜类化合物,异戊二烯也是其他萜类化合物的基本骨架[2]。异戊二烯通常以石油资源为原料,由化学合成法生产,而这些方法会消耗大量资源并造成严重的污染[3]。此外,化学合成法还会受到石油价格、供应波动,以及资源锐减的影响。所以,开发利用可再生原料生产异戊二烯的可靠生物工艺可为行业带来新的发展。一些用于生产异戊二烯的生物基工艺已在模式生物中得到了广泛的研究,例如在酵母(Saccharomyces cerevisiae)[4]和大肠杆菌(Escherichia coli)中[5]。迄今为止,2个自然界中独立的类异戊二烯合成途径已经被研究人员发现[6-7],分别是甲羟戊酸(mevalonate, MVA)途径以及甲基赤藓糖醇-磷酸(2-C-methylerythritol-4-phosphate, MEP)途径[8]。其中MVA途径在大肠杆菌中异源表达是提高异戊二烯和其他萜类化合物产量的有效途径[9-10]。异戊二烯由基本前体异戊烯基二磷酸(isopentenyl pyrophosphate, IPP)异构为二甲基烯丙基二磷酸(dimethylallyl pyrophosphate,DMAPP),在异戊二烯合酶(isoprene synthase,IspS)的催化作用下合成。
目前,已在E.coli和S.cerevisiae中广泛研究了MEP和MVA代谢途径,尤其着重于平衡代谢通量和增加辅助因子的利用率[11]。而在类异戊二烯生物合成面临的各种挑战中,研究人员通常认为不能积累足够量的IPP和DMAPP是主要瓶颈之一。异戊烯基焦磷酸异构酶(isopentenyl diphosphate isomerase, IDI)是萜类生物合成的关键限速酶,催化IPP和DMAPP之间的相互转化[12-13]。根据不同的途径,IDI在萜类生物合成过程中发挥着不同但重要的作用[14]。天然条件的IDI存在活性低、底物亲和力差、半衰期短等限制因素,所以可以通过蛋白质工程对该关键酶进行改造,以期提高IPP和DMAPP的积累。WANG等[15]基于前体毒性开发1种高通量筛选的方法,应用于异戊二烯合酶的定向进化,筛选出的最佳突变体ISPSM4,其在酿酒酵母中分批补料发酵的产量达3.4 g/L。启动子工程和核糖体结合位点(ribosome binding site,RBS)工程也是行之有效的方法。YUAN等[16]通过增强IDI的表达,将β-胡萝卜素的产量提高了1.4倍。当通过启动子优化上调Mva K1的表达时,紫穗槐二烯产量大幅提升[17]。将MVA途径插入具有强启动子的高拷贝质粒中,可以进一步增加异戊二烯的产量[18]。LIU等[9]运用反义RNA策略,降低了副产物的产生,引导更多的DMAPP合成异戊二烯。通过密码子优化和RBS序列的调整增强IspS的表达,实现了类异戊二烯产量的增加[17]。
本课题组前期在大肠杆菌中建立了MVA途径表达系统。针对限速酶IDI活性不强等问题,本研究采用理性工程的组合策略,运用酶分子改造、启动子优化和RBS策略,分别从基因水平、转录水平和翻译水平这3个层面对IDI进行表达调控,以进一步提高异戊二烯的产量。
1 材料与方法
1.1 材料与试剂
1.1.1 主要试剂
限制性内切酶,NEB和TaKaRa;Taq DNA聚合酶、pfu DNA聚合酶,CWBIO;PrimeSTAR® HS DNA聚合酶,TaKaRa;2× MultiF Seamless Assembly Mix,Abclonal;引物,金唯智科技有限公司。所有试剂和化学品皆为分析纯,除非另有说明,均为商业来源。
1.1.2 菌株与质粒
本研究中构建的质粒和菌株如表1所示,所使用的引物如表2所示。
表1 本研究中的菌株和质粒
Table 1 Strains and plasmids used in this study

表2 本研究中的引物
Table 2 Primers used in this study

引物名称引物序列(5′-3′)pACYC-Idi-FAGGATTTGAGTCAAGATGATTGCTGTTAACCGAGCTTTAAGAAGGAGATATACATGACGACAAATCGTAAGGpACYC-Idi-RTGCTAGTTATTGCTCAGCGGTGGCAGCAGCTTACGCCTTTTTCATCTGATCATTTGCTTCMet146His-FGTGCATGTCAATGTCCATCAGGAATTACTCATGCCCMet146His-RGGGCATGAGTAATTCCTGATGGACATTGACATGCACMet146Leu-FGTGCATGTCAATGTCCTGCAGGAATTACTCATGCCCMet146Leu-RGGGCATGAGTAATTCCTGCAGGACATTGACATGCACMet146Phe-FGTGCATGTCAATGTCCCGCAGGAATTACTCATGCCCMet146Phe-RGGGCATGAGTAATTCCTGCGGGACATTGACATGCACMet146Thr-FGTGCATGTCAATGTCACCCAGGAATTACTCATGCCCMet146Thr-RGGGCATGAGTAATTCCTGGGTGACATTGACATGCACOverlap IDI-FAGGATTTGAGTCAAGATGATTGCTGTTAACTCGAGCOverlap IDI-RTGCTAGTTATTGCTCAGCGGTGGCpACYC-esmpd-FTGCTGCCACCGCTGAGCAATAACTAGCApACYC-esmpd-RGCTCGAGTTAACAGCAATCATCTTGACTCAA(pET28a)-Idi-FCTTTAAGAAGGAGATATACCATGACGACAAATCGTAAGGA(pET28a)-Idi-RGCAGCCAACTCAGCTTCCTTTCGGGCTTTGTTACGCCTTTTTCATCTGATCT7-1-FTATTACGACTCACTATAGGGGAATTGTGAGCGGATAACAAT7-1-RCCTATAGTGAGTCGTAATAATTTCGCGGGATCGAGATCTCGATCCTCTAT7-2-FATATACGACTCACTATAGGGGAATTGTGAGCGGATAACAAT7-2-RCCTATAGTGAGTCGTATATATTTCGCGGGATCGAGATCTCGATCCTCTAT7-3-FTAATGCGACTCACTATAAGGGAATTGTGAGCGGATAACAAT7-3-RCTTATAGTGAGTCGCATTAATTTCGCGGGATCGAGATCTCGATCCTCTAT7-4-FTAATAGGACTCACTATTGGGGAATTGTGAGCGGATAACAAT7-4-RCCAATAGTGAGTCCTATTAATTTCGCGGGATCGAGATCTCGATCCTCTAT7-5-FTGATACGACTCACTATAGGGGAATTGTGAGCGGATAACAAT7-5-RCCTATAGTGAGTCGTATCAATTTCGCGGGATCGAGATCTCGATCCTCTARBS-1-FCTCCTCCGGGCTAAGGGAGTATATTATGACGACAAATCGTAAGGACRBS-1-RAATATACTCCCTTAGCCCGGAGGAGCAAAATTATTTCTAGAGGGGAATTGTTATCRBS-2-FCTCCTCTGGGCTAAGGGAGTATATTATGACGACAAATCGTAAGGACRBS-2-RAATATACTCCCTTAGCCCAGAGGAGCAAAATTATTTCTAGAGGGGAATTGTTATCRBS-3-FCTCACCCAGGCTAAGGGAGTATATTATGACGACAAATCGTAAGGACRBS-3-RAATATACTCCCTTAGCCTGGGTGAGCAAAATTATTTCTAGAGGGGAATTGTTATCRBS-4-FCTCCCCCAGGCTAAGGGAGTATAGTATGACGACAAATCGTAAGGACRBS-4-RACTATACTCCCTTAGCCTGGGGGAGCAAAATTATTTCTAGAGGGGAATTGTTATCpET28a-(Idi)-linear-FCAAAGCCCGAAAGGAAGCTGpET28a-(Idi)-linear-RGGTATATCTCCTTCTTAAAGTTAAACAAAAGln16Phe-FATCCTCTATGCCCTTGAGTTTAAAAGTTCCTATAATGln16Phe-RATTATAGGAACTTTTAAACTCAAGGGCATAGAGGATAsp121Phe-FCTTGGAACCAATATTGGATTGTTTAAGCCTGTCGAGAsp121Phe-RCTCGACAGGCTTAAACAATCCAATATTGGTTCCAAG
1.1.3 培养基
LB(Luria-Bertani)培养基(g/L):酵母提取物5,胰蛋白胨10,NaCl 10,用于构建质粒过程中培养菌株。抗生素氨苄青霉素、卡那霉素、氯霉素的质量浓度分别为100、50、30 mg/L。
M9培养基:33.7 mmol/L Na2PO4,22.0 mmol/L KH2PO4,8.55 mmol/L NaCl,9.35 mmol/L NH4Cl,1 mmol/L MgSO4,0.3 mmol/L CaCl2,1 mg/L生物素,1 mg/L维生素B1,0.134 mmol/L EDTA,31 mmol/L FeCl3·6H2O,6.2 mmol/L ZnCl2,0.76 mmol/L CuCl2·2H2O,0.42 mmol/L CoCl2·2H2O,1.62 mmol/L H3BO3,0.081 mmol/L MnCl2·H2O,3 g/L 酵母提取物和20 g/L葡萄糖,用于异戊二烯的生产。固体培养基为液体培养基中添加2%(质量分数)的琼脂粉。
1.1.4 仪器与设备
GCMS-QP2020型气相色谱质谱联用仪,岛津;LongGene A300型PCR仪,朗基科学仪器有限公司。本研究所用其他材料及设备参照文献[19]。
1.2 实验方法
1.2.1 蛋白质建模和关键位点分析
从UniProt数据库获得肺炎链球菌(Streptococcus pneumoniae)来源的IDI的氨基酸序列,利用I-TASSER(https://zhanggroup.org/I-TASSER/)构建蛋白质模型,根据SAVES(https://saves.mbi.ucla.edu/)的质量评估工具:ERRAT、PROVE、WHAT_CHECK、PROCHECK等,对各个PDB模型进行打分并选择出最佳的得分模型。使用HotSpot Wizard(https://loschmidt.chemi.muni.cz/hotspotwizard/)选择位于活性口袋或隧道中的高度易变残基相对应的功能性热点进行分析,确定突变热点氨基酸位点为Met146,构建饱和突变体库,计算突变体的热稳定性,并构建质粒。
1.2.2 基因克隆和质粒构建
使用引物对pACYC-Idi-F/Idi-pACYC-R,分别以实验室前期构建的质粒、大肠杆菌BL21基因组、酿酒酵母s288c基因组为模板扩增基因idi,在pACYC-esmpd的XhoⅠ和AvrⅡ双酶切,Gibson组装法连接插入基因片段,得到质粒pACYC-esmpd-idi、pACYC-esmpd-idi-EC和pACYC-esmpd-idi-SC。
Met146His等单点突变使用PCR产生。以质粒pACYC-esmpd-IDI为模板,分别使用引物对Met146His-R/Overlap IDI-F,Met146His-F/Overlap IDI-R;Met146 Leu -R/Overlap IDI-F,Met146Leu -F/Overlap IDI-R;Met146Phe -R/Overlap IDI-F,Met146Phe -F/Overlap IDI-R;Met146Thr -R/Overlap IDI-F,Met146Thr -F/Overlap IDI-R进行PCR,然后重叠PCR得到IDI-MUT片段,Gibson组装法连接Xho I和Avr II双酶切的pACYC-esmpd骨架,构成质粒pACYC-esmpd-idimut。
使用引物对pET28a-(Idi)-linear-F/pET28a-(Idi)-linear-R线性化载体pET28a,(pET28a)-Idi-F/(pET28a)-Idi-R得到idi片段,Gibson组装得到质粒pET-IDI。使用引物对T7-R/T7-F,RBS-R/RBS-F环P质粒pET-IDI再进行Gibson组装得到T7变体和BRS变体质粒pET-T7-IDI,pET-RBS-IDI。
1.2.3 菌株的培养
将质粒转化至大肠杆菌BL21(DE3)中。平板上随机挑选3个菌落PCR验证为阳性的克隆,接种至LB种子培养基于37 ℃、220 r/min恒温振荡培养箱过夜培养。次日转接至培养基LB中,当OD600至0.6~0.8时添加0.5 mmol/L异丙基β-D-1-硫代吡喃半乳糖苷(isopropyl-β-D-thiogalactopyranoside, IPTG)诱导蛋白表达。24 h和48 h取样并进行检测。
1.2.4 异戊二烯的检测
通过顶空自动进样器将20 mL密封小瓶中的1 mL气体样品注入气相色谱质谱仪。GC-MS仪器配置为:电子碰撞(electron impact, EI)检测器和TG-WAXMS色谱柱(30 m×0.25 mm×0.25 μm薄膜厚度)。方法条件:入口温度200 ℃,氮气载气恒定流量1.10 mL/min,传输线温度300 ℃,离子源温度250 ℃,扫描m/z 50~300。执行以下程序:初始温度为40 ℃保持1 min,然后以15 ℃/min的速率升至200 ℃,最后保持1 min。在用70 ℃的顶空针进样前,将样品在60 ℃孵育10 min,振荡10 s。分析抽取的样品为1 mL,并以1∶50的比例分流到色谱柱中。通过与一组已知浓度的异戊二烯绘制的标准曲线比较,将峰面积转换为异戊二烯浓度进行定量。
2 结果与分析
2.1 不同来源IDI的筛选和MVA表达体系的构建
IDI催化IPP和DMAPP之间的转化,被证明是部分类异戊二烯生产的关键酶。不同来源的IDI之间往往具有不同强度的活性[20]。根据现有的报道,将来自S.cerevisiae的IDI(IDI-SC)、来自E.coli的IDI(IDI-EC)和来自S.pneumoniae 的IDI(IDI-SP)引入,构建DMAPP表达质粒pACYC-esmpd-idi。该质粒和pET-IspS共转化大肠杆菌BL21(DE3),以构建异戊二烯在大肠杆菌中的生产体系。随机挑选平板上的3个阳性克隆在20 mL密闭小瓶的4 mL M9培养基中培养。通过GC-MS检测异戊二烯的产量,我们发现这3种不同来源的酶活性不同,会造成异戊二烯产量的差异。如图1所示,与其他2种IDI相比较,IDI-SP对于生产异戊二烯的贡献最大,产量达到了334.266 mg/L,IDI-EC和IDI-SC的产量分别为42.790、277.509 mg/L。因此在接下来的工作中,我们能选择以IDI-SP为基础进行改造和优化。

图1 不同来源IDI对异戊二烯生产的影响
Fig.1 Isoprene production from different sources of IDI
2.2 基于分子模拟理性改造IDI
接下来,对肺炎链球菌来源的idi基因进行了定点突变。使用1.2.1节的方法,挑选饱和突变体库中热稳定性最高的4种突变体构建质粒。突变Met146His、Met146Leu、Met146Thr和Met146Phe使用PCR产生。使用热击法将质粒转化进入大肠杆菌DH5α中。
将突变体质粒pACYC-esmpd-idi与pET-IspS共转化到E.coli BL21(DE3)中,以GC-MS检测48 h时异戊二烯的产量来验证突变体IDI的酶活力。如图2所示,与野生型相比,Met146残基替代成His后,单位OD600的异戊二烯产量达到了野生型的198%,产量提高至820.46 mg/L。其他3个突变体也表现出了异戊二烯产能的提升,分别生产了579.46、553.86、484.18 mg/L的异戊二烯。在重复发酵实验中Met146His菌株再次表现出了提高异戊二烯产量的能力。

a-IDI突变体的异戊二烯产量;b-IDI突变体单位OD600的异戊二烯产量
图2 IDI突变体对异戊二烯生产的影响
Fig.2 Isoprene production from different sources of IDI
为了更深层地了解IDI改造导致产物产量增加的分子基础,使用来自肺炎链球菌的IPP异构酶(PBD ID:4N02)作为IDI模型的模板,进行计算机建模和分子对接。如图3所示,疏水性氨基酸146-MET突变为带正电荷侧链的146-HIS后,61-MET、209-THR和底物的疏水作用力被改变,疏水性减弱,该区域的灵活性增加,因此可能提高了催化速率。以上结果显示,我们成功地构建了4个IDI突变体,其中Met146His的活性最高。

a-突变体Met146His的结构;b-突变体Met146His和IPP结合
图3 突变体Met146His的结构模拟和底物IPP的分子对接
Fig.3 Structural simulation of the mutant Met146His and molecular docking of the substrate IPP
2.3 启动子工程优化关键酶IDI的表达提高异戊二烯生产
为进一步优化IDI的表达水平,选择了启动子优化策略,设计不同强度的启动子序列,用于IDI表达量的分析和对异戊二烯产量影响的研究。T7启动子是目前大肠杆菌表达系统中最为强大且专一性高的启动子,根据KOMURA等[21]的研究,T7变体的转录活性与所得蛋白质丰度密切相关。以RNA read/DNA read为指标量化T7变体的转录活性,如表3所示,选择了不同强度的T7启动子,来探究其对IDI表达以及异戊二烯生产的影响。
表3 T7启动子突变体
Table 3 T7 promoter mutants
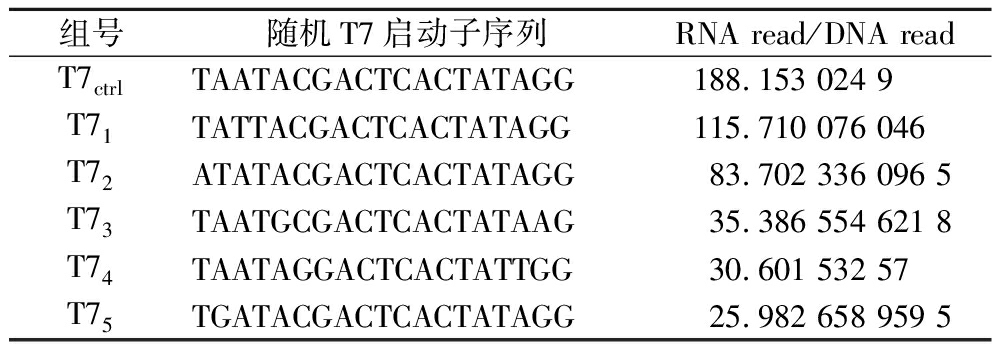
组号随机T7启动子序列RNA read/DNA readT7ctrlTAATACGACTCACTATAGG188.153 024 9 T71TATTACGACTCACTATAGG115.710 076 046T72ATATACGACTCACTATAGG83.702 336 096 5T73TAATGCGACTCACTATAAG35.386 554 621 8T74TAATAGGACTCACTATTGG30.601 532 57T75TGATACGACTCACTATAGG25.982 658 959 5
如图4所示,在不同强度的启动子下工程菌株表现出不同的产物产量。T71的异戊二烯产量为763.002 mg/L,显著高于ControlT7和其他T7变体。这表明经过启动子优化后,异戊二烯的产量可以得到进一步的提升,其中T71对IDI表达有增强效应。
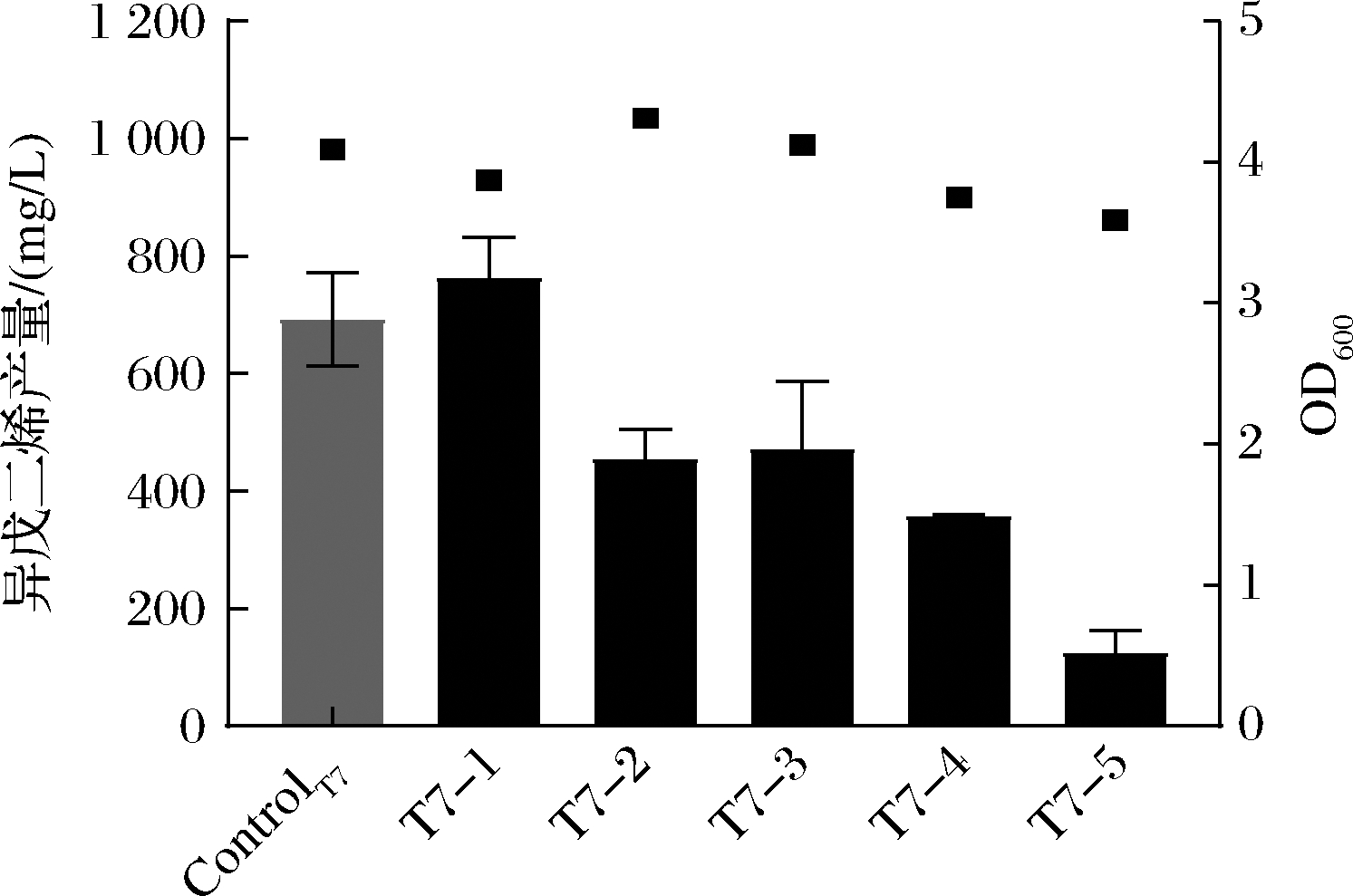
图4 不同T7调控IDI对异戊二烯生产的影响
Fig.4 Effect of different T7-regulated IDIs on isoprene production
2.4 RBS优化关键酶IDI的表达对异戊二烯生产的影响
菌株代谢工程的另一种有力策略是对基因的RBS进行优化。LI等[20]研究来源于Staphylococcus aureus的IDI发现,在RBS修饰后其表达得到改善,导致异戊二烯产量增加1 610倍。使用RBS Calculator(https://docs.denovodna.com/docs/rbs-calculator)在线设计了不同强度的RBS以调控IDI的表达,RBS序列如表4所示。
表4 RBS突变体
Table 4 RBS mutants

组号RBS序列T.I.R/auRBSWTUUUAACUUUAAGAAGGAGAUAUACC11 347.889 41RBS1CUCCUCCGGGCUAAGGGAGUAUAUU10 255.348 59RBS2CUCCUCUGGGCUAAGGGAGUAUAUU6 657.580 708RBS3CUCACCCAGGCUAAGGGAGUAUAUU3 631.257 808RBS4CUCCCCCAGGCUAAGGGAGUAUAGU1 041.450 259
如图5所示,以Met146His-T71为ControlRBS,翻译起始速率(translation initiation rate,T.I.R)为6 657.580 708 au的RBS变体在摇瓶发酵中体现出最好的调控效果,生产了862.79 mg/L的异戊二烯,与ControlRBS相比提升了40%。
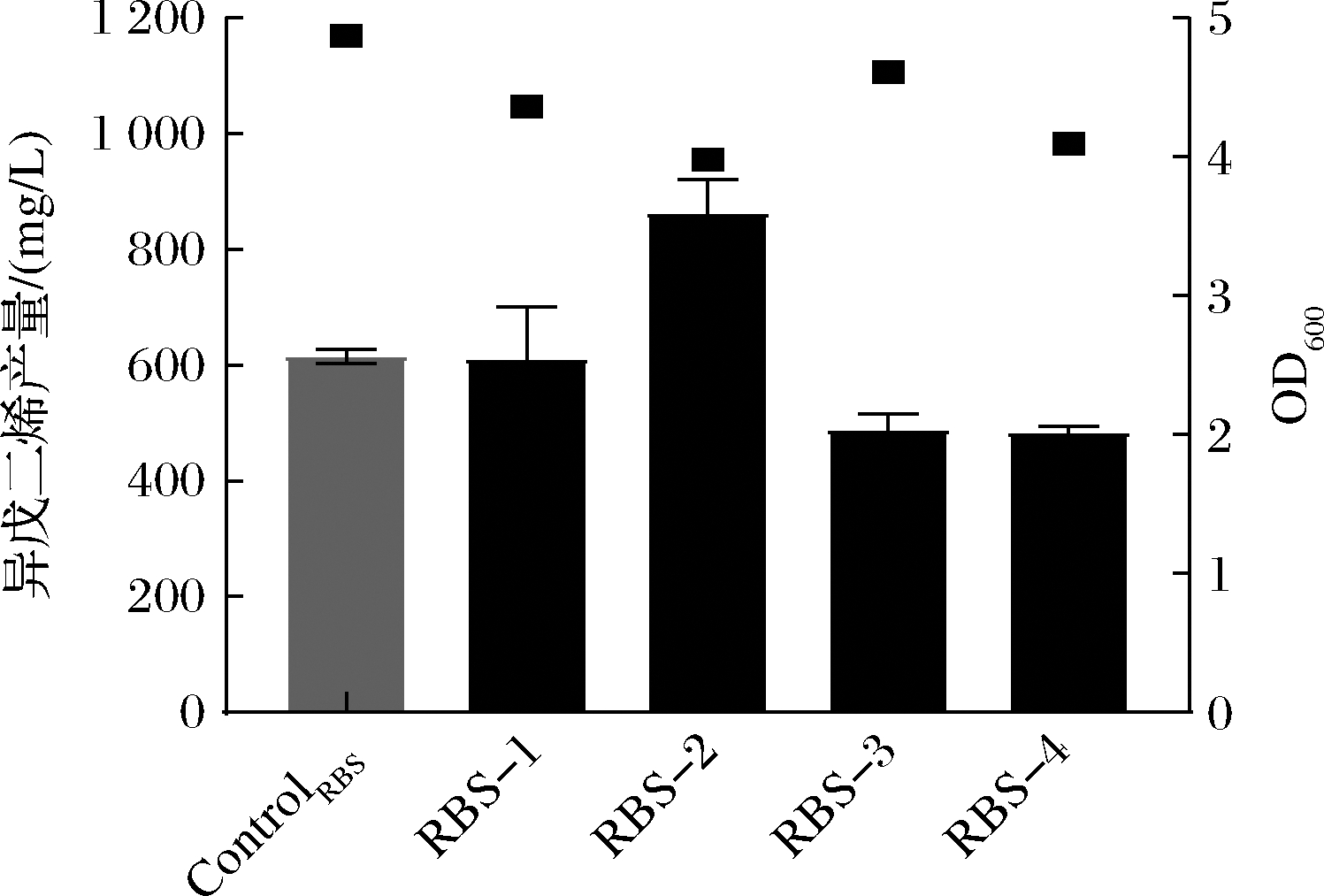
图5 不同RBS调控IDI对异戊二烯生产的影响
Fig.5 Effect of various RBS-regulated IDIs on isoprene production
3 讨论
用于菌株工程的大多数方法可以分为2种类型,理性工程和适应性进化。对酶蛋白进行定点诱变改造,调控酶表达的策略等都属于理性工程[20]。对于异戊二烯的生产,大多采用合理的工程方法。LYU等[22]通过启动子替换和诱导剂调整,改变上游和下游途径模块之间的代谢通量使异戊二烯的最终产量提高了4.7倍。CHEN等[23]在酿酒酵母中通过定点诱变构建了IDI突变体,与野生型IDI相比,突变型IDI的番茄红素产量增加了1.8倍。
IDI被证实是类异戊二烯生产途径中的一种关键酶,负责催化IPP和DMAPP之间的转化。通过蛋白质工程制备优良的IDI,以解除其半衰期短、酶活性低和底物亲和力弱等限制非常重要。我们先比较了不同物种来源的IDI对异戊二烯生产的影响。然后,使用理性设计的方法对S. pneumoniae来源的IDI进行了定点诱变,通过对酶蛋白建立模型并分析了功能热点,计算出了突变位点Met146,将突变体导入异戊二烯生产菌株中,得到了一株最优的突变体Met146His,其使得异戊二烯的产量提高至97.29 mg/L。
从乙酰辅酶A生产异戊二烯需要8个催化步骤,代谢通量的平衡难以实现[24]。为了达到代谢通量平衡,酶表达的调节是必要的。许多因素,包括启动子、RBS序列、伴侣蛋白、温度、pH值等,都被证明影响酶的表达[25]。一般来说,酶的表达主要在转录、翻译和翻译后水平受到调节,转录和翻译水平的调控被广泛应用。本研究中,启动子工程被用于调控IDI的转录水平。在T7启动子的基础上,构建了5个不同强度的T7启动子的变体,来观察IDI表达的改变对异戊二烯生产的影响。在不同强度的启动子调控下分别产生了763.002、454.893、472.032、356.622和124.565 mg/L的异戊二烯。RBS序列优化在很多相关研究中都被证明是在翻译水平调节酶表达水平的有效策略。因此,在启动子策略后应用了RBS策略,从翻译水平调控了IDI的表达水平,并且获得了异戊二烯产量提高的菌株。T.I.R为6 657.580 708 au的RBS变体体现出最好的调控效果,生产了862.79 mg/L的异戊二烯。然而,RBS序列优化,包括所有的理性设计工程,并不总是能很好地发挥作用。在本研究中,3 631.257 808和1 041.450 259 au的RBS序列优化也会导致异戊二烯产量降低。同时需要注意的是,启动子序列、RBS序列只是部分影响酶表达的因素,但不是唯一的因素。
4 结论
综上所述,本研究在大肠杆菌中应用组合策略,针对甲羟戊酸代谢途径中的关键酶IDI,采用定点诱变、启动子工程和RBS优化,得到了异戊二烯产量提升2.58倍的工程菌株。与以往对IDI进行3轮易错PCR和饱和突变[23]的改造方法相比,本研究采用理性设计的方法,经过模拟计算再进行定点诱变,显著简化和缩短了酶改造的过程,大大提高了其效率。这是对于Streptococcus pneumoniae来源的IDI首次进行改造和表达优化,使异戊二烯在大肠杆菌中的摇瓶水平产量达到了862.79 mg/L。IDI的改造同时也可以应用于倍半萜、二萜等下游产物的生物合成。
[1] NOWICKA B, KRUK J. Occurrence, biosynthesis and function of isoprenoid quinones[J]. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 2010, 1797(9):1587-1605.
[2] AJIKUMAR P K, TYO K, CARLSEN S, et al. Terpenoids: Opportunities for biosynthesis of natural product drugs using engineered microorganisms[J]. Molecular Pharmaceutics, 2008, 5(2):167-190.
[3] GUENTHER A, KARL T, HARLEY P, et al. Estimates of global terrestrial isoprene emissions using MEGAN (Model of Emissions of Gases and Aerosols from Nature)[J]. Atmospheric Chemistry and Physics, 2006, 6(11):3181-3210.
[4] HONG S Y, ZURBRIGGEN A S, MELIS A. Isoprene hydrocarbons production upon heterologous transformation of Saccharomyces cerevisiae[J]. Journal of Applied Microbiology, 2012, 113(1): 52-65.
[5] LIU C L, FAN L H, LIU L, et al. Combinational biosynthesis of isoprene by engineering the MEP pathway in Escherichia coli[J]. Process Biochemistry, 2014, 49(12): 2078-2085.
[6] LIU H W, SUN Y Z, RAMOS K R M, et al. Combination of Entner-Doudoroff pathway with MEP increases isoprene production in engineered Escherichia coli[J]. PLoS One, 2013, 8(12): e83290.
[7] RAMOS K R M, VALDEHUESA K N G, LIU H W, et al. Combining De Ley-Doudoroff and methylerythritol phosphate pathways for enhanced isoprene biosynthesis from D-galactose[J]. Bioprocess and Biosystems Engineering, 2014, 37(12):2505-2513.
[8] YOON S H, LEE Y M, KIM J E, et al. Enhanced lycopene production in Escherichia coli engineered to synthesize isopentenyl diphosphate and dimethylallyl diphosphate from mevalonate[J]. Biotechnology and Bioengineering, 2006, 94(6):1025-1032.
[9] LIU C L, LV Q A, TAN T W. Joint antisense RNA strategies for regulating isoprene production in Escherichia coli[J]. RSC Advances, 2015, 5(91):74892-74898.
[10] ÖZAYDIN B, BURD H, LEE T S, et al. Carotenoid-based phenotypic screen of the yeast deletion collection reveals new genes with roles in isoprenoid production[J]. Metabolic Engineering, 2013, 15: 174-183.
[11] NAVALE G R, DHARNE M S, SHINDE S S. Metabolic engineering and synthetic biology for isoprenoid production in Escherichia coli and Saccharomyces cerevisiae[J]. Applied Microbiology and Biotechnology, 2021, 105(2): 457-475.
[12] BERTHELOT K, ESTEVEZ Y, DEFFIEUX A, et al. Isopentenyl diphosphate isomerase: A checkpoint to isoprenoid biosynthesis[J]. Biochimie, 2012, 94(8): 1621-1634.
[13] LIU Z, ZHANG Y C, JIA X G, et al. In vitro reconstitution and optimization of the entire pathway to convert glucose into fatty acid[J]. ACS Synthetic Biology, 2017, 6(4):701-709.
[14] RAD S A, ZAHIRI H S, NOGHABI K A, et al. Type 2 IDI performs better than type 1 for improving lycopene production in metabolically engineered E. coli strains[J]. World Journal of Microbiology and Biotechnology, 2012, 28(1): 313-321.
[15] WANG F, LV X M, XIE W P, et al. Combining Gal4p-mediated expression enhancement and directed evolution of isoprene synthase to improve isoprene production in Saccharomyces cerevisiae[J]. Metabolic Engineering, 2017, 39:257-266.
[16] YUAN L Z, ROUVI RE P E, LAROSSA R A, et al. Chromosomal promoter replacement of the isoprenoid pathway for enhancing carotenoid production in E. coli[J]. Metabolic Engineering, 2006, 8(1):79-90.
RE P E, LAROSSA R A, et al. Chromosomal promoter replacement of the isoprenoid pathway for enhancing carotenoid production in E. coli[J]. Metabolic Engineering, 2006, 8(1):79-90.
[17] KIM J H, WANG C, JANG H J, et al. Isoprene production by Escherichia coli through the exogenous mevalonate pathway with reduced formation of fermentation byproducts[J]. Microbial Cell Factories, 2016, 15(1): 1-10.
[18] REDDING-JOHANSON A M, BATTH T S, CHAN R, et al. Targeted proteomics for metabolic pathway optimization: Application to terpene production[J]. Metabolic Engineering, 2011, 13(2): 194-203.
[19] 李翔. 甘油对巴斯德毕赤酵母甲醇代谢影响的转录组学研究[D]. 无锡: 江南大学, 2018.
LI X. Transcriptomic analysis of impacts of glycerol on methanol metabolism in Pichia pastoris[D]. Wuxi: Jiangnan University, 2018.
[20] LI M J, CHEN H L, LIU C Q, et al. Improvement of isoprene production in Escherichia coli by rational optimization of RBSs and key enzymes screening[J]. Microbial Cell Factories, 2019, 18(1):1-12.
[21] KOMURA R, AOKI W, MOTONE K, et al. High-throughput evaluation of T7 promoter variants using biased randomization and DNA barcoding[J]. PLoS One, 2018, 13(5): e0196905.
[22] LYU X M, GU J L, WANG F, et al. Combinatorial pathway optimization in Escherichia coli by directed co-evolution of rate-limiting enzymes and modular pathway engineering[J]. Biotechnology and Bioengineering, 2016, 113(12):2661-2669.
[23] CHEN H L, LI M J, LIU C Q, et al. Enhancement of the catalytic activity of Isopentenyl diphosphate isomerase (IDI) from Saccharomyces cerevisiae through random and site-directed mutagenesis[J]. Microbial Cell Factories, 2018, 17(1):1-14.
[24] TIAN T A, KANG J W, KANG A, et al. Redirecting metabolic flux via combinatorial multiplex CRISPRi-mediated repression for isopentenol production in Escherichia coli[J]. ACS Synthetic Biology, 2019, 8(2):391-402.
[25] FORDJOUR E, MENSAH E O, HAO Y P, et al. Toward improved terpenoids biosynthesis: Strategies to enhance the capabilities of cell factories[J]. Bioresources and Bioprocessing, 2022, 9(1):6.