核桃(Juglans regia L.)别称胡桃,是胡桃科经济作物。2020年我国核桃产量达到479.59万t,居世界首位[1]。核桃含有丰富的脂肪、蛋白质等营养物质。核桃肽主要通过化学法、酶法降解或微生物发酵制备而成。核桃肽消化吸收性能好、安全性高,而且还具有多种生理调节功能,如抗氧化、免疫调节、降血压、降血糖和降血脂等[2-3]。
Plastein反应又称类蛋白反应,为蛋白酶存在下,其水解反应的逆反应[4]。Plastein反应产物制备分为3步:水解、浓缩和合成。Plastein反应为第3步,即合成,其可以用于减少蛋白酶解液的苦味[5],修饰活性肽以提高肽的生物活性,如抗氧化活性、血管紧张素转化酶(angiotensin Ⅰ converting enzyme,ACE)抑制活性。UDENIGWE等[6]利用类蛋白反应,使酪蛋白的铁还原潜能显著增加(P<0.05);高丹丹等[7]通过Plastein反应修饰使马铃薯蛋白ACE抑制肽的抑制率提高了1.35倍。Plastein反应还用于改善牡蛎[8]、南瓜籽[9]酶解物的ACE抑制活性。目前未发现将Plastein反应用于核桃ACE抑制肽的修饰。
本研究利用Plastein反应对核桃ACE抑制肽进行修饰,研究了底物浓度、反应温度、反应时间以及添加外源氨基酸对该反应的影响,以提高ACE抑制肽的活性。探究了离子浓度、温度和变性剂浓度对Plastein产物结构稳定性的影响,采用圆二色光谱和X-射线衍射分析研究Plastein反应产物的结构信息,并和未修饰的ACE抑制肽进行对比分析,探究Plastein反应对ACE抑制肽结构的影响。
1 材料与方法
1.1 材料与仪器
核桃分离蛋白,实验室前期制备;碱性蛋白酶(200 U/mg),上海源叶生物科技有限公司;中性蛋白酶(60 000 U/g)、苯丙氨酸、甘氨酸、亮氨酸,北京蓝弋科技有限公司;ACE、马尿酰组氨酰亮氨酸(N-hippuryl-his-leu hydrate, HHL),美国Sigma公司;乙腈(色谱纯),天津市康科德科技有限公司;其他试剂均为分析纯。
新芝-12N型冷冻干燥机,宁波新芝生物科技股份有限公司;HC-2518R型高速冷冻离心机,安徽中科中佳科学仪器有限公司;VivaFlow超滤膜包,德国赛多利斯公司;LC-2010A HT型高效液相色谱,日本岛津公司;L6型紫外可见分光光度计,上海仪电分析仪器有限公司;Jasco-815型圆二色谱仪,Jasco日本分光公司;D8 ADVANCE型X-射线衍射仪,德国布鲁克AXS公司。
1.2 实验方法
1.2.1 核桃ACE抑制肽的制备
参照JIN等[10]的方法并稍作修改。将核桃蛋白加入去离子水使质量浓度为50 g/L,调节pH为9.5,加入5% (质量分数)碱性蛋白酶,在55 ℃下酶解3 h。灭酶后调节pH为7.0,加入4.17%(质量分数)中性蛋白酶,在45 ℃下酶解1.5 h,灭酶。离心收集上清液,上清液过超滤膜,得到<5 kDa的核桃多肽,将滤液冷冻干燥后置于-20 ℃冷藏储存备用。
1.2.2 水解度测定
采用甲醛滴定法。调整酶解液pH为7.0,之后加入甲醛溶液,混合均匀。使用NaOH溶液滴定至pH 9.2,消耗NaOH溶液体积记为V1。取相同浓度的未水解的蛋白溶液,做空白试验,消耗的NaOH溶液体积记为V2。水解度的计算如公式(1)所示:
水解度![]()
(1)
式中:c,NaOH溶液的浓度,mol/L;ρ,所用酶解液的蛋白质量浓度,g/L;V,酶解液的体积,mL;Htot,每克原料蛋白中肽键物质的量,mmol,其中核桃蛋白的Htot为8.0 mmol/g。
1.2.3 ACE抑制肽体外ACE抑制率测定
参考SANGSAWAD等[11]的方法。取待测溶液40 μL,加入20 μL的ACE溶液(0.1 U/mL),37 ℃保温5 min后加入50 μL的HHL溶液反应60 min。之后加入HCl溶液终止反应。使用硼酸盐缓冲液代替待测溶液重复以上步骤作为空白对照。使用高效液相色谱测定样品中马尿酸的峰面积。根据公式(2)计算ACE抑制率:
ACE抑制率![]()
(2)
式中:a,空白对照组中的马尿酸的峰面积;b,添加抑制剂组中的马尿酸的峰面积。
1.2.4 Plastein反应修饰ACE抑制肽
参照XU等[12]的方法,并略作修改。配制一定底物质量分数的核桃多肽溶液,调节pH为9.0,加入核桃多肽质量分数2%的碱性蛋白酶。以混合物的游离氨基酸减少量及ACE抑制率为指标,探究底物浓度、反应温度和反应时间对Plastein反应的影响。
1.2.5 添加外源氨基酸的Plastein修饰反应
按照1.2.4节中得到的Plastein反应条件进行反应,并在体系中分别添加亮氨酸、甘氨酸和苯丙氨酸,制备外源氨基酸存在下的Plastein反应修饰物,并分别测定修饰产物的游离氨基酸减少量及ACE抑制率。
1.2.6 游离氨基酸含量测定
采用邻苯二甲醛(o-phthalaldehyde,OPA)法[8]。在340 nm处测定吸光值,绘制标准曲线y=0.016 89x+0.001 48,R2=0.999 7。在相同条件下测定样品吸光值,通过标准曲线计算样品中的游离氨基酸含量。样品游离氨基酸的减少量(μmol/g)=反应前游离氨基酸含量-反应后游离氨基酸含量。
1.2.7 Plastein反应验证实验
在相同浓度下测定不同修饰物的ACE抑制率,并且与修饰前的ACE抑制肽作比较。
1.2.8 Plastein反应产物结构稳定性实验
1.2.8.1 温度稳定性
参考DOUCET等[13]的方法,略作修改。将Plastein反应产物配成质量浓度为5 mg/mL的溶液,分别在0、20、40、60、80、100 ℃下保温5 min,在420 nm下测定溶液的浊度。
1.2.8.2 离子稳定性
参考JIANG等[14]的方法,并略作修改。分别用不同浓度梯度的NaCl溶液将Plastein反应产物配制成5 mg/mL的溶液,静置5 min,在420 nm下测定溶液的浊度。空白对照分别为相应浓度的NaCl溶液。
1.2.8.3 变性剂的影响
参考JIANG等[14]的方法,并略作修改。分别用不同浓度梯度的尿素溶液和十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液将Plastein反应产物配制成5 mg/mL的溶液,振摇,添加SDS的溶液室温下静置20 min。在420 nm下测定溶液的浊度。
1.2.9 圆二色谱分析
溶液质量浓度为0.2 mg/mL,石英比色皿光程为10 mm;实验参数:扫描波长190~400 nm,扫描速度50 nm/min,分辨率0.1 nm,带宽1.0 nm,每个样品扫描3次,取平均值。
1.2.10 X-射线衍射分析
实验参数:辐射源Cu-Kα,靶电压40 kV,管电流40 mA,扫描速度5 °/min,扫描范围5°~90°。连续扫描得到样品的X射线衍射图谱。
1.2.11 数据分析
所有实验测定次数至少为3次,采用Excel 2010、Origin Pro 9.1软件对数据进行分析。运用SPSS 17.0做方差分析(analysis of variance,ANOVA),不同字母表示差异显著(P<0.05)。
2 结果与分析
2.1 Plastein反应修饰ACE抑制肽
2.1.1 底物质量分数对Plastein反应的影响
Plastein反应的底物质量分数相对酶解反应较大,有利于发生缩合和转肽反应[15]。如图1-a所示,当底物质量分数从30%增加到50%时,Plastein反应修饰物的游离氨基酸的减少量呈先上升后下降的趋势,底物质量分数为35%时最大,此时游离氨基酸减少量为185.05 μmol/g。原因是底物浓度太低,则游离氨基酸的量处于较低水平,并且酶的水解作用起主导作用,不利于反应的进行[16];当底物质量分数过大时,反应混合物会聚结,这可能导致底物与碱性蛋白酶的接触面积减小,从而阻碍碱性蛋白酶对反应催化效率的提升[9]。反应产物的ACE抑制率也呈现先上升后下降的趋势,产物ACE抑制率达到最高时为88.55%。考虑节省原料,因此选用的最佳底物质量分数为35%。

a-底物质量分数;b-反应温度;c-反应时间
图1 反应条件对Plastein反应产物ACE抑制率和游离氨基酸含量的影响
Fig.1 Effect of reaction conditions on ACE inhibitory rate and free amino acids content of Plastein reaction products
2.1.2 反应温度对Plastein反应的影响
活性蛋白酶对于催化Plastein反应很重要。如图1-b所示,本次实验中使用的碱性蛋白酶最适反应温度为40~55 ℃,但较低的温度会对反应有利,因为Plastein反应是放热反应[17]。当反应温度为30 ℃时,反应修饰物的ACE抑制率和游离氨基酸减少量最高,分别为89.06%和102.68 μmol/g。高丹丹等[7]在研究Plastein反应对马铃薯蛋白ACE抑制肽的影响时发现,随着温度升高,经修饰后的ACE抑制肽的ACE抑制率会呈现先上升后下降的趋势,当温度为42 ℃时,ACE抑制率达到最大值。这与本研究中ACE抑制率的变化趋势一致。JIANG等[14]选用胰蛋白酶的Plastein反应温度为45 ℃。当反应温度由40 ℃升到60 ℃时,反应修饰物的ACE抑制率小幅增加,可能是由于温度达到碱性蛋白酶最适反应温度,因此反应初始速度较快,使得产物ACE抑制率较高。考虑碱性蛋白酶的热稳定性,本反应选用的最佳温度为30 ℃。
2.1.3 反应时间对Plastein反应的影响
随着反应时间的增加,Plastein反应修饰物的ACE抑制率和游离氨基酸的减少量都呈先上升后下降的趋势。如图1-c所示,ACE抑制率和游离氨基减少量都在反应3 h后达到最大。这是由于反应时间过短,反应不充分;反应时间过长后,可能会使ACE抑制肽分子质量增大,从而使ACE抑制活性降低。反应时间过长也会使一些氨基酸再次游离。UDENIGWE等[18]研究表明肽转化这一可变步骤发生在反应0.5~3 h间。胡田媛等[9]的研究中,反应时间对修饰产物的ACE抑制率和游离氨基酸减少量的影响与本研究一致。因此,选择3 h为最佳反应时间。
2.1.4 添加外源氨基酸对Plastein反应的影响
ACE抑制肽的结构会影响其活性。大量研究表明,在C端三肽序列处含有芳香族残基(例如色氨酸、苯丙氨酸、酪氨酸或脯氨酸)和N端位置含有支链脂肪族氨基酸(例如甘氨酸、缬氨酸、亮氨酸和异亮氨酸),会导致多肽的ACE抑制活性升高和产生低的半抑制浓度(half inhibitory concentration,IC50)值[19-20]。
如图2-a所示,随着亮氨酸添加量的增加,反应产物的游离氨基酸减少量以及ACE抑制率呈现先上升后下降的趋势,在亮氨酸添加量为0.5 mmol/g肽时,二者数值达到最大,分别为106.06 μmol/g和90.55%。图2-b显示,随着甘氨酸添加量的增加,反应产物的游离氨基酸减少量和ACE抑制率都呈增加的趋势,在甘氨酸添加量为0.7 mmol/g肽时达到最大,为84.63 μmol/g和88.07%。如图2-c所示,苯丙氨酸添加量增加时,产物的ACE抑制率整体呈现上升趋势,游离氨基酸减少量先增加后减少,当苯丙氨酸添加量为0.6 mmol/g肽时达到最大,为83.50 μmol/g,此时,反应产物的ACE抑制率为88.20%。XU等[21]添加苯丙氨酸对酪蛋白水解物进行Plastein反应修饰时,苯丙氨酸添加量为0.6 mol/mol酪蛋白水解物中游离氨基酸量,反应后水解物的降血压活性增加。
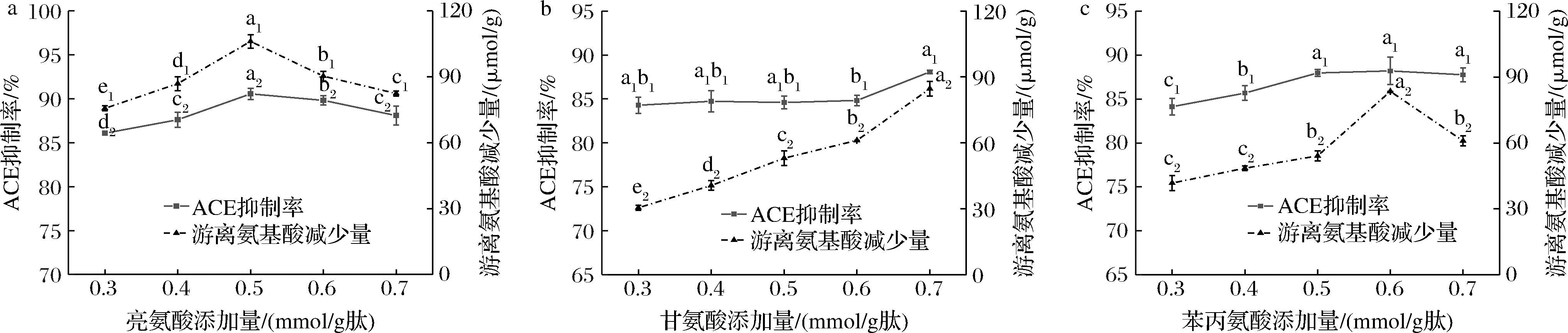
a-亮氨酸;b-甘氨酸;c-苯丙氨酸
图2 外源氨基酸添加量对Plastein反应产物ACE抑制率和游离氨基酸含量的影响
Fig.2 Effect of exogenous amino acids addition on ACE inhibitory rate and free amino acids content of Plastein reaction products
2.2 Plastein反应验证实验
分别以最优条件制备ACE抑制肽以及Plastein反应产物,并分别添加0.5 mmol/g肽亮氨酸、0.7 mmol/g肽甘氨酸以及0.6 mmol/g肽苯丙氨酸制备添加外源氨基酸的Plastein产物。质量浓度为1 mg/mL时测得各样品的ACE抑制率如图3所示。

图3 不同类型产物的ACE抑制活性
Fig.3 ACE inhibition activity of different types of products
经过Plastein反应修饰后的产物相较于未修饰的ACE抑制肽,除添加甘氨酸的Plastein反应产物外,其抑制活性都显著增强(P<0.05)。其中,未添加外源氨基酸的Plastein反应产物的ACE抑制率最高,为90.67%。相较于未修饰的ACE抑制肽提高了3.62%。该结果与XU等[12]的类蛋白反应结果一致,其研究发现,当中性蛋白酶催化酪蛋白水解物进行类蛋白反应修饰后,修饰产物的ACE抑制活性提高,其IC50值从40.4 μg/mL降低至14.7 μg/mL。SUN等[22]通过Plastein反应对酪蛋白水解物修饰后,提高了水解物的ACE抑制活性,使其IC50值从52.6 μg/mL降低至14.9 μg/mL。
测定亮氨酸、甘氨酸和苯丙氨酸的ACE抑制率以排除外源氨基酸自身具有ACE抑制活性的情况。其浓度与最优氨基酸添加量下Plastein反应产物中浓度相同,结果表明3种氨基酸均无ACE抑制活性,说明氨基酸是通过参与Plastein反应提高了ACE抑制肽的活性。
2.3 Plastein反应产物结构稳定性
图4-a显示,随着NaCl溶液浓度增加,溶液浊度有所下降,但总体上没有发生重大变化。该结果与DOUCET等[13]的研究结果一致,随着NaCl溶液浓度由0.1 mol/L增加到2 mol/L,Plastein反应修饰后乳清多肽溶液的浊度也没有明显下降,结果表明能够打破弱离子键的NaCl没有导致聚集物的解离。因此,Plastein反应产物具有一定的离子稳定性。如图4-b所示,Plastein反应产物在温度<60 ℃时比较稳定,当温度>60 ℃后,溶液浊度下降。可能是因为加热破坏了Plastein反应产物中氢键的相互作用。这表明Plastein反应产物在60 ℃以下具有较高的稳定性。该结果与UDENIGWE等[6]的结果略有不同,其研究表明,酪蛋白的Plastein产物在100 ℃加热后仍具有较好的稳定性,并且能够保持抗氧化活性。

a-NaCl溶液;b-温度;c-尿素;d-SDS
图4 不同环境条件对Plastein反应产物结构稳定性的影响
Fig.4 Effect of different environment conditions on the structure stability of Plastein reaction products
如图4-c所示,随着尿素浓度升高,溶液浊度逐渐下降。尿素与蛋白质分子以氢键作用结合,引起蛋白质分子结构域的协同解折叠,会破坏蛋白质内部的氢键,使蛋白质增溶。JIANG等[14]研究了在尿素存在下Plastein反应修饰的海地瓜ACE抑制肽的稳定性,结果显示尿素浓度对溶液的浊度值有显著影响。Plastein反应产物在较低浓度的尿素溶液中具有稳定性。图4-d显示,随着SDS浓度增加,溶液浊度下降。与UDENIGWE等[6]的研究结果一致。SDS因为同时存在亲水基团和疏水基团,可以破坏分子间的疏水相互作用。溶液浊度下降表明高浓度的SDS破坏了Plastein反应产物的分子间疏水相互作用,使其溶解性增强。Plastein反应产物在低SDS浓度下具有较好的稳定性。稳定性实验结果表明,离子键、氢键以及疏水相互作用使Plastein反应产物具有较好的结构稳定性,从而可以保持产物的ACE抑制活性。
2.4 圆二色谱分析
250 nm以下远紫外区主要是蛋白质中肽键的吸收峰,可判断蛋白质肽链的构象变化[23]。α-螺旋构象的特征是常在192 nm处为一正带。β-折叠的特征性圆二色谱是在216 nm处有一负带,在接近195 nm处,有一个相当大的正带。如图5所示,Plastein反应产物和未修饰的ACE抑制肽在190 nm都具有最大吸收峰,说明它们都含有α-螺旋,但不同的是Plastein反应产物在190 nm处的吸光值增强,且在215 nm附近的吸收峰发生红移,说明Plastein反应促进了变性肽段重新扭曲折叠,导致溶液中α-螺旋和β-折叠的变化。该结果与LIU等[24]研究了Plastein反应后的乳清蛋白水解物,其松散的肽链会重新排列,形成有序的二级结构,主要由β-折叠组成。圆二色谱图的变化说明Plastein反应中有新的二级结构生成,因此使ACE抑制肽的活性提高。

图5 ACE抑制肽和Plastein反应产物的圆二色光谱
Fig.5 CD spectra of ACE inhibitory peptide and Plastein reaction products
2.5 X-射线衍射分析
X-射线衍射技术是利用晶体形成的X-射线衍射,对物质进行内部原子在空间分布状况的结构分析方法。每种晶体所产生的衍射花样都反映出该晶体内部的原子分配规律。如图6所示,Plastein反应产物的X-射线衍射图谱与未修饰的ACE抑制肽相比,在22.1°的结晶峰强度变弱,这与JIANG等[14]测定的海地瓜酶解物的X-射线衍射图谱类似,在其研究中,Plastein产物的XRD光谱在22.1°处的强吸收峰由高且尖锐变得弱而宽。31.7°和45.5°的结晶峰强度变强,更为显著的是在56.4°、66.1°、75.3°和84.1°出现新的结晶峰。Plastein反应后原子没有改变,但是原子的空间排布发生了变化,因此表明该反应改变了ACE抑制肽的结构,从而提高了ACE抑制肽的活性。

a-ACE抑制肽;b-Plastein修饰产物
图6 X-射线衍射图谱
Fig.6 X-ray diffraction patterns
3 结论
本研究利用Plastein反应对核桃ACE抑制肽进行修饰,探究了底物质量分数、反应温度、反应时间以及添加外源氨基酸(亮氨酸、甘氨酸、苯丙氨酸)对该反应的影响。经过Plastein反应修饰后,ACE抑制肽活性增强,未添加外源氨基酸的Plastein反应产物的ACE抑制率达到最高,为90.67%。探究了NaCl浓度、温度和变性剂浓度对Plastein反应产物的影响,结果表明离子浓度为0~2 mol/L、温度在60 ℃以下、变性剂浓度低于0.25 mol/L时Plastein反应产物具有较好的结构稳定性。圆二色光谱以及X-射线衍射图谱研究结果表明,Plastein反应改变了ACE抑制肽的结构,从而提高了ACE抑制肽的活性。综上所述,经Plastein反应修饰后的核桃ACE抑制肽的活性提高,并且具有较好的结构稳定性。
[1] 国家林业和草原局. 中国林业和草原年鉴[M].北京:中国林业出版社, 2021:217.
National Forestry and Grassland Administration.China Forestry and Grassland Yearbook[M].Beijing:China Forestry Press, 2021:217.
[2] FANG S X, RUAN G R, HAO J, et al.Characterization and antioxidant properties of Manchurian walnut meal hydrolysates after calcium chelation[J].LWT, 2020, 130:109632.
[3] GU X, HOU Y K, LI D, et al.Separation, purification, and identification of angiotensin I-converting enzyme inhibitory peptides from walnut (Juglans regia L.) hydrolyzate[J].International Journal of Food Properties, 2015, 18(2):266-276.
[4] SUN X H, ACQUAH C, GAZME B, et al.Mechanisms of plastein formation influence the IgE-binding activity of egg white protein hydrolysates after simulated static digestion[J].Food Chemistry, 2021, 345:128783.
[5] 侯钰柯, 石金明, 曾宪明, 等.类蛋白反应及其在肉类中的应用[J].食品与发酵工业, 2021, 47(8):261-267.
HOU Y K, SHI J M, ZENG X M, et al.Plastein reactions and its application in meat[J].Food and Fermentation Industries, 2021, 47(8):261-267.
[6] UDENIGWE C C, WU S H, DRUMMOND K, et al.Revisiting the prospects of plastein:Thermal and simulated gastric stability in relation to the antioxidative capacity of casein plastein[J].Journal of Agricultural and Food Chemistry, 2014, 62(1):130-135.
[7] 高丹丹, 马忠仁, 热孜万古力·赛买提, 等.马铃薯蛋白ACE抑制肽的Plastein反应修饰研究[J].食品与机械, 2018, 34(2):6-10;82.
GAO D D, MA Z R, SAIMAITI R Z W G L, et al.Plastein reaction to modify the ACE inhibitory peptides of potato protein[J].Food and Machinery, 2018, 34(2):6-10;82.
[8] 韩青, 周丽杰, 李智博, 等.酶法制备联合Plastein反应修饰牡蛎ACE抑制肽工艺优化[J].食品科学, 2017, 38(6):104-110.
HAN Q, ZHOU L J, LI Z B, et al.Optimized preparation of ACE inhibitory peptides from oyster by enzymatic hydrolysis coupled with plastein reaction[J].Food Science, 2017, 38(6):104-110.
[9] 胡田媛, 杨晨, 陈哲, 等.南瓜籽ACE抑制肽的Plastein反应修饰及分离鉴定[J].中国油脂, 2023, 48(2):29-35.
HU T Y, YANG C, CHEN Z, et al.Plastein reaction modification, isolation and identification of ACE inhibitory peptides from pumpkin seeds[J].China Oils and Fats, 2023, 48(2):29-35.
[10] JIN F, WANG Y P, TANG H K, et al.Limited hydrolysis of dehulled walnut (Juglans regia L.) proteins using trypsin:Functional properties and structural characteristics[J].LWT, 2020, 133:110035.
[11] SANGSAWAD P, ROYTRAKUL S, YONGSAWATDIGUL J.Angiotensin converting enzyme (ACE) inhibitory peptides derived from the simulated in vitro gastrointestinal digestion of cooked chicken breast[J].Journal of Functional Foods, 2017, 29:77-83.
[12] XU W, KONG B H, ZHAO X H.Optimization of some conditions of Neutrase-catalyzed plastein reaction to mediate ACE-inhibitory activity in vitro of casein hydrolysate prepared by Neutrase[J].Journal of Food Science and Technology, 2014, 51(2):276-284.
[13] DOUCET D, GAUTHIER S F, OTTER D E, et al.Enzyme-induced gelation of extensively hydrolyzed whey proteins by alcalase: comparison with the plastein reaction and characterization of interactions[J].Journal of Agricultural and Food Chemistry, 2003, 51(20):6036-6042.
[14] JIANG S S, ZHAO Y H, SHEN Q Q, et al.Modification of ACE-inhibitory peptides from Acaudina molpadioidea using the plastein reaction and examination of its mechanism[J].Food Bioscience, 2018, 26:1-7.
[15] 朱磊, 张馨心, 谢艳英, 等.类蛋白反应的作用机制及其对海洋源蛋白修饰的研究进展[J].食品工业科技, 2020, 41(9):362-367.
ZHU L, ZHANG X X, XIE Y Y, et al.Research progress on mechanism of plastein reactions and its modification function of marine proteins[J].Science and Technology of Food Industry, 2020, 41(9):362-367.
[16] ZHAO X H, LI Y Y.An approach to improve ACE-inhibitory activity of casein hydrolysates with plastein reaction catalyzed by Alcalase[J].European Food Research and Technology, 2009, 229(5):795-805.
[17] HAJOS G, ELIAS I, HALASZ A.Methionine enrichment of milk protein by enzymatic peptide modification[J].Journal of Food Science, 1988, 53(3):739-742.
[18] UDENIGWE C C, RAJENDRAN S R C K.Old products, new applications? Considering the multiple bioactivities of plastein in peptide-based functional food design[J].Current Opinion in Food Science, 2016, 8:8-13.
[19] DATTA A, BHATTACHARYYA D, SINGH S, et al.Role of aromatic amino acids in lipopolysaccharide and membrane interactions of antimicrobial peptides for use in plant disease control[J].Journal of Biological Chemistry, 2016, 291(25):13301-13317.
[20] ZAREI M, FORGHANI B, EBRAHIMPOUR A, et al.In vitro and in vivo antihypertensive activity of palm kernel cake protein hydrolysates:Sequencing and characterization of potent bioactive peptides[J].Industrial Crops and Products, 2015, 76:112-120.
[21] XU J L, PANG J N, CHEN F F, et al.Antihypertensive activities of the plasteins derived from casein hydrolysates in spontaneously hypertensive rats[J].CyTA-Journal of Food, 2017, 15(1):105-109.
[22] SUN H, ZHAO X H.Angiotensin I converting enzyme inhibition and enzymatic resistance in vitro of casein hydrolysate treated by plastein reaction and fractionated with ethanol/water or methanol/water[J].International Dairy Journal, 2012, 24(1):27-32.
[23] KAMAT B P, SEETHARAMAPPA J.In vitro study on the interaction of mechanism of tricyclic compounds with bovine serum albumin[J].Journal of Pharmaceutical and Biomedical Analysis, 2004, 35(3):655-664.
[24] LIU C H, LIU W, FENG Z B, et al.Aggregation of whey protein hydrolysate using Alcalase 2.4 L[J].PLoS One, 2014, 9(10):e109439.