在将不可逆污垢转换为可逆污垢时,酸、碱、氧化剂、螯合剂和表面活性剂是常见的化学清洁剂[1]。但是它们引起的后续环境问题令人担忧,化学品的消耗增加了膜系统的运行成本。研究显示使用普通惰性盐可以有效地去除污垢,这意味着盐可以将污垢从不可逆状态变为可逆状态[2]。盐清洗方法在离子交换清除有机污垢和凝胶层溶胀方面表现出很高的清洗效率。在所用的盐中,NaCl是最有效的钙桥有机污垢清洁剂[3]。XIANG等[4]研究了5种不同的一价盐离子(即NaCl、KCl、CsCl、NaBr和NaI)和不同离子强度对牛血清白蛋白(bovine serum albumin, BSA)对膜污染的影响。结果发现在Na+的存在下, BSA的过滤性能有明显改善,并且增加盐浓度可促进BSA的过滤效率,降低蛋白的不可逆污染,缓解膜污染,并增加了静电排斥力。乳清蛋白超滤过程中引起的膜污染需要不同的盐浓度才能有效清洁。蛋白表面疏水性官能团的暴露及二级结构的展开都与膜污染的程度相关[5],乳清蛋白在超滤的过程中,溶液中离子浓度不断变化,与蛋白结构的变化有着密切的关系,蛋白结构的不断变化导致蛋白与蛋白、蛋白与膜之间相互作用的变化,当蛋白的疏水结构暴露,蛋白在膜表面的污染加剧,随着超滤时间的延长,由可逆污染变为不可逆污染,膜通量下降,此时需要进行化学膜清洗,恢复膜通量[6]。
由于超滤过程中,截留液中的Na+浓度不断变化,然而关于不同的Na+浓度下,乳清蛋白表面结构的变化及与膜污染之间的关系研究较少。本文选择在不同超滤时间点加入Na+,通过膜通量监测及膜表面蛋白含量的测定,确定可以延缓膜污染的最佳Na+调控时间和浓度条件。通过拉曼光谱、红外光谱和圆二色谱考察Na+调控条件对乳清蛋白超滤过程中截留液蛋白和膜表面蛋白结构的影响,探索离子调控蛋白结构变化与膜污染之间的关系,揭示Na+调控对乳清蛋白超滤效果的影响机制,为进一步调控离子比例,提高膜过滤效率,减轻膜污染提供理论依据。
聚醚砜膜(polyethersulfone, PES), 美国纳诺斯通水务公司,截留分子质量为10 kDa;NaCl,天津科密欧化学试剂有限公司;所有溶液均以去离子水配制。
J-600圆二色谱仪,日本JASCO公司;670-IR+610-IR红外光谱仪,美国Varian公司; inVia拉曼光谱仪,英国Renishaw公司。
1.2.1 膜通量的测定
采用不同浓度的NaCl溶液调节乳清蛋白超滤过程中截留液的离子强度,选择在0、4、8 min分别加入不同浓度(5、10、15、20 mmol/L)的NaCl溶液进行调控,监测超滤24 min时的膜通量变化,以未经离子调控的超滤24 min的乳清蛋白样品为对照组,进行对比。采用死端过滤,跨膜压力0.3 MPa。膜通量的计算如公式(1)所示:
(1)
式中:V,不同超滤时间的渗透体积,mL;A,膜表面积,cm2;Δt,2次质量测量之间的时间,min[7]。
1.2.2 蛋白浓度的测定
对Na+调控后的超滤膜表面乳清蛋白含量进行测定。
采用Lowry法测定蛋白含量[8]:1 mL 10 g/L的CuSO4·5H2O,1 mL 20 g/L的酒石酸钾钠和100 mL 20 g/L的Na2CO3试剂混合备用;将标准蛋白,BSA溶解于1 mol/L NaOH,配制成1 mg/mL的BSA溶液;取0.5 mL不同浓度的蛋白溶液,放至10 mL离心管中;向不同浓度的BSA溶液中加入5 mL上述混合液,搅拌10 min;加入0.5 mL 1 mol/L福林酚试剂,反应30 min,660 nm处测定吸光值,绘制标准曲线。
1.2.3 二级结构的测定
在25 ℃下,使用圆二色谱仪测定修饰蛋白质的二级结构,光谱分辨率为0.5 nm。光谱(190~250 nm)使用10 mm路径长度的石英电池记录,扫描速度为100 nm/min,灵敏度为20 mdeg。将样品稀释至0.2 mg/mL。校正圆二色谱中溶剂的贡献,并用特定椭圆度和波长表示。使用Jasco SSE-338蛋白质二级结构分析程序进行二级结构组成的评估[9]。
1.2.4 Na+调控过程中超滤膜表面蛋白结构的测定
拉曼光谱:将膜表面蛋白分散在重水中至100 mg/mL溶液中,5 ℃下储存48 h,以在分析前进行完全H/D交换。实验条件是扫描频率范围200~1 800 cm-1,He-Ne激光器,波长632.8 nm,功率6.4 mW,积分时间100 s,室温[10]。
红外吸收光谱:采用傅里叶变换衰减全反射红外光谱法(attenuated total refraction Fourier transform infrared spectrometry, ATR-FTIR)分析,入射角45°使用32扫描/光谱分辨率1 928 cm-1[11]。
1.2.5 膜阻力的测定
对Na+调控后的超滤膜进行膜阻力的测定,膜通量的计算根据Darcy公式,如公式(2)和公式(3)所示[12]:
(2)
Rt=Rm+Rc+Rp
(3)
式中:J,膜通量,mL/(cm2·min);ΔP,乳清过滤时膜两侧压力差,kPa;μ,进料液黏度,Pa·s;Rt,乳清膜过滤总阻力,cm-1;Rm,聚醚砜膜自身阻力,cm-1;Rc,乳清蛋白膜饼层阻力,cm-1;Rp,乳清蛋白膜孔堵塞阻力,cm-1。
每个实验重复3次,结果表示为平均值±偏差。数据统计分析采用SPSS 11.5软件(P<0.05表示差异显著,P>0.05表示差异不显著),图1和图2将所有数据放在一起进行显著性分析,图3和图4显著性分析采用组内比较,相同字母表示差异不显著,不同字母表示差异显著,采用Origin 8.5绘图。

图1 不同超滤时间点和不同Na+浓度调控膜通量变化
Fig.1 Changes of membrane flux regulated by Na+ at different ultrafiltration times

图2 不同超滤时间和不同浓度Na+调控后膜表面蛋白含量
Fig.2 Membrane surface protein content regulated by various Na+ concentrations at different ultrafiltration times

图3 不同超滤时间和不同浓度Na+调控后膜阻力分析
Fig.3 Membrane resistance treated with different concentration of Na+ at different ultrafiltration times
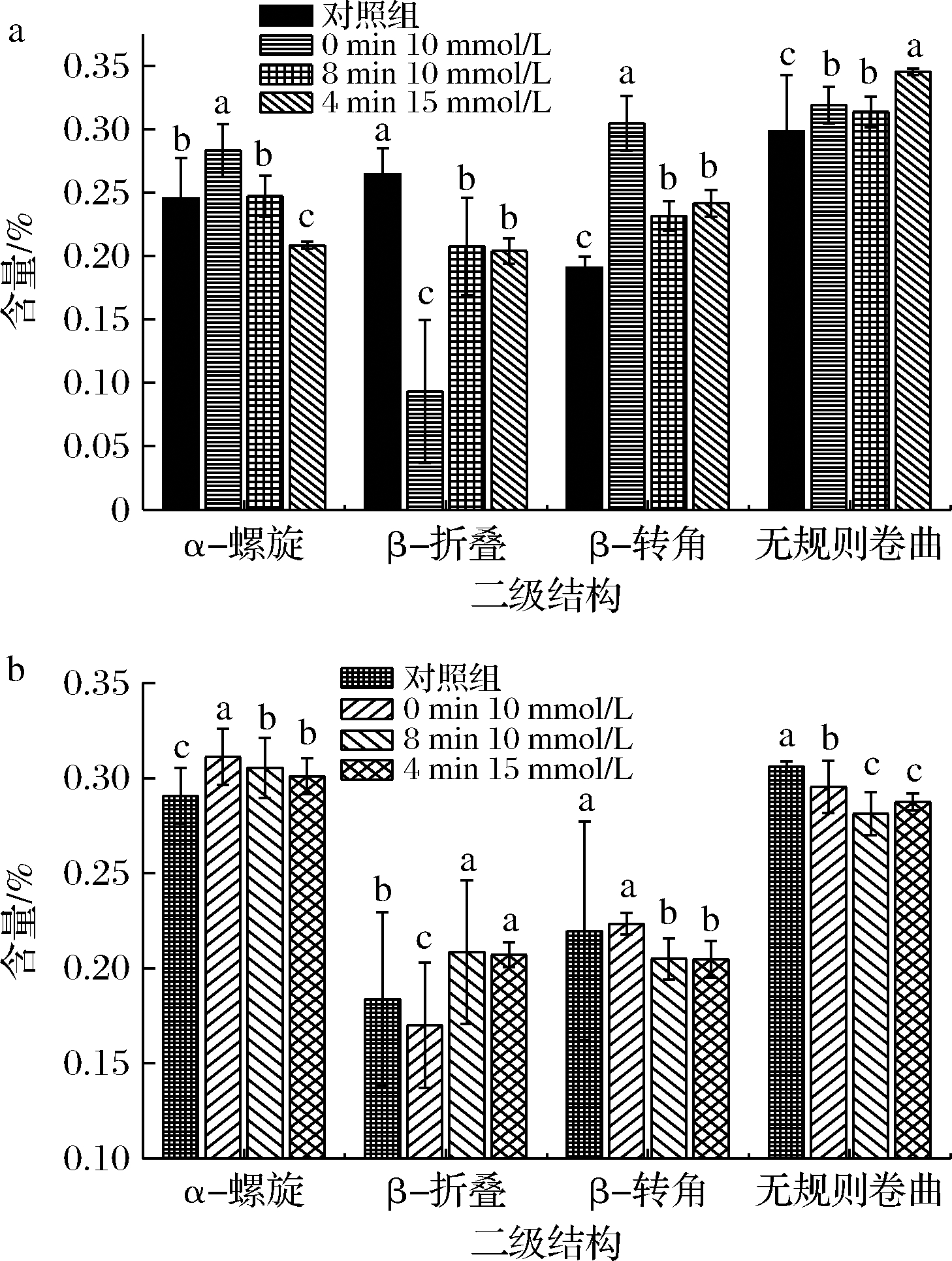
a-超滤膜表面蛋白;b-截流液蛋白
图4 不同超滤时间和不同浓度Na+调控后蛋白二级结构
Fig.4 Secondary structure of protein regulated by different concentration of Na+ at different ultrafiltration times
在超滤时间0、4、8 min时分别加入5、10、15、20 mmol/L NaCl,观察24 min时膜通量变化,与未加入Na+调控的乳清超滤效果比较。由图1可知,在超滤0 min时,加入Na+浓度为5~10 mmol/L时,膜通量升高,主要是由于Na+的加入,产生了盐溶效应,Na+降低了蛋白表面电荷引力,降低了蛋白与蛋白之间的电荷引力聚集的情况,使得膜通量升高[4]。在超滤4 min时加入Na+浓度为15 mmol/L膜通量增加,加入5、10、20 mmol/L NaCl均使膜通量降低。在超滤8 min时,加入10 mmol/L NaCl超滤效果最好。研究表明,在相对较高的离子强度下,膜污染减轻主要是由于水合排斥力的增加[13]。但离子强度过高会产生盐析现象,蛋白聚集沉淀。Na+浓度增加到15 mmol/L时,通量降低,继续增加到20 mmol/L时,膜通量变化不显著,与静电屏蔽效应有关,此时更多Na+吸附在膜表面,引起了更高的电荷屏蔽效应,使蛋白间的继续聚集沉淀现象减弱,因此Na+浓度的继续增加降低了蛋白与蛋白、蛋白与膜之间的相互作用[14]。因此,在超滤开始时(0 min),加入10 mmol/L Na+可以有效提高乳清蛋白超滤膜通量。
由图2可知,在不同时间点加入不同浓度的Na+,膜表面蛋白含量变化显著。在超滤时间4、8 min时加入5 mmol/L Na+进行调控时,膜表面蛋白含量与对照组相比,膜表面蛋白含量变化不显著,主要是Na+浓度较小,对膜表面蛋白含量影响较小。在超滤4 min时,加入20 mmol/L Na+时膜表面蛋白含量增加高于对照组,在超滤8 min时加入20 mmol/L Na+时,膜表面蛋白含量显著升高,高于对照组,主要是离子强度的增加,引起静电荷屏蔽效应和电荷中和效应,乳清蛋白超滤环境中的负电荷随着Na+浓度的增加而降低,蛋白内部和分子间排斥力减弱,促进聚合物折叠[15],蛋白堆积在膜表面或沉积在膜孔中,膜表面蛋白含量增高。
在超滤0 min时加入10 mmol/L Na+时蛋白含量最低,此时通量增加,超滤效果较好,膜表面蛋白含量较低,主要是水合Na+的存在,在带负电的蛋白周围形成了一个特殊的水合层,水合排斥力增加[16]。随着Na+浓度的增加,蛋白在膜表面的堆积增加,与乳清溶液中多种离子的比例失衡导致蛋白疏水结构的暴露有关。在超滤4 min时,加入15 mmol/L Na+调控时,超滤24 min时监测膜表面蛋白含量减少。超滤8 min时,加入10 mmol/L Na+调控,超滤24 min时膜表面蛋白含量最低,说明在超滤前8 min时,沉积在膜表面的蛋白在Na+加入后,出现了盐溶现象,部分蛋白从膜表面进入截留液中,超滤到24 min时膜表面蛋白含量显著低于对照组,膜污染减轻。在超滤8 min时,加入15 mmol/L Na+,膜表面蛋白含量相较于对照组无明显变化,过滤效果较差。随着离子强度的增加到20 mmol/L,由于双电层的压缩,边界层较高的离子浓度会导致乳清蛋白液体的电荷中性破坏[17],膜表面积累的Na+使蛋白发生盐析,多孔性蛋白质沉积在膜表面,使渗透性降低。随着过滤的进行,蛋白质不断沉积在滤饼层上,形成饼层阻力,膜通量下降[18]。
以上研究发现,在超滤0、4、8 min时,分别加入10、15、10 mmol/L的Na+调控,与对照组相比可以有效的提高膜通量,24 min后膜表面蛋白的沉积量降低,因此选取以上调控条件的样品,分别监测离子调控后的乳清蛋白超滤24 min时的膜阻力。如图3所示,与对照组相比,Na+调控后,膜总阻力均有下降,其中在超滤0 min加入10 mmol/L NaCl调控后,超滤24 min时刻,与对照组相比膜总阻力最低,通量最高。Na+可降低膜污染中的孔隙堵塞,从图3可以看出,在超滤4 min和8 min时进行Na+调控后的乳清蛋白阻力均有显著下降,同时与对照组相比,饼层阻力也均有降低[19]。主要是Na+含量升高,静电屏蔽效应减弱,膜表面蛋白沉积减少,饼层阻力下降。在超滤0 min时,加入10 mmol/L NaCl的膜表面蛋白浓度较低,说明此时加入该浓度的Na+可以有效降低饼层阻力。在超滤8 min时,加入10 mmol/L时和4 min加入15 mmol/L Na+时,膜总阻力相较于0 min调控较高,但阻力较低,由前文中研究可以发现7 min时发生孔隙堵塞,说明在该时间点前或临近该时间点加入Na+调控有助于减轻孔隙堵塞的形成,提高过滤效率。
以上研究发现,在超滤0、4、8 min时,分别加入10、15、10 mmol/L时的Na+调控与对照组相比可以有效地提高膜通量,降低24 min后膜表面蛋白的沉积量,因此选取以上调控条件的样品,分别取超滤24 min时,截留液和膜表面蛋白进行表面结构分析,考察Na+调控对蛋白二级结构和表面基团的影响,分析其调控机制。由图4可知,在超滤0 min时,加入10 mmol/L Na+进行调控时,α-螺旋含量上升,β-折叠含量降低,β-转角以及无规则卷曲含量上升。β-折叠结构对于蛋白空间网状结构的形成具一定的作用,常见于折叠区域,但其结构不稳定,蛋白结构易发生变化,形成聚集体,在聚集体状态下,β-折叠易于转向β-转角及无规则卷曲。因此,在超滤0 min时,加入10 mmol/L Na+使蛋白质β-折叠含量降低,降低了蛋白在膜表面的聚集沉淀,提高了膜通量,与图1和图2得到的结论一致。
在超滤4 min时,加入15 mmol/L的Na+进行调控时,α-螺旋和β-折叠含量降低,β-转角以及无规则卷曲含量上升。氢键被破坏,β-折叠和β-转角含量的增加能够改变蛋白质-蛋白质之间的相互作用,促进蛋白质在膜表面形成疏松饼层,减轻膜污染,但与在超滤0 min时,加入10 mmol/L Na+比较,膜污染增加。在超滤8 min时,加入10 mmol/L时,α-螺旋含量与对照组相比无明显变化,β-折叠含量降低,β-转角以及无规则卷曲含量上升。在超滤8 min加入时Na+调控,相较于在超滤0 min时加入,膜污染减缓效果较弱,此时通量上升可能是由于蛋白质与蛋白质之间的吸引力导致蛋白质结构不稳定,发生β-折叠向β-转角和无规则卷曲转变。而且,截留液中的乳清蛋白的α-螺旋含量高于膜表面蛋白,无规则卷曲的含量也低于膜表面蛋白,因此,在超滤的初始阶段加入一定量的Na+调控,有助于乳清蛋白β-折叠以及无规则卷曲含量降低,促进更多的蛋白离开膜表面,进入截留液中,有利于缓解膜污染。
2.5.1 傅里叶红外光谱(Fourier transform infrared spectroscopy, FTIR)表征
Na+浓度与蛋白在溶液中的结构,表面基团的暴露有关,而乳清蛋白在超滤浓缩的过程中,蛋白表面亲疏水基团的暴露与超滤过程中蛋白在膜表面的聚集和不可逆膜污染的形成有关。通过FTIR和拉曼光谱探索Na+有效调控乳清蛋白超过滤机制。截流液蛋白红外光谱图与对照组相比(图5-b),Na+调控后3 500~3 300 cm-1亲水基团O—H吸收峰减弱,膜表面蛋白在3 500~3 300 cm-1亲水基团O—H吸收峰与之相反,羟基的伸缩振动加强,说明膜表面蛋白分子间氢键和分子内氢键作用力增加。
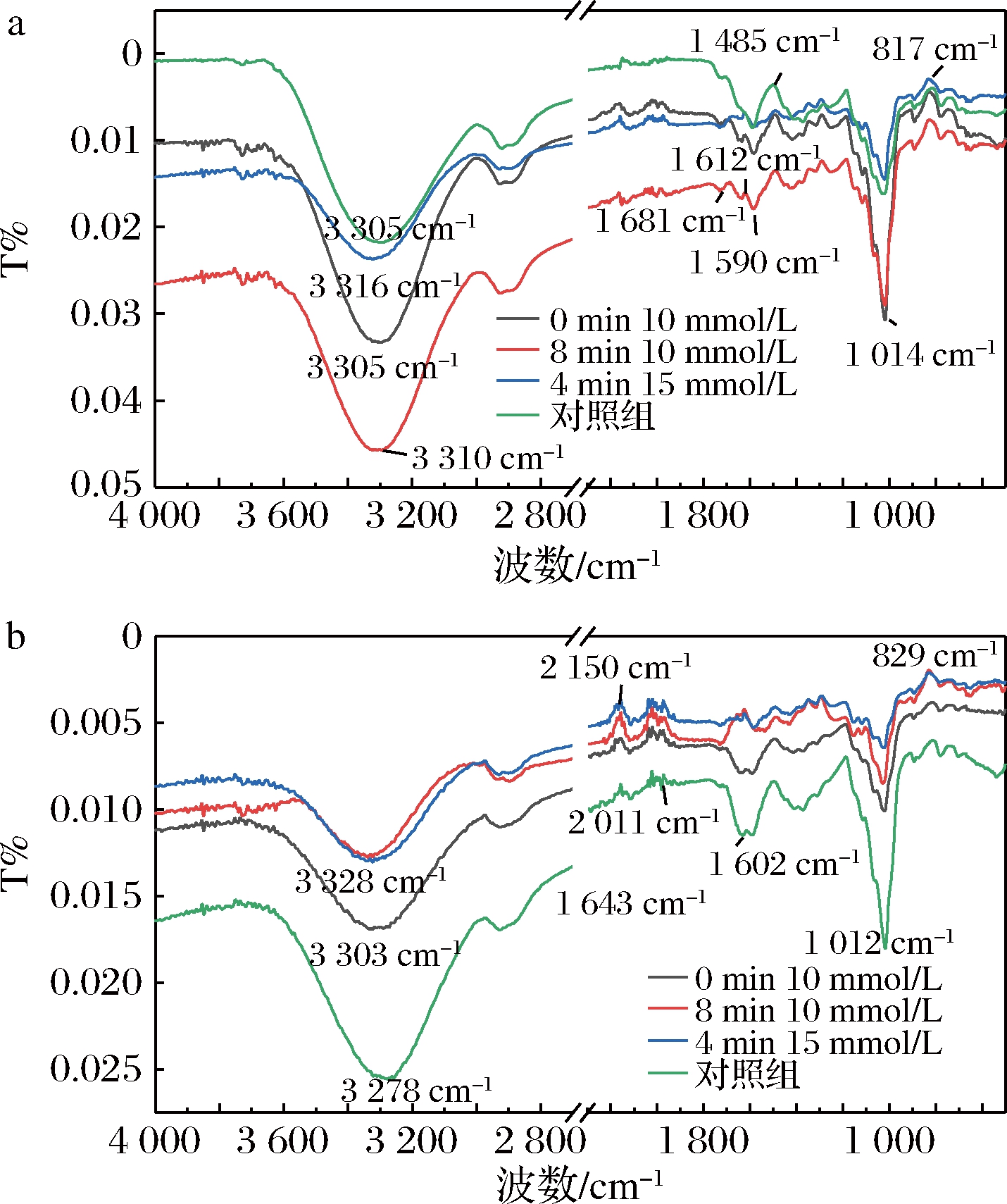
a-膜表面蛋白;b-截流液蛋白
图5 不同超滤时间和不同浓度Na+调控后膜表面蛋白和截留液蛋白红外光谱
Fig.5 Infrared spectra of membrane surface proteins and retention protein regulated by different concentration of Na+ at different ultrafiltration times
酰胺Ⅰ带(1 600~1 700 cm-1)由羰基(C![]() O)键伸缩振动产生[20],其峰型受蛋白质特定二级结构影响。根据谱图确定各子峰与各二级结构对应关系,在酰胺I带中,α-螺旋对应1 650~1 660 cm-1,β-折叠对应1 610~1 640 cm-1和1 670~1 690 cm-1,β-转角对应1 660~1 695 cm-1,无规则卷曲特征峰为1 650~1 640 cm-1。3 100~2 800 cm-1C—H烯烃类伸缩振动增加,1 400 cm-1附近的峰归属于氨基酸相关的—COO—对称拉伸,1 540 cm-1附近主要是酰胺II带是N—H基团平面弯曲和多肽链C—N伸缩模式的特征峰。1 080 cm-1频率处出现的宽峰是由对称和非对称C
O)键伸缩振动产生[20],其峰型受蛋白质特定二级结构影响。根据谱图确定各子峰与各二级结构对应关系,在酰胺I带中,α-螺旋对应1 650~1 660 cm-1,β-折叠对应1 610~1 640 cm-1和1 670~1 690 cm-1,β-转角对应1 660~1 695 cm-1,无规则卷曲特征峰为1 650~1 640 cm-1。3 100~2 800 cm-1C—H烯烃类伸缩振动增加,1 400 cm-1附近的峰归属于氨基酸相关的—COO—对称拉伸,1 540 cm-1附近主要是酰胺II带是N—H基团平面弯曲和多肽链C—N伸缩模式的特征峰。1 080 cm-1频率处出现的宽峰是由对称和非对称C![]() O伸缩振动所引起的,吸收峰小于1 000 cm-1属于指纹区域。如图5-a所示,在超滤0 min加入10 mmol/L Na+调控,超滤24 min后膜表面蛋白呈现强烈的C
O伸缩振动所引起的,吸收峰小于1 000 cm-1属于指纹区域。如图5-a所示,在超滤0 min加入10 mmol/L Na+调控,超滤24 min后膜表面蛋白呈现强烈的C![]() O伸缩振动,膜污染减轻。与蛋白质中酸性氨基酸的暴露有关,酸性氨基酸和碱性氨基酸都具有较强的亲水特性[21-22]。
O伸缩振动,膜污染减轻。与蛋白质中酸性氨基酸的暴露有关,酸性氨基酸和碱性氨基酸都具有较强的亲水特性[21-22]。
2.5.2 拉曼光谱表征
由图6可以看出,Na+调控后的拉曼光谱,截流液与膜表面蛋白主要在2 800~3 000 cm-1特征谱带有较强烈的振动,此时主要存在脂肪族C—H键的伸缩振动。膜表面蛋白的拉曼谱带中,与对照组相比,离子调控后的振动强度较弱,其中在超滤8 min时,加入10 mmol/L时,C—H键的振动最低,此时膜表面蛋白含量降低,已知C—H键的变化可提供关于蛋白质疏水作用及加工过程中构象变化的有关信息,由此推测加入Na+调控时有助于减轻膜表面蛋白极性微环境的变化,降低疏水作用力,提高膜通量,减轻膜污染。截流液拉曼谱带中显示,在超滤0 min时,加入10 mmol/L Na+调控,C—H键振动最强烈,此时β-转角以及无规则卷曲含量上升,氢键被破坏,影响疏水作用力,导致截流液蛋白极性微环境发生变化,C—H键振动增加。芳香族和脂肪族氨基酸的C—H振动2 930~2 933 cm-1[23]。![]() C—H芳香族氨基酸的伸缩振动3 060 cm-1,氨基酸、肽和蛋白质的疏水基团在2 800~3 100 cm-1区域显示C—H伸缩振动带。如图6-a所示,在Na+调控后,超滤24 min时,膜表面蛋白的疏水特性与对照组相比显著降低[24]。2 880 cm-1主要是甲基(—CH3)的对称伸缩振动和脂肪族氨基酸的C—H伸缩振动。与蛋白的疏水特性相关。图6-a中2 930 cm-1谱带强度的降低反映了烃链周围环境的极性降低(或非极性增加),主要是盐离子的加入争夺了蛋白与水之间氢键的相互作用,降低蛋白质分子极性基团与水分子的相互作用。由图6-b可知,在超滤4 min时,加入15 mmol/L的Na+,超滤24 min时,截留液中蛋白的疏水性氨基酸残基显著下降,此时,截留液中蛋白沉积在膜表面或者与膜表面蛋白与蛋白之间的相互作用降低,有延缓膜污染的趋势。
C—H芳香族氨基酸的伸缩振动3 060 cm-1,氨基酸、肽和蛋白质的疏水基团在2 800~3 100 cm-1区域显示C—H伸缩振动带。如图6-a所示,在Na+调控后,超滤24 min时,膜表面蛋白的疏水特性与对照组相比显著降低[24]。2 880 cm-1主要是甲基(—CH3)的对称伸缩振动和脂肪族氨基酸的C—H伸缩振动。与蛋白的疏水特性相关。图6-a中2 930 cm-1谱带强度的降低反映了烃链周围环境的极性降低(或非极性增加),主要是盐离子的加入争夺了蛋白与水之间氢键的相互作用,降低蛋白质分子极性基团与水分子的相互作用。由图6-b可知,在超滤4 min时,加入15 mmol/L的Na+,超滤24 min时,截留液中蛋白的疏水性氨基酸残基显著下降,此时,截留液中蛋白沉积在膜表面或者与膜表面蛋白与蛋白之间的相互作用降低,有延缓膜污染的趋势。
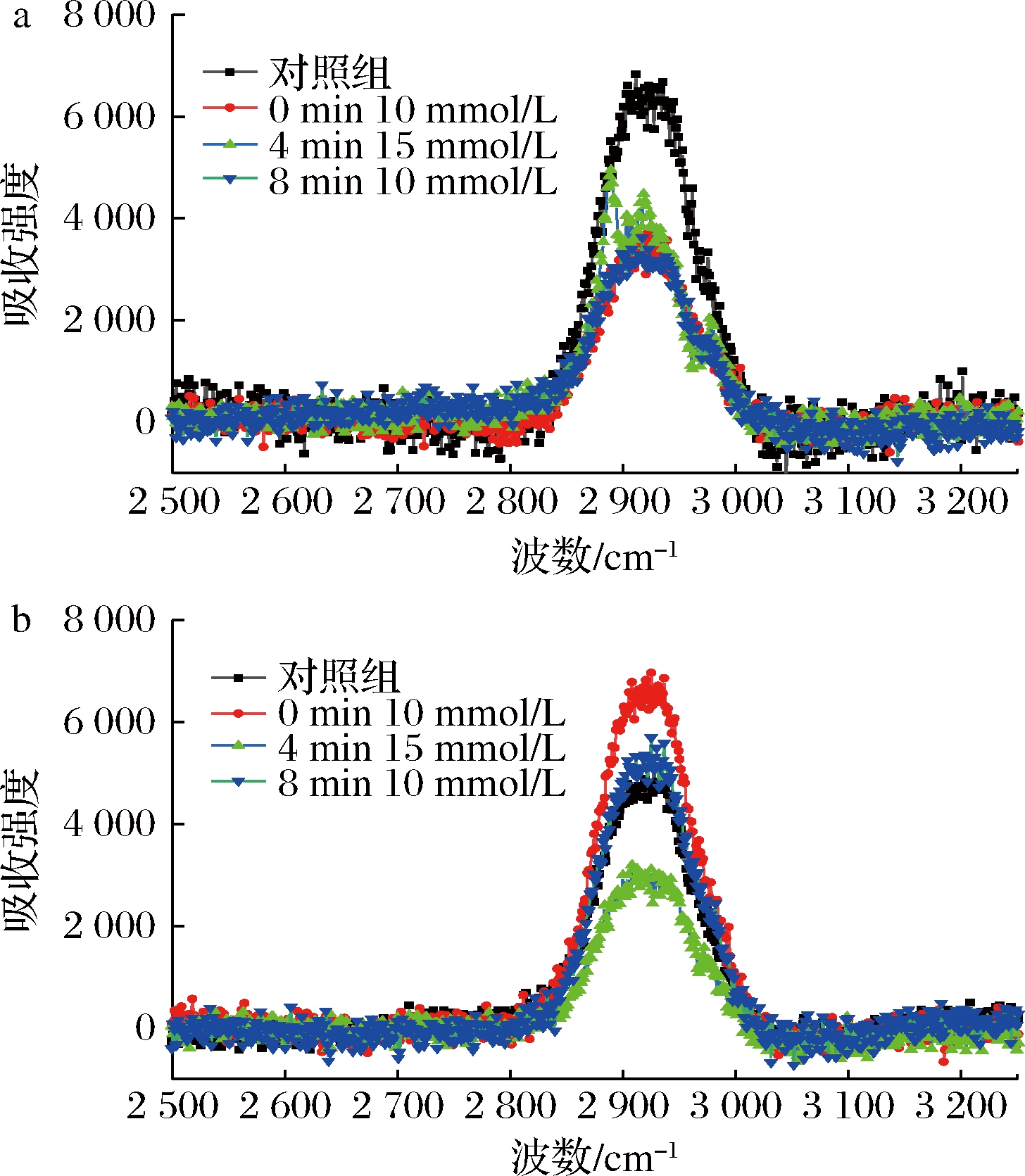
a-膜表面蛋白;b-截流液蛋白
图6 不同时间和不同浓度Na+调控后膜表面蛋白和截流液蛋白拉曼光谱
Fig.6 Raman spectra of membrane surface proteins and retention proteins regulated by Na+ at different times and concentrations
在不同浓度和不同时间点进行Na+调控,乳清蛋白超滤过程中膜污染程度不同。通过膜通量和蛋白浓度的测定,发现在在超滤0、4、8 min时分别加入10、15、10 mmol/L Na+调控,可以有效提高超滤24 min时的膜通量,离子强度过高导致蛋白内部结构收敛和聚集,堵塞膜孔,膜表面蛋白含量降低,通量降低。与对照组相比,Na+调控后的膜总阻力均有下降,其中,在超滤0 min时加入10 mmol/L Na+进行调控时,膜总阻力最低,通量最高,α-螺旋含量增加,蛋白质结构发生变化,形成聚集体,β-折叠易于转向β-转角及无规则卷曲,膜阻力下降。红外光谱显示,C![]() O振动增加,蛋白表面酸性氨基酸暴露,蛋白亲水性增强。拉曼光谱显示芳香族和脂肪族氨基酸在2 930~2 933 cm-1的C—H振动显著降低,膜表面蛋白的疏水特性降低。对蛋白在膜表面的沉积具有一定的抑制作用。在超滤4 min时,加入15 mmol/L的Na+,α-螺旋含量降低,β-折叠和β-转角含量的增加,膜通量增加。与对照组相比,膜表面C—H键伸缩振动强度降低,在3 500~3 300 cm-1处,亲水基团O—H吸收峰增强,羟基的伸缩振动加强,膜阻力降低。因此,离子调控乳清蛋白超滤过程,需要考察调控的时间点和离子浓度,离子调控有助于减轻膜孔堵塞,提高过滤效率。
O振动增加,蛋白表面酸性氨基酸暴露,蛋白亲水性增强。拉曼光谱显示芳香族和脂肪族氨基酸在2 930~2 933 cm-1的C—H振动显著降低,膜表面蛋白的疏水特性降低。对蛋白在膜表面的沉积具有一定的抑制作用。在超滤4 min时,加入15 mmol/L的Na+,α-螺旋含量降低,β-折叠和β-转角含量的增加,膜通量增加。与对照组相比,膜表面C—H键伸缩振动强度降低,在3 500~3 300 cm-1处,亲水基团O—H吸收峰增强,羟基的伸缩振动加强,膜阻力降低。因此,离子调控乳清蛋白超滤过程,需要考察调控的时间点和离子浓度,离子调控有助于减轻膜孔堵塞,提高过滤效率。
[1] ANT N E,
N E,  LVAREZ J R, PALACIO L, et al.Ageing of polyethersulfone ultrafiltration membranes under long-term exposures to alkaline and acidic cleaning solutions[J].Chemical Engineering Science, 2015, 134:178-195.
LVAREZ J R, PALACIO L, et al.Ageing of polyethersulfone ultrafiltration membranes under long-term exposures to alkaline and acidic cleaning solutions[J].Chemical Engineering Science, 2015, 134:178-195.
[2] LEE S, ELIMELECH M.Salt cleaning of organic-fouled reverse osmosis membranes[J].Water Research, 2007, 41(5):1134-1142.
[3] LEE H, IM S J, LEE H, et al.Comparative analysis of salt cleaning and osmotic backwash on calcium-bridged organic fouling in nanofiltration process[J].Desalination, 2021, 507:115022.
[4] HE X, MENG F G, LIN A L, et al.Monovalent ion-mediated fouling propensity of model proteins during low-pressure membrane filtration[J].Separation and Purification Technology, 2015, 152:200-206.
[5] XIN Y J, BLIGH M W, KINSELA A S, et al.Calcium-mediated polysaccharide gel formation and breakage:Impact on membrane foulant hydraulic properties[J].Journal of Membrane Science, 2015, 475:395-405.
[6] WANG W Q, LI J J, ZHOU J Y, et al.The effect of ion environment changes on retention protein behavior during whey ultrafiltration process[J].Food Chemistry:X, 2022, 15:100393.
[7] MILLER D J, KASEMSET S, WANG L, et al.Constant flux crossflow filtration evaluation of surface-modified fouling-resistant membranes[J].Journal of Membrane Science, 2014, 452:171-183.
[8] 王文琼. 蛋白聚合酶催化耦联超滤回收乳清蛋白及膜污染机制研究[D].哈尔滨:哈尔滨工业大学, 2017.
WANG W Q.Cheese whey protein recovery by polymerase catalysis coupling with ultrafiltration and membrane fouling mechanism research[D].Harbin:Harbin Institute of Technology, 2017.
[9] WANG W Q, BAO Y H, CHEN Y.Characteristics and antioxidant activity of water-soluble Maillard reaction products from interactions in a whey protein isolate and sugars system[J].Food Chemistry, 2013, 139(1-4):355-361.
[10] LI Y Q.Structure changes of soybean protein isolates by pulsed electric fields[J].Physics Procedia, 2012, 33:132-137.
[11] 王文琼, 孙志勇, 黄冬成, 等.乳酸菌发酵对乳清蛋白蓝莓果汁体系特性的影响[J].食品与发酵工业, 2020, 46(13):42-48.
WANG W Q, SUN Z Y, HUANG D C, et al.Effect of lactic acid bacteria fermentation on the characteristics of whey protein/blueberry juice system[J].Food and Fermentation Industries, 2020, 46(13):42-48.
[12] LISTIARINI K, CHUN W, SUN D D, et al.Fouling mechanism and resistance analyses of systems containing sodium alginate, calcium, alum and their combination in dead-end fouling of nanofiltration membranes[J].Journal of Membrane Science, 2009, 344(1-2):244-251.
[13] MIAO R, WANG L, MI N, et al.Enhancement and mitigation mechanisms of protein fouling of ultrafiltration membranes under different ionic strengths[J].Environmental Science &Technology, 2015, 49(11):6574-6580.
[14] KILMER N T, HUSS R L, GEORGE C C, et al.The influence of ion identity and ionic strength on membrane biofouling of a binary protein solution[J].Separation and Purification Technology, 2021, 255:117769.
[15] ZHANG B, TANG H L, CHEN J Y, et al.New mechanistic insights into the effect of cations on membrane fouling caused by anionic polyacrylamide[J].Journal of Colloid and Interface Science, 2022, 606:10-21.
[16] WANG F Y, ZHANG M J, PENG W, et al.Effects of ionic strength on membrane fouling in a membrane bioreactor[J].Bioresource Technology, 2014, 156:35-41.
[17] GAO F, WANG J, ZHANG H W, et al.Role of ionic strength on protein fouling during ultrafiltration by synchronized UV-vis spectroscopy and electrochemical impedance spectroscopy[J].Journal of Membrane Science, 2018, 563:592-601.
[18] MO H J, TAY K G, NG H Y.Fouling of reverse osmosis membrane by protein (BSA):Effects of pH, calcium, magnesium, ionic strength and temperature[J].Journal of Membrane Science, 2008, 315(1-2):28-35.
[19] KESKIN B, ALI NAZIRI MEHRABANI S, AREFI-OSKOUI S, et al.Development of Ti2AlN MAX phase/cellulose acetate nanocomposite membrane for removal of dye, protein and lead ions[J].Carbohydrate Polymers, 2022, 296:119913.
[20] 钱方, 牟光庆.基于红外光谱分析热处理对牛乳蛋白质二级结构变化研究[C]//中国食品科学技术学会第十三届年会论文摘要集.北京, 2016.
QIANG F, MU G G.Secondary structure changes of heat treatments on milk protein based on fourier transform infrared spectroscopy[C].Abstracts of the 13th Annual Meeting of CIFST.Beijing:Chinese Journal of Food Science and Technology, 2016.
[21] OKUR H I, HLAD LKOV
LKOV J, REMBERT K B, et al.Beyond the hofmeister series:Ion-specific effects on proteins and their biological functions[J].The Journal of Physical Chemistry B, 2017, 121(9):1997-2014.
J, REMBERT K B, et al.Beyond the hofmeister series:Ion-specific effects on proteins and their biological functions[J].The Journal of Physical Chemistry B, 2017, 121(9):1997-2014.
[22] ZHANG Y J, CREMER P S.Interactions between macromolecules and ions:The Hofmeister series[J].Current Opinion in Chemical Biology, 2006, 10(6):658-663.
[23] WANG Q, HE L L, LABUZA T P, et al.Structural characterisation of partially glycosylated whey protein as influenced by pH and heat using surface-enhanced Raman spectroscopy[J].Food Chemistry, 2013, 139(1-4):313-319.
[24] ALIZADEH-PASDAR N, NAKAI S, LI-CHAN E C Y.Principal component similarity analysis of Raman spectra to study the effects of pH, heating, and κ-carrageenan on whey protein structure[J].Journal of Agricultural and Food Chemistry, 2002, 50(21):6042-6052.