果胶广泛分布于高等植物的初生细胞壁和细胞间区域,由半乳糖醛酸和半乳糖醛酸甲酯组成[1]。天然果胶类物质以原果胶、果胶、果胶酸的形态广泛存在于植物的果实、根、茎和叶中,是细胞壁的一种组成成分,它们伴随纤维素而存在,构成相邻细胞中间层黏结物,使植物细胞紧紧黏结在一起[2]。根据酯化程度,果胶可分为高甲氧基果胶(high methoxyl pectin,HMP)[酯化度(degree of esterification,DE)>50%]和低甲氧基果胶(low methoxyl pectin,LMP) (DE<50%)[3]。HMP凝胶在低pH和高糖浓度下形成,由于在低pH值下可以防止羧基的解离,高度水解和带电荷的羧基被转化为不带电荷的羧基分子,分子间的斥力减小,分子的水合作用减弱,促进了分子间结合和三维网络结构[4]。糖和酸并不是LMP凝胶化的必要条件,二价阳离子如Ca2+通常用于诱导其凝胶化,当二价阳离子加入LMP溶液时,Ca2+和果胶链上游离的羧基之间被描述为“蛋箱”模型的交联相互作用[5]。通常,单价阳离子不会引起果胶的胶凝,在碱性pH下向HMP中加入单价阳离子会导致HMP的胶凝,这取决于单价阳离子和果胶的浓度[6]。CHEN等[7]在AOP 中加入单价阳离子导致了 AOP 的凝胶化,随着单价阳离子和果胶浓度的增加,果胶凝胶的形态和结构变得更加致密,凝胶强度增加,单价阳离子和游离羧基之间的屏蔽和静电吸引可能主导HMP的凝胶化[8]。
神仙豆腐是从豆腐柴中提取果胶凝胶后形成的产品,含有丰富的果胶、蛋白质、脂肪、纤维素、异黄酮、维生素、矿物质等营养成分,具有极高的营养价值,是最具开发和食用潜力的营养食品之一[9]。其主要原料豆腐柴(Premna microphylla Turcz),又名豆腐木、豆腐叶、臭黄荆、观音桔、土黄芪、腐婢等,为马鞭草科豆腐柴属多年生落叶灌木,营养成分丰富,富含果胶和蛋白质,是一种新型的食药两用型植物,主要分布于我国的陕西南部、云南、四川、贵州、浙江、湖北、湖南等地。用草酸铵从豆腐柴中提取出的果胶 AOP 是一种富含低酯化度(DE:14.26%)和高半乳糖醛酸LMP,该特性有助于果胶发挥良好的胶凝性能。
本文研究了K+诱导AOP凝胶化,通过动态流变测试、硬度测试、保水性(water holding capacity,WHC)测试、X射线衍射光谱(X-ray diffraction,XRD)测试、微观结构观察、傅里叶红外光谱(Fourier transform infrared,FT-IR)测试和凝胶作用力进一步探讨了K+对AOP凝胶的影响。研究结果可为一价阳离子诱导果胶凝胶化提供参考。
1 材料与方法
1.1 材料与试剂
豆腐柴叶粉,岚皋县绿竹食品有限公司;KCl,天津化学试剂有限公司;尿素,广州赛国生物科技有限公司;十二烷基硫酸钾(potassium lauryl sulfate,PDS),国药集团化学试剂有限公司;95%乙醇,巴斯夫生物科技有限公司;蒸馏水,邵阳学院实验室提供;NaOH,上海巨鹏化工有限公司;半乳糖醛酸(98%),源叶生物有限公司;浓H2SO4,成都金山化学试剂有限公司。
1.2 仪器与设备
Haake RheoStress 6000流变仪、Nicolet 6700傅里叶红外光谱仪、ST-16R高速冷冻离心机,Thermo Fisher Scientific公司;W201B旋转蒸发仪,上海申胜生物技术有限公司;FD-1A-50冷冻干燥机,北京博医康实验仪器有限公司;TA-XT Plus物性测试仪,英国Stable Micro Systems有限公司;D/MAX2500V X射线衍射仪,日本理学株式会社;Gemini 500扫描电子显微镜,德国卡尔蔡司公司。
1.3 实验方法
1.3.1 豆腐柴果胶(AOP)凝胶的制备
根据PAN等[10]的方法,用草酸铵提取法提取AOP。首先,采用索氏提取法对新鲜豆腐柴粉末进行去色素、去脂肪处理。之后,粉末与95%体积分数乙醇按照料液比1∶30(g∶mL)进行混合,将悬浮液置于冰箱(4 ℃)中保存24 h,过滤后得到不溶性固体。将0.1 mol/L的草酸铵溶液加入不溶性固形物中[按料液比1∶30(g∶mL)],70 ℃加热30 min。离心后(11 000 r/min,10 min,25 ℃),将上清液加入95%乙醇中(上清液与乙醇以1∶30 体积比混合),4 ℃保存24 h。随后,收集固体,干燥后用超纯水透析(48 h,分子截留量14 kDa)。透析液冻干过夜获得AOP。另外,配制1 mol/L的KCl溶液。将AOP储备液与KCl溶液按不同比例混合于10 mL体系的离心管中,来制备混合物(0.3、0.4、0.5、0.6、0.7 mol/L, K+体积分数为0.3% AOP),室温静置12 h后观察其状态,拍摄获得直观图。
1.3.2 动态流变学测试
根据1.3.1节的方法制备了含不同K+浓度(0.3、0.4、0.5、0.6、0.7 mol/L)的AOP凝胶。用流变仪在振荡模式下对凝胶进行频率扫描测量,从而获得果胶凝胶的储能模量(G′)和损耗角(tanδ=G″/G′)与振荡频率之间的变化关系。实验参数设置为:平行板夹具(直径35 mm,间隙1 mm),恒温25 ℃,剪切应力0.1 Pa,频率0.1~10 Hz。
1.3.3 凝胶硬度测试
在测试凝胶硬度之前,将含有不同K+浓度的AOP凝胶(0.3、0.4、0.5、0.6、0.7 mol/L),根据1.3.1节的方法在20 mL的玻璃样品瓶(φ=27.5 mm,h=57.0 mm)中制备,使得凝胶高度约为10.0 mm。测试过程中,使用P/0.5圆柱形探头进行硬度测试,允许以1.0 mm/s的速度压缩凝胶至4.0 mm深度,施加5 g的触发力[11]。每个凝胶制备3个样本,每个样本测试1次。
1.3.4 WHC测试
含不同K+浓度(0.4、0.5、0.6、0.7 mol/L)的AOP凝胶WHC根据LI等[12]的方法测定。离心前称取AOP凝胶的质量,称取质量记为mt,离心后(10 000 r/min,10 min,25 ℃),称量离心水,其质量记为mr。凝胶的WHC按公式(1)计算:
(1)
1.3.5 XRD测试
将AOP和冷冻干燥后的凝胶样品置于XRD仪中分析,测试条件为:CuKα靶,扫描范围2θ为5~60°,扫描速率2°/min。
1.3.6 扫描电镜(scanning electron microscope,SEM)测试
根据SONG等[13]的方法,采用SEM观察凝胶微观结构。按照1.3.1节的方法制备了不同K+浓度诱导的AOP凝胶后,再转移至-80 ℃冰箱中冷藏12 h后,冷冻干燥12 h。将冻干后的凝胶喷金后,置于扫描电子显微镜中观察,加速电压为5.0 kV。在1 000倍下观察每个样品的显微照片。采用XT Microscope Control软件釆集图谱。
1.3.7 FT-IR测试
称取冷冻干燥后的AOP和AOP凝胶样品1~3 mg进行KBr压片,然后放入样品池中,采用傅里叶红外光谱仪进行扫描检测,光谱范围4 000~400 cm-1,分辨率4 cm-1。
1.3.8 凝胶作用力测试
通过硬度测试和动态流变学测试,分析AOP与K+之间的凝胶作用力。将10 mol/L尿素、2%(体积分数)PDS两种不同的解离试剂分别在AOP-K+凝胶配制的过程中加入。室温静置12 h后,流变学测量按1.3.1节和1.3.2节中的方法进行。
1.4 处理及分析
实验数据以平均值±标准差形式表示。采用Origin 8.0软件绘制图表,利用LSD测试和SPSS 21.0软件对数据进行方差分析(ANOVA)。P<0.05表示为有显著性差异。
2 结果与分析
2.1 AOP凝胶的可视化观察和动态流变学研究
图1展示了添加不同浓度的K+后,0.3%(体积分数)AOP溶液状态的变化。在AOP溶液中,K+浓度为0.3 mol/L时发生聚集,但形成的聚集物掉入到了管底(图1-b)。因此,此时AOP没有形成坚固的凝胶。当K+浓度>0.4 mol/L时,AOP形成了坚固的凝胶。动态流变试验常用来表征凝胶的形成,损耗因子tanδ可作为评估标准。当样品的tanδ>1时,通常认为是液体;当试样的tanδ<1时,一般认为它具有固体性质。tanδ值越小,说明凝胶的固体性质越高。

a-正立图;b-倒立图
图1 不同K+浓度下AOP凝胶图
Fig.1 Diagrams of AOP gel at different K+ concentration
如图2所示,含0.3 mol/L K+时AOP的G′显著低于其他样品。另外,其tanδ≈0.7,高于其他凝胶。表明AOP在0.3 mol/L处形成的聚集体结构最弱。随着K+浓度的增加,样品的G′增大,在0.6 mol/L时达到最大值,同时,tanδ达到最低值,低于0.1。这表明,0.6 mol/L K+对AOP的凝胶化最有利,在此浓度下可以形成具有最高类固体性质的凝胶。K+诱导的AOP凝胶化可能归因于K+的静电屏蔽效应,这可能导致AOP链形成更多缠结,果胶链之间可能形成更多低键能相互作用,如氢键[14-15]。
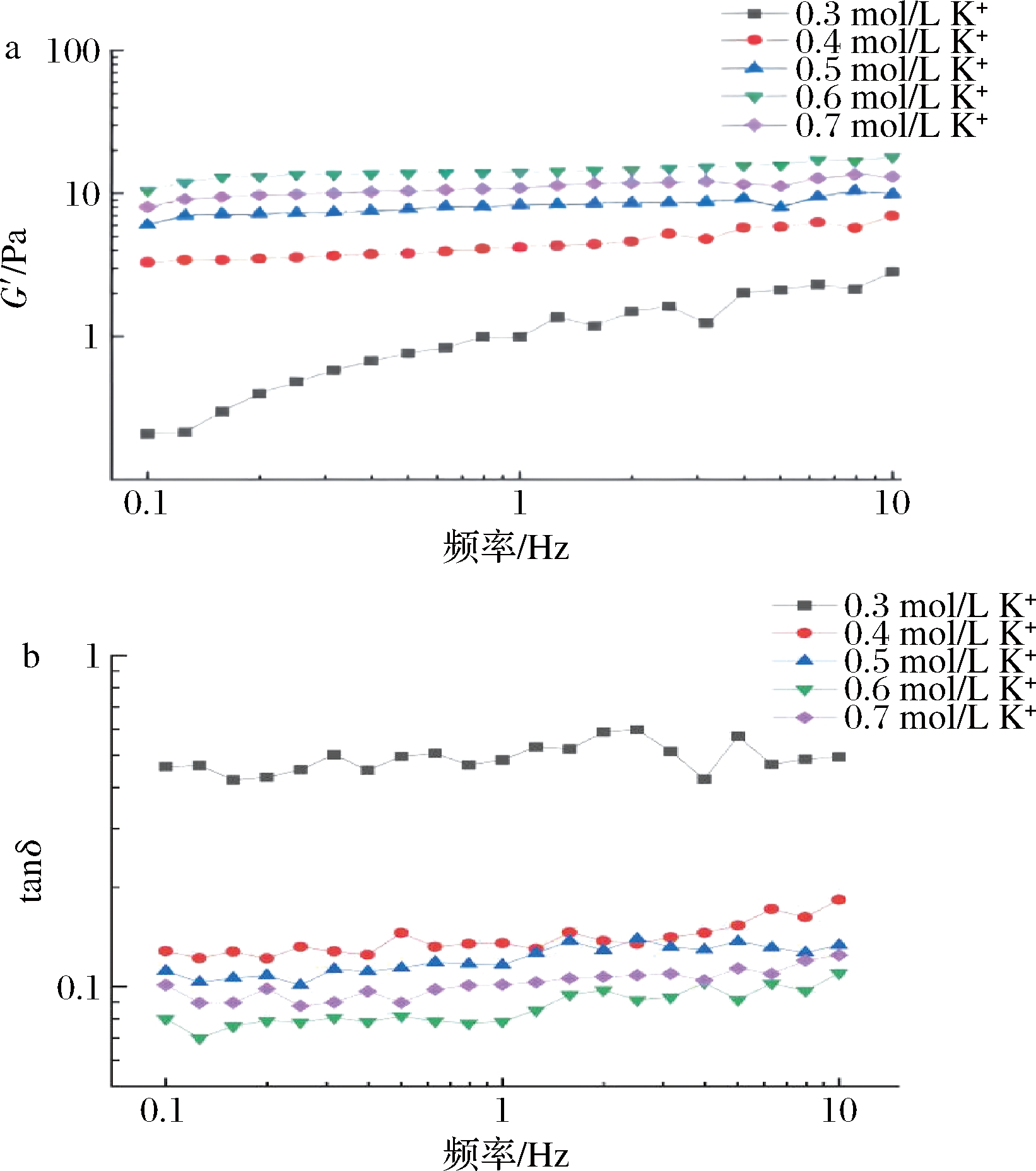
a-G′;b-tanδ
图2 含不同K+浓度的AOP凝胶的G′和tanδ
Fig.2 G′ and tanδ of the AOP gel with different K+ concentrations
2.2 凝胶硬度和WHC分析
如图3所示,通过差异性分析,可以得到不同K+浓度对承压力和WHC存在显著差异性(P<0.001,t=7.356)、(P=0.001,t=6.847)。随着K+浓度的增加,从0.4到0.6 mol/L凝胶硬度增加,在0.7 mol/L时下降,而AOP凝胶的WHC也有类似的变化趋势(图3)。AOP凝胶的最高WHC也出现在0.6 mol/L,这些结果与可视图一致。由此可知,存在一个最佳的K+浓度,使得AOP凝胶的凝胶硬度和WHC最强。陈晔等[16]研究了单价阳离子对柑橘果胶凝胶硬度和WHC的影响,结果表明,存在一个最佳的K+浓度(0.8 mol/L)使得柑橘果胶形成具有最佳的凝胶硬度和WHC的凝胶。随着K+的加入,果胶链之间的斥力减小使得果胶链之间的距离减小,为氢键提供了更多的结合区域,从而增强了凝胶结构,提高了凝胶硬度。同时,当形成更多的氢键时,更多的水会在凝胶网络中缠结,增加了AOP凝胶的WHC。然而,由于维持凝胶结构需要足够的静电斥力,当K+浓度高于最佳浓度时,果胶链间斥力的进一步降低可能会降低凝胶结构的稳定性。因此,AOP凝胶的硬度和WHC会降低。

a-凝胶硬度;b-保水性
图3 含不同K+浓度的AOP果胶的凝胶硬度和保水性
Fig.3 Gel hardness and water holding capacity of AOP pectin with varying K+ concentrations
2.3 XRD分析
如图4所示,K+的加入对AOP的晶型结构有显著的影响。从AOP的XRD图谱(图4-a)可以看出,有宽吸收峰,说明AOP具有非晶型结构。在所有的AOP凝胶中(图4-b),AOP的2个特征峰消失了,又形成了新的峰,说明K+的加入会导致AOP形成新的晶体结构。此外,含有0.6 mol/L K+的凝胶具有最强的峰强度,而峰强度在0.7 mol/L处降低。这意味着在0.6 mol/L K+形成的凝胶比在0.7 mol/L K+形成的凝胶具有更有序的结构。董姬秀等[17]研究了K+浓度对凉粉单多糖-大豆分离蛋白复合凝胶的影响。他们发现,当K+含量较高时,复合凝胶的原始特征峰几乎消失,并形成新的尖锐特征峰,这意味着会产生新的分子间相互作用。新晶体结构的形成可能是由于K+的静电屏蔽作用,导致了AOP链的缠结。随后,果胶链上未解离的羧基产生了更多的氢键,AOP发生了凝胶化。在这个过程中,可能会形成一个更有序的结构。但当K+的含量高于最佳浓度时,凝胶结构稳定下降,从而降低了AOP凝胶的规律性。

a-AOP;b-AOP凝胶
图4 AOP和在不同K+浓度下AOP凝胶的XRD图
Fig.4 XRD plot of AOP and AOP gel at different K+ concentrations
2.4 SEM分析
如图5-a所示,在K+含量为0.4 mol/L时,AOP凝胶呈现出了较为疏松、多孔的凝胶网络结构,凝胶网络中的空隙较大。而随着K+浓度增加到0.6 mol/L(图5-c),AOP凝胶呈现出了更加致密、均匀、光滑的微观结构,凝胶网络中的空隙越来越小,说明盐离子的增加,强化了AOP凝胶的结构。此外,随着K+浓度的增加,凝胶表面出现的块状物质也随着增多,当盐离子浓度达到0.7 mol/L时,凝胶表面出现了大量的块状颗粒,这可能是由于AOP在较高浓度K+的诱导下,发生了较强的凝聚作用,从而随机形成了大量不规则的聚集体。这种作用可能弱化了AOP凝胶的强度。

a-0.4 mol/L;b-0.5 mol/L;c-0.6 mol/L;d-0.7 mol/L
图5 在不同K+浓度下AOP凝胶的SEM图
Fig.5 SEM plots of the AOP gels at different K+ concentrations
2.5 FT-IR分析
对于AOP的红外光谱(图6-a),3 361 cm-1处的宽峰对应于O—H伸缩振动。在2 930 cm-1处的吸收峰是由C—H伸缩振动引起的。在1 730 cm-1处的吸收峰是由—COOCH3和—COOH中的C![]() O伸缩振动引起的。1 602和1 414 cm-1的吸收峰是由O
O伸缩振动引起的。1 602和1 414 cm-1的吸收峰是由O![]() C—O在—COO—中的不对称振动和对称振动引起的。1 104和1 015 cm-1的吸收峰是由糖环上的C—O—H和C—O—C的伸缩振动引起的。不同K+浓度的AOP凝胶的红外光谱(图6-b)与(图6-a)相比没有形成新的吸收峰,说明添加K+并没有诱导化学键的生成。因此,可以推断,K+诱导的AOP凝胶化主要是通过物理键形成的。此外,当K+浓度从0 增加到0.7 mol/L时,O—H吸收峰的波数从3 361 cm-1增加到3 423 cm-1,说明分子间氢键的增强[18-19]。同时,O
C—O在—COO—中的不对称振动和对称振动引起的。1 104和1 015 cm-1的吸收峰是由糖环上的C—O—H和C—O—C的伸缩振动引起的。不同K+浓度的AOP凝胶的红外光谱(图6-b)与(图6-a)相比没有形成新的吸收峰,说明添加K+并没有诱导化学键的生成。因此,可以推断,K+诱导的AOP凝胶化主要是通过物理键形成的。此外,当K+浓度从0 增加到0.7 mol/L时,O—H吸收峰的波数从3 361 cm-1增加到3 423 cm-1,说明分子间氢键的增强[18-19]。同时,O![]() C—O非对称振动峰从1 602增加到1 616.8 cm-1,可能是由于—COO—与K+之间发生的静电结合。根据这些结果,可以推测K+诱导的静电屏蔽作用(减少AOP分子之间的静电斥力)和氢键导致了AOP凝胶的形成。
C—O非对称振动峰从1 602增加到1 616.8 cm-1,可能是由于—COO—与K+之间发生的静电结合。根据这些结果,可以推测K+诱导的静电屏蔽作用(减少AOP分子之间的静电斥力)和氢键导致了AOP凝胶的形成。

a-AOP;b-AOP凝胶
图6 AOP和在不同K+浓度下AOP凝胶的FT-IR图谱
Fig.6 FT-IR profile of AOP and AOP gel at different K+ concentrations
2.6 凝胶作用力分析
在AOP凝胶的制备中加入尿素和PDS 2种解离剂,分别破坏氢键、疏水相互作用。制备的凝胶用于动态流变试验。结果表明,尿素对AOP凝胶的影响最显著(图7),与对照组相比,含有尿素的样品的G′明显降低。同时,其tanδ明显高于其他样本,表明此样品的类固体性质被大大削弱。含有PDS的凝胶样品,其G′和tanδ没有显著的不同的控制。这些结果证实了氢键在AOP凝胶化过程中起着最重要的作用,而疏水键的作用很小。ZHOU等[20]研究了低甲氧基果胶的酸诱导凝胶化,他们发现,分子之间的氢键会促进低甲氧基果胶在酸性pH下(2.5)的凝胶化。由于AOP的酯化度很低,果胶上并没有很多疏水区域。因此,果胶链之间的疏水相互作用受到很大限制。相反,AOP含有高含量的聚半乳糖醛酸,所以羧基广泛分布在果胶链上。因此,当静电斥力在AOP链之间减弱时,相邻的未解离的羧基之间往往形成氢键,主导着AOP的凝胶化。因此,氢键可能是AOP凝胶化的主要作用力。
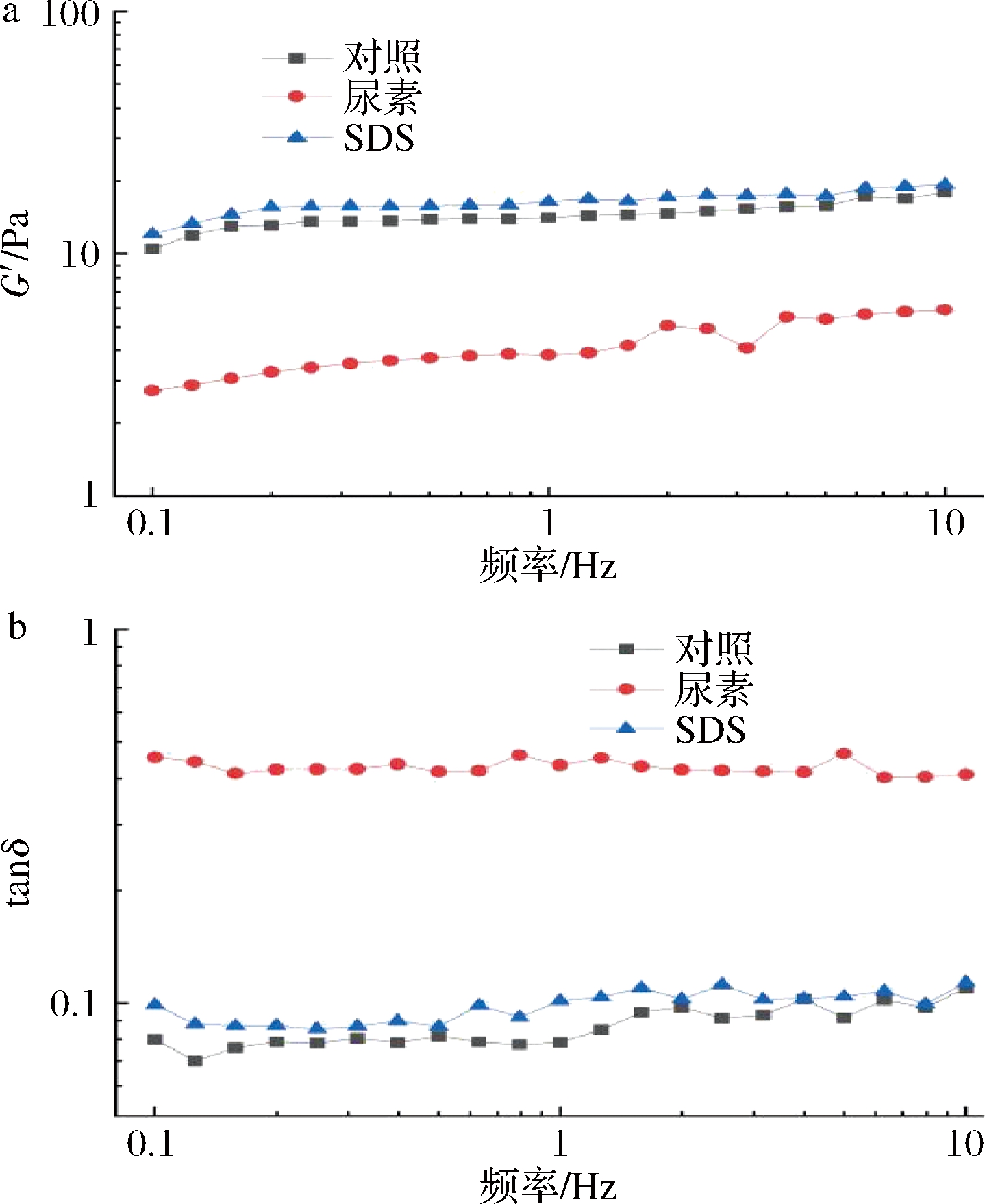
a-G′;b-tanδ
图7 包含不同的解离试剂(2 mol/L尿素和体积分数为0.4%PDS)的0.6 mol/L K+的AOP凝胶的G′和tanδ
Fig.7 G′ and tanδ of a 0.6 mol/L K+ AOP gel containing different dissociation reagents (2 mol/L urea and 0.4% PDS)
2.7 凝胶机理分析
根据HUANG等[21]的研究,在常温下盐离子与pH对果胶的凝胶化起到了主导作用。盐离子种类的不同会导致果胶形成凝胶的机理不同。一般来说,二价阳离子加入到低酯果胶中时,能够通过结合解离的羧酸根基团,在相互靠近的果胶分子链的光滑区之间形成分子间的离子结合点[22]。另外,从构成凝胶的分形聚集体(絮凝体)的微观动力学角度来说,当Ca2+浓度在临界盐浓度以上,絮凝体间通过相互连接形成反应受限的凝胶网络结构,因此Ca2+介导的果胶凝胶使絮凝体间的交联强于絮凝体内的交联,使得凝胶处于“强交联”状态[23]。对于单价阳离子,K+诱导果胶形成凝胶的机理与二价阳离子不同,在高酯果胶进行去酯化的过程中,一定浓度的单价盐离子的存在会使得果胶分子上解离的羧酸根基团会与单价阳离子结合,降低了静电斥力,使得果胶的扩展度降低,之后K+会与羟基形成一定的静电吸引作用,从而形成凝胶[24]。另外,有研究指出,对于低酯果胶,在较低pH下(2~4),一价离子的存在进一步降低了低酯果胶链间的电荷排斥,并通过氢键的作用形成凝胶[25-26]。pH的变化会导致果胶分子链的构象、结构发生变化,在较高pH下,果胶链的构象是高度伸展的,其局部几何结构接近于二级有序结构,而随着pH的降低,果胶的链构象将转换成可逆的更加紧实的三维结构。当pH达到果胶链几乎不带电的非常低的pH值时,果胶链会通过三倍螺旋的二聚作用形成凝胶[27]。在这个过程中,羧基基团会通过形成氢键来稳定凝胶结构。
基于上述讨论和实验结果,可以推断出K+诱导AOP凝胶化的机理(图8)。在AOP溶液中加入KCl溶液时,K+会与果胶链上游离的羧基结合,产生静电屏蔽效应,从而降低了AOP分子内部和分子间的静电斥力,降低了AOP的膨胀程度,使果胶分子相互靠近。同时,AOP分子内和分子间的氢键将通过果胶链上的羟基和未解离的羧基形成,从而导致果胶分子间的结合和凝胶的形成。此外,有一个最佳的K+浓度有助于AOP凝胶的最佳结构。当K+含量超过最佳浓度时,果胶分子间的静电斥力将大大降低,AOP分子间的结合将更加强烈。在此过程中,果胶分子随机聚集,大大降低了凝胶结构的有序性和强度。

图8 K+诱导豆腐柴果胶自凝胶
Fig.8 K+ induced P.microphylla pectin self-gel
3 结论
本研究对K+诱导AOP凝胶化进行了研究,证明了K+浓度对AOP凝胶的形成有决定性的影响。此外,K+诱导AOP凝胶化主要是由静电屏蔽和氢键引起的,0.6 mol/L的K+浓度是AOP形成固体状特征和稳定结构凝胶的最佳浓度,在AOP溶液中加入KCl溶液时,K+会与果胶链上游离的羧基结合,产生静电屏蔽效应,从而降低了AOP分子内部和分子间的静电斥力,降低了AOP的膨胀程度,使果胶分子相互靠近。同时,AOP分子内和分子间的氢键将通过果胶链上的羟基和未解离的羧基形成,从而导致果胶分子间的结合和凝胶的形成。当K+浓度高于最适浓度时,果胶分子强烈聚集导致了凝胶强度和稳定性的降低,使得其凝胶性能降低。
[1] 李兴武, 章黎黎.豆腐柴叶果胶凝胶形成研究进展[J].农产品加工, 2020(24):69-72.
LI X W, ZHANG L L.Research progress on leaf pectin gel formation of Premna microphylla Turcz[J].Farm Products Processing, 2020(24):69-72.
[2] LIN L H, SHEN M Y, LIU S C, et al.An acidic heteropolysaccharide from Mesona chinensis:Rheological properties, gelling behavior and texture characteristics[J].International Journal of Biological Macromolecules, 2018, 107:1591-1598.
[3] SHI Q, ZOU M Y, SONG M M, et al.Effects of ultrasonic on structure, chain conformation and morphology of pectin extracted from Premna microphylla Turcz[J].Carbohydrate Polymers, 2022, 296:119949.
[4] SHI Q, ZOU M Y, WANG J H, et al.Ultrasonic effects on molecular weight degradation, physicochemical and rheological properties of pectin extracted from Premna microphylla Turcz[J].International Journal of Biological Macromolecules, 2022, 221:1065-1076.
[5] MA G Q, CHAI X Y, HOU G G, et al.Phytochemistry, bioactivities and future prospects of mulberry leaves:A review[J].Food Chemistry, 2022, 372:131335.
[6] 忻晓庭, 刘大群, 章检明, 等.漂烫与干燥方式对豆腐柴叶干粉营养组分及豆腐适制性的影响[J].浙江农业学报, 2022, 34(8):1743-1751.
XIN X T, LIU D Q, ZHANG J M, et al.Effects of blanching and drying on nutritional components and processing suitability of dried Promma microphylla Turcz leaves[J].Acta Agriculturae Zhejiangensis, 2022, 34(8):1743-1751.
[7] CHEN Y Y, LIU X, LEI X J, et al.Premna microphylla Turcz pectin protected UVB-induced skin aging in BALB/c-nu mice via Nrf2 pathway[J].International Journal of Biological Macromolecules, 2022, 215:12-22.
[8] YU Q Q, XIONG Z Y, SHI T, et al.On the gelation of Premna microphylla Turcz extracts:The effects of supernatant and precipitate of plant ash suspension[J].Food Research International, 2022, 156:111316.
[9] 赵若寒, 刘佳奇, 张艺, 等.豆腐柴果胶凝胶特性及其凝胶食品应用[J].浙江农业学报, 2022, 34(9):2013-2019.
ZHAO R H, LIU J Q, ZHANG Y, et al.Characteristics of pectin gel from Premna microhylla Turcz and its application of gel food[J].Acta Agriculturae Zhejiangensis, 2022, 34(9):2013-2019.
[10] PAN M K, ZHOU F F, SHI R H, et al.Characterizations of a pectin extracted from Premna microphylla Turcz and its cold gelation with whey protein concentrate at different pHs[J].International Journal of Biological Macromolecules, 2019, 139:818-826.
[11] DONG Z, DU Z Q, WU X Y, et al.Fabrication and characterization of ZnO nanofilms using extracted pectin of Premna microphylla Turcz leaves and carboxymethyl cellulose[J].International Journal of Biological Macromolecules, 2022, 209:525-532.
[12] LI X, WEI Z L, WANG X Y, et al.Premna microphylla Turcz leaf pectin exhibited antioxidant and anti-inflammatory activities in LPS-stimulated RAW 264.7 macrophages[J].Food Chemistry, 2021, 349:129164.
[13] SONG G L, CHEN F Y, CHEN S B, et al.Polysaccharides from Premna microphylla Turcz ameliorate inflammation via the enhancement of intestinal resistance in host[J].Journal of Ethnopharmacology, 2021, 276:114208.
[14] GONG H Y, LIN X Y, XIE Y, et al.A novel self-crosslinked gel microspheres of Premna microphylla Turcz leaves for the absorption of uranium[J].Journal of Hazardous Materials, 2021, 404:124151.
[15] 徐安书. 豆腐柴叶凝胶的影响因素研究[J].安徽农业科学, 2022, 50(2):172-175.
XU A S.Influencing factors of bean curd leaf gel[J].Journal of Anhui Agricultural Sciences, 2022, 50(2):172-175.
[16] 陈晔, 李静雯, 李晓, 等.豆腐柴叶果胶凝胶流变特性及其在吞咽障碍食品中的应用研究[J].食品科技, 2021, 46(11):252-258.
CHEN Y, LI J W, LI X, et al.Rheological properties of Premna microphylla Turcz pectin and its application in food for improving dysphagia[J].Food Science and Technology, 2021, 46(11):252-258.
[17] 董姬秀, 王齐瑞.豆腐柴的研究进展[J].河南林业科技, 2021, 41(3):30-32.
DONG J X, WANG Q R.Research progress of tofu Chai[J].Journal of Henan Forestry Science and Technology, 2021, 41(3):30-32.
[18] LU J K, LI J J, JIN R C, et al.Extraction and characterization of pectin from Premna microphylla Turcz leaves[J].International Journal of Biological Macromolecules, 2019, 131:323-328.
[19] BANERJEE J, VIJAYARAGHAVAN R, ARORA A, et al.Lemon juice based extraction of pectin from mango peels:Waste to wealth by sustainable approaches[J].ACS Sustainable Chemistry &Engineering, 2016, 4(11):5915-5920.
[20] ZHOU F F, PAN M K, LIU Y, et al.Effects of Na+ on the cold gelation between a low-methoxyl pectin extracted from Premna microphylla turcz and soy protein isolate[J].Food Hydrocolloids, 2020, 104:105762.
[21] HUANG Z H, XING G L, TU C H, et al.Effect of Premna microphylla Turcz leaves’ extract addition on physicochemical and antioxidant properties of packed tofu by lactic fermentation[J].International Journal of Food Science &Technology, 2020, 55(6):2541-2550.
[22] 邓诺梅, 董帅, 付嘉艳, 等.豆腐柴奶茶最优工艺[J].食品工业, 2022, 43(8):75-78.
DENG N M, DONG S, FU J Y, et al.The optimal process of Premna microphylla Turcz leaf milk tea[J].The Food Industry, 2022, 43(8):75-78.
[23] ELMAIDOMY A H, MOHAMMED R, HASSAN H M, et al.Metabolomic profiling and cytotoxic tetrahydrofurofuran lignans investigations from Premna odorata blanco[J].Metabolites, 2019, 9(10):223.
[24] 张星海. 抹茶果胶豆腐食品创新工艺研究[J].农产品加工, 2020(23):32-35; 38.
ZHANG X H.Study on innovative process of matcha pectin tofu food[J].Farm Products Processing, 2020(23):32-35; 38.
[25] 刘昕, 张驰, 薛艾莲, 等.超声-酶法提取的豆腐柴低酯果胶理化性质及结构表征[J].食品与发酵工业, 2021, 47(8):108-115.
LIU X, ZHANG C, XUE A L, et al.Physicochemical properties and structure characterization of low-methoxy pectin from Premna microphylla Turcz extracted by ultrasound-enzyme treatment[J].Food and Fermentation Industries, 2021, 47(8):108-115.
[26] 李刚凤, 严红波, 杨丽娟, 等.响应面法优化豆腐柴叶液态酸奶的发酵工艺[J].食品工业, 2020, 41(10):27-32.
LI G F, YAN H B, YANG L J, et al.Optimization of fermentation process for Premna microphylla Turcz leaf liquid yoghurt by response surface methodology[J].The Food Industry, 2020, 41(10):27-32.
[27] 李晓, 李静雯, 陈晔, 等.豆腐柴叶低甲氧基果胶提取工艺优化及其加工特性和微观结构研究[J].食品工业科技, 2020, 41(13):14-21.
LI X, LI J W, CHEN Y, et al.Optimization of low-methoxy pectin extraction from Premna microphylla Turcz and study on its processing characteristics and microstructure properties[J].Science and Technology of Food Industry, 2020, 41(13):14-21.