D-阿洛酮糖作为一种稀有酮糖,是果糖的C-3差向异构体,其甜度相当于蔗糖的70%,能量仅为蔗糖的0.3%,具有低卡、绿色、甜度高,口感和容积特性与蔗糖类似的特点,被认为是蔗糖的理想替代甜味剂[1-2]。D-阿洛酮糖具有改善胰岛素抵抗[3]、抗肥胖[4]和调节血脂代谢[5]等多种生理功能。除此之外,它还能改善产品品质,如提高明胶软糖弹性和含水量,保持烘焙类产品的湿度和硬度[6-7]等。因此,D-阿洛酮糖作为蔗糖的替代品和食品添加剂具有重要的开发价值。由于D-阿洛酮糖的极其稀缺性和良好的生理功能,如何以较低的成本和简便的工艺生产出大量的D-阿洛酮糖是近年的研究热点。与复杂繁琐且产率低的化学合成法相比,绿色高效的生物合成法成为新的研究热点。生物法合成D-阿洛酮糖目前最重要的途径是利用D-阿洛酮糖3-差向异构酶(D-allulose 3-epimerase, DAEase)催化D-果糖在C-3进行可逆的差向异构化反应获得。近年来已有20余种不同微生物来源的DAEase在真核及原核表达系统中成功进行异源表达的报道[8],转化率普遍在20%~35%,具有较好的应用前景。
对于纯度要求较高的食品和药品,后期的分离提纯效率对其产业化生产具有重要意义。D-阿洛酮糖的工业化生产制备面临着酶催化后D-阿洛酮糖与残留底物分离的问题,这使D-阿洛酮糖的生产成本大大增加。模拟移动床技术(simulated moving bed,SMB)是一种可规模化生产的连续色谱分离技术,可以将生物合成法得到的D-阿洛酮糖从混合糖液中分离出来[9],但是设备昂贵,操作繁琐,目前尚未普及使用。色谱分离法是一种基于离子交换原理的成熟工艺,成本低廉,操作方便且分离效果较好,也被应用于D-阿洛酮糖的料液分离。D-阿洛酮糖由于其较高的溶解度,且易吸潮,受热易呈玻璃态[10],因此结晶难度大,难以用加热干燥法制得最终的产品,严重限制了D-阿洛酮糖工业化生产。现有的报道中多为乙醇结晶法[11],但是该工艺需要使用大量有机溶剂,存在潜在的安全隐患,且存在产品收率低,容易引入外来杂质,结晶困难,工艺不稳定和成本过高等问题,因此乙醇结晶法并不适合于工业化生产。而冷却结晶法具备操作简单,设备要求低等优点,但已报道的冷却工艺中仍存有结晶周期长、晶粒不稳定及回收率低等不足,需要进一步优化,以建立回收率高、能耗低的结晶方法。
与生物法转化合成D-阿洛酮糖的上游产业研究相比,目前针对D-阿洛酮糖的分离纯化、结晶等下游研究较少,为进一步提高D-阿洛酮糖的生产效率,降低工业化生产D-阿洛酮糖的成本,简化下游的分离提纯、结晶、干燥等工艺步骤的研究必不可少。因此,本研究通过在大肠杆菌中异源表达不同微生物来源的酮糖3-差相异构酶,利用重组工程大肠杆菌获得D-阿洛酮糖料液,并尝试优化D-阿洛酮糖的冷却结晶工艺,完成D-阿洛酮糖从生物合成到分离纯化,再到冷却结晶的小试阶段,为工业化生产稀有酮糖提供重要依据。
1 材料与方法
1.1 实验材料
1.1.1 菌株与质粒
本实验中分别合成3种不同的D-阿洛酮糖3-差向异构酶的目的基因片段,微生物来源分别为根癌农杆菌(Agrobacterium tumefaciens)、多尔氏菌(Dorea sp. CAG317)、梭状芽孢杆菌(Clostridium scindens ATCC 35704),分别命名为DAE01、DAE02、DAE03。重组大肠杆菌BL21(DE3,pET28a-DAE01)、BL21(DE3,pET28a-DAE02)、BL21(DE3,pET28a-DAE03)为本实验室构建。引物合成、质粒构建及核酸测序由南京金斯瑞股份有限公司完成。宿主菌大肠杆菌BL21(DE3)、质粒pET28a(+)由本实验室保存。
1.1.2 基础培养基及主要试剂
LB(Luria-Bertani)培养基(g/L):蛋白胨10、NaCl 10、酵母提取物5,121 ℃灭菌20 min,用于重组菌株的培养。T4 DNA连接酶、卡纳霉素、异丙基-β-D-硫代半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG),生工生物工程(上海)股份有限公司;阳离子交换树脂001×7、阴离子交换树脂313、DTF-Ca2+色谱分离树脂,江苏苏青集团;质粒小量提取试剂盒,上海捷瑞有限公司。D-阿洛酮糖标品(色谱纯),阿拉丁;其他试剂均为国产分析纯。
1.1.3 仪器与设备
Waters 1525EF高效液相色谱仪、Sugar-PakTM1糖柱,美国Waters公司;HL-2B型数显恒流泵、DBS-100自动部分收集器,上海沪西分析仪器厂;ZQZY-70B振荡培养箱,上海知楚仪器有限公司;Synergy H1多功能酶标仪,美国伯腾仪器有限公司;夹套结晶器,天津易普佳科技有限公司;YRE-201D型旋转蒸发仪,巩义市予华仪器有限责任公司;DZF-6096真空干燥箱,上海一恒仪器有限公司。
1.2 实验方法
1.2.1 重组菌株的构建
在美国国家生物技术信息中心(National Center for Biotechnology Information, NCBI)数据库上筛选得到3种不同微生物来源的编码DAEase的基因序列,其中DAE01全长870 bp,DAE02全长870 bp,DAE03全长867 bp,通过密码子优化后,将优化后的3条基因序列交由南京金斯瑞公司合成。在C端整合6×His tag,同时在基因序列的5′端与3′端分别引入Nco Ⅰ和Xho Ⅰ酶切位点,通过限制性位点将修饰的序列整合到pET-28a(+)载体中,构成重组质粒pET28a-DAE01、pET28a-DAE02、pET28a-DAE03。将上述3个重组质粒转化到E.coil DH5α感受态细胞中,挑取阳性转化子,接入带有卡那霉素抗性的LB液体培养基中过夜培养,抽提质粒。将获得的3个pET28a-DAEase重组质粒转化到E.coil BL21(DE3)感受态细胞中,过夜培养,挑取单菌落验证。验证成功后,将菌液送上海生工公司测序,保存测序结果正确的重组菌。得到3株重组菌株E.coil BL21(DE3,pET28a-DAE01)、E.coil BL21(DE3,pET28a-DAE02)、E.coil BL21(DE3,pET28a-DAE03),图1为质粒构建示意图。

图1 重组DAEase质粒构建
Fig.1 The construction of DAEase recombinant plasmid
1.2.2 诱导表达及验证
挑取验证成功的重组菌,接种到卡那霉素终质量浓度为50 μg/mL的LB培养液中,37 ℃,200 r/min,培养8~10 h,以1.0%(体积分数)接种量转接至卡那霉素终质量浓度为50 μg/mL的1 L LB培养基中扩大培养至OD600值为0.6~0.8,进行诱导表达。诱导表达条件为:IPTG终浓度为0.2~0.5 mmol/L,20 ℃,14~16 h。冰浴10 min停止诱导,管式离心机收集湿菌体后,使用Tris-HCl破胞缓冲液洗涤菌体,使菌液质量浓度控制在100 mg/mL,进行超声波破胞,破胞条件为:功率300 W,工作1 s,停2 s,15 min。12 000 r/min离心15 min,取上清液进行十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)进行蛋白验证。
1.2.3 全细胞转化反应条件优化
将一定浓度的湿菌体与不同的缓冲体系(醋酸盐缓冲液pH 5.0~6.0,磷酸盐缓冲液pH 7.0~8.0,Tris-HCl缓冲液pH 9.0~10.0),充分混合得到的反应混合物在15~65 ℃下反应,以确定3种不同重组菌全细胞反应的最佳pH和温度。接下来,再分别将终浓度为5 mmol/L的MnSO4、CoCl2、ZnCl2、NiCl2、MgCl2或EDTA加入反应混合物,反应10 min,然后高温煮沸5 min停止反应。单位D-阿洛酮糖全细胞催化活力定义在全细胞反应条件下单位时间(1 min)内生成1 μmol D-阿洛酮糖所需要的全细胞的量,活力最高的值被确定为相对最高活力(100%)。在上述研究基础上,分别将3株重组菌(湿菌体质量浓度为20~120 mg/mL)在不同质量浓度的D-果糖(50~750 g/L)下合成D-阿洛酮糖,在最佳的反应体系下反应5 h,以考察湿菌体浓度和底物浓度对全细胞反应的影响。
1.2.4 D-阿洛酮糖的色谱分离
全细胞转化得到的反应液使用阴、阳离子大孔树脂吸附分离其中的盐离子,脱盐脱色处理后得到的混合溶液使用DTF-Ca2+分离树脂进行分离纯化。参考邢庆超等[12]的方法,具体参数为:DTF-Ca2+分离树脂处理再生后装填入型号为26 cm×100 cm带夹套的层析柱中,填料体积为400 mL。待柱平衡后,将脱盐处理后的D-果糖和D-阿洛酮糖混合溶液缓慢滴入到树脂表面,一次进样量为10 mL。洗脱条件为:去离子水为流动相,柱温60 ℃,流速1 mL/min,用自动收集器收集洗脱样品,通过HPLC检测,与D-阿洛酮糖和D-果糖标准样品比较,定性定量各管样品中的D-果糖和D-阿洛酮糖的浓度。
1.2.5 D-阿洛酮糖冷却结晶工艺优化
采取冷却结晶法对D-阿洛酮糖的料液进行结晶,利用HPLC检测结晶率和纯度来确定最优的结晶条件。基本方法为:分离纯化后得到的阿洛酮糖料液经60 ℃旋转蒸发后,浓缩至一定的料液质量浓度(1.1、1.2、1.3、1.4、1.5 g/mL),接着往体系中加入过筛的质量分数为2.0% D-阿洛酮糖晶种,然后按照一定降温速率(1.0、2.0、3.0、4.0、5.0 ℃/h)降温至终点温度(5、10、15、20、25 ℃),终点温度停留时间不超过2 h,搅拌速率分别为20、40、80、120,150 r/min,结晶析出晶体后,8 000 r/min离心过滤,4 ℃无水乙醇洗涤滤饼2~3次,50 ℃真空干燥至恒重。对料液浓度、终点温度、降温速率、搅拌速率等因素进行工艺优化。
1.2.6 HPLC定量分析
HPLC检测条件[13]:Waters 600高效液相色谱仪、Sugar-pakTM1柱,Waters 2410示差遮光检测器。流动相为超纯水,柱温85 ℃,流速0.4 mL/min,进样量10 μL。D-阿洛酮糖标样质量浓度为5 mg/mL。所有样品均需用0.22 μm微孔滤膜过滤。D-阿洛酮糖转化率计算如公式(1)、公式(2)所示:
(1)
(2)
式中:R1,D-阿洛酮糖生物转化率,%;R2,D-阿洛酮糖结晶率,%;CA,D-阿洛酮糖溶液质量浓度,g/mL;CF,D-果糖溶液质量浓度,g/mL;mA,D-阿洛酮糖结晶后的干重,g;VA,D-阿洛酮糖料液体积,mL。
2 结果与分析
2.1 DAEase 的SDS-PAGE结果分析
由图2的SDS-PAGE结果可知,诱导后的3株重组大肠杆菌破胞上清液均在25~35 kDa处有清晰可见的条带,与目的蛋白的分子质量大小一致,说明3种酮糖3-差向异构酶在E.coli BL21(DE3)中均能实现正确表达,且为可溶性表达,目的蛋白的表达量也较高,得到的粗酶液可以进行后续的实验。
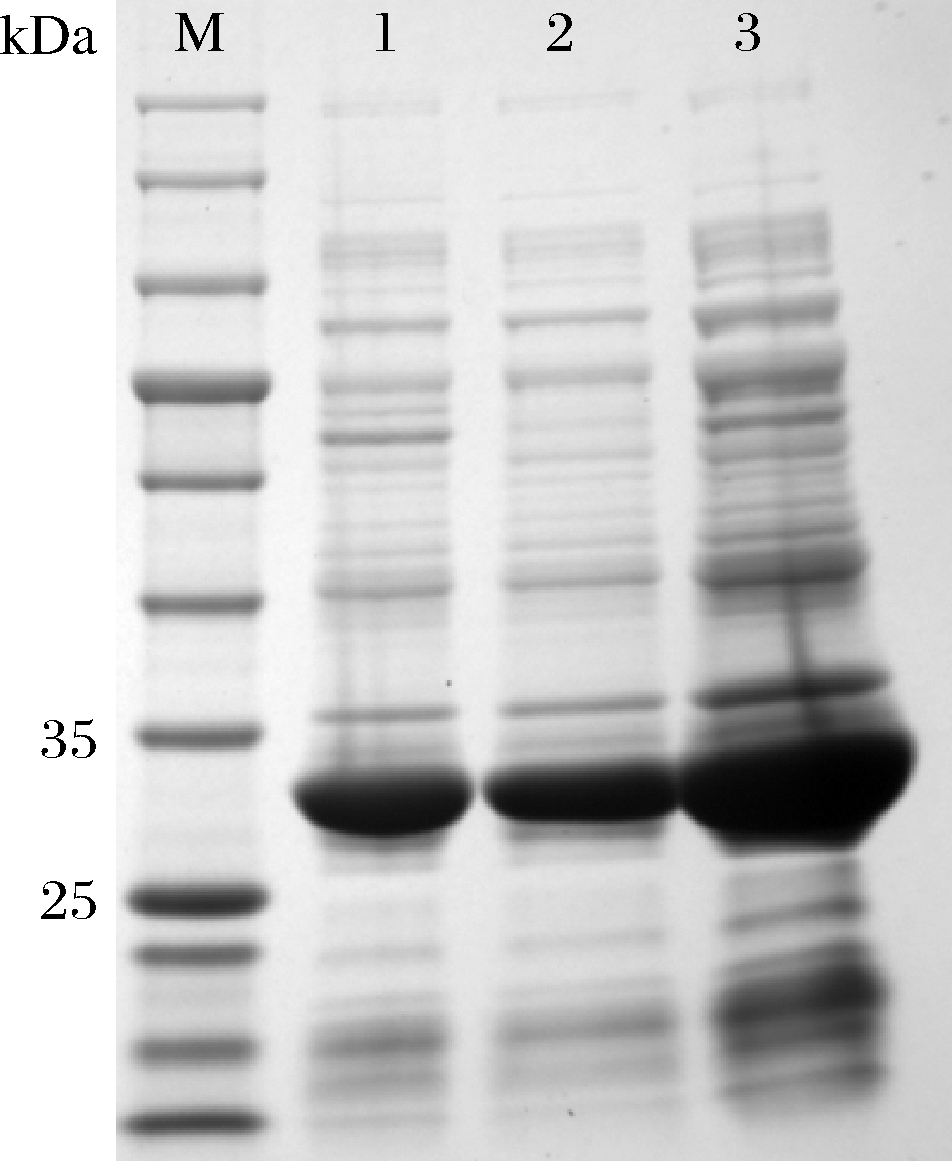
图2 重组大肠杆菌破胞上清液SDS-PAGE图
Fig.2 SDS-PAGE analysis of the recombinant
E.coli BL21(DE3) cell-free extracts
M-蛋白Marker;1-诱导后的E. coli BL21(DE3,pET28a-DAE01)
破胞上清液;2-诱导后的E. coli BL21(DE3,pET28a-DAE02)
破胞上清液;3-诱导后的E. coli BL21(DE3,pET28a-DAE03)
破胞上清液(3种目的蛋白分子质量均约为32 kDa)
2.2 重组大肠杆菌转化能力分析及优化
全细胞反应可以一定程度上减少反应的环境对游离酶的影响,在复杂的体系内,全细胞比游离酶更稳定,同时全细胞反应避免复杂的蛋白酶纯化步骤[14]。构建成功的3株重组大肠杆菌按照1.2.3节中所述方法进行D-阿洛酮糖的全细胞生物转化。为研究温度对重组酮糖差相异构酶催化活性的影响,分别在不同温度(15~65 ℃)条件下进行全细胞反应,结果如图3-a所示。在一定范围内随着反应温度的升高,3种不同重组全细胞的催化活性都逐步升高,这是因为当反应温度升高,可逆反应的平衡向生成D-阿洛酮糖的方向移动,目的产物的产量越高,因此在较高的温度下反应有利于提高D-阿洛酮糖的生物转化率。DAE01和DAE03在45~55 ℃时相对催化活性较高,都能保持在80%以上。当温度高于55 ℃时,DAE01和DAE03重组菌的活力急剧下降,相对催化活性低于60%,原因是温度过高,导致酮糖差相异构酶的酶活性降低,从而使得重组大肠杆菌催化活性快速降低。在全细胞催化转化过程中,反应温度会通过影响酮糖差相异构酶的催化活力,进而显著影响静息细胞的催化活性。因此DAE01和DAE03重组菌的最适反应温度为45~55 ℃,而DAE02的最适温度为65 ℃,是3种不同重组菌中耐热性最好的。

a-反应温度;b-pH;c-底物质量浓度;d-湿菌体质量浓度
图3 不同因素对全细胞生物转化能力的影响
Fig.3 Effect of different factors on whole-cell bioconversion capacity
为研究pH对3株重组菌全细胞催化活性的影响,按照1.2.3节中所述,在不同pH条件的缓冲体系下分别进行了全细胞反应并测定了相对催化活力。由图3-b可知,反应环境的pH值会影响酶蛋白的构象,同时影响活性中心残基和底物分子的解离状况,进而影响全细胞的催化活性。DAE01的最适pH和大多数其他的酮糖差相异构酶一样是在偏碱环境下(pH 8.0)且当pH低于6.0或高于9.0时,几乎失去了催化活性。DAE03在中性环境下呈现出其相对最高催化活力,而当处于偏酸或偏碱的体系下,其催化活力显著降低,这与DAE01存在明显差异,而DAE02则展现了较宽的pH适应性,其在弱酸条件下(pH 6.0)呈现最高的催化活性,并且在pH 7.0~8.0的反应环境中相对催化活力均高于60%。
金属离子也会对全细胞催化反应产生一定的作用,金属二价离子对重组菌相对催化活性的影响结果见表1。DAE01和DAE03为非离子依赖型酶,添加部分金属离子可以提高其催化活性,如Co2+、Mn2+、Mg2+均有促进作用,而其他的金属离子则会强烈抑制全细胞的催化活性;DAE02为Co2+依赖型酶[15],只有添加了Co2+才可以充分发挥其催化活性,当体系中未添加Co2+或是添加了其他金属辅因子均会降低其催化活性。此外EDTA作为一种金属螯合剂,添加到反应体系中,使得3种不同的重组细胞的催化活性受到显著抑制,3种重组菌的相对催化活性均低于10%。因EDTA在反应体系中螯合了金属离子,导致DAE02完全失去了催化活性。考虑到添加过多的金属离子,在生产中不仅会提高生产成本,也会为下游生产的分离纯化造成困难,因此DAE03在这一方面表现出较好的生产潜力。
表1 金属离子对重组菌催化活性的影响
Table 1 Effect of metal ions on recombinant enzymes activity
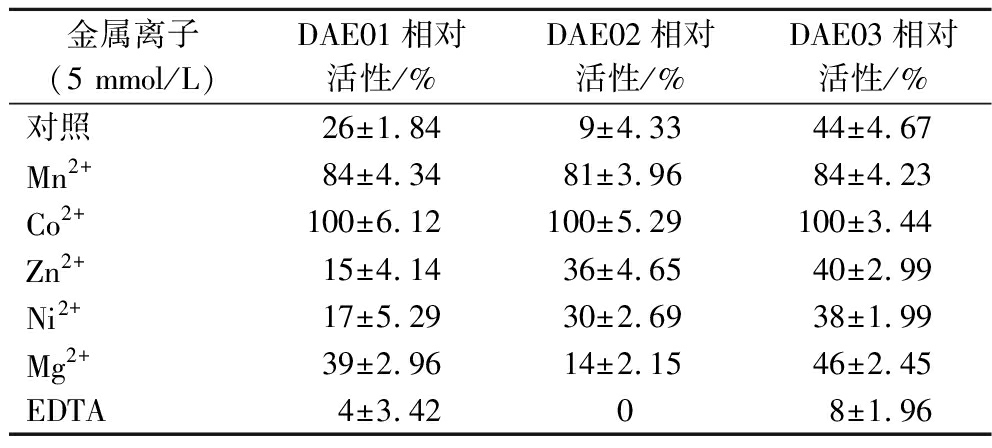
金属离子(5 mmol/L)DAE01相对活性/%DAE02相对活性/%DAE03相对活性/%对照26±1.849±4.3344±4.67Mn2+84±4.3481±3.9684±4.23Co2+100±6.12100±5.29100±3.44Zn2+15±4.1436±4.6540±2.99Ni2+17±5.2930±2.6938±1.99Mg2+39±2.9614±2.1546±2.45EDTA4±3.4208±1.96
在上述实验结果基础上,将3种重组全细胞在各自最佳的反应温度和pH下,添加合适的金属辅离子,进行后续的转化实验。研究不同底物浓度和湿菌体对于D-阿洛酮糖生物转化率的影响。反应5 h后取样,离心并稀释后过滤膜除菌,用HPLC检测D-阿洛酮糖生成量并计算转化率。结果如图3-c和图3-d所示。表达3种不同来源的DAEase的全细胞反应转化率都随着底物浓度和湿菌体浓度的增加而升高,在到达反应平衡后,不再持续增长。由结果也可知,3种全细胞的D-阿洛酮糖生物转化率基本在20%~32%,其中表达DAE01的全细胞在pH 8.0,45 ℃条件下进行催化反应,在D-果糖达到600 g/L时,反应达到平衡后产物转化率达到29.34%,反应液中D-阿洛酮糖溶液质量浓度约为176 g/L。表达DAE03的重组全细胞在pH 7.0,反应温度为45 ℃,D-果糖质量浓度为750 g/L,添加湿菌体质量浓度为100 mg/mL时,达到最高的转化效果,转化率为32.19%。而表达DAE02的全细胞在pH 6.0,反应温度为65 ℃,湿菌体质量浓度为120 mg/mL的条件下反应5 h后,最高转化率达到32.60%,HPLC结果见图4。综合以上分析和未来工业化生产潜力等多重因素的考虑,DAE02在耐热性、嗜弱酸性以及催化活性等方面都展现出更好的生产价值,因此后续将以表达DAE02的重组全细胞为主要研究对象继续下游的D-阿洛酮糖生产工艺研究。

图4 全细胞反应产物HPLC结果图
Fig.4 The HPLC analysis of whole-cell bioconversion
2.3 D-阿洛酮糖的色谱分离结果
色谱分离技术是利用不同物质在固定相和流动相中分配系数差异来分离混合物。基于上述结果,选择全细胞转化率最高的E.coli BL21(DE3,pET28a-DAE02)进行后续实验,将所述的重组菌在最佳条件下反应,得到的反应液按照1.2.4节所述方法,进行脱盐脱色及色谱分离后,由自动收集器收集后的样品通过HPLC检测,分别与标品进行比较,图5为定量检测每管洗脱样品中的D-阿洛酮糖和D-果糖的浓度的结果。由图5可知,实验成功除去了反应体系中的盐离子,并且实现了分离D-果糖和D-阿洛酮糖这两种性质接近的组分的目的,且分离效果较好,可以得到纯度为98.10%的D-阿洛酮糖。
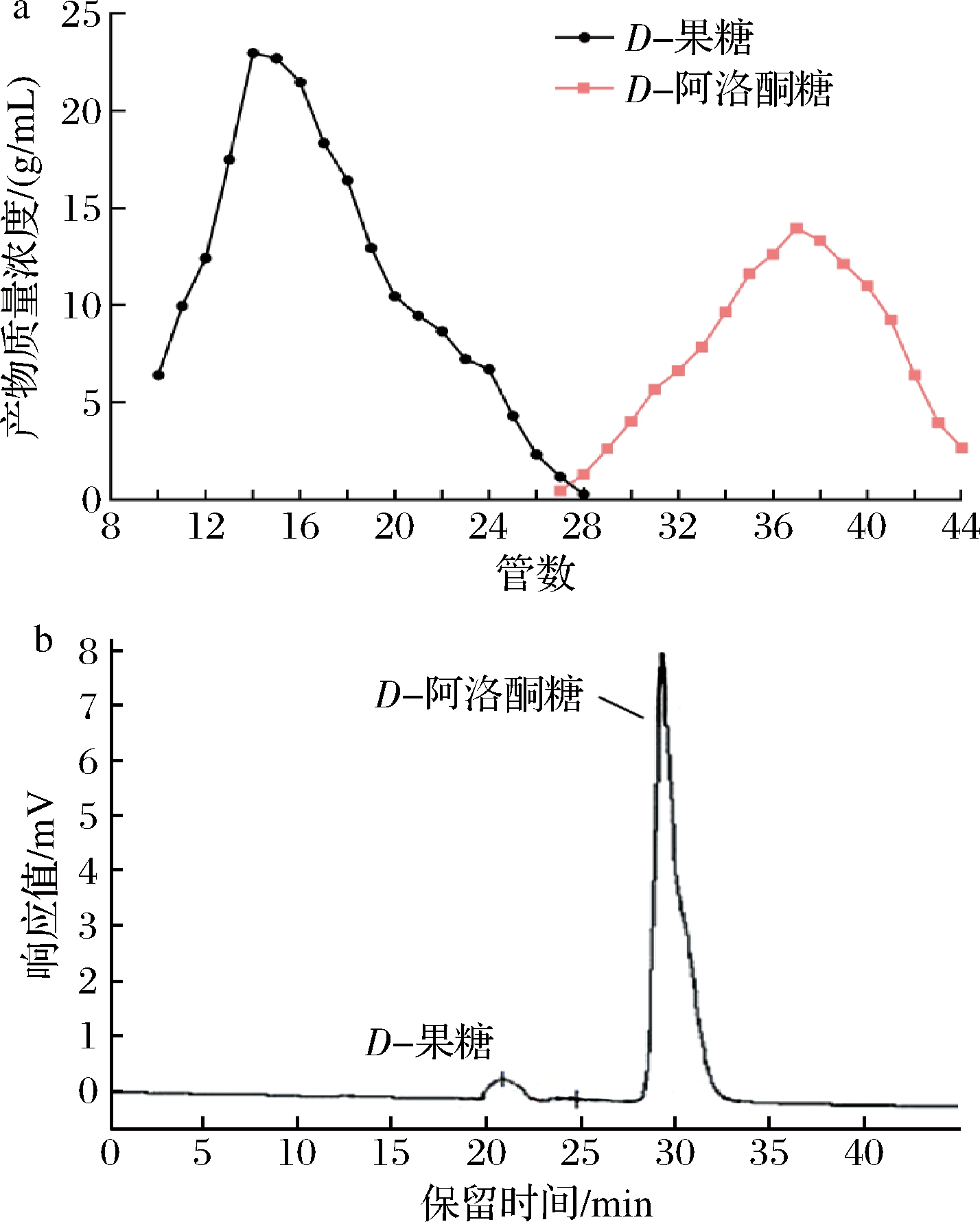
a-每管中D-果糖和D-阿洛酮糖两种不同组分的浓度;b-分离后的样品HPLC结果图
图5 色谱分离结果
Fig.5 Chromatographic separation results
2.4 D-阿洛酮糖冷却结晶工艺的优化结果分析
根据现有报道,目前D-阿洛酮糖结晶产率最高的工艺是采用乙醇体系进行结晶,通过优化乙醇用量等提升结晶率,但该法需添加大量有机试剂且未对结晶过程进行分析。而目前采用纯水体系对D-阿洛酮糖进行重结晶的方法包括减压蒸发及线性降温结晶法[16]。这些方法的突出缺点在于能耗大,结晶周期长,收率一般不高于50%。因此本研究在现有冷却结晶工艺的基础上,采用纯水体系进行D-阿洛酮糖的结晶,对关键因素进一步优化,提高结晶效率。
分别设置质量浓度为1.0、1.1、1.2、1.3、1.4、1.5 g/mL的D-阿洛酮糖料液以研究料液对结晶率的影响,结果见图6-a。随着D-阿洛酮糖溶液的料液浓度的升高,结晶率也在不断升高。当料液质量浓度低于1.2 g/mL时,D-阿洛酮糖基本无法结晶析出,这与郭元亨等[11]的研究结果一致。说明在D-阿洛酮糖冷却结晶过程中,析出晶体的总重量受料液浓度影响,料液浓度越大,析出的D-阿洛酮糖晶体质量越大。因为在一定温度下,料液浓度越高,溶液的过饱和度越高,导致可析出的D-阿洛酮糖越多。但考虑到实际生产中,若要进一步升高D-阿洛酮糖溶液的料液浓度,能耗会急骤升高,旋蒸浓缩耗费时间也会显著增加。另外,当浓度过高时,转移浓缩的料液更为困难,物料损耗会很大,不利于工业生产,因此最佳的料液质量浓度应在1.4~1.5 g/mL。
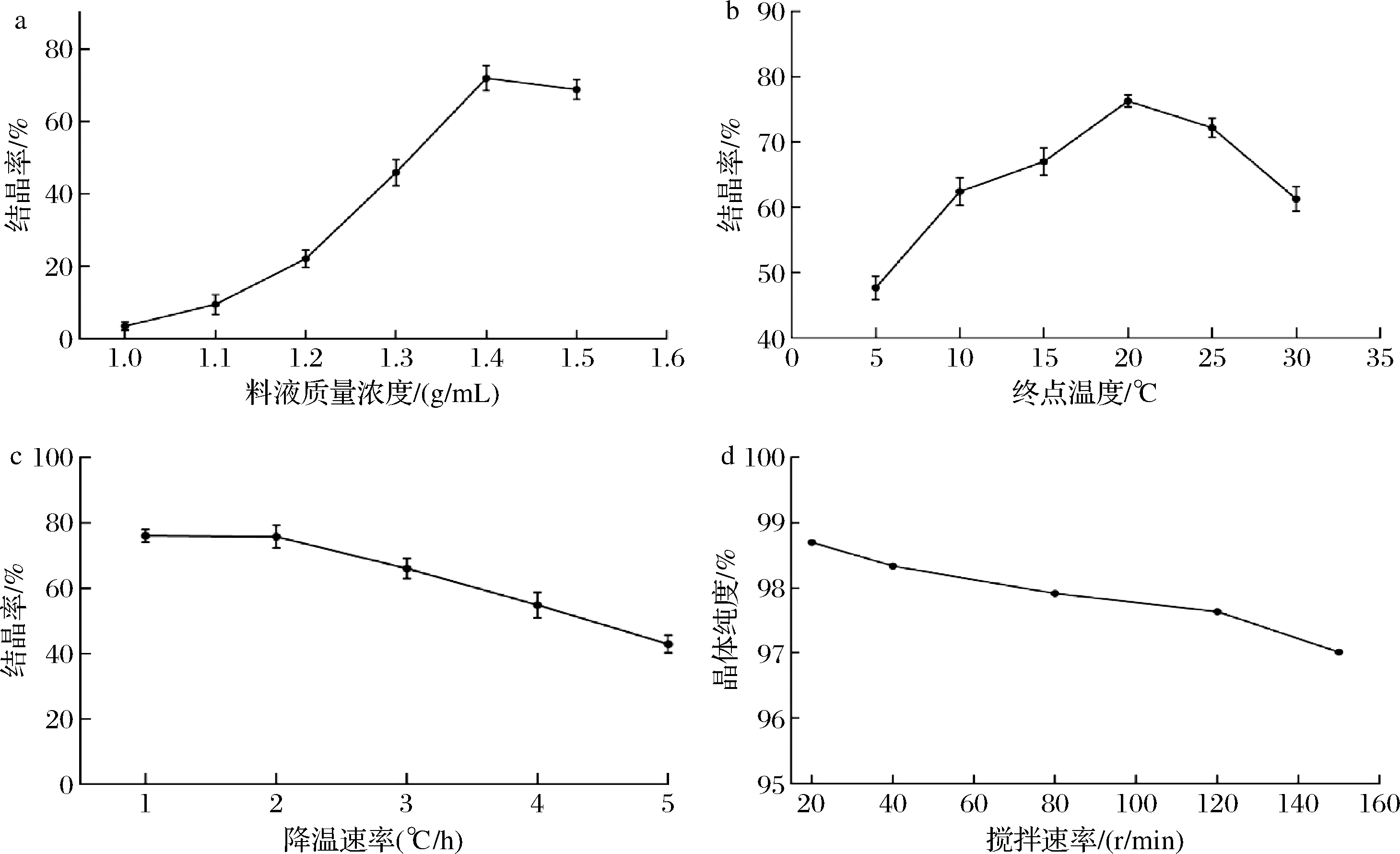
a-不同料液质量浓度下结晶回收率;b-不同终点温度下结晶回收率;c-不同降温速率下结晶回收率;d-不同搅拌速率下晶体纯度
图6 不同因素对D-阿洛酮糖冷却结晶的影响
Fig.6 Effect of different factors on the cooling crystallization of D-allulose
结晶的终点温度同样对D-阿洛酮糖的结晶过程影响显著,计算D-阿洛酮糖在不同终点温度的结晶率结果见图6-b,在5~20 ℃区间内,随着终点温度的升高,结晶率也在显著增加,而终点温度低于25 ℃后,结晶率迅速降低,最适宜的结晶终点温度应该选择为20~25 ℃区间内。分析原因可能是体系中加入D-阿洛酮糖的晶种后,随着晶体的长大,料液浓度逐渐下降;此时温度下降又会导致料液的过饱和度增加量,大于晶体生长引起的过饱和度降低量,导致溶液绝对过饱和度不断变大,使体系处于不稳定区,从而引发二次成核。当然终点温度的升高可降低料液的黏度,提升溶质分子的扩散速率,从而提高晶体的生长速率,进而显著降低介稳区宽度,促进成核发生[17]。而终点温度过高时,料液的溶解度进一步增大,反而抑制了晶核的生长,不利于晶体的析出。
图6-c为降温速率对结晶的影响,料液冷却的降温速率越大,最终的结晶产率越低。这是因为冷却速率越大,料液的最终过饱和度也越大,整个结晶周期耗时越短,而晶体生长速度是保持一定的,所以冷却速率越快,D-阿洛酮糖的有效结晶时间越短,结晶出来的物质越少。而另一方面降温速率过低,结晶周期过长,会增加结晶过程的能耗成本。因此综合结晶率和结晶周期的时间成本两方面因素,最佳的降温速率2~2.5 ℃/h。
搅拌转速也是结晶过程中的重要因素之一,利用HPLC测定不同搅拌转速下D-阿洛酮糖结晶晶体纯度,检测结果见图6-d,结晶过程中搅拌速率越高,最终的晶体纯度会越低,当转速为20 r/min时,产品的纯度最高,达到98.70%。搅拌速率越高,导致结晶的推动力过大,易在体系中形成大量微晶,难以附着在晶核上,在溶液中直接以微晶形式存在,致使在离心过程中晶体微小无法从黏液中分离,也容易吸附杂质离子,导致产品的纯度降低。
使用优化后的冷却结晶工艺进行D-阿洛酮糖的结晶,其结晶率达到77.43%,得到D-阿洛酮糖结晶产品。由生物法转化得到的D-阿洛酮糖和D-果糖混合料液经脱盐脱色、色谱分离纯化及浓缩后,再通过优化的冷却结晶工艺得到的D-阿洛酮糖结晶产品没有发生黏结现象、晶体粒度较为均一,且在全过程中均未发生美拉德反应,未产生结晶产品的褐变,产品品质较佳。
3 结论与展望
本研究成功构建了pET28a-DAE01、pET28a-DAE02、pET28a-DAE03重组质粒,并在E.coli BL21(DE3)中实现异源表达,进一步对不同全细胞反应条件进行探究,对比发现来源于Dorea sp.CAG317的DAE02的相对催化活性更高,最高转化率达到32.60%。与此同时对D-阿洛酮糖的下游生产工艺进行探索开发,总结出D-阿洛酮糖最佳结晶工艺条件为:D-阿洛酮糖料液质量浓度为1.4~1.5 g/mL,结晶终点温度区间为20~25 ℃,降温速率和搅拌速率分别为2~2.5 ℃/h和20 r/min。在此最佳条件下进行冷却结晶,结晶率最高为77.43%。此工艺简单易行,且不需要添加有机溶剂,可行性高。在之后的研究中仍需对D-阿洛酮糖的结晶动力学进行深入研究,获得更为确切的晶体参数和结晶动力学方程,探究更稳定的工业化D-阿洛酮糖结晶工艺理论依据,降低生产成本。
[1] HOSSAIN A, YAMAGUCHI F, MATSUO T, et al.Rare sugar D-allulose:Potential role and therapeutic monitoring in maintaining obesity and type 2 diabetes mellitus[J].Pharmacology &Therapeutics, 2015, 155:49-59.
[2] HAN Y, KWON E Y, YU M K, et al.A preliminary study for evaluating the dose-dependent effect of D-allulose for fat mass reduction in adult humans:A randomized, double-blind, placebo-controlled trial[J].Nutrients, 2018, 10(2):160.
[3] LEE D, HAN Y, KWON E Y, et al. D-allulose ameliorates metabolic dysfunction in C57BL/KsJ-db/db mice[J].Molecules, 2020,25(16):3656.
[4] HAYAKAWA M, HIRA T, NAKAMURA M, et al.Secretion of GLP-1 but not GIP is potently stimulated by luminal D[J].Biochemical and Biophysical Research Communications, 2018, 496(3):898-903.
[5] NAGATA Y, MIZUTA N, KANASAKI A, et al.Rare sugars, D-allulose, D-tagatose and D-sorbose, differently modulate lipid metabolism in rats[J].Journal of the Science of Food and Agriculture, 2018, 98(5):2020-2026.
[6] ATES E G, OZVURAL E B, OZTOP M H.Understanding the role of D-allulose and soy protein addition in pectin gels[J].Journal of Applied Polymer Science, 2021, 138(8):49885.
[7] OGAWA M, INOUE M, HAYAKAWA S, et al.Effects of rare sugar D-allulose on heat-induced gelation of surimi prepared from marine fish[J].Journal of the Science of Food and Agriculture, 2017, 97, 5014-5020.
[8] XIA Y, CHENG Q Q, MU W M, et al.Research advances of D-allulose:An overview of physiological functions, enzymatic biotransformation technologies, and production processes[J].Foods, 2021, 10(9):2186.
[9] 刘玉杰. 模拟移动床色谱分离D-阿洛酮糖、阿洛醇和D-塔罗糖醇[D].济南:山东大学, 2020.
LIU Y J.Separation of D-psicose, allitol and D-talitol using simulated moving bed chromatography[D].Jinan:Shandong University, 2020.
[10] 王琪, 彭超, 周卫强, 等.新型甜味剂阿洛酮糖绿色生物制造工艺研究进展[J].生物化工, 2022, 8(3):170-176.
WANG Q, PENG C, ZHOU W Q, et al.Research progress on green bio-manufacturing technology of new sweetener D-psicose[J].Biological Chemical Engineering, 2022, 8(3):170-176.
[11] 郭元亨, 吕哲, 丁子元, 等.乙醇体系中D-阿洛酮糖的结晶工艺优化[J].食品工业科技, 2019, 40(24):185-189;198.
GUO Y H, LYU Z, DING Z Y, et al.Crystallization process optimization of D-psicose in ethanol system[J].Science and Technology of Food Industry, 2019, 40(24):185-189;198.
[12] 邢庆超, 沐万孟, 江波, 等.D-阿洛酮糖的分离纯化[J].食品工业科技, 2011, 32(9):236-238;242.
XING Q C, MU W M, JIANG B, et al.Separation and purification of D-psicose[J].Science and Technology of Food Industry, 2011, 32(9):236-238;242.
[13] 张龙涛, 沐万孟, 江波, 等.生物转化生成D-阿洛酮糖的类球红细菌的筛选[J].食品与发酵工业, 2008, 34(9):40-43.
ZHANG L T, MU W M, JIANG B, et al.Screening of Rhodobacter sphaeroides for bioproduction of D-psicose[J].Food and Fermentation Industries, 2008, 34(9):40-43.
[14] PARK C S, KIM T, HONG S H, et al. D-Allulose production from D-fructose by permeabilized recombinant cells of Corynebacterium glutamicum cells expressing D-allulose 3-epimerase Flavonifractor plautii[J].PLoS One, 2016, 11(7):e0160044.
[15] ZHANG W L, LI H, ZHANG T, et al.Characterization of a D-psicose 3-epimerase from Dorea sp.CAG317 with an acidic pH optimum and a high specific activity[J].Journal of Molecular Catalysis B:Enzymatic, 2015, 120:68-74.
[16] 刘宗利, 李克文, 高蕾蕾, 等.一种D-阿洛酮糖晶体的制备方法:中国, CN112226474A[P].2021-01-15.
LIU Z L, LI K W, GAO L L, et al.Method for preparing D-allulose crystals:China, CN112226474A[P].2021-01-15.
[17] DINCER T D, OGDEN M I, PARKINSON G M.In situ investigation of growth rates and growth rate dispersion of α-lactose monohydrate crystals[J].Journal of Crystal Growth, 2009, 311(5):1352-1358.