蓝靛果(Lonicicera caerulea L.)是忍冬科,忍冬属蓝果忍冬的变种,又名山茄子、黑瞎子果等,其果实是一种蓝黑色或紫色浆果,多为长圆形,味道微酸,略带苦涩[1],主产于中国吉、黑、蒙等地,分布广泛[2],具有良好的经济价值、营养价值和药用价值。蓝靛果中富含花色苷、黄酮类物质、多酚等营养成分[3-5],其果实中花色苷含量较高。大量研究表明:花色苷具有抗氧化、抗癌、抗肝损伤、抗突变、预防糖尿病等作用[6-10]。随着蓝靛果大面积的种植、产量增加和加工技术不断提高,市场上把蓝靛果的鲜果加工成干果、冻干粉等形态,因此,比较不同形态的蓝靛果中花色苷的提取量,对蓝靛果的储运具有重要的参考价值。
常见的花色苷提取方法有传统的溶剂提取、超临界流体萃取、酶提取及超声辅助提取法等。超声辅助提取法是采用超声波辅助溶剂进行提取,超声波产生高速、强烈的空化效应和搅拌作用,破坏物料细胞,使溶剂渗透到物料细胞中,缩短提取时间,提高提取率。相较于溶剂提取法,超声辅助提取时间短、提取效率高[11-12];相较于超临界流体萃取,超声辅助提取法运行成本较低;相较于酶提取法,超声波的空化效应保持花色苷的结构和活性成分不变、更好地保护花色苷的结构。
目前,影响超声辅助提取法的因素有:乙醇体积分数、超声时间、超声温度、超声功率和料液比等。花色苷会被强大的冲击波破坏细胞结构使其破裂,可以缩短提取时间和减少废弃物的产生,超声波时间过长使得花色苷剪切分子结构出现变化致使提取量下降[13];花色苷会随着超声温度的升高而增大其溶解度,过高的温度也会降低花色苷的稳定性,导致花色苷的降解,提取量反而下降[14]。花色苷通常在弱碱性或中性条件下不易提取且不稳定,所以提取时通常采用酸化的乙醇溶液,酸化的乙醇溶液可以在提取时破坏植物细胞膜的同时溶解其中的花色苷。近年来,有关乙醇体积分数变化影响鲜果中花色苷提取量的研究较多,如:周新宇等[15]在刺玫果花色苷最优提取条件下可以得出乙醇体积分数为60%;李凤凤等[16]研究发现乙醇体积分数为85%时,对蓝靛果花色苷提取量最佳。但有关乙醇体积分数变化、超声时间和超声温度对蓝靛果干果和冻干粉中花色苷提取量影响的研究较少,需加强研究。
本研究以花色苷提取量为评价标准,采用超声辅助的方法,优化乙醇体积分数、超声时间、超声温度3个因素,确定不同形态的蓝靛果(鲜果、干果和冻干粉)中花色苷的最佳提取方法;利用体外抗氧化活性方法评价不同形态的蓝靛果中花色苷的清除自由基能力,确保花色苷的功效。同时对蓝靛果的储运提供了一定的参考价值,有利于推动蓝靛果产品的深度开发和利用。
1 材料与方法
1.1 材料、试剂与设备
蓝靛果鲜果,伊春市鑫野实业有限公司;蓝靛果干果、冻干粉,黑龙江大兴安岭塔河县绿野山产品开发有限公司。蓝靛果鲜果、干果和冻干粉含水量分别为75%、14.50%和9.50%。
无水乙醇、浓HCl、K2S2O8、抗坏血酸(均为国产分析纯)、DPPH、ABTS(均为阿拉丁试剂),北京博奥拓达科技有限公司。
KQ-250E型超声波清洗器,昆山市超声仪器有限公司;UV-2600型紫外可见分光光度计,岛津仪器有限公司;FA1004B型电子天平,上海佑科仪器仪表有限公司;AQ-180E型粉碎机,慈溪耐欧贸易有限公司。
1.2 实验方法
1.2.1 蓝靛果前处理
蓝靛果鲜果和干果清洗后,晾干,分别密封在容量瓶里,冻干粉直接存入容量瓶密封,放入4 ℃冰箱保存备用。
1.2.2 蓝靛果花色苷提取工艺
蓝靛果前处理→粉碎至粗粉→按考察的实验条件进行超声提取→重复浸提3次,抽滤后合并提取液→蓝靛果花色苷粗提液→消光系数法计算提取量
1.2.3 蓝靛果花色苷提取量测定
取制备的蓝靛果花色苷提取液2 mL,定容到50 mL容量瓶中后振荡并摇匀,用超纯水做空白对照,在535 nm处测定吸光值。根据孙兴丽等[17]消光系数法测定花色苷提取量。花色苷提取量的计算如公式(1)所示:
总花色苷提取量![]()
(1)
式中:OD,稀释后溶液的吸光值;DV,稀释倍数;TEV,提取液总体积,mL;CrW,样品质量,g;98.2,1%的花色苷1 mol消光系数。
1.2.4 单因素试验设计
准确称取5 g蓝靛果鲜果、干果和冻干粉各5份,以蓝靛果花色苷的提取量为衡量指标,分别考察乙醇体积分数、超声时间、超声温度3个因素对花色苷提取量的影响,功率为100 W,乙醇体积分数40%、65%、80%、95%、100%[18],超声时间0、10、20、30、40 min[19],超声温度20、25、30、35、40 ℃[20]条件下超声提取,每个处理做3个平行。
1.2.5 DPPH自由基清除活性的测定
选取蓝靛果干果提取液2 mL,稀释成不同质量浓度(0.002、0.004、0.006、0.008、0.010 mg/mL)定容至20 mL,实验备用。参照WANG等[21]的方法并稍作修改。用分析天平称取2.0 mg的DPPH,用无水乙醇溶解并定容到50 mL的容量瓶中,配制成0.1 mmol/L的DPPH自由基溶液,吸取2 mL系列浓度蓝靛果干果提取液置于比色管中,加入2 mL DPPH乙醇溶液充分混匀,避光反应30 min后在517 nm处测定吸光度值A0,用2 mL的乙醇溶液分别代替系列浓度蓝靛果干果提取液和DPPH乙醇溶液,重复上述操作,分别测定吸光度值A1和A2,用抗坏血酸作为阳性对照,平行测定3次,DPPH自由基清除率的计算如公式(2)所示:
DPPH自由基清除率![]()
(2)
式中:A0,样品组吸光度值;A1,空白组吸光度值;A2,对照组吸光度值。
1.2.6 ABTS阳离子自由基清除活性的测定
参照RAUDON 等[22]的方法准确称取96.00 mg ABTS粉末和16.575 mg K2S2O8,分别置于25 mL容量瓶中,加入超纯水定容至刻度后摇匀。取5 mL K2S2O8溶液与5 mL ABTS溶液混合,在室温避光条件下静置过夜,使其产生ABTS阳离子。吸取0.1 mL系列浓度蓝靛果干果提取液置于比色管中,加入3.9 mL ABTS阳离子工作液充分混匀,在室温避光反应10 min后在734 nm处测定吸光度值记作A1;吸取3.9 mL ABTS阳离子乙醇溶液与0.1 mL乙醇溶液,10 min后在734 nm处测定吸光度值记作A0;吸取0.1 mL乙醇溶液与3.9 mL系列浓度蓝靛果干果提取液,10 min后在734 nm处测定吸光度值记作A2。用抗坏血酸作为阳性对照,平行测定3 次,ABTS阳离子自由基清除率的计算如公式(3)所示:
等[22]的方法准确称取96.00 mg ABTS粉末和16.575 mg K2S2O8,分别置于25 mL容量瓶中,加入超纯水定容至刻度后摇匀。取5 mL K2S2O8溶液与5 mL ABTS溶液混合,在室温避光条件下静置过夜,使其产生ABTS阳离子。吸取0.1 mL系列浓度蓝靛果干果提取液置于比色管中,加入3.9 mL ABTS阳离子工作液充分混匀,在室温避光反应10 min后在734 nm处测定吸光度值记作A1;吸取3.9 mL ABTS阳离子乙醇溶液与0.1 mL乙醇溶液,10 min后在734 nm处测定吸光度值记作A0;吸取0.1 mL乙醇溶液与3.9 mL系列浓度蓝靛果干果提取液,10 min后在734 nm处测定吸光度值记作A2。用抗坏血酸作为阳性对照,平行测定3 次,ABTS阳离子自由基清除率的计算如公式(3)所示:
ABTS阳离子自由基清除率![]()
(3)
式中:A0,空白组吸光度值;A1,样品组吸光度值;A2,对照组吸光度值。
1.2.7 数据处理
采用SPSS 19.0统计软件进行单因素试验中Duncan’s多重差异显著性分析并计算样品对各自由基清除能力为50%时的半抑制浓度(half maximal inhibitory concentration, IC50)。实验数据图采用GraphPad Prism进行绘制。
2 结果与分析
2.1 单因素试验结果
2.1.1 乙醇体积分数对蓝靛果花色苷提取量的影响
如图1所示,乙醇体积分数对花色苷提取量的影响具有显著性差异(P<0.05)。在蓝靛果冻干粉和干果中,随着乙醇体积分数的增加,花色苷的提取量也逐渐增加,在乙醇体积分数为95%时,花色苷的提取量达到最大。蓝靛果鲜果中,乙醇的体积分数为65%时,花色苷的提取量达到峰值,与陈智玲等[23]采用超高压提取蓝莓渣花色苷的研究结果相似。而后随着乙醇体积分数增加,花色苷的提取量下降,可能是由于鲜果失去水分,含糖量升高使其不易溶解;另一方面65%的乙醇与蓝靛果鲜果中的花色苷极性相似,在这种相似相溶的情况下,花色苷提取量最大,当乙醇体积分数过高时,溶液极性降低,花色苷无法被萃取出来,导致花色苷的提取量变少。因此,蓝靛果冻干粉和干果提取花色苷的最佳乙醇体积分数为95%,鲜果提取花色苷的最佳乙醇体积分数为65%。
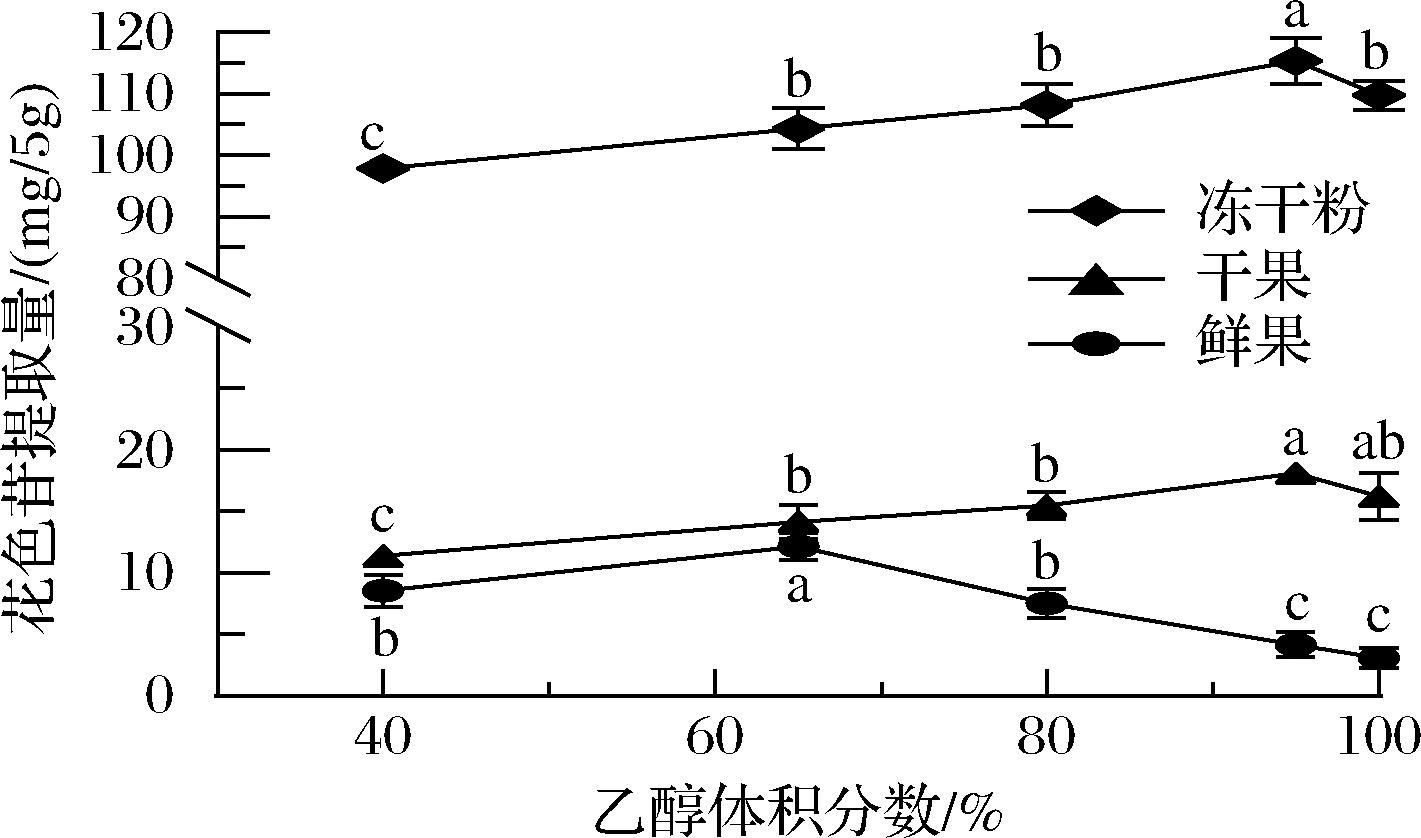
图1 乙醇体积分数对花色苷提取量的影响
Fig.1 Effect of ethanol concentration on anthocyanins extraction
注:小写字母不同表示处理间差异显著(P<0.05)(下同)。
2.1.2 超声时间对蓝靛果花色苷提取量的影响
如图2所示,超声时间在0~30 min时,干果和鲜果花色苷提取量分别从20.11、8.76 mg/5 g上升至21.70、10.14 mg/5 g,经SPSS 19.0显著性分析,P=0.806(P>0.05)和P=0.203(P>0.05),说明超声时间在0~30 min蓝靛果花色苷提取量无显著性差异,造成这种情况可能是干果和鲜果经充分破碎和高速振荡提取后,花色苷能快速溶出;冻干粉花色苷提取量从84.31 mg/5 g上升至121.1 mg/5 g,说明超声时间对蓝靛果冻干粉花色苷提取量的影响差异显著(P<0.05)。当超声时间为30 min时,花色苷的提取量均达到峰值,但当超声时间延长为40 min时,提取量略有下降,可能是超声时间延长,花色苷的结构被破坏,造成一些不被需要的杂质也被萃取出[24],进而影响花色苷的提取量。因此,花色苷提取的最适时间为30 min。
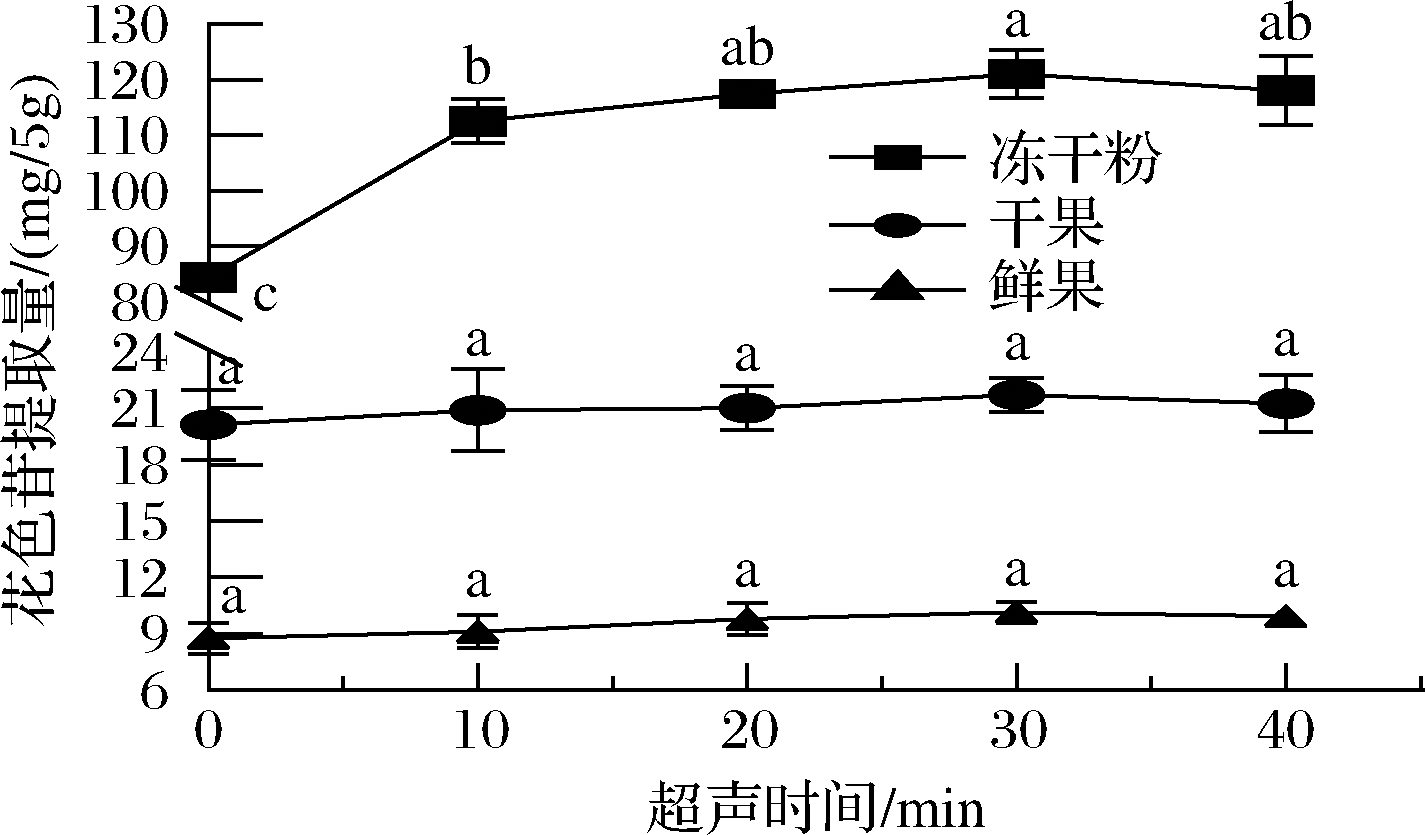
图2 超声时间对花色苷提取量的影响
Fig.2 Effect of ultrasonic time on anthocyanin extraction
2.1.3 超声温度对蓝靛果花色苷提取量的影响
如图3所示,超声温度对蓝靛果鲜果和干果花色苷提取量的影响具有显著性差异(P<0.05),当提取温度处于20~35 ℃ 时,蓝靛果鲜果和干果花色苷提取量随温度升高急剧增加,但蓝靛果冻干粉花色苷提取量随温度升高增加缓慢,冻干粉花色苷提取量从113.27 mg/5 g上升至120.57 mg/5 g,说明超声时间在0~30 min之间无显著性差异(P>0.05)。在35 ℃ 时提取量均达到峰值,这种现象和周丽萍等[25]采用超声波辅助逆流提取蓓蕾蓝靛果花色苷的特点相符合。温度35~40 ℃时,蓝靛果花色苷提取量均略有下降,可能是由于温度过高导致花色苷结构遭到破坏,花色苷的提取量反而下降。因此,花色苷提取的最适温度为35 ℃。
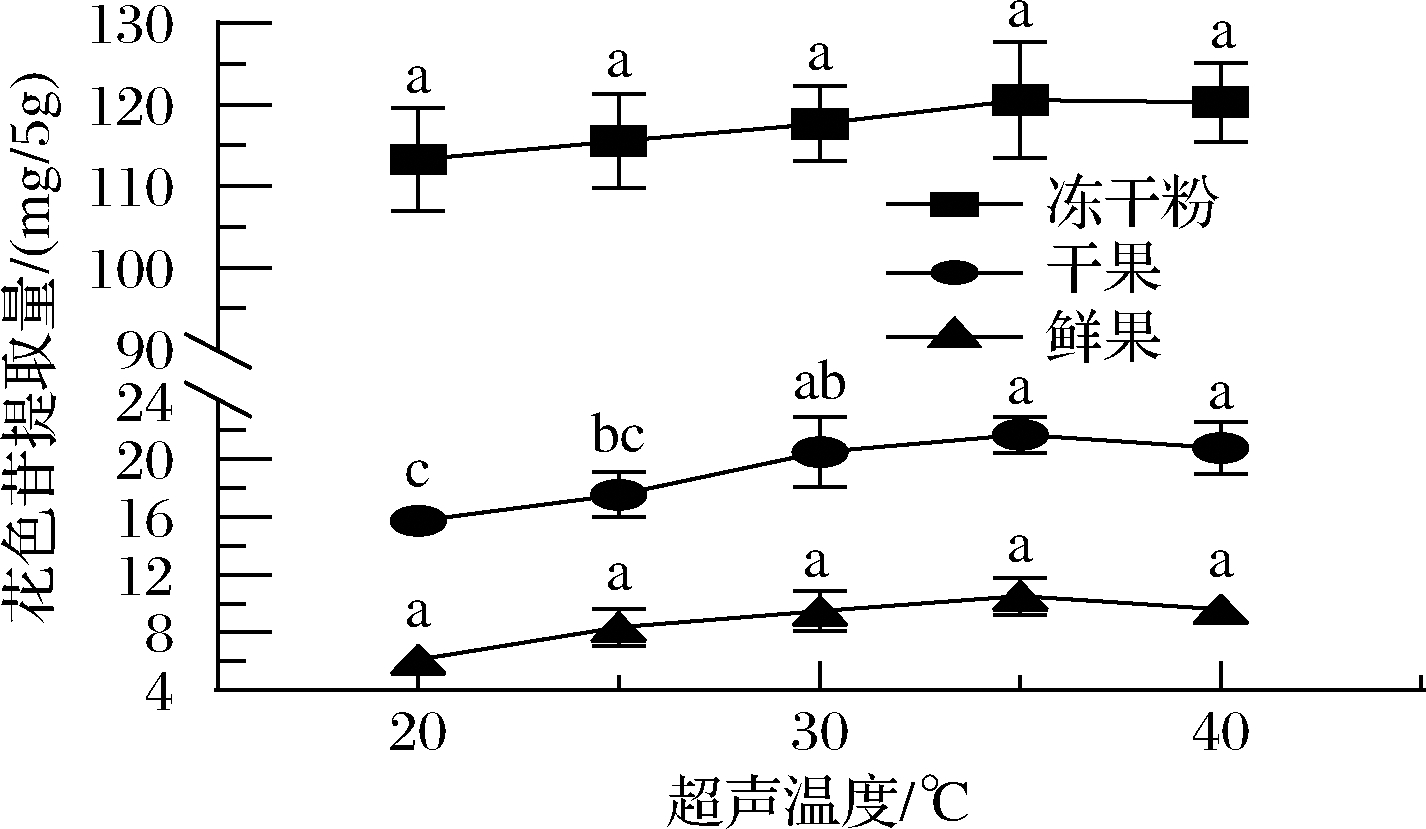
图3 超声温度对花色苷提取量的影响
Fig.3 Effect of ultrasonic temperature on anthocyanin extraction
2.2 三种形态的蓝靛果花色苷的提取量
如图4所示,5 g蓝靛果鲜果、干果和冻干粉中花色苷的提取量为10.40、22.20、121.50 mg,鲜果和干果中花色苷提取量与万山[26]和张聪等[19]的研究结果相似。显著性分析结果表明,鲜果,干果和冻干粉中花色苷提取量之间分别存在显著性差异(P<0.05),因此,3种形态的蓝靛果花色苷提取量之间存在显著性差异(P<0.05)。蓝靛果冻干粉花色苷提取量最高,其次是干果,鲜果花色苷提取量最少。干果的花色苷提取量高于鲜果的花色苷提取量,是因为制作蓝靛果干果时经过干燥、晾晒等步骤,使得其中的水分大量蒸发,重量减轻。但其中的花色苷没有受到破坏,还因为水分散失而浓缩,含量比鲜果高。参考李景等[27]的研究,可知1 kg干果由 6~7 kg鲜果才能制得,那么每5 g干果花色苷是由30~35 g鲜果制成,30~35 g蓝靛果鲜果中花色苷的提取量为133.15~155.34 mg(根据本实验结果推算),接近5 g蓝靛果干果中花色苷的提取量,即是鲜果花色苷提取量的6倍。1 kg蓝靛果冻干粉是由10~20 kg鲜果制得,每5 g蓝靛果冻干粉花色苷是由50~100 g蓝靛果鲜果制成,50~100 g蓝靛果鲜果中花色苷的提取量为221.91~443.82 mg,冻干粉中花色苷的提取量远高于鲜果中花色苷提取量,这可能由于蓝靛果鲜果制成冻干粉过程中的一些挥发性成分损失很小,能很好保留原有鲜果中的营养成分,使其组织结构保存较好,含水量较低,致使相同提取条件下,蓝靛果鲜果中花色苷的提取量远不及蓝靛果冻干粉花色苷。
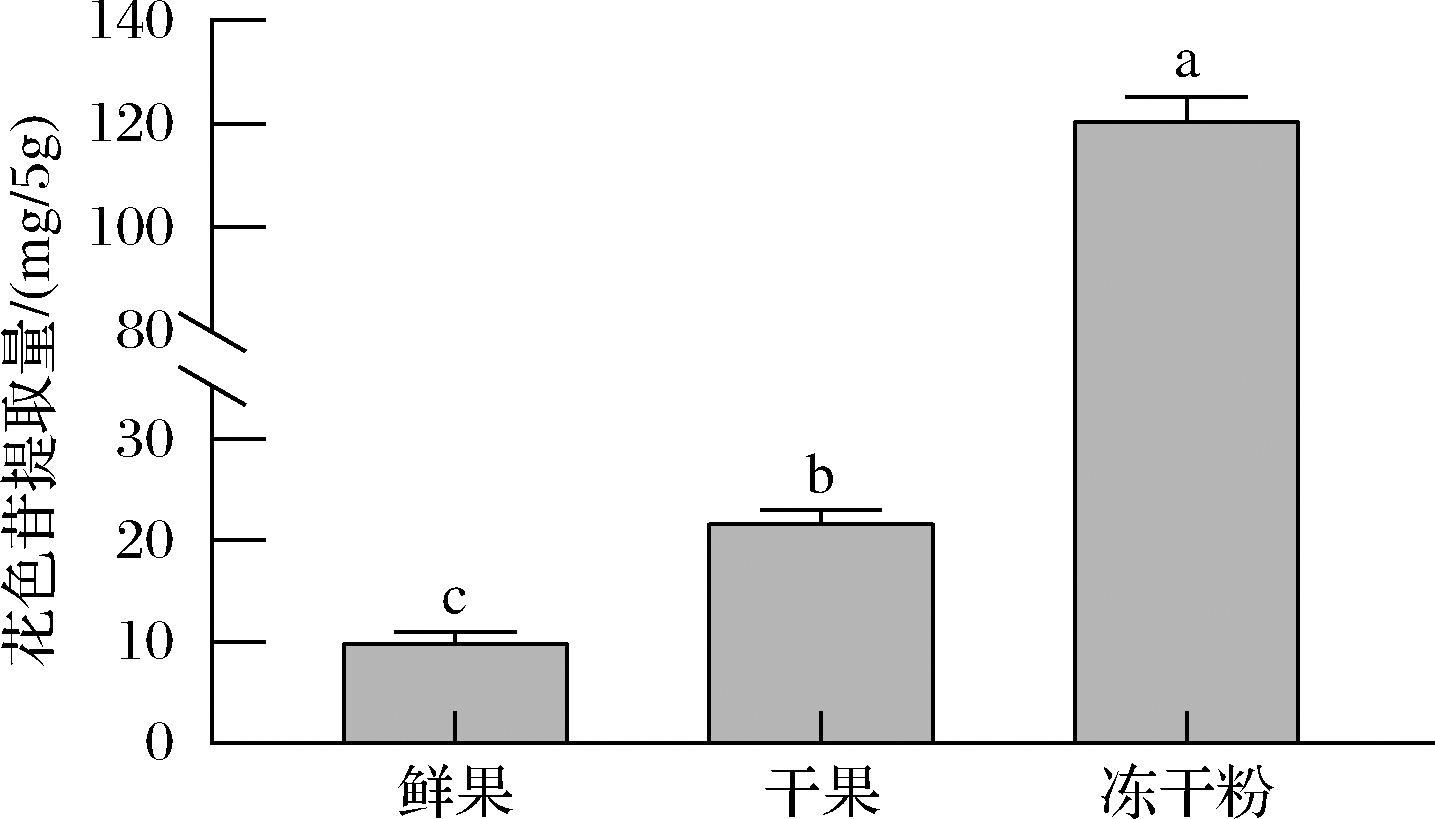
图4 三种蓝靛果中花色苷的提取量
Fig.4 Extraction of anthocyanins from three kinds of L.edulis
2.3 抗氧化活性测定结果
2.3.1 蓝靛果冻干粉花色苷DPPH自由基清除能力
DPPH自由基存在单电子,在517 nm处,其醇溶液呈紫色[28]。因为反应体系中的自由基清除剂能给DPPH自由基提供电子和氢原子,使单电子配对,从而DPPH自由基溶液发生褪色。褪色程度越大说明清除DPPH自由基的能力越强[29]。如图5所示,当质量浓度在0.02~0.1 mg/mL,蓝靛果花色苷对DPPH自由基的清除能力显著性增强(P<0.05)。蓝靛果花色苷和维生素C溶液对照组在质量浓度为0.1 mg/mL时,清除DPPH自由基的能力都达到最大,清除率分别为84.79%和98.54%。经SPSS软件计算得出蓝靛果花色苷提取液和维生素C溶液对照组的IC50值分别为47.490和32.981 μg/mL。因此蓝靛果花色苷提取液和维生素C溶液对照组对DPPH自由基均能较好地清除,且清除率随质量浓度增加而增强。

图5 花色苷和维生素C对DPPH自由基的清除率
Fig.5 DPPH free radical scavenging effect of anthocyanins and vitamin C
2.3.2 蓝靛果冻干粉花色苷ABTS阳离子自由基清除能力
使ABTS溶液和K2S2O8溶液混合,从而氧化成绿色的ABTS阳离子自由基,当抗氧化剂和ABTS阳离子起作用后ABTS阳离子的颜色消失,因此ABTS阳离子法广泛应用于评价抗氧化剂清除自由基的能力,且方法简单快速[30]。如图6所示,蓝靛果花色苷提取液和维生素C溶液对照组均具有一定的清除ABTS自由基能力,蓝靛果花色苷提取液清除ABTS阳离子自由基能力弱于同浓度时维生素C溶液对照组(P<0.05)。当质量浓度在0.02~0.1 mg/mL,蓝靛果花色苷提取液和维生素C溶液对照组对ABTS阳离子的清除率均随质量浓度增加而增加,通过SPSS软件计算得出蓝靛果花色苷提取液和维生素C溶液对照组对ABTS阳离子自由基清除能力的IC50值分别为59.600和38.661 μg/mL。

图6 花色苷和维生素C对ABTS阳离子自由基的清除率
Fig.6 ABTS cation free radical scavenging effect of anthocyanins and vitamin C
2.3.3 三种形态的蓝靛果对DPPH和ABTS阳离子自由基清除能力
由表1可知,在最佳提取条件下,稀释了25倍的蓝靛果鲜果、干果和冻干粉提取液中花色苷的提取量并不一样,但3种形态的蓝靛果对于DPPH自由基和ABTS阳离子自由基的清除能力没有因为果实形态的变化而受到破坏,并且3种形态的蓝靛果都对DPPH自由基和ABTS阳离子自由基有着极强的清除能力,这说明蓝靛果中其他的成分也具有抗氧化性,还需进一步的研究。
表1 三种形态的蓝靛果对DPPH自由基、ABTS阳离子自由基清除率
Table 1 The scavenging efficiency of three kinds of Lonicera edulis to DPPH free radical and Abts free radical
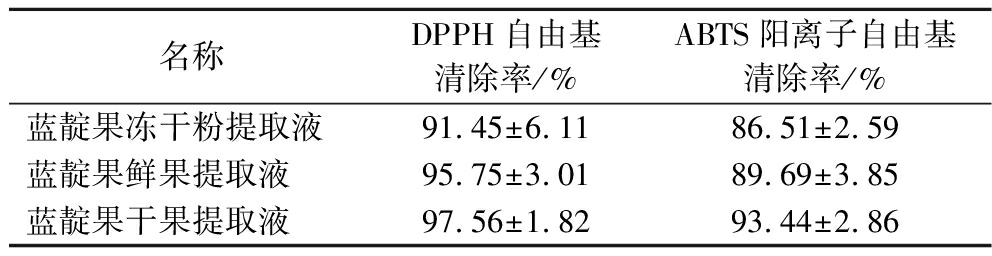
名称DPPH自由基清除率/%ABTS阳离子自由基清除率/%蓝靛果冻干粉提取液91.45±6.1186.51±2.59蓝靛果鲜果提取液95.75±3.0189.69±3.85蓝靛果干果提取液97.56±1.8293.44±2.86
3 结论
本文采用超声波辅助提取3种形态的蓝靛果(鲜果、干果和冻干粉)中的花色苷,通过单因素优化实验,确定最佳提取条件为:提取冻干粉和干果的最佳乙醇体积分数为95%;提取鲜果的最佳乙醇分数为65%;3种形态的蓝靛果的最佳超声时间均为30 min、最佳超声温度均为35 ℃,且花色苷提取量变化为:冻干粉[(121.50±4.73) mg/5 g]>干果[(22.20±2.08) mg/5 g]>鲜果[(10.40±1.05) mg/5 g]。通过蓝靛果花色苷的体外清除自由基实验,表明与蓝靛果鲜果和干果相比,冻干粉的抗氧化能力没有削弱,其清除DPPH自由基和ABTS阳离子自由基的IC50分别为47.490和59.600 μg/mL。综上,相比较,冻干粉形态的蓝靛果更具有储存和运输优势,为蓝靛果产品的深加工提供一定的参考价值。
[1] 张星. 蓝莓与蓝靛果复合冻干粉加工贮藏稳定性及产品开发[D].北京:中国农业科学院, 2021.
ZHANG X.Stability of mixed blueberry(Vaccinium corymbosum L.)and blue honeysuckle berry(Lonicera caerulea L.)during freeze drying and storage and product development[D].Beijing:Chinese Academy of Agricultural Sciences, 2021.
[2] 苏雅, 裴毅, 王柏茗, 等.蓝靛果忍冬研究现状综述[J].天津农林科技, 2020(4):41-43.
SU Y, PEI Y, WANG B M, et al.Research status of Lonicera caerulea L[J].Science and Technology of Tianjin Agriculture and Forestry, 2020(4):41-43.
[3] ZORZI M, GAI F, MEDANA C, et al.Bioactive compounds and antioxidant capacity of small berries[J].Foods, 2020, 9(5):623.
[4] GO BA M, SOK
BA M, SOK
 -
- TOWSKA A, KUCHARSKA A Z.Health properties and composition of honeysuckle berry Lonicera caerulea L.an update on recent studies[J].Molecules, 2020, 25(3):749.
TOWSKA A, KUCHARSKA A Z.Health properties and composition of honeysuckle berry Lonicera caerulea L.an update on recent studies[J].Molecules, 2020, 25(3):749.
[5] LIANG Z X, LIANG H R, GUO Y Z, et al.Cyanidin 3-O-galactoside:A natural compound with multiple health benefits[J].International Journal of Molecular Sciences, 2021, 22(5):2261.
[6] LEE Y S, CHO I J, KIM J W, et al.Hepatoprotective effects of blue honeysuckle on CCl4-induced acute liver damaged mice[J].Food Science &Nutrition, 2018, 7(1):322-338.
[7] 李圣桡, 李若萌, 陈博朴, 等.蓝靛果的营养价值与加工技术研究进展[J].农产品加工, 2020(2):68-73.
LI S R, LI R M, CHEN B P, et al.Research progress on nutritional value and processing technology of blue rime fruit[J].Farm Products Processing, 2020(2):68-73.
[8] 杨万基, 霍俊伟, 高欢, 等.蓝靛果保健功能及食品开发的研究进展[J].中国果树, 2019(6):22-26.
YANG W J, HUO J W, GAO H, et al.Research progress on nutrition health function and food development of blue honeysuckle[J].China Fruits, 2019(6):22-26.
[9] 唐敬思, 王红梅, 佟锰, 等.蓝靛果忍冬花色苷的研究进展[J].食品研究与开发, 2020, 41(16):220-224.
TANG J S, WANG H M, TONG M, et al.Research progress on anthocyanins of Lonicera caerulea L[J].Food Research and Development, 2020, 41(16):220-224.
[10]  ESONIEN
ESONIEN L, LABOKAS J, JASUTIEN
L, LABOKAS J, JASUTIEN I, et al.Bioactive compounds, antioxidant, and antibacterial properties of Lonicera caerulea berries:Evaluation of 11 cultivars[J].Plants, 2021, 10(4):624.
I, et al.Bioactive compounds, antioxidant, and antibacterial properties of Lonicera caerulea berries:Evaluation of 11 cultivars[J].Plants, 2021, 10(4):624.
[11] HE B, ZHANG L L, YUE X Y, et al.Optimization of Ultrasound-Assisted Extraction of phenolic compounds and anthocyanins from blueberry (Vaccinium ashei) wine pomace[J].Food Chemistry, 2016, 204:70-76.
[12] HU W W, GONG H, LI L Q, et al.Ultrasound treatment on stability of total and individual anthocyanin extraction from blueberry pomace:Optimization and comparison[J].Molecules, 2019, 24(14):2621.
[13] 姜秀娟, 刘海霞, 徐爱, 等.花色苷提取的最新研究进展[J].农业技术与装备, 2021(11):54-55.
JIANG X J, LIU H X, XU A, et al.Recent advances in extraction of anthocyanins[J].Agricultural Technology &Equipment, 2021(11):54-55.
[14] 倪开岭, 李红, 冯一彤, 等.山桃稠李果实花色苷的提取及抗氧化研究[J].中国林副特产, 2020(2):5-7.
NI K L, LI H, FENG Y T, et al.Study on extraction process and antioxidation of anthocyanin from Prunus maackii[J].Forest by-Product and Speciality in China, 2020(2):5-7.
[15] 周新宇, 吕重宁, 秦汝兰.刺玫果中花色苷提取工艺优化及抗氧化性分析[J].食品工业科技, 2022, 43(4):178-186.ZHOU X Y, LYU C N, QIN R L.Optimization of extraction technique and antioxidant activity of anthocyanins from Rosa davurica pall[J].Science and Technology of Food Industry, 2022, 43(4):178-186.
[16] 李凤凤, 张秀玲, 柳晓晨, 等.响应面优化微波辅助提取蓝靛果花色苷工艺及其抗氧化活性[J].食品工业科技, 2019, 40(2):195-200;214.
LI F F, ZHANG X L, LIU X C, et al.Optimization of microwave-assisted extraction of anthocyanins from Lonicera edulis and its antioxidant activity by response surface methodology[J].Science and Technology of Food Industry, 2019, 40(2):195-200;214.
[17] 孙兴丽, 黄国清, 柳阳, 等.紫甘薯花色苷的提取及稳定性研究[J].食品工业, 2012, 33(8):17-20.
SUN X L, HUANG G Q, LIU Y, et al.Extraction and stability of anthocyanins from purple sweet potatoes[J].The Food Industry, 2012, 33(8):17-20.
[18] 王鑫, 韩茜宇, 薛宏坤.山葡萄皮花色苷提取工艺优化及其组分分析[J].食品工业, 2020, 41(6):55-59.
WANG X, HAN X Y, XUE H K.Optimization of ultrasound-assisted extraction of anthocyanins from Vitis amurensis rupr skins of “Shuangfeng” and analysis of its components[J].The Food Industry, 2020, 41(6):55-59.
[19] 张聪, 张彦龙, 白龙林, 等.响应面优化超声波辅助提取蓝靛果花色苷及抗炎活性研究[J].生物技术, 2020, 30(5):473-480;443.
ZHANG C, ZHANG Y L, BAI L L, et al.Optimization of ultrasonic-assisted extraction of anthocyanins from Lonicera edulis by response surface methodology and anti-inflammatory activity studies[J].Biotechnology, 2020, 30(5):473-480;443.
[20] 米佳, 禄璐, 罗青, 等.超声波辅助酶法提取黑果枸杞花色苷的工艺优化及其稳定性研究[J].食品科技, 2020, 45(8):187-191.
MI J, LU L, LUO Q, et al.Extraction and stability of anthocyanin of Lycium ruthenicum Murr[J].Food Science and Technology, 2020, 45(8):187-191.
[21] WANG Y F, JIA J X, REN X J, et al.Extraction, preliminary characterization and in vitro antioxidant activity of polysaccharides from Oudemansiella radicata mushroom[J].International Journal of Biological Macromolecules, 2018, 120:1760-1769.
[22] RAUDON L, LIAUDANSKAS M, VILKICKYT
L, LIAUDANSKAS M, VILKICKYT G, et al.Phenolic profiles, antioxidant activity and phenotypic characterization of Lonicera caerulea L.berries, cultivated in Lithuania[J].Antioxidants, 2021, 10(1):115.
G, et al.Phenolic profiles, antioxidant activity and phenotypic characterization of Lonicera caerulea L.berries, cultivated in Lithuania[J].Antioxidants, 2021, 10(1):115.
[23] 陈智玲, 马剑, 文博, 等.超高压提取蓝莓渣花色苷的工艺优化及其抗氧化活性[J].食品工业科技, 2022, 43(21):185-194.
CHEN Z L, MA J, WEN B, et al.Optimization of ultra-high pressure extraction and the antioxidant activity of anthocyanins from blueberry pomace[J].Science and Technology of Food Industry, 2022, 43(21):185-194.
[24] 李旭, 高博, 赵丽华, 等.响应面法优化超声波提取蓝靛果花色苷及其抗炎活性的研究[J].食品科技, 2021, 46(3):176-183.
LI X, GAO B, ZHAO L H, et al.Optimization of the ultrasonic-assisted extraction of anthocyanins form Lonicera edulis by response surface methodology and its anti-inflammatory activities[J].Food Science and Technology, 2021, 46(3):176-183.
[25] 周丽萍, 王化, 何丹娆, 等.超声波辅助逆流提取蓓蕾蓝靛果花色苷工艺[J].北京林业大学学报, 2017, 39(9):119-125.
ZHOU L P, WANG H, HE D R, et al.Extraction technology of anthocyanin from Lonicera caerulea’Beilei’ fruit by ultrasonic-assisted countercurrent extraction[J].Journal of Beijing Forestry University, 2017, 39(9):119-125.
[26] 万山. 红树莓花色苷超声波辅助提取及体外生物活性研究[D].北京:北京林业大学, 2016.
WAN S.Ultrasound-assisted extraction and in vitro biological activity of anthocyanins from red raspberry[D].Beijing:Beijing Forestry University, 2016.
[27] 李景, 汪滨, 于立梅, 等.国内外蓝莓果干相关标准比对研究及建议[J].标准科学, 2021(1):29-33.
LI J, WANG B, YU L M, et al.Comparison study on foreign and domestic dried blueberry-related standards, technical regulations &specifications and related suggestions[J].Standard Science, 2021(1):29-33.
[28] 张宽朝, 汪炜姿, 余平, 等.黑豆种皮花色苷酶法辅助提取工艺优化及其抗氧化活性分析[J].天然产物研究与开发, 2022, 34(1):83-92.
ZHANG K C, WANG W Z, YU P, et al.Optimization of enzyme assisted extraction and antioxidant activity of anthocyanins from black bean seed coat[J].Natural Product Research and Development, 2022, 34(1):83-92.
[29] 熊双丽, 卢飞, 史敏娟, 等.DPPH自由基清除活性评价方法在抗氧化剂筛选中的研究进展[J].食品工业科技, 2012, 33(8):380-383.
XIONG S L, LU F, SHI M J, et al.Advanement of evaluation methods about DPPH radical scavenging activity in Screening Antioxidant[J].Science and Technology of Food Industry, 2012, 33(8):380-383.
[30] PROTTI M, GUALANDI I, MANDRIOLI R, et al.Analytical profiling of selected antioxidants and total antioxidant capacity of goji (Lycium spp.) berries[J].Journal of Pharmaceutical and Biomedical Analysis, 2017, 143:252-260.