山东临沂盛产蜜桃,黄金蜜桃具有果形端正、鲜黄亮丽、味美多汁、营养丰富、口感宜人等优点而深受消费者喜爱[1]。同时,该品种成熟期较晚,填补了晚熟黄肉鲜食桃的空档[2]。近年来,黄金蜜桃的品种增加,其种植面积和产量也大幅上升[3]。黄金蜜桃主要以鲜食为主,于每年4月初开花,果实在8月下旬至9月中旬成熟,果期较短。目前对于桃果采摘期的判定,主要依靠果农的经验,对桃果成熟度并没有一套系统判断标准,很难保证桃品质稳定性。随着桃树栽培面积逐年扩张,果实品质参差不齐、栽培管理措施不一致、采收期差异化、高品质或同质化难实现等问题突出呈现。这些问题的存在不仅会影响桃的口感,也会使消费者对产品失去信任,不利于桃产业的发展。因此,科学准确的判断蜜桃采摘成熟度具有非常重要的意义。
研究表明,采收成熟度对水果的品质、贮藏期、加工利用有很大的影响。采收期过早,会导致蜜桃的营养成分积累不足,口感青涩、风味不足;采收期过晚,蜜桃虽然风味浓、品质较高,但易腐烂,不利于贮藏、运输,缩短产品货架期。适宜的采收期可使消费者体验到品质最佳的果实,已在杨梅[4]、李[5]、红毛丹[6]、枇杷[7]、枣[8]、无花果[9]等多种水果中展开采收期研究,但还未见采收成熟度对黄金蜜桃果实品质的影响方面的研究报道,缺乏对黄金蜜桃最佳采收期的系统研究。因此,本文以黄金蜜桃为研究对象,分5个时期采收果实,综合评价果实的好果率、外观品质、内在品质等指标,并对理化指标进行相关性分析和主成分分析(principal component analysis,PCA),探究黄金蜜桃成熟过程中的品质变化规律,根据用途确定其最佳采收期,为黄金蜜桃的保鲜、贮藏及加工提供参考依据。
1 材料与方法
1.1 材料与试剂
黄金蜜桃采摘自山东省临沂市李官镇,果园位于东经118°40′ 00.98″、北纬35°32 ′01.30″,海拔87.9 m。栽培株行距 2.0 m×4.0 m,选取果园内树形良好、长势相同的5株正常结果株,果园管理方法统一。于2020年8月11日、8月17日、8月23日、8月29日、9月4日5个时期进行采摘。以开花后日期计算,分别为开花后127 d(SA)、133 d(SB)、139 d(SC)、145 d(SD)、151 d(SE)。每个时期从5棵果树的东、南、西、北4个方向,采收成熟度、大小基本一致,无伤、残、次、病虫害的果实。用保鲜袋包装后,及时预冷并贮藏于温度(0±1)℃、相对湿度80%~90%的冰箱中,并在当日带回临沂市农产品精深加工及贮藏保鲜重点实验室进行实验。图1为不同采收成熟度的黄金蜜桃,每个时期取30个果实进行指标测定,重复3次。

图1 不同采收成熟度黄金蜜桃
Fig.1 Golden peach with different harvest maturity
葡萄糖、DNS、牛血清蛋白、考马斯亮蓝G-250、咔唑、半乳糖醛酸,北京索莱宝科技有限公司;总超氧化物歧化酶(total superoxide dismutase,T-SOD)测试盒(羟胺法),南京建成生物工程研究所;乙醇、Na2CO3、NaOH、浓H2SO4、三氯乙酸、H3PO4、BaCl2等均为分析级试剂,国药集团化学试剂有限公司(中国上海)。
1.2 仪器与设备
MNT游标卡尺,上海美耐特实业有限公司;NR10QC色差仪,日本柯尼卡美能达公司;TA.GEL质构仪,上海保圣实业发展有限公司;WYA(2WAJ)阿贝折光仪,上海仪电物理光学仪器有限公司;UV-1800紫外分光光度计,日本岛津有限公司;PHS-3C INESA型pH计,上海仪电科学仪器股份有限公司;KQ5200E超声波清洗器,昆山市超声仪器有限公司;LC-LX-H185C台式高速离心机,上海力辰邦西仪器科技有限公司。
1.3 试验方法
1.3.1 果实落果率、霉变率、好果率
落果率:观察并统计总果数及果树下落果数量,按公式(1)计算。
落果率![]()
(1)
霉变率:观察并统计果树上发霉变质的果实,按公式(2)计算。
霉变率![]()
(2)
好果率:用100%减去落果率和霉变率,按公式(3)计算。
好果率/%=100%-落果率-霉变率
(3)
1.3.2 果实外在品质指标
单果重(weight,W):将样品分别放在电子天平上称量,记录每个果实的质量,并计算果实平均单果质量。
果形指数(fruit shape index,FSI):用游标卡尺分别测量果实赤道部位的横径和果实的高度或纵径,纵径与横径的比值表示果形指数。
果实硬度(hardness,H):用质构仪测定果实的硬度,质构剖面分析测试。对样品赤道区域的不同位置进行了测定。实验开始前进行仪器的力校准。然后在返回距离120 mm,返回力5.0 gf的条件下进行。将样品置于样品台,使用圆柱形探针(TA2探头)将样品下压至8 mm,触发点力为5.0 gf。实验过程保持测试前速度5.00 mm/s,测试速度1.00 mm/s,实验后速度3.00 mm/s。分析都在室温下进行。
色差值:用色差仪对果实赤道区域进行测量,L*(亮度指数)、a*(红色饱和指数)、b*(黄色饱和指数)。褐变指数按公式(4)、公式(5)[10]计算,色度(C)按公式(6)[11]计算,色相(H°)按公式(7)[12]计算。
(4)
褐变指数![]()
(5)
(6)
(7)
感官品质评价:参考高伦江等[13]方法,略有改动。挑选8名经过专门培训的评价员,在同一评价环境下对样品进行评价,取平均值。评价标准见表1。
表1 黄金蜜桃果实感官评分标准
Table 1 Sensory scoring standard of golden peach fruit
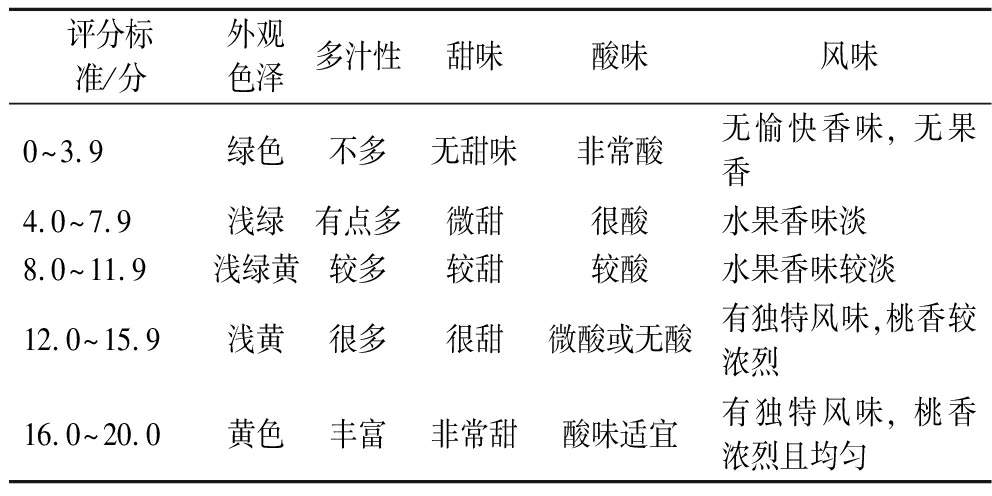
评分标准/分外观色泽多汁性甜味酸味风味0~3.9绿色不多无甜味非常酸无愉快香味, 无果香4.0~7.9浅绿有点多微甜很酸水果香味淡8.0~11.9浅绿黄较多较甜较酸水果香味较淡12.0~15.9浅黄很多很甜微酸或无酸有独特风味,桃香较浓烈16.0~20.0黄色丰富非常甜酸味适宜有独特风味, 桃香浓烈且均匀
1.3.3 果实内在品质指标
水分含量(moisture content,MC)参考LI等[14]的方法测定,按照公式(8)计算;可溶性固形物(total soluble solid,TSS)采用阿贝折射仪测定;可溶性糖含量(soluble sugar content,SSC)采用蒽酮比色法;可滴定酸(titratable acidity,TA)采用酸碱滴定法测定;固酸比(TSS/TA)、糖酸比(SSC/TA)、呼吸强度(respiratory intensity,RI)采用静置法测定;维生素C含量采用分光光度计法测定;可溶性蛋白(soluble protein,S-pro)采用考马斯亮蓝染色法[15];总超氧化物歧化酶(total superoxide dismutase,T-SOD)采用试剂盒测定;总果胶(total pectin,TP)采用咔唑比色法测定,根据SUN等[16]的方法并加修改。
水分含量![]()
(8)
1.4 数据统计分析
实验数据采用Excel软件进行统计分析,采用Prism 9软件对数据进行单因素ANOVA分析(邓肯检验)、相关性分析、PCA并制图。
2 结果与分析
2.1 不同采收成熟度对落果率、霉变率和好果率的影响
由表2可知,随成熟的提高,果实落果率和霉变率从8月23日(SC)开始不断提高。8月23日后,已有一些果实从树上落果,此外,受雨季影响,许多果实开始发生霉变,导致果实落果率和霉变率在SC时期后极显著上升(P<0.01),9月4日(SE)果实的落果率和霉变率分别高达54.65%、31.92%。因此,至9月4日好果率仅为13.42%,果实损失严重。
表2 不同采收期黄金蜜桃对落果率、霉变率和好果率的影响 单位:%
Table 2 Fruit drop rate, mildew rate and good fruit rate of golden peach at different harvest periods

指标采收期SASBSCSDSE落果率0.00±0.00C0.00±0.00C2.19±1.28C19.22±3.12B54.65±4.94A霉变率0.00±0.00C0.00±0.00C1.38±1.14C15.80±2.95B31.92±5.01A好果率100.00±0.00A100.00±0.00A96.83±1.89A64.99±5.72B13.42±4.36C
注:表中小写字母表示显著差异,大写字母表示极显著差异。
2.2 不同采收成熟度对果实外在品质的影响
2.2.1 不同采收成熟度对单果重和果形指数的影响
由表3可知,黄金蜜桃的单果重随着其成熟度极显著增加(P<0.01),但其果形指数在前4个时期并没有显著差异,维持在0.94左右,只有在SE时期显著降低至0.91(P<0.05),表明不同成熟度的果形较为稳定,接近圆形。
表3 不同成熟度对黄金蜜桃外观品质的影响
Table 3 Effect of different maturity on appearance quality of golden peach

指标采收期SASBSCSDSE单果重/g225.86±14.41E247.48±15.50D290.37±10.46C364.70±19.75B419.65±18.09A果形指数0.95±0.04a0.94±0.04a0.94±0.04a0.94±0.03a0.91±0.02b硬度/N11.30±0.85A9.03±0.46B6.95±0.56C4.81±0.59D3.23±0.44EL∗73.82±1.59a74.35±3.55a74.87±6.92a71.99±2.09a67.27±3.02aa∗-1.00±1.85E1.59±0.93D4.76±2.82C9.29±1.10B11.74±1.54Ab∗35.28±1.95a35.88±1.49a36.16±1.14a37.36±2.00a38.33±2.06a褐变指数61.35±4.53D65.34±5.83C69.15±8.09C80.26±5.46B93.58±4.18A色度35.34±1.93D35.93±1.48CD36.57±1.39C38.51±2.08B40.11±2.15A色相87.07±1.89a87.35±1.30a82.62±4.22b76.05±1.44c72.98±2.02d
2.2.2 不同采收成熟度对果实硬度和色泽的影响
硬度是果实成熟的重要指标,直接体现果实软硬程度,也影响果实的口感和用途。由表3可知,随成熟度的提高果实硬度迅速下降,从SA时期的11.30 N下降到SE时期的3.23 N,差异极显著(P<0.01),表明成熟过程中果实质地不断变软。
色泽是反映桃果实成熟度的关键指标,为果实外观品质提供重要信息,其与花青素、类胡萝卜素等色素合成有关[17]。如表3所示,在果实的成熟过程中,L*值从SC时期后开始降低,表明果实色泽不断加深;a*值显著增加(P<0.01),b*值不断增加,表明颜色从青绿色变为亮黄色,这与外观观察的趋势相同。此外,果实成熟过程中褐变指数显著增加,表明褐变程度不断加深。色度值表示颜色的鲜艳饱和程度,色度值由SA的35.34增加至SE的40.11,表明果实成熟过程中颜色变深。色相即颜色的色相角度,是色彩的基本属性,能综合反映出样品的颜色。色相值由87.07降至72.98,表明成熟过程中,果实由绿色向黄色转变。
2.2.3 不同采收成熟度对果实感官品质评分的影响
由表4可知,黄金蜜桃的色泽评分、多汁性评分、甜味评分、风味评分随着果实的成熟而增加,并达到极显著水平(P<0.01),酸味评分在SC时期达到17.06,略有降低,总体维持在16分左右。可见,SE时期的果实感官品质最好。
表4 不同成熟度对黄金蜜桃感官评分的影响
Table 4 Effect of different maturity on the sensory score of golden peach
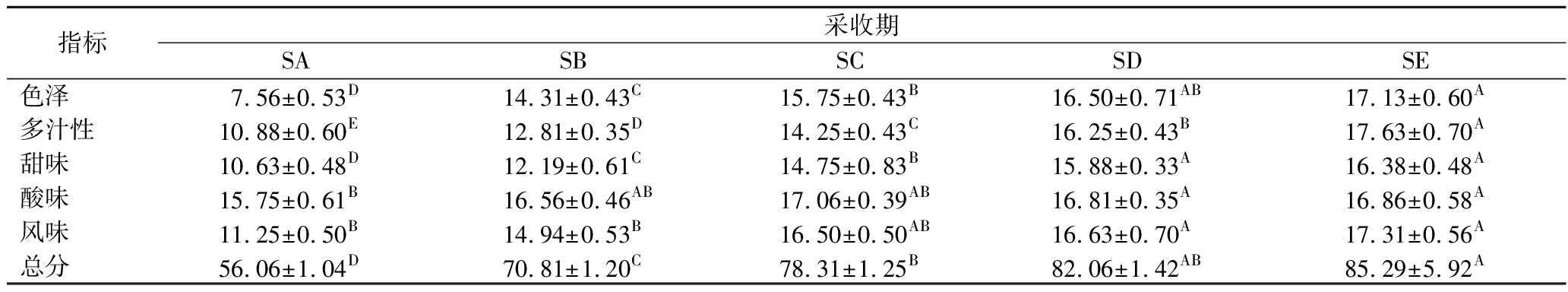
指标采收期SASBSCSDSE色泽7.56±0.53D14.31±0.43C15.75±0.43B16.50±0.71AB17.13±0.60A多汁性10.88±0.60E12.81±0.35D14.25±0.43C16.25±0.43B17.63±0.70A甜味10.63±0.48D12.19±0.61C14.75±0.83B15.88±0.33A16.38±0.48A酸味15.75±0.61B16.56±0.46AB17.06±0.39AB16.81±0.35A16.86±0.58A风味11.25±0.50B14.94±0.53B16.50±0.50AB16.63±0.70A17.31±0.56A总分56.06±1.04D70.81±1.20C78.31±1.25B82.06±1.42AB85.29±5.92A
2.3 不同采收成熟度对果实内在品质指标的影响
2.3.1 不同采收成熟度对果实水分含量、TSS、SSC和TA的影响
水分含量是水果成熟的重要标志,随着果实的成熟而提高, 由表5可知,在桃果实成熟过程中水分含量不断增加,这与之前的多汁性评分结果一致。
表5 不同成熟度对果实水分含量、TSS、SSC和TA的影响
Table 5 Effects of different maturity on fruit water content, TSS, SSC, and TA

指标采收期SASBSCSDSE水分含量/%87.38±0.05C87.89±0.08bC88.62±0.28BC91.06±0.08aAB91.45±0.24ATSS/°Brix11.10±0.19d11.25±0.25d11.70±0.10c12.10±0.10b12.70±0.10aSSC/%5.71±0.07eD7.96±0.04dC8.35±0.04C11.79±0.11A9.85±0.17BTA/‰3.07±0.21a2.40±0.08a1.73±0.08b1.79±0.08b1.62±0.08c
TSS、SSC和TA 是评价果实成熟度、品质以及口感的指标,其含量受果实成熟过程中积累的糖、酸、维生素、氨基酸、矿物质等多种物质决定。TSS含量是评定园艺果实品质的重要指标,也关系到消费者对其的认可程度。TSS随着果实的成熟不断增加,SSC在SA~SD阶段也表现出同样的趋势,可能与叶片的光合作用合成糖类以及果实的淀粉等转化有关,在SD~SE时期略有下降,可能与光合作用减弱和糖代谢的增加有关。TA和TSS、SSC有着相反的趋势,在果实成熟过程中逐渐下降,在SE阶段达到最低点1.62‰,下降了47.2%。TA与水果中有机酸的含量直接相关,由于在呼吸过程中消耗有机酸,水果的代谢变化可能会降低酸度。
2.3.2 不同采收成熟度对果实固酸比和糖酸比的影响
由图2可知,果实成熟过程中,固酸比和糖酸比的变化趋势基本一致,分别从SA时期的36.16,18.60提升至SD时期的67.60、65.87,并达到最高值。固酸比在SC和SD时期未达到差异显著水平,糖酸比在SB与SE时期未达到差异显著水平,其余时期均达到差异极显著水平。SE时期固酸比和糖酸比的下降可能与果实糖、有机酸等代谢有关。

图2 不同采收成熟度对果实固酸比和糖酸比的影响
Fig.2 Effects of different harvest maturity on fruit TSS/TA and SSC/TA
2.3.3 不同采收成熟度对果实呼吸强度的影响
呼吸强度是果实代谢快慢的重要特征[18],由表6可知,果实的呼吸强度在SA和SB时期较低,SC、SD和SE时期较高,保持在80~90 mg/(kg·h)之间,只有SA和SD时期达到差异显著水平(P<0.05)。果实呼吸强度的峰值出现在第4阶段,表明果实的代谢能力在早期增加,在SD期后下降。
表6 不同成熟度对果实呼吸强度、维生素C、T-SOD、S-pro和果胶的影响
Table 6 Effects of same maturity on fruit RI, Vitamin C, T-SOD, S-pro, and pectin

指标采收期SASBSCSDSE呼吸强度/[mg/(kg·h)]70.73±1.67b77.95±1.83ab84.59±3.46ab89.52±2.74a84.42±3.25ab维生素C/(μg/g)227.59±0.60eD261.9±0.44dC468.64±4.30cB543.03±1.68aA518.12±3.22bAT-SOD/(U/g)283.39±3.95aA266.53±6.29aA257.21±6.20aAB267.15±5.27aA223.99±4.36bB可溶性蛋白/(μg/g)134.74±1.55eD158.64±3.91dD197.74±2.31cC240.41±1.03bB286.98±2.15aASP/‰3.75±0.06bAB3.66±0.03bAB3.50±0.08bB3.69±0.06bAB4.16±0.08aA原果胶/‰4.69±0.08a4.37±0.06ab4.33±0.18ab4.29±0.03b4.25±0.08b总果胶/‰8.43±0.13abAB8.04±0.05bAB7.83±0.24abAB7.98±0.05bB8.41±0.05aA
2.3.4 不同采收成熟度对果实维生素C含量的影响
维生素C又称抗坏血酸,其能清除自由基,维持活性氧代谢平衡并延缓果实后熟软化,是评价果实品质的重要指标之一[19]。由表6可知,随果实成熟度的提高,维生素C含量呈现出先增加后降低的趋势,SA至SD时期果实维生素C含量增加了138.6%,SD至SE时期维生素C含量下降了4.6%。且不同成熟度黄金蜜桃果实维生素C含量均达到差异显著水平(P<0.05),这与研究者在甘蓝[20]、梨[21]、李子[22]中发现的研究结果一致。
2.3.5 不同采收成熟度对果实T-SOD活性的影响
SOD有清除活性氧的作用,其活性可以直观地反映果实受到氧化的程度[23]。由表6可知,随果实成熟度的提高,T-SOD活性整体呈下降趋势,在SD时期果实T-SOD活性有所回升,后又下降。SA~SD期间的差异不显著,SE和各成熟度间的差异显著(P<0.05)。
2.3.6 不同采收成熟度对果实可溶性蛋白含量的影响
可溶性蛋白可为人体提供必要的营养物质,是果实代谢的重要指标,因此是评价果实品质和营养的重要指标。黄金蜜桃的可溶性蛋白含量随果实成熟度的增加不断上升,除SA和SB时期间为差异显著水平(P<0.05),其余各成熟期间均达到差异极显著水平(P<0.01)。在SE时期达到最高值286.98 μg/g,相比SA时期增加了113.0%。
2.3.7 不同采收成熟度对果实果胶含量的影响
果胶作为一种植物胶,未成熟果实中的果胶与纤维素结合形成非水溶性的原果胶(protopectin,PP),使果实坚硬,随果实成熟度提高,果胶与纤维素分离,形成水溶性果胶(soluble pectin,SP),使果实软化,硬度降低[15]。如表6可知,黄金蜜桃水溶性果胶含量随果实成熟度增加呈先下降后上升趋势,SA~SD期间无显著差异,SE时期达到4.16‰,显著高于其他成熟期(P<0.05),可能与原果胶有关。果实原果胶含量随成熟度增加呈下降的趋势,从SA时期的4.69‰下降到SE阶段4.25‰,只有SA和SD、SE期间差异显著(P<0.05)。总果胶含量变化浮动很小,维持在7.83‰~8.43‰之间,只有SE和SB、SD期间差异显著(P<0.05)。
2.4 不同采收成熟度果实指标的相关性和显著性分析
用Prism对不同成熟度黄金蜜桃的外观指标和内在指标进行相关性分析,结果如图3、表7所示,在桃果成熟过程中单果重和a*值、b*值、水分含量、TSS含量、SSC含量、呼吸强度、维生素C含量、可溶性蛋白含量、可溶性果胶含量呈正相关,和果形指数、硬度、L*、TA含量、T-SOD活性、原果胶含量呈负相关,且除了与可溶性果胶具有显著相关性外,与其他指标均为极显著相关性。
表7 不同采收成熟度果实指标的相关性和显著性分析
Table 7 Correlation and significance analysis of fruit indicators at different harvest maturity
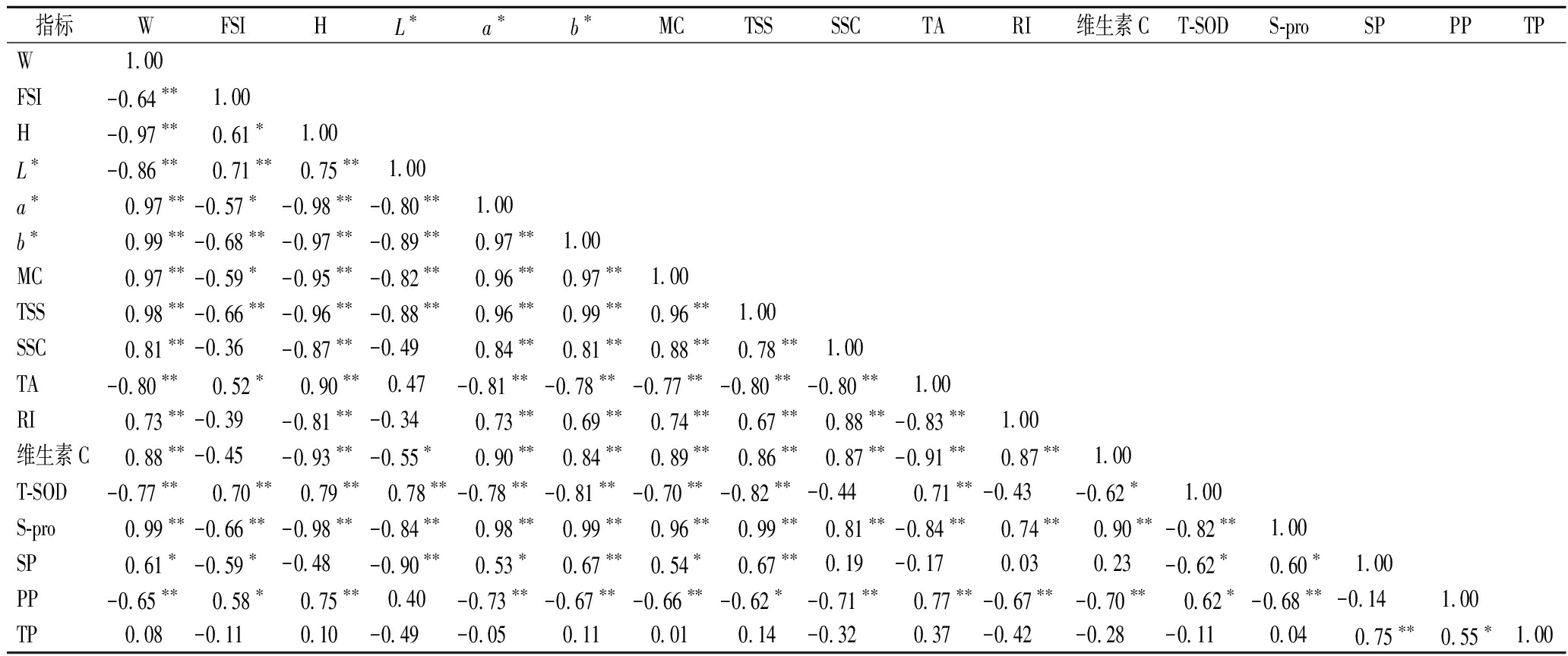
指标WFSIHL∗a∗b∗MCTSSSSCTARI维生素CT-SODS-proSPPPTPW 1.00FSI-0.64∗∗ 1.00H-0.97∗∗ 0.61∗ 1.00L∗-0.86∗∗ 0.71∗∗ 0.75∗∗ 1.00a∗ 0.97∗∗-0.57∗-0.98∗∗-0.80∗∗ 1.00b∗ 0.99∗∗-0.68∗∗-0.97∗∗-0.89∗∗ 0.97∗∗ 1.00MC 0.97∗∗-0.59∗-0.95∗∗-0.82∗∗ 0.96∗∗ 0.97∗∗ 1.00TSS 0.98∗∗-0.66∗∗-0.96∗∗-0.88∗∗ 0.96∗∗ 0.99∗∗ 0.96∗∗ 1.00SSC 0.81∗∗-0.36-0.87∗∗-0.49 0.84∗∗ 0.81∗∗ 0.88∗∗ 0.78∗∗ 1.00TA-0.80∗∗ 0.52∗ 0.90∗∗ 0.47-0.81∗∗-0.78∗∗-0.77∗∗-0.80∗∗-0.80∗∗ 1.00RI 0.73∗∗-0.39-0.81∗∗-0.34 0.73∗∗ 0.69∗∗ 0.74∗∗ 0.67∗∗ 0.88∗∗-0.83∗∗ 1.00维生素C 0.88∗∗-0.45-0.93∗∗-0.55∗ 0.90∗∗ 0.84∗∗ 0.89∗∗ 0.86∗∗ 0.87∗∗-0.91∗∗ 0.87∗∗ 1.00T-SOD-0.77∗∗ 0.70∗∗ 0.79∗∗ 0.78∗∗-0.78∗∗-0.81∗∗-0.70∗∗-0.82∗∗-0.44 0.71∗∗-0.43-0.62∗ 1.00S-pro 0.99∗∗-0.66∗∗-0.98∗∗-0.84∗∗ 0.98∗∗ 0.99∗∗ 0.96∗∗ 0.99∗∗ 0.81∗∗-0.84∗∗ 0.74∗∗ 0.90∗∗-0.82∗∗ 1.00SP 0.61∗-0.59∗-0.48-0.90∗∗ 0.53∗ 0.67∗∗ 0.54∗ 0.67∗∗ 0.19-0.17 0.03 0.23-0.62∗ 0.60∗ 1.00PP-0.65∗∗ 0.58∗ 0.75∗∗ 0.40-0.73∗∗-0.67∗∗-0.66∗∗-0.62∗-0.71∗∗ 0.77∗∗-0.67∗∗-0.70∗∗ 0.62∗-0.68∗∗-0.14 1.00TP 0.08-0.11 0.10-0.49-0.05 0.11 0.01 0.14-0.32 0.37-0.42-0.28-0.11 0.04 0.75∗∗ 0.55∗1.00
注:*表示在P<0.05水平下相关性显著;**表示在P<0.01水平下相关性极显著。

图3 果实不同采收成熟度间指标的相关性分析
Fig.3 Correlation analysis of indicators between different harvest maturity of fruits
此外,作为黄金蜜桃果实颜色参数指标,a*值和b*值呈极显著正相关关系;L*值和a*值、b*值呈极显著负相关关系,与T-SOD活性呈极显著正相关关系,与水分含量、TSS含量、T-SOD活性、可溶性蛋白、可溶性果胶呈极显著负相关关系;a*值、b*值除了与总果胶含量无显著相关性外,与其他指标均有显著相关性。
水分含量和TSS含量、SSC、呼吸强度、维生素C含量、可溶性蛋白含量有极显著正相关关系,和可溶性果胶含量由显著相关关系,和可滴定酸含量、T-SOD活性、原果胶含量有极显著负相关关系。TSS含量除了与总果胶含量无显著相关性外,与其他指标均有显著相关性,其中与可溶性蛋白含量相关性较高,R2达到0.99。可滴定酸含量和T-SOD活性、原果胶含量有极显著正相关关系,和呼吸强度、维生素C含量、可溶性蛋白含量有极显著负相关关系。可溶性蛋白含量和维生素C含量有极显著正相关关系,和T-SOD活性有极显著负相关关系。
综合上述分析,果实内在指标、外观品质指标以及内在指标和外观品质指标间均存在相关性,果实单果重、a*值、b*值和其他指标相关性较高,因此可作为果实品质评价的代表性指标。
2.5 不同采收成熟度果实指标的PCA
用Prism对不同成熟度黄金蜜桃的相关数据进行PCA,降维后前2个主成分累积贡献率为89.28%,能较好的表征原始变量的特征差异,因此,将这2 个主成分作为评价果实品质的综合变量。如图4-a所示,不同成熟度的黄金蜜桃可以被很好的区分,聚成SA、SB、SC、SD和SE 5类。由图4-b可见,单果重、呼吸强度、TSS、水分含量、SSC、可溶性蛋白、维生素C、a*、b*等指标聚于右方,进一步说明果实在SD、SE时期品质更佳。

a-主成分得分图;b-主成分负载图
图4 不同成熟度黄金蜜桃理化特性的PCA结果
Fig.4 PCA results of physical and chemical characteristics of golden peach with different maturity
3 结论
在本研究中,SA和SB时期,黄金蜜桃的好果率为100%,随着成熟度的提高,果实在SD、SE时期的落果率、霉变率极显著增加,好果率在SE时期仅为13.42%,损失严重;果实的单果重、硬度不断增加;果形指数在果实成熟过程中差异不显著;L*值呈先升高后降低趋势,a*值、b*值、褐变指数、色度值呈不断上升趋势,色相不断降低;果实的色泽、多汁性、甜味、风味评分和总分不断升高,酸味评分先上升后下降;随成熟度的提高,果实水分含量、TSS、SSC、呼吸强度、可溶性蛋白含量不断上升,TA、T-SOD活性、总果胶含量不断下降,水溶性果胶含量先下降后上升,固酸比、糖酸比、维生素C含量先升高后降低、在SD时期达到最高。进一步对其理化指标进行相关性分析,发现随成熟度的提高,果实单果重、a*值和b*值与其他指标的相关性较高,且除总果胶指标外,与其他各指标之间均存在显著相关关系。PCA结果表明SC、SD和SE时期的果实品质较好。
分析表明,SA和SB时期果实感官品质指标、固酸比、糖酸比、维生素C含量等较低,不适合鲜食和贮藏加工。随着成熟度的提高,果实变大,风味渐浓,甜度、维生素C含量等指标增加,硬度、酸度降低,因此SC、SD时期的果实适合鲜食和贮藏加工。SE时期的果实多汁、风味更佳浓郁,但维生素C含量降低,果实较软,不便运输,且霉变率较高,好果率极低,不能达到理想的产量。本研究反映了不同采收成熟度黄金蜜桃的品质变化,后续可根据果实的不同用途确定最佳采摘期。研究结果为黄金蜜桃的运输、贮藏、加工提供了理论基础和科学依据。
[1] 李守才. 蒙阴蜜桃高质量发展的优势、制约因素和改进措施[J].果农之友, 2022(2):58-60.
LI S C.Advantages, restrictive factors and improvement measures of high-quality development of Mengyin peach[J].Fruit Growers’ Friend, 2022(2):58-60.
[2] 潘磊, 牛良, 曾文芳, 等.晚熟黄桃新品种‘黄金蜜桃4号’[J].园艺学报, 2020, 47(S2):2886-2887.
PAN L, NIU L, ZENG W F, et al.A late ripening yellow peach cultivar’Huangjin mitao 4’[J].Acta Horticulturae Sinica, 2020, 47(S2):2886-2887.
[3] 钟呈星, 王言文, 李守才, 等.2016—2020年蒙阴蜜桃品种变化及影响因素分析[J].落叶果树, 2021, 53(5):33-35.
ZHONG C X, WANG Y W, LI S C, et al.Analysis on variety and influencing factors of Mengyin peach varieties from 2016 to 2020[J].Deciduous Fruits, 2021, 53(5):33-35.
[4] 张丛, 李文, 李成悦, 等.不同成熟度杨梅果实的品质及花青素组分比较[J].亚热带农业研究, 2022, 18(1):41-45.
ZHANG C, LI W, LI C Y, et al.Comparison of fruit quality and anthocyanin composition of Myrica rubra with different maturity levels[J].Subtropical Agriculture Research, 2022, 18(1):41-45.
[5] 薛晓敏, 韩雪平, 王贵平, 等.不同成熟度对李果实品质的影响[J].经济林研究, 2020, 38(3):26-36.
XUE X M, HAN X P, WANG G P, et al.Effects of different maturities on characteristics of plum fruit quality[J].Non-Wood Forest Research, 2020, 38(3):26-36.
[6] 朱文靖, 张容鹄, 邓浩, 等.不同成熟度红毛丹果实果肉品质特性及抗氧化活性比较[J].现代食品科技, 2021, 37(9):138-144;293.
ZHU W J, ZHANG R H, DENG H, et al.Comparison of the fruit pulp quality characteristics and antioxidant capacity of rambutan fruits with different maturity levels[J].Modern Food Science and Technology, 2021, 37(9):138-144;293.
[7] 许奇志, 陈秀萍, 邓朝军, 等.不同成熟度“新白8号”枇杷果实品质特性分析[J].中国南方果树, 2019, 48(2):71-74;81.
XU Q Z, CHEN X P, DENG C J, et al.Characteristics of fruit quality of xinbai No.8 loquat at different maturity[J].South China Fruits, 2019, 48(2):71-74;81.
[8] 闫超, 苏彩霞, 刘晓红, 等.不同成熟度“新郑红3号”营养品质的研究[J].北方园艺, 2019(5):65-69.
YAN C, SU C X, LIU X H, et al.Study on nutritional properties of ‘Xinzhenghong 3’ jujube at different maturation stages[J].Northern Horticulture, 2019(5):65-69.
[9] 孙锐, 孙蕾, 马金辉, 等.不同成熟度无花果品质指标的变化分析[J].经济林研究, 2017, 35(2):32-37.
SUN R, SUN L, MA J H, et al.Change analysis of fig’s quality indicators in different maturities[J].Nonwood Forest Research, 2017, 35(2):32-37.
[10] PALOU E, HERN NDEZ-SALGADO C, L
NDEZ-SALGADO C, L PEZ-MALO A, et al.High pressure-processed guacamole[J].Innovative Food Science &Emerging Technologies, 2000, 1(1):69-75.
PEZ-MALO A, et al.High pressure-processed guacamole[J].Innovative Food Science &Emerging Technologies, 2000, 1(1):69-75.
[11] NEVARA G A, YEA C S, KARIM R, et al.Effects of moist-heat treatments on color improvement, physicochemical, antioxidant, and resistant starch properties of drum-dried purple sweet potato powder[J].Journal of Food Process Engineering, 2019, 42(1):e12951.
[12] ZHOU J Y, SUN C D, ZHANG L L, et al.Preferential accumulation of orange-colored carotenoids in Ponkan (Citrus reticulata) fruit peel following postharvest application of ethylene or ethephon[J].Scientia Horticulturae, 2010, 126(2):229-235.
[13] 高伦江, 方波, 曾顺德, 等.青脆李采后贮藏中生理及感官品质变化研究初报[J].南方农业, 2019, 13(19):51-54.
GAO L J, FANG B, ZENG S D, et al.Preliminary report on the changes of physiology and sensory quality in postharvest storage of Prunus salicina[J].South China Agriculture, 2019, 13(19):51-54.
[14] LI Y L, LIU S, CHEN S Q, et al.Physicochemical changes in fresh-cut peaches with the combined treatment of UV-B irradiation and 1-MCP[J].Postharvest Biology and Technology, 2022, 184:111755.
[15] 曹建康, 姜微波, 赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社, 2007.
CAO J K, JIANG W B, ZHAO Y M.Postharvest physiological and biochemical laboratory guidance for fruits and vegetables[M].Beijing:China Light Industry Press, 2007.
[16] SUN Q Q, ZHANG N, WANG J F, et al.Melatonin promotes ripening and improves quality of tomato fruit during postharvest life[J].Journal of Experimental Botany, 2015, 66(3):657-668.
[17] LI X B, WANG Y, JIN L, et al.Development of fruit color in Rubus chingii Hu (Chinese raspberry):A story about novel offshoots of anthocyanin and carotenoid biosynthesis[J].Plant Science, 2021, 311:110996.
[18] KHALID S, MALIK A U, KHAN A S, et al.Tree age and fruit size in relation to postharvest respiration and quality changes in ‘Kinnow’ mandarin fruit under ambient storage[J].Scientia Horticulturae, 2017, 220:183-192.
[19] 陈娇, 李芬芳, 李奕星, 等.外源抗坏血酸对香蕉常温后熟期果实品质的影响[J].中国南方果树, 2020, 49(1):56-60.
CHEN J, LI F F, LI Y X, et al.Effect of exogenous ascorbic acid on quality of banana fruit ripened at room temperature[J].South China Fruits, 2020, 49(1):56-60.
[20] 雷琳, 阚茗铭, 叶发银, 等.采收成熟度对甘蓝营养成分的影响[J].食品与发酵工业, 2017, 43(11):101-106.
LEI L, KAN M M, YE F Y, et al.Effects of the maturity on cabbage nutients[J].Food and Fermentation Industries, 2017, 43(11):101-106.
[21] 贾晓辉, 王文辉, 姜云斌, 等.采收成熟度对‘玉露香’梨果实品质和耐贮性的影响[J].果树学报, 2016, 33(5):594-603.
JIA X H, WANG W H, JIANG Y B, et al.Effects of harvest maturity on fruit quality and storage life of‘Yuluxiang’pears[J].Journal of Fruit Science, 2016, 33(5):594-603.
[22] 黄展文, 王颖, 李明娟, 等.采收成熟度对龙滩珍珠李果实品质的影响[J].食品与发酵工业, 2021, 47(7):203-210.
HUANG Z W, WANG Y, LI M J, et al.Effect of harvest maturity on the quality of ‘Longtan’ pearl plum[J].Food and Fermentation Industries, 2021, 47(7):203-210.
[23] ZHANG Y, GONG Y, CHEN L, et al.Hypotaurine delays senescence of peach fruit by regulating reactive oxygen species metabolism[J].Scientia Horticulturae, 2019, 253:295-302.