烘焙是一种传统的食品热加工方法,近几年,面包、蛋糕、糕点等烘焙食品兼具正餐主食和休闲零食属性,在人们现代生活的饮食结构中占据了重要的位置,我国烘焙食品行业市场规模2020年已高达约2 400亿元[1]。烘焙食品一般含油量较高,油脂在保证良好的口感、风味和外观上起到了关键的作用,但在高温条件下也会产生对人体有害的物质,如单氯丙醇酯和缩水甘油酯。有数据显示,我国各地市售焙烤食品中氯丙醇酯污染普遍存在[2-6],其中,云南省境内随机抽样发现面包和饼干中单氯丙醇酯检出率分别为47%和27%[2],江西省市售面包中3-氯丙醇酯检出率达77.8%[6],2~12岁儿童组饼干、糕点暴露水平均高于2016年欧盟食品安全局对婴幼儿及儿童摄入3-MCPD最大耐受评估值0.8 μg/kg·d[3],而缩水甘油酯通常会与3-氯丙醇酯一起存在[7]。
单氯丙醇酯(esters of monochloropropanediol, MCPD酯)包括3-氯-1,2-丙二醇酯(esters of 3-monochloro-1,2-propanediol, 3-MCPD酯)和2-氯-1,3-丙二醇酯(esters of 2-monochloro-1,3-propanediol, 2-MCPD酯),其中3-MCPD酯的水解产物3-MCPD在氯丙醇类物质中毒性相对明确,世界卫生组织国际癌症研究机构(International agency for Research on Cancer, IARC)已在2011年将3-MCPD归为2B类,3-MCPD酯可通过在体内水解释放出游离的3-MCPD而产生肾毒性、生殖毒性、肝毒性和潜在致癌性。食品加工过程中3-MCPD酯的生成与降解反应同时存在。目前普遍接受的3-MCPD酯生成机理推测主要有4种:氯离子的直接亲核取代机理[8]、环酰氧鎓离子中间体机理[8-9]、自由基中间体机理[10-11]及缩水甘油酯机理[12-13];3-MCPD酯可能的降解途径也有3种[14],包括异构化、脱酰化和脱氯反应,其中异构化反应会将3-MCPD酯转换成2-MCPD酯,仍存在毒性作用。缩水甘油酯(glycidyl esters, GEs)也是油脂在高温条件下产生的一种潜在致癌物,其水解产物缩水甘油被证明具有致癌和遗传毒性,并于2000年被IARC归为2A类。GEs与3-MCPD酯有着相似的结构,两者生成机理密不可分,在一定条件下可能相互转换,因此在对MCPD酯开展研究的同时往往也会监测GEs的含量。
目前有关油脂精炼过程或煎炸过程中3-MCPD酯的形成规律的研究已逐渐深入,但含油量较高的烘焙食品在加工过程中MCPD酯和GEs生成规律的研究仍相对缺乏。另外,蛋白也是烘焙食品的重要组成部分,由于其同时含有亲水和亲油基团,在食品体系中起到乳化的作用[15],蛋白也可能影响MCPD酯的生成[16],因此,本研究基于蛋糕的配方,在油、水和NaCl的基础体系中添加了酪蛋白,建立烘焙模拟体系,监测了不同温度条件下MCPD酯和GEs的变化规律,探究了油水比的影响,改变烘焙模拟体系中油脂的种类(菜籽油、玉米油和椰子油)研究MCPD酯和GEs含量变化规律的差异,此外,分析了MCPD酯和GEs含量变化与油脂氧化程度变化的相关性,探讨油脂氧化对体系中MCPD酯和GEs生成的影响机制,为控制烘焙过程中MCPD酯和GEs的生成提供一定的理论参考。
1 材料与方法
1.1 材料与试剂
压榨一级菜籽油,道道全粮油股份有限公司;压榨一级玉米油,益海嘉里金龙鱼粮油食品股份有限公司;椰子油,上海麦克林生化科技有限公司;酪蛋白,美国Sigma-Aldrich公司。
苯硼酸(phenylboronic acid, PBA)纯度97%,上海阿拉丁生化科技股份有限公司;四氢呋喃(tetrahydrofuran, THF)、甲苯、正庚烷、正己烷、甲醇(均为色谱纯),上海易恩化学技术有限公司;NaCl、NaBr、NaHCO3、Na2SO4、KOH(均为分析纯),天津市大茂化学试剂厂;标准品:3-氯-1,2-丙二醇棕榈酸二酯-d5(1,2-dipalmitoyl-3-chloropropanediol-d5,PP-3-MCPD-d5),纯度>98%,加拿大CDN isotopes公司;3-氯-1,2-丙二醇棕榈酸二酯(1,2-dipalmitoyl-3-chloropropanediol,PP-3-MCPD)、2-氯-1,3-丙二醇棕榈酸二酯(1,3-dipalmitoyl-2-chloropropanediol,PP-2-MCPD)、棕榈酸缩水甘油酯-d5(glycidyl palmitate-d5,Gly-P-d5)、棕榈酸缩水甘油酯(glycidyl palmitate,Gly-P)(纯度均>98%),加拿大Toronto Research Chemicals公司。
1.2 仪器与设备
Agilent 8890-7000D三重串联四极杆气相色谱质谱联用仪,美国安捷伦科技公司;Carry 50 Conc紫外分光光度计,美国Varian公司;HWCL-5油浴锅,郑州长城科工贸有限公司;RV 10 auto FLEX旋转蒸发仪,德国IKA公司;MD200-2氮吹仪,杭州奥盛仪器有限公司。
1.3 实验方法
1.3.1 烘焙模拟体系的制备
(1)不同加热温度的烘焙模拟体系
基于芝士蛋糕配方,保留油、水、NaCl、酪蛋白等主要组分建立烘焙模拟体系:称量玉米油2.0 g、酪蛋白0.05 g和0.1 g/mL的NaCl溶液5 mL于耐压管中,加入磁力搅拌转子混合均匀,分别在160、180、200 ℃油浴搅拌加热5、10、15、20、30 min,待加热结束迅速冰水浴冷却。用20 mL正己烷分离提取油脂部分,采用旋转蒸发和N2吹扫除去溶剂,样品保存于4 ℃。
(2)不同油水比的烘焙模拟体系
控制体系总质量不变,改变油与水的质量比分别为1∶6、2∶5、3∶4、4∶3、5∶2、6∶1,于200 ℃下搅拌加热30 min,其余操作均同(1)。
(3)不同油脂的烘焙模拟体系
分别选用菜籽油、玉米油和椰子油制备烘焙模拟体系,加热温度为200 ℃,其余操作均同(1)。
1.3.2 单氯丙醇酯和缩水甘油酯的测定
样品前处理:参考国际标准ISO 18363-3—2017及李昌[13]的方法并作适当修改。精确称取样品(115±5) mg,分别加入50 μL的PP-3-MCPD-d5(40 μg/mL)和Gly-P-d5(50 μg/mL)作为内标。加入2 mL THF溶解样品,加入30 μL的3 mg/mL NaBr酸性水溶液混匀,50 ℃水浴孵化15 min,将缩水甘油酯转化为3-溴-1,2-丙二醇(3-monobromopropanediol,3-MBPD)酯;用3 mL 6 g/L NaHCO3溶液停止反应后,加入2 mL正庚烷混合,提取上层有机相,40 ℃下N2吹扫约15 min除去溶剂,用1 mL THF复溶,加入1.8 mL的硫酸甲醇溶液混合均匀,置于40 ℃水浴孵育16 h进行酯交换反应;用0.5 mL的0.1 g/mL NaHCO3溶液停止反应,氮吹15 min,加入2 mL 20% Na2SO4溶液,分别2次用2 mL的正庚烷除去脂肪酸甲酯;加入250 μL的250 g/L PBA丙酮水溶液,超声5 min进行衍生化,用1 mL正庚烷提取衍生物2次,氮吹5~10 min,最后加入400 μL正庚烷溶解,过0.22 μm有机膜后转移至带有200 μL内插管的样品瓶中,后续进行GC-MS测定,采用内标-标准曲线法定量,含量以相应的游离态(氯丙醇和缩水甘油)计,单位以mg/kg样品表示。
气相色谱条件:色谱柱为HP-5MS毛细管柱(30 m×0.25 mm×0.5 μm);进样量1.0 μL,不分流,进样温度280 ℃;溶剂延迟5 min;载气为He,1 mL/min;采用程序升温,初始温度80 ℃保持1 min,以10 ℃/min升至160 ℃后保持3 min,再以3 ℃/min升至180 ℃,以20 ℃/min升至300 ℃并保持5 min。
质谱条件:电离源为电子轰击(electron impact ion,EI)源,电离能量70 eV;离子源温度230 ℃;四极杆温度150 ℃;传输线温度280 ℃;单离子检测扫描模式(single ion monitoring,SIM),参数设置如表1所示。
表1 SIM监测离子参数
Table 1 Monitoring parameters of SIM
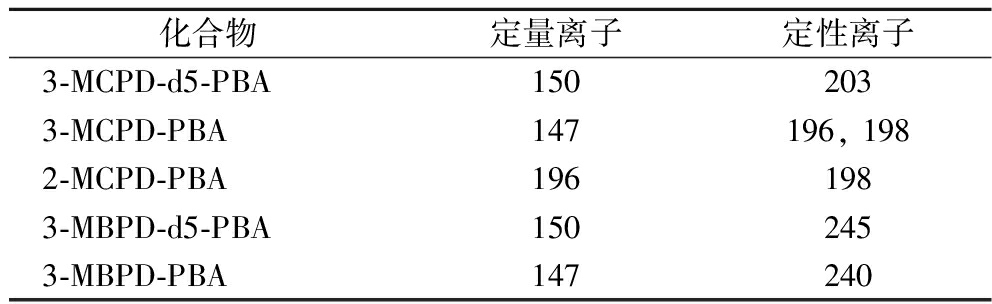
化合物定量离子定性离子3-MCPD-d5-PBA1502033-MCPD-PBA147196, 1982-MCPD-PBA1961983-MBPD-d5-PBA1502453-MBPD-PBA147240
1.3.3 脂肪酸组成的测定
参考焦文娟[17]的气质检测方法,略作修改。
样品前处理:称取0.1 g样品溶于3 mL正己烷中,加入3 mL KOH溶液(0.4 mol/L甲醇),50 ℃振荡孵育15 min。5 000 r/min离心5 min分层,移取上层有机相,经无水Na2SO4除水,过0.22 μm有机滤膜后转移至带有200 μL内插管的进样瓶中,后续进行GC-MS测定,采用归一化法进行定量。
气相色谱条件:采用HP-INNOWax毛细管色谱柱(30 m×250 μm×0.25 μm),进样量0.1 μL,分流比60∶1,进样温度250 ℃;溶剂延迟3 min;载气为He,1.2 mL/min;升温程序为初始温度130 ℃,保持1 min后以5 ℃/min增加到250 ℃,最后以250 ℃保持3 min。
质谱条件:EI;电离能70 eV;离子源温度230 ℃;检测模式为全扫描模式。
1.3.4 共轭二烯和共轭三烯的测定
参考GB/T 22500—2008《动植物油脂 紫外吸光度的测定》方法,测定232和268 nm下的紫外吸光度。
1.3.5 茴香胺值的测定
参考GB/T 24304—2009《动植物油脂 茴香胺值的测定》方法。
1.3.6 数据统计分析
所有试验与指标测定均平行3次,使用Excel 2019、SPSS 25.0等软件进行数据统计分析,用Duncan法进行多重比较(P<0.05),利用Origin 2022b绘制图形。
2 结果与分析
2.1 不同加工条件下单氯丙醇酯和缩水甘油酯的变化规律
考察了加热时间、加热温度以及油水比对烘焙模拟体系中的MCPD酯和GEs生成的影响规律。如图1所示,初始体系GEs含量最高[(0.589 9±0.005 3) mg/kg],其次为3-MCPD酯[(0.485 4±0.010 5) mg/kg]、2-MCPD酯[(0.234 0±0.009 8) mg/kg],这些危害物是油脂在精炼过程中产生的,并可进入食品加工体系。

a-3-MCPD酯的含量;b-2-MCPD酯的含量;c-GEs的含量
图1 不同加热温度下烘焙模拟体系中MCPD酯和GEs的变化
Fig.1 Changes in the content of MCPD esters and GEs in baking models at different temperatures
注:小写字母代表不同加热时间的样品在同一温度条件下的显著性差异(P<0.05)。
加热时间是影响MCPD酯和GEs生成的主要因素之一。随着加热时间的延长,烘焙模拟体系中的MCPD酯和GEs含量总体均呈现先上升后下降并逐渐保持稳定的趋势,说明在加热过程中同时进行着生成与降解反应,与张渊博等[18]的研究中先上升后下降的趋势相似。图1-a中可见,3种温度下,加热5 min时产生的3-MCPD酯含量最高;当加热时间增加至15 min,180和200 ℃下模拟体系中的3-MCPD酯含量分别为(0.465 9±0.015 8)和(0.457 9±0.004 5) mg/kg,已低于初始含量(0.485 4±0.010 5) mg/kg,此时3-MCPD酯的总生成量已经小于总降解量。图1-b中,2-MCPD酯变化规律与3-MCPD酯基本一致,说明模拟体系加热过程中3-MCPD酯降解的主要原因不是异构化成2-MCPD酯,可能是脱酰化等其他的降解途径。又如图1-c所示,GEs的变化规律与MCPD酯略有差异,所有温度条件下模拟体系在加热10 min时产生最多的GEs。
除了加热时间,加热温度也是MCPD酯和GEs的重要影响因素之一[19-20],并与时间存在交互作用。当加热较短时间(0~10 min),3-MCPD酯含量随着温度的升高而增加,在200 ℃加热5 min时产生了最高含量的3-MCPD酯[(0.647 7±0.006 6) mg/kg];而GEs含量随着温度升高而减少。当加热在20~30 min间,不同温度条件下MCPD酯含量和GEs都具有显著性差异(P<0.05),此时2-MCPD酯、3-MCPD酯和GEs都随温度升高而降低,表明MCPD酯和GEs热稳定性都不高[14,19]。GEs含量与温度始终呈负相关,原因可能是GEs存在亲电子的环氧结构,在水分含量较高的模拟体系中易受到亲核物质的攻击而开环[18],从而稳定性较差。而MCPD酯在加热时间分别为5和30 min时与温度呈现相反的相关性,可能与模拟体系中存在的蛋白有关。SADOWSKA-ROCIEK等[16]曾发现蛋白含量与3-MCPD酯含量呈现正相关,但蛋白的作用仍尚不明确。在此推测,蛋白在烘焙模拟体系中起到了乳化作用,加热仅5 min时,蛋白的乳化能力未受到较大的破坏,使得前体物质甘油酯与氯离子的反应基本不受油水界面的限制,而高温提高了反应速率,促进了MCPD酯的生成;但当加热时间为30 min时,蛋白完全变性,油与水乳化状态被破坏,此时甘油酯与氯离子接触几率显著降低,MCPD酯生成较少,同时温度越高,热降解反应越强,因此MCPD酯含量越低。
此外,还探究了油水比对烘焙模拟体系中MCPD酯和GEs含量的影响。如图2所示,随着油水比的增大,3-MCPD酯的含量显著增加,即水分含量越低,3-MCPD酯越易生成。油水比为1∶6时3-MCPD酯的含量仅为(0.329 3±0.005 4) mg/kg,而油水比2∶5时含量已增加2倍多,达到(1.085 3±0.054 1) mg/kg,这可能是因为油是提供前体物质甘油酯的原料,低油水比体系不能提供足够的前体物质,限制了3-MCPD酯的生成速率,同时体系中高含水量使得降解反应更快。2-MCPD酯的含量同样也受油水比的影响(图2-b),呈现先增加后持平的趋势,在4∶3体系中产生了最高含量的2-MCPD酯[(0.263 3±0.013 9) mg/kg],然而当油水比大于3∶4后,其含量差异没有显著性(P<0.05)。而GEs含量基本保持稳定(图2-c),说明油水比不是GEs生成的主要影响因素。
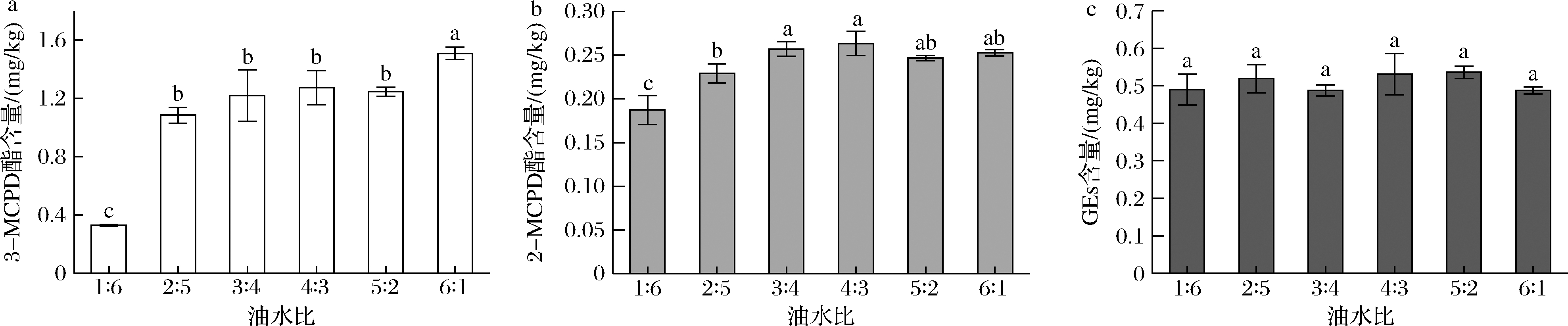
a-3-MCPD酯的含量;b-2-MCPD酯的含量;c-GEs的含量
图2 油水比对MCPD酯及GEs含量的影响
Fig.2 Effects of oil-water ratio on the content of MCPD esters and GEs
注:小写字母代表不同油水比样品的显著性差异(P<0.05)。
2.2 含不同油脂的烘焙模拟体系中单氯丙醇酯和缩水甘油酯的变化规律
不同油脂烘焙模拟体系中MCPD酯和GEs的含量变化规律如图3所示。在玉米油和椰子油体系中,3-MCPD酯的含量都随着加热时间的增加先上升后降低(图3-a),并在加热5 min时含量最高,分别为(0.647 7±0.006 6)和(0.386 4±0.008 3) mg/kg;而菜籽油体系中3-MCPD酯含量在加热15 min时才达到峰值[(0.718 1±0.004 7) mg/kg],比其他油脂烘焙体系产生了更多的3-MCPD酯,随后迅速下降;2-MCPD酯的含量变化规律与3-MCPD酯基本一致(图2-b)。菜籽油体系中MCPD酯特殊的变化规律可能是由于加热初期降解反应受到了较强的限制,随着加热的持续,限制因素失效后即刻迅速降解。不同油脂烘焙模拟体系中GEs的变化规律也存在差异,在玉米油和椰子油体系中仍保持先升后降的总体变化趋势,但菜籽油体系中GEs含量却随着加热时间的增加先降低后升高,表明GEs的生成反应在加热初期被抑制,初步猜测可能与菜籽油中高含量的不饱和脂肪酸有关。

a-3-MCPD酯的含量;b-2-MCPD酯的含量;c-GEs的含量
图3 不同油脂烘焙模拟体系中MCPD酯和GEs的变化
Fig.3 Changes in the content of MCPD esters and GEs in baking models with different oils
注:小写字母代表不同加热时间的样品在同一烘焙模拟体系中的显著性差异(P<0.05)。
2.3 脂肪酸组成的变化
当烘焙模拟体系中油脂种类不同,其脂肪酸组成也有明显差异。有研究基于量子化学模拟发现脂肪酸碳链长度和不饱和度会影响3-MCPD酯生成[21],因此脂肪酸组成可能对MCPD酯和GEs的生成有影响,为此测定了各油脂体系处理前后脂肪酸组成的变化(表2)。加热前,3种油脂中不饱和脂肪酸相对含量由高到低分别为菜籽油92.68%、玉米油84.52%、椰子油11.43%,其中油酸C16∶1是菜籽油的主要脂肪酸,亚油酸C16∶2是玉米油的主要脂肪酸,月桂酸C12∶0是椰子油的主要脂肪酸。而结合图3结果发现,3-MCPD酯和2-MCPD酯增长量在菜籽油体系中最大,在椰子油中最少,因此,不饱和脂肪酸相对含量较高的油脂可能更易生成MCPD酯。加热后,体系中饱和脂肪酸的相对含量都有所升高(P<0.05),单不饱和脂肪酸的相对含量都下降(P<0.05),是因为加热过程中不饱和脂肪酸发生了氧化,因此猜测3-MCPD酯和2-MCPD酯的生成可能与油脂的氧化存在一定关联。
表2 不同烘焙模拟体系中油脂脂肪酸组成的变化
Table 2 Changes in fatty acid composition of oils in different baking models
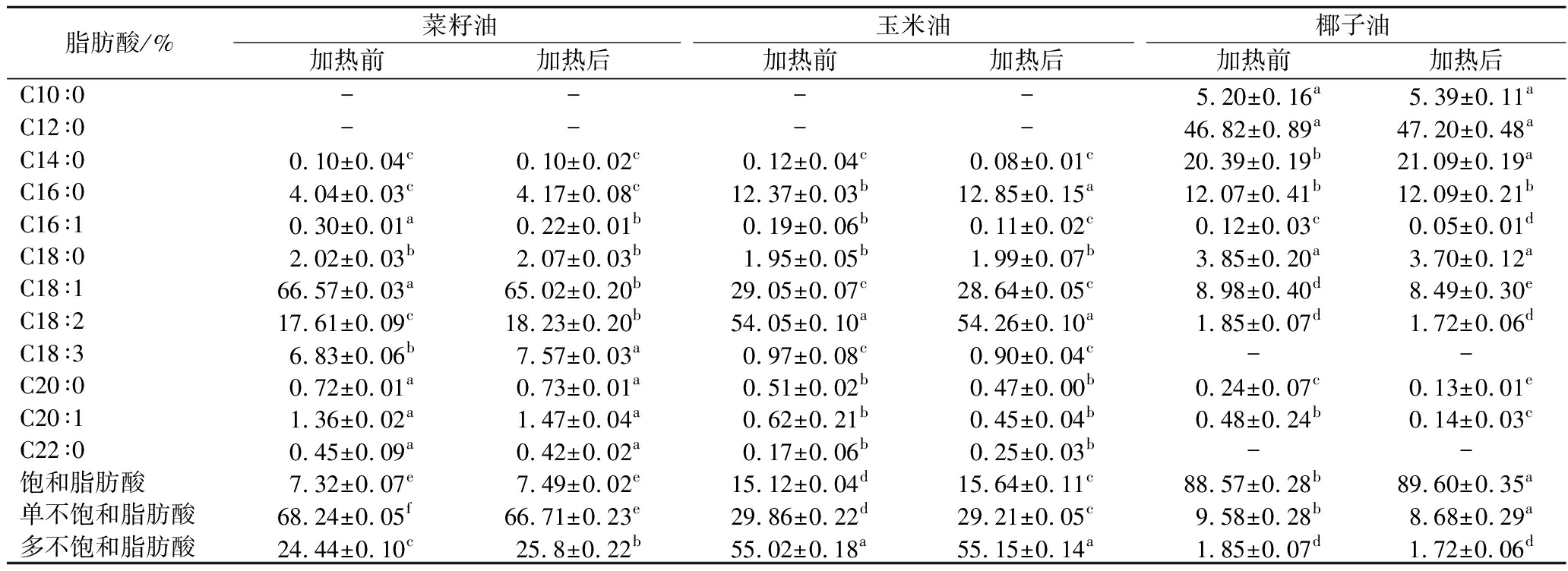
脂肪酸/%菜籽油玉米油椰子油加热前加热后加热前加热后加热前加热后C10∶0----5.20±0.16a5.39±0.11aC12∶0----46.82±0.89a47.20±0.48aC14∶00.10±0.04c0.10±0.02c0.12±0.04c0.08±0.01c20.39±0.19b21.09±0.19aC16∶04.04±0.03c4.17±0.08c12.37±0.03b12.85±0.15a12.07±0.41b12.09±0.21bC16∶10.30±0.01a0.22±0.01b0.19±0.06b0.11±0.02c0.12±0.03c0.05±0.01dC18∶02.02±0.03b2.07±0.03b1.95±0.05b1.99±0.07b3.85±0.20a3.70±0.12aC18∶166.57±0.03a65.02±0.20b29.05±0.07c28.64±0.05c8.98±0.40d8.49±0.30eC18∶217.61±0.09c18.23±0.20b54.05±0.10a54.26±0.10a1.85±0.07d1.72±0.06dC18∶36.83±0.06b7.57±0.03a0.97±0.08c0.90±0.04c--C20∶00.72±0.01a0.73±0.01a0.51±0.02b0.47±0.00b0.24±0.07c0.13±0.01eC20∶11.36±0.02a1.47±0.04a0.62±0.21b0.45±0.04b0.48±0.24b0.14±0.03cC22∶00.45±0.09a0.42±0.02a0.17±0.06b0.25±0.03b--饱和脂肪酸7.32±0.07e7.49±0.02e15.12±0.04d15.64±0.11c88.57±0.28b89.60±0.35a单不饱和脂肪酸68.24±0.05f66.71±0.23e29.86±0.22d29.21±0.05c9.58±0.28b8.68±0.29a多不饱和脂肪酸24.44±0.10c25.8±0.22b55.02±0.18a55.15±0.14a1.85±0.07d1.72±0.06d
注:“-”表示未检出;同行数据不同字母上标表示差异具有显著性(P<0.05)。
2.4 油脂氧化程度的变化
为了分析油脂氧化与MCPD酯和GEs含量是否存在关联,同时也监测了样品加热过程中的氧化程度。由于高温处理的油中共轭二烯(conjugated dienes,CD)和茴香胺值与其总极性含量(total polar compounds,TPC)有良好的相关性[22],共轭三烯(conjugated trienes,CT)也能反映油脂的氧化程度,且CD、CT和茴香胺值的测定方法更简单、更快速,能分别反映油脂的初级氧化和次级氧化程度,因此采用测定CD、CT和茴香胺值来监测氧化程度,其中CD和CT通过测定油脂在232 nm(K232)、268 nm(K268)下的紫外吸收值来表征。
如图4所示,不同温度条件下,玉米油烘焙模拟体系中CD(图4-a)、CT(图4-b)含量都随着加热时间先增加后减少,茴香胺值(图4-c)随着时间增加而增加,并从15 min开始迅速攀升,说明大约在15 min时大量初级氧化产物开始加速氧化生成次级氧化产物。
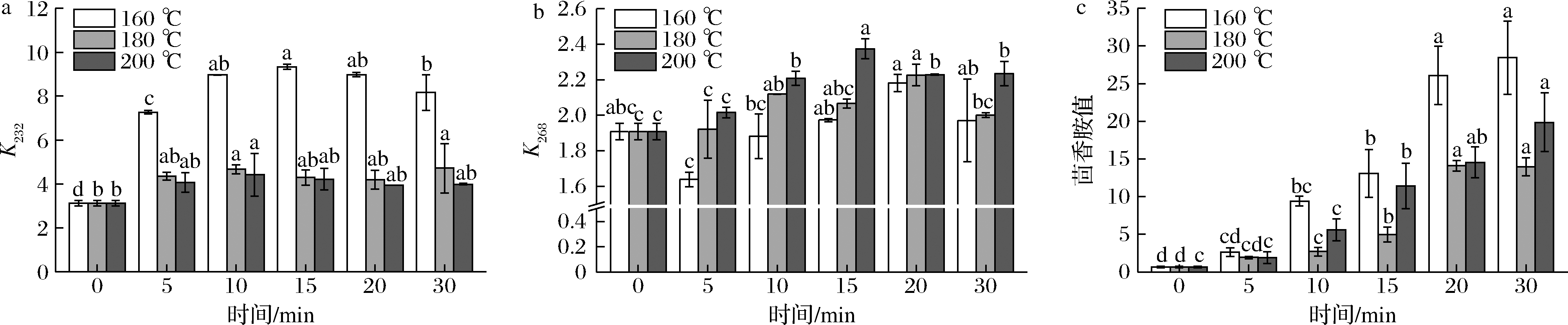
a-232 nm下的紫外吸收值;b-268 nm下的紫外吸收值;c-茴香胺值
图4 不同温度条件下油脂氧化程度的变化
Fig.4 Changes in the degree of oil oxidation at different temperatures
注:小写字母代表不同加热时间的样品在同一温度条件下的显著性差异(P<0.05)。
对玉米油不同油水比条件下的烘焙模拟体系(200 ℃加热30 min)的氧化程度测定结果如图5,油水比对CD和CT含量无影响,但对茴香胺值影响显著,油占比越大,茴香胺值越小,说明低水分环境能限制次级氧化产物的生成。
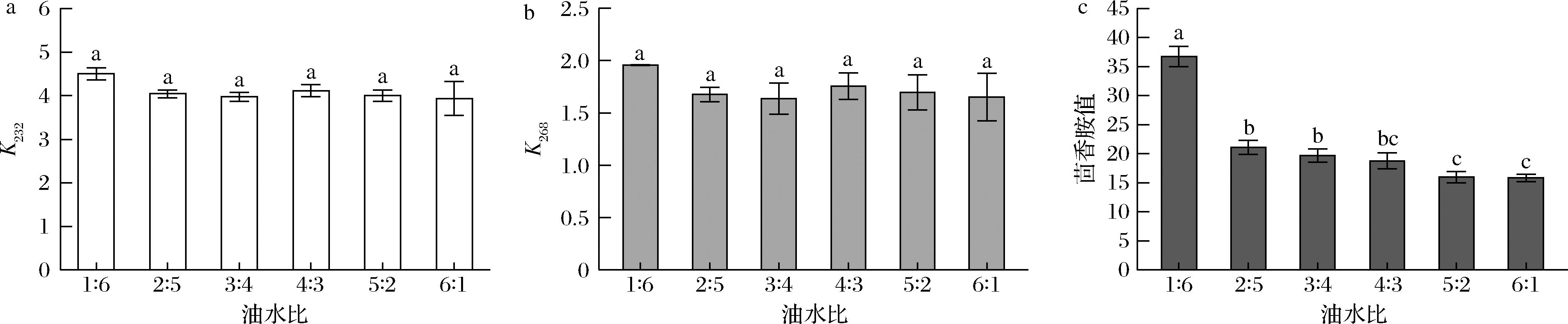
a-232 nm下的紫外吸收值;b-268 nm下的紫外吸收值;c-茴香胺值
图5 油水比对油脂氧化的影响
Fig.5 Effects of oil-water ratio on the oil oxidation
注:小写字母代表不同油水比样品的显著性差异(P<0.05)。
含不同油脂的烘焙模拟体系中油脂氧化的变化如图6所示,随着加热时间的延长,CT和茴香胺值都不断增加,但CD的变化规律有所区别,如图6-a所示,椰子油的CD早在加热5 min时达到峰值(3.271±0.891),玉米油在加热10 min出现拐点(4.424±0.966),而菜籽油在30 min时CD仍在增加,达5.887±0.954,可见不饱和脂肪酸含量越高的油脂初级氧化持续的时间越长。

a-232 nm下的紫外吸收值;b-268 nm下的紫外吸收值;c-茴香胺值
图6 不同烘焙模拟体系中油脂氧化程度的变化
Fig.6 Changes in the degree of oil oxidation in different baking models
注:小写字母代表不同加热时间的样品在同一烘焙模拟体系中的显著性差异(P<0.05)。
2.5 单氯丙醇酯和缩水甘油酯与油脂氧化的相关性分析
为了明确MCPD酯和GEs生成与油脂氧化之间的关系,以玉米油烘焙模拟体系为参考,对3-MCPD酯、2-MCPD酯、GEs含量与氧化指标做了Spearman相关性分析。结果如图7所示,3-MCPD酯与2-MCPD酯呈正相关(P<0.01),相关系数高达0.802,与CD值(K232)相关系数为-0.640,呈负相关(P<0.01);2-MCPD酯与CT值(K268)、茴香胺值均呈负相关(P<0.05);GEs与CD值呈正相关(P<0.01)。玉米油氧化程度越高,3-MCPD酯和2-MCPD酯含量反而越低,但初级氧化程度越高,GEs含量越高,可能是因为油脂在氧化的同时能限制MCPD酯的降解和GEs的生成,随着氧化程度增加,MCPD酯的降解反应和GEs的生成反应不再受限,导致MCPD酯和GEs含量分别减少和增加,与图3中菜籽油体系加热初期MCPD酯降解和GEs生成受限制的猜测相呼应,因此可以进一步推测,不饱和脂肪酸含量高的菜籽油更易氧化,对加热初期模拟体系中MCPD酯降解和GEs生成产生了更强的抑制效果。
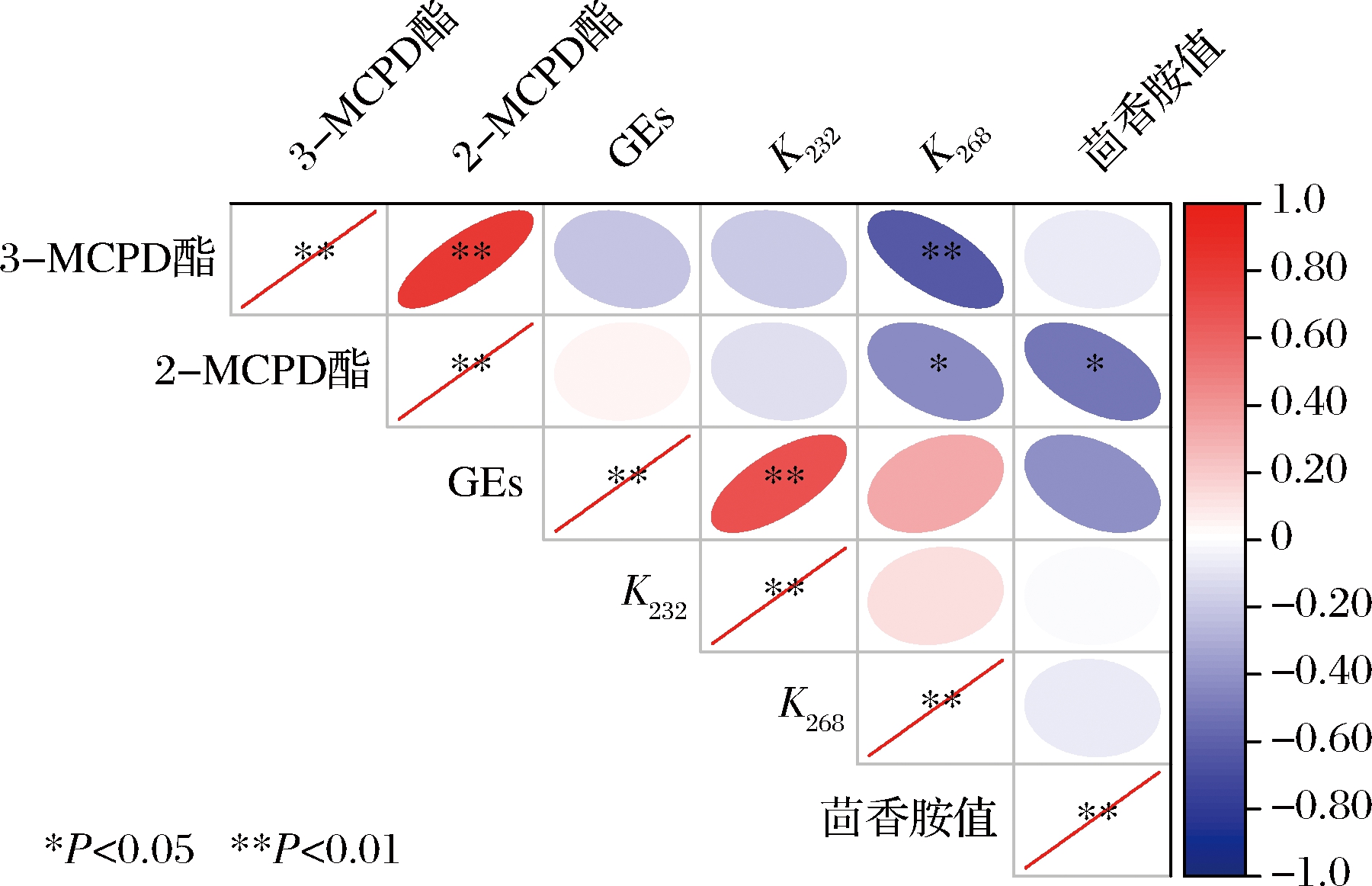
图7 玉米油烘焙模拟体系MCPD酯和GEs与油脂氧化程度的相关性分析
Fig.7 Correlation between the content of MCPD esters and GEs and the degree of oil oxidation in the baking models with maize oil
3 结论
通过对烘焙模拟体系加热过程的监测,发现MCPD酯和GEs都同时进行着生成与降解反应。加工条件是影响烘焙模拟体系中3-MCPD酯、2-MCPD酯和GEs含量的重要因素,其中温度和时间能显著影响这3种物质的含量,且存在交互作用,油水比也是MCPD酯生成的影响因素,但不影响GEs的生成。此外,油脂种类对MCPD酯和GEs的生成具有重要作用,并可能受其脂肪酸组成的影响,其中不饱和脂肪酸含量为92.68%的菜籽油能产生更高含量的MCPD酯和较低含量的GEs,而玉米油烘焙模拟体系中油脂氧化程度与MCPD酯和GEs之间存在显著的相关性,由此推测富含不饱和脂肪酸的油脂能通过自身氧化抑制MCPD酯的降解和GEs的生成。本研究结果为控制烘焙食品中MCPD酯和GEs提供了理论参考,另外,烘焙体系中蛋白的存在是否会影响MCPD酯和GEs的生成以及油脂氧化涉及影响MCPD酯和GEs降解或生成的具体机理还有待进一步探索。
[1] 王缘. 新消费时代下烘焙品牌好利来转型路径研究[J].产业创新研究, 2022(3):117-119.
WANG Y.Research on the transformation path of Holiland, a baking brand in the new consumption era[J].Industrial Innovation, 2022(3):117-119.
[2] 李彦生, 张婷, 刘建辉, 等.多种油脂性食品中氯丙醇酯的检测及暴露危险分析[J].食品安全质量检测学报, 2017, 8(10):3841-3845.
LI Y S, ZHANG T, LIU J H, et al.Determination and exposure risk analysis of chloropropanols esters in a variety of fat-rich foods[J].Journal of Food Safety &Quality, 2017, 8(10):3841-3845.
[3] 宋迎春, 周鸿, 袁娅, 等.江西省焙烤及油炸食品中氯丙醇酯污染调查及暴露风险评估[J].应用预防医学, 2022, 28(3):237-240.
SONG Y C, ZHOU H, YUAN Y, et al.Investigation and exposure risk assessment of chloropropanol esters in baked and fried foods in Jiangxi Province[J].Applied Preventive Medicine, 2022, 28(3):237-240.
[4] ZHANG H X, CHEN J A, HUANG L C, et al.Occurrence and risk assessment of 3- and 2-monochloropropanediol (MCPD) esters in vegetable oils and related products from Zhejiang market[J].Food Additives &Contaminants:Part A, 2020, 37(6):931-937.
[5] 郭蓉, 王玮, 李敏, 等.陕西省市售食用植物油及油脂类食品中脂肪酸氯丙醇酯的污染水平调查与暴露风险评估[J].卫生研究, 2019, 48(3):493-498;503.
GUO R, WANG W, LI M, et al.Contamination and dietary exposure assessment of fatty acid esters of chloropropanediols in vegetable oil and fat-rich food in Shaanxi Province[J].Journal of Hygiene Research, 2019, 48(3):493-498;503.
[6] 熊丽, 周鸿, 梁健.江西省市售四类食品中3-氯丙醇酯污染水平调查与分析[J].现代预防医学, 2017, 44(21):3883-3886.
XIONG L, ZHOU H, LIANG J.Pollution levels of 3-chloro-1, 2-propanediol esters in 4 kinds of commercially available food, Jiangxi[J].Modern Preventive Medicine, 2017, 44(21):3883-3886.
[7] 李荷丽, 程雅晴, 贝君, 等.食品中氯丙醇脂肪酸酯风险及应对措施概述[J].食品安全质量检测学报, 2021, 12(17):7043-7051.
LI H L, CHENG Y Q, BEI J, et al.Review on risk and countermeasures of chloropropanol esters in foodstuffs[J].Journal of Food Safety &Quality, 2021, 12(17):7043-7051.
[8] COLLIER P D, CROMIE D D O, DAVIES A P.Mechanism of formation of chloropropanols present in protein hydrolysates[J].Journal of the American Oil Chemists Society, 1991, 68(10):785-790.
[9] RAHN A K K, YAYLAYAN V A.Monitoring cyclic acyloxonium ion formation in palmitin systems using infrared spectroscopy and isotope labelling technique[J].European Journal of Lipid Science and Technology, 2011, 113(3):330-334.
[10] ZHANG X W, GAO B Y, QIN F, et al.Free radical mediated formation of 3-monochloropropanediol (3-MCPD) fatty acid diesters[J].Journal of Agricultural and Food Chemistry, 2013, 61(10):2548-2555.
[11] ZHAO Y E, ZHANG Y Q, ZHANG Z F, et al.Formation of 3-MCPD fatty acid esters from monostearoyl glycerol and the thermal stability of 3-MCPD monoesters[J].Journal of Agricultural and Food Chemistry, 2016, 64(46):8918-8926.
[12] SONNET P E.A short highly regio- and stereoselective synthesis of triacylglycerols[J].Chemistry and Physics of Lipids, 1991, 58(1-2):35-39.
[13] 李昌. 油脂中3-氯丙醇酯的暴露评估及其在热加工过程中的形成机理和控制[D].南昌:南昌大学, 2015.
LI C.Exposure evaluation of 3-chloropropanol ester in oil and its formation mechanism and control during thermal processing[D].Nanchang:Nanchang University, 2015.
[14] ERMACORA A, HRNCIRIK K.Study on the thermal degradation of 3-MCPD esters in model systems simulating deodorization of vegetable oils[J].Food Chemistry, 2014, 150:158-163.
[15] 李庆云. 热处理大豆分离蛋白乳浊液中油脂氧化与蛋白氧化相互作用关系研究[D].广州:华南理工大学, 2016.
LI Q Y.The study of the relationship between protein oxidation and lipid oxidation in the heat-treated soy protein isolate stabilized emulsions[D].Guangzhou:South China University of Technology, 2016.
[16] SADOWSKA-ROCIEK A, CIE LIK E, FLORKIEWICZ A.Formation of free and bound 3-monochloropropane-1, 2-diol in fat-rich cereal model systems:The impact of flour composition[J].Chemical Papers, 2018, 72(2):497-507.
LIK E, FLORKIEWICZ A.Formation of free and bound 3-monochloropropane-1, 2-diol in fat-rich cereal model systems:The impact of flour composition[J].Chemical Papers, 2018, 72(2):497-507.
[17] 焦文娟. 脂肪晶体结构对脂肪结晶乳液消化性能的影响及机理研究[D].广州:华南理工大学, 2020.
JIAO W J.Effect of fat crystal structure on digestibility of fat crystal emulsion and its mechanism[D].Guangzhou:South China University of Technology, 2020.
[18] 张渊博, 王小三, 刘睿杰, 等.高油酸葵花籽油煎炸过程中MCPD酯及缩水甘油酯的变化[J].中国油脂, 2018, 43(7):87-91.
ZHANG Y B, WANG X S, LIU R J, et al.Changes of MCPD esters and glycidyl esters in high-oleic acid sunflower seed oil during frying[J].China Oils and Fats, 2018, 43(7):87-91.
[19] LI C, LI L Y, JIA H B, et al.Formation and reduction of 3-monochloropropane-1, 2-diol esters in peanut oil during physical refining[J].Food Chemistry, 2016, 199:605-611.
[20] 贾雪颖, 黄明泉, 张雨萌, 等.食用油与氯化钠模型反应中氯丙醇酯的消长规律[J].食品与发酵工业, 2021, 47(7):86-93.
JIA X Y, HUANG M Q, ZHANG Y M, et al.Influence of process parameters on 3-MCPD and 2-MCPD esters in model reaction of edible oil and sodium chloride[J].Food and Fermentation Industries, 2021, 47(7):86-93.
[21] 曹睿智. 油脂中3-氯丙醇酯的生成机制研究[D].天津:天津科技大学, 2019.
CAO R Z.Study on the formation mechanism of 3-chloropropanol esters in oils and fats[D].Tianjin:Tianjin University of Science &Technology, 2019.
[22] WONG Y H, GOH K M, NYAM K L, et al.Monitoring of heat-induced carcinogenic compounds (3-monochloropropane-1,2-diol esters and glycidyl esters) in fries[J].Scientific Reports, 2020, 10(1):15110.