海参(Stichopus japonicus)属于棘皮动物门海参纲,是我国重要的经济水产品,年产值达千亿元人民币[1]。海参体壁主要由胶原蛋白、蛋白聚糖和糖蛋白组成[2],作为高蛋白低脂肪的水产品,海参已被证实具有免疫调节[3]、神经保护[4]、抗疲劳[5]和抗氧化[6]等多种生物活性。随着消费者对合理膳食结构和健康生活方式的追求,海参产品越来越受到市场的青睐,产业链不断壮大。2021年我国刺参养殖面积达24.74万hm2,养殖产量22.27万t[7]。由于极易自溶,海参多数是以加工产品的方式销售,目前市场上主要产品形式为干海参和即食海参。干海参水分含量低,利于长期贮藏且便于运输,但食用前需要较为复杂的复水处理。即食海参属于预制菜的一种,因其食用方便且兼顾了营养与便利而受到消费者的欢迎,但即食海参通常需要冷冻保存,在常温甚至冷藏条件下海参体壁极易出现品质劣变的现象,影响了其市场占有率。目前已有部分针对即食海参贮藏期间变化的相关研究[8-9],但样品处理均在实验室完成,与实际生产有一定差异。本文拟通过对4 ℃条件下市售即食海参体壁品质变化规律的研究,探究影响即食海参贮藏稳定性的原因,旨在为即食海参的稳定化加工及贮藏提供理论依据。
1 材料与方法
1.1 材料与试剂
原料:即食海参80只,每只质量约50~60 g,购于大连市某海参加工企业。新鲜海参经解剖、盐煮、泡发、速冻、包装后冷冻保存,保温箱加冰袋密封3 h内运送至实验室。
H型氨基酸混合标准溶液(每种氨基酸浓度2.50 μmol/mL,日本和光纯药工业株式会社);羟脯氨酸标准品、一水合柠檬酸、无水乙酸钠、氯胺T、对二氨基苯甲醛,阿拉丁生化科技股份有限公司;海参组织蛋白酶L测定试剂盒,上海酶联生物有限公司;其他化学试剂均为国产分析纯。
1.2 仪器与设备
ME204分析天平、HB43-S水分测定仪、FE20K酸度计,瑞士梅特勒托利多科技有限公司;LG-1.0真空冷冻干燥机,沈阳航天新阳速冻设备制造有限公司;PEN3电子鼻,德国Airsense公司;TA.XT Plus物性测试仪,英国Stable Micro System公司;Spectra Max Plus384酶标仪,美国美谷分子仪器有限公司;SX700高压蒸汽灭菌器,日本多美数字生物公司;SW-CJ-2FD超净工作台,苏州安泰空气技术有限公司;IN612C低温培养箱,日本雅马拓科技株式会社;L-8900全自动氨基酸分析仪、SU810扫描电子显微镜,日本株式会社日立制作所。
1.3 实验方法
1.3.1 样品的贮藏
将即食海参样品分为8组,每组10只,在4 ℃条件下贮藏14 d,每2 d取一次样,拍照记录海参形态。
1.3.2 质量损失率的测定
将样品放入培养皿中,分别测定样品总质量、体壁质量和液体质量,质量损失率按公式(1)计算:
(1)
式中:M,质量损失率,%;m1,液体质量,g;m,样品总质量,g。
1.3.3 水分含量的测定
采用快速水分测定仪对样品水分进行测定。称取3.0 g样品,采用标准升温程序在105 ℃条件下进行干燥,每组做3个平行。
1.3.4 菌落总数的测定
采用GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》中的方法进行,25 g样品加入225 mL无菌生理盐水,均质后进行梯度稀释,取1 mL稀释液加入平板并倒入20 mL平板计数琼脂,混匀,待琼脂凝固后将平板倒置于30 ℃条件下培养72 h后进行计数,按公式(2)计算:
(2)
式中:N,样品中菌落总数, CFU/g;∑C,平板菌落数之和;n1,第一稀释度平板个数:n2,第二稀释度平板个数;d,稀释因子。
1.3.5 pH值的测定
采用GB 5009.237—2016 《食品安全国家标准 食品pH值的测定》中的方法,称取10 g绞碎样品,加入新煮沸后冷却的水至100 mL,摇匀,浸渍30 min,6 000 r/min离心10 min,取50 mL上清液于100 mL烧杯中测定pH值。
1.3.6 组织蛋白酶L活力的测定
采用酶联免疫法测定样品组织蛋白酶活性。将样品用生理盐水稀释并捣碎后,于3 000 r/min离心10 min,将一定浓度的上清液加入预先包被组织蛋白酶抗体的微孔中,加入辣根过氧化物酶标记的抗体,37 ℃孵育60 min,加入显色剂,37 ℃避光孵育15 min,加入终止液,在450 nm处测定OD值,按曲线方程计算样品浓度。
1.3.7 质构的测定
取海参背部中间一块表面积1.5 cm×1.5 cm的体壁,将表面的疣足修理平整后进行测定。选用P/0.5柱形探头,形变量50%,感应力5 g。测前、测中、测后速度均为0.5 mm/s。
1.3.8 挥发性物质的测定
准确称取3 g匀浆后的样品置于40 mL的顶空瓶内,加盖密封,37 ℃孵育30 min后进行测定,每组3个平行。样品采集时间120 s、自动调零时间10 s、样品准备时间5 s、进样流量300 mL/min,传感器清洗时间200 s。
1.3.9 胶原蛋白含量的测定
参考PROCKOP等[10]的方法。样品水解过滤后,蒸至剩余约1滴后进行定容,加入氯胺T与显色剂,在558 nm处测定吸光值,计算羟脯氨酸的含量,并最终换算成胶原蛋白的含量,换算系数为11.1。
1.3.10 氨基酸含量的测定
游离氨基酸含量参考张苏平等[11]的方法。取一定量样品,加入少量0.02 mol/L 盐酸溶解并定容至25 mL,超声波提取20 min,6 000 r/min离心10 min,上清液过0.22 μm膜后,采用全自动氨基酸分析仪进行测定。
氨基酸总量的测定采用GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》中酸水解方法。样品加入6 mol/L 盐酸后,110 ℃条件下水解22 h,经过滤、定容、浓缩后,采用全自动氨基酸分析仪进行测定。
1.3.11 扫描电镜观察微观结构
取海参背部中间1 mm×1 mm×3 mm左右大小样品,2.5%戊二醛固定12 h后,0.1 mol/L磷酸缓冲液漂洗。乙醇梯度脱水(30%、50%、70%、80%、100%),二氧化碳临界点干燥,离子喷金镀膜后在扫描电子显微镜下观察[12]。
1.4 数据处理方法
采用统计软件SPSS Statistics 22.0进行数据处理和显著性差异分析,P<0.05为显著水平。
2 结果与分析
2.1 即食海参贮藏过程中形态的变化
如图1所示,贮藏0 d时,海参肉质饱满、疣足挺拔、表皮完整、弹性较好,有少量汁水。随着贮藏时间的延长,体壁内液体不断析出,同时体积缩小,但在整个贮藏期内形态均较为完整。在贮藏1周后,体积缩小明显,汁水大量析出,杂质变多。贮藏10 d后,体壁上的疣足开始分解,出现部分残缺,14 d时表皮开始变软、变黏,色泽变化不大。

图1 即食海参4 ℃贮藏期间形态变化
Fig.1 Changes in body wall morphology of instant sea cucumber during storage at 4 ℃
2.2 即食海参贮藏过程中质量损失率的变化
如图2所示,新鲜即食海参质量约为50 g,随着汁液的不断流失,贮藏8 d质量降至40 g以下,而后迅速下降并在12 d后降至30 g左右。加工过程中的高温加热会使海参体壁的胶原蛋白变性,使胶原纤维形成交联的网络结构[13],内部出现气孔[14],泡发过程中,这些结构会不断吸水使海参体积不断增大,吸水能力增加。即食海参的初始质量损失率约为6.59%,4 ℃条件下,体壁蛋白降解,组织内水分的流动性增强,组织对水分的束缚力逐渐减弱,质量损失率迅速增加,在贮藏6 d时质量损失率达21.85%,在贮藏14 d时达到40.27%。

图2 即食海参4 ℃贮藏期间质量损失率的变化
Fig.2 Mass loss rate changes of instant sea cucumber during storage at 4 ℃
2.3 即食海参贮藏过程中水分含量的变化
如图3所示,随着贮藏时间的延长,体壁含水量呈现缓慢下降的趋势,从96.32%降至93.62%。体壁内游离水增加、结合水降低[15],可溶性成分随水从涨发变大的组织间隙流出,导致海参组织劣化。
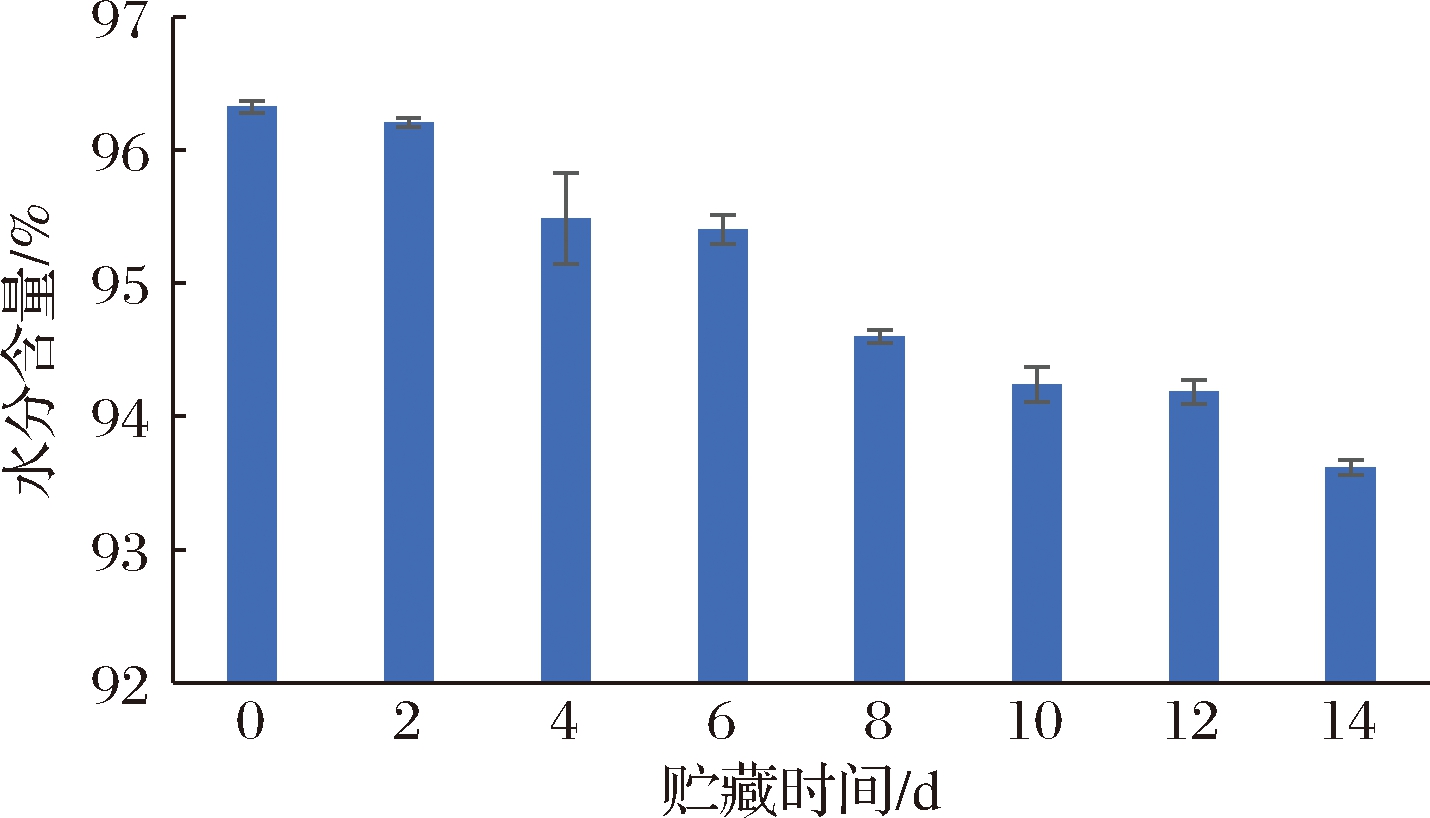
图3 即食海参4 ℃贮藏期间水分含量的变化
Fig.3 Water content changes of instant sea cucumber during storage at 4 ℃
2.4 即食海参贮藏过程中菌落总数的变化
如图4所示,贮藏2 d时菌落总数与新鲜海参相差不大,维持在6×105 CFU/g左右,而后部分微生物在冷藏和高水分条件下开始恢复代谢,加速生长,在贮藏6 d时增加到2.3×106 CFU/g,已知细菌总数105 CFU/cm2的鱼体在0 ℃条件下保质期约为6 d,即食海参在贮藏1周后食用价值也大大降低。当菌落总数大于5×106 CFU/g时表示肉已变质[16],在贮藏14 d时,菌落总数增加了约5倍,达到3.7×106 CFU/g,体壁黏软有异味。

图4 即食海参4 ℃贮藏期间菌落总数的变化
Fig.4 Total number of bacterial colony changes in instant sea cucumber during storage at 4 ℃
2.5 即食海参贮藏过程中pH的变化
如图5所示,一般食品中pH变化多呈V字形改变,在腐败开始时略微降低,随后由于微生物对蛋白质的分解产生氨类和三甲胺等碱性物质导致pH上升[17]。即食海参的pH值在贮藏期内从初始的8.73降到6.88,并未出现升高,表明产品并未出现严重腐败现象。

图5 即食海参4 ℃贮藏期间pH值的变化
Fig.5 pH value changes of instant sea cucumber during storage at 4 ℃
2.6 即食海参贮藏过程中组织蛋白酶L活力的变化
研究发现,内源酶中的组织蛋白酶对肉制品的品质变化有重要影响[8]。海参因含有丰富的内源酶而具有较强的自溶能力[18],新鲜海参的组织蛋白酶L活力通常在3 000 U/mg以上。已有研究表明组织蛋白酶L会间接影响胶原蛋白的降解[19]。如图6所示,本研究中的即食海参样品的组织蛋白酶在贮藏期内均维持在很低的水平,从初始的149.28 U/mg缓慢降至113.11 U/mg,变化不大。推测其已经在加工过程中遭到破坏,考虑其并不是引起即食海参品质变化的主要因素。
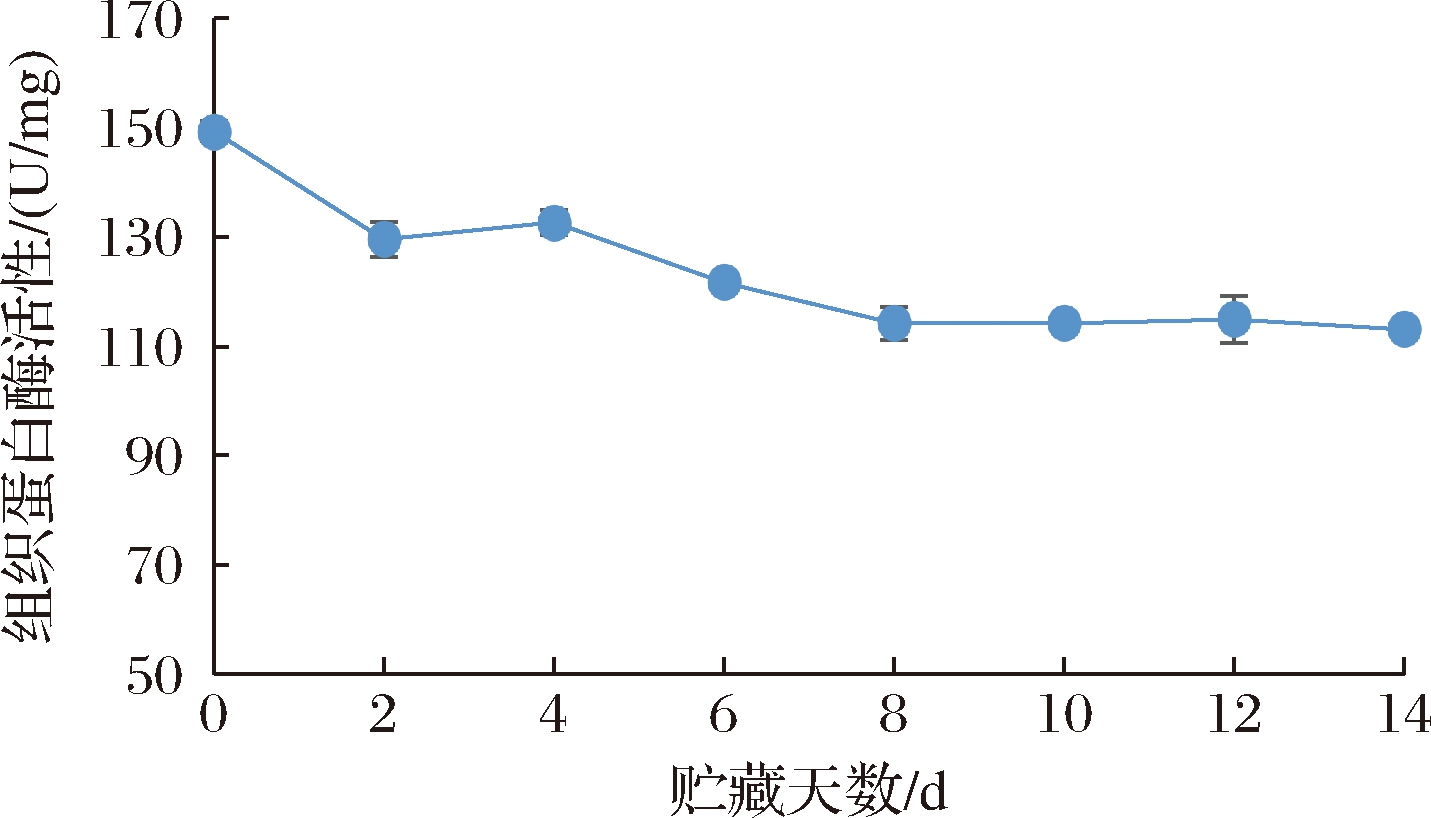
图6 即食海参4 ℃贮藏期间组织蛋白酶L活力的变化
Fig.6 Cathepsin L activity changes of instant sea cucumber during storage at 4 ℃
2.7 即食海参贮藏过程中质构特性的变化
选用柱形探头对样品进行2次挤压来模拟人嘴巴的咬合动作,探究贮藏过程中即食海参被咀嚼时的变化。如表1所示,共检测出硬度、弹性、内聚性、胶黏性、咀嚼性、回复性6个指标,脆性、粘连性和黏性3个指标未测出,说明即食海参体壁在挤压过程中没有出现破碎,同时也没有和探头产生粘连现象。结果显示,海参的硬度、胶黏性和咀嚼性与贮藏时间总体呈负相关,弹性和内聚性与贮藏时间则呈正相关。
表1 即食海参4 ℃贮藏期间质构特性的变化Table 1 Texture properties changes of instant sea cucumber during storage at 4 ℃
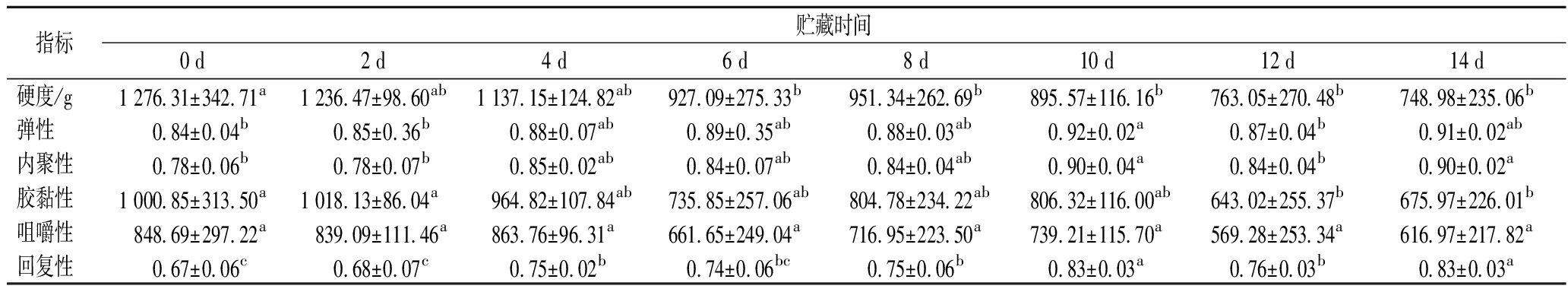
指标贮藏时间0 d2 d4 d6 d8 d10 d12 d14 d硬度/g1 276.31±342.71a1 236.47±98.60ab1 137.15±124.82ab927.09±275.33b951.34±262.69b895.57±116.16b763.05±270.48b748.98±235.06b弹性0.84±0.04b0.85±0.36b0.88±0.07ab0.89±0.35ab0.88±0.03ab0.92±0.02a0.87±0.04b0.91±0.02ab内聚性0.78±0.06b0.78±0.07b0.85±0.02ab0.84±0.07ab0.84±0.04ab0.90±0.04a0.84±0.04b0.90±0.02a胶黏性1 000.85±313.50a1 018.13±86.04a964.82±107.84ab735.85±257.06ab804.78±234.22ab806.32±116.00ab643.02±255.37b675.97±226.01b咀嚼性848.69±297.22a839.09±111.46a863.76±96.31a661.65±249.04a716.95±223.50a739.21±115.70a569.28±253.34a616.97±217.82a回复性0.67±0.06c0.68±0.07c0.75±0.02b0.74±0.06bc0.75±0.06b0.83±0.03a0.76±0.03b0.83±0.03a
注:同一行不同字母代表差异显著(P<0.05)(下同)。
硬度从很大程度上决定了海参的口感,硬度过大,不易咀嚼和消化吸收,硬度过小,肉质绵软,没有劲道。贮藏前即食海参硬度为(1 276.31±342.71) g,前4 d硬度变化不显著,6 d时下降显著(P<0.05)而后缓慢下降至(748.98±235.06) g。咀嚼性是弹性与胶黏性的乘积,表示咀嚼即食海参所需的能量,在贮藏期间呈缓慢下降的趋势但差异不显著(P>0.05)。林琳等[20]的研究表明,贮藏过程中即食海参的硬度和咀嚼性均呈下降趋势。弹性是指海参体壁变形后恢复原状的能力。内聚性是使体壁聚在一起的能力,贮藏0 d时,海参体壁挤压后能恢复到原来的84%,内聚性为0.78,随着贮藏时间的延长,汁液不断流失,弹性和内聚性缓慢上升,贮藏14 d时可恢复到原来的91%,内聚性升高到0.90,可见持水力的降低对即食海参贮藏过程中的弹性有较大影响。加工方式和复水条件都对持水力有较大的影响[21]。回复性在某种程度上可以理解为韧性,是指第一次下压时,样品原面积与形变之后面积的比值。回复性在0~2 d较为稳定,在贮藏4 d和10 d时出现显著增加(P<0.05)。
2.8 即食海参贮藏过程中挥发性物质的变化
海参蛋白质含量丰富,其腐败变质主要以蛋白质的分解为特征,分解产物多数具有挥发性,因此通过电子鼻模拟嗅觉系统测定挥发物质的变化,收集气味指纹数据,能够从气味角度了解蛋白降解情况[22]。含硫化合物的阈值和浓度对水产品的气味特征有重要影响[23]。由图7可知,即食海参在贮藏前6 d的主要挥发性物质为无机硫化物,还含有少量的有机硫化物和氮氧化合物。随着贮藏时间的延长,海参中的蛋白质在微生物的作用下发生降解,生成醛、酮、酸和含硫的小分子化合物[24],并不断积累,从8 d开始,含甲基类化合物、无机硫化物和醇类、酮类物质逐渐增多,氮氧化合物则相应减少。

W1C-芳香成分,苯类;W5S-氮氧化合物;W3C-芳香族成分,氨类;W6S-氢化物;W5C-短链烷烃芳香成分;W1S-甲基类;W1W-硫化物;W2S-醇类、酮类;W2W-芳香成分,有机硫化物;W3S-长链烷烃
图7 即食海参4 ℃贮藏期间挥发性物质的变化
Fig.7 Volatile substances changes of instant sea cucumber during storage at 4 ℃
2.9 即食海参贮藏过程中胶原蛋白含量的变化
在14 d贮藏期内,各组样品的胶原蛋白含量为27.27%~31.15%(表2),无明显规律。显著性分析结果表明,贮藏时间对胶原蛋白含量的影响不显著。赵园园等[9]研究表明即食海参体壁胶原蛋白在15 d后开始快速降解。胶原蛋白含量的测定是通过测定样品中羟脯氨酸的含量进而换算出胶原蛋白含量,说明各组样品的胶原蛋白未发生明显水解或降解为多肽或羟脯氨酸阶段而未进一步降解。
表2 即食海参4 ℃贮藏期间胶原蛋白含量(干基)
Table 2 Collagen content changes of in instant sea cucumber during storage at 4 ℃(dry basis)
贮藏时间/d02468101214胶原蛋白含量/%27.50±0.18d27.51±0.25d31.15±0.27a29.88±0.80b30.75±0.48a28.31±0.31c27.27±0.15d29.44±0.40b
2.10 即食海参贮藏过程中氨基酸种类及含量的变化
以游离状态存在的氨基酸的种类和含量的变化能够反映出蛋白质降解的水平和程度[25]。如表3所示,氨基酸种类和含量在贮藏期内均呈现不断增加的趋势。在贮藏前6 d,主要检测到以Glu、Phe和Gly为主的7~9种氨基酸,在贮藏12 d时氨基酸种类增加到16种。游离氨基酸总量在0~10 d以平均每2 d 10 mg/100 g的速度递增。10 d以后游离氨基酸总量迅速增加,14 d时达到(107.73±1.21) mg/100 g,说明样品在贮藏10 d后开始加速分解。
表3 即食海参4 ℃贮藏期间游离氨基酸种类及含量的变化(干基) 单位:mg/100 g
Table 3 Free amino acid species and contents changes of instant sea cucumber during storage at 4 ℃(dry basis)

种类贮藏时间0 d2 d4 d6 d8 d10 d12 d14 d蛋氨酸Met---1.95±0.12d0.61±0.00e2.99±0.14b4.54±0.09a2.62±0.01c苯丙氨酸Phe-5.09±0.02g10.92±0.33f15.19±0.39e21.87±0.57d23.51±0.25c28.56±0.43b52.21±0.76a异亮氨酸Ile-----0.57±0.02c1.89±0.05a1.37±0.03b缬氨酸Val1.02±0.01h2.54±0.01f2.35±0.04g5.32±0.00c3.89±0.01e6.93±0.10b7.66±0.05a4.75±0.02d苏氨酸Thr-0.47±0.02c0.85±0.00bc0.51±0.02c1.10±0.50bc1.15±0.01b2.47±0.01a2.08±0.01a亮氨酸Leu-----1.32±0.01b3.40±0.07a3.51±0.01a赖氨酸Lys0.41±0.00e0.75±0.03e0.27±0.00e2.97±0.07d3.84±0.54c3.97±0.02c6.34±0.47a5.28±0.07b丙氨酸Ala0.48±0.01g0.61±0.02f0.51±0.02fg1.12±0.00e1.35±0.07d1.84±0.03c3.11±0.02b4.93±0.05a精氨酸Arg0.99±0.02c2.05±0.13a0.38±0.061.35±0.03b-0.88±0.17c0.87±0.00c0.88±0.06c
续表3

种类贮藏时间0 d2 d4 d6 d8 d10 d12 d14 d甘氨酸Gly0.93±0.00f1.03±0.00f1.32±0.01e3.94±0.04d3.76±0.13d5.96±0.10c11.77±0.05a 8.65±0.02b天冬氨酸Asp----0.15±0.06a-0.19±0.02a0.21±0.00a谷氨酸Glu4.49±0.32b6.14±1.40b8.12±0.01b4.71±0.02b9.02±2.88ab9.52±0.01ab10.26±0.03ab12.12±0.14a胱氨酸Cys------2.17±0.01a2.61±0.01a酪氨酸Tyr------1.16±0.08a1.21±0.00a组氨酸His----2.01±1.28a0.78±0.05b2.49±1.22a4.42±0.23a丝氨酸Ser0.35±0.02d0.74±0.02c0.83±0.02bc- - 0.71±0.05c1.39±0.04a0.88±0.01b游离氨基酸总量8.68±0.28g19.41±1.51f25.56±0.39f37.07±0.46e47.60±6.01d60.14±0.83c88.27±2.55b107.73±1.21a游离氨基酸种类799910131616
样品经酸水解后共检测到17种氨基酸(表4),氨基酸总量为68.52~77.21 g/100 g,其中以Glu和Gly含量最高,其次为Asp和Pro,氨基酸总量没有明显变化规律。
表4 即食海参4 ℃贮藏期间氨基酸总量含量的变化(干基) 单位:g/100 g
Table 4 Total amino acid content changes of instant sea cucumber during storage at 4 ℃(dry basis)
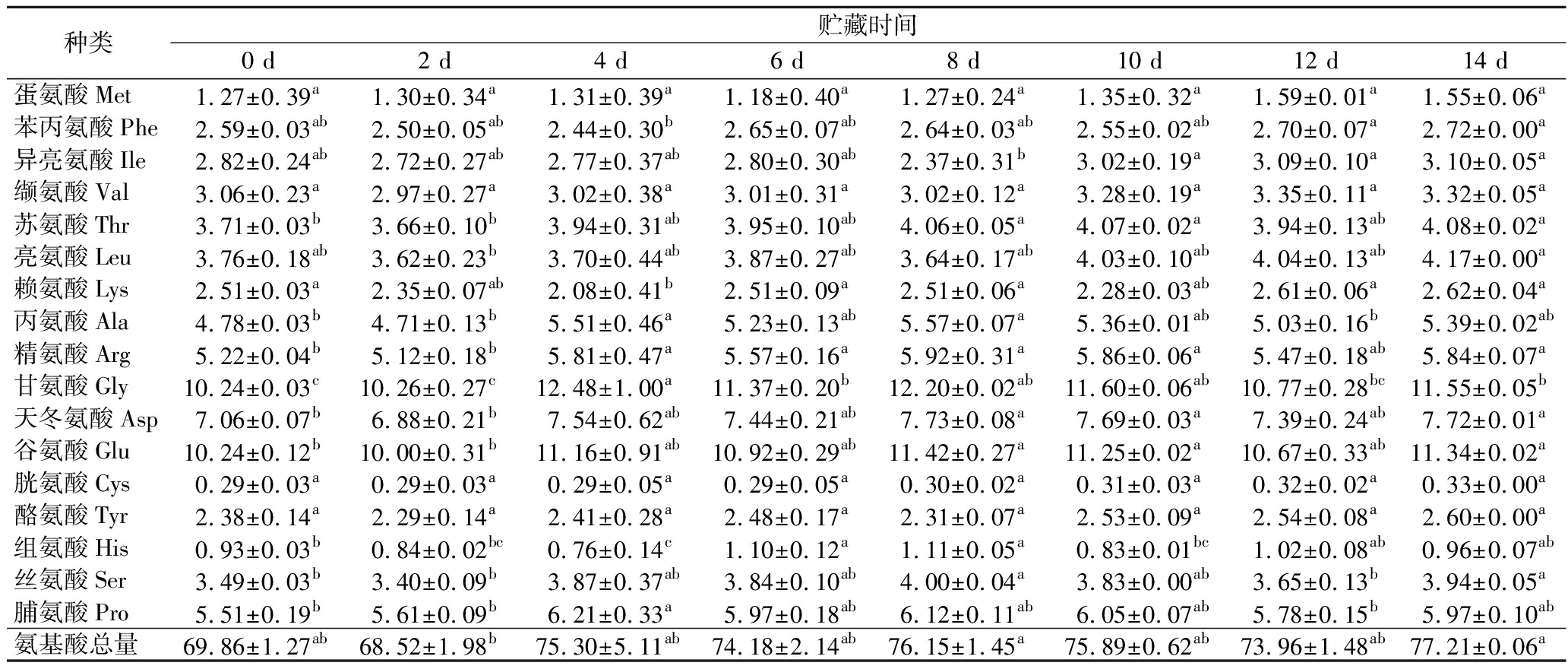
种类贮藏时间0 d2 d4 d6 d8 d10 d12 d14 d蛋氨酸Met1.27±0.39a1.30±0.34a1.31±0.39a1.18±0.40a1.27±0.24a1.35±0.32a1.59±0.01a1.55±0.06a苯丙氨酸Phe2.59±0.03ab2.50±0.05ab2.44±0.30b2.65±0.07ab2.64±0.03ab2.55±0.02ab2.70±0.07a2.72±0.00a异亮氨酸Ile2.82±0.24ab2.72±0.27ab2.77±0.37ab2.80±0.30ab2.37±0.31b3.02±0.19a3.09±0.10a3.10±0.05a缬氨酸Val3.06±0.23a2.97±0.27a3.02±0.38a3.01±0.31a3.02±0.12a3.28±0.19a3.35±0.11a3.32±0.05a苏氨酸Thr3.71±0.03b3.66±0.10b3.94±0.31ab3.95±0.10ab4.06±0.05a4.07±0.02a3.94±0.13ab4.08±0.02a亮氨酸Leu3.76±0.18ab3.62±0.23b3.70±0.44ab3.87±0.27ab3.64±0.17ab4.03±0.10ab4.04±0.13ab4.17±0.00a赖氨酸Lys2.51±0.03a2.35±0.07ab2.08±0.41b2.51±0.09a2.51±0.06a2.28±0.03ab2.61±0.06a2.62±0.04a丙氨酸Ala4.78±0.03b4.71±0.13b5.51±0.46a5.23±0.13ab5.57±0.07a5.36±0.01ab5.03±0.16b5.39±0.02ab精氨酸Arg5.22±0.04b5.12±0.18b5.81±0.47a5.57±0.16a5.92±0.31a5.86±0.06a5.47±0.18ab5.84±0.07a甘氨酸Gly10.24±0.03c10.26±0.27c12.48±1.00a11.37±0.20b12.20±0.02ab11.60±0.06ab10.77±0.28bc11.55±0.05b天冬氨酸Asp7.06±0.07b6.88±0.21b7.54±0.62ab7.44±0.21ab7.73±0.08a7.69±0.03a7.39±0.24ab7.72±0.01a谷氨酸Glu10.24±0.12b10.00±0.31b11.16±0.91ab10.92±0.29ab11.42±0.27a11.25±0.02a10.67±0.33ab11.34±0.02a胱氨酸Cys0.29±0.03a0.29±0.03a0.29±0.05a0.29±0.05a0.30±0.02a0.31±0.03a0.32±0.02a0.33±0.00a酪氨酸Tyr2.38±0.14a2.29±0.14a2.41±0.28a2.48±0.17a2.31±0.07a2.53±0.09a2.54±0.08a2.60±0.00a组氨酸His0.93±0.03b0.84±0.02bc0.76±0.14c1.10±0.12a1.11±0.05a0.83±0.01bc1.02±0.08ab0.96±0.07ab丝氨酸Ser3.49±0.03b3.40±0.09b3.87±0.37ab3.84±0.10ab4.00±0.04a3.83±0.00ab3.65±0.13b3.94±0.05a脯氨酸Pro5.51±0.19b5.61±0.09b6.21±0.33a5.97±0.18ab6.12±0.11ab6.05±0.07ab5.78±0.15b5.97±0.10ab氨基酸总量69.86±1.27ab68.52±1.98b75.30±5.11ab74.18±2.14ab76.15±1.45a75.89±0.62ab73.96±1.48ab77.21±0.06a
2.11 扫描电镜观察结果
鲜活刺参中含有粗细不等的束状纤维,纤维束间孔隙度较大[26]。即食海参加工过程中长时间的加热处理,会使束状纤维发生热收缩、卷曲、凝聚,纤维间孔隙度减小,纤维排列紧密。随着蛋白质变性程度不断增强,胶原纤维断裂,肌肉组织中的纤维变性成明胶状物质,部分纤维会聚集形成片状结构[27]。从电镜观察结果来看(图8),即食海参的纤维结构已经不是很清晰,0 d时能观察到大致的纤维结构,而后主要以凝胶状和片状结构为主,未观察到明显变化。

a-贮藏0 d;b-贮藏2 d;c-贮藏4 d;d-贮藏6 d;e-贮藏8 d;f-贮藏10 d;g-贮藏12 d;h-贮藏14 d
图8 即食海参4 ℃贮藏期间扫描电镜观察结果(×1 500)
Fig.8 Scanning electron microscope observation results of instant sea cucumber during storage at 4 ℃ (×1 500)
3 结论
即食海参在4 ℃冷藏保存6 d后品质下降明显,表现为体积缩小、硬度降低、气味变化、游离氨基酸种类增多等。影响即食海参体壁品质劣变的主要因素是微生物作用,水分的流失也对其贮藏期间的品质变化有重要影响。目前市场上绝大多数的即食海参产品均需冷冻保存,解冻后方能食用,不能做到冷藏保存、常温保存、开袋即食。因此,关于提高即食海参常温条件下贮藏稳定性的相关研究具有重要意义。
[1] 常耀光, 刘艳艳, 石菲菲, 等.海参在加工过程中的组分与食品结构变化[J].水产学报, 2022, 46(7):1129-1142.
CHANG Y G, LIU Y Y, SHI F F, et al.Changes in composition and food structure of sea cucumber during processing[J].Journal of Fisheries of China, 2022, 46(7):1129-1142.
[2] DONG X F, YANG X H, LI H Y, et al.Effects of oxidation on the structure of collagen fibers of sea cucumber (Apostichopus japonicus) body wall during thermal processing[J].LWT, 2021, 138:110528.
[3] JIANG J W, GAO S, WANG X D, et al.The role of a novel secretory peptidoglycan recognition protein from the sea cucumber Apostichopus japonicus in innate immunity[J].Aquaculture, 2022, 546:737339.
[4] ZHAO Y E, DONG Y F, GE Q, et al.Neuroprotective effects of NDEELNK from sea cucumber ovum against scopolamine-induced PC12 cell damage through enhancing energy metabolism and upregulation of the PKA/BDNF/NGF signaling pathway[J].Food &Function, 2021, 12(17):7676-7687.
[5] WANG Q Q, SHI J Y, ZHONG H, et al.High-degree hydrolysis sea cucumber peptides improve exercise performance and exert antifatigue effect via activating the NRF2 and AMPK signaling pathways in mice[J].Journal of Functional Foods, 2021, 86:104677.
[6] HOSSAIN A, DAVE D, SHAHIDI F.Antioxidant potential of sea cucumbers and their beneficial effects on human health[J].Marine Drugs, 2022, 20(8):521.
[7] 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会.中国渔业统计年鉴-2022[M].北京:中国农业出版社, 2022.
Fisheries Administration of Ministry of Agriculture and Rural Affairs of the People’s Republic of China, National Fisheries Technology Extension Center, China Society of Fisheries.China Fishery Statistical Yearbook-2022[M].Beijing:China Agriculture Press, 2022.
[8] 白颖, 冯丁丁, 浦源, 等.海参低温贮藏过程中品质与理化性质的变化[J].中国食品学报, 2021, 21(1):208-214.
BAI Y, FENG D D,PU Y, et al. Quality and physicochemical properties of sea cucumber during low temperature storage[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(1):208-214.
[9] 赵园园, 薛勇, 李兆杰, 等.即食仿刺参的制备与常温贮藏期间品质变化研究[J].食品工业科技, 2015, 36(11):305-308.
ZHAO Y Y, XUE Y, LI Z J, et al. Preparation of fresh-eaten sea cucumber and changes in its quality during room temperature storage[J].Science and Technology of Food Industry, 2015, 36(11):305-308.
[10] PROCKOP D J,UDENFRIEND S,LINDSTEDT S.A simple technique for measuring the speci c activity of labeled hydroxyproline in biological materials[J].Journal of Biological Chemistry, 1961, 236(5):1395-1398.
c activity of labeled hydroxyproline in biological materials[J].Journal of Biological Chemistry, 1961, 236(5):1395-1398.
[11] 张苏平, 邱伟强, 卢祺,等.全自动氨基酸分析仪法测定4种贝类肌肉中谷胱甘肽和游离氨基酸含量[J].食品科学, 2017, 38(4):170-176.
ZHANG S P, QIU W Q, LU Q, et al.Determination of glutathione and free amino acids in muscles of four shellfish species by automatic amino acid analyzer[J].Food Science, 2017, 38(4):170-176.
[12] DONG X F, SHEN P, YU M Q, et al. (-)-Epigallocatechin gallate protected molecular structure of collagen fibers in sea cucumber Apostichopus japonicus body wall during thermal treatment[J].LWT, 2020, 123:109076.
[13] WANG J, LIN L, SUN, X, et al. Mechanism of sea cucumbers (Apostichopus japonicus) body wall changes under different thermal treatment at micro-scale[J].LWT, 2020,130:109461.
[14] DONG X P, LIU W T, SONG X, et al.Characterization of heat-induced water adsorption of sea cucumber body wall[J].Journal of Food Science, 2019, 84(1):92-100.
[15] SUN X, ZHU L L, QI X, et al. Cleavage sites and non-enzymatic self-degradation mechanism of ready-to-eat sea cucumber during storage[J].Food Chemistry, 2022, 375:131722.
[16] 钟萍, 陈鲜丽, 罗威, 等.不同贮藏温度对鱼肉嫩度和菌落总数的影响研究[J].食品研究与开发, 2021, 42(7):45-49.
ZHONG P, CHEN X L, LUO W, et al. Effects of different storage temperature on tenderness and total number of bacterial colonies of fish[J].Food Research and Development, 2021, 42(7):45-49.
[17] 汤夕瑶, 张旭飞, 任惠峰, 等.冷藏过程中凡纳滨对虾颜色变化与鲜度指标间的相关性研究[J].食品与发酵工业, 2022, 48(9):170-178.
TANG X Y, ZHANG X F,REN H F, et al. Study on the correlation between the color change and freshness indexes of Litopenaeus vannamei during cold storage[J].Food and Fermentation Industries, 2022, 48(9):170-178.
[18] 冯丁丁, 董秀芳, 熊欣, 等.基于ESR技术研究海参热加工过程中的氧化物[J].中国食品学报, 2018, 18(5):252-256.
FENG D D, DONG X F, XIONG X, et al. Studies on oxidative products in Stichopus japonicus during thermal processing based on ESR technology[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(5):252-256.
[19] GE L H, XU Y S, XIA W S.The function of endogenous cathepsin in quality deterioration of grass carp(Ctenopharyngodon idella)fillets stored in chilling conditions[J].International Journal of Food Science&Technology, 2015, 50(3):797-803.
[20] 林琳, 孙霄, 侯虎.贮藏温度对高温高压海参体壁组织结构变化的作用[J].食品与发酵工业, 2019, 45(19):194-199.
LIN L, SUN X, HOU H.Effects of storage temperature on the structural changes of high temperature and high pressure sea cucumber body wall[J].Food and Fermentation Industries, 2019, 45(19):194-199.
[21] 员璐. 海参复水工艺优化及品质研究[D].重庆:西南大学, 2016.
YUN L.Research on rehydration process optimization and quality of sea cucumber[D].Chongqing:Southwest University, 2016.
[22] 张鹏, 肖水水, 李江阔, 等.电子鼻结合气相色谱-质谱联用技术分析冷藏期间刺参挥发性成分的变化[J].食品与发酵工业, 2016, 42(9):204-209.
ZHANG P, XIAO S S, LI J K, et al. Analysis of volatiles compounds change of sea cucumber during cold storage by electronic nose combined with GC-MS[J].Food and Fermentation Industries, 2016, 42(9):204-209.
[23] 尹一鸣, 徐永霞, 张朝敏, 等.水产品贮藏期间风味劣变机理的研究进展[J].食品与发酵工业, 2020, 46(14):269-274.
YIN Y M, XU Y X, ZHANG C M, et al. The progress on flavor deterioration mechanism of aquatic products during storage[J].Food and Fermentation Industries, 2020, 46(14):269-274.
[24] 贾哲, 陈晓婷, 潘南, 等.双斑东方鲀在冷藏保鲜过程中挥发性风味物质的变化[J].食品科学, 2021, 42(20):188-196.
JIA Z, CHEN X T, PAN N, et al. Changes of volatile flavor compounds in Takifugu bimaculatus during refrigeration storage[J].Food Science, 2021, 42(20):188-196.
[25] XIONG X, XIE W C, XIE J W, et al.Protein oxidation results in textural changes in sea cucumber (Apostichopus japonicus) during tenderization[J].LWT, 2021, 144:111231.
[26] SHOULDERS M D, RAINES R T.Collagen structure and stability[J].Annual Review of Biochemistry, 2009, 78:929-958.
[27] PENG Z, HOU H, BU L, et al.Nonenzymatic softening mechanism of collagen gel of sea cucumber (Apostichopus japonicus)[J].Journal of Food Processing and Preservation, 2015, 39(6):2322-2331.