老香黄,是岭南特有的保健和药用制品,别称老香橼、佛手香黄,由芸香科植物佛手的果实炮制而成,主产于广东、四川、浙江等地[1]。佛手果为广东地道“十大广药”之一,潮州佛手果为广东名果之一,自明代以来,就有关于佛手种植和加工的记载,如《海阳县志》曰:“香橼,佛手柑,梅,邑中之梅大半渍糖以入茶品,亦有用盐晒者[2]。老香黄的制作工艺包括盐腌、晒干、炊熟、浸中药粉液等步骤,九蒸九晒,陈封瓦瓮中数年,最后制成了果肉油亮漆黑,肉质绵绵如膏状的老香黄,它不仅能够促进消化、理气和胃,还能舒缓胃胀、嗝噎、痰多、咳嗽,甚至解酒[3]。
佛手中含有多种生物活性成分,包括精油、黄酮类化合物、多糖、香豆素和酚酸等[1],是我国传统的名贵中药。《本草从新》记载:“佛手,性虽中和。单用多用。亦损正气。须与参术并行。陈久者良”[4]。在传统观念中认为,老香黄制成后,保存愈久药效愈佳,身价也愈高[5]。目前关于老香黄的研究在国内外报道不多,主要集中在质量安全、成分、指纹图谱、化学模式识别及相关工艺等方面的研究。如郭舒臣等[6]采用超高效液相色谱-串联质谱(ultra performance liquid chromatography/tandem mass spectrometry, UPLC-MS/MS)建立了一种化学模式识别技术快速判别不同年份老香黄的方法,并筛选出6个差异性化学标志物,其中贡献最大的标志性化合物为5,7-二甲氧基香豆素;陈小爱等[7]采用电子鼻、GC-MS和气相-离子迁移谱技术(gas chromatography-ion mobility spectrometry, GC-IMS)分析老香黄发酵期间的挥发性成分变化,研究表明,β-蒎烯和1-石竹烯在发酵12个月样品中含量最高;柠檬烯、茴香脑和2,4-二甲基苯乙烯在老香黄发酵2个月时含量达到最高;异松油烯、麦芽酚和芳樟醇在样品发酵4个月时含量最高;α-松油醇和糠醛分别在发酵6个月和8个月时含量为最高。对老香黄风味贡献程度最大的5个物质分别是香茅醛、壬醛、异松油烯、反式-β-罗勒烯和柠檬烯;林良静等[8]采用GC-IMS结合ROAV鉴定出佛手香黄的特征性香气成分主要由甲硫基丙醛和烯萜类物质组成,呈现果香、花香的香气特征。这些研究目前仅停留在对老香黄活性成分的分析及挥发性物质的鉴定等,并无系统地研究不同贮藏年份对老香黄主要黄酮类化合物、总酚总黄酮、抗氧化性及挥发性成分的影响[9]。
基于此,本文以不同贮藏年份的老香黄为研究对象,结合高效液相色谱、体外抗氧化评价、气相色谱-质谱联用仪等技术,探究不同贮藏年份老香黄黄酮类化合物,抗氧化活性及挥发性成分的变化,以期寻找不同年份老香黄品质变化的物质基础,旨在为老香黄“陈久者良”提供科学依据,也为老香黄在贮藏期间的品质形成提供理论基础。
1 材料与方法
1.1 材料与试剂
2020年、2019年、2017年、2015年和2013年腌制的佛手(对应分别贮藏1年、2年、4年、6年和8年),每个年份各3批,广东济公保健食品有限公司;福林-酚,上海瑞永生科技有限公司;DPPH、ABTS、TPTZ、水溶性维生素E(Trolox)、5,7-二甲氧基香豆素、阿魏酸、绿原酸、芦丁、紫丁香苷、儿茶素、甲氧橙皮苷标准品,上海源叶生物科技有限公司。
1.2 仪器与设备
UV1800型紫外分光光度计、LC-20AT型高效液相色谱仪,岛津仪器(苏州)有限公司;DL-800B型智能超声波清洗器,上海之信仪器有限公司;DB-5非极性毛细管色谱柱(30 m×0.25 mm,0.25 μm)、DB-WAX极性毛细管色谱柱(60 m×0.25 mm ID,0.25 μm),美国Restek;7890B-5977B型气相色谱-质谱联用仪,美国Agilent科技公司;57330-U型三相固相微萃取头(Polydimethylsiloxane/Divinylbenzene/Carboxen,PDMS/DVB/CAR),美国Supelco公司。
1.3 实验方法
1.3.1 提取液的制备
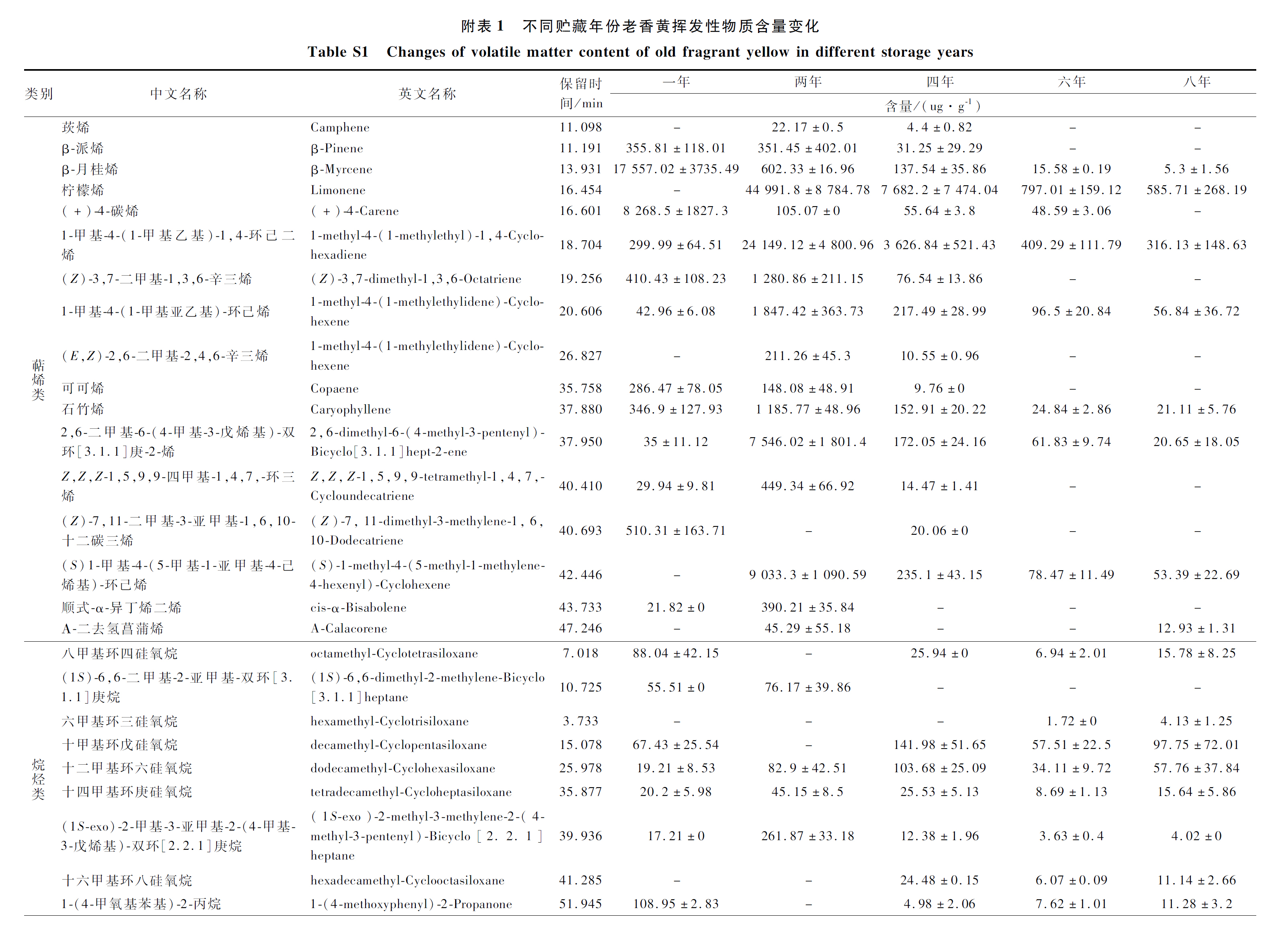
参照邓祥等[10]的方法,采用超声波辅助法提取。将5个贮藏年份的老香黄样品打粉,分别称取粉末10 g于小烧杯中,加15 mL酸化甲醇常温提取。超声30 min,过滤,收集上清液。对滤渣重复上述操作提取,直至滤液基本无色,合并滤液,定容至50 mL容量瓶,保存备用。
1.3.2 黄酮类单体化合物含量的测定
参考陈小爱等[7]的方法并加以修改。Waters C18柱(4.6 mm×250 mm),流动相为体积分数0.1%甲酸(A)-甲醇(D),检测波长:280和330 nm,进样体积10 μL,柱温35 ℃;梯度洗脱程序:0~10 min,40%~60% D;10~20 min,60%~80% D;20~30 min,80%~100% D;30~35 min,100%~40% D;35~40 min,40% D;流速0.9 mL/min。分别取1 mL样品提取液过0.22 μm微孔滤膜后进行液相分析,色谱条件如上,每个样品重复3次。
1.3.3 总酚和总黄酮含量及抗氧化能力的测定
总酚含量采用Folin-Ciocalteu[11]比色法。以没食子酸质量浓度为横坐标,吸光值为纵坐标绘制标准曲线,总酚含量以相当没食子酸质量表示(mg GAE/d.w.)。
总黄酮含量采用NaNO2-Al(NO3)3-NaOH[12]法。以芦丁质量浓度为横坐标,吸光值为纵坐标绘制标准曲线,总黄酮含量以芦丁当量表示(mg Rutin/g d.w.)。
DPPH自由基清除能力测定参照ZHANG等[13]的方法。以Trolox标准品浓度(mmol/L)为横坐标,自由基清除率为纵坐标绘制标准曲线,DPPH自由基清除能力以Trolox当量表示(mmol Trolox/100 g)。
ABTS阳离子自由基清除能力测定参考CHOI等[14]的方法,并略作修改。以Trolox标准品清除率为纵坐标,各清除率对应的标准品浓度为横坐标绘制标准曲线。ABTS阳离子自由基清除能力以Trolox当量表示(mmol Trolox/100 g)。
铁离子还原能力(ferric reducing/antioxidant power, FRAP)测定抗氧化活性参照ZHANG等[13]的方法。以标准品吸光度为纵坐标,各吸光度对应的标准品浓度为横坐标绘制标准曲线。Fe3+还原力以维生素C当量表示(mg VC/100 g)。
1.3.4 顶空固相微萃取-气相色谱-质谱联用技术分析
挥发性芳香组分的固相微萃取提取:参考CHEN等[15]和徐娅莹[16]的方法,略有所修改。称取6.0 g样品于15 mL萃取瓶中,加2 mL饱和NaCl溶液及10 μL体积分数0.1%内标1-己醇,50 ℃平衡20 min;随后将三相纤维头(PDMS/DVB/CAR)置于样品上方的空气中,50 ℃萃取30 min后,迅速将纤维头插入气相色谱仪的进样口,解析10 min,同时启动气相色谱仪采集数据。
GC-MS条件:参考陈小爱等[7]和SONG等[17]的方法,略有所修改。采用DB-WAX弹性毛细管柱,载气为氦气,流速1.0 mL/min,进样口温度270 ℃。色谱柱升温程序:初始温度40 ℃,保持3 min,然后2 ℃/min升温至100 ℃,最后5 ℃/min加热到230 ℃,保持10 min,采用不分流进样模式。质谱条件:采用全扫描模式采集信号,电离方式EI,电子轰击能量为70 eV;接口温度280 ℃,离子源温度230 ℃,四级杆温度150 ℃,扫描质量范围35~350 amu,倍增器电压;扫描速度:5.2 次/s。
GC-MS定性分析:与标准信息库NIST16进行比对;采用正构系列烷烃混合标样C5~C20计算挥发性成分的保留指数,并与参考文献进行对比;根据所记录香气描述以及利用标准品的质谱信息进行定性。保留指数(linear retention index, LRI)[18]的计算如公式(1)所示:
(1)
式中:N,目标物质左侧正构烷烃的碳原子数;n,位于目标物质两侧的正构烷烃的碳分子数之差;tRa,tRN和tR(N+n)分别是待测物质左侧和右侧正构烷烃的保留时间。
GC-MS定量分析:各挥发性物质的相对含量用化合物的峰面积与内标物的峰面积的比值即浓度的比值计算得出。
1.4 数据统计分析
采用Excel、Origin 8.0、R软件统计分析实验数据及制图;采用SPSS(v.19)进行单因素方差分析和显著性分析。老香黄的抗氧化能力与黄酮类化合物的相关性分析采用Pearson类型,相关系数显著性采用双尾检验分析。
2 结果与分析
2.1 不同年份老香黄中黄酮化合物的种类及含量
根据样品色谱图1和图2,结果如表1所示,5个不同贮藏年份的老香黄样品黄酮类化合物组成有:5,7-二甲氧基香豆素、芦丁、绿原酸、阿魏酸、紫丁香苷、甲氧橙皮苷和儿茶素,其种类基本相同,但是含量存在显著变化。其中,绿原酸在6年老香黄样品中含量最高,为13.4 μg/g,较2年老香黄提高3.05倍;阿魏酸在8年老香黄中含量最高,4年老香黄含量最低;儿茶素在6年老香黄含量最高为161.23 μg/g,是含量最低的1年老香黄的2.74倍。而芦丁在2年老香黄含量最高,8年老香黄含量最低;紫丁香苷在一年老香黄含量最高,8年老香黄含量最低;5,7-二甲氧基香豆素和甲氧橙皮苷分别在1年和2年老香黄样品中含量最高,为47.57和37.22 μg/g,而在4年老香黄样品中含量最低,分别为11.44、19.10 μg/g。由于样品是不同年份采摘的不同批次样品,所以部分黄酮类化合物随贮藏年份的不规则变化规律可能是由于样品本身的差异导致。
表1 不同年份老香黄中黄酮类物质含量变化 单位:μg/g
Table 1 Changes of flavonoids in Laoxianghuang in different years

贮藏年份5,7-二甲氧基香豆素芦丁绿原酸阿魏酸紫丁香苷甲氧橙皮苷儿茶素1年47.57±0.07a48.12±0.14b4.48±0.17d2.78±0.01d12 557.68±14.35a32.40±0.09b58.85±0.28e2年18.00±0.74d53.18±0.11a4.39±0.12d4.93±0.02c10 129.00±188.01b37.22±0.81a66.26±1.77d4年11.44±0.10e45.09±0.11c5.90±0.07c1.80±0.01e6 999.26±18.82c19.10±0.10d83.00±0.28c6年35.12±0.10c45.35±0.08c13.4±0.10a7.21±0.14b6 019.80±2.53d30.3±1.82bc161.23±0.90a8年41.23±0.19b35.12±0.03d12.05±0.17b12.53±0.17a5 895.83±5.41d28.94±0.08c150.66±0.22b
注:同列进行单因素方差分析多重比较,t检验;表中不同字母表示有显著差异(P<0.05)(下同)。

图1 样品色谱图(330 nm)
Fig.1 Sample chromatogram (330 nm)

图2 样品色谱图(280 nm)
Fig.2 Sample chromatogram (280 nm)
但从整体来看,随着老香黄贮藏年份的增加,绿原酸、阿魏酸和儿茶素含量呈上升趋势,而5,7-二甲氧基香豆素、芦丁、紫丁香苷和甲氧橙皮苷含量呈现下降趋势。这是由于老香黄在制作、贮藏过程中黄酮类物质会发生变化。如刘志聪等[19]报道,在老香黄制作过程中,紫丁香苷、5,7-二甲氧基香豆素、芦丁、甲氧橙皮苷、绿原酸、阿魏酸和儿茶素等黄酮类物质经过多道工艺的炮制,特别是盐浸和蒸煮等工艺发生了严重的流失;其次,在老香黄贮藏过程中,紫丁香苷、5,7-二甲氧基香豆素、芦丁和甲氧橙皮苷可能在微生物作用下会转化为其他二级代谢产物如葡萄糖苷等,从而导致上述黄酮类化合物含量下降[20]。此外,裴科等[21]发现了一些未失去活性的酶如纤维素酶会将绿原酸、阿魏酸和儿茶素从纤维素结构中水解,从而使其含量增高。
紫丁香苷在不同年份老香黄中含量均较高,它具有抗氧化等生物活性,老香黄的加工、贮藏过程会使其降解,但研究表明绿原酸、阿魏酸和儿茶素均较紫丁香苷的抗氧化性强[22],所以紫丁香苷含量的下降并不会影响老香黄随贮藏年份增加抗氧化性的增强,它对老香黄药效的其他影响,有待进一步思考和研究。大量研究表明5,7-二甲氧基香豆素是佛手的标志性成分[23],在本研究中也发现不同年份老香黄样品都可以检测到5,7-二甲氧基香豆素,其含量在不同贮藏年份变化不规律,但整体呈现下降趋势,据郭舒臣等[6]报道其含量在佛手果实不同成熟阶段变化很大,根据含量可作为标志物来判断老香黄的大概年份。
2.2 不同年份老香黄的总酚、总黄酮含量及抗氧化能力变化
由图3可知,不同年份老香黄的总酚、总黄酮含量变化趋势一致,整体表现为6年和8年>2年和4年>1年,说明随着贮藏年限的增加,老香黄的总酚、总黄酮含量增加。其中6年老香黄总酚、总黄酮含量最高,分别为2.42、1.49 mg/g;1年老香黄总酚、总黄酮含量最低。

图3 不同年份老香黄总酚、总黄酮含量变化
Fig.3 Changes of total phenols and flavonoids in Laoxianghuang in different years
注:图柱上不同小写字母表示不同贮藏年份老香黄间
差异显著(P<0.05)。
此外,由表2可知,随着贮藏时间的延长,老香黄提取物的DPPH清除能力变化趋势为:6年和8年>2年和4年>1年;ABTS阳离子自由基清除能力也显示6年老香黄的清除能力最强,为0.64 mmol Trolox/100 g,较清除率最低的1年老香黄提高1.64倍;Fe3+的还原能力变化趋势显示6年和8年>2年和4年>1年。这表明在检测年限内,老香黄的抗氧化性随着贮藏年份的增加而提高,与总酚、总黄酮的变化趋势一致。这可能是由于以下几点原因导致:黄酮等酚类化合物经多道工艺(盐腌、炮制)发生了由结合态向游离态的转变,生物利用率提高了[12];此外,老香黄贮藏过程中,在黑曲霉等微生物的作用下,发生了黄酮类化合物的积累和转化,比如黑曲霉产生的β-葡糖糖酶主要用于黄酮苷与苷元的转化,从而导致总酚、总黄酮含量增加[20]。大量的研究结果证实[24],总酚、总黄酮含量与抗氧化活性之间存在高度相关性。根据表3相关性分析,不同年份老香黄的DPPH和ABTS阳离子清除能力以及Fe3+还原能力分别与总酚、总黄酮、绿原酸、阿魏酸、儿茶素含量呈极显著正相关性(P<0.01);而与5,7-二甲氧基香豆素、甲氧橙皮素不存在显著相关性(P>0.05);与芦丁、紫丁香苷含量存在极显著负相关性(P<0.01)。这表明随着老香黄贮藏年限的增加,儿茶素、绿原酸和阿魏酸是对老香黄抗氧化能力起主要贡献作用的活性物质。根据KADOMA等[22]的报道,绿原酸、阿魏酸和儿茶素是属于抗氧化性较强的黄酮类化合物,其含量增加,也会导致抗氧化性增强。这也是随着贮藏年限增加,老香黄抗氧化性增强的又一原因。
表2 不同年份老香黄抗氧化能力的变化
Table 2 Changes of antioxidant capacity of Laoxianghuang in different years

贮藏年份DPPH/(mmol Trolox/100 g)ABTS阳离子/(mmol Trolox/100 g)FRAP/(mg VC/100 g)1年1.33±0.01e0.39±0.01e626.90±3.27e2年1.44±0.01c0.44±0.01d835.41±4.16d4年1.37±0.01d0.47±0.01c869.41±10.46c6年2.44±0.01a0.64±0.01a1 679.08±10.10a8年2.33±0.01b0.62±0.01b1 557.18±7.20b
表3 不同年份老香黄中总酚、总黄酮含量、抗氧化特性(FRAP、DPPH和ABTS)以及活性物质之间的相关性
Table 3 Correlation between total phenols, total flavonoids, antioxidant properties (FRAP, DPPH and ABTS) and active substances in Laoxianghuang in different years

指标总酚总黄酮DPPHABTSFRAP5,7-二甲氧基香豆素芦丁绿原酸阿魏酸紫丁香苷甲氧橙皮素儿茶素总酚1总黄酮 0.974∗∗1DPPH 0.989∗∗ 0.966∗∗1ABTS 0.991∗∗ 0.960∗∗ 0.971∗∗1FRAP 0.996∗∗ 0.978∗∗ 0.986∗∗ 0.995∗∗15,7-二甲氧基香豆素-0.281 0.150-0.325-0.351-0.3181芦丁-0.660∗∗-0.477-0.649∗∗-0.682∗∗-0.643∗∗-0.669∗∗1绿原酸 0.976∗∗ 0.944∗∗ 0.984∗∗ 0.981∗∗ 0.985∗∗-0.455-0.688∗∗1阿魏酸 0.847∗∗ 0.761∗∗ 0.839∗∗ 0.793∗∗ 0.801∗∗-0.099-0.735∗∗ 0.767∗∗1紫丁香苷-0.821∗∗-0.770∗∗-0.746∗∗-0.881∗∗-0.837∗∗ 0.379 0.662∗∗-0.805∗∗-0.572∗∗1甲氧橙皮素-0.017 0.092 0.040-0.138-0.059 0.690∗∗ 0.433-0.115 0.208 0.5011儿茶素 0.986∗∗ 0.951∗∗ 0.983∗∗ 0.992∗∗ 0.993∗∗-0.425-0.699∗∗ 0.996∗∗ 0.782∗∗-0.843∗∗-0.1391
注:相关类型为pearson类型,关系数显著性进行双尾检验分析,*表示显著相关(P<0.05),**表示差异极显著相关(P<0.01)。
2.3 不同年份老香黄挥发性成分的变化
老香黄的主要挥发性成份为萜烯类、醇类和芳香烃类化合物,也是老香黄风味物质的主要来源[8]。由图4~图6可知,不同年份老香黄的挥发性物质种类和相对含量差异较大。分别从1年、2年、4年、6年和8年老香黄中检测出65、61、68、65和63种挥发性成分。并且随着贮藏年限的增加,萜烯类和芳香烃类物质的个数和含量整体呈下降趋势,而醇类物质个数和含量整体呈上升趋势。其中,1年老香黄中萜烯类化合物有13个,含量为28 165.15 μg/g,占总物质含量的79.98%;芳香烃类化合物有15个,含量为3 169.73 μg/g,占总物质含量的15.9%;醇类化合物15个,含量为1 250.29 μg/g,占总物质含量的4.05%。随着贮藏年限增加,8年老香黄总萜烯类物质数量下降到8个,含量为1 060.41 μg/g,占总物质含量的20.87%,相比1年老香黄下降了59.11%;芳香烃类化合物数量下降到11个,含量为476.56 μg/g,占整体物质含量的9.26%,相比1年老香黄下降了6.64%;而醇类在8年老香黄中增加到17个,且相对含量最高,为1 746.80 μg/g,占总物质含量的35.64%,相比1年老香黄上升了31.59%。由此可知,随着贮藏年限的增加,老香黄特征性挥发成分萜烯类和芳香烃类物质含量降低,而醇类物质含量升高。柠檬烯是老香黄中最主要的烯烃类化合物,其在2年老香黄的老香黄中含量最高,为44 991.8 μg/g,随贮藏时间的延长含量急剧减少,到8年老香黄下降到了585.71 μg/g;乙醇、α-萜品醇和1-甲基-4-(1-甲基乙基)-3-环己烯-1-醇是老香黄中最主要的醇类化合物,随着贮藏时间的延长,含量均呈上升趋势。

图4 五个贮藏年份老香黄中挥发性物质的种类组成
Fig.4 Species composition of volatile substances in Laoxianghuang in five storage years
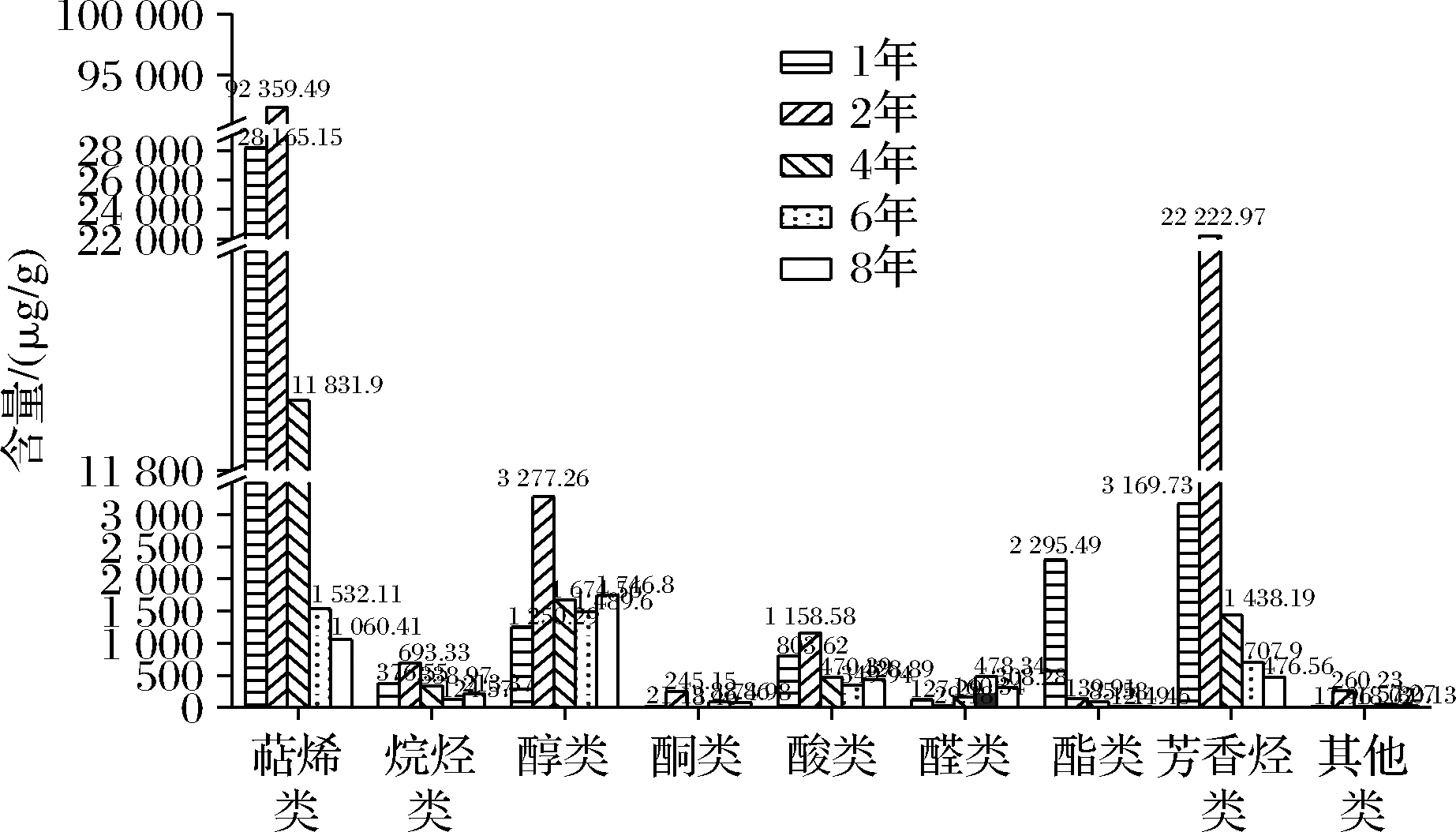
图5 五个贮藏年份老香黄中各类挥发性物质的含量
Fig.5 Contents of various volatile substances in Laoxianghuang in five storage years
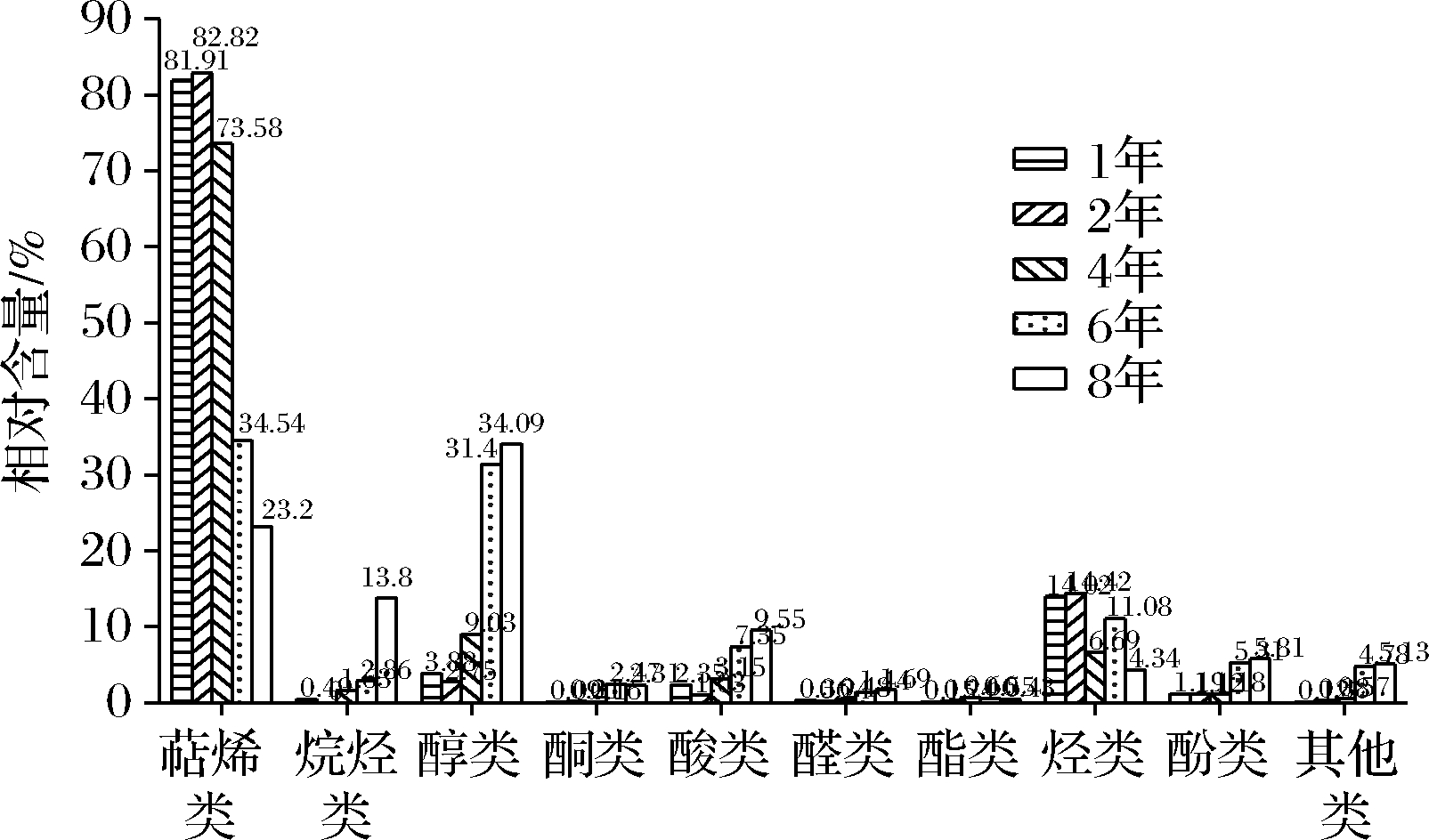
图6 五个贮藏年份老香黄中各类挥发性物质的含量
Fig.6 Contents of various volatile substances in Laoxianghuang in five storage years
为了进一步研究不同年份老香黄挥发性成分的差异,通过挥发性物质含量构建主成分分析(principal component analysis, PCA)模型,由图7-a可知,在PCA得分图中可以将5个不同年份老香黄分成3组,4年和1年老香黄,8年和6年老香黄,以及2年老香黄。由载荷图图7-b和增强出版附件1(https://doi.org/10.13995/j.cnki.11-1802/ts.033818)显示,4年和1年老香黄中主要挥发性贡献物质为柠檬烯、α-萜品醇、苯甲酸和1-甲基-4-(1-甲基乙基)-1,4-环己二烯等,具有柑橘香、柠檬特征香、清甜花香、松香和松节油香等气味;2年老香黄中柠檬烯、1-甲基-4-(1-甲基乙基)-1,4-环己二烯和(S)1-甲基-4-(5-甲基-1-亚甲基-4-己烯基)-环己烯等为主要挥发性贡献物质,具有柑橘香、药草香、果香、松香和松节油香等气味;8年和6年老香黄中主要香气贡献物质为柠檬烯、α-萜品醇、苯甲酸、1-甲基-4-(1-甲基乙基)-1,4-环己二烯和糠醛等,具有花香、药香、醇香和焦甜香等气味。由此可知,老香黄在贮藏过程中,挥发性香气成分由柠檬香、柑橘香、松香向花香、药香、醇香转变。

a-得分图;b-载荷图
图7 不同年份老香黄GC-MS的主成分分析图
Fig.7 Principal component analysis of Laoxianghuang
in different years by GC-MS
柠檬烯和1-甲基-4-(1-甲基乙基)-1,4-环己二烯等萜烯类化合物下降以及α-萜品醇等醇类化合物上升的主要原因是老香黄在贮藏过程中长期暴露于有氧环境下,萜烯类化合物发生了氧化反应而减少[25],此外,VESPERMANN等[26]研究发现,在黑曲霉等微生物的作用下萜烯类化合物向醇类和烷烃类物质发生转变,如α-蒎烯在黑曲霉的作用下可转化为α-萜品醇,从而导致萜烯类含量降低,醇类物质增加。此外,老香黄贮藏过程中酵母菌可以利用糖分生成乙醇和CO2,使醇类化合物含量升高[21]。在中药传统经验上,认为“陈久者良”其中依据之一就是气味“香醇”[27],上述风味物质的转变为老香黄“陈久者良”的说法找到了根据。
3 结论
随着贮藏时间的延长,老香黄总酚、总黄酮含量增加,抗氧化能力增强,其中绿原酸、阿魏酸和儿茶素含量与总黄酮、总酚含量、抗氧化能力呈正相关。GC-MS结果显示,萜烯类、醇类和芳香烃类化合物是老香黄主要的挥发性物质,也是老香黄风味物质的主要来源,在贮藏过程中柠檬烯和1-甲基-4-(1-甲基乙基)-1,4-环己二烯等烯烃类物质的含量逐渐减少,同时乙醇、α-萜品醇和1-甲基-4-(1-甲基乙基)-3-环己烯-1-醇等醇类物质的含量逐渐增加,香气成分由柠檬香、药草香、松香向醇香、花香、焦甜香转变,气味随之变香醇。上述黄酮类化合物、抗氧化性以及挥发性成分的变化规律可为老香黄“陈久者良”提供科学依据,也为老香黄贮藏期间的品质形成规律提供参考。



[1] 张璐, 田静, 尹萌, 等.基于数学模型分析不同产地佛手的化学成分差异性[J].药物分析杂志, 2019, 39(1):122-126.
ZHANG L, TIAN J, YIN M, et al.Analysis of chemical diversity of Fructus Citri Sarcodactylis from different habitats based on mathematical model[J].Chinese Journal of Pharmaceutical Analysis, 2019, 39(1):122-126.
[2] 罗思敏, 吴孟华, 周宇, 等.佛手的品种源流及药用食用考[J].中国中药杂志, 2020, 45(16):3997-4003.
LUO S M, WU M H, ZHOU Y, et al.Herbalogical study on original plant and medicinal and edible values of Citri Sarcodactylis Fructus[J].China Journal of Chinese Materia Medica, 2020, 45(16):3997-4003.
[3] 丁利君. 佛手瓜凉果和果酱的研制[J].农产品加工(学刊), 2005(2):51-53.
DING L J.Preparation of chayote preserves and jams[J].Academic Periodical of Farm Products Processing, 2005(2):51-53.
[4] 吴仪洛. 本草从新[M].北京:红旗出版社, 1996.
WU Y L.Herbal Renewal[M].Beijing:Hongqi Publishing House, 1996.
[5] 郑玉忠, 郭守军, 杨永利, 等.药食凉果老香黄制作工艺的研究[J].农产品加工(学刊), 2014(1):44-45;48.
ZHENG Y Z, GUO S J, YANG Y L, et al.Production process of preserved fruits Laoxianghuang[J].Academic Periodical of Farm Products Processing, 2014(1):44-45;48.
[6] 郭舒臣, 郑玉忠, 郭瑞, 等.不同年份老香黄定量分析及其化学模式识别研究[J].分析测试学报, 2021, 40(1):10-18.
GUO S C, ZHENG Y Z, GUO R, et al.Quantitative analysis and chemical pattern recognition of Lao-Xiang-Huang preserved in different years[J].Journal of Instrumental Analysis, 2021, 40(1):10-18.
[7] 陈小爱, 蔡惠钿, 刘静宜, 等.基于电子鼻、GC-MS和GC-IMS技术分析老香黄发酵期间的挥发性成分变化[J].食品工业科技, 2021, 42(12):70-80.
CHEN X A, CAI H T, LIU J Y, et al.Analysis of volatile components in Laoxianghuang during fermentation by electronic nose, GC-MS and GC-IMS[J].Science and Technology of Food Industry, 2021, 42(12):70-80.
[8] 林良静, 蔡惠钿, 包涵, 等.潮汕特色佛手香黄的特征挥发性风味成分分析[J].现代食品科技, 2021, 37(7):238-249.
LIN L J, CAI H T, BAO H, et al.Analysis of the characteristic volatile flavor components of preserved Lao-Xiang-Huang of Chaozhou[J].Modern Food Science and Technology, 2021, 37(7):238-249.
[9] 岳玲, 程轩轩, 唐晓敏, 等.佛手的传统应用[J].中国实验方剂学杂志, 2019, 25(4):206-211.
YUE L, CHENG X X, TANG X M, et al.Traditional application of citri sarcodactylis fructus[J].Chinese Journal of Experimental Traditional Medical Formulae, 2019, 25(4):206-211.
[10] 邓祥, 黄小梅, 王坤.川佛手中黄酮类物质的微波和超声波联合提取工艺优化[J].应用化工, 2017, 46(11):2154-2157.
DENG X, HUANG X M, WANG K.Process optimization of microwave and ultrasonic extraction of flavonoids in Chuan bergamot[J].Applied Chemical Industry, 2017, 46(11):2154-2157.
[11] WANG R R, DING S H, ZHAO D D, et al.Effect of dehydration methods on antioxidant activities, phenolic contents, cyclic nucleotides,and volatiles of jujube fruits[J].Food Science and Biotechnology, 2016, 25(1):137-143.
[12] 刘丽娜, 徐玉娟, 肖更生, 等.不同年份陈皮黄酮成分分析及抗氧化活性评价[J].南方农业学报, 2020, 51(3):623-629.
LIU L N, XU Y J, XIAO G S, et al.Flavonoids and antioxidant activity of Pericarpium Citri Reticulatae in different storage years[J].Journal of Southern Agriculture, 2020, 51(3):623-629.
[13] ZHANG H, JIANG L, YE S, et al.Systematic evaluation of antioxidant capacities of the ethanolic extract of different tissues of jujube (Ziziphus jujuba Mill.) from China[J].Food and Chemical Toxicology, 2010, 48(6):1461-1465.
[14] CHOI S H, AHN J B, KIM H J, et al.Changes in free amino acid, protein, and flavonoid content in jujube (Ziziphus jujuba) fruit during eight stages of growth and antioxidative and cancer cell inhibitory effects by extracts[J].Journal of Agricultural and Food Chemistry, 2012, 60(41):10245-10255.
[15] CHEN X A, CHEN H Q, XIAO J, et al.Variations of volatile flavour compounds in finger citron (Citrus medica L.var.sarcodactylis) pickling process revealed by E-nose, HS-SPME-GC-MS and HS-GC-IMS[J].Food Research International, 2020, 138:109717.
[16] 徐娅莹. 佛手萜类芳香物质的器官差异与合成相关基因鉴别[D].杭州:浙江大学, 2019.
XU Y Y.Organ differences and identification of genes related to synthesis of terpenoids aromatic substances from bergamot[D].Hangzhou:Zhejiang University, 2019.
[17] SONG S Q, TONG Y Z, FENG T, et al.Multi-analysis of odorous compounds in finger citron (Citrus medica L.var.sarcodactylis swingle) and certification of key compounds[J].Journal of Essential Oil Bearing Plants, 2018, 21(3):600-613.
[18] COLLIER W A, BAIRD D B, PARK-NG Z A, et al.Discrimination among milks and cultured dairy products using screen-printed electrochemical arrays and an electronic nose[J].Sensors and Actuators B:Chemical, 2003, 92(1-2):232-239.
[19] 刘志聪, 张振霞, 赖宣, 等.潮州老香黄的HPLC指纹图谱研究及指标成分测定[J].世界科学技术-中医药现代化, 2017, 19(8):1370-1374.
LIU Z C, ZHANG Z X, LAI X, et al.Analysis on HPLC fingerprints and index content determination of Lao-Xiang-Huang of Chaozhou[J].Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology, 2017, 19(8):1370-1374.
[20] 王福, 张鑫, 卢俊宇, 等.陈皮“陈久者良”之黄酮类成分增加原因探究[J].中国中药杂志, 2015, 40(24):4890-4896.
WANG F, ZHANG X, LU J Y, et al.Study of reason of “the older, the better”of Pericarpium Citri Reticulatae(PCR) which contributed increase of flavonoids[J].China Journal of Chinese Materia Medica, 2015, 40(24):4890-4896.
[21] 裴科, 宁燕, 王卓, 等.以咖啡酸和阿魏酸为指标从不同炮制因素的角度探究川芎酒炙机理[J].广东化工, 2021, 48(8):71-74.
PEI K, NING Y, WANG Z, et al.Based on caffeic acid and ferulic acid, the mechanism of Ligusticum chuanxiong hort.was explored from different processing factors[J].Guangdong Chemical Industry, 2021, 48(8):71-74.
[22] KADOMA Y, FUJISAWA S.A comparative study of the radical-scavenging activity of the phenolcarboxylic acids caffeic acid, p-coumaric acid, chlorogenic acid and ferulic acid, with or without 2-mercaptoethanol, a thiol, using the induction period method[J].Molecules, 2008, 13(10):2488-2499.
[23] 林乐维, 蒋林, 郝大庆, 等.不同采收期广佛手中5, 7-二甲氧基香豆素的含量测定[J].现代中药研究与实践, 2009, 23(6):15-17.
LIN L W, JIANG L, HAO D Q, et al.Determination of 5, 7-dimethoxycoumarin in fructus citri sarcodactylis from Guangdong at different collecting times[J].Research and Practice on Chinese Medicines, 2009, 23(6):15-17.
[24] VELIOGLU Y S, MAZZA G, GAO L, et al.Antioxidant activity and total phenolics in selected fruits, vegetables, and grain products[J].Journal of Agricultural and Food Chemistry, 1998, 46(10):4113-4117.
[25] MOLINA G, PIMENTEL M R, PASTORE G M.Pseudomonas:A promising biocatalyst for the bioconversion of terpenes[J].Applied Microbiology and Biotechnology, 2013, 97(5):1851-1864.
[26] VESPERMANN K A C, PAULINO B N, BARCELOS M C S, et al.Biotransformation of α- and β-pinene into flavor compounds[J].Applied Microbiology and Biotechnology, 2017, 101(5):1805-1817.
[27] 魏飞亭, 董嘉皓, 乔日发, 等.中药“陈久者良”的研究概述与思考[J].世界科学技术-中医药现代化, 2020, 22(8):3048-3053.
WEI F T, DONG J H, QIAO R F, et al.Overview and Thinking of the Long-stored TCM “Pericarpium Citri Reticulatae, the older the better”[J].Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology, 2020, 22(8):3048-3053.