蛋黄含有丰富的磷脂、必需脂肪酸、维生素和矿物质,此外还含有生物活性蛋白质:卵黄抗体(immunoglobulin of yolk, IgY)[1]。然而新鲜鸡蛋在常温下易变质,在加工和运输时造成了巨大的损失和浪费[2]。因此,干燥作为一种解决手段常被用来生产蛋黄粉(egg yolk powder, EYP)。EYP与新鲜蛋黄具有相同的营养成分,且保留了新鲜蛋黄的功能特性[3]。冷冻干燥(freeze-drying, FD)是一种生物制品常用的干燥方式,且是可以保留产品良好品质的最佳干燥方式之一[4]。由于EYP含有大量的疏水甘油,水溶性较低,在工业化生产中可能受到限制。且研究表明,冷冻会使蛋黄液出现胶化的现象,这会导致蛋黄的溶解性大打折扣。其次,蛋黄液在经过干燥处理后,脂类物质会从低密度脂蛋白(low density lipoprotein, LDL)中分离并转移至干蛋黄表面,严重降低其乳化性质[5]。此外,目前采用的蛋黄改性方法有酶改性法[6-7]、调节pH法以及糖基化等,这些方法特别是酶改性法不仅成本过高,而且会对卵黄抗体的含量有一定影响。
目前,已有的EYP研究主要集中在对其乳化性和溶解性的提高[7-10],并未考虑干燥对卵黄抗体的影响。因此本研究采用冷冻干燥制备EYP,并添加双糖(海藻糖、蔗糖)来改善冻干EYP的溶解性,并同时对卵黄抗体起到保护作用。以期探究冷冻干燥对EYP结构的损害以及双糖改善其溶解度的机理。
1 材料与方法
1.1 材料与试剂
新鲜红皮鸡蛋(每个大约60 g),洛阳本地超市;海藻糖、D-甘露醇,上海蓝季生物科技有限公司;Na2HPO4、KH2PO4、NaCl、KCl,天津德恩化学试剂有限公司,配制pH 7.4、0.01 mol/L PBS缓冲液;鸡卵黄抗体(IgY)ELISA试剂盒,上海臻科生物科技有限公司。
1.2 仪器与设备
FD-1A-50冷冻干燥机,北京博医康实验仪器有限公司;101型电热恒温鼓风干燥箱,北京科伟永兴仪器有限公司;Xrite color i5色差仪,美国爱色丽公司;TM3030Plus扫描电镜,日本日立公司;DSC1差示扫描量热仪,瑞士Mettler-Toledo公司;Vector 33型傅里叶变换中远红外仪,德国布鲁克公司;Multiskan FC酶标仪,上海赛默飞世尔仪器有限公司。
1.3 实验方法
1.3.1 蛋黄液预处理
取若干鸡蛋,破碎后将蛋黄置于滤纸去除多余蛋清和卵黄膜,收集蛋黄原液于烧杯中并65 ℃巴氏杀菌20 min。取适量蛋黄原液加入2倍体积的蒸馏水,搅拌均匀后按质量等分为3份于同规格平板中,蛋黄液厚度不超过1 cm。配方如表1所示。将样品置于磁力搅拌器中速搅拌30 min,随后在-25 ℃冷冻8 h。
表1 配方组成(比例按蛋黄原液质量计算)
Table 1 Composition of formulation (proportion calculated by raw liquid mass of egg yolk)
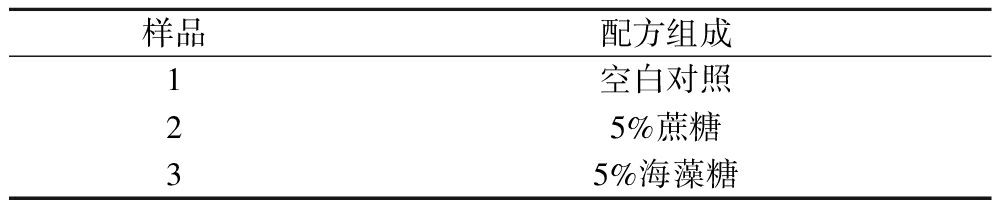
样品配方组成1空白对照25%蔗糖35%海藻糖
1.3.2 EYP的制备
1.3.2.1 FD过程
将预冻好的样品放置在真空冷冻干燥机隔板上后,将腔室压力降低到20 Pa,将冷阱温度降低到-50 ℃,降温速率为2.5 ℃/min。样品的初始温度为-25 ℃,最终温度的上限为20 ℃。冷阱温度和腔室压力分别保持在-50 ℃和20 Pa,干燥时间约为20 h。
1.3.2.2 EYP的处理
冷冻干燥过程结束后,样品呈现为干燥的饼状,使用粉碎机在2 000 r/min粉碎机中粉碎2 min,将得到的EYP用自封袋密封保存待测。
1.4 残余水分含量
分别称取1 g干燥样品,置于烘箱中105 ℃绝干,并计算残余水分含量。每个样品平行测定3次,取平均值。
1.5 溶解度的测定
按照GU等[3]的方法并稍作修改,分别称取0.5 g干燥样品溶于5 mL蒸馏水中,并使用涡旋仪涡旋2 min,随后3 000 r/min离心5 min,取上清液于105 ℃绝干,称取干物质质量,溶解度的计算如公式(1)所示:
溶解度![]()
(1)
式中:m1,上清液干物质质量,g;m2,样品质量,g。
1.6 粉体特性
1.6.1 流动性的测定
将漏斗固定在铁架台上并保持垂直,漏斗下方铺上洁净白纸,使漏斗出口的最底端距白纸3 cm。分别称取1 g样品,将样品沿漏斗内壁缓慢倒入,使其在漏斗下方形成锥体,记录锥体的高为h(cm),半径为r(cm),其休止角(γ)的计算如公式(2)所示:
(2)
1.6.2 堆积密度的测定
按照MOUNIR等[2]的方法并加以修改。称取1 g样品,置于5 mL干燥量筒中,轻轻振荡使其平坦后,记录体积,其堆积密度的计算如公式(3)所示:
(3)
式中:ρ,堆积密度,g/cm3;m,样品质量,g;V,样品容积,cm3。
1.7 表面疏水性的测定
由于EYP的溶解性较低,故采用溴酚蓝(bromophenol blue, BPB)结合法来测定EYP表面疏水性,参考SHEN等[11]的方法并加以改动。将样品溶解于蒸馏水配制5 mg/mL蛋黄溶液,并涡旋1 min。取1 mL蛋黄溶液加入200 μL溴酚蓝溶液(1 mg/mL)涡旋混合,室温下反应10 min,并使用1 mL去离子水代替样品溶液与200 μL溴酚蓝溶液混合作为空白对照。样品经10 000 r/min离心15 min,上清液稀释10倍,测定595 nm处吸光值。表面疏水性用溴酚蓝结合量(BPB bound, μg)表示,BPB bound的计算如公式(4)所示:
(4)
式中:Abs空白,空白对照在595 nm处的吸光度值;Abs样品,样品在595 nm处的吸光度值。
1.8 色泽
使用Xrite color i5型色差仪(美国爱色丽公司)分析了EYP的颜色。分析前,用白色CR-400校准板对仪器进行校准,将样品放在透明塑料袋中以测量颜色。所有分析均测3次平行。
1.9 扫描电镜(scanning electron microscope, SEM)
样品经过喷金处理后,在15 kV的加速电压下,使用SEM对冻干EYP的显微结构进行了表征。
1.10 差示扫描量热仪(differential scanning calorimeter, DSC)分析
使用DSC分析了EYP的热行为。样品在N2净化的干盒中进行称重和制备。每次测量都使用2个封闭的铝坩锅:一个空坩锅作为参考,另一个坩锅装有5 mg的EYP。以高纯N2为载气(100 mL/min),样品在25 ℃平衡3 min后,以20 ℃/min的速率将样品从25 ℃降至-70 ℃,然后再以20 ℃/min的速率升温至100 ℃。采用软件分析标记了初始的玻璃化转变温度和偏移的玻璃化转变温度以及蛋黄液的共晶温度(eutectic temperature, Teu)。通过计算拐点,确定了中间玻璃化转变温度(glass transition temperature, Tg),为进一步的评价提供了依据。
1.11 傅里叶中远红外光谱法(Fourier transform infrared spectrometer, FT-IR)测定二级结构
参考KUDRE等[12]的方法,使用傅里叶变换中远红外仪对冻干样品进行FT-IR分析。将约300 μg样品与约300 mg干燥KBr混合,并使用真空压片机进行压片,用干N2连续清洗仪器和样品室。以KBr光谱为背景,每个样本扫描64次,平均分辨率为4 cm-1,对4 000~400 cm-1的光谱进行分析。然后对得到的FT-IR谱进行二阶导数处理、基线校正和平滑处理。
1.12 ELISA法测定卵黄抗体含量
使用上海臻科生物科技有限公司的“鸡卵黄抗体(IgY)ELISA试剂盒”测定样品中的活性卵黄抗体含量。取0.5 g EYP溶于4.5 mL、0.01 mol/L PBS中并涡旋1 min,然后26 ℃下8 000 r/min离心15 min,取上清液测定。根据说明书进行了酶联免疫吸附试验,抗原-抗体反应完成后使用Multiskan FC型酶标仪测定吸光度,并按照试剂盒所带标准曲线进行定量。
1.13 数据处理与分析
采用SPSS 19.0软件进行显著性分析(P<0.05),使用Origin 8.5软件进行数据处理。上述试验均重复3次,最终结果以平均值表示。
2 结果与分析
2.1 残余水分含量与溶解度
冷冻干燥样品未粉碎前为干燥的冻干饼,呈海绵状。在3组样品中,添加了双糖的样品感官上要比未添加双糖的样品更加细腻,所有样品的残余水分含量均≤5%(表2)。各个样品的溶解度如表2所示。
表2 冻干EYP的残余水分含量和溶解度
Table 2 Residual moisture content and solubility of lyophilized egg yolk powder

样品残余水分含量/%溶解度/%14.35±0.01b15.00±1.00c25.00±0.01a37.50±4.10a35.00±0.02a31.40±3.11b
注:同一列中标注不同字母表示差异显著(P<0.05)(下同)。
结果表明,未添加配方的EYP溶解度仅为15%,而经过添加了双糖的EYP溶解度则大大提高了,这说明双糖的添加不仅在EYP中引入了亲水基团,且结合表面疏水性、微观结构以及蛋白质结构变化来看,双糖维持了EYP中脂蛋白的天然结构,进而改善了冻干EYP的溶解性。且添加蔗糖的样品明显高于添加海藻糖的样品,这可能是由于蔗糖更亲水。此外,冷冻干燥破坏了蛋白质的自然结构,诱导了蛋白质的聚集,这个过程可能是不可逆的[13]。因此,在EYP复水后,蛋白质聚集导致了不溶性蛋黄粉大颗粒的产生,降低了EYP的溶解度。
2.2 冷冻干燥EYP的粉体特性
冻干EYP的流动性和堆积密度由图1所示,添加了双糖的样品普遍比对照样品有更低的休止角和更高的堆积密度。由图1-a可以看出,添加了双糖的样品较未添加双糖的样品休止角均有所降低。根据MOUNIR等[2]的研究,冷冻干燥可能会破坏EYP中脂蛋白的结构,导致蛋黄颗粒中的脂肪融出,并转移到蛋黄颗粒表面,使蛋黄颗粒的黏附性增加,导致流动性变差。而双糖在冷冻干燥过程中起到了冻干保护剂的作用,一定程度上维持了其天然结构。
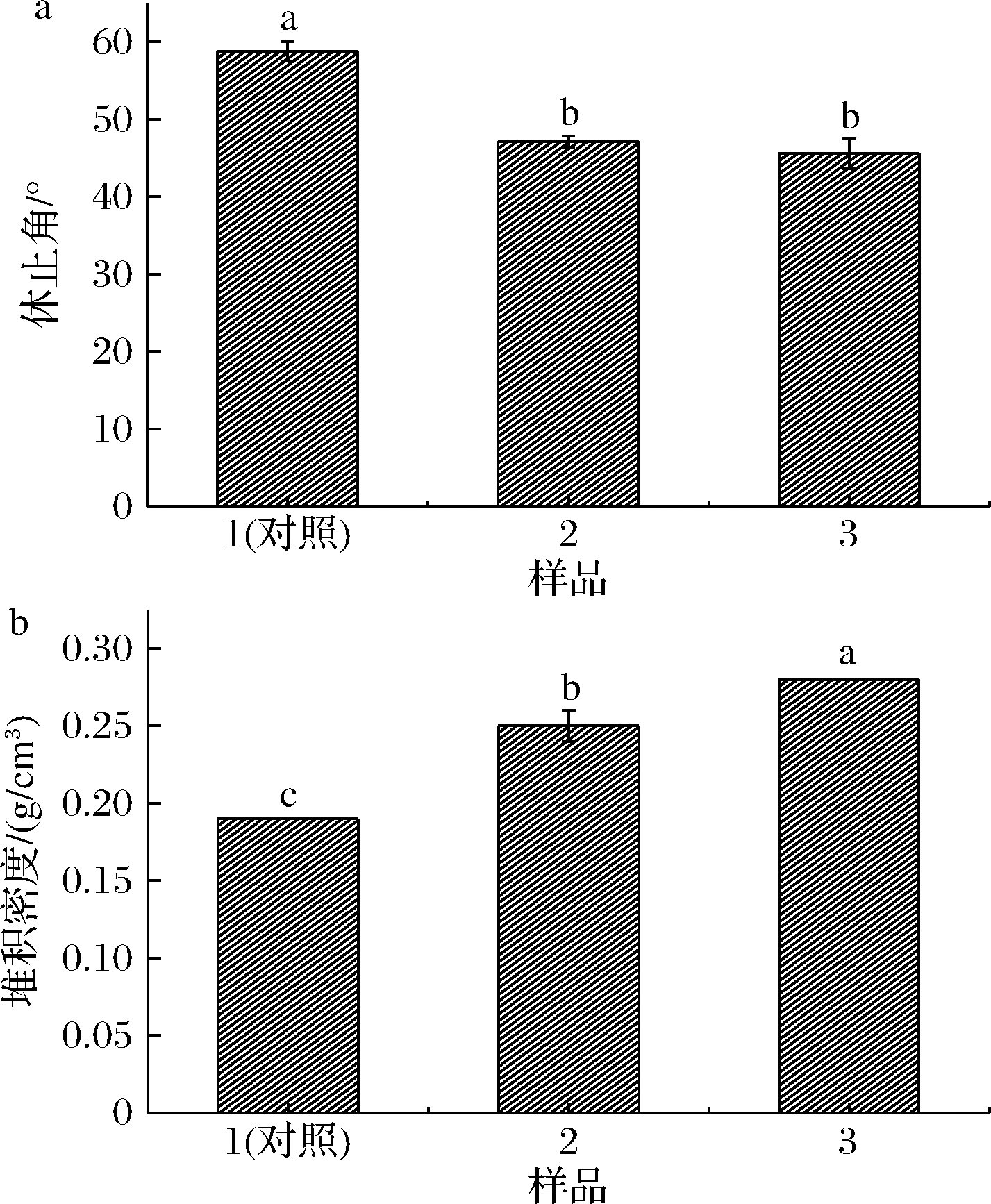
a-休止角;b-堆积密度
图1 冻干EYP的休止角和堆积密度
Fig.1 Rest angle and accumulation density of lyophilized yolk powder
EYP的堆积密度由图1-b所示。结果表明,不管是添加蔗糖样品还是添加海藻糖样品,EYP的堆积密度均较对照样品增加了。这表明未添加双糖的EYP粉体颗粒较大且黏附性较大,导致颗粒间空隙较大,因此堆积密度较小。而添加了配方处理的EYP颗粒较小且黏附性较小,粉体更加细腻,堆积密度更高。
2.3 表面疏水性
表面疏水性(BPB bound)可以用来反映蛋白质分子表面疏水基团的数量,与蛋白质的稳定性、构象和功能密切相关[14-15]。从表3可以看出,与空白对照相比,样品在添加辅料后表面疏水性均有所降低。可能的原因是冷冻干燥诱导蛋白质变性,从而破坏了蛋白质的自然状态,暴露了其表面的氢键和极性基团,导致蛋白质聚集。此外,EYP的溶解度也与其表面疏水性密切相关。研究表明,表面疏水性与溶解度呈负相关,这是由于暴露的疏水基团在广泛的分子间相互作用中溶解度降低,与本研究的结果一致[16-17]。
表3 冻干EYP的表面疏水性
Table 3 Surface hydrophobicity of lyophilized egg yolk powder
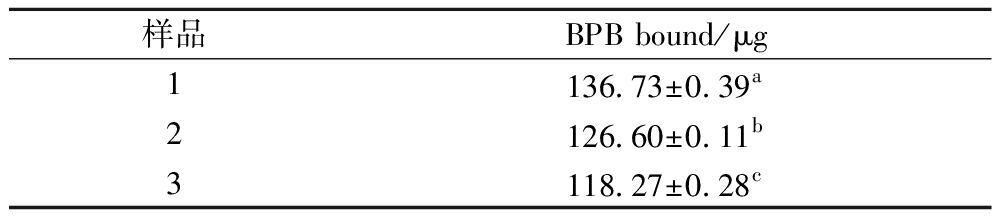
样品BPB bound/μg1136.73±0.39a2126.60±0.11b3118.27±0.28c
2.4 色泽分析
颜色是反映食物特征的一个重要因素,如新鲜度,可以影响消费者的选择[18]。表4显示了EYP的颜色属性:L*、a*和b*。结果表明,不同添加制备的EYP的色度值不同,添加双糖的EYP的亮度值均高于对照样品。此外,b*代表黄蓝值,因此随着粉末的黄色的增加而增加。与FD对照样品相比,添加海藻糖和蔗糖的样品均呈现出更明显的黄色且亮度更高,拥有更好的色泽。
表4 冻干EYP的色泽
Table 4 Color of lyophilized EYP

样品L∗a∗b∗183.24±0.02a7.58±0.14a45.12±0.73b283.54±0.02a7.97±0.06a49.83±0.13a383.99±0.03a7.33±0.01a49.36±0.05a
2.5 微观结构分析
图2为FD得到的EYP的微观结构。所有样品均呈不规则的片状,FD对照样品表面有许多突出的颗粒,这是由于低密度脂蛋白中脂质物质分离并转移到干蛋黄表面。此外,对照样品显示出更多的蛋黄颗粒聚集,可能是由于在冻干过程中,水合壳被部分破坏,从而破坏了蛋白质的自然状态,表面的氢键和极性基团会暴露出来,导致蛋白质变性。在干燥过程中,当水合壳被破坏,蛋白质暴露在缺水的环境中,质子倾向于向电离的羧基转移,从而尽可能地消除蛋白质中的电荷。电荷的减少可能会促进蛋白质分子间的疏水相互作用,从而导致蛋白质聚集[19]。这增加了脂蛋白分子之间的疏水相互作用,并导致蛋黄颗粒相互作用并形成聚集体。添加蔗糖和海藻糖的EYP呈现出更分散的状态,且粒径更小,分布更均匀,因此蛋黄颗粒溶解时与水的接触面更大,更易溶解。此外,添加双糖的EYP表面较对照样品更光滑,突起较少,这说明双糖有效抑制了脂质的融出。

a-1(对照)(×200);b-2(×200);c-3(×200);d-1(对照)(×1 000);e-2(×1 000);f-3(×1 000)
图2 EYP的微观结构
Fig.2 Microstructure of the EYP
2.6 DSC分析
EYP的Tg和Teu与配方组成显著相关(表5)。3组样品的Teu均高于冷冻干燥机的冷阱温度,适用于冷冻干燥。对于Tg,较高的Tg值表明分子运动较慢。FD对照样品的Tg和Teu值分别为34.14 ℃和-8.01 ℃,添加双糖的样品Tg均增加,添加海藻糖样品的Tg高于添加蔗糖的样品,这是由于海藻糖的Tg更高。蛋白质聚集需要大量的扩散运动,但随着Tg的增加而减慢[20]。这表明了添加双糖可以抑制EYP中蛋白质的聚集。此外,具有较高的Tg值,表明其具有较高的温度耐受性,并能在较高的温度下保持其稳定性[21]。因此,含双糖的EYP可以在较高的温度下保存并保持其稳定性。
表5 蛋黄液的共晶温度和EYP的玻璃化转变温度
Table 5 The cocrystal temperature of the egg yolk fluid and the glass transition temperature of the EYP
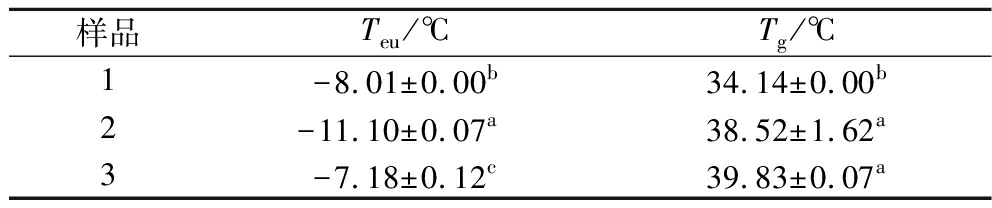
样品Teu/℃Tg/℃1-8.01±0.00b34.14±0.00b2-11.10±0.07a38.52±1.62a3-7.18±0.12c39.83±0.07a
2.7 傅里叶变换中远红外分析
采用傅里叶变换红外光谱法确定了EYP的结构。图3为不同条件下制备的EYP的傅里叶变换红外光谱。EYP表现出一系列的特征峰,包括—OH伸缩振动为3 288 cm-1,—CH2反对称伸缩振动为2 925 cm-1,—CH2对称拉伸振动为2 854 cm-1,—C![]() O伸缩振动为1 746 cm-1。根据之前的研究,蛋黄脂质的特征峰是—CH2在1 460 cm-1处的剪切弯曲振动和—CH3在1 375 cm-1处的对称弯曲振动[22]。研究表明,酰胺Ⅰ带(1 700~1 600 cm-1,如图3所示)常用来表征蛋白质的二级结构[23]。与对照组相比,添加双糖的样品在酰胺Ⅰ带显示出更多的波数,且脂质和蛋白质的特征峰均有轻微的蓝移。表6显示了EYP中各二级结构的相对含量。此外,在制备的样品中,添加双糖的样品与对照组相比保留了更多的α-螺旋和β-折叠。表明双糖在干燥过程中对EYP中的蛋白质天然结构起到了一定的保护作用。这与表面疏水性和溶解度结果一致。
O伸缩振动为1 746 cm-1。根据之前的研究,蛋黄脂质的特征峰是—CH2在1 460 cm-1处的剪切弯曲振动和—CH3在1 375 cm-1处的对称弯曲振动[22]。研究表明,酰胺Ⅰ带(1 700~1 600 cm-1,如图3所示)常用来表征蛋白质的二级结构[23]。与对照组相比,添加双糖的样品在酰胺Ⅰ带显示出更多的波数,且脂质和蛋白质的特征峰均有轻微的蓝移。表6显示了EYP中各二级结构的相对含量。此外,在制备的样品中,添加双糖的样品与对照组相比保留了更多的α-螺旋和β-折叠。表明双糖在干燥过程中对EYP中的蛋白质天然结构起到了一定的保护作用。这与表面疏水性和溶解度结果一致。

图3 EYP的FT-IR图谱
Fig.3 FT-IR spectrum of EYP
表6 EYP的二级结构相对含量
Table 6 Secondary structure relative content of EYP

样品α-螺旋/%β-折叠/%无规则卷曲/%β-转角/%116.32±0.33c35.65±0.43b14.01±0.96a29.89±2.73a216.95±0.19b37.55±0.27a13.70±0.21b28.37±0.37c317.19±0.12a37.42±0.06a13.62±0.16b29.17±1.06b
2.8 EYP中活性IgY的含量
如表7所示,与对照组相比,添加双糖的EYP中保留的活性IgY含量增加。在之前的研究中,冷冻干燥会影响IgY的活性,但海藻糖和蔗糖对IgY均有保护作用[13,24],且海藻糖的保护效果要优于蔗糖。
表7 EYP的活性IgY保留含量
Table 7 Active IgY retention content of EYP

样品活性IgY含量/(mg/g)119.06c221.09b322.15a
3 结论
通过测定EYP的溶解度、色泽、热稳定性以及活性卵黄抗体的含量,确定了双糖对冻干EYP水溶性和活性抗体含量的改善作用。此外,通过测定微观结构、表面疏水性以及二级结构,明确了冻干破坏了蛋黄粉中的蛋白质结构,并导致了干燥后蛋黄颗粒的聚集以及溶解度的降低,而双糖可以抑制这一过程,对蛋白质起到保护作用,这说明EYP的水溶性与其LDL的结构密切相关。因此深入研究在保持其活性卵黄抗体含量的基础上,提高其水溶性和稳定性,对EYP在食品领域的应用具有深远影响。
[1] KOVACS-NOLAN J, MINE Y.Egg yolk antibodies for passive immunity[J].Annual Review of Food Science and Technology, 2012, 3:163-182.
[2] MOUNIR S, ALLAF K.Response surface methodology (RSM) as relevant way to study and optimize texturing by instant controlled pressure drop DIC in innovative manufacturing of egg white and yolk powders[J].Drying Technology, 2018, 36(8):990-1005.
[3] GU L P, JIAO H, MCCLEMENTS D J, et al.Improvement of egg yolk powder properties through enzymatic hydrolysis and subcritical fluid extraction[J].LWT, 2021, 150:112075.
[4] IRZYNIEC Z, KLIMCZAK J, MICHALOWSKI S.Freeze-drying of the black currant juice[J].Drying Technology, 1995, 13(1-2):417-424.
[5] 王婵. 提高蛋黄粉乳化性的研究进展及展望[J].农村经济与科技, 2016, 27(21):99-100;103.
WANG C.Research progress and prospect of improving emulsification of egg yolk powder[J].Rural Economy and Science-Technology, 2016, 27(21):99-100;103.
[6] 李欢欢, 陈伊凡, 张晋, 等.热处理对酶解蛋黄液功能特性和热稳定性的影响[J].中国食品学报, 2020, 20(10):105-114.
LI H H, CHEN Y F, ZHANG J, et al.Effect of heat treatment on the functional properties and thermal stability of liquid egg yolk hydrolyzed with trypsin[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(10):105-114.
[7] 黄丹, 马美湖, 蔡朝霞, 等.磷脂酶A1改性制备高乳化性蛋黄粉的工艺条件优化[J].食品科学, 2010, 31(6):20-25.
HUANG D, MA M H, CAI Z X, et al.Phospholipase A1 modification for preparation of egg yolk powder with high emulsifying properties[J].Food Science, 2010, 31(6):20-25.
[8] TANG S T, ZHOU X, GOUDA M, et al.Effect of enzymatic hydrolysis on the solubility of egg yolk powder from the changes in structure and functional properties[J].LWT, 2019, 110:214-222.
[9] 唐世涛. 超声联合蛋白酶酶解对蛋黄粉溶解性及乳化稳定性的影响[D].武汉:华中农业大学, 2019.
TANG S T.Effect of ultrasonic combined with protease enzymatic hydrolysis on solubility and emulsifying stability of egg yolk powder[D].Wuhan:Huazhong Agricultural University, 2019.
[10] 赵晓光. 磷脂酶改性蛋黄的制备及其应用的研究[D].无锡:江南大学, 2008.
ZHAO X G.Study on preparation and application of phospholipase modified egg yolk with phospholipase[D].Wuxi:Jiangnan University, 2008.
[11] SHEN H, ZHAO M M, SUN W Z.Effect of pH on the interaction of porcine myofibrillar proteins with pyrazine compounds[J].Food Chemistry, 2019, 287:93-99.
[12] KUDRE T G, BEJJANKI S K, KANWATE B W, et al.Comparative study on physicochemical and functional properties of egg powders from Japanese quail and white Leghorn chicken[J].International Journal of Food Properties, 2018, 21(1):957-972.
[13] WANG Z, LI L L, REN G Y, et al.A comprehensive review on stability of therapeutic proteins treated by freeze-drying:Induced stresses and stabilization mechanisms involved in processing[J].Drying Technology, 2022, 40(16):3373-3388.
[14] CHANDRAPALA J, ZISU B, PALMER M, et al.Effects of ultrasound on the thermal and structural characteristics of proteins in reconstituted whey protein concentrate[J].Ultrasonics Sonochemistry, 2011, 18(5):951-957.
[15] SUN Y J, CHEN J H, ZHANG S W, et al.Effect of power ultrasound pre-treatment on the physical and functional properties of reconstituted milk protein concentrate[J].Journal of Food Engineering, 2014, 124:11-18.
[16] LI Q Q, ZHANG X Y, TANG S T, et al.Improved effect of ultrasound-assisted enzymolysis on egg yolk powder:Structural properties, hydration properties and stability characteristics[J].Food Chemistry, 2022, 382:132549.
[17] HU H, WU J H, LI-CHAN E C Y, et al.Effects of ultrasound on structural and physical properties of soy protein isolate (SPI) dispersions[J].Food Hydrocolloids, 2013, 30(2):647-655.
[18] XU L, ECHEVERRIA-JARAMILLO E, SHIN W S.Physicochemical properties of muffins prepared with lutein &zeaxanthin-enriched egg yolk powder[J].LWT, 2022, 156:113017.
[19] HANSEN L J J, DAOUSSI R, VERVAET C, et al.Freeze-drying of live virus vaccines:A review[J].Vaccine, 2015, 33(42):5507-5519.
[20] DEVINENI D, GONSCHOREK C, CICERONE M T, et al.Storage stability of keratinocyte growth factor-2 in lyophilized formulations:Effects of formulation physical properties and protein fraction at the solid-air interface[J].European Journal of Pharmaceutics and Biopharmaceutics, 2014, 88(2):332-341.
[21] XU Y M, CARPENTER J F, CICERONE M T, et al.Contributions of local mobility and degree of retention of native secondary structure to the stability of recombinant human growth hormone (rhGH) in glassy lyophilized formulations[J].Soft Matter, 2013, 9(32):7855-7865.
[22] XIE Y X, WANG J Q, WANG Y, et al.Effects of high-intensity ultrasonic (HIU) treatment on the functional properties and assemblage structure of egg yolk[J].Ultrasonics Sonochemistry, 2020, 60:104767.
[23] SHENG L, HE Z J, CHEN J H, et al.The impact of N-glycosylation on conformation and stability of immunoglobulin Y from egg yolk[J].International Journal of Biological Macromolecules, 2017, 96:129-136.
[24] WANG Z, DUAN X, LI L L, et al.Effects of freeze-drying and microwave vacuum freeze-drying on the activity of IgY:From the perspective of protein structure[J].Drying Technology, 2023, 41(2):222-232.