醛类是酒类中的主要羰基化合物,其中乙醛是酒类中质量浓度最高的挥发性醛类,质量浓度在总醛的60%以上[1-4]。乙醛的质量浓度影响着酒类的风味和老化,乙醛质量浓度低时有水果香,质量浓度高会产生辛辣的刺激性气味并给酒类带来恶劣的青草味,缩短酒类风味的保鲜期,甚至饮用后会引起人体的不良反应[5]。同时,2009年乙醛被列为I类致癌物[6]。
常见的酒类样品中乙醛含量检测方法为GC和HPLC法,为了提高准确性通常会结合固相微萃取或衍生化处理技术[7-8]。GC和HPLC法检测乙醛涉及昂贵仪器的使用而且程序复杂,相比之下,近年来涌现的荧光探针检测方法展示出其简便、廉价且高效等优势。荧光探针已经成功应用于水、饮料以及生物系统中金属离子、甲醛和酶的检测[9-15],同时也包含空气中羰基类化合物检测[9,16]等诸多领域。但是在酒类检测分析领域应用较少[17-18],而且尚无一种应用于酒类样品中乙醛检测的荧光探针。
目前荧光探针的主要设计方法是依据响应机理寻找合适的反应基团和荧光基团[19]。为了建立一种高效分析和检测酒类样品中乙醛的方法,本研究报道了一种基于4-硝基苯呋咱为荧光基团[20],肼基作为反应基团的荧光探针,作用原理为光电子诱导转移(photoinduced electron transfer,PET)过程。本研究通过蒸馏法去除酮酸类物质等的干扰在荧光探针检测实际样品的应用中属于首次,结果表明本研究开发的荧光探针可以成功用于啤酒、白酒、黄酒和葡萄酒等酒类的乙醛质量浓度的检测。
1 材料与方法
1.1 实验材料
1.1.1 荧光探针
图1中展示了荧光探针的合成路线。称取500 mg 4-氯-7-硝基苯并呋咱于烧瓶中,外壁包裹锡纸避光。加入50 mL氯仿使4-氯-7-硝基苯并呋咱充分溶解。加入50 mL体积分数5%水合联氨(3.125 mL体积分数80%水合联氨+46.875 mL甲醇),N2吹扫后封口搅拌5 h,静置1 h,析出黄褐色沉淀并抽滤,用二氯甲烷清洗滤饼,得到固体461.61 mg。

图1 荧光探针合成途径
Fig.1 Synthesis of the fluorescent probe
1.1.2 实验试剂
二甲亚砜、水合肼、甲醇、三氯甲烷、二氯甲烷、氯仿和乙腈(均为色谱纯)、盐酸和N,N-二甲基甲酰胺(N,N-Dimethylformamide,DMF)(均为分析纯),中国国药集团。4-氯-7-硝基苯并呋咱、乙醛、糠醛、5-羟甲基糠醛、乙偶姻、2,3-丁二酮、2,3-戊二酮、2,3-己二酮、丙酮酸、丙酮、羟基丙酮、α-酮戊二酸、甲基乙二醛、丙醛、丁醛、异丁醛、异戊醛、己醛、苯乙醛、乙二醛、L-天冬酰胺、L-谷氨酸酸、1-丙醇、1-丁醇、异丁醇、异戊醇、苯乙醇、乙酸、乳酸、乙酸乙酯、乙酸异戊酯、己酸乙酯、乳酸乙酯和3-庚酮(均为分析纯),Aladdin公司。
1.1.2.1 选择性分析物
称取乙醛、糠醛、5-羟甲基糠醛、乙偶姻、2,3-丁二酮、2,3-戊二酮、2,3-己二酮、丙酮酸、丙酮、羟基丙酮、羟基丙酮、α-酮戊二酸、甲基乙二醛、正丙醛、正丁醛、异丁醛、异戊醛、己醛、壬醛、苯乙醛、乙二醛、天冬氨酸、谷氨酸、乙醇、丙醇、正丁醇、异丁醇、异戊醇、苯乙醇、乙酸、乳酸、乙酸乙酯、乙酸异戊酯、己酸乙酯和乳酸乙酯各100 mg溶于10 mL纯水中得到10 g/L母液并储存在-20 ℃下,稀释至15 mg/L用于选择性分析。
1.1.2.2 抗干扰性分析物
根据报道的啤酒、白酒、黄酒和葡萄酒中羰基化合物和醇酯类化合物的质量浓度,配制模拟样品来证明其他干扰物存在的条件下乙醛的响应情况,各样品的干扰物质量浓度如下:
啤酒:乙醛10 mg/L;干扰物:乙缩醛 25 mg/L、丙醛 0.3 mg/L、正丁醛 0.3 mg/L、异丁醛 0.3 mg/L、异戊醛 0.1 mg/L、庚醛 0.2 mg/L、辛醛 0.2 mg/L、糠醛 2 mg/L、5-羟甲基糠醛 8 mg/L、2,3-丁二酮 0.1 mg/L、2,3-戊二酮 0.5 mg/L、乙偶姻 5 mg/L、丙酮醛 0.1 mg/L、正丙醇 25 mg/L、异戊醇 100 mg/L、乙酸 20 mg/L、乙酸乙酯 50 mg/L、乙酸异戊酯 10 mg/L、丙酮酸 100 mg/L。
白酒:乙醛300 mg/L;干扰物:乙缩醛 800 mg/L、丙醛 20 mg/L、异丁醛 10 mg/L、异戊醛 100 mg/L、糠醛 20 mg/L、苯甲醛 400 mg/L、苯乙醛 440 mg/L、5-羟甲基糠醛 600 mg/L、2,3-丁二酮 230 mg/L、正丙醇 2 250 mg/L、异戊醇 460 mg/L、乳酸 1 000 mg/L、乙酸 1 000 mg/L、己酸 500 mg/L、乙酸乙酯 5 000 mg/L、己酸乙酯 3 000 mg/L、乳酸乙酯 2 000 mg/L、四甲基吡嗪 5 mg/L。
黄酒:乙醛50 mg/L;干扰物:乙缩醛 50 mg/L、丙醛5 mg/L、异丁醛5 mg/L、异戊醛5 mg/L、糠醛 10 mg/L、苯甲醛150 mg/L、5-羟甲基糠醛 500 mg/L、乙酸乙酯 100 mg/L、丙醇 80 mg/L、异丁醇 100 mg/L、异戊醇 300 mg/L、3-甲基丁醇 200 mg/L、乳酸 5 000 mg/L、乙酸 1 500 mg/L、乳酸乙酯 500 mg/L、β-苯乙醇 100 mg/L、单乙基琥珀酸酯 180 mg/L、丙酮酸 50 mg/L。
葡萄酒:乙醛100 mg/L;干扰物:乙缩醛100 mg/L、丙醛10 mg/L、异丁醛10 mg/L、异戊醛10 mg/L、2,3-丁二酮 2 mg/L、乙偶姻 5 mg/L、糠醛 20 mg/L、异丁醇 150 mg/L、异戊醇 150 mg/L、乳酸 500 mg/L、乙酸 2 000 mg/L、乙酸乙酯 100 mg/L、乳酸乙酯 100 mg/L、丙酮酸 20 mg/L。
1.1.3 酒类样品
啤酒样品由当地超市购买的成品酒以及实验室自制的发酵液组成,白酒、黄酒和红酒样品是从当地超市购买的。发酵液按参考文献[21]的方法进行制备。成品啤酒、啤酒发酵液、白酒、黄酒和葡萄酒的信息如表1和表2所示。
表1 成品啤酒和发酵液样品信息表
Table 1 Basic information of the samples of beer

样品酒精度(体积分数)/%原麦汁浓度/°P发酵度/%成品啤酒14.610.5-成品啤酒24.911.0-啤酒发酵液15.512.066.7啤酒发酵液24.812.064.3
注:-表示没有该项数据。
表2 白酒、黄酒和葡萄酒信息表
Table 2 Basic information of the samples of Baijiu, wine and Huangjiu

样品产品名称酒精度(体积分数)/%产地白酒样品1郎酒45.0四川泸州白酒样品2泸州老窖52.0四川泸州黄酒样品1沙洲优黄11.0江苏苏州黄酒样品2塔牌10.0浙江绍兴葡萄酒样品1张裕12山东烟台葡萄酒样品2长城13河北张家口
在乙醛模拟体系中:分别向100 mL乙醛标准溶液样品(10 mg/L)中加入100、200、400 μL乙醛储备溶液(1 g/L),每个加标量制备3个平行样品;在真实酒类体系中,分别向100 mL啤酒中加入100、200、400 μL乙醛储备溶液(1 g/L),向100 mL白酒中加入1 000、2 000、4 000 μL乙醛储备溶液(1 g/L),向100 mL黄酒和葡萄酒中加入500、1 000、2 000 μL乙醛储备溶液(1 g/L)。每个加标量制备3个平行样品,用于回收率的验证。
1.2 实验仪器
全波长酶标仪 Synergy H4,美国Biotek仪器有限公司;顶空气相色谱仪 HS-10/GC-2010,日本岛津公司。
1.3 实验方法
1.3.1 荧光探针检测方法
目前被普遍接受的检测方法如图2-a所示,通用检测方法将酒类样品适当稀释后,取微量滴入探针溶液中进行检测[22]。本研究使用的荧光探针检测方法如图2-b所示,与通用方法最大的不同在于,酒类样品在检测前需进行蒸馏收集,检测方法如下:

a-通用方法;b-本研究使用的方法
图2 荧光探针检测方法示意图
Fig.2 Schematic diagram of the fluorescent probe detection method
使用双乙酰蒸馏装置对酒样进行蒸馏。取酒样100 mL,啤酒等含气样品需滴加一滴消泡剂,白酒用蒸馏水稀释25倍,黄酒和葡萄酒样品用蒸馏水稀释10倍。当馏出液接近20 mL时停止接收,并用蒸馏水补足到20 mL,得到馏出液A。蒸馏过程在2 min中内完成,馏出液在冰浴下使用25 mL具塞比色管接收。
在5 mL离心管中加入250 μL盐酸溶液(体积分数8%,溶剂为乙腈),10 μL蒸馏后的酒类样品(10 μL纯水作为空白对照),740 μL荧光探针溶液(40 mg/L,溶剂为乙腈),置于5 ℃培养箱中低温反应20 min,取200 μL反应液于96孔酶标板中并在荧光光谱仪上检测,将除去空白的荧光强度带入线性回归方程F553 nm=79.25Cs+134.49(R2=0.998 3)中,得到乙醛质量浓度Cs。样品中乙醛的质量浓度计算如公式(1)。
C=Cs/N
(1)
式中:C,样品中乙醛的质量浓度;N,蒸馏的浓缩倍数,样品为啤酒时N=5,样品为白酒时N=0.2,样品为黄酒或葡萄酒时N=0.5。
1.3.2 荧光探针与乙醛的紫外吸收光谱和荧光光谱
在V(乙腈)∶V(DMSO)=9∶1(pH 2.1)的体系中测试荧光探针(40 mg/L)与不同质量浓度乙醛(0、1、2、5、10、20、30、40、50、60、70、80、90、100 mg/L)反应完全后的紫外吸收光谱图。
在V(乙腈)∶V(DMSO)=9∶1(pH 2.1)体系中测试荧光探针(40 mg/L)与不同质量浓度乙醛(0、1、2、5、10、20、30、40、50、60、70、80、90、100 mg/L)反应完全后,在荧光光谱仪上得到512~700 nm的荧光光谱图。激发波长485 nm;狭缝宽度2 nm、2 nm;检测温度25 ℃。
测试荧光探针在DMSO、MeOH、纯水、乙腈、DMF和PBS共6种溶剂中的紫外吸收光谱和荧光光谱,探针质量浓度均为40 mg/L,在5 ℃下反应20 min。
1.3.3 顶空气相色谱法(headspace gas chromatography,HS-GC)
用纯水将乙醛标准储备液(1 g/L)按照质量浓度梯度依次稀释为1~100 mg/L的乙醛标准溶液,白酒样品需稀释10倍。取4 mL乙醛标准溶液或4 mL酒类样品于顶空进样瓶中,并加入1 mL 3-庚酮内标工作溶液(30 mg/L)和2.0 g NaCl,盖好橡胶盖并压紧铝帽。HS-GC分析条件:平衡温度70 ℃;平衡时间30 min;传输线温度130 ℃;进样时间0.04 min;进样口温度200 ℃;检测器温度250 ℃;程序升温40~180 ℃(10 ℃/min);柱流量1.2 mL/min;载气(N2)流量30 mL/min;燃气(H2)流量47 mL/min;助燃气流量:400 mL/min。将酒类样品的峰面积和内标峰面积的比值作为y值带入标准曲线y=0.231 3x-0.001 3,R2=0.999 7中得到酒类样品中乙醛的质量浓度x。
2 结果与分析
2.1 荧光探针的合成
苯并呋咱属于一类较为常见的荧光基团,改变4位和7位的取代基会产生不同的发射特点。本研究将4位取代基设计为硝基作为强吸电子基团,7位取代基设计为肼基作为反应基团,形成PET效应。反应基团与乙醛结合后,乙醛争夺了肼基向硝基转移的电子,PET过程被破坏,引起荧光发射增强。利用这一原理可以实现对酒类样品中乙醛含量的检测,荧光响应示意图如图3所示。
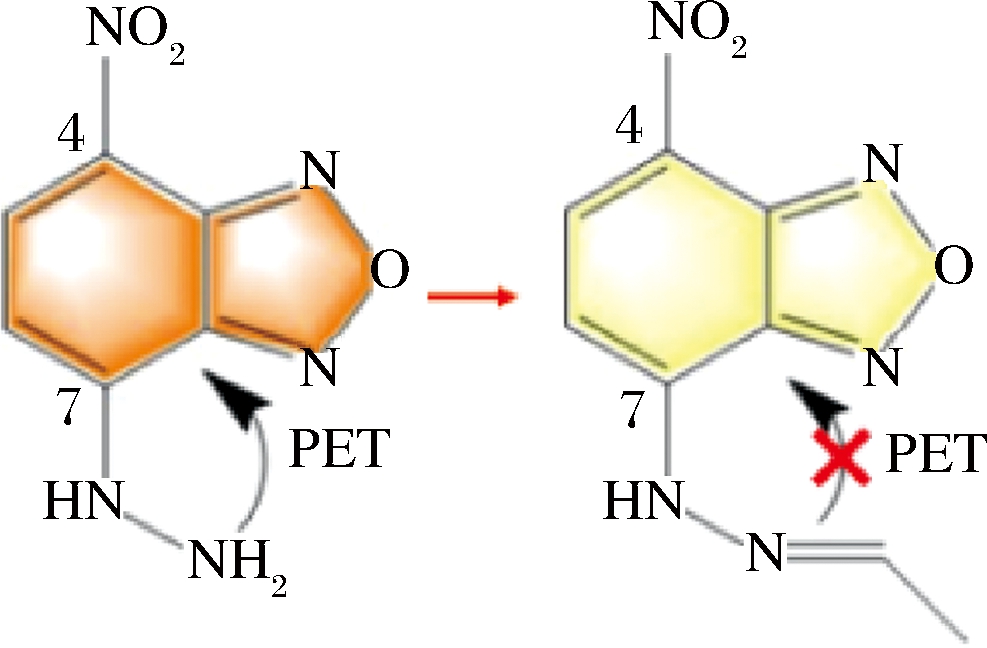
图3 荧光探针响应机理
Fig.3 Response mechanism of the fluorescent probe
2.2 紫外吸收光谱及荧光性质研究
荧光探针与乙醛的紫外吸收光谱如图4-a所示,荧光探针主要吸收峰在450~550 nm,最大吸收峰为485 nm。加入乙醛后吸收强度增加,在485 nm处有最强吸收峰。因此荧光光谱的激发波长的参数应选择485 nm。

a-荧光探针与不同浓度乙醛的紫外吸收光谱;b-荧光探针与不同浓度乙醛的荧光光谱;c-荧光探针在不同溶剂下的紫外吸收光谱;d-荧光探针在不同溶剂下的荧光光谱
图4 紫外吸收光谱及荧光光谱
Fig.4 Spectra of UV absorption and fluorescence
荧光探针与乙醛的荧光光谱如图4-b所示,荧光探针在512~600 nm处显示出主要吸收带,而且在553 nm表现出不断增强的最大吸收峰,表明荧光探针与乙醛反应后生成新物质并释放荧光信号。
如图4-c所示,荧光探针在DMSO、MeOH、纯水、乙腈、DMF和PBS溶剂最大吸收波长集中在436~492 nm。同时可以观察到,随着溶剂极性的增加,荧光探针的最大吸收波长发生了红移,当溶剂为纯水和PBS时最大吸收波长为436 nm,溶剂为MeOH时最大吸收波长为448 nm,而当乙腈、DMF和DMSO作为溶剂时最大吸收波长则在464~492 nm,属于正溶剂效应。
如图4-d所示,荧光探针在不同溶剂中的最大发射波长在552~568 nm,斯托克斯位移的范围在68~132 nm。荧光探针在乙腈、DMF和MeOH中几乎具有相同的最大发射波长,为553 nm。而荧光探针在DMSO(最大发射波长560 nm)、纯水(最大发射波长564 nm)和PBS(最大发射波长568 nm)中的最大发射波长都出现了不同程度的红移,但红移范围都在15 nm之内,差异并不明显。值得注意的是,在乙腈中可以观察到较为强烈的荧光增强,荧光探针在乙腈中表现出的荧光强度要远高于其他5种溶剂。
2.3 选择性和抗干扰性分析
测试多种分析物来证实荧光探针的选择性,结果如图5所示。测试相同质量浓度(10 mg/L)的选择性分析物。结果表明,在相同质量浓度下,探针对乙醛的响应值最高,啤酒中部分微克级别羰基化合物如正丙醛、正丁醛和异丁醛的荧光强度为乙醛的4%~26%,而啤酒中毫克级别羰基化合物响应值较低,仅为乙醛响应值的1%~14%,同时可以发现探针对醇酯类物质几乎没有响应,对白酒、黄酒以及葡萄酒中除乙醛外的主要风味物质响应值微乎其微。

图5 选择性分析
Fig.5 Selectivity analysis
本研究合成的荧光探针也曾被用作荧光衍生剂,并结合高效液相色谱仪和荧光检测器检测羰基化合物,涉及的羰基化合物包括乙醛、丙醛、丁醛、戊醛、苯甲醛、茴香醛、丙酮、苯乙酮和苯丙酮等,这些羰基化合物经过一定的预处理都可以和荧光探针完全反应[23-24]。但从报道的结果来看,乙醛的响应值要远高于其他羰基化合物,且预处理时间最短。酒类中其他羰基化合物可以和荧光探针上的肼基相结合,但在乙醛与荧光探针反应结束时,活性不高的羰基化合物尚未与荧光探针完全反应,响应值极低。
因此,本研究合成的荧光探针在实际检测应用中具有明显的优势。为了进一步证明荧光探针的实用性,还需要进行抗干扰分析。
抗干扰性能分析如图6所示,证实探针的抗干扰性需要模拟真实酒类样品,这种模拟真实样品质量浓度的方式在以往的研究中有过实例[25]。干扰物质应包含羰基化合物以及酒类样品中含量丰富的醇酯类化合物,质量浓度的选择以报道过的最高质量浓度作为依据[1-4]。

a-啤酒模拟样品;b-白酒模拟样品;c-黄酒模拟样品;d-葡萄酒模拟样品
图6 抗干扰性分析
Fig.6 Anti-interference analysis
结果表明,丙酮酸的干扰较强,尤其会影响啤酒中乙醛含量的检测。在100 mg/L丙酮酸的存在下,会导致啤酒中乙醛检测值偏高约30%。在50 mg/L丙酮酸的存在下, 会导致黄酒中乙醛检测值偏高约10%。在20 mg/L丙酮酸的存在下,会导致葡萄酒中乙醛检测值偏高约5%。丙酮酸对白酒中乙醛检测的干扰可忽略不计。丙酮酸是啤酒发酵液中的重要代谢产物,由选择性分析可知,荧光探针对丙酮酸的响应值为乙醛的10%以下,但丙酮酸在发酵液中的质量浓度有时会超过100 mg/L,作为啤酒发酵液中高浓度的羰基化合物,对荧光探针检测啤酒中乙醛的影响较大,严重限制了荧光探针检测方法的应用。
乙缩醛对乙醛的检测干扰也较为明显,尤其影响啤酒和白酒中乙醛的检测,乙缩醛在酸性条件下会水解为乙醛,乙醛和荧光探针FPN1作用后促进乙缩醛进一步水解,进而导致检测值偏高。在25 mg/L乙缩醛的存在下,会导致啤酒中乙醛检测值偏高约17%。在800 mg/L乙缩醛的存在下,会导致白酒中乙醛检测值偏高16%。由选择性分析可知,荧光探针对乙缩醛的响应值为乙醛的15%,而啤酒和白酒中乙缩醛质量浓度约为乙醛质量浓度的2~3倍,会导致检测结果偏高,同样限制了对酒类中乙醛检测的应用。
本研究提出的荧光探针检测方法则可以通过蒸馏的方式将乙缩醛和丙酮酸留在蒸馏室内,达到去除干扰物的目的。
2.4 荧光探针检测方法的实际应用
荧光探针和乙醛浓度的线性关系如图7所示,线性范围为0.12~200 mg/L,检测限为0.12 mg/L。荧光探针检测方法的回收率和RSD如表3所示。回收率为91.50%~111.14%,回收率效果较好。RSD在1.12%~5.95%,检测方法的稳定性较优。
表3 荧光探针检测方法的有效性
Table 3 The validity of the fluorescent probe detection method
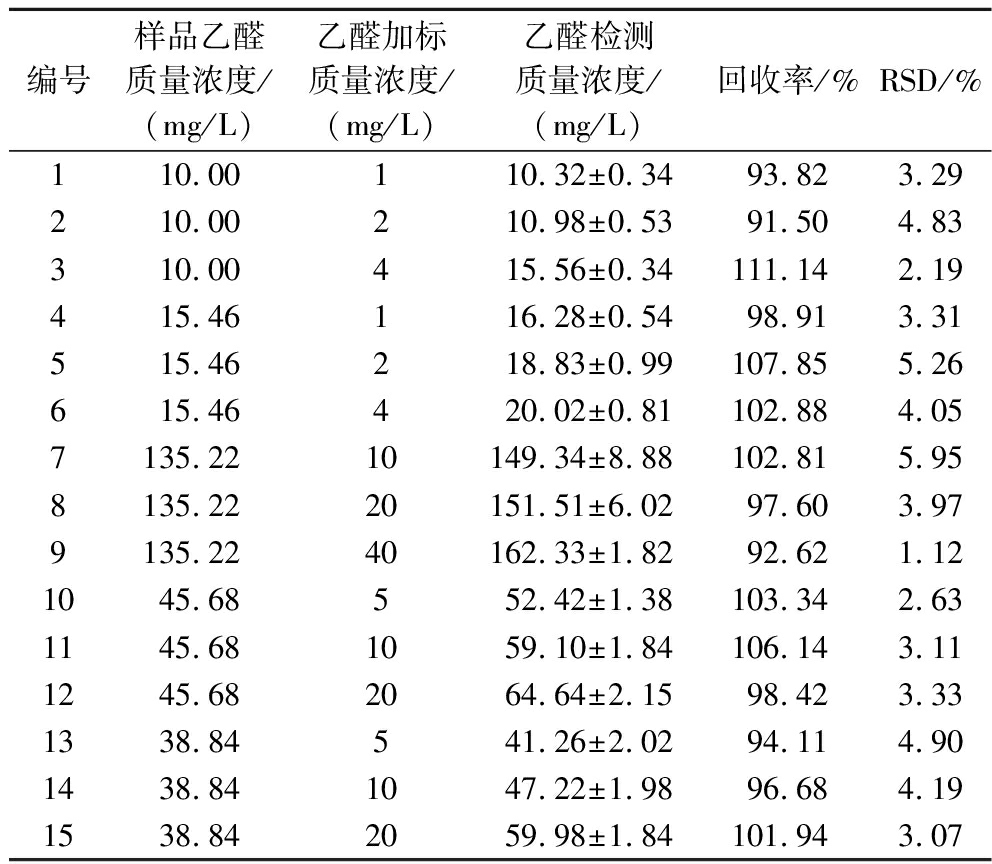
编号样品乙醛质量浓度/(mg/L)乙醛加标质量浓度/(mg/L)乙醛检测质量浓度/(mg/L)回收率/%RSD/%110.00110.32±0.3493.823.29210.00210.98±0.5391.504.83310.00415.56±0.34111.142.19415.46116.28±0.5498.913.31515.46218.83±0.99107.855.26615.46420.02±0.81102.884.057135.2210149.34±8.88102.815.958135.2220151.51±6.0297.603.979135.2240162.33±1.8292.621.121045.68552.42±1.38103.342.631145.681059.10±1.84106.143.111245.682064.64±2.1598.423.331338.84541.26±2.0294.114.901438.841047.22±1.9896.684.191538.842059.98±1.84101.943.07
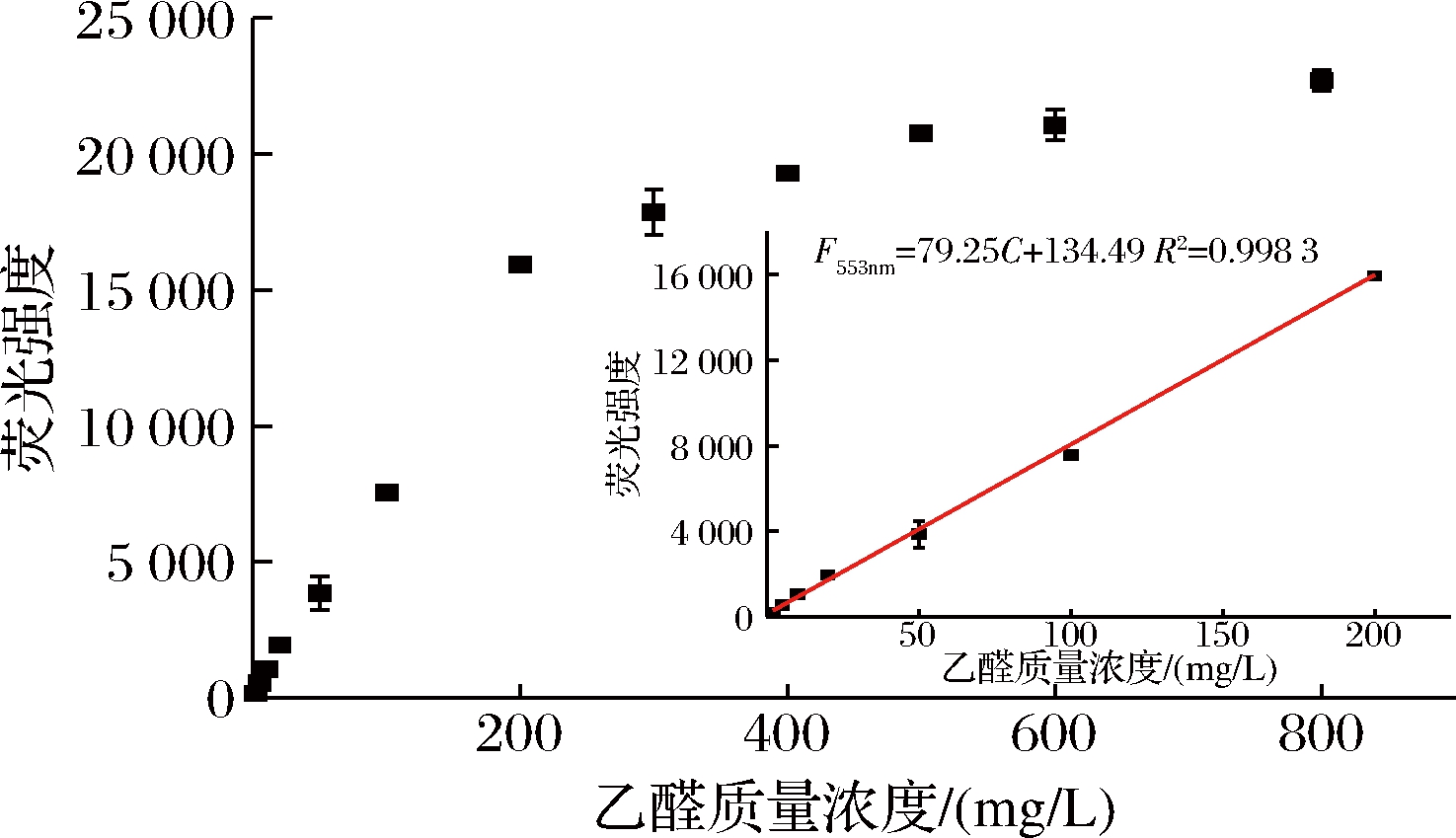
图7 荧光强度和乙醛质量浓度的线性关系图
Fig.7 Linear relationship between fluorescence intensity and acetaldehyde concentration
用荧光探针检测方法和HS-GC法对啤酒、白酒、黄酒和葡萄酒样品中的乙醛质量浓度进行检测,结果如表4所示。结果经显著性差异分析,P=0.632>0.05,说明2种方法的检测结果无显著性差异。
表4 基于荧光探针检测方法和HS-GC法检测酒类样品中的乙醛
Table 4 Determination of acetaldehyde concentrations in the samples of alcoholic beverages by fluorescent probe method and HS-GC method
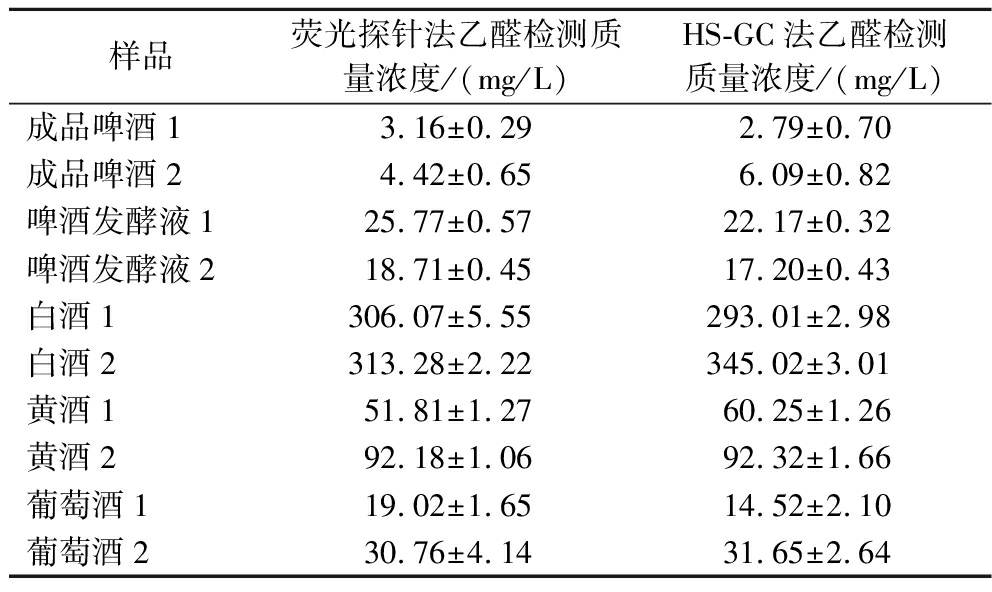
样品荧光探针法乙醛检测质量浓度/(mg/L)HS-GC法乙醛检测质量浓度/(mg/L)成品啤酒13.16±0.292.79±0.70成品啤酒24.42±0.656.09±0.82啤酒发酵液125.77±0.5722.17±0.32啤酒发酵液218.71±0.4517.20±0.43白酒1306.07±5.55293.01±2.98白酒2313.28±2.22345.02±3.01黄酒151.81±1.2760.25±1.26黄酒292.18±1.0692.32±1.66葡萄酒119.02±1.6514.52±2.10葡萄酒230.76±4.1431.65±2.64
3 结论与讨论
本研究提出了基于荧光探针的酒类样品中乙醛的新型快速检测方法。通过蒸馏排除酒类中酮酸类物质等的干扰具有实际应用价值。荧光探针检测方法的线性范围和回收率分别为0.12~200 mg/L和91.50%~111.14%。尚有进一步开发试纸法的潜力,可以从试纸的选择、探针质量浓度的选择、表面活性剂的选择以及稳定性验证对试纸法进行开发,制备荧光标准比色卡,将样品检测结果与标准比色卡进行比较可以快速高效地判断酒类样品中乙醛的浓度范围。乙醛在酒类酿造过程中主要由生物途径和化学途径产生,实时监测乙醛含量对酒类质量管控具有重要意义,荧光探针检测方法在保证准确度的同时,避免了昂贵的大型检测仪器的使用,简便快捷,节约成本。本研究开发的荧光探针成功地应用于啤酒、白酒、黄酒和葡萄酒等酒类样品中乙醛含量的检测。
[1] WEI Y, ZOU W, SHEN C H, et al.Basic flavor types and component characteristics of Chinese traditional liquors:A review[J].Journal of Food Science, 2020, 85(12):4096-4107.
[2] YU H Y, XIE T, XIE J R, et al.Characterization of key aroma compounds in Chinese rice wine using gas chromatography-mass spectrometry and gas chromatography-olfactometry[J].Food Chemistry, 2019, 293:8-14.
[3] LAGO L O, NICOLLI K P, MARQUES A B, et al.Influence of ripeness and maceration of the grapes on levels of furan and carbonyl compounds in wine -Simultaneous quantitative determination and assessment of the exposure risk to these compounds[J].Food Chemistry, 2017, 230:594-603.
[4] MOREIRA N, MEIRELES S, BRAND O T, et al.Optimization of the HS-SPME-GC-IT/MS method using a central composite design for volatile carbonyl compounds determination in beers[J].Talanta, 2013, 117:523-531.
O T, et al.Optimization of the HS-SPME-GC-IT/MS method using a central composite design for volatile carbonyl compounds determination in beers[J].Talanta, 2013, 117:523-531.
[5] SAISON D, DE SCHUTTER D P, VANBENEDEN N, et al.Decrease of aged beer aroma by the reducing activity of brewing yeast[J].Journal of Agricultural and Food Chemistry, 2010, 58(5):3107-3115.
[6] SECRETAN B, STRAIF K, BAAN R, et al.A review of human carcinogens—Part E:Tobacco, Areca nut, alcohol, coal smoke, and salted fish[J].The Lancet Oncology, 2009, 10(11):1033-1034.
[7] ELIAS R J, LAURIE V F, EBELER S E, et al.Analysis of selected carbonyl oxidation products in wine by liquid chromatography with diode array detection[J].Analytica Chimica Acta, 2008, 626(1):104-110.
[8] WANG Q, O’REILLY J, PAWLISZYN J.Determination of low-molecular mass aldehydes by automated headspace solid-phase microextraction with in-fibre derivatisation[J].Journal of Chromatography A, 2005, 1071(1/2):147-154.
[9] MANNA S K, ACHAR T K, MONDAL S.Recent advances in selective formaldehyde detection in biological and environmental samples by fluorometric and colorimetric chemodosimeters[J].Analytical Methods:Advancing Methods and Applications, 2021, 13(9):1084-1105.
[10] XIN F Y, TIAN Y, JING J, et al.A two-photon fluorescent probe for imaging of endogenous formaldehyde in HeLa cells and quantitative detection of basal formaldehyde in milk samples[J].Analytical Methods, 2019, 11(23):2969-2975.
[11] KOLANOWSKI J L, LIU F, NEW E J.Fluorescent probes for the simultaneous detection of multiple analytes in biology[J].Chemical Society Reviews, 2018, 47(1):195-208.
[12] PAK Y, SWAMY K, YOON J.Recent progress in fluorescent imaging probes[J].Sensors, 2015, 15(9):24374-24396.
[13] TERAI T, NAGANO T.Fluorescent probes for bioimaging applications[J].Current Opinion in Chemical Biology, 2008, 12(5):515-521.
[14] WANG J J, RAO Q P, WANG H Y, et al.A terpyridine-based test strip for the detection of Hg2+ in various water samples and drinks[J].Analytical Methods, 2019, 11(2):227-231.
[15] WANG J L, WANG H, HAO Y F, et al.A novel reaction-based fluorescent probe for the detection of cysteine in milk and water samples[J].Food Chemistry, 2018, 262:67-71.
[16] LIU X, LI N, LI M, et al.Recent progress in fluorescent probes for detection of carbonyl species:Formaldehyde, carbon monoxide and phosgene[J].Coordination Chemistry Reviews, 2020, 404:213109.
[17] WU X M, WANG H, YANG S X, et al.A novel coumarin-based fluorescent probe for sensitive detection of copper(II) in wine[J].Food Chemistry, 2019, 284:23-27.
[18] WANG H, WANG J L, YANG S X, et al.Highly selective and rapidly responsive fluorescent probe for hydrogen sulfide detection in wine[J].Food Chemistry, 2018, 257:150-154.
[19] 刘宜嵩, 王壬, 钮成拓, 等.荧光探针在高通量筛选技术上的应用进展[J].食品与发酵工业, 2021, 47(11):266-271.
LIU Y S, WANG R, NIU C T, et al.Application of fluorescence probe in high throughput screening[J].Food and Fermentation Industries, 2021, 47(11):266-271.
[20] MENG Q T, SHI Y, WANG C P, et al.NBD-based fluorescent chemosensor for the selective quantification of copper and sulfide in an aqueous solution and living cells[J].Organic &Biomolecular Chemistry, 2015, 13(10):2918-2926.
[21] 许鑫. 基于增变因子选育低乙醛啤酒酵母及机制解析[D].无锡:江南大学, 2020.
XU X.Breeding of low acetaldehyde beer yeast based on mutagens and its mechanism analysis[D].Wuxi:Jiangnan University, 2020.
[22] DUAN N, YANG S X, TIAN H Y, et al.The recent advance of organic fluorescent probe rapid detection for common substances in beverages[J].Food Chemistry, 2021, 358:129839.
[23] GÜBITZ G, WINTERSTEIGER R, FREI R W.Fluorogenic labelling of carbonylcompounds with 7-hydrazine-4-nitrobenzo-2-oxa-1, 3-diazole (NBD-H)[J].Journal of Liquid Chromatography, 1984, 7(4):839-854.
[24] KOIZUMI H, SUZUKI Y.High-performance liquid chromatography of aliphatic aldehydes by means of post-column extraction with fluorometric detection[J].Journal of Chromatography A, 1988, 457:299-307.
[25] YU M, ZUO C S, ZHANG N.An experimental and computational study on naphthylideneimine based pH sensitive fluorescence probe for zinc[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2020, 224:117389.