洋葱(Allium cepa L.)是百合科、葱属多年生草本植物,别名玉葱、葱头[1]。洋葱是一种耐储藏、便于流通的农作物,是一种世界性蔬菜,其栽培历史强[2-3],现在更是为世界人民所喜爱。中国的新疆、甘肃、云南、山东等地都盛产洋葱,洋葱味道辛辣、鲜美、可口,是很好的饭菜佐料。洋葱中富含各种营养物质,不光具有良好的食用效果,近几年在药用方面的研究也越来越多。洋葱具有抗氧化[4]、抗肿瘤、清除自由基、抗衰老、防治心血管疾病等作用[5-6]。其中烟酸是洋葱中一种重要的有效成分,本研究对洋葱中的烟酸做出研究。
烟酸属于维生素B系列化合物[7],又称尼克酸、维生素B3、抗癞皮病因子,分子式为C6H5NO2,化学名称吡啶-3-甲酸,呈白色结晶或结晶性粉末,无臭或有微臭,味微酸,水溶液显酸性,是对于人体十分重要的营养成分,对于促进人体的正常生长发育十分重要。各种植物中都含有烟酸,但是含量差别较大[8]。
目前针对烟酸的提取方法主要有振荡提取法[9]、直接浸取法[10-12]、微生物法[13]、固相萃取法[14]、超声提取法[15]、微波提取法。对烟酸含量的研究主要有液相色谱法[16-20]、液相色谱-质谱法[9],毛细管电泳法[21-22],紫外可见分光光度计[23]。周琳[16]建立HPLC,使用梯度洗脱,选取250 nm测定了烟酸片中有关物质;谭建平等[17]建立高效液相色谱法用于烟酸注射液中烟酸的含量测定及有关物质检查,该方法使用C18柱,检测波长为262 nm;王艳等[18]建立反相高效液相色谱法,使用C18色谱柱(150 mm×4.6 mm,5 μm),在265 nm下同时测定多维元素片中烟酸、维生素B1、维生素B6、烟酰胺和维生素B2的方法;郝刚等[9]采用超高效液相色谱串联质谱(ultra performance liquid chromatography-tandem mass spectrometry, UPLC-MS/MS)的方法测定奶粉中烟酸含量,烟酸提取后经强阳离子交换固相萃取柱净化,采用BEH-C18超高效液相色谱柱、20 mmol/L乙酸水溶液-乙腈(体积比为20∶80)流动相分离,以电喷雾离子源正离子方式进行多反应监测(multiple reaction monitorin, MRM),所建方法适合奶粉中烟酸的含量测定;曹江平等[23]建立了超声、微波辅助酸解法,之后采用紫外可见分光光度计测定了枸杞中烟酸的含量。在研究中毛细管电泳法并不常见,很多实验室都没有毛细管电泳仪器,因而不如液相色谱法方便简洁。紫外分光光度法测定烟酸定量相对稳定,但是因为提取基质复杂可能存在干扰,对定量研究产生影响,因而不如液相色谱法、液相色谱-质谱法来的定量准确。液相色谱-质谱法虽然定量准确,但是仪器贵重,大多实验室没法提供检测。液相色谱法可以配合多种检测器进行良好的定性定量,在测定的同时也能为制备色谱法制备烟酸提供参考依据,但是试验表明现有报道的检测烟酸液相色谱方法还不是很科学和准确,普遍存在提取不完全、加标回收率低等不足。
本研究在系统地分析总结现有方法的基础上,通过与现有文献报道的主要方法对比,试验出了提取洋葱中烟酸的新的前处理方法,并对高效液相色谱法的条件进行了优化选择,方法操作简单、检测灵敏度高、稳定性好,为测定洋葱中烟酸含量提供了方法支撑,同时对我国主要产区的洋葱中烟酸的含量进行了研究,该方法及分析检测数据可以应用到洋葱提取物及功能性成分研究领域。
1 材料与方法
1.1 原料与试剂
洋葱:市售。
甲醇、乙腈(色谱纯),默克股份两合公司;无水乙醇(分析纯),天津市科密欧化学试剂有限公司;乙酸乙酯(色谱纯),赛默飞世尔科技(中国)有限公司;甲酸(分析纯),天津市凯信化学工业有限公司;烟酸标准品(C6H5NO2,CAS号:59-67-6,纯度≥99.6%),德国Dr.Ehrenstorfer GmbH。
1.2 仪器与设备
1260型高效液相色谱仪、1290+6460型液质联用仪,安捷伦科技有限公司;SP-756P型紫外分光光度计,上海光谱仪器有限公司;ME203/02天平,梅特勒-托利多仪器(上海)有限公司;A2S-T-1024-BE超纯水机,美国艾科浦国际有限公司;MS3型涡旋混合器,IKA公司;KH-600型超声波清洗机,昆山禾创超声仪器有限公司;TG16C型离心机,长沙英泰仪器有限公司;SQP型万分之一电子天平,德国赛多利斯公司。
1.3 实验方法
1.3.1 样品前处理
用制样器将样品充分打碎,后混匀,装入自封袋中,密封之后做好标记,在-20 ℃以下冷冻存放,称样前解冻后摇匀。
称取样品5 g(精确至0.01 g)于烧杯中,转移样品于25 mL容量瓶中,并用0.1%(体积分数)甲酸水定容,全部转移至50 mL离心管中,涡旋1 min,之后超声20 min,置于离心机中,在室温条件下以10 000 r/min的速度,离心5 min,取上清液过微孔滤膜(0.22 μm,尼龙)后上机测定。
1.3.2 标准曲线溶液的配制
准确称取10 mg烟酸标准品,用0.1%(体积分数,下同)甲酸水溶解,转移至10 mL容量瓶中,用0.1%甲酸水定容,配制成1 mg/mL的标准储备液;吸取适量标准储备液用0.1%甲酸水稀释成1、5、10、50、100 μg/mL的标准系列溶液。
1.3.3 高效液相色谱仪条件
色谱柱:ZORBAX Eclipse Plus C18液相色谱柱(250 mm×4.6 mm,5 μm);流动相A:0.01%(体积分数)甲酸水溶液;流动相B:甲醇;流动相比例:A为90%,B为10%,流速:1.0 mL/min,柱温:35 ℃,进样量:10 μL,二级管阵列检测器检测范围:190~400 nm,检测波长:260 nm。
1.3.4 定性、定量方法
主要以烟酸保留时间定性,辅助以全扫描光谱定性进行二次确认,以外标法烟酸进行定量分析。
2 结果与分析
2.1 提取方式的选择
因烟酸的水溶液呈现酸性,在酸性条件下可以到达更好的提取效果。为了更好地提取洋葱中的烟酸,分别对使用0.1%甲酸水提取法、0.1%甲酸乙醇提取法、0.1%甲酸甲醇提取法、0.1%甲酸乙酸乙酯提取法、0.1%甲酸乙腈提取法进行提取试验对比,并且与现有文献[19-20]报道比较新的方法进行比较,从表1可以看出以上溶液均能不同程度地提取洋葱中的烟酸,0.1%甲酸水的提取效果最佳,比普遍认可的报道文献方法更优。
表1 不同的试剂提取的效果的对比 单位:mg/kg
Table 1 Comparison of extraction effects of different reagents
提取方式0.1%甲酸水0.1%甲酸乙醇0.1%甲酸甲醇0.1%甲酸乙腈0.1%甲酸乙酸乙酯甲醇∶水(3∶7)pH 4.5水(盐酸)烟酸含量12.811.411.412.00.26.810.3
同时,对不同提取时间下洋葱中烟酸提取的效果进行了提取研究,不同的提取效果见表2,发现超声提取20 min就足以将洋葱中的烟酸完全提取出来,更多的时间对于洋葱中的烟酸提取效果没有明显的提升,反而浪费时间和资源。
表2 不同时间下提取效果的对比 单位:mg/kg
Table 2 Comparison of extraction effects of different time
提取时间/min20 min40 min60 min烟酸含量13.312.612.7
2.2 色谱条件的选择
2.2.1 检测波长的选择
通过高效液相色谱-二极管阵列检测器的全波长3D扫描功能,在190~400 nm波段内对槲皮素进行全扫描。通过扫描结果可知,烟酸在192 nm处有最强的紫外吸收,但是基线不平稳;而在260 nm处烟酸有最佳紫外吸收,有最大的信噪比,具体的图谱见图1,因而选取260 nm作为本实验的检测波长。

图1 烟酸标准色谱图
Fig.1 Standard chromatogram of nicotinic acid
2.2.2 色谱柱的选择
C18色谱柱是液相色谱法最为常用的色谱柱,但是由于烟酸在水中会发生水解,致使烟酸峰型很差,必须在酸性流动相体系条件下才能出峰良好,因而在水相中加入0.1%的甲酸。加入甲酸致使流动相的酸性较强,一般的C18柱在该pH下分离效果会受到影响,且同时会影响色谱柱的寿命,所以本方法采用了Agilent ZORBAX Eclipse Plus C18液相色谱柱(250 mm×4.6 mm,5 μm),该色谱柱在硅胶制造和键合技术方面工艺先进,因此获得了更优异的效果。在低pH流动相条件下的分离时,具有良好的色谱柱寿命和优异的重现性。结果表明Agilent ZORBAX Eclipse Plus C18液相色谱柱(250 mm×4.6 mm,5 μm)能够很好地分离、检测烟酸,基线平稳、波动小。
2.2.3 流动相的选择
检测烟酸的流动相体系一般是在酸性体系来检测,乙腈比较适用于低波长,高波长则应选择甲醇体系,通过比较0.1%磷酸水溶液体系、0.1%醋酸水溶液体系、0.1%甲酸水溶液体系和报道文献[16-20]方法选择的流动相体系发现,0.1%甲酸水溶液体系下烟酸的峰形更好,对称性更好,没有拖尾。因此,选用0.1%甲酸水溶液+甲醇的体系来测定洋葱中烟酸的含量。
2.2.4 流动相比例的选择
烟酸亲水性较好,流动相采用梯度洗脱时烟酸和杂质的出峰时间过早,从而使得烟酸和杂质没有很好地分离,且有基线波动会干扰检测结果,致使烟酸检测的效果不佳。而采用等度洗脱时,可以保持流动相体系的环境持续稳定,基线波动非常小,并且烟酸和杂质可以很好地分离,能够准确地检测烟酸,分析检测洋葱中烟酸色谱图具体见图2。

图2 洋葱中烟酸的色谱图
Fig.2 Chromatogram of nicotinic acid in onion
2.3 标准曲线
该方法的标准曲线以质量浓度(X,μg/mL)为横坐标、峰面积(Y)为纵坐标,在烟酸标准溶液浓度1~100 μg/mL,标准曲线的相关系数(R)范围为0.999 91~0.999 98,烟酸标准溶液的线性关系良好,满足洋葱中烟酸定量分析的要求。
2.4 检出限和定量限
以0.1%甲酸水作空白基质,在其中加入低浓度烟酸标准品,确定该方法中烟酸的方法检出限为0.15 mg/kg,定量限为0.50 mg/kg,可见本方法的检出限和定量限非常低,说明本方法的响应好,灵敏度高。
2.5 回收率、精密度和烟酸稳定性
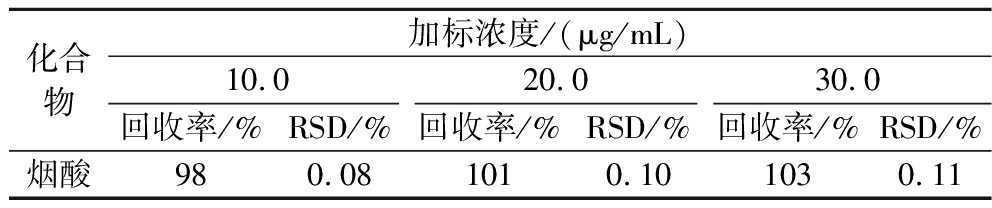
选用烟酸含量合适的洋葱,在其中添加10.0、20.0、30.0 μg/mL 3个浓度的烟酸标准溶液,按照本方法样品前处理方法进行处理,每个加标样品平行测定6次,从表3可以看出本实验中烟酸的加标回收率为98%~103%,相对标准偏差(relative standard deviation, RSD)为0.08%~0.11%,说明该检测方法的准确度和精密度很好,非常适用于洋葱中烟酸的分析检测。
表3 烟酸的回收率和精密度
Table 3 Recoveries and RSDs of nicotinic acid
化合物加标浓度/(μg/mL)10.020.030.0回收率/%RSD/%回收率/%RSD/%回收率/%RSD/%烟酸980.081010.101030.11
标准样品在常温放置24 h之后进样,标准样品浓度减小0.32%~0.59%,样品稳定性很好。
2.6 与报道文献方法的对比
分别用本方法与已报道的周琳[16]建立的使用梯度洗脱并选取250 nm测定了烟酸片中有关物质、谭建平等[17]建立高效液相色谱法用于烟酸注射液中烟酸的含量测定及有关物质检查、王艳等[18]建立反相高效液相色谱法在265 nm同时测定多维元素片中烟酸、维生素B1、维生素B6、烟酰胺和维生素B2的方法、郝刚等[9]采用UPLC-MS/MS测定奶粉中烟酸含量的方法、曹江平等[23]建立了超声、微波辅助酸解法前处理法之后采用紫外可见分光光度计测定了枸杞中烟酸的含量的相关提取分析方法对同一黄洋葱进行了分析对比,具体分析检测的结果见表4,很明显本方法测得的含量比报道方法测得的含量高的多,同时在黄洋葱中添加25 μg /mL的烟酸标准溶液后前处理及分析检测,本方法的加标回收率为99%,报道文献方法的加标回收率为49%~66%,具体见图3,通过试验证明本方法更优于已报道的方法。

图3 本方法与报道方法的加标回收率对比
Fig.3 Comparison of spiked recoveries between this method and the reported method
表4 本方法与报道方法检测结果的对比 单位:mg/kg
Table 4 Comparison of detection results between this method and the reported method

化合物提取分析方法本方法测含量周琳[16]法测含量谭建平等[17]法测含量王艳等[18]法测含量郝刚等[9]法测含量曹江平等[23]法测含量烟酸30.219.219.618.520.114.8
2.7 洋葱样品分析
对不同品种洋葱和洋葱的不同部位中的烟酸含量进行了研究测试,从检测结果发现,不同洋葱中烟酸含量差别较大,具体结果见表5,不同品种洋葱中的烟酸含量差别较大,黄洋葱和紫洋葱中的烟酸含量较高;同一品种洋葱中,洋葱越新鲜洋葱中烟酸含量越高;同一洋葱中不同部位的烟酸含量差别较大,见表6,洋葱表皮的烟酸含量小于洋葱中心的烟酸含量,规律呈现出越接近洋葱内部烟酸含量越高。
表5 不同洋葱中烟酸含量对比 单位:mg/kg
Table 5 Comparison of nicotinic acid content in different onions
名称紫洋葱白洋葱小白洋葱黄洋葱烟酸含量19.611.712.822.2
表6 洋葱中不同部位烟酸含量对比 单位:mg/kg
Table 6 Comparison of nicotinic acid content in different parts of onions
名称5号洋葱表皮5号洋葱中部5号洋葱中心烟酸含量5.315.528.9
2.8 不同主产区洋葱中烟酸的质量评价
我国的洋葱主要产区在甘肃、新疆、吉林、黑龙江、内蒙古、山东、四川、云南,因为不同地域的气候和地质差别比较大,通过分析检测发现不同地域的洋葱的烟酸含量有很大差异,其中甘肃、新疆产的洋葱中的烟酸含量较高,尤其是甘肃酒泉产的最高,含量可达到32 mg/kg,应与该地域的沙土地质和昼夜温差大有一定的关联,不同地域的洋葱中烟酸的含量见图4。以洋葱中烟酸的含量为指标对洋葱进行质量评价,甘肃酒泉产的洋葱质量等级最高,依次是新疆石河子、吉林延吉、黑龙江齐齐哈尔产的为中等,再次是内蒙古通辽、云南元谋、山东潍坊、四川西昌产的为低一等级,北方种植的洋葱质量等级普遍较高。

图4 不同区域洋葱中烟酸的含量
Fig.4 Content of nicotinic acid in onion from different regions
3 结论
烟酸是洋葱中很重要的营养成分,本次研究建立了高效液相色谱-二极管阵列检测器测定洋葱中烟酸的方法。利用0.1%甲酸水超声提取,以高效液相色谱-二极管阵列检测器进行定性和定量的分析,该方法前处理简单快速,实验灵敏度高,具有精密度、准确度好等特点,有效地解决了现有国内外报道方法中普遍存在的提取效果不佳、检测不准确的问题,适用于洋葱中烟酸含量的检测分析,同时分析检测了主要产区洋葱中烟酸的含量,可为洋葱的品质筛选、功能性成分研究和深加工提供有效依据。
[1] 刘梓建, 袁先铃, 张镨予, 等.洋葱品种制调味汁的适宜性评价[J].中国调味品, 2022, 47(1):46-51.
LIU Z J, YUAN X L, ZHANG P Y, et al.Evaluation on the suitability of onion varieties for making sauce[J].China Condiment, 2022, 47(1):46-51.
[2] 周琬颜. 中国洋葱国际竞争力研究[D].保定:河北农业大学, 2019.
ZHOU W Y.Study on the international competitiveness of Onions in China[D].Baoding:Hebei Agricultural University, 2019.
[3] 向伟勇, 许晓光.全球化背景下中国洋葱产业发展的机遇与挑战[J].中国蔬菜, 2022(1):16-21.
XIANG W Y, XU X G.Opportunities and challenges of onion industry development in China under the background of globalization[J].China Vegetables, 2022(1):16-21.
[4] 王诗童, 王娟, 黄威, 等.洋葱和洋葱皮对烤肉饼中多环芳烃和气味的影响[J].食品安全导刊, 2022(3):65-67;71.
WANG S T, WANG J, HUANG W, et al.Effect of onion and onion peel on polycyclic aromatic hydrocarbons and odor in grilled pork patties[J].China Food Safety Magazine, 2022(3):65-67;71.
[5] 陈佳. 洋葱皮黄酮酶法辅助提取、纯化及体外抗氧化研究[D].杨凌:西北农林科技大学, 2011.
CHEN J.Enzymatic-assisted extraction, purification and antioxidant activity of flavonoids from onion peel[D].Yangling:Northwest A &F University, 2011.
[6] 王荟如. 红洋葱:我们身边的抗衰老新星[J].健康指南:中老年, 2022(7):16-17.
WANG H R.Red onion-the anti-aging star around us[J].Health Guide:Middle-aged and Elderly, 2022(7):16-17.
[7] 关静, 霍艳艳, 董春娇.烟酸类药物的研究进展[J].沈阳医学院学报, 2011, 13(2):110-112.
GUAN J, HUO Y Y, DONG C J.Research progress of nicotinic acid drugs[J].Journal of Shenyang Medical College, 2011, 13(2):110-112.
[8] 赖文清. 烟酸[J].国外畜牧学-猪与禽, 2003, 23(2):14-16.
LAI W Q.Niacin[J].Foreign Animal Husbandry (Pig and Poultry), 2003,23(2):14-16.
[9] 郝刚, 俞蕴莉, 顾炳仁.UPLC-MS/MS法测定奶粉中烟酸的含量[J].中国乳业, 2014(11):54-58.
HAO G, YU Y L, GU B R.Determination of nicotinic acid in milk powder by ultra performance liquid chromatography-tandem mass spectrometry[J].China Dairy, 2014(11):54-58.
[10] 裴亭. 高效液相色谱法测定茶叶中烟酸的含量[J].茶叶科学, 2011, 31(2):124-128.
PEI T.Determination of nicotinic acid in tea leaves by HPLC[J].Journal of Tea Science, 2011, 31(2):124-128.
[11] 黄敏文, 王广基, 孙建国, 等.RP-HPLC法测定Beagle犬血浆中烟酸浓度及烟酸药代动力学研究[J].中国临床药理学与治疗学, 2005, 10(3):302-305.
HUANG M W, WANG G J, SUN J G, et al.Determination of sustained-release niacin formulation by RP-HPLC in dog plasma and its pharmacokinetic study[J].Chinese Journal of Clinical Pharmacology and Therapeutics, 2005, 10(3):302-305.
[12] 远辉, 丁春瑞, 郝明明.高效液相色谱法测定新疆开心果中烟酸的含量[J].安徽农业科学, 2012, 40(34):16801-16802.
YUAN H, DING C R, HAO M M.Determination of nicotinic acid in pistachio of Xinjiang uygur autonomous region by HPLC[J].Journal of Anhui Agricultural Sciences, 2012, 40(34):16801-16802.
[13] 邓小净, 梅秀鹏, 徐德, 等.不同玉米籽粒中烟酸和玉米黄质含量的测定[J].食品科学, 2015, 36(12):119-124.
DENG X J, MEI X P, XU D, et al.Niacin and Zeaxanthin contents in different maize kernels[J].Food Science, 2015, 36(12):119-124.
[14] 丁海萍, 赵玉英, 王琳琳.高效液相色谱法测定蓄中烟酸的含量[J].内蒙古民族大学学报(自然科学版), 2012, 27(3):277-279.
DING H P, ZHAO Y Y, WANG L L.Determination the content of nicotinic acid in Polygonum aviculare L by HPLC[J].Journal of Inner Mongolia University for Nationalities (Natural Sciences), 2012, 27(3):277-279.
[15] 姚春燕, 李彩均.高效液相色谱法测定化妆品中烟酸、烟酰胺含量[J].科技资讯, 2014, 12(4):138-139.
YAO C Y, LI C J.Determination of nicotinic acid and nicotinamide in cosmetics by HPLC[J].Science &Technology Information, 2014, 12(4):138-139.
[16] 周琳. 烟酸片中有关物质的测定及结果分析[J].海峡药学, 2022, 34(5):71-74.
ZHOU L.Determination and result analysis of related substances in nicotinic acid tablets[J].Strait Pharmaceutical Journal, 2022, 34(5):71-74.
[17] 谭建平, 陈禧翎, 郑思嘉.HPLC法测定烟酸注射液中烟酸的含量及有关物质[J].国际医药卫生导报, 2012, 18(12):1785-1788.
TAN J P, CHEN X L, ZHENG S J.Concentration and related substances of niacin injection determined by high performance liquid chro-matography[J].International Medicine & Health Guidance News, 2012, 18(12):1785-1788.
[18] 王艳, 王坚民.高效液相色谱法同时测定元素多维片中5种水溶性维生素[J].中国卫生检验杂志, 2010, 20(3):510-511.
WANG Y, WANG J M.HPLC determination of five water soluble vitamins in multivitamin tablets[J].Chinese Journal of Health Laboratory Technology, 2010, 20(3):510-511.
[19] 刘红梅, 张黎兴.高效液相色谱法测定烟酰胺中烟酸的含量[J].广东化工, 2021, 48(18):175-176;183.
LIU H M, ZHANG L X.Determination of nicotinic acid in nicotinamide by HPLC[J].Guangdong Chemical Industry, 2021, 48(18):175-176;183.
[20] 李越, 方亚莉.高效液相色谱法测定特殊膳食中的烟酸和烟酰胺[J].食品安全导刊, 2021(27):79;83.
LI Y, FANG Y L.Determination of nicotinic acid and nicotinamide in special diet by HPLC[J].China Food Safety Magazine, 2021(27):79;83.
[21] 丁黎, 李世壮.高效毛细管电泳在中药分析中的应用[J].药学进展, 1995, 19(2):78-82.
DING L, LI S Z.Application of high performance capillary electrophoresis in the analysis of traditional Chinese medicine[J].Progress in Pharmaceutical Sciences, 1995, 19(2):78-82.
[22] 齐莉, 周蓉, 王雅芬, 等.高效毛细管电泳在食品分析中的应用[J].分析测试仪器通讯, 1997, 7(3):159-164.
QI L, ZHOU R, WANG Y F, et al.High performance capillary electrophoresis and its application in food analysis[J].Analytical Instruments Newsletter, 1997, 7(3):159-164.
[23] 曹江平, 周继梅, 邸宏伟, 等.枸杞中烟酸提取方法研究[J].应用化工, 2016, 45(8):1525-1527;1531.
CAO J P, ZHOU J M, DI H W, et al.Study on extraction method of nicotinic acid in Goji berries(Lycium barbarum)[J].Applied Chemical Industry, 2016, 45(8):1525-1527;1531.