依靠不可再生原料的化工、能源、医药等传统制造业以“高排放、高污染”的加工模式对生态环境造成巨大影响,在全球倡导发展绿色低碳循环经济体系的趋势下,传统制造业面临绿色转型的严峻挑战[1]。具有原料再生、过程高效清洁优良特征的生物制造作为生物经济战略性新兴产业发展方向,利用生物有机体进行高质量的绿色生产,有望推动生物技术融合工业制造,变革未来物质加工和生产模式,实现绿色可持续发展[2]。
工业微生物细胞工厂是绿色生物制造的前提,其利用天然可再生原料通过自身代谢网络合成“高价值、低能耗”的各类物质,也可实现废弃物回收利用,提高资源利用率[3]。目前微生物细胞工厂已广泛应用于轻工业、化工、能源、环保、生物防治等领域生产食品、药品、生物环保材料和生物制剂等。但是,迄今为止我国自主研发的成熟高性能工业微生物细胞工厂仍然较少,其生产水平距国际大公司先进工业微生物细胞工厂仍存在一定差距。因此,开展我国自主工业微生物细胞工厂的设计创制研究,是保障我国生物制造产业绿色可持续发展的关键[4]。
为了建立具有优良性状的高效微生物细胞工厂,对微生物为底盘的工业菌株进行多维度的改造与构建,通过多轮“设计-构建-测试-学习”(design-build-test-learning,DBTL)循环以达到以下目的[5]:(1)提高微生物细胞的生长速率;(2)扩大底物谱及增强底物转化效率;(3)提高目标产物的产量和质量;(4)增强微生物底盘细胞的鲁棒性和耐受性;(5)优化目标产物生产分离方式,减少下游产业成本等。对此研究人员融合“建物致知”和“建物致用”的理念开发了许多育种策略,主要包括传统的诱变育种策略和新型的理性、非理性育种策略以创制微生物细胞工厂[6]。
由于谷氨酸棒杆菌(Corynebacterium glutamicum)具有公认食品安全(Generally Regarded As Safe, GRAS)的特性,已成为工业生产的模式微生物之一,被应用于构建绿色高效的微生物细胞工厂[7]。20世纪50年代后已被广泛用于大规模生产L-氨基酸,随着基因工程、代谢工程和分子生物学等学科的发展,它也被用于工业生产高价值产品,包括有机酸、聚合物前体、高级醇和蛋白质等。而该菌株的非致病性、无芽孢、迅速生长、无内毒素,有完整的分泌途径,胞外水解酶活性较低的优良性状使其备受关注[8]。近年来,基因编辑技术、代谢调控技术和高通量筛选技术的快速发展,显著加速了工业菌种的改造提升与工业化应用,也推动了生物制造领域的进步[9]。本文针对谷氨酸棒杆菌的育种策略和高通量筛选结合实际案例进行综述,介绍了传统及新型育种策略,并展望了生物技术与人工智能融合对未来微生物细胞工厂的潜在应用。
1 谷氨酸棒杆菌育种策略
从自然界中分离得到的谷氨酸棒杆菌,其性状远不能满足工业生产的需要,因此如何对微生物底盘进行提升,以获得高产高效的工业微生物细胞工厂就成为了工业应用的关键。而微生物育种的策略主要包括传统育种和新型育种,传统育种方式主要采用诱变育种,是指在人为条件下,利用物理、化学、生物因素,诱发生物体产生突变,从中选择、培育植物和微生物新品种的方法,而随着合成生物学、代谢工程、基因编辑技术、多种组学以及各种交叉学科的深入研究,使得微生物细胞工厂创制技术得到了不断的发展和创新[6],发展的新型育种包括非理性的重离子辐射、常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变育种、适应性进化育种,理性的基因编辑等,这些技术和手段都为获得优质的微生物底盘细胞提供了便利[10]。
1.1 传统育种策略
诱变育种作为传统的微生物育种技术被广泛应用于生物领域,包括物理诱变、化学诱变、生物诱变及复合诱变[11]。如图1所示,它不需要复杂的基因操作及代谢网络调控知识,方便快捷、成本较低及成功率较高,因此为微生物选育提供了便利。

图1 提高重组蛋白产量的主要方法[11]
Fig.1 The main method to increase the yield of recombinant protein[11]
物理诱变主要利用电离辐射如X-射线、γ-射线和来自放射性物质及非电离辐射如紫外线、激光、微波等物理诱变因素,加速微生物的突变率。电离辐射能量极高,能使构成基因的化学物质直接发生电离作用,从而形成变异。非电离辐射的能量较低,只能产生激发作用,其中紫外线照射是最常采用的方法之一,紫外线可使DNA分子形成嘧啶二聚体,阻碍碱基正常配对,引起突变或死亡[12]。陈晓博等[13]通过紫外线诱变谷氨酸棒杆菌出发菌株BC001,用结构类似物D-精氨酸平板筛选获得高产L-精氨酸的BC307突变株,产量提升至2.94 g/L。
化学诱变主要利用一些化学物质以提高生物的突变率,其可以使DNA分子发生烷化、错配或移码,影响mRNA的转录,造成功能蛋白重组,表型改变[14]。常用的化学诱变剂如烷化剂、碱基类似物、移码诱变剂等。例如,ZHANG等[15]先通过沉默丙酮酸脱氢酶基因复合物并敲除乳酸脱氢酶基因,然后通过硫酸二乙酯诱变获得高产3-甲基-1-丁醇的谷氨酸棒杆菌突变体,其产量高达659 mg/L。
生物诱变通过提高基因重组频率获得新的遗传型,主要包括噬菌体、DNA转座子诱变和原生质体融合、基因组重排等。其中原生质体融合是一种很重要的菌种改良技术,可将遗传性状不同的亲株细胞进行随机融合,借以获得兼有双亲优良性状的稳定重组子[16]。它打破了物种间界限,实现远缘菌株的基因重组,为诱变育种提供了一种有效手段。张婧芳等[17]将谷氨酸棒杆菌GS538和谷氨酸高产菌S9114进行原生质体融合,定向选育出1株高产L-鸟氨酸的RH169菌株,产量可达19.3 g/L。
复合诱变是采用2种或多种诱变剂同时处理或先后使用。因为菌株长期使用同种诱变剂后,会产生“疲劳效应”,同时会出现菌株生长周期延长、代谢减慢、回复突变等问题,而研究表明复合诱变具有协同效应,较单一因子诱变有很大优势[11]。例如,PARK等[18]用N-甲基-N-亚硝基-N′-硝基胍和紫外线处理谷氨酸棒杆菌AR0菌株,成功获得耐10 g/L精氨酸羟酸酯和30 g/L刀豆氨酸的AR1突变菌株,AR1经分批补料培养后L-精氨酸产量达34.2 g/L,比在相同条件下培养的AR0菌株获得的L-精氨酸高2倍以上。
1.2 新型育种策略
随着科学技术的发展,多种新型育种策略的出现为创制工业微生物细胞工厂注入了新的活力,主要分为非理性的育种策略和理性的育种策略。非理性的育种策略包括重离子辐射、ARTP诱变技术及适应性进化等策略。理性育种策略是基于合成生物学、基因编辑技术及微生物代谢网络的深入研究,应用理性设计构建优良的微生物细胞工厂[19]。
1.2.1 非理性育种策略
相比存在一定的安全风险的传统育种技术,近年来发展的新型育种技术[20]更加安全高效。例如重离子辐射、ARTP等有无毒无害、突变率高、遗传稳定等优点,适应性进化具有能够提供足够的遗传多样性,积累丰富的有益突变体等特点,这些技术加速了优良微生物细胞工厂的构建。
重离子辐射在其穿透的路径上有较大的能量沉积,产生很强的局部电离,与传统的光子辐射相比具有较高的生物学相对效应,已经广泛应用于生物育种、疾病诊断和治疗[21]。缪建顺等[22]通过12C6+束辐照诱变谷氨酸棒杆菌,经筛选后获得谷氨酸高产菌株GM006,其产量最高达121.1 g/L,比原始菌株提高10.09%。
ARTP诱变是1种新近开发的安全物理诱变育种技术[23],如图2所示,主要采用He作为诱变源,能够在大气压下产生温度在25~40 ℃的高活性粒子浓度的等离子体射流,包含多种化学活性粒子,如激发态的氦原子、氧原子、氮原子、·OH自由基等。这些粒子能够改变微生物细胞壁膜的结构及通透性,对遗传物质造成损伤,诱发生物细胞启动容错率高的SOS修复机制,从而获得遗传稳定的突变菌株。与其他诱变方法相比,ARTP具有突变率高、突变频谱广、操作简单、安全性高、环境友好等特点,目前已广泛应用于包括细菌、放线菌、真菌、酵母等在内的100多种微生物诱变育种。例如,ZHAO等[24]通过ARTP诱变产生累积19.4 g/L的L-精氨酸的突变菌株,并通过发酵优化进一步提升L-精氨酸产量获得高达71.3 g/L的突变株。LV等[25]利用ARTP诱变及高通量筛选获得了高产L-谷氨酰胺的谷氨酸棒杆菌,发酵终质量浓度为(25.7±2.7) g/L,并通过理性改造进一步改善L-谷氨酰胺的生产,使L-谷氨酰胺发酵终质量浓度增加了186.0%,达到(73.5±3.1)g/L。

a-以直接作用模式使用大气压DBD等离子体处理生物体;b-以间接作用方式使用射频APGD等离子体射流处理生物体
图2 ARTP诱变2种模式原理[23]
Fig.2 Principle of two modes of ARTP mutagenesis[23]
对于缺乏遗传背景或与表型特征相互影响的微生物,可以采用具有独特优势的适应性实验室进化(adaptive laboratory evolution,ALE)。ALE是在实验室条件下,借助人工选择压力,通过微生物自发突变的不断富集实现微生物的定向进化,并从进化群体中筛选优良性状个体的一种方法,其作为定向诱变已被广泛应用于提高微生物产物产量、生长速度、胁迫耐受力和底物利用率等研究[26]。例如TUYISHIME等[27]利用ALE成功获得高甲醇利用率的谷氨酸棒杆菌,突变体在甲醇-木糖最小培养基上显示出细胞生长增加20倍,并利用甲醇和木糖,物质的量比达3.83∶1。KRÜGER等[28]通过ALE增强谷氨酸棒状杆菌的耐受性,使其适应血红素水平的增加,分离的菌株显示出对浓度高达100 μmol/L的血红素生长的高度耐受性。徐美娟等[29]还阐述了谷氨酸棒杆菌抗各种环境胁迫机制,并总结了提高谷氨酸棒杆菌鲁棒性和耐受性的合成生物学新策略。
1.2.2 理性育种策略
随着代谢工程、合成生物学及全基因组测序的发展,加速了研究人员对微生物代谢调控机制的深入了解,对微生物细胞工厂的创制也从非理性的育种策略转变为更为理性的育种方式,其理性改造主要有以下策略[30]:
(1)生物合成元件及代谢途径的挖掘和优化[31]。经典的基因表达调控元件包括5′非编码区、启动子、核糖体结合位点(ribosome-binding site,RBS)、终止子等能够有效调控转录水平和翻译水平,但由于细胞基因水平的调控是复杂的、多元化的过程,经典的基因表达调控元件不能满足精准调控的强度,因此研究人员也开发了多种新型基因调控元件,如核糖开关、核酸适配体等,在调控蛋白表达水平、改变细胞物质代谢等过程中发挥了重要作用。例如,WEN等[32]将谷氨酸棒杆菌S9114进行代谢工程改造,并调节基因odhA的RBS序列以减弱α-氧戊二酸脱氢酶复合物活性,实现谷氨酸在生物素过量的玉米秸秆水解物中的高效积累,使谷氨酸积累量升高6倍以上。
基因编辑技术的发展使研究人员能够更为理性的改善微生物底盘的自身性能,可以挖掘内源性物质代谢途径,并利用过表达代谢途径中的关键基因,消除产物反馈抑制等方式进行优化,也可以通过对代谢网络的解析,构建异源代谢的最佳途径,从而提高目标产物合成路径的精确性[7]。例如WANG等[33]通过敲除ltbR转录调控因子,过表达L-亮氨酸合成途径的关键基因,包括ilvC、leuDH、rocG,从而获得L-亮氨酸产量达(23.31±0.24) g/L的高产菌株。
(2)代谢流量动态调控
细胞代谢网络存在复杂的调控机制,对微生物底盘进行单一调控元件或代谢途径的改造可能会引起代谢失衡,不利于构建高效的工业化微生物细胞工厂,因此对微生物底盘进行全局性的代谢流量动态调控是必要的。常用的代谢流量动态调控策略包括调控关键酶、强化底物利用过程中的能量供给、优化目标产物合成过程中的碳通量和氧化还原平衡等[34]。
细胞的代谢通过“基因-酶-反应”组成了基因组代谢网络模型,多种酶参与的代谢途径普遍存在代谢失衡,导致中间代谢物积累,影响目标产物的转化效率。因此,可以通过强化关键酶的性能和产量、削弱支路副产物的关键酶,来提高代谢途径的整体催化效率。优化底物利用过程中能量供给以提高利用率,也可以通过构建廉价碳或氮源底物利用途径来降低能源成本。细胞在代谢过程中会产生和消耗能量,若供给量小于需求量,会影响目标产物的合成效率,因此需要对代谢途径中碳通量和氧化还原平衡进行优化[35],实现动态调控。例如XU等[36]通过理性改造依赖于NAD(P)H的二氢二吡啶酸还原酶,改变了其氧化还原通量,从而提高了谷氨酸棒杆菌中L-赖氨酸的产量[2.93 g/(L·h)],其碳产量从0.35 g/g葡萄糖提高到0.44 g/g葡萄糖。
(3)大规模基因编辑
随着基因编辑技术、高通量筛选及生物信息学的发展,为创制绿色高效的微生物细胞工厂提供了更多有力工具。传统的基因编辑技术基于同源重组以实现目的基因的敲除、敲入和突变,但由于其低效率限制了底盘细胞改造的效率和通量,不能满足全基因组范围大量基因编辑的需求。近年来,新一代基因编辑技术 CRISPR/Cas系统发展迅速,因其具有效率高、操作便捷、成本低等优点,已广泛应用于多种真核和原核生物的基因组编辑。迄今为止,NCBI数据库已经收录了79株全基因组测序的谷氨酸棒杆菌,且研究人员开发了完备的基因组编辑系统,如CRISPR-Cas9系统、CRISPR-Cpf1/dCpf1系统及RE-CRISPR系统等,推动了谷氨酸棒杆菌底盘细胞的优化改造[37]。目前主要通过“自上而下的基因组精简”和“自下而上的基因组合成”2种策略进行底盘细胞构建。LIU等[38]通过优化谷氨酸棒杆菌的CRISPR系统并利用CRISPR辅助的染色体编辑和CRISPRi阵列筛选用于工程关键酶,微调代谢通量和提高L-脯氨酸产量,最终获得L-脯氨酸产量达到142.4 g/L的高产菌株。SUN等[39]建立了基于人工合成sRNA的基因表达沉默技术,实现了染色体基因表达的快速下调,单基因弱化效率达到80%以上。
2 高通量筛选技术
微生物细胞工厂通过理性/非理性的改造,会产生大量非目标性的个体,尤其是非理性改造会产生大型突变文库,需要从其中筛选出理想性状的底盘细胞具有很大挑战性。传统的琼脂平板筛选法、摇瓶筛选方法和微孔板筛选方法是目前最常用的筛选方法,其作为简单易行的初筛方法,可用于排除大量无活性和极低活性的微生物。但由于微生物改造所产生的巨大文库,通过传统筛选方式不仅通量低、效率低下且成本昂贵。为克服以上问题,近年来已开发了多种高通量筛选技术及设备[40],如自动化液体处理平台、荧光激活细胞分选技术(fluorescence-activated cell sorting,FACS)、液滴微流控分选技术(droplet-based microfluidic sorting,DMFS)和基于生物传感器筛选策略等,用于高效筛选具有目标性状的微生物底盘细胞。
2.1 高通量自动化液体处理平台
早期的高通量筛选主要采用多孔板进行微生物细胞的检测筛选,可以实现样品与试剂的添加、培养和检测,包括24、48、96和384孔板。多孔板培养结合自动化液体处理平台,每天处理样品高达104个,显著提升筛选速率。目前已经开发了多种全自动处理工作站,利用软件程序推动自动化液体处理平台与多种检测仪器组合的无缝集成[41],包括微孔板检测仪、细胞成像系统、洗板机、分液器、自动培养箱和储板器等,极大缩短了手动操作时间,通过更高效的工作流程提高实验室生产率,这些系统已应用于微生物工程菌株选育、药物筛选、微生物高内涵分析等,是不可或缺的初期医药研发工具。例如RAJ等[42]开发了一种环保的高通量自动化筛选平台,能够快速有效地建立表型酶和微生物菌株的微孔板筛选实验,加速实现DBTL循环,研究者成功利用该平台在厌氧条件下生产烯酸还原酶,并进行了烯酸还原酶最大活性的最佳pH值筛选,发现其在pH 5~6下工作最佳。
2.2 荧光激活细胞分选技术
FACS是流式细胞术的一种特殊技术[43],如图3所示,它是利用激光束激发将基因型和表型偶联的微生物细胞中的荧光标记物,通过光学系统收集并分析每个细胞的光散射和荧光信号,再根据设定的参数将细胞按照特定的性质进行分选,分选速率高达107克隆/h,是一种高效分析和分选微生物细胞的工具,也是目前最常用和成熟的细胞高通量筛选技术,已广泛应用于新药研发、医学研究、临床诊断等多种领域中。例如ZHANG等[44]通过ARTP诱变提高谷氨酸ΔSSAAI菌株的L-丝氨酸产率,构建了基于NCgl0581响应L-丝氨酸的浓度的生物传感器,利用FACS从大型诱变库中成功分选出高产L-丝氨酸的谷氨酸C36-pDser菌株,累积量为34.78 g/L,蔗糖产量为0.35 g/g,分别比亲本菌株高35.9%和66.7%。

图3 流式细胞分选原理简图[43]
Fig.3 Schematic diagram of flow cell sorting[43]
2.3 液滴微流控分选技术
近年来,DMFS发展迅速,已成为强大的超高通量筛选工具[45],其通过液滴生成、液滴培养及液滴检测分选,从大量的液滴中分离出目标液滴,获得高效的微生物底盘细胞。纳升至皮升级液滴作为微反应器,常采用油包水的形式做区室化反应,同时适用胞内表达和胞外分泌,具有通量高、速度快、体积微小、均一性好、单分散性良好等特点,为医药、食品、环保研究等搭建了一个全新的平台。目前液滴微流控技术已经在生命科学研究中有不同的应用[46],例如高通量筛选细胞药物、单细胞组学研究,并结合细胞测序形成单细胞高通量液滴测序技术,以绘制整个细胞亚群的基因组图谱、适应性进化、开发药物输送系统等。
基于不同的分选参数开发了有多种检测技术,典型的检测技术如荧光激活液滴分选技术(fluorescence-activated droplet sorting,FADS),它的应用最为广泛,已成为微生物工程菌株液滴分选的主要方式。JIANG等[47]综述了不同分析物质利用FADS研究的最新进展,并根据荧光偶联策略原理,将其分为4大类,包括荧光底物分析策略、酶联荧光分析策略、基于生物传感器荧光偶联策略以及基于抗体亲和力荧光偶联策略。然而,有许多天然酶或代谢物是非荧光的,因此限制了FADS的适用性。为了克服这些问题,其他检测技术也被开发,例如吸光度激活液滴分选技术、吸光度激活液滴分选技术、质谱液滴分选技术等。
目前基于DMFS开发了微型化、自动化、智能化的全自动高通量微生物液滴培养仪(microbial microdroplet culture system,MMC),可用于单细胞微生物筛选,进行生长曲线测定、压力富集、适应性进化及菌种耐药性研究等[48]。邓磊等[49]利用ARTP诱变技术及MMC选育组氨酸结构类似物的抗性突变株,成功从耐受3-氨基-1,2,4-三氮唑10 g/L和D-组氨酸8 g/L的抗性突变株中筛选得到谷氨酸棒杆菌Cg-F4,其L-组氨酸产量为0.561±0.016 g/L。YU等[50]建立第一个谷氨酸棒杆菌基因组规模CRISPRi干扰文库,同时集成了FlAsH-四半胱氨酸驱动的FADS技术,如图4所示,开发了一个工程化高通量的CRISPRi-微流体筛选平台,并成功应用该平台增强了谷氨酸棒状杆菌中多种重组蛋白分泌产量。
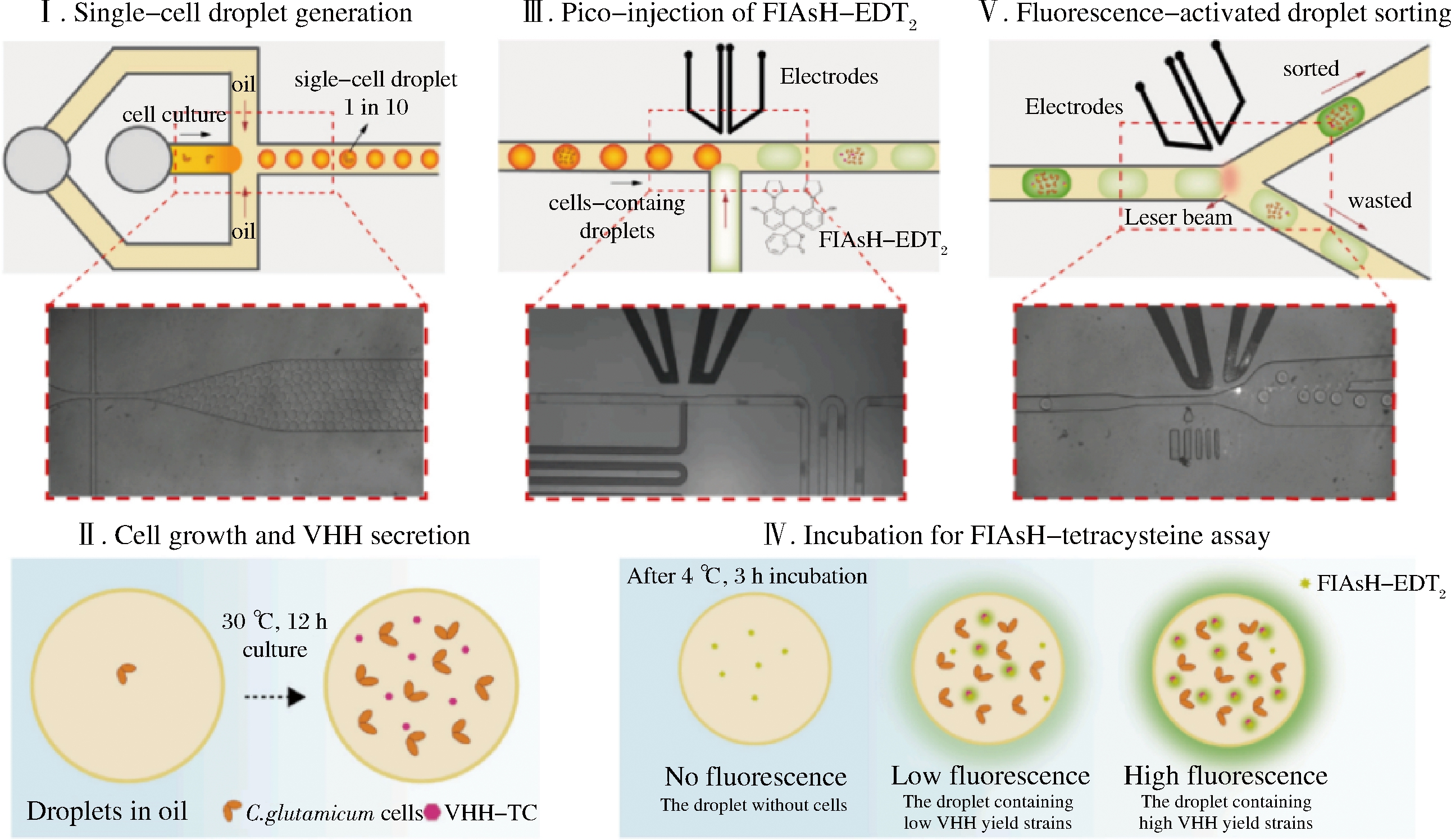
图4 液滴微流控筛选高产菌株[50]
Fig.4 Droplet microfluidic screening for high-yield strains[50]
2.4 基于生物传感器的高通量筛选策略
生物传感器是合成生物学和代谢工程的重要组成部分,可以将生物物质浓度转变为电信号、光信号等易于检测的信号,具有灵敏度高、特异性强、分析速度快的特点,因此被认为是动态调控、筛选理想表型的强大装置。常用的生物传感器主要包括基于荧光蛋白的生物传感器、基于核酸的生物传感器、基于转录调控因子的生物传感器和基于双组分系统的生物传感器等[51]。近年来生物传感器已应用于目标化合物浓度检测、高通量筛选、定向进化和代谢动态控制等方面,为加快构建微生物细胞工厂提供了有力工具。STELLA等[52]开发了一种基于转录因子的生物传感器,通过整合pfkA和Lrp,将谷氨酸棒状杆菌的生长与支链氨基酸的细胞内浓度耦合,从而增强氨基酸的产生。TAN等[53]利用L-异亮氨酸生物传感器筛选得到对L-异亮氨酸响应增强的突变启动子PbrnFE7,获得高产4-羟基-L-异亮氨酸谷氨酸棒杆菌ST17,产量达到135.3 mmol/L。
3 展望
微生物细胞工厂的构建以满足工业需求为导向加快市场应用,经过多年的研究积累,谷氨酸棒杆菌从诱变育种到基于先验知识和模拟计算理性设计,利用新型技术对微生物底盘进行改造,达到“建物致用”的目标,应用基因型-表型关联技术,通过高通量筛选获得不同特性的工业微生物细胞工厂,极大提高了谷氨酸棒杆菌细胞工厂的创制效率,然而细胞工厂物质和能量代谢受时空的影响及复杂多元化的代谢调控网络仍然是制约其工业应用的瓶颈[54]。尽管目前的改造和检测手段众多,能够从多方面获取不同优良性状的微生物底盘,但目前的技术和日益增长的微生物细胞工厂需求依然存在巨大差异,缺乏对多层次信息的理解和应用。
随着合成生物学、生物信息学及人工智能的发展,有望克服这些难题,使得包括先进的人工智能辅助设计、复杂基因网络动态调控、基因组编辑、超高通量筛选、智能检测、智能自动化生物平台在内的前沿技术的结合将合成生物推向下一个阶段[55],实现生物制造到生物智造的变革,突破合成生物学科技创新,开发出更为经济、高效、可持续发展的工业微生物细胞工厂,加快推动生物智造在轻化工、医药、能源等领域的规模化应用,完善生物产业技术体系,使生物经济实现高质量发展。
[1] SOLARTE-TORO J C, CARDONA ALZATE C A.Biorefineries as the base for accomplishing the sustainable development goals (SDGs) and the transition to bioeconomy:Technical aspects, challenges and perspectives [J].Bioresource Technology, 2021, 340:125626.
[2] LIU L, GUAN N Z, LI J H, et al.Development of GRAS strains for nutraceutical production using systems and synthetic biology approaches:Advances and prospects[J].Critical Reviews in Biotechnology, 2017, 37(2):139-150.
[3] MCCARTY N S, LEDESMA-AMARO R.Synthetic biology tools to engineer microbial communities for biotechnology [J].Trends in Biotechnology, 2019, 37(2):181-197.
[4] 周文娟, 付刚, 齐显尼, 等.发酵工业菌种的迭代创制[J].生物工程学报, 2022, 38(11):4 200-4 218.
ZHOU W J, FU G, QI X N, et al.Upgrading microbial strains for fermentation industry[J].Chinese Journal of Biotechnology, 2022, 38(11):4200-4218.
[5] LONG M F, XU M J, ZHANG X A, et al.Synthetic biology and metabolic engineering for amino acid production in Corynebacterium glutamicum[J].Scientia Sinica Vitae, 2019, 49(5):541-552.
[6] AHMAR S, GILL R A, JUNG K H, et al.Conventional and molecular techniques from simple breeding to speed breeding in crop plants:Recent advances and future outlook[J].International Journal of Molecular Sciences, 2020, 21(7):2590.
[7] 上官玲玲, 卢慧芳, 夏会丽, 等.谷氨酸棒杆菌细胞工厂构建与应用的研究进展[J].食品与发酵工业, 2022, 48(17):313-320.
SHANGGUAN L L, LU H F, XIA H L, et al.Research progress on construction and application of Corynebacterium glutamicum cell factory[J].Food and Fermentation Industries, 2022, 48(17):313-320.
[8] ZHA J, ZHAO Z, XIAO Z Y, et al.Biosystem design of Corynebacterium glutamicum for bioproduction[J].Current Opinion in Biotechnology, 2023, 79:102870.
[9] LEE J Y, NA Y A, KIM E, et al.The actinobacterium Corynebacterium glutamicum, an industrial workhorse[J].Journal of Microbiology and Biotechnology, 2016, 26(5):807-822.
[10] DO CARMO FÉLIX F K, LETTI L A, VIN CIUS DE MELO PEREIRA G, et al.L-lysine production improvement:A review of the state of the art and patent landscape focusing on strain development and fermentation technologies[J].Critical Reviews in Biotechnology, 2019, 39(8):1031-1055.
CIUS DE MELO PEREIRA G, et al.L-lysine production improvement:A review of the state of the art and patent landscape focusing on strain development and fermentation technologies[J].Critical Reviews in Biotechnology, 2019, 39(8):1031-1055.
[11] YANG H Q, QU J F, ZOU W, et al.An overview and future prospects of recombinant protein production in Bacillus subtilis[J].Applied Microbiology and Biotechnology, 2021, 105(18):6607-6626.
[12] YU Q H, LI Y C, WU B, et al.Novel mutagenesis and screening technologies for food microorganisms:Advances and prospects[J].Applied Microbiology and Biotechnology, 2020, 104(4):1517-1531.
[13] 陈晓博, 罗雪粤, 张淑荣, 等.生产L-精氨酸的脯氨酸营养缺陷型菌株的选育[J].北京化工大学学报(自然科学版), 2011, 38(6):83-86.
CHEN X B, LUO X Y, ZHANG S R, et al.Screening of a L-arginine producing mutant(D-Argr) with a proline auxotroph[J].Journal of Beijing University of Chemical Technology (Natural Science Edition), 2011, 38(6):83-86.
[14] RAINA A, WANI M R, LASKAR R A, et al.Chemical mutagenesis:Role in breeding and biofortification of lentil (Lens culinaris Medik) mutant lines[J].Molecular Biology Reports, 2022, 49(12):11313-11325.
[15] ZHANG Y, ZHANG X H, XIAO S Y, et al.Engineering Corynebacterium glutamicum mutants for 3-methyl-L-butanol production[J].Biochemical Genetics, 2019, 57(3):443-454.
[16] DONG Y T, MIAO R Y, FENG R C, et al.Edible and medicinal fungi breeding techniques, a review:Current status and future prospects[J].Current Research in Food Science, 2022, 5:2070-2080.
[17] 张婧芳, 汪江波, 黄金明, 等.L-鸟氨酸高产菌的原生质体融合育种[J].氨基酸和生物资源, 2009, 31(1):53-57;75.
ZHANG J F, WANG J B, HUANG J M, et al.Breeding of high-yield L-ornithine-producing strain by protoplast fusion[J].Amino Acids &Biotic Resources, 2009, 31(1):53-57;75.
[18] PARK S H, KIM H U, KIM T Y, et al.Metabolic engineering of Corynebacterium glutamicum for L-arginine production [J].Nature Communications, 2014, 5:4618.
[19] WANG Y, ZHENG P, SUN J B.Recent advances in developing enabling technologies for Corynebacterium glutamicum metabolic engineering [J].Chinese Journal of Biotechnology, 2021, 37(5):1603-1618.
[20] BLEISCH R, FREITAG L, IHADJADENE Y, et al.Strain development in microalgal biotechnology-random mutagenesis techniques[J].Life, 2022, 12(7):961.
[21] HU W, LI W, CHEN J.Recent advances of microbial breeding via heavy-ion mutagenesis at IMP [J].Letters in Applied Microbiology, 2017, 65(4):274-280.
[22] 缪建顺, 曹国珍, 张苗苗, 等.重离子束诱变选育谷氨酸高产菌株[J].辐射研究与辐射工艺学报, 2015, 33(5):39-45.
MIAO J S, CAO G Z, ZHANG M M, et al.High-yield glutamic acid strain screened by heavy ion irradiation[J].Journal of Radiation Research and Radiation Processing, 2015, 33(5):39-45.
[23] ZHANG X, ZHANG X F, LI H P, et al.Atmospheric and room temperature plasma (ARTP) as a new powerful mutagenesis tool [J].Applied Microbiology and Biotechnology, 2014, 98(12):5387-5396.
[24] ZHAO Z Q, CAI M M, LIU Y R, et al.Genomics and transcriptomics-guided metabolic engineering Corynebacterium glutamicum for L-arginine production [J].Bioresource Technology, 2022, 364:128054.
[25] LV Q L, HU M K, TIAN L Z, et al.Enhancing L-glutamine production in Corynebacterium glutamicum by rational metabolic engineering combined with a two-stage pH control strategy[J].Bioresource Technology, 2021, 341:125799.
[26] STELLA R G, WIECHERT J, NOACK S, et al.Evolutionary engineering of Corynebacterium glutamicum [J].Biotechnology Journal 2019, 14(9):e1800444.
[27] TUYISHIME P, WANG Y, FAN L W, et al.Engineering Corynebacterium glutamicum for methanol-dependent growth and glutamate production[J].Metabolic Engineering, 2018, 49:220-231.
[28] KRÜGER A, FRUNZKE J.A pseudokinase version of the histidine kinase ChrS promotes high heme tolerance of Corynebacterium glutamicum[J].Frontiers in Microbiology, 2022, 13:997448.
[29] 徐美娟, 上官春雨, 陈鑫, 等.谷氨酸棒杆菌耐受胁迫机制及工业鲁棒性合成生物学研究进展[J].生物工程学报, 2021, 37(3):831-845.
XU M J, SHANGGUAN C Y, CHEN X, et al.Advances in stress tolerance mechanisms and synthetic biology for the industrial robustness of Corynebacterium glutamicum[J].Chinese Journal of Biotechnology, 2021, 37(3):831-845.
[30] JIANG Y, SHENG Q, WU X Y, et al.L-arginine production in Corynebacterium glutamicum:Manipulation and optimization of the metabolic process[J].Critical Reviews in Biotechnology, 2021, 41(2):172-185.
[31] 田荣臻, 刘延峰, 李江华, 等.典型模式微生物基因表达精细调控工具的研究进展[J].合成生物学, 2020, 1(4):454-469.
TIAN R Z, LIU Y F, LI J H, et al.Progress in the regulatory tools of gene expression for model microorganisms[J].Synthetic Biology Journal, 2020, 1(4):454-469.
[32] WEN J B, BAO J.Engineering Corynebacterium glutamicum triggers glutamic acid accumulation in biotin-rich corn stover hydrolysate [J].Biotechnology for Biofuels, 2019, 12:86.
[33] WANG Y Y, ZHANG F, XU J Z, et al.Improvement of L-leucine production in Corynebacterium glutamicum by altering the redox flux[J].International Journal of Molecular Sciences, 2019, 20(8):2020.
[34] 高聪, 陈城虎, 陈修来, 等.代谢工程改造微生物合成生物基单体的进展与挑战 [J].化工进展:1-13.
GAO C, CHEN C H, CEHN X L, et al.Progress and challenges of engineering microorganisms to produce biobased monomers [J].Chemical Industry and Engineering Progress:1-13.
[35] 朱欣娜, 戴住波, 樊飞宇,等.微生物细胞工厂[J].科学通报,2023, 68(13):1626-1636.
ZHU X, DAI Z, FAN F, et al.Microbial cell factories [J].Chinese Science Bulletin, 2023, 68(13):1626-1636.
[36] XU J Z, YANG H K, LIU L M, et al.Rational modification of Corynebacterium glutamicum dihydrodipicolinate reductase to switch the nucleotide-cofactor specificity for increasing L-lysine production [J].Biotechnology and Bioengineering, 2018, 115(7):1764-1777.
[37] MANGHWAR H, LINDSEY K, ZHANG X L, et al.CRISPR/Cas system:Recent advances and future prospects for genome editing[J].Trends in Plant Science, 2019, 24(12):1102-1125.
[38] LIU J, LIU M S, SHI T, et al.CRISPR-assisted rational flux-tuning and arrayed CRISPRi screening of an L-proline exporter for L-proline hyperproduction[J].Nature Communications, 2022, 13:891.
[39] SUN D H, CHEN J Z, WANG Y, et al.Metabolic engineering of Corynebacterium glutamicum by synthetic small regulatory RNAs[J].Journal of Industrial Microbiology &Biotechnology, 2019, 46(2):203-208.
[40] SARNAIK A, LIU A, NIELSEN D, et al.High-throughput screening for efficient microbial biotechnology [J].Current Opinion in Biotechnology, 2020, 64:141-150.
[41] CZERNIECKI S M, CRUZ N M, HARDER J L, et al.High-throughput screening enhances kidney organoid differentiation from human pluripotent stem cells and enables automated multidimensional phenotyping[J].Cell Stem Cell, 2018, 22(6):929-940.e4.
[42] RAJ K, VENAYAK N, DIEP P, et al.Automation assisted anaerobic phenotyping for metabolic engineering[J].Microbial Cell Factories, 2021, 20(1):184.
[43] VITELLI M, BUDMAN H, PRITZKER M, et al.Applications of flow cytometry sorting in the pharmaceutical industry:A review [J].Biotechnology Progress, 2021, 37(4):e3146.
[44] ZHANG X, ZHANG X M, XU G Q, et al.Integration of ARTP mutagenesis with biosensor-mediated high-throughput screening to improve L-serine yield in Corynebacterium glutamicum[J].Applied Microbiology and Biotechnology, 2018, 102(14):5939-5951.
[45] TEREKHOV S S, SMIRNOV I V, STEPANOVA A V, et al.Microfluidic droplet platform for ultrahigh-throughput single-cell screening of biodiversity [J].Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(10):2550-2555.
[46] AMIRIFAR L, BESANJIDEH M, NASIRI R, et al.Droplet-based microfluidics in biomedical applications [J].Biofabrication, 2022, 14(2).doi:10.1088/1 758-5090/ac39a9.
[47] JIANG J J, YANG G Y, MA F Q.Fluorescence coupling strategies in fluorescence-activated droplet sorting (FADS) for ultrahigh-throughput screening of enzymes, metabolites, and antibodies[J].Biotechnology Advances, 2023, 66:108173.
[48] JIAN X J, GUO X J, WANG J, et al.Microbial microdroplet culture system (MMC):An integrated platform for automated, high-throughput microbial cultivation and adaptive evolution[J].Biotechnology and Bioengineering, 2020, 117(6):1724-1737.
[49] 邓磊, 张豪, 郑穗平.常压室温等离子体诱变与微生物液滴培养系统联用筛选L-组氨酸产生菌[J].中国酿造, 2021, 40(2):53-58.
DENG L, ZHANG H, ZHENG S P.Screening of L-histidine producing strain based on ARTP mutagenesis combined with microbial microdroplet culture system[J].China Brewing, 2021, 40(2):53-58.
[50] YU X Y, LI S, FENG H B, et al.CRISPRi-microfluidics screening enables genome-scale target identification for high-titer protein production and secretion[J].Metabolic Engineering, 2023, 75:192-204.
[51] YU W W, XU X H, JIN K, et al.Genetically encoded biosensors for microbial synthetic biology:From conceptual frameworks to practical applications[J].Biotechnology Advances, 2023, 62:108077.
[52] STELLA R G, GERTZEN C G W, SMITS S H J, et al.Biosensor-based growth-coupling and spatial separation as an evolution strategy to improve small molecule production of Corynebacterium glutamicum [J].Metabolic Engineering, 2021, 68:162-173.
[53] TAN S Y, SHI F, LIU H Y, et al.Dynamic control of 4-hydroxyisoleucine biosynthesis by modified L-isoleucine biosensor in recombinant Corynebacterium glutamicum[J].ACS Synthetic Biology, 2020, 9(9):2378-2389.
[54] 袁姚梦, 邢新会, 张翀.微生物细胞工厂的设计构建:从诱变育种到全基因组定制化创制[J].合成生物学, 2020, 1(6):656-673.
YUAN Y M, XING X H, ZHANG C.Progress and prospective of engineering microbial cell factories:From random mutagenesis to customized design in genome scale[J].Synthetic Biology Journal, 2020, 1(6):656-673.
[55] 赵国屏. 合成生物学:从“造物致用”到产业转化[J].生物工程学报, 2022, 38(11):4001-4011.
ZHAO G P.Synthetic biology:From “build-for-use” to commercialization[J].Chinese Journal of Biotechnology, 2022, 38(11):4001-4011.