土壤农杆菌是一类土壤微生物,发现于植物根系附近,主要有根癌农杆菌和发根农杆菌(Agrobacterium rhizogenes)两大类。从1934年HILDEBRAND首次发现发根农杆菌能够诱导植物生成毛状根,到1982年CHILTON等人在研究中再次证实,发根农杆菌诱导获取植物毛状根成为重要的新型植物培养方式[1]。发根农杆菌是根瘤菌科、农杆菌属的一种革兰氏阴性土壤细菌,它可以感染大多数双子叶植物和少数单子叶植物以及极个别的裸子植物[1]。
毛状根是植物受到发根农杆菌的感染后所产生的一种病理状态,与植物自然生长的根相比,失去了向地性,不依赖添加激素的培养基生长,具有生长迅速、分化程度高、周期短、生产效率高、遗传稳定、易于操作的优点。因此,毛状根作为更具优势的植物研究形态被广泛应用于植物次生代谢产物生产、品种改良、环境修复和生物转化等的原材料。尤其在药用植物领域,利用发根农杆菌介导的遗传转化方式获得毛状根,从而实现所需的药用成分次生代谢产物的大量生产。目前为止,多种植物毛状根体系已被建立起来,并获得了高产量的次生代谢产物,例如,喜树碱、长春碱、类黄酮、丹参酮类、人参皂苷、姜黄素等,其中长春花、紫草、胡萝卜等植物毛状根已经达到了工业化生产水平[2]。近年来毛状根由于其安全、易于操作等优点,在植物修复方面已经受到了广泛关注,毛状根组织也被用于有机物和重金属污染物的植物修复方面[3]。目前为止已经获得了多种重金属富集植物毛状根组织,用于研究相关重金属以及有机污染物的修复机制,如印度芥菜、天蓝遏蓝菜等[4]。
该文针对毛状根在植株再生、次生代谢生产以及环境修复等方面的应用进行了总结,阐述了植物毛状根的应用现状,为利用毛状根扩大培养植物次级代谢产物提供依据,同时也为后续研究毛状根在环境修复以及植株再生方面提供参考。
1 毛状根的形成与调控
发根农杆菌诱导机制与根癌农杆菌引起的冠瘿病相似[5](如图1所示),是通过遗传转化诱导植物生成毛状根,其感染伤口之后,会生成可溶性小分子化合物,进而诱导活化Ri(Root induce)质粒Vir区与毛根诱导有关的基因位点,即rol(root loci)A、B和C基因群,通过Vir区基因的调控作用,使转移DNA(transfer DNA,T-DNA)在植物细胞中的整合和表达,最终形成毛状根,每个位点负责一个典型的表型改变,即rolA与节间缩短和叶片起皱有关;rolB负责突出的柱头和缩短的雄蕊长度;rolC导致节间缩短和根尖优势降低。在毛状根培养中,植物可以自发地(直接从根中)再生,也可以将根转移到含有激素的培养基中再生。因其包含了植物生长素合成的基因,因此单条根便可以在不含激素的培养基正常生长。Ri质粒的基因转移可以避免愈伤组织期和体细胞无性系变异,获得了自发的芽再生能力,也有较高的转基因植株转化和再生率,转基因植物可以在不使用选择剂的情况下获得,从而避免使用抑制枝条再生的化学物质[6]。因此可以改变毛状根的基因,定向地优化抗虫、抗病或是次生代谢积累的能力[7]。
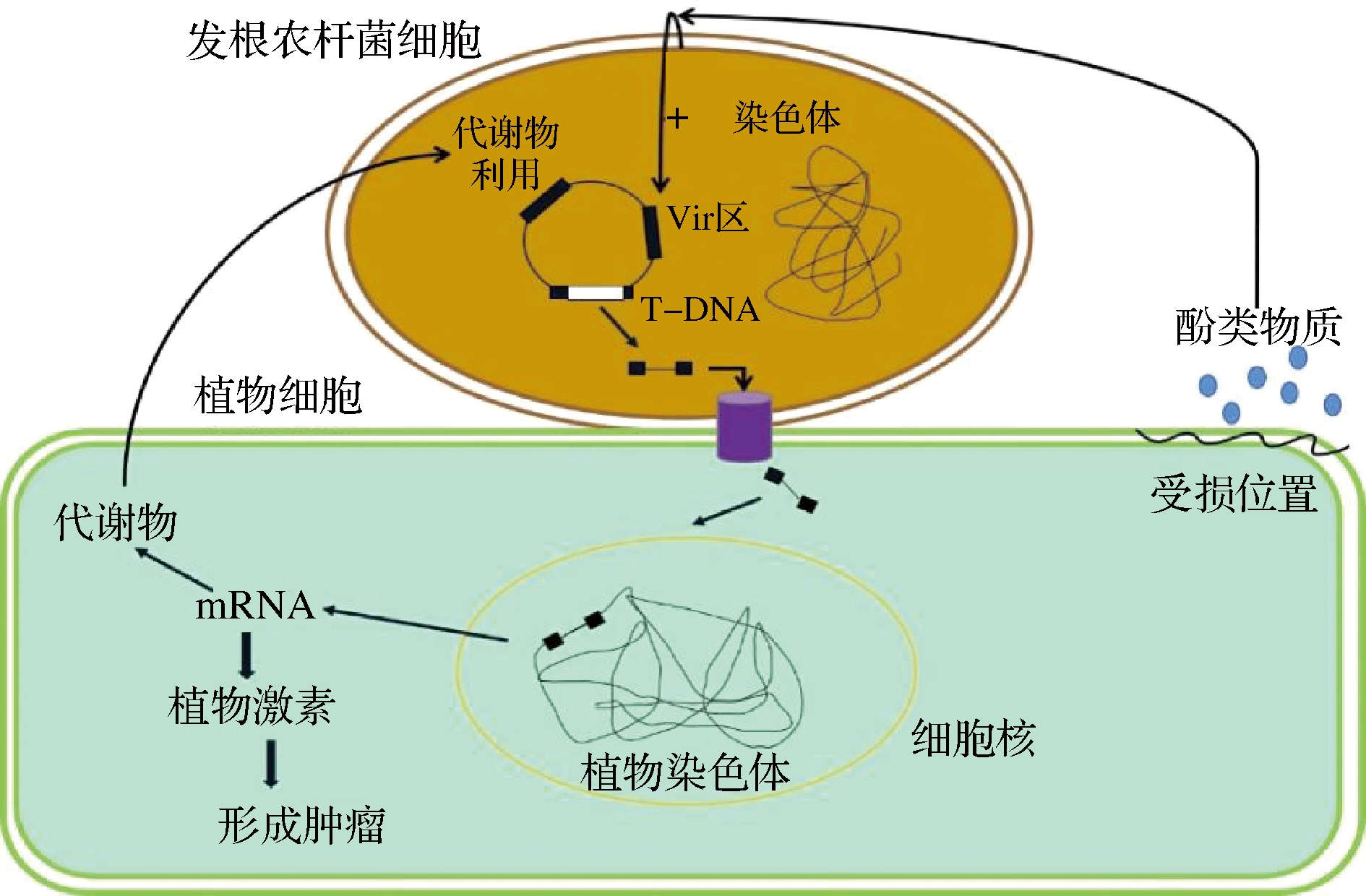
图1 发根农杆菌诱导机制[8]
Table 1 Induction mechanism of A. rhizogenes[8]
毛状根是一种细胞工程和基因工程结合的植物培养形式,目前促进毛状根生长及提高产量的方法较多,如发根农杆菌携带相关基因(生长代谢及激素途径的关键酶基因或转录因子)建立转基因基因植株;优化培养基成分、温度、pH等,培养条件因物种而异;另外,随着人们对植物免疫机理的深入认识,诱导植物抗病性的信号物质,即诱导子,出现在人们视野中,目前已发现有数百种诱导子能够激活植物免疫产生抗性,黑曲霉、脂肪酸、多糖等被广泛应用于药用植物的活性成分积累[9]。
2 毛状根的应用
毛状根的培养操作简单,设备要求低,可操作性强;生长周期短、遗传生化稳定性具有很高的工业价值。因此,毛状根作为更具优势的研究对象被广泛应用于植物次生代谢产物的研究(表1)、植物性状优化、环境修复和生物转化等方面(表2)。
表1 植物毛状根促进植物次生代谢产物积累相关研究
Table 1 Correlational research between hairy root and accumulation of secondary metabolites

植物名促进毛状根生长/次生代谢物累计体系优化研究主要参考文献杜仲Eucommia ulmoides Oliver桃叶珊瑚苷-[17]地黄Rehmannia glutinosa 毛蕊花糖苷水杨酸[13]丹参Salvia miltiorrhiza丹参酮转基因[20]颠茄Atropa belladonna L.姜黄素及其糖苷转基因[21]生物碱转基因[40]西洋参Panax quiquefolium L.人参皂苷ABA[22]酵母提取物[23]花生Arachis hypogaea Linn.花生四烯醇MeJA白藜芦醇MeJA、CD[26]紫胡萝卜Daucus carota L.花青素乙烯利[27]人参Panax ginseng C.A.Meyer花青素转基因[28]黄岑Scutellaria baicalensis Georgi类黄酮转基因[29]何首乌Fallopia multiflora (Thunb.)Harald.酚类转基因、MeJA[30]无花果Ficus carica Linn.酚类、黄酮类印度梨形孢[31]短小蛇根草Ophiorrhiza pumila喜树碱转基因[33]长春花Catharanthus roseus (L.)G.Don长春碱转基因诱导子[35][36][37][38]
表2 其他植物毛状根的应用研究
Table 2 Applications of hairy roots in other plants

应用植物名功能主要参考文献植株再生棉花Gossypium spp.大豆Glycine max (Linn.) Merr.马铃薯Solanum tuberosum L.基因功能鉴定[10]提高耐盐性[12]提高抗病性[7]消除SGAs[13]环境修复芥菜Brassica juncea (L.) Czern.et Coss.番茄Solanum lycopersicum L.萝卜Raphanus sativus L.辣椒Capsicum annuum L.油菜Brassica napus L.烟草Nicotiana tabacum L.油菜Brassica napus L.辣根Armoracia rusticana (Lam.) P.Gaertner et Schreb.菊苣Cichorium intybus L.芥菜Brassica juncea (L.) Czern.et Coss.辣根Armoracia rusticana (Lam.) P.Gaertner et Schreb.龙葵Solanum nigrum L.油菜Brassica napus L.芥菜Brassica juncea (L.) Czern.et Coss.苋色藜Chenopodium amaranticolor脱色[43]耐受电离辐射[44]去除硫丹[46]降解苯酚[47]降解苯酚[48]降解2,4-二氯苯酚[49]降解二苯甲酮[52]降解对氯苯基三氯乙烷[53]降解砷[55]镉的耐受性[56]去除和降解铬[57]降解铀[59]
2.1 毛状根在植株再生方面的应用
一些植物可以通过毛状根无需经过愈伤组织阶段诱导出根和芽,从而实现植物的再生;并且由毛状根再生的植物在基因上相对稳定,因此可以通过选择合适的菌株以及培养条件诱导出毛状根,再利用毛状根培养出具有优良性状的再生植株,此技术已在棉花、大豆等植株中成功应用。
CUI等[10]以商品棉品种——中棉24为材料,建立了发根农杆菌介导的稳定转化方法,并首次通过体细胞胚胎发生方式成功地将其转化为毛状根再生植株。从毛状根诱导到成熟植株发育所需时间约为7个月,转化效率为12%。结果表明,该转化方法简单易行,适合于对转化毛状根进行选择,获得转化植株,为棉花基因功能分析提供了一个实用可靠的平台。发根农杆菌MSU440能够携带β-葡萄糖苷酸酶 (β-glucuronidase,GUS)标记的T-DNA,产生能表达和再生GUS的转基因毛状根无性系。以马铃薯八氢番茄红素去饱和酶基因为靶点的CRISPR/Cas9试剂在毛状根克隆系和再生植株中表达。在再生植株中,突变体保持稳定,平均突变率为38%,并能通过生殖系传播给后代[11]。
毛状根的可再生性除了使植株培育更便捷外也为植物的定向进化提供了可能性,NAC转录因子家族具有功能特征,特别是其在耐盐性中的作用,该家族成员GmNAC15在大豆毛状根中的过表达明显提高植株的耐盐性[12]。SHIH等[7]建立了一种用于植物合成生物学的酵母组装基因堆积方法,并利用发根农杆菌NCPPB2659在大豆毛状根进行堆叠基因簇来实现形状改变,使其有较高的病原菌抗性。由于马铃薯中含有的甾体糖苷生物碱(steroidal glycoalkaloids,SGAs)给人带来苦味并带有毒性,所以在马铃薯育种中降低SGAs的含量是必要条件。在前期植物体基因沉默中并不能消除该生物碱的产生,直到2018年NAKAYASU等[13]以马铃薯毛状根为实验材料,通过CRISPR/Cas9技术,敲除SGAs生物合成中编码类固醇16α-羟化酶(16α-hydroxylase)的St16DOX导致马铃薯毛状根中SGAs积累的完全消除。
毛状根可以定向改造植物性状,对抗病抗药抗干旱等进行优化,也是观赏性花卉植物的一种新型培育方式。毛状根是一个遗传相对稳定的体系,但在某些情况下,转基因植物与对照组相比也会发生表型上的改变,基因是否发生突变需要经过其他方式进一步佐证。因此,通过扩大诱导生根的实验总体,来提高优势再生植物的成功率是必要的。
2.2 调控次生代谢产物的积累
植物次生代谢产物是指在植物体中合成的一类生长非必需的小分子有机化合物,是植物对环境的一种适应,是在长期进化过程中植物与生物和非生物因素相互作用的结果,其生产和分布通常有种属、器官、组织及生长发育期的特异性。植物次生代谢物包括萜烯类、酚类与生物碱等,不仅对植物的发育和适应具有重要意义,而且在人类医药、化工等行业也具有重要的经济价值[14]。由于植株本身合成的次生代谢产物量少且不稳定,远不能满足市场的需求;而毛状根具有稳定的遗传性、生长条件简单、不依附于外源激素就能够快速生长以及可以合成高含量的次生代谢物等优点,为次生代谢产物的合成提供了简便快速的途径。
2.2.1 萜类
萜类化合物是由一组结构多样的植物次生代谢物组成,由2个五碳结构的前体衍生而来,通过2条途径合成。它们通常分为3大类:单萜、倍半萜和二萜[15]。萜类化合物有很多功能以及生理活性,它不仅具有药用功能,还有经济价值。研究表明,很多萜类化合物具有抗癌功效,比如紫杉醇。萜类化合物有特殊的香味,可用于芳香剂、香料等的制作,也可用在香水制造以及化妆品研发中[16]。利用毛状根已成功诱导促进了包括松香烷类二萜、丹参酮、姜黄素、人参皂苷等多种萜类物质合成。
利用发根农杆菌诱导毛状根来生产次生代谢产物,与植物本身合成的产量相比显著提高。杨蕊等[17]通过培养杜仲毛状根获得桃叶珊瑚苷,其产量最高达到30.105 mg/g,并且高于植物根以及皮所生成的含量。松香烷类二萜具有抗癌、抗氧化以及抗炎等生物活性,但是植物本身合成量极低。通过过表达香叶基香叶基焦磷酸合酶(geranylgeranyl diphosphate synthases,GGPPS)或柯巴基焦磷酸合酶(copalyl diphosphate synthase,CPPS)因能够提高松香烷类二萜的总含量,在GGPPS和CPPS过表达毛状根体系中分别增加了8倍和10倍[18]。WANG等[19]以发根农杆菌介导的地黄遗传转化体系为研究对象,筛选能显著提高地黄毛状根毛蕊花糖苷积累的最佳激发因子。结果表明毛蕊花糖苷积累量与水杨酸的添加呈正相关,最佳水杨酸剂量为25 μmol/L。丹参酮是丹参中有价值的天然二萜类化合物,以丹参毛状根为对象,研究玉米转录因子C1(Zea mays C1,ZmC1)对丹参酮生物合成的影响。结果表明,ZmC1的外源表达通过上调萜类生物合成基因转录本显著提高了丹参酮的积累,在C1-6品系中获得的总丹参酮干重达到3.59 mg/g,是对照组的3.4倍[20]。
姜黄素是具有降血脂、抗肿瘤、抗炎、抗氧化等作用的二酮类化合物,通过代谢工程在颠茄毛状根中首次成功证实姜黄素及其糖苷的合成。通过异源表达姜黄素生物合成途径关键基因,即双酮基辅酶A合成酶基因(diketide-CoA synthase,DCS)和姜黄素合成酶(curcumin synthase 1,CURS3)和葡萄糖基转移酶基因(Catharanthus roseus glucosyltransferase gene,CaUGT2),改变颠茄苯丙素途径固有的生物合成前体的路线,导致在毛状根克隆体系中产生姜黄素及其糖苷。在摇瓶培养条件下,携带DCS/CURS3基因的PGD2-HR1(transgenic HR clones of the PGD2 series)克隆的姜黄素产量最高(180.62±4.7) μg/g(干重),而同时表达DCS/CURS3和CaUGT2基因的PGD3-HR3克隆的姜黄素单苷含量最高(32.63±2.27) μg/g(干重),姜黄素含量最高(67.89±2.56) μg/g(干重)。生物反应器放大结果显示,PGD2-HR1(姜黄素的2.3倍)和PGD3-HR3克隆(姜黄素-单葡萄糖苷和姜黄素的0.9倍和1.65倍)的产量有所提高。这些发现表明利用毛状根培养物作为姜黄素及其糖苷的生产来源是有优势的[21]。
西洋参毛状根培养物合成的人参皂苷是一种具有多向药理活性的三萜皂苷。其生物合成过程中的第一个限速酶是3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy-3-methyl glutaryl coenzyme A reductase,HMGR)。KOCHAN等[22]分析了脱落酸(abscisic acid,ABA)、酵母提取物对西洋参HMGR基因表达、西洋参毛状根生物量以及人参皂苷水平的影响。结果显示,外源添加ABA可以影响西洋参毛状根的生长和生物量,而ABA短时间处理(1和3 d)对新鲜生物量没有影响,0.5和1 mg/L的ABA处理较长时间对新鲜生物量和干生物量均有显著抑制作用;在摇瓶培养条件下,50 mg/L的酵母提取物处理3 d后,6种人参皂苷(Rb1、Rb2、Rc、Rd、Re和Rg1)的总含量达到最高[20 mg/g(干重)],人参皂苷含量是对照组的1.57倍。结果表明,酵母提取物可用于提高毛状根培养物中人参皂苷的产量,其中50 mg/L时效果最好。同时,摇瓶实验和生物反应器实验的总皂苷含量比未处理样品的总皂苷含量分别提高了55%和140%[23]。
2.2.2 酚类
酚类化合物广泛存在于自然界中,根据挥发性分为挥发性酚和非挥发性酚。自然界中存在的酚类化合物大部分是植物生命活动的结果,植物体内所含的酚称内源性酚,其余称外源性酚。对动物和人类的研究表明,多酚可以延缓与年龄相关的学习、记忆和神经退行性疾病的衰退[24]。自由基与人类许多慢性和急性疾病相关,如哮喘、动脉粥样硬化性白内障、糖尿病、肝损伤和神经退行性疾病。抗氧化剂是一种有用的成分,它通过清除自由基的靶点来抑制自由基。黄酮类化合物和酚类化合物具有清除自由基的作用[25]。毛状根已被应用于探究花生四烯醇、花青素、黄酮类等酚类化合物的积累。
在花生中含有多种二苯乙烯类活性物质,包括白藜芦醇、白皮杉醇、花生四烯醇。有研究探究其活性成分产生的最佳诱导工艺[26],确定了以18 g/L甲基-β-环糊精(cyclodextrin, CD)、125 μmol/L茉莉酸甲酯(methyl jasmonate, MeJA)、3 mmol/L H2O2和1 mmol/L MgCl2共同处理时,效果最佳。诱导子作用168 h后,花生四烯醇-1、花生四烯醇-2、花生四烯醇-3和花生四烯醇-5的总合成量约为750 mg/L[相当于107 mg/g(干重)]。与其他激发剂处理相比, MeJA和CD联合处理可持续产生高水平的白藜芦醇、白皮杉醇、花生四烯醇-1和花生四烯醇-3。此外,MeJA和CD单独处理结果不佳,也可说明它们对白藜芦醇合成酶基因的表达具有协同作用。由此,证明花生毛状根培养是一种生产多种类型的生物活性二苯乙烯类可控的和可持续的体系。
BARBA-ESPIN等[27]建立了一种生产花青素的紫胡萝卜毛状根培养方法。该研究利用发根农杆菌对4种胡萝卜品种的主根和下胚轴外植体进行了转化。确定3个快速生长的毛状根系,其中2个来自根外植体(NB-R和43-R系),1个来自下胚轴外植体(43-H系)。在4周的时间里,毛状根生物量在液体介质中积累了25~30倍。利用超高液相色谱-光电二极管阵列-飞行时间质谱仪联用技术检测了9种花青素和24种羟基肉桂酸衍生物。在毛状根培养中添加乙烯释放化合物乙烯利,在43-R系中,同对照组相比花青素含量显著提升至82%,在NB-R系中,羟基肉桂酸含量>20%。此外,在乙烯利的作用下,毛状根中超氧化物歧化酶和谷胱甘肽转移酶活性升高。这些研究结果表明,紫胡萝卜毛状根培养可作为花青素和抗氧化剂体外生产的方式,并为研究黑胡萝卜次生代谢的调控提供了新的思路。进一步通过差异表达基因分析,发现异位表达诱导了涉及苯丙素生物合成(24个基因)和类黄酮生物合成(17个基因)的基因表达,导致花青素的产量比转基因对照组多出191~341倍。此外,过表达人参毛状根的DPPH自由基清除活性和氧化自由基吸收能力值比对照组高约7倍。在α-黑色素细胞刺激因子刺激的B16F10细胞中,与对照相比,过表达人参毛状根抑制50%~59%的黑色素积累。研究结果显示,异位表达是提高花青素生产的有效策略,从而提高人参毛状根培养的生物活性[28]。
利用发根农杆菌侵染何首乌叶片,获得毛状根培养物(hairy roots cultures, HRCs),以研究其中的酚类化合物代谢机制。在该研究中,所有6个HRC系的生物量(至少6.6倍)和酚类化合物(至少2.4倍)均高于非转基因毛状根。进一步证实毛状根培养物是次生代谢产物的潜在来源。在选择的6个HRCs系中,以HR-01株系表现最好,根系生物量[105.2 g/L(鲜重), 9.7 g/L(干重)]比非转基因根高10倍。HR-01的总酚含量也显著增加[26.64 mg/g(干重)],非转基因根总酚含量为8.36 mg/g(干重)。用50 μmol/L MeJA侵染5 d后,HRCs中的酚类化合物水平增加了2.5倍以上。该研究结果表明,HRCs在生物反应器中大规模生产根系生物量和次生代谢产物有广阔的前景[29]。黄芩苷、黄芩素和乌黄素是黄芩生产的有价值的天然黄酮类化合物。研究显示,玉米转录因子Lc通过在黄岑毛状根系中全面上调类黄酮生物合成途径基因提高这3种黄酮类化合物的产量,最终的总类黄酮含量高达(80.5±6.15) mg/g(干重)。比3个Gus-过表达株系的总黄酮含量平均值高出322%。同样,拟南芥转录因子PAP1通过上调苯丙氨酸解氨酶1、苯丙氨酸解氨酶2、苯丙氨酸解氨酶3、肉桂酸-4-羟基化酶、4-香豆酸:辅酶A连接酶、查尔酮异构酶以及UDP-葡萄糖醛酸:黄芩素7-O-葡萄糖醛酸基转移酶提高黄酮生物量积累,最终生成的总类黄酮含量高达(133±7.66) mg/g(干重),比3个Gus-过表达株系的总黄酮含量平均值高出532%。上述结果表明,通过发根农杆菌介导的转化可以实现黄芩的代谢工程,在毛状根培养中过表达玉米Lc转录因子(maize leaf color,ZmLc)和拟南芥PAP1转录因子(production of anthocyanin pigment 1,AtPAP1)可以促进黄芩苷、黄芩素和乌黄素的生产。同时,ZmLc和AtPAP1可作为黄芩毛状根培养物类黄酮生物合成途径的正向调节因子[30]。
无花果是酚类和黄酮类化合物的重要来源,在多种疾病中具有重要的药用价值。有研究探讨了印度梨形孢对无花果毛状根培养物生长、酚类化合物产量、抗氧化能力和类黄酮生物合成途径基因表达水平的影响。以2%的印度梨形孢培养滤液处理72 h后,酚类化合物的富集效果最好:没食子酸(80.5倍)、咖啡酸(26.2倍)、香豆酸(4.5倍)、肉桂酸(60.1倍)、芹菜素(27.6倍)和芦丁(5.7倍)。培养滤液和细胞提取物以6%体积比诱导48 h后,绿原酸含量最高,为4.9倍,槲皮素类黄酮含量最高,为8.8倍。生物合成基因分析表明,真菌诱导子可上调苯丙氨酸解氨酶、查尔酮合成酶、类黄酮糖基转移酶和MYB3转录因子[31]。该研究表明,印度梨形孢是一种有效的诱导子,可促进无花果毛状根次生代谢产物的产生。
2.2.3 生物碱
生物碱是存在于自然界中的一类含氮的碱性有机化合物,主要存在于植物中。大多数都有复杂的环状结构,环内多包含氮素,有显著的生物活性,是中草药中重要成分之一。生物碱具有抗肿瘤、抗氧化等功能。喜树碱及其类似物作为拓扑异构酶抑制剂,表现出强效的抗肿瘤活性[32],尤其是喜树碱、长春碱、颠茄碱等药用活性物质的代谢研究,植物毛状根成为主要植物培养模式。
喜树碱是一种单萜吲哚生物碱,广泛应用于癌症的治疗。HAO等[33]以短小蛇根草毛状根为对象,研究喜树碱的积累与培养时间的关系。结果表明,短小蛇根草中喜树碱的积累与培养时间的增加呈正相关。此外,短小蛇根草转录因子OpWRKY2的表达与喜树碱的生物合成相关,并受到多种植物激素的诱导。喜树碱生物合成基因色氨酸脱羧酶(tyrosine decarboxylase,OpTDC)在OpWRKY2过表达毛状根系中表达量增加,而在OpWRKY2沉默毛状根系中表达量显著降低。通过对转基因毛状根的代谢产物分析发现,OpWRKY2正向调控喜树碱和色胺的生物合成。凝胶迁移实验、酵母单杂交实验和双荧光素酶报告实验检测表明,OpWRKY2在体外和体内结合并激活OpTDC的启动子。综上所述,结果表明OpWRKY2在喜树碱生物合成中起正向调控作用,为通过短小蛇根草中功能性WRKY来提高喜树碱水平提供了一种可行的策略。
萜类吲哚生物碱(terpene indole alkaloids, TIAs)生物合成工程是一项复杂的任务[34],茉莉酸(jasmonic acid,JA)响应的AP2/ERF转录因子转录因子(APETALA2/ethylene responsive factor)ORCA3(octadecanoid responsive Catharanthus AP2-domain protein)及其调节因子CrMYC2(basic helix-loop-helix factor)在萜类吲哚生物碱生物合成中发挥关键作用。在长春花毛状根中,ORCA4的过表达导致长春花毛状根中TIA含量显著增加,这是以前通过表达单个编码TF或途径酶基因无法获得的结果。CrMYC2是JA信号的关键调控因子,它直接调控ORCA3,也间接影响ORCA4和ORCA5。ORCA基因簇和CrMYC2都受到由丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPKs) CrMAPK3/6、CrMAPKK1,可能还有CrMAPKKK1组成的CrMAPK级联调控。CrMAPK级联参与TIA生物合成的过程可以通过CrMAPKK1在长春花毛状根中过表达得到证实。PAUL等[35]还通过实验验证了CrMYC2作为ORCA3的激活因子和ORCA基因簇调控的TDC和细胞色素P450还原酶(cytochrome P450 reductase, CPR)基因的共激活因子双重控制TIA基因调控。SUN等[36]成功将长春碱途径的前2个基因水甘草碱16-羟化酶(tabersonine 16-hydroxylase, T16H)和16-氧-甲基-转移酶(16-O-methyhransferase,16OMT)导入长春花毛状根中,以启动长春碱途径代谢物中间体的产生。T16H和16OMT的过表达导致文朵灵通路的前2个中间体16-羟基-甘草碱和16-甲氧基-甘草碱的合成。一些研究者也致力于研究水甘草碱生产长春碱的完整生物合成途径[37]。除此之外,诱导子壳聚糖的添加显著增强了长春碱的积累[38]。未来,消除甘草碱的竞争反应、沉默表达负调控因子以及过表达文朵灵途径关键酶基因,将成为促进毛状根中文朵灵的合成的有效措施。
颠茄是颠茄属多年生草本植物,有效成分为生物碱,比如颠茄碱、东莨菪碱和阿托品等。可用于治疗镇痛、制止盗汗、胃酸过多等。研究表明,不同培养基对颠茄毛状根生长有影响,B5培养基和MS培养基对颠茄毛状根生长量差异不大,但是B5培养基中毛状根生长情况更好,并且B5培养基中单瓶毛状根生物碱含量最高[39]。研究发现莨菪碱6-β羟化酶(DiH6H)蛋白在植物中高度保守,参与东莨菪碱和山莨菪碱的生物合成。这些发现为在毛曼陀罗毛状根中过表达H6H基因开辟了新的途径,从而可能将该系统转化为一个潜在的东莨菪碱工厂,以获得更高的东莨菪碱产量。LI等[40]研究指出,过表达DiH6H能够促进东莨菪碱在毛曼陀罗毛状根中的生成,过表达DiH6H的毛状根中东莨菪碱含量为0.54 mg/g(干重),显著高于对照组。
2.3 在环境修复方面的应用
与现有的物理和化学技术相比,生物修复是一种可替代的有效技术,它具有生态友好性、成本效益高等特点,近年来被应用于环境净化领域。在生物修复的来源中,植物修复具有安全、易于操作、对环境破坏性较小等优点[41],是一种廉价、环保的修复有机污染物的技术,尤其是对土壤和水中酚类化合物等有机污染物的修复[42]。通过不同体系对环境修复的效果比较分析,有学者认为毛状根在修复环境方面有比较高的研究价值[41]。近年来,毛状根已被成功用作研究工具,筛选不同植物品种对多氯联苯、三硝基甲苯、药物、纺织染料、酚类物质、重金属和放射性核素等环境污染物的耐受性、累积性和去除能力[4]。
2.3.1 用于污水处理
酚类物质是主要的化学污染物之一,具有很高的毒性且能够致癌,对人以及动物都极其有害。有研究表明,芥菜毛状根培养4 d内甲基橙脱色率达92%[43],番茄毛状根培养物可以耐受电离辐射[44],甘蓝型油菜毛状根能够促进苯酚的降解,对于含10~250 mg/L的苯酚溶液,清除率分别为80%~100%[45-46];此外,甘蓝型油菜、萝卜和辣椒的毛状根在2~96 h内可以从培养基中去除了86%的硫丹(一种多氯环己二烯杀虫剂)[47]。有研究人员建立了表达番茄基本过氧化物酶基因(expressed basic Px genes from tomato,tpx1和tpx2)的转基因烟草毛状根,选择10个烟草毛状根克隆体系进行苯酚去除试验。结果显示,所有体系的去除率均较高,但部分转基因体系的去除率明显高于对照组[48]。IB
 EZ等[49]研究利用丛枝菌根真菌(arbuscular mycorrhiza fungi,AMF)对转基因烟草毛状根(即TPX1)耐酚性进行了研究,测定其抗氧化反应和氧化损伤参数,如丙二醛含量。在污染物浓度增加的情况下,与野生型相比,转基因AMF的TPX1毛状根具有更高的抗氧化酶,与外源性AMF相关的TPX1毛状根中丙二醛水平保持不变。这些结果表明,该培养物对苯酚具有耐受性,而且对苯酚诱导的氧化损伤具有有效的保护机制。氯酚是环境中最常见的持久性污染物之一,其氯取代基有很高的毒性。根据VANINA等[50]的研究,甘蓝型油菜毛状根能够清除废水中的2,4-二氯苯酚(2,4-dichlorophenol, 2,4-DCP)。在较短时间(30 min)内获得了很高的去除效率(98%),根系重复使用6个循环后,2,4-DCP的去除率下降到86%。TALANO等[51]通过烟草毛状根克隆系,去除2,4-DCP。对于2,4-DCP初始质量浓度分别为250、500和1000 mg/L的溶液,毛状根培养物去除其效率分别为98%、88%和83%。在处理60 min和10 mmol/L H2O2条件下,500 mg/L 2,4-DCP的去除率最高。
EZ等[49]研究利用丛枝菌根真菌(arbuscular mycorrhiza fungi,AMF)对转基因烟草毛状根(即TPX1)耐酚性进行了研究,测定其抗氧化反应和氧化损伤参数,如丙二醛含量。在污染物浓度增加的情况下,与野生型相比,转基因AMF的TPX1毛状根具有更高的抗氧化酶,与外源性AMF相关的TPX1毛状根中丙二醛水平保持不变。这些结果表明,该培养物对苯酚具有耐受性,而且对苯酚诱导的氧化损伤具有有效的保护机制。氯酚是环境中最常见的持久性污染物之一,其氯取代基有很高的毒性。根据VANINA等[50]的研究,甘蓝型油菜毛状根能够清除废水中的2,4-二氯苯酚(2,4-dichlorophenol, 2,4-DCP)。在较短时间(30 min)内获得了很高的去除效率(98%),根系重复使用6个循环后,2,4-DCP的去除率下降到86%。TALANO等[51]通过烟草毛状根克隆系,去除2,4-DCP。对于2,4-DCP初始质量浓度分别为250、500和1000 mg/L的溶液,毛状根培养物去除其效率分别为98%、88%和83%。在处理60 min和10 mmol/L H2O2条件下,500 mg/L 2,4-DCP的去除率最高。
为研究植物氧苯酮的潜在降解能力,对成熟的毛状根培养物进行了氧苯酮处理。处理3 h后,辣根毛状根能去除20%以上的氧苯酮(100 μmol/L)。在处理后的毛状根中检测到2种新的代谢产物,分别为氧苯酮-Glu和氧苯酮-Mal-Glu。辣根毛状根系统为探索氧苯酮在植物体内的代谢提供一种简单的方法。此外,利用植物对紫外线过滤化合物进行修复,为处理废水中出现的污染物提供了一种合适的选择[52]。以菊苣和芥菜为材料,研究它们对双对氯苯基三氯乙烷(dichlorodiphenyltrichloroethane,DDT)的吸收和降解能力。在14C 标记的DDT(14C DDT)处理24 h后,培养基中检测到的总施用量只有12%~13%,表明毛状根对DDT的有效吸收。在培养的初始阶段,原位降解率较高,10 d内残留在根中的14C DDT从77%下降到61%。在无毛状根培养基和有毛状根灭菌培养基中,14C DDT均未发生自发降解。研究结果表明,这些植物在环境治理中具有潜在的适用性和优势,可用于DDT等持久性外生物质的植物修复[53]。
2.3.2 用于重金属污染处理
利用植物去除环境中的有毒重金属目前具有巨大的经济价值。植物修复和植物开采的方法依赖于植物在其组织中积累大量金属的能力。对这些技术的发展特别重要的是超累积植物,它能够吸收和储存高浓度的Cd、Ni、Zn、Cu和其他重金属,而不会造成金属毒性或细胞损伤[54]。而HRCs由高度均匀的组织组成,结构和功能类似于完整的植物根。HRCs与组织培养相比,基因型和表型稳定性更好[55]。
有研究者以龙葵毛状根为对象,研究了铁调控转运体基因(IRT1)在植物修复镉污染中的应用潜力。与野生型相比,转基因毛状根具有显著的根系生长优势,抗氧化酶活性提高,细胞凋亡减少。结果表明,IRT1在毛状根中的表达使镉积累水平比野生型提高了19%。这些结果为了解转基因龙葵毛状根对镉的耐受机制提供了重要依据,对开发高效的植物修复转基因候选植物具有重要意义[56]。PEROTTI等[57]研究欧洲油菜毛状根对Cr(VI)的修复效果,并对其修复机理和修复后溶液的毒性进行研究,证明了油菜毛状根能够耐受并有效地去除合成溶液中质量浓度高达10 mg/L的Cr(VI),Cr(VI)部分降低为对不同微生物的毒性小的Cr(III)。SUN等[58]在油菜毛状根镉(Cd)胁迫下发现了2394个差异表达基因,免疫印迹检测结果显示谷胱甘肽合成和代谢信号通路在Cd应激反应中发挥重要作用,这些结果为进一步了解油菜对重金属的耐受性及其分子机制提供了有价值的信息,同时也为植物修复提供了思路。
由于砷对所有生物都有剧毒这一特性,因此砷污染是食物链的潜在污染,寻找适合去除污染土壤中砷的超富集物成为一项至关重要的任务。辣根是一种具有较高重金属积累潜力的作物植物,也可用于研究砷胁迫下的生理过程。KOFRO OV
OV [55]等研究在不同含量砷(5~60 μg/L)的培养基上,对辣根毛状根培养物进行体外培养。结果表明砷虽能抑制其生长,但在最高浓度时生物量增加了3倍。此外,毛状根组织能够在7 d内除去培养基中多达75%的砷。这一研究指出,辣根毛状根具有有效的抗氧化系统,即使在高曝晒条件下,也能使其良好生长和大量积累。辣根具有的这些重要特征,进一步证实辣根在砷植物修复中具有广阔的应用前景。EAPEN等[59]利用芥菜和苋色藜毛状根培养物,研究其对铀的降解能力。发现毛状根能在短时间内将铀从水溶液中除去,芥菜毛状根可以从含有5 000 μmol/L以上的溶液中吸收20%~23%的铀。目前对芥菜和苋色藜毛状根转化培养的研究表明,它们是去除污染溶液中重金属和放射性核素的理想选择,在这些污染溶液中,毛状根可以存活数小时到数天。
[55]等研究在不同含量砷(5~60 μg/L)的培养基上,对辣根毛状根培养物进行体外培养。结果表明砷虽能抑制其生长,但在最高浓度时生物量增加了3倍。此外,毛状根组织能够在7 d内除去培养基中多达75%的砷。这一研究指出,辣根毛状根具有有效的抗氧化系统,即使在高曝晒条件下,也能使其良好生长和大量积累。辣根具有的这些重要特征,进一步证实辣根在砷植物修复中具有广阔的应用前景。EAPEN等[59]利用芥菜和苋色藜毛状根培养物,研究其对铀的降解能力。发现毛状根能在短时间内将铀从水溶液中除去,芥菜毛状根可以从含有5 000 μmol/L以上的溶液中吸收20%~23%的铀。目前对芥菜和苋色藜毛状根转化培养的研究表明,它们是去除污染溶液中重金属和放射性核素的理想选择,在这些污染溶液中,毛状根可以存活数小时到数天。
3 结论与展望
该综述通过对毛状根在再生植物、次生代谢生产以及环境修复方面应用的总结,阐述了毛状根在应用研究中的作用。尤其由于其生长迅速和遗传性能稳定,并且在不添加外源激素的基础上也能快速生长的特点成为次生代谢产物生产的一种可靠且有效的途径;为生产植物自身含量低、生长周期长、合成途径复杂的次生代谢产物提供了有效的方法,具有很高的应用前景。但仍存在诸多问题需要解决。目前,毛状根的培养大多在实验室规模,采用少量多批次的培养,生长情况由肉眼判定,特别是外源物感染也是组织培养过程不可避免的因素,同时还存在如扩大培养现有技术无法支撑,没有成型的生物反应器能满足其正常生理生化要求,包括pH、营养消耗、含氧量、添加子等的严格监控;培养过程中,毛状根的生长形态会逐渐成团,球形限制了根部对氧气与营养的吸收,而且毛状根培养过程中很容易出现氧化迸发致其死亡的情况,这些不定因素都会导致植物开始凋亡,如何维持毛状根最佳生长状态和速率则是需要克服的另一问题;毛状根可能会产生异于野生植株的新物质,对于目标产物和生产途径干扰情况未知,需要大量实验验证;不同的植物培养条件具有物种差异性,最优培养条件需要摸索,目前毛状根培养成功的只有部分双子叶植物和少部分单子叶植物及裸子植物,应用范围较窄。因此,如何更好的开发和利用毛状根培育技术,使其能够达到基础研究和大规模工业化生产的要求还需要进一步探讨。此外,国内对于毛状根的研究主要是在体系构建等方面,需要更多研究者深入系统研究其代谢调控机制,从基因水平上对合成有效物质的关键基因进行表达调控,促进次生代谢产物的合成。同时尽管已经有很多研究证明毛状根培养物可以去除酚类物质以及重金属物质(Cd、Cr、As等),在今后的研究中仍需要重点发掘新的植物修复毛状根并研究毛状根在环境修复方面的作用机制。
[1] 张来, 罗正伟, 张显强, 等.发根农杆菌Ri质粒的特征及其应用[J].安徽农业科学, 2010, 38(15):8183-8185.
ZHANG L, LUO Z W, ZHANG X Q, et al.Characteristic and application about Ri plasmid of Agrobacterium rhizogenes[J].Journal of Anhui Agricultural Sciences, 2010, 38(15):8183-8185.
[2] 刘彤, 杨淑慎, 方荣锋, 等.Ri质粒介导的毛状根体系建立及其在植物次生代谢产物合成中的研究进展[J].植物科学学报, 2015, 33(2):264-270.
LIU T, YANG S S, FANG R F, et al.Establishment of hairy root system mediated by Ri plasmid and its advances in biosynthesis of plant secondary metabolites[J].Plant Science Journal, 2015, 33(2):264-270.
[3] 陈友明, 刘静轶, 张腾, 等.重金属超富集植物东南景天毛状根的诱导[J].热带亚热带植物学报, 2017, 25(2):136-140.
CHEN Y M, LIU J Y, ZHANG T, et al.Induction of hairy roots in heavy metal hyperaccumulator Sedum alfredii[J].Journal of Tropical and Subtropical Botany, 2017, 25(2):136-140.
[4] AGOSTINI E, TALANO M A, GONZ LEZ P S, et al.Application of hairy roots for phytoremediation:What makes them an interesting tool for this purpose?[J].Applied Microbiology and Biotechnology, 2013, 97(3):1017-1030.
LEZ P S, et al.Application of hairy roots for phytoremediation:What makes them an interesting tool for this purpose?[J].Applied Microbiology and Biotechnology, 2013, 97(3):1017-1030.
[5] CHRISTEY M C, SINCLAIR B K, BRAUN R H, et al.Regeneration of transgenic vegetable brassicas (Brassica oleracea and B.campestris) via Ri-mediated transformation[J].Plant Cell Reports, 1997, 16(9):587-593.
[6] GIRI A, NARASU M L.Transgenic hairy roots[J].Biotechnology Advances, 2000, 18(1):1-22.
[7] SHIH P M, VUU K, MANSOORI N, et al.A robust gene-stacking method utilizing yeast assembly for plant synthetic biology[J].Nature Communications, 2016, 7:13215.
[8] DOW M.Encyclopedia of Applied Plant Sciences [M].Second Edition.HRI Wellesbourne, UK:Academic Press, 2017.
[9] JIAO J, GAI Q Y, WANG W, et al.Remarkable enhancement of flavonoid production in a co-cultivation system of Isatis tinctoria L.hairy root cultures and immobilized Aspergillus niger[J].Industrial Crops and Products, 2018, 112:252-261.
[10] CUI M L, LIU C, PIAO C L, et al.A stable Agrobacterium rhizogenes-mediated transformation of cotton (Gossypium hirsutum L.) and plant regeneration from transformed hairy root via embryogenesis[J].Frontiers in Plant Science, 2020, 11:604255.
[11] BUTLER N M, JANSKY S H, JIANG J M.First-generation genome editing in potato using hairy root transformation[J].Plant Biotechnology Journal, 2020, 18(11):2201-2209.
[12] LI M, HU Z, JIANG Q Y, et al.GmNAC15 overexpression in hairy roots enhances salt tolerance in soybean[J].Journal of Integrative Agriculture, 2018, 17(3):530-538.
[13] NAKAYASU M, AKIYAMA R, LEE H J, et al.Generation of α-solanine-free hairy roots of potato by CRISPR/Cas9 mediated genome editing of the St16DOX gene[J].Plant Physiology and Biochemistry, 2018, 131:70-77.
[14] MA X H, MA Y, TANG J F, et al.The biosynthetic pathways of tanshinones and phenolic acids in Salvia miltiorrhiza[J].Molecules, 2015, 20(9):16235-16254.
[15] LING C C, ZHENG L J, YU X R, et al.Cloning and functional analysis of three aphid alarm pheromone genes from German chamomile (Matricaria chamomilla L.)[J].Plant Science, 2020, 294:110463.
[16] 梁宗锁, 方誉民, 杨东风.植物萜类化合物生物合成与调控及其代谢工程研究进展[J].浙江理工大学学报(自然科学版), 2017, 37(2):255-264.
LIANG Z S, FANG Y M, YANG D F.Biosynthesis, regulation and metabolic engineering of terpenoids in plants[J].Journal of Zhejiang Sci-Tech University (Natural Sciences Edition), 2017, 37(2):255-264.
[17] 杨蕊, 张家辉, 孙雪梅, 等.杜仲毛状根培养条件优化及其桃叶珊瑚苷药用成分的研究[J].中国中药杂志, 2009, 34(15):1902-1905.
YANG R, ZHANG J H, SUN X M, et al.Hairy root culture optimization and aucubin medical composition production of Eucommia ulmoides[J].China Journal of Chinese Materia Medica, 2009, 34(15):1902-1905.
[18] VACCARO M C, ALFIERI M, DE TOMMASI N, et al.Boosting the synthesis of pharmaceutically active abietane diterpenes in S.sclarea hairy roots by engineering the GGPPS and CPPS genes[J].Frontiers in Plant Science, 2020, 11:924.
[19] WANG F Q, ZHI J Y, ZHANG Z Y, et al.Transcriptome analysis of salicylic acid treatment in Rehmannia glutinosa hairy roots using RNA-seq technique for identification of genes involved in acteoside biosynthesis[J].Frontiers in Plant Science, 2017, 8:787.
[20] ZHAO S J, ZHANG J J, TAN R H, et al.Enhancing diterpenoid concentration in Salvia miltiorrhiza hairy roots through pathway engineering with maize C1 transcription factor[J].Journal of Experimental Botany, 2015, 66(22):7211-7226.
[21] SINGH S, PANDEY P, AKHTAR M Q, et al.A new synthetic biology approach for the production of curcumin and its glucoside in Atropa belladonna hairy roots[J].Journal of Biotechnology, 2021, 328:23-33.
[22] KOCHAN E, BALCERCZAK E, SZYMCZYK P, et al.Abscisic acid regulates the 3-hydroxy-3-methylglutaryl CoA reductase gene promoter and ginsenoside production in Panax quinquefolium hairy root cultures[J].International Journal of Molecular Sciences, 2019, 20(6):1310.
[23] KOCHAN E, SZYMCZYK P, ![]() et al.Yeast extract stimulates ginsenoside production in hairy root cultures of American ginseng cultivated in shake flasks and nutrient sprinkle bioreactors[J].Molecules, 2017, 22(6):880.
et al.Yeast extract stimulates ginsenoside production in hairy root cultures of American ginseng cultivated in shake flasks and nutrient sprinkle bioreactors[J].Molecules, 2017, 22(6):880.
[24] GUEST P.Reviews on new drug targets in age-related disorders:Part II[M].//Advances in Experimental Medicine and Biology, 2021.
[25] SIKANDAR A, ZHANG M Y, WANG Y Y, et al.Mycochemical screening and analysis, antioxidant activity, and biochemical composition of fermentation strain Snef1216 (Penicillium chrysogenum) [J].Journal of Analytical Methods in Chemistry, 2020,1-8.
[26] YANG T H, FANG L L, CESAR N O, et al.Enhanced production of resveratrol, piceatannol, arachidin-1, and arachidin-3 in hairy root cultures of peanut co-treated with methyl jasmonate and cyclodextrin[J].Journal of Agricultural and Food Chemistry, 2015, 63(15):3942-3950.
[27] BARBA-ESP N G, CHEN S T, AGNOLET S, et al.Ethephon-induced changes in antioxidants and phenolic compounds in anthocyanin-producing black carrot hairy root cultures[J].Journal of Experimental Botany, 2020, 71(22):7030-7045.
N G, CHEN S T, AGNOLET S, et al.Ethephon-induced changes in antioxidants and phenolic compounds in anthocyanin-producing black carrot hairy root cultures[J].Journal of Experimental Botany, 2020, 71(22):7030-7045.
[28] JIN S, HYUN T K.Ectopic expression of production of anthocyanin pigment 1 (PAP1) improves the antioxidant and anti-melanogenic properties of ginseng (Panax ginseng C.A.Meyer) hairy roots[J].Antioxidants, 2020, 9(10):922.
[29] PARK C H, XU H, YEO H J, et al.Enhancement of the flavone contents of Scutellaria baicalensis hairy roots via metabolic engineering using maize Lc and Arabidopsis PAP1 transcription factors[J].Metabolic Engineering, 2021, 64:64-73.
[30] HO T T, LEE J D, AHN M S, et al.Enhanced production of phenolic compounds in hairy root cultures of Polygonum multiflorum and its metabolite discrimination using HPLC and FT-IR methods[J].Applied Microbiology and Biotechnology, 2018, 102(22):9563-9575.
[31] AMANI S, MOHEBODINI M, KHADEMVATAN S, et al.Piriformospora indica based elicitation for overproduction of phenolic compounds by hairy root cultures of Ficus carica[J].Journal of Biotechnology, 2021, 327:43-53.
[32] WANG J L, WANG K X, HAN T L, et al.Antitumour properties based on the self-assembly of camptothecin and carbamoylmannose conjugates[J].Chemical Biology &Drug Design, 2020, 96(2):870-877.
[33] HAO X L, XIE C H, RUAN Q Y, et al.The transcription factor OpWRKY2 positively regulates the biosynthesis of the anticancer drug camptothecin in Ophiorrhiza pumila[J].Horticulture Research, 2021, 8(1):7.
[34] KULAGINA N, MÉTEIGNIER L V, PAPON N, et al.More than a Catharanthus plant:A multicellular and pluri-organelle alkaloid-producing factory[J].Current Opinion in Plant Biology, 2022, 67:102200.
[35] PAUL P, SINGH S K, PATRA B, et al.A differentially regulatedAP 2/ERF transcription factor gene cluster acts downstream of aMAP kinase cascade to modulate terpenoid indole alkaloid biosynthesis in Catharanthus roseus[J].New Phytologist, 2017, 213(3):1107-1123.
[36] SUN J Y, ZHAO L, SHAO Z Y, et al.Expression of tabersonine 16-hydroxylase and 16-hydroxytabersonine-O-methyltransferase in Catharanthus roseus hairy roots[J].Biotechnology and Bioengineering, 2018, 115(3):673-683.
[37] MISTRY V, DARJI S, TIWARI P, et al.Engineering Catharanthus roseus monoterpenoid indole alkaloid pathway in yeast[J].Applied Microbiology and Biotechnology, 2022, 106(7):2337-2347.
[38] TANG W Z, LIU X Q, HE Y N, et al.Enhancement of vindoline and catharanthine accumulation, antioxidant enzymes activities, and gene expression levels in Catharanthus roseus leaves by chitooligosaccharides elicitation[J].Marine Drugs, 2022, 20(3):188.
[39] 张翠平, 李琳琳, 韦悦, 等.3种常用培养基对颠茄毛状根生长与次生代谢产物积累的影响[J].西南大学学报(自然科学版), 2017, 39(6):36-41.
ZHANG C P, LI L L, WEI Y, et al.Effects of three media on the growth and secondary metabolite contents of Atropa belladonna L.hairy roots[J].Journal of Southwest University (Natural Science Edition), 2017, 39(6):36-41.
[40] LI Q, ZHU T T, ZHANG R, et al.Molecular cloning and functional analysis of hyoscyamine 6β-hydroxylase (H6H) in the poisonous and medicinal plant Datura innoxia Mill[J].Plant Physiology and Biochemistry, 2020, 153:11-19.
[41] PATIL P, DESAI N, GOVINDWAR S, et al.Degradation analysis of Reactive Red 198 by hairy roots of Tagetes patula L.(marigold)[J].Planta, 2009, 230(4):725-735.
[42] PAISIO C E, GONZ LEZ P S, GERBAUDO A, et al.Toxicity of phenol solutions treated with rapeseed and tomato hairy roots[J].Desalination, 2010, 263(1-3):23-28.
LEZ P S, GERBAUDO A, et al.Toxicity of phenol solutions treated with rapeseed and tomato hairy roots[J].Desalination, 2010, 263(1-3):23-28.
[43] TELKE A A, KAGALKAR A N, JAGTAP U B, et al.Biochemical characterization of laccase from hairy root culture of Brassica juncea L.and role of redox mediators to enhance its potential for the decolorization of textile dyes[J].Planta, 2011, 234(6):1137-1149.
[44] DESIDERIO A, SALZANO A M, SCALONI A, et al.Effects of simulated space radiations on the tomato root proteome[J].Frontiers in Plant Science, 2019, 10:1334.
[45] GONZ LEZ P S, ONTA
LEZ P S, ONTA ON O M, ARMENDARIZ A L, et al.Brassica napus hairy roots and rhizobacteria for phenolic compounds removal[J].Environmental Science and Pollution Research, 2013, 20(3):1310-1317.
ON O M, ARMENDARIZ A L, et al.Brassica napus hairy roots and rhizobacteria for phenolic compounds removal[J].Environmental Science and Pollution Research, 2013, 20(3):1310-1317.
[46] GONZ LEZ P S, MAGLIONE G A, GIORDANA M, et al.Evaluation of phenol detoxification by Brassica napus hairy roots, using Allium cepa test[J].Environmental Science and Pollution Research, 2012, 19(2):482-491.
LEZ P S, MAGLIONE G A, GIORDANA M, et al.Evaluation of phenol detoxification by Brassica napus hairy roots, using Allium cepa test[J].Environmental Science and Pollution Research, 2012, 19(2):482-491.
[47] LUCERO P A, MAGALLANES-NOGUERA C, GIANNINI F A, et al.Remediation of endosulfan-contaminated water by hairy roots:Removal and phytometabolization assessment[J].International Journal of Phytoremediation, 2023, 25(1):106-114.
[48] SOSA ALDERETE L G, TALANO M A, IB
 EZ S G, et al.Establishment of transgenic tobacco hairy roots expressing basic peroxidases and its application for phenol removal[J].Journal of Biotechnology, 2009, 139(4):273-279.
EZ S G, et al.Establishment of transgenic tobacco hairy roots expressing basic peroxidases and its application for phenol removal[J].Journal of Biotechnology, 2009, 139(4):273-279.
[49] IB
 EZ S G, MEDINA M I, AGOSTINI E.Phenol tolerance, changes of antioxidative enzymes and cellular damage in transgenic tobacco hairy roots colonized by arbuscular mycorrhizal fungi[J].Chemosphere, 2011, 83(5):700-705.
EZ S G, MEDINA M I, AGOSTINI E.Phenol tolerance, changes of antioxidative enzymes and cellular damage in transgenic tobacco hairy roots colonized by arbuscular mycorrhizal fungi[J].Chemosphere, 2011, 83(5):700-705.
[50] ANGELINI V A, OREJAS J, MEDINA M I, et al.Scale up of 2, 4-dichlorophenol removal from aqueous solutions using Brassica napus hairy roots[J].Journal of Hazardous Materials, 2011, 185(1):269-274.
[51] TALANO M A, FRONTERA S, GONZ LEZ P, et al.Removal of 2, 4-diclorophenol from aqueous solutions using tobacco hairy root cultures[J].Journal of Hazardous Materials, 2010, 176(1-3):784-791.
LEZ P, et al.Removal of 2, 4-diclorophenol from aqueous solutions using tobacco hairy root cultures[J].Journal of Hazardous Materials, 2010, 176(1-3):784-791.
[52] CHEN F R, HUBER C, MAY R, et al.Metabolism of oxybenzone in a hairy root culture:Perspectives for phytoremediation of a widely used sunscreen agent[J].Journal of Hazardous Materials, 2016, 306:230-236.
[53] SURESH B, SHERKHANE P D, KALE S, et al.Uptake and degradation of DDT by hairy root cultures of Cichorium intybus and Brassica juncea[J].Chemosphere, 2005, 61(9):1288-1292.
[54] BOOMINATHAN R, DORAN P M.Cadmium tolerance and antioxidative defenses in hairy roots of the cadmium hyperaccumulator, Thlaspi caerulescens[J].Biotechnology and Bioengineering, 2003, 83(2):158-167.
[55] KOFRO OV
OV M, HRDINOV
M, HRDINOV A, MA
A, MA KOV
KOV P, et al.Strong antioxidant capacity of horseradish hairy root cultures under arsenic stress indicates the possible use of Armoracia rusticana plants for phytoremediation[J].Ecotoxicology and Environmental Safety, 2019, 174:295-304.
P, et al.Strong antioxidant capacity of horseradish hairy root cultures under arsenic stress indicates the possible use of Armoracia rusticana plants for phytoremediation[J].Ecotoxicology and Environmental Safety, 2019, 174:295-304.
[56] YE P, WANG M H, ZHANG T, et al.Enhanced cadmium accumulation and tolerance in transgenic hairy roots of Solanum nigrum L.expressing iron-regulated transporter gene IRT1[J].Life, 2020, 10(12):324.
[57] PEROTTI R, PAISIO C E, AGOSTINI E, et al.CR(VI) phytoremediation by hairy roots of Brassica napus:Assessing efficiency, mechanisms involved, and post-removal toxicity[J].Environmental Science and Pollution Research, 2020, 27(9):9465-9474.
[58] SUN Y P, LU Q Y, CAO Y S, et al.Comparative transcriptome analysis of the molecular mechanism of the hairy roots of Brassica campestris L.in response to cadmium stress[J].International Journal of Molecular Sciences, 2019, 21(1):180.
[59] EAPEN S, SUSEELAN K N, TIVAREKAR S, et al.Potential for rhizofiltration of uranium using hairy root cultures of Brassica juncea and Chenopodium amaranticolor[J].Environmental Research, 2003, 91(2):127-133.