漆酶是一种氧化还原酶,来源广泛,包括植物、昆虫、真菌和细菌等。在分子氧的存在下,漆酶可以通过单电子催化氧化底物,同时将氧分子还原为水[1-2]。作为催化剂,漆酶具有底物广泛、无二次污染、效率高等优点[3-4],这样优良的催化性能使其被广泛应用于纸浆漂白、环境处理、生物检测、食品加工、有机合成和生物能源等领域[5-6]。
然而,天然漆酶的稳定性低、活性差、易受环境因素影响、重复使用困难等缺点限制了其实际应用[7-8]。为了改善这些现状,研究者们采用了多种改性方法,如蛋白质工程、固定化和培养基工程。而蛋白质工程已被证明是开发具有改进特性或警示功能的生物催化剂的有效策略。其中理性设计是一种可靠的技术,通常用于识别基于先验结构信息的突变热点残基。CHEN等[9]在计算机辅助设计程序的支持下,采用了定点突变方法来提高短小芽孢杆菌CotA漆酶对ABTS的特异性,以及其热稳定性。SANTIAGO等[10]成功地将计算方法与实验验证相结合,合理设计了一种用于聚苯胺生产的改进漆酶。经过进化后,改良型的kcat值提高了2倍。WANG等[11]采用基于亲和力的虚拟突变分析出了枯草芽胞杆菌漆酶降解HPAM-3的关键氨基酸残基。GARCIA等[12]通过在来自色链霉菌的小漆酶蛋白(SLac)中引入新的二硫键,使该酶对不可逆热变性表现出了更强的抵抗力。
本实验对来自地衣芽胞杆菌的漆酶BlLac进行了研究,为了提高它的工业适用性,我们对该酶进行了理性设计改造,在同源建模和与底物ABTS对接后,采用虚拟氨基酸突变的方法,利用软件Discovery Studio 4.0计算突变结合能变化以及预设二硫键,通过突变文库的筛选最后构建出优化的突变体,并对其分子结构进行了分析,阐明了酶活性提高和热稳定性提升的机制。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
地衣芽胞杆菌来源的漆酶基因BlLac(GenBank:AAU23292.2)的氨基酸序列来自国家生物技术信息中心(National Center for Biotechnology Information,NCBI),由生工生物工程(上海)股份有限公司进行全基因合成。大肠杆菌Escherichia coli JM109和枯草芽胞杆菌(Bacillus subtilis)WB600分别被用于重组质粒扩增和蛋白表达,质粒pMA5被用作表达载体(启动子已经过优化)[13],均由本实验室保藏。
1.1.2 试剂与仪器
ABTS、氨苄青霉素、硫酸卡那霉素(kana)、溶菌酶、木糖,生工生物工程(上海)股份有限公司;Mut Express ⅡFast Mutagenesis Kit V2 突变试剂盒、One-Step PAGE Gel Fast Preparation Kit(12%)、BCA蛋白质定量试剂盒、180 kDa蛋白预染marker,诺唯赞生物科技有限公司;引物,金唯智生物科技有限公司。
PCR扩增仪,伯乐生命医学产品(上海)有限公司;超净工作台,苏净集团苏州安泰空气技术有限公司;高速冷冻离心机,日立(中国)有限公司;酶标仪,帝肯(上海)贸易有限公司;恒温金属浴,杭州博日科技股份有限公司;凝胶成像系统,伯乐生命医学产品(上海)有限公司;蛋白纯化系统,苏州赛普仪器有限公司;Nano-dsc,美国TA公司;Biologic ALX 250分光光度计,赛默飞世尔科技公司。
1.1.3 培养基与缓冲液
LB(Luria-Bertani)液体培养基(g/L):胰蛋白胨10.0,NaCl 10.0,酵母粉5.0,121 ℃高压蒸汽灭菌20 min。
TB(terrific broth)液体培养基(g/L):蛋白胨12.0、酵母提取物24.0、甘油4 mL、KH2PO4 2.31、K2HPO4 16.2,121 ℃高压蒸汽灭菌20 min。
Tris-HCl缓冲液:2.422 8 g/L Tris,用HCl溶液调pH至8.0。
1.2 实验方法
1.2.1 同源建模与分子对接
通过同源结构构建网站SWISS-MODEL(https://swissmodel.expasy.org/assess),以序列一致性与BlLac达到99.64%的地衣芽胞杆菌假定蛋白(PDB ID:6DZD)为模板,构建3D模型。以ABTS为配体,使用软件Discovery Studio 2019 CDOKER模块进行蛋白质-配体柔性对接[14]。该配体的三维结构从PubChem(https://pubchem.ncbi.nlm.nih.gov/)网站下载。
1.2.2 突变文库的构建
本研究利用Discovery Studio软件对分子对接结果进行可视化分析,通过氢键、Pi键、盐桥离子键等相互作用力来定义重要氨基酸,使用Mutation Energy模块对这些氨基酸位点进行虚拟的定点饱和突变,根据突变能量(Mutation Energy)变化从低到高对氨基酸突变的结果进行排序,选择突变能量较低的突变体,进行合理的氨基酸突变,从而提高酶的活力。同时,通过Discovery Studio软件Predict Disulfide Bridges模块对该蛋白结构模型进行二硫键的预设,根据预测的每对二硫键对稳定性的影响,同时考虑到以下参数条件:能量变化<5.0、过近接触为0、温度因子变化>20.0、氨基酸埋藏深度3~8等[15],寻找到相应的突变位点,以提高该酶的热稳定性。
1.2.3 突变体的构建,表达和纯化
通过(vazyme.com)在线服务设计引物,由金唯智生物科技有限公司合成后进行单点突变,并且以单点突变为基础进行组合突变,具体的突变过程使用Mut Express Ⅱ Fast Mutagenesis Kit V2 突变试剂盒进行。将重组产物转化至大肠杆菌Escherichia coli JM109感受态中,提取质粒并进行DNA测序,然后将测序成功的质粒转化到B.subtilis WB600感受态细胞中,对单菌落进行菌落PCR验证,引物如电子增强出版附件1(https://doi.org/10.13995/j.cnki.11-1802/ts.034552)所示。挑取验证成功的单菌落接种至10 mL LB(kana)(50 μg/mL)培养基中,在37 ℃、200 r/min振荡培养12 h,后以5%的接种量转接至150 mL TB(kana)(50 μg/mL)培养基中,以37 ℃、200 r/min过夜培养10 h左右(待OD600达到2.0),然后加入终质量浓度为20 mg/mL的木糖在37 ℃、200 r/min诱导培养2 h,收集的菌体可先储存-20 ℃备用。将收到的菌体与20 mmol/L(pH=8)的Tris-HCl 缓冲液以1∶20(g∶mL)的比例重悬,并向重悬液里加入0.5 mol/L NaCl、20 mmol/L咪唑和质量分数1%的20 mg/mL溶菌酶,在37 ℃的培养箱中静置3 h,然后使用超声细胞破碎仪在冰上破碎细胞,所得破碎液在低温条件下进行高速离心。上清液用于蛋白纯化,利用镍柱亲和层析柱进行纯化,将200 mmol/L洗脱下来的蛋白经过超滤浓缩,从而得到目的蛋白酶液。采用SDS-PAGE分析蛋白条带。
1.2.4 蛋白浓度的测定
以牛血清白蛋白为参照物,采用BCA蛋白定量试剂盒测定蛋白浓度。
1.2.5 酶活性的检测
通过ABTS氧化法测定该酶的活性。将180 μL,pH 4.5的0.1 mol/L乙酸-乙酸钠缓冲液和终浓度为40 μmol/L的ABTS溶液在37 ℃下孵育5 min,该反应直接在酶标板中进行,加入100 μL 的待测样品后,立即在420 nm处测量吸光度的增加。一个酶活力单位被定义为在37 ℃下1 min能转化1 μmol/L底物的酶量,计算方法如公式(1)和公式(2)所示:
酶活力![]()
(1)
式中:A,420 nm处吸光度值的变化;Vt,反应体系的体积,mL;Vs,酶液样品体积,mL;ε,ABTS阳离子自由基的摩尔消光系数,ε=36(μmol/mL)-1·cm-1;L,光径,cm;t,反应时间,min。
比酶活力/(U/mg蛋白)![]()
(2)
1.2.6 动力学参数的测定
以不同浓度的ABTS来测定酶的动力学参数,反应体系中ABTS的系列浓度为0.02~0.5 mmoL/L,将反应体系中ABTS溶液(20 μL)和0.1 mol/L的乙酸-乙酸钠缓冲液(180 μL, pH 4.5)置于37 ℃的条件下预热,然后加入100 μL 的纯酶液测定5 min内OD420值的变化。根据公式(1)计算酶活力。动力学参数由米氏方程拟合。
1.2.7 半衰期的测定
将稀释好的酶液放置在40 ℃的水浴锅中保温,每隔30 min取一次样进行酶活力测定,以初始相对酶活力为100%,根据指数衰减定律计算酶活力下降到50%所需要的时间。
1.2.8 温度和pH对BlLac的影响
为了确定温度和pH对该酶的影响,以ABTS为底物在不同温度(20~80 ℃)和不同pH(3~6.5)下测定酶活性,从而确定最适温度和最适pH。通过酶溶液在不同温度(30、40、50 ℃)下孵育一段时间后的残余活性,确定该酶的热稳定性。通过测量酶在不同pH(3~10.6)、4 ℃下孵育2 h后的残余活性,确定该酶在酸碱条件下的稳定性。各种pH缓冲溶液分别为:Na2HPO4-柠檬酸缓冲液(pH 3.0~8.0)、甘氨酸-NaOH缓冲液(pH 8.6~10.6)。
1.2.9 纳米差示扫描量热(nano differential scanning calorimetry,Nano DSC)分析
采用纳米差示扫描量热法测定该酶的Tm值。每个分析样品的蛋白质质量浓度控制在1 mg/mL左右,在注入仪器之前,样品将脱气10 min。在操作过程中,样品以1 ℃/min的速率从35 ℃加热到95 ℃。通过数据分析软件Nano Analyze得到最终结果。
1.2.10 圆二色光谱(circular dichroism,CD)研究
在20 mmol/L的Tris-HCl缓冲液(pH 7.0)中,用分光光度计在室温下测定纯化漆酶的紫外-CD光谱[16]。在平台国家重点实验室采用紫外(190~250 nm)CD光谱法测定酶的二级结构[17],利用DichroWeb的SELCON3分析程序(http://dichroweb.cryst bbk.ac.uk/html/process.shtml)计算二级结构元素[18]。
2 结果与分析
2.1 突变体的构建和筛选
2.1.1 突变文库一:基于相互作用力的氨基酸突变以提高酶活力
利用软件Discovery Studio将ABTS对接至蛋白质3D结构模型(PDB ID:6DZD)中(图1),获得酶-底物复合体结构。定义距底物5 Å范围内的氨基酸残基组成催化口袋,包含11个位点:CYS A:189、ARG B:222、ILE B:216、LYS A:226、LYS B:217、GLU A:224、VAL A:245、GLU A:244、ASN A:240、GLU B:218、ARG A:230。将这11 种氨基酸分别进行单点突变,使用Discovery Studio的工具栏Macromolecules的Calculate Mutation Energy(Binding)模块计算催化口袋220个单点突变的突变能量,将计算结果按照突变能量由低到高排序,选择突变能量较低,实现在理论上能够稳定活性位点与酶相互作用的突变,如电子增强出版附件2所示,共包含了35个单点突变。
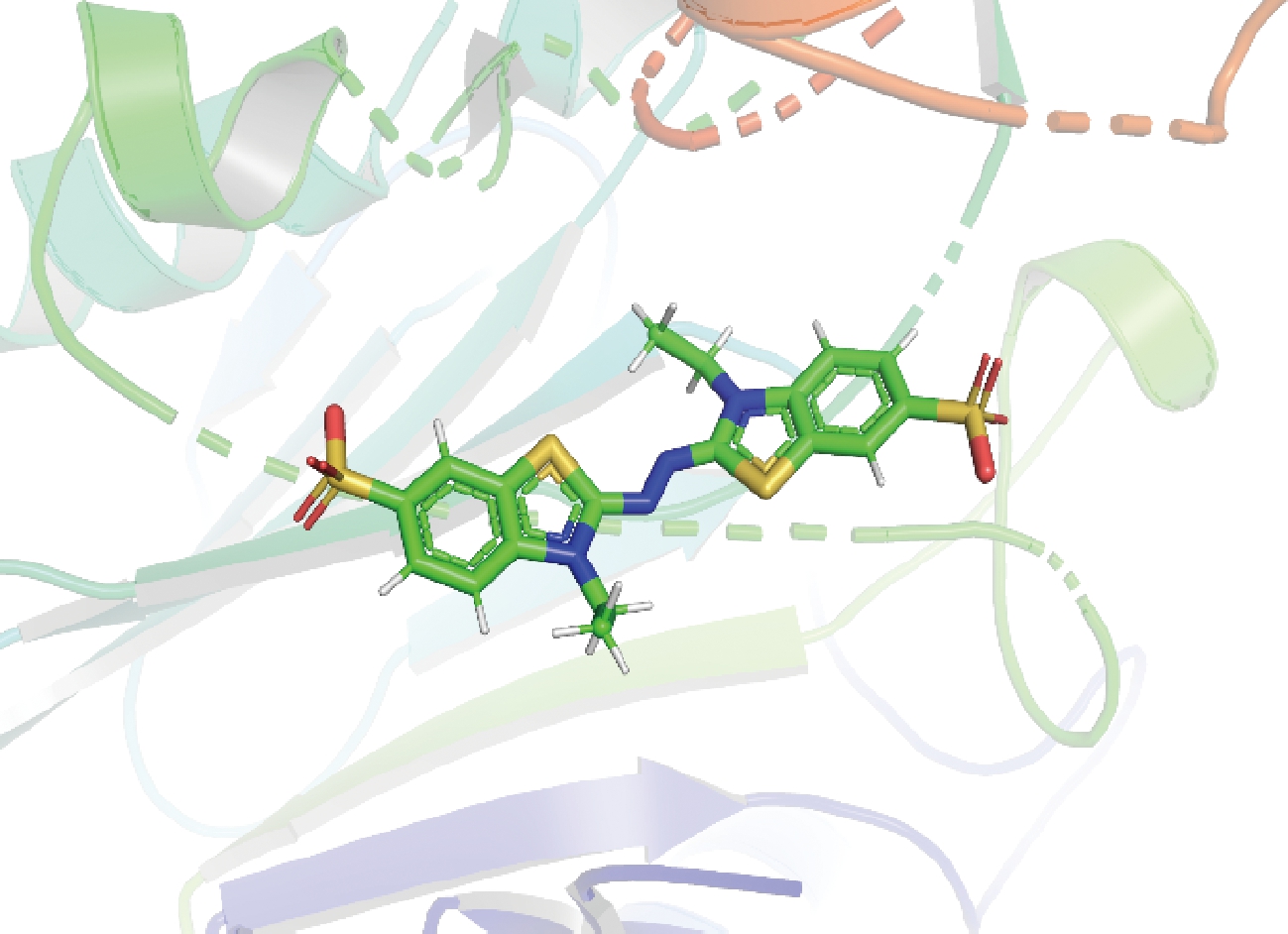
图1 底物ABTS与蛋白对接结果
Fig.1 Result of substrate ABTS docking with protein
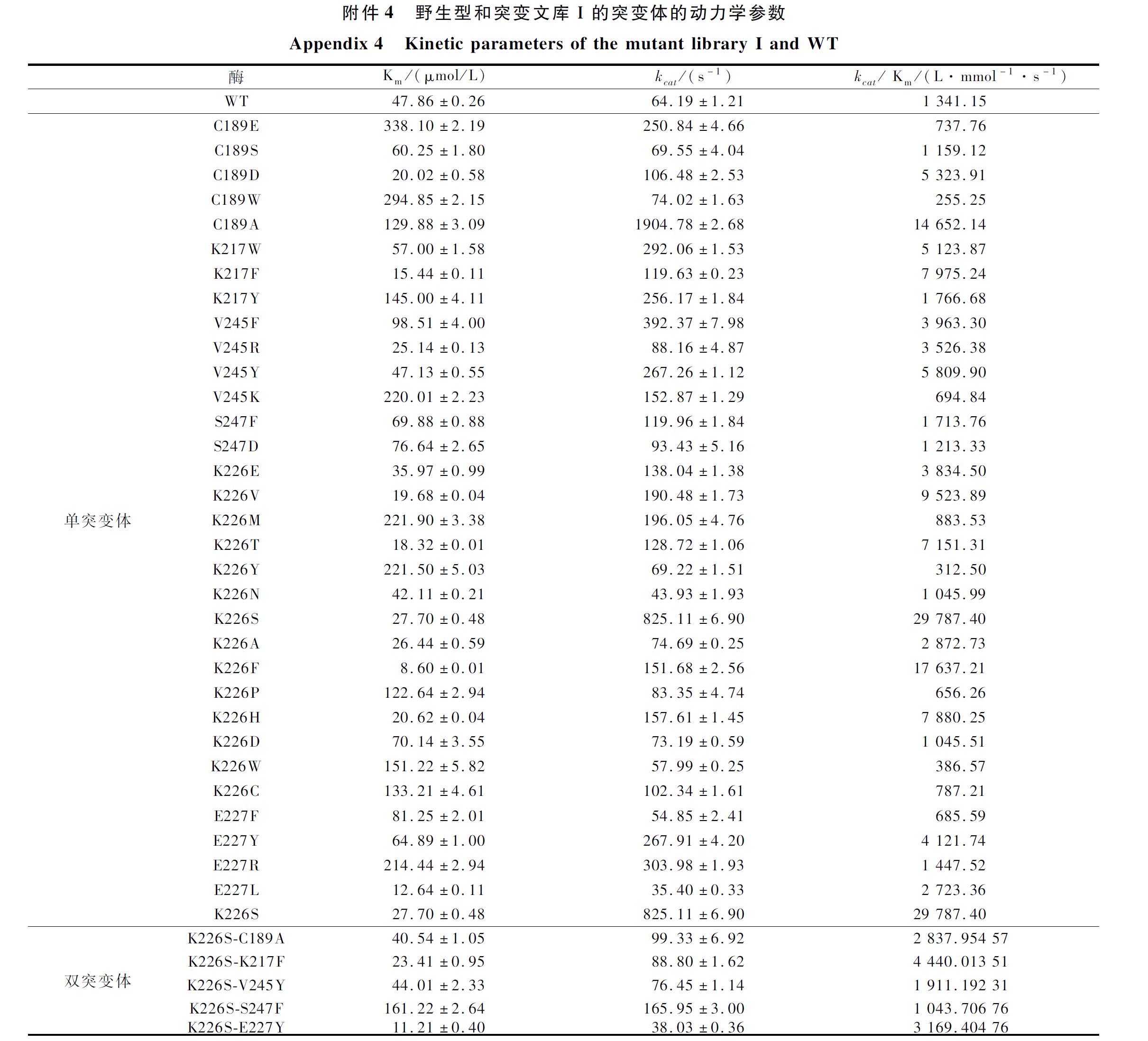
将这35个单点突变体构建并在枯草芽胞杆菌中诱导表达后,选择有效突变体测定其酶活力和动力学参数,结果如图2、电子增强出版附件3和附件4所示,发现其比酶活力与催化效率(kcat/Km)的变化基本一致。突变体C189A、K217F、V245Y、S247F、K226S、E227Y的催化效率(kcat/Km)分别达到野生型的10.9、5.9、4.3、1.3、22、3.1倍,分析研究数据可知,这几个突变体由于生成底物的速率都有明显的提升,因此催化效率都有所提高,而部分优秀突变体,如K226S在kcat值明显提高的同时,Km值显著下降,对底物的亲和能力也大大提升,所以其对底物的催化效率也相应提高。为了达到更好的改造效果,本文将催化效率最高的突变体K226S与其他5个突变体进行了组合突变,根据比酶活力(电子增强出版附件3)和动力学参数(图2和电子增强出版附件4)结果显示,组合突变均未达到K226S单点突变的改造效果,而组合双突变体中,除了K226S/S247F之外,Km值均低于野生型。而本突变文库针对结合能最低化的设计就是为了增强底物与酶之间的亲和力,因此该组合突变基本达到了突变目的。但是组合突变可能减缓了反应结束后产物的释放,从而导致kcat值下降,因此整体催化效率提升没有单突变那么显著。

a-Kcat值的热图分析;b-Km值的热图分析;c-kcat/Km值的热图分析
图2 野生型和突变文库Ⅰ的突变体的动力学参数的热图分析
Fig.2 Thermal analysis of kinetic parameters of the mutant library I and WT
同时,对该突变文库的单点突变体和双点突变体在40 ℃下测定了其半衰期,结果如图3所示,发现大部分突变体热稳定性有所下降或趋于同等水平,其中V245R、V245Y的热稳定性分别是野生型的1.8倍和1.4倍,为了得到热稳定性更高的突变体,本文构建了另一个突变文库进行后续实验。
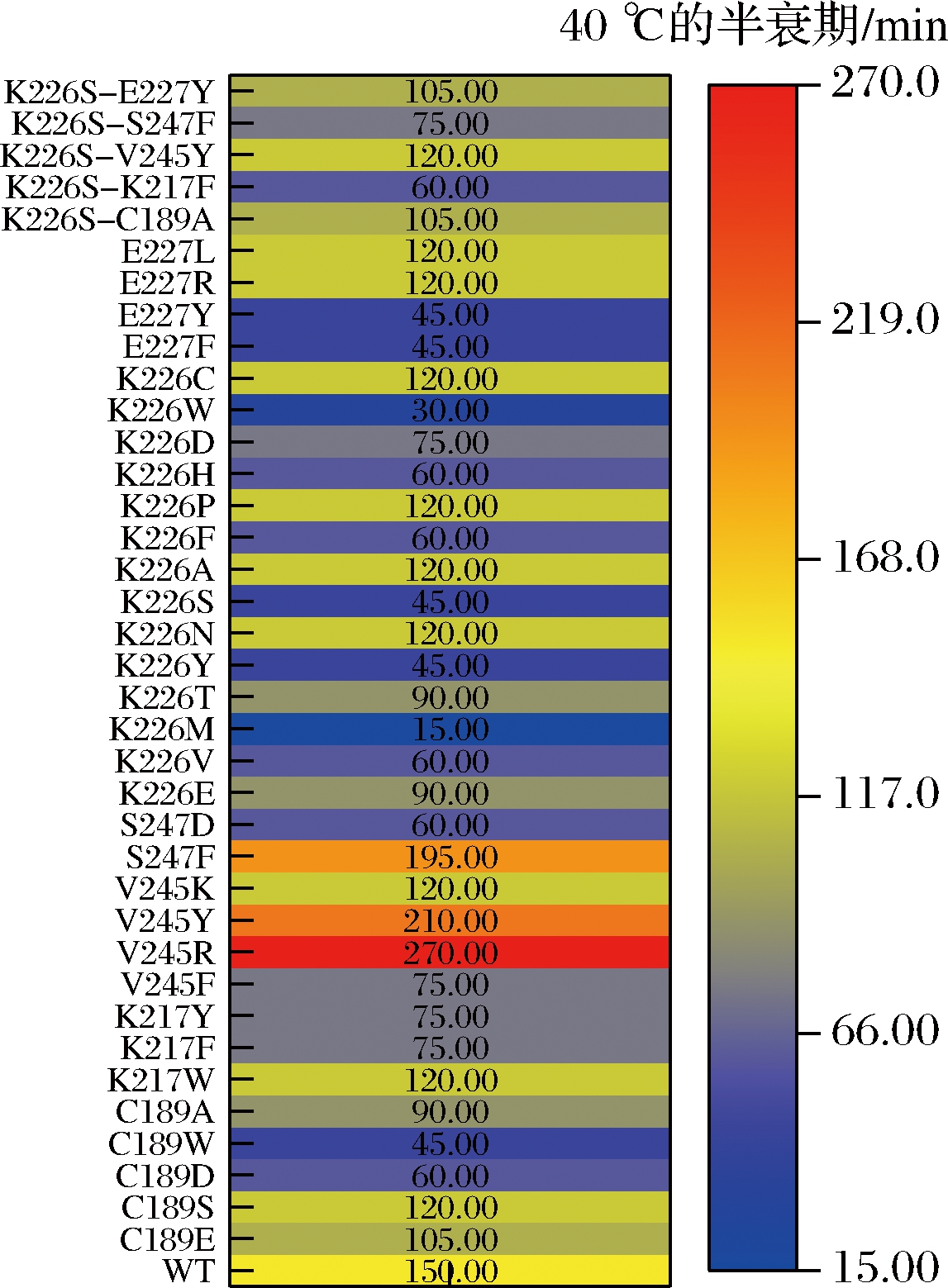
图3 野生型和突变文库Ⅰ的突变体在40 ℃下的半衰期
Fig.3 Half-life of the mutant library I and WT at 40 ℃
由于突变文库一中的突变体K226S、C189A和K217F对底物的催化效率有较为明显的提升,本文将选取这3种突变体进行后续实验。
2.1.2 突变文库二:预测突变形成二硫键以增强稳定性
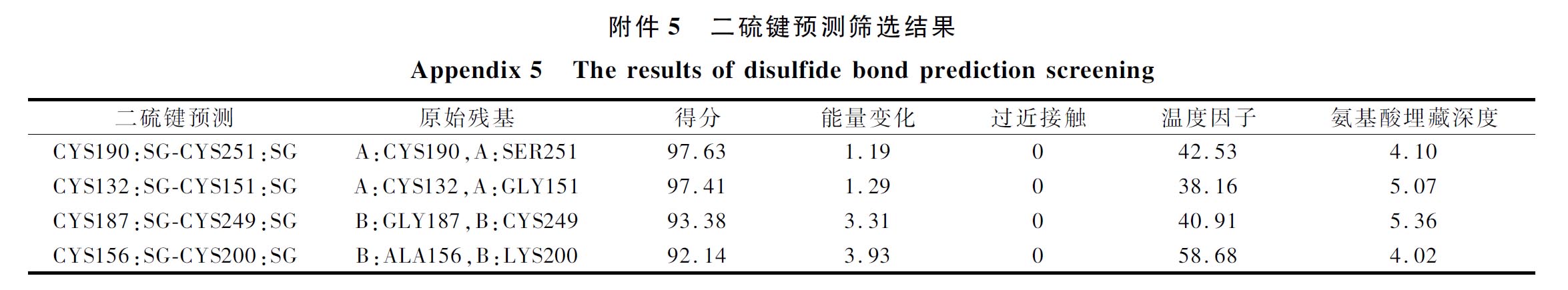
据报道,通过氨基酸突变形成二硫键,从而可以增强蛋白质的稳定性[19]。本文使用软件Discovery Studio对蛋白质3D结构模型(PDB ID:6DZD)预设21对二硫键,根据模拟结果和各项打分以及Pymol观察模拟后,最终确定了4对较为合理的二硫键预测,其结果和模拟结构如电子增强出版附件5所示。
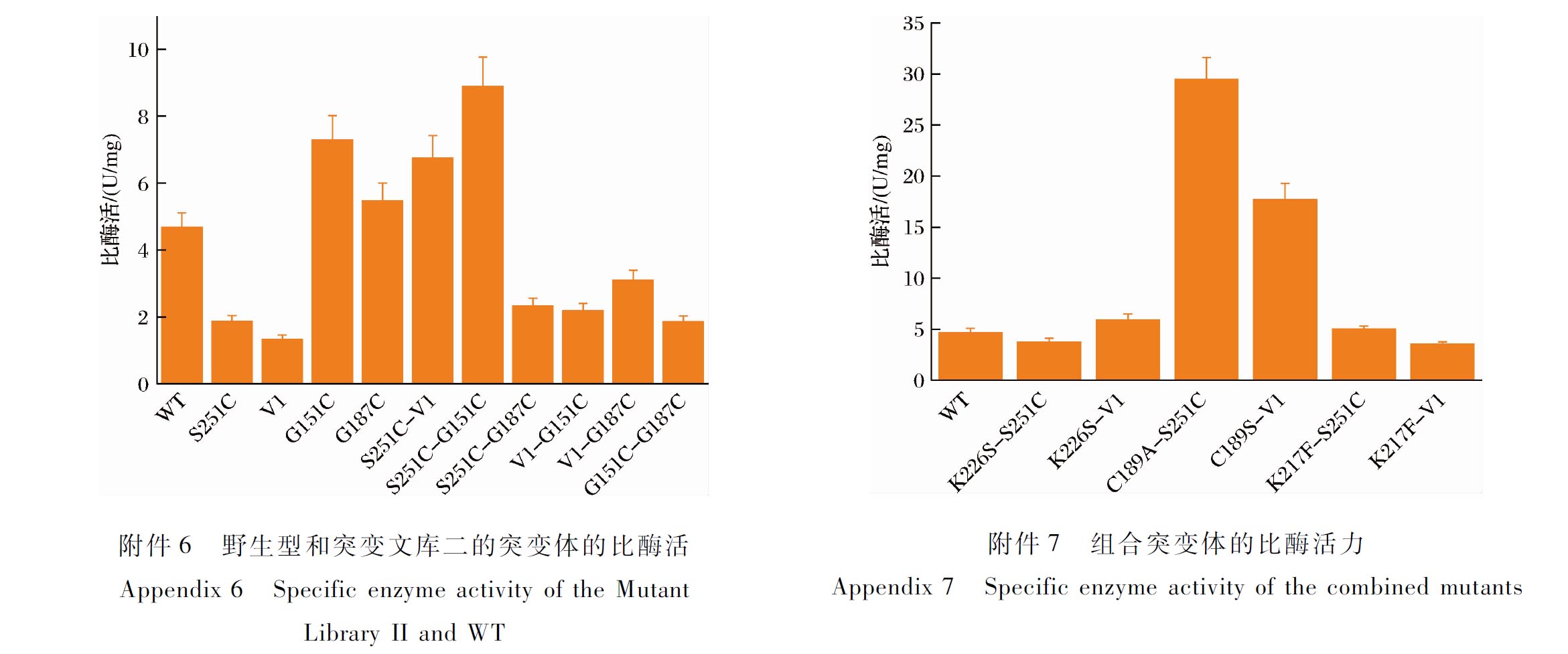
采用定点突变构建共计4个突变体:S251C、G151C、G187C、V1(A156C/K200C)。将野生型与这4个突变体表达纯化后,测定其比酶活力和动力学参数,结果如电子增强出版附件6和表1所示。研究结果表明,突变体的酶催化效率与野生型相比,大部分有所降低或者处于同样的水平,分析原因可能是二硫键的引入导致酶的柔性部分受阻,从而不能正常发挥催化活性。测定其在40 ℃下的半衰期,结果如图4所示,在热稳定性上,这4种突变体均具有较为明显的改造效果,S251C、G151C、G187C、V1在40 ℃下的半衰期分别是野生型的3.2、3.2、2.4、2倍,说明二硫键的引入对该酶的稳定性有较好的提升效果。接着将这4种突变体两两组合进行组合突变,以期得到更好的改造效果,共计6个突变体:S251C-V1、S251C-G151C、S251C-G187C、V1-G151C、V1-G187C、G151C-G187C。由电子增强出版附件6和表1可知,可能是由于原本突变体的酶活性不高,该组合突变对酶活性的改造亦没有明显效果。在40 ℃下的半衰期(图4)结果表明,组合突变体的热稳定性并没有原本突变体好,这可能是由于多对二硫键的引入会对蛋白质的整体结构造成影响,从而不利于结构的稳定性。因此,本文选取突变文库二中热稳定性较好的突变体S251C和V1进行后续实验。
表1 野生型和突变文库二的突变体的动力学参数
Table 1 Kinetic parameters of the mutant library Ⅱ and WT

酶Km/(μmol/L)kcat/skcat/Km/[L/(mmol·s)]WT47.86±1.39 64.19±0.021 341.15S251C17 220.45±12.979 172.74±12.11532.68G151C182.11±3.4568.22±0.49379.00G187C52.18±1.01104.49±0.312 089.71V147.11±1.3473.65±1.271 567.03S251C-G151C629.75±6.191 604.46±9.042 546.76S251C-G187C35 785.81±16.1023 902.41±22.44668.04S251C-V1320.01±4.66619.40±4.991 935.63V1-G151C51.58±2.3731.36±1.16627.14V1-G187C8 704.76±8.537 714.71±11.14886.75G151C-G187C63.02±2.5831.76±0.52529.35

图4 野生型和突变文库二的突变体在40 ℃的半衰期。
Fig.4 Half-life of the mutant library II and WT at 40 ℃
2.1.3 突变文库一与突变文库二的组合突变
基于2.1.1节和2.1.2节分别筛选出来的优质突变体,为了使该酶的活力和热稳定性同时提升,本研究选取突变文库一中的3种优异突变体K226S、C189A、K217F与突变文库二中的2种优异突变体S251C和V1进行组合突变,获得6种组合突变体:K226S-S251C、K226S-V1、C189A-S251C、C189A-V1、K217F-S251C、K217F-V1。同样,对组合突变体的比酶活力、动力学参数和在40 ℃下的半衰期进行测定,研究结果(电子增强出版附件7、表2和图5)显示,相对于野生型,组合突变体C189A-S251C在底物催化效率提高了5.3倍的同时,在40 ℃下的热稳定性也提高了1.2倍,展现出了较好的底物催化效率和比较高的热稳定性,因此,本文筛选出最优突变体C189A-S251C进行后续的实验。
表2 组合突变体的动力学参数
Table 2 Kinetic parameters of combined mutants

酶Km/(μmol/L)kcat/s-1kcat/Km/[L/(mmol·s)]WT47.86±2.0864.19±0.021 341.15K226S-S251C68.49±0.1473.00±0.481 073.57K226S-V1134.51±4.39220.26±0.821 694.31C189A-S251C47.65±0.24338.12±1.248 453.00C189A-V185.22±0.36404.97±2.165 062.17K217F-S251C73.39±0.13100.57±1.701 436.67K217F-V166.63±1.0971.57±1.531 022.38
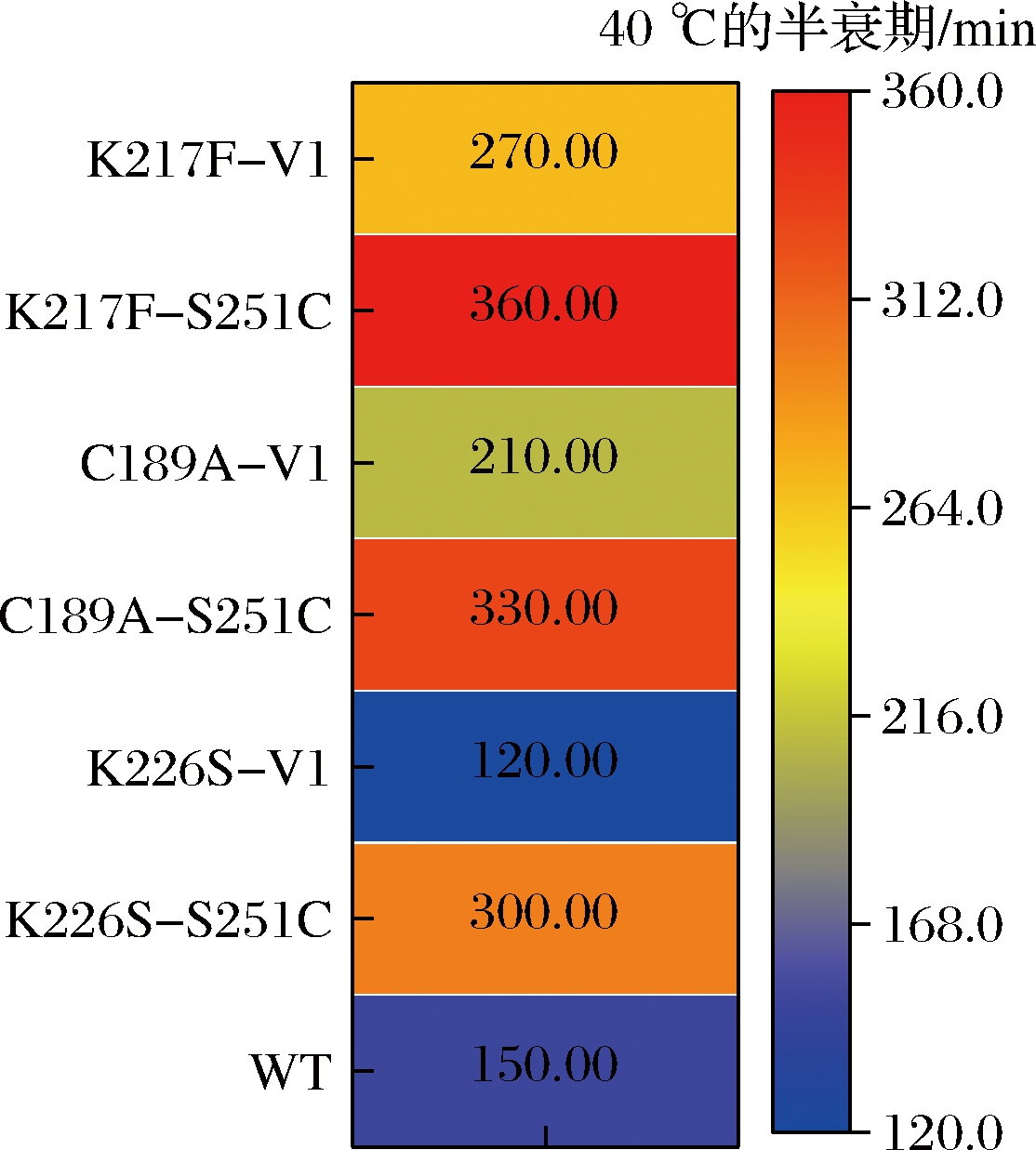
图5 组合突变体在40 ℃下的半衰期
Fig.5 Half-life of the combined mutants at 40 ℃
2.2 温度和pH对野生型和突变体的影响
2.2.1 野生型和突变体的最适温度和最适pH
首先,在20~80 ℃下测定野生型和突变体C189A-S251C的酶活力,如图6-a所示,在30~55 ℃,两者都检测到比较高的活性,而突变体C189A-S251C的最适温度为50 ℃,比野生型的最适温度37 ℃要高,且该突变体在80 ℃下仍能检测到55%左右的活性,分析由于该突变体内含的二硫键使其稳定性提高,使最适温度也相应提升。

a-最适温度;b-最适pH
图6 野生型和突变体C189A-S251C的最适温度和最适pH
Fig.6 Optimal temperature and pH for wild-type and its mutant C189A-S251C
然后,采用不同的pH缓冲液测定该酶在37 ℃下的最适pH。如图6-b所示,含有100 mmol/L柠檬酸的缓冲液pH为4.0~4.5,检测到较高的活性,并且野生型和突变体的酶活力均在pH值为4.5时最高。此结果表明,最适反应pH不受该突变的影响。
2.2.2 野生型和突变体的pH稳定性和温度稳定性
pH稳定性的结果表明,该酶在改造之后,在酸性溶液中的稳定性增强了(图7-a)。野生型在pH 6.5时稳定,而突变体C189A-S251C在pH 5.5时稳定。并且与野生型相比,突变体在pH 3.0下孵育2 h后保持了约52%的残余酶活力。

a-pH稳定性;b-30 ℃下温度稳定性;c-40 ℃下温度稳定性;d-50 ℃下温度稳定性
图7 野生型和突变体C189A-S251C的pH稳定性和温度稳定性
Fig.7 pH and temperature stability of wild-type and its mutant C189A-S251C
根据热稳定性研究(图7-b~图7-d),突变体C189A-S251C的温度稳定性要优于野生型,尤其在50 ℃下的野生型孵育40 min后,其剩余酶活力几乎为0,而突变体C189A-S251C的剩余酶活力在50%左右。
2.3 Nano DSC分析
如表3所示,原始酶的Tm值为54.23 ℃,而突变体C189A-S251C的Tm值为57.39 ℃,上升了约3 ℃,说明该突变体的热稳定性高于野生型。而焓变(ΔH)则反映了蛋白质分子的聚集程度和疏水性/亲水性,该突变体的焓变值要低于野生型,说明经过突变,该蛋白结构内部的疏水作用力减弱,使得分子的聚集程度降低。该结果与上述研究结果相对应,且为该突变体热稳定性的提高提供了理论依据。
表3 野生型和突变体C189A-S251C的Tm值
Table 3 Tm values of wild-type and its mutant C189A-S251C

酶水分活度Tm/℃ΔH/(kJ/mol)WT0.69754.23451.7C189A-S251C0.97657.39351.2
2.4 二级结构变化研究
利用CD技术分析了由突变引起的蛋白质二级结构的变化,该酶的二级结构中富含α-螺旋,β-折叠比较缺乏。突变体C189A-S251C导致了α-螺旋的下降和β-折叠的上升,β-转角和无规则卷曲的含量基本不变,分别保持在20%和30%左右的水平。本文推断,该二级结构的变化也是引起突变体酶活力上升和热稳定性提高的原因之一。结果如表4和图8所示。
表4 野生型和突变体的二级结构
Table 4 Secondary structures of wild-type and mutants
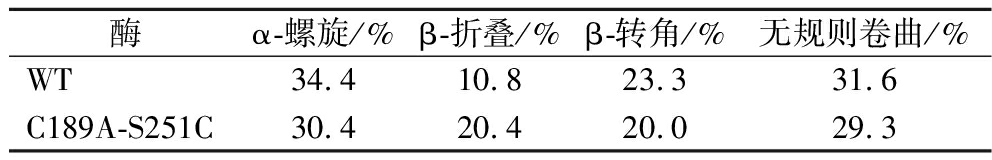
酶α-螺旋/%β-折叠/%β-转角/%无规则卷曲/%WT34.410.823.331.6C189A-S251C30.420.420.029.3
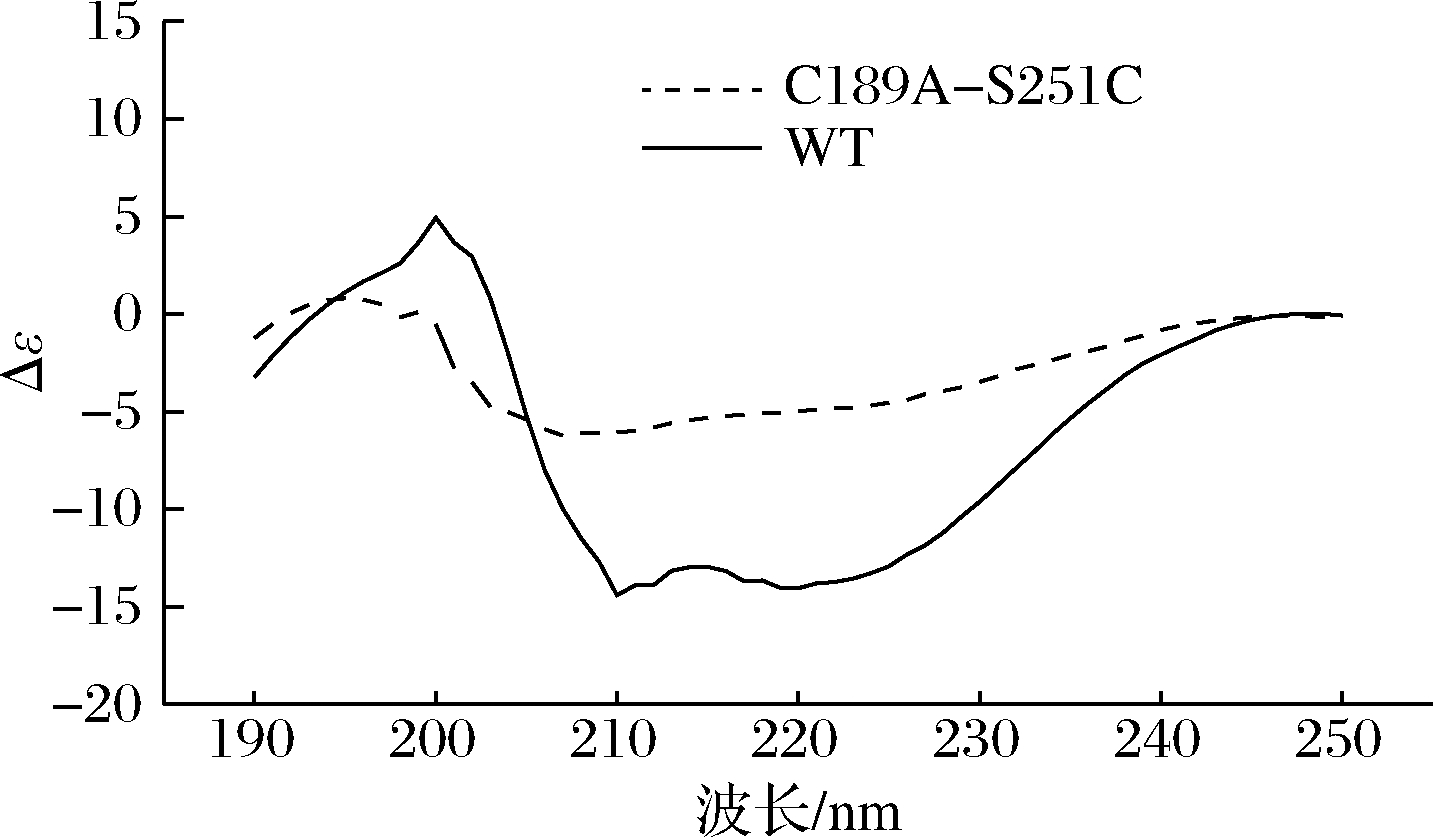
图8 WT和突变体C189A-S251C的CD光谱
Fig.8 CD spectra of WT and its mutant C189A-S215C
2.5 突变体的模拟结构分析
为了进一步探究突变体C189A-S251C催化活性和热稳定性提高的原因,本研究利用软件Pymol对野生型和突变体与底物ABTS对接后的三维结构进行分析。氢键在配体识别和结合中起着至关重要的作用[20],并且氢键网络的合理改变可能引起酶的构象变化,从而提高酶的活性或稳定性[21]。如图9所示,该突变改变了突变位点附近的氢键与配体的相互作用。一方面,与野生型相比,突变体C189A-S251C与底物ABTS形成的氢键相互作用减少,ARG B:222与底物ABTS相互作用的键长由1.76 Å变为2.04 Å,这些改变将增加酶的灵活性,使催化中心更容易接近底物[22]。另一方面,突变酶与底物之间形成了新的氢键,如CYS B:190与底物ABTS之间的氢键,距离为3.04 Å,这种必需残基与配体之间相对较短的距离可以提高酶的催化效率[23],使催化通道底部的位点和配体结合位点之间的相互作用更加积极,此外,新形成端的氢键可能有助于稳定酶[24]。

a-野生型与底物对接的相互作用力;b-突变体C189A-S251C与底物对接的相互作用力;c-野生型与底物对接的三维结构模拟;d-突变体C189A-S251C与底物对接的三维结构模拟
图9 野生型与突变体C189A-S215C的二维和三维结构模拟
Fig.9 Structural simulation of wild type and its mutant C189A-S215C
注:三维结构模拟中黄色棍棒结构代表底物,绿色虚线代表氢键,黄色虚线代表距离。
对于突变体C189A-S251C,二硫键的引入也可使其变得更加稳定。经过原子测距发现,突变之前,残基SER A:251与CYS A:190之间的距离为3.4 Å,突变之后CYS A:190与CYS A:190两个硫原子之间的距离为3.7 Å,空间距离适中,且由2.1.2节可知其他影响因素(如立体位阻、氨基酸埋藏深度等)都处于比较合理的数值,有利于二硫键的形成。因此,由较好的热稳定性的提升推测,二硫键得以成功引入。
综上所述,分子间相互作用的改变可能导致酶的内腔发生适当的变化,增强酶与底物的相互作用,从而提高结合效率和催化效率[25-27]。而二硫键的引入可以提高蛋白质结构的刚性,有利于酶热稳定性的提高。
3 结论
本实验通过结构模拟,针对突变能量的高低和二硫键预测分别构建了2个突变文库,并实现了突变文库之间的组合突变,一共对56种突变体进行了筛选,成功提升了该酶对底物ABTS的催化活性,同时较好地提高了该酶的热稳定性,证明了该实验策略的有效性和可靠性,为今后的突变改造策略提供了依据,避免了氨基酸突变选择的盲目性。
结果表明,最终突变体C189A-S251C对底物的催化效率可达到野生型的5.3倍,并且在40 ℃的半衰期较野生型提高了1.2倍,同时提高了该酶在酸性环境下的耐受力,最适温度和Tm值也有所上升,这一改造结果也为BlLac漆酶在生物技术和环境等领域的应用潜力提供了技术支持。



[1] SU J, FU J J, WANG Q, et al.Laccase:A green catalyst for the biosynthesis of poly-phenols[J].Critical Reviews in Biotechnology, 2018, 38(2):294-307.
[2] RAM REZ-MONTOYA L A, HERN
REZ-MONTOYA L A, HERN NDEZ-MONTOYA V, MONTES-MOR
NDEZ-MONTOYA V, MONTES-MOR N M A, et al.Correlation between mesopore volume of carbon supports and the immobilization of laccase from Trametes versicolor for the decolorization of Acid Orange 7[J].Journal of Environmental Management, 2015, 162:206-214.
N M A, et al.Correlation between mesopore volume of carbon supports and the immobilization of laccase from Trametes versicolor for the decolorization of Acid Orange 7[J].Journal of Environmental Management, 2015, 162:206-214.
[3] STRONG P J, CLAUS H.Laccase:A review of its past and its future in bioremediation[J].Critical Reviews in Environmental Science and Technology, 2011, 41(4):373-434.
[4] LLORET L, EIBES G, L -CHAU T A, et al.Laccase-catalyzed degradation of anti-inflammatories and estrogens[J].Biochemical Engineering Journal, 2010, 51(3):124-131.
-CHAU T A, et al.Laccase-catalyzed degradation of anti-inflammatories and estrogens[J].Biochemical Engineering Journal, 2010, 51(3):124-131.
[5] BARRIOS-ESTRADA C, DE JES S ROSTRO-ALANIS M, MU
S ROSTRO-ALANIS M, MU OZ-GUTIÉRREZ B D, et al.Emergent contaminants:Endocrine disruptors and their laccase-assisted degradation -A review[J].Science of the Total Environment, 2018, 612:1516-1531.
OZ-GUTIÉRREZ B D, et al.Emergent contaminants:Endocrine disruptors and their laccase-assisted degradation -A review[J].Science of the Total Environment, 2018, 612:1516-1531.
[6] MENDONÇA MACIEL M J, CASTRO E SILVA A, TELLES RIBEIRO H C.Industrial and biotechnological applications of ligninolytic enzymes of the basidiomycota:A review[J].Electronic Journal of Biotechnology, 2010, 13(6).
[7] LU C, CAO L, LIU R, et al.Effect of common metal ions on the rate of degradation of 4-nitrophenol by a laccase-Cu2+ synergistic system[J].Journal of Environmental Management, 2012, 113:1-6.
[8] ZEEB B, GIBIS M, FISCHER L, et al.Crosslinking of interfacial layers in multilayered oil-in-water emulsions using laccase:Characterization and pH-stability[J].Food Hydrocolloids, 2012, 27(1):126-136.
[9] CHEN Y, LUO Q, ZHOU W, et al.Improving the catalytic efficiency of Bacillus pumilus CotA-laccase by site-directed mutagenesis[J].Applied Microbiology and Biotechnology, 2017, 101(5):1935-1944.
[10] SANTIAGO G, DE SALAS F, LUCAS M F, et al.Computer-aided laccase engineering:Toward biological oxidation of arylamines[J].ACS Catalysis, 2016, 6(8):5415-5423.
[11] WANG F L, ZHANG D C, WU X F, et al.Biodegradation of anionic polyacrylamide mediated by laccase and amidase:Docking, virtual mutation based on affinity and DFT study[J].New Journal of Chemistry, 2021, 45(32):14554-14562.
[12] GARCIA K E, BABANOVA S, SCHEFFLER W, et al.Designed protein aggregates entrapping carbon nanotubes for bioelectrochemical oxygen reduction[J].Biotechnology and Bioengineering, 2016, 113(11):2321-2327.
[13] GAO Q Y, SHAO J, TANG M W, et al.Promote the expression and corrected folding of an extremely stable N-demethylase by promoter reconstruction, native environment simulation and surface design[J].International Journal of Biological Macromolecules, 2021, 178:434-443.
[14] XIN Y, SHEN C, TANG M W, et al.Recreating the natural evolutionary trend in key microdomains provides an effective strategy for engineering of a thermomicrobial N-demethylase[J].Journal of Biological Chemistry, 2022, 298(3):101656.
[15] CRAIG D B, DOMBKOWSKI A A.Disulfide by Design 2.0:A web-based tool for disulfide engineering in proteins[J].BMC Bioinformatics, 2013, 14:346.
[16] NASOOHI N, KHAJEH K, MOHAMMADIAN M, et al.Enhancement of catalysis and functional expression of a bacterial laccase by single amino acid replacement[J].International Journal of Biological Macromolecules, 2013, 60:56-61.
[17] PEREZ-IRATXETA C, ANDRADE-NAVARRO M A.K2D2:Estimation of protein secondary structure from circular dichroism spectra[J].BMC Structural Biology, 2008, 8:25.
[18] KUMAR S, JAIN K K, RANI S, et al.In-vitro refolding and characterization of recombinant laccase (CotA) from Bacillus pumilus MK001 and its potential for phenolics degradation[J].Molecular Biotechnology, 2016, 58(12):789-800.
[19] MODARRES H P, MOFRAD M R, SANATI-NEZHAD A.Protein thermostability engineering[J].RSC Advances, 2016, 6(116):115252-115270.
[20] KIM D, PARK B, JUNG B W, et al.Identification and molecular modeling of a family 5 endocellulase from Thermus caldophilus GK24, a cellulolytic strain of Thermus thermophilus[J].International Journal of Molecular Sciences, 2006, 7(12):571-589.
[21] CHOU K C.Low-frequency motions in protein molecules.Beta-sheet and beta-barrel[J].Biophysical Journal, 1985, 48(2):289-297.
[22] LIANG C N, FIORONI M, RODR GUEZ-ROPERO F, et al.Directed evolution of a thermophilic endoglucanase (Cel5A) into highly active Cel5A variants with an expanded temperature profile[J].Journal of Biotechnology, 2011, 154(1):46-53.
GUEZ-ROPERO F, et al.Directed evolution of a thermophilic endoglucanase (Cel5A) into highly active Cel5A variants with an expanded temperature profile[J].Journal of Biotechnology, 2011, 154(1):46-53.
[23] BASIT A, TAJWAR R, SADAF S, et al.Improvement in activity of cellulase Cel12A of Thermotoga neapolitana by error prone PCR[J].Journal of Biotechnology, 2019, 306:118-124.
[24] KHAIRUDIN N B, MAZLAN N S F.Molecular docking study of beta-glucosidase with cellobiose, cellotetraose and cellotetriose[J].Bioinformation, 2013, 9(16):813-817.
[25] WANG X, ZHANG L, FENG L.Removal efficiency of ibuprofen and determination of active sites in catalytic ozonation process by modified SCACs[J].Chinese Journal of Environmental Engineering, 2015, 9(2):621-626.
[26] LI L Z, LIU C J, QU M R, et al.Characteristics of a recombinant Lentinula edodes endoglucanase and its potential for application in silage of rape straw[J].International Journal of Biological Macromolecules, 2019, 139:49-56.
[27] YOAV S, STERN J, SALAMA-ALBER O, et al.Directed evolution of Clostridium thermocellum β-glucosidase A towards enhanced thermostability[J].International Journal of Molecular Sciences, 2019, 20(19):4701.