芝麻(Sesamum indicum L.)是我国主要的油料作物之一,芝麻籽除富含油脂、蛋白质等营养物质外,还含有木脂素、维生素E、甾醇等生理活性成分[1]。木脂素是一类由两分子苯丙素衍生物聚合而成,广泛分布于植物中的次级代谢产物,具有多种生理活性功能[2-3]。根据溶解特性,芝麻木脂素可分为脂溶性木脂素和水溶性木脂素,前者主要有芝麻素(sesamin)、芝麻林素(sesamolin)、芝麻素酚(sesaminol)、芝麻林素酚(sesamolinol)、松脂醇(sesamolinol)等,后者主要是数量(1~3)不等的葡萄糖糖基与芝麻素酚、芝麻林素酚或松脂醇苷元缩合形成的糖苷[4]。在芝麻油提取过程中,脂溶性木脂素溶入油脂中,水溶性木脂素则留存于芝麻粕中。
芝麻粕是芝麻籽提取油脂后的副产物,其蛋白质含量高(>45%),且含有单糖、多糖、粗脂肪和矿物质元素等营养元素,以及木脂素等生理活性物质[5-6]。目前,芝麻粕主要用于生产饲料,导致其价值未得到充分开发和利用。芝麻素酚葡萄糖苷(sesaminol glucosides, SGs)是主要的水溶性芝麻木脂素,具有多种重要的生理活性功能,广泛应用于医药、食品和化妆品领域,极具应用和开发价值[7-8]。由于SGs主要残留于芝麻粕中,因此芝麻粕提取是一种十分经济有效、极具应用发展前景的SGs生产方式。随着现代分析仪器和分离技术的迅速发展,SGs生理功能和药理机制研究不断深入,分离纯化成本大大下降,这也为SGs及相关产品的开发和应用创造了良好的条件。本文聚焦于SGs生理功能的最新研究进展,从抗氧化、抗炎、抗肿瘤、抗新冠病毒、心血管保护、预防肥胖、神经保护和抗皮肤衰老8个方面进行了分析、归纳和总结,并对未来发展前景和研究发展方向进行了展望,以期促进芝麻资源综合开发利用,提升产业经济效益,并为SGs相关研究提供参考和借鉴。
1 芝麻素酚葡萄糖苷的化学结构
SGs是芝麻素酚苷元与1~3个葡萄糖糖基缩合形成的糖苷类化合物,其化学结构如图1所示。FUKUDA等[9]以β-半乳糖苷酶处理芝麻粕,随后以体积分数80%的乙醇萃取,在极性萃取部位鉴定出芝麻素酚,证实芝麻粕中存在SGs。KATSUZAKI等[10]以体积分数85%的乙醇从芝麻籽中提取抗氧化活性物质,在提取物中鉴定出3种SGs,即芝麻素酚单葡萄糖苷(sesaminol monoglucoside, SMG)、芝麻素酚二葡萄糖苷(sesaminol diglucoside, SDG)和芝麻素酚三葡萄糖苷(sesaminol triglucoside, STG)。后来,MOAZZAMI等[11]发现SDG的2个葡萄糖残基之间具有β1→2和β1→6两种连接糖苷键,因此SDG具有2种同分异构体(图1)。
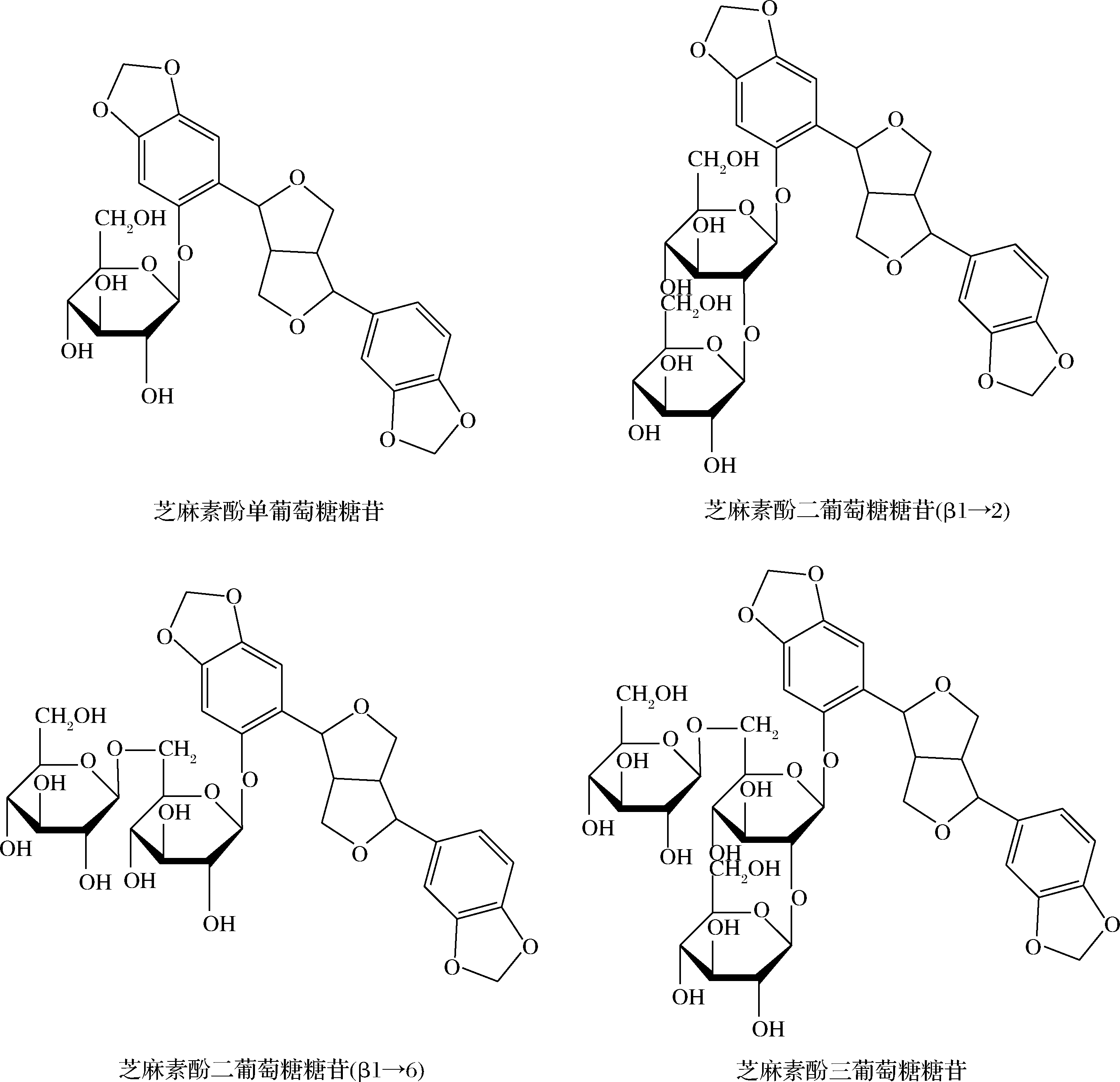
图1 芝麻素酚葡萄糖苷的化学结构
Fig.1 Chemical structure of sesaminol glucosides
2 芝麻素酚葡萄糖苷的制备和分离纯化
2.1 芝麻素酚葡萄糖苷的制备
芝麻粕提取是目前最主要的SGs制备方式。芝麻粕提取SGs,不仅有利于促进芝麻资源的综合利用,还可提升芝麻的经济附加值。蒸馏水、甲醇和乙醇是常用的SGs提取溶剂,采用磁力搅拌、超声波、回流提取、亚临界萃取等辅助手段,通过统计学方法优化提取工艺,可有效地提升SGs的提取效率。SUJA等[12]采用索氏提取法从芝麻粕中提取SGs,通过优选提取溶剂,发现甲醇提取效率最高,达到6.817 mg/g芝麻粕。SHYU等[13]在甲醇体积分数80%、料液比1∶10(g∶mL)、提取时间24 h、室温条件下提取SGs,STG和SDG得率分别达到(2.21±0.10) mg/g芝麻粕和(0.11±0.02) mg/g芝麻粕。彭珍等[14]通过单因素法优化提取工艺条件,在乙醇体积分数75%,料液比1∶20(g∶mL),提取时间10 h,提取温度25 ℃,提取次数2次的最优条件下,STG得率达到19.4%。汪学德[15]构建了一个动力学模型指导STG亚临界萃取,在料液比1∶40(g∶mL)、亚临界水流速5 L/h、压力5 MPa、提取温度120 ℃、提取时间15 min条件下,STG得率达到1.45 mg/g芝麻粕。EOM等[16]采用响应面法优化了超声波辅助提取芝麻粕SGs的中试工艺条件,并在此基础上设计了芝麻粕处理能力2.1 t/批次的工业生产线,SDG得率可达4.6 mg/g芝麻粕。
此外,对芝麻粕进行微生物发酵前处理,或采用新型膜分离技术,可提高SGs得率。OHTSUKI等[17]以芝麻粕中分离的1株环状芽胞杆菌(Bacillus circulans)YUS-2发酵芝麻粕,发现发酵可提高芝麻粕的SGs含量,进而提高SGs的提取得率。DAS等[18]研究发现,利用超滤和纳滤膜分离技术亦可提高芝麻粕的SGs提取得率。
2.2 芝麻素酚葡萄糖苷的分离纯化
目前,柱层析和制备色谱是最主要的SGs纯化方法[17, 19]。彭珍等[14]等通过聚酰胺柱层析对STG粗提物进行纯化,首先以蒸馏水溶解STG粗提物,随后上样,以40倍柱体积蒸馏水、1.2 mL/min的流速进行洗脱,获得的STG纯度达86.53%。OHTSUKI等[17]以体积分数80%的甲醇为提取溶剂,从B.circulans YUS-2发酵的芝麻粕中提取SGs,随后通过Amberlite XAD-2大孔树脂柱层析分离,最后通过Capcell Pak C18 UG120制备型高效液相色谱柱纯化,获得的SDG和STG纯度分别达到95.8%和92.7%。ZHU等[19]以体积分数为80%的甲醇为提取溶剂从芝麻粕中提取STG,通过减压浓缩和冷冻干燥获得STG粗提物,随后以聚酰胺柱层析初步分离纯化,再通过Toyopearl HW-40S凝胶柱层析进一步纯化,获得的STG纯度高达98.86%,得率为6.153 mg/g芝麻粕,回收率达73.16%。李丹丹[20]将STG粗提物溶于去离子水,过滤后上样于XAD-2大孔树脂层析柱,以体积分数0%、20%、40%、60%、80%和100%的甲醇洗脱,HPLC监测发现STG主要集中于80%甲醇洗脱液中,将其减压浓缩后通过AKTA纯化系统纯化,最终获得的STG纯度高达99%。
柱层析虽能以较低的能耗获取较高纯度的产品,但分离工艺复杂、耗费时间长,提取溶剂需求量大且难以回收,因而工业化生产难度较大。制备色谱虽然分离效率高、适用性广、灵敏度高,并且操作简单,易于实现自动化操作,可以获得纯度很高的产品,但需要专业的生产设备,且有机溶剂消耗量大,因而成本较高,目前多用于实验室研究,尚未应用于大规模工业化生产。因此,简化柱层析分离工艺,缩短分离时间,提高溶剂利用效率,以及开发成本低廉、简单快速的制备色谱,将是未来SGs工业化生产的发展方向。
3 芝麻素酚葡萄糖苷的生理功能
氧化应激是指机体在风险因子刺激或病理条件下,胞内氧化物的产生与抗氧化作用失衡,即过量的活性氧自由基(reactive oxygen species, ROS)无法得到及时有效的清除,从而导致机体损伤[21]。ROS是机体的正常代谢产物,它可清除体内的有害微生物,介导机体免疫,作为第二信使参与信号转导,维持机体正常生理功能等。但是,过高水平的ROS将导致机体代谢异常,进而引发疾病,其致病机制主要有2种:一是通过氧化作用,破坏膜脂、酶、结构蛋白和DNA/RNA等生物大分子,影响细胞功能,甚至导致细胞死亡;二是导致信号传导发生异常,如胞内H2O2浓度达到一定水平时,其第二信使功能即失效,从而导致细胞生理功能受损[21-22]。
ROS可诱导上调机体促炎因子转录水平,促进炎症发生[23];诱发DNA突变,导致肿瘤发生,同时还可促进肿瘤细胞活化、转化和组织浸润转移[24]。ROS参与血管细胞迁移和增殖相关的多条信号通路的传导,可促进动脉内壁斑块形成,引发和加速动脉粥样硬化进程,诱发心血管疾病[22]。此外,ROS还可激活脑组织细胞促分裂素原活化蛋白激酶(mitogen-activated protein kinases, MAPK)信号通路,诱导神经细胞凋亡[25]。通过破坏皮肤外周质的胶原蛋白和透明质酸,ROS可导致皮肤衰老[26]。SGs具有很强的抗氧化活性和自由基清除能力,这也是其抗炎、抗肿瘤、抗新冠病毒、心血管保护、预防肥胖、保护神经系统、抗皮肤衰老等其他生理活性功能的来源和基础。
3.1 抗氧化
SGs具有很强的自由基清除能力,在多种体外培养细胞模型以及体内动物模型实验中展现了优良的抗氧化活性[27]。研究发现,STG的自由基清除能力强于SDG[28]。此外,SDG的2,2-联苯基-1-苦基肼基(2,2-diphenyl-1-picrylhydrazylhydrate, DPPH)自由基清除能力随浓度提高而增强,高浓度SGs的DPPH自由基清除能力与合成抗氧化剂,如2,6-二叔丁基对甲酚(butylated hydroxytoluene, BHT)和叔丁基对苯二酚(tert-butylhydroquinone, TBHQ),以及天然抗氧化剂维生素C、生育酚相近[18, 26]。
细胞内的抗氧化酶,如超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)、谷胱甘肽过氧化酶(glutathione peroxidase, GSH-Px)等表达或活性受到抑制,或者氧化应激因子,如乳酸脱氢酶LDH水平升高,标志着胞内ROS水平上升,将导致细胞氧化应激损伤[29]。β-淀粉样蛋白(β-amyloid, Aβ)是导致阿尔茨海默症的主要诱因,在脑组织细胞中可促进自由基形成,提高细胞ROS水平,引发酶蛋白和膜脂氧化,触发炎症级联反应,并最终诱导脑组织神经细胞凋亡[30]。Aβ的25-35区域肽段(Aβ25-35)是其诱导氧化应激和细胞凋亡的活性功能区域[31]。在Aβ25-35处理的PC12大鼠嗜铬细胞瘤细胞和SK-N-SH人神经母细胞瘤细胞中,SGs可通过抑制ROS水平上升和降低DNA氧化作用,保护细胞免受氧化应激损伤[25, 32]。UM等[25]还发现,SGs可将Aβ25-35处理的SK-N-SH神经母细胞瘤细胞CAT活力和GSH恢复至正常水平。KANG等[33]发现,以SGs含量为1%的脱脂芝麻粉喂饲家兔,可抑制脂质过氧化作用,并降低其氧化应激敏感性。UM等[34]研究发现,在SAMP8阿尔茨海默症模型小鼠中,SGs可抑制脑组织细胞脂质的过氧化作用,并可缓解氧化应激压力,改善认知缺陷。此外,肠道菌群可水解SGs生成抗氧化活性更强的产物芝麻素酚,后者可穿过淋巴系统,进入肝脏,并转运至肺、心脏、肾脏和脑等其他组织,发挥抗氧化活性功能[33,35-36]。
3.2 抗炎
炎症是机体应对病原体感染和损伤的一种防御机制,它通过炎症应答信号通路及相关代谢途径对受损组织或器官进行修复和再生,但严重的急性炎症或长期炎症可导致病变、器官衰竭、慢性炎症性疾病,自身免疫,缺陷甚至死亡,因此控制炎症对于维持机体稳态具有重要的作用[37]。
研究证实,SGs及其体内代谢产物具有良好的抗炎活性[38-39]。核因子κB(nuclear factor-κB,NF-κB)信号通路除参与细胞凋亡外,还参与炎症应答[40]。NF-κB信号通路激活后可诱导表达促炎因子,如肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)、白细胞介素6(interleukin 6, IL-6)、白细胞介素1β(interleukin 1β, IL-1β),引发机体炎症[40]。正常状态下,NF-κB与专一性的NF-κB阻遏蛋白(nuclear factor-κB inhibitor, IκB)结合,不具备活性;但是,若IκB被磷酸化或泛素化修饰,或被降解,NF-κB信号通路将被激活[41]。在脂多糖(lipopolysaccharide, LPS)诱导的炎症星形胶质细胞中,SGs可通过抑制IκB的磷酸化和降解,以及NF-κB的p50转位,抑制NF-κB信号通路,从而产生抗炎作用,如抑制LPS诱导的一氧化氮和ROS的生成,下调细胞质磷脂酶A2、环氧合酶2和诱导型一氧化氮合酶表达[38-39]。此外,人体内的肠道菌群可将STG分解形成芝麻素酚,后者可下调促炎因子TNF-α和IL-6表达,从而达到抗炎效果[39]。
3.3 抗肿瘤
肿瘤是人体正常细胞发生基因突变,导致细胞癌化,恶性增殖,是一种严重威胁人类健康的疾病,外部环境因素和机体内在因素均可导致肿瘤发生。肿瘤细胞具有10个基本特征,即生长信号自给自足;对生长抑制信号不敏感;逃避细胞凋亡;具有无限的复制潜力;持续生成新生血管;组织浸润和转移;逃避免疫破坏;能量代谢重编程;基因组不稳定和易突变以及促进肿瘤炎症[42]。这是由于细胞基因突变,导致相关信号通路和代谢调控发生改变,从而引发细胞生理病变,表型发生变化。这不仅是其区别于正常细胞的关键特征,也是肿瘤治疗的靶点。
SGs及其体内代谢物可作用于多个信号通路,具有良好的抗肿瘤活性功能。体外实验研究结果显示,SGs可有效抑制MDA-MB-231和MCF7乳腺癌细胞、SK-MEL-28黑色素瘤细胞、A549肺癌细胞、RKO结直肠癌细胞生长[43]。SHENG等[44]研究发现,在氧化偶氮甲烷(azoxymethane, AOM)诱导的结肠癌小鼠模型中,日常喂食SGs可抑制结肠癌前病变。
人体肠道菌群可代谢STG形成多种产物,JAN等[45]将STG与人粪便肠道菌群进行厌氧共培养,通过HPLC、质谱和核磁共振鉴定到8个STG代谢物,芝麻素酚是最主要的代谢产物,此外还包括肠二醇(enterodiol, END)和肠内酯(enterolactone, ENL)2种哺乳动物木脂素。体外实验结果显示,END和ENL均可显著抑制ES-2卵巢癌细胞增殖、浸润和扩散转移;小鼠体内实验结果显示,ENL的抗卵巢癌活性高于END,并且副作用更小[46]。此外,ENL可通过阻断胞外信号激酶(extracellular signal regulated kinases, ERK)/NF-κB/上皮-间质转化诱导转录因子(epithelial-mesenchymal transition inducible transcription factor, Snail)信号通路,抑制转化生长因子-β诱导的上皮间质转化作用,从而抑制MDA-MB-231乳腺癌细胞的转移[47]。END可通过调控MAPK信号通路抑制CT26结直肠癌细胞的生长,并可诱导细胞凋亡[48]。
腺嘌呤核苷酸转位酶2(adenine nucleotide translocase-2, ANTA2)与肿瘤细胞的能量代谢、增殖和细胞凋亡密切相关,抑制ANTA2可有效抑制肿瘤细胞生长,因此ANTA2也是一个潜在的肿瘤治疗靶点[49]。细胞周期蛋白D1(cyclin D1)是细胞G1/S期转换的关键调节因子。正常生理状态下,cyclin D1在细胞进入S期后迅速分解,若cyclin D1持续高表达,将使细胞G1期缩短,提前进入S期,导致细胞增殖失控,形成肿瘤细胞[50]。cyclin D1的转录受NF-κB信号通路调控,而哺乳动物雷帕霉素靶蛋白复合体1(mammalian target of rapamycin complex 1, mTORC1)信号通路可促进cyclin D1翻译和蛋白稳定,ANTA2可以特异性激活NF-κB和mTORC1信号通路[51]。WATANABE等[43]研究发现,芝麻素酚可与ANTA2特异性结合,抑制NF-κB和mTORC1信号通路,从而抑制cyclin D1的转录和翻译,达到抗肿瘤的效果。
3.4 抗新冠病毒
新冠肺炎是一种由新型冠状病毒SARS-CoV-2引发的严重急性呼吸道综合症,传播性极强,危害人体健康,严重影响人类生产生活。研究显示,刺突蛋白对SARS-CoV-2侵染宿主有着重要作用,而木瓜蛋白酶样蛋白酶(papain-like protease, PLpro)和3-胰凝乳蛋白酶样蛋白酶(3-chymotrypsin-like protease, 3CLpro)则是病毒复制的关键因子,也是新冠肺炎治疗和相关药物开发的作用靶点[52-53]。分子对接常用于研究小分子化合物与蛋白质的相互作用,也是靶向药物筛选的常用工具。分子对接模拟结果显示,SMG可与SARS-CoV-2刺突蛋白、PLpro和3CLpro紧密结合,从而抑制SARS-CoV-2对宿主的侵染和病毒复制[54]。因此,SMG可作为潜在的新冠病毒抑制剂,进一步进行研究和开发。
3.5 预防肥胖
肥胖是动脉粥样硬化、冠心病,甚至癌症等多种疾病的重要诱因[55]。哺乳动物中存在2种脂肪存在形式,即白色脂肪组织(white adipose tissue, WAT)和棕色脂肪组织(brown adipose tissue, BAT)。WAT主要为三脂酰甘油形式储存的脂粒,BAT则富含线粒体。β3肾上腺素能受体(β3-adrenergic receptor, β3-AR)可激活BAT,上调线粒体解耦联蛋白1(uncoupling protein 1, UCP1)基因表达水平,调控一系列基因表达,促进脂肪分解,并通过非偶联呼吸作用将多余的能量以热量形式释放[56]。UCP1是调控产热过程的关键因子,受BAT特异性转录因子PR结构域蛋白16(PR domain-containing 16, Prdm16)调控[57-59]。因此,BAT也被视为肥胖及其相关代谢性疾病的潜在治疗靶点。JAHAGIRDAR等[60]研究发现,体外使用SDG处理BAT可上调UCP1表达水平;在高脂饮食喂养的小鼠饲料中添加SDG,可降低腹股沟和附睾的WAT质量,降低血清中的葡萄糖水平,并使脂肪粒变小,从而抑制体重增长;免疫印迹结果显示,喂饲了SDG的小鼠UCP1水平明显升高,这说明SDG可通过UCP1作用激活BAT,增加能量消耗,从而抑制肥胖。随后的分子对接结果显示,SDG可嵌入至β3-AR的活性口袋中,激活β3-AR,从而上调UCP1表达水平,达到抑制肥胖的目的。
3.6 心血管保护
心血管疾病主要包括高血压,冠心病,先天性、扩张性和肺源性心脏病,风湿性心房颤动,心力衰竭,心律失常和脑卒中等。动脉粥样硬化是动脉中脂质和纤维积累导致的一种慢性疾病,并伴随着促炎因子水平上升、脂代谢异常等不良反应,也是引发多种心血管疾病的主要诱因[61]。因此,减缓和控制动脉粥样硬化对于保护心血管和预防心血管疾病发生具有重要的作用。
高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)是重要的心血管疾病筛查标志物,与动脉粥样硬化性心血管疾病呈负相关[62]。KANG等[33]以SGs含量为1%的脱脂芝麻粉喂养家兔,90 d后检测发现芝麻粉喂饲组HDL-C显著高于对照组,说明SGs可有效预防动脉粥样硬化,保护心血管。
在动脉粥样硬化起始和发展进程中,细胞黏附分子发挥着重要的作用。STG在肝脏中可代谢生成芝麻素酚-6-儿茶酚[63],后者可通过抑制NF-κB信号通路激活抑制细胞黏附分子内皮-白细胞黏附分子1(cell adhesion molecules endothelial-leukocyte adhesion molecule1)、细胞内黏附分子1(intracellular adhesion molecule 1)和血管细胞黏附分子1(vascular cell adhesion molecule 1)基因的表达,从而阻止动脉粥样硬化进程[64]。
3.7 神经保护
NF-κB信号通路与细胞凋亡密切相关。胞内过量的ROS可激活MAPK信号通路,后者可激活NF-κB信号通路,诱导细胞凋亡[21]。此外,促凋亡因子p53、Bax、caspase-3、caspase-9和抗凋亡因子Bcl-2在细胞的凋亡中亦有着重要作用[65]。同时,胞内钙浓度水平过高也会诱导细胞凋亡。
SGs可通过抑制神经细胞凋亡的方式保护神经系统。阿尔茨海默症又名老年痴呆,是一种老年神经系统退行性疾病。Aβ是引发阿尔茨海默症的主要因素,25-35区域肽段(Aβ25-35)是Aβ的活性功能区域,可诱导细胞产生ROS和提高胞内钙水平,进而诱导脑组织神经细胞凋亡[31-32, 66]。神经细胞模型——PC12大鼠嗜铬细胞瘤细胞和SK-N-SH人神经母细胞瘤细胞体外实验结果显示,SGs可有效地抑制Aβ25-35诱导的ROS形成、8-羟基-2-脱氧鸟苷的产生、DNA的氧化以及胞内钙浓度水平的升高,从而抑制细胞凋亡,并且这种抑制效果与浓度正相关,说明SGs具有良好的神经保护作用[25, 32]。SGs抑制细胞凋亡的机制是通过抑制IκB的磷酸化和p50转位抑制NF-κB信号通路,下调促凋亡因子p53、Bax、caspase-3和caspase9的表达水平,以及上调抗凋亡因子Bcl-2的表达水平[25, 32]。注射Aβ25-35可诱导小鼠认知缺陷,被动回避和Morris水迷宫试验结果显示,喂饲SGs对Aβ25-35诱导的认知缺陷有明显的保护作用;并且喂饲SGs可显著抑制Aβ25-35导致的海马CA1和CA3区神经元损失[67]。
3.8 抗皮肤衰老
胶原蛋白是由3条多肽链形成的三螺旋结构,是皮肤细胞外基质的主要组成部分,占真皮层比重的80%以上,在皮肤中可形成致密的纤维蛋白网状结构,牢牢地锁住水分,保持皮肤弹性,维持皮肤紧致[68]。透明质酸是一种广泛分布于皮肤细胞外基质的非硫酸化糖胺聚糖,在较低的浓度下亦可相互作用形成三维网状结构,可通过氢键与水分子结合将其固定于透明质酸网状结构中,防止流失,对于维持皮肤湿润和关泽具有重要作用[69]。ROS是导致皮肤衰老的主要因素,它可以破坏皮肤细胞外基质,抑制胶原蛋白和透明质酸的合成,诱导激活胶原蛋白酶和透明质酸酶,促进胶原蛋白和透明质酸降解[70]。因此,抑制透明质酸酶和胶原蛋白酶活性,减少胶原蛋白和透明质酸分解,可有效延缓皮肤衰老。NANTARAT等[26]发现,SDG可有效抑制胶原蛋白和透明质酸降解,其对胶原蛋白酶和透明质酸酶的半抑制浓度分别为0.26和0.70 mg/mL,质量浓度为1.0 mg/mL的SDG对透明质酸酶的48 h抑制率高达92.6%,说明SDG可有效地抑制皮肤衰老。
4 结语
SGs是一种重要的水溶性木脂素,在食品、化妆品和医药领域有着广泛的应用,具有广阔的市场前景。研究显示,SGs具有抗氧化、抗炎、抗肿瘤、抗新冠病毒、心血管保护、预防肥胖、保护神经系统和抗皮肤衰老等多种生理活性功能。但是,现有SGs许多生理功能研究还停留在动物模型,甚至体外细胞模型研究阶段,临床研究报道甚少,药理机制尚不完全明晰,距临床应用和产品开发仍有很长的距离。因此,深化SGs生理功能研究,推进相关产品的开发利用可从以下几个方面进行。首先,借助现代医药和仪器分析技术的发展成果,逐步推进现有生理活性功能的小鼠、哺乳动物模型和人体临床药理研究,解析药理机制,做好安全性评价,为SGs产品的开发奠定基础。其次,在现有研究基础上,积极开展SGs对重大疾病(如恶性肿瘤、严重心血管疾病、神经系统功能障碍等)的相关研究,发掘新的生理活性功能,更好地为人类健康服务。此外,可进一步研究SMG、SDG和STG之间,以及SGs与其他芝麻木脂素之间在营养保健或疾病治疗方面的协同作用,使其更好地应用于食品、药品和化妆品行业。
目前,高昂的分离纯化成本是制约SGs产品产业化的主要因素。因此,借助现代分离技术的发展成果,开发低成本、高效率的新型分离技术,将是未来推动SGs产业发展和升级的关键。此外,SGs来源于芝麻,其安全性毋庸置疑。因此在产品开发方面,可首先聚焦于SGs功能食品开发,逐步带动SGs相关化妆品和医药产品开发,进而推动整个SGs产业的发展。SGs广泛的生理活性功能,使其具有防治多种疾病的潜力,推动SGs生理活性功能研究和产品开发,对促进芝麻资源综合利用和人类健康具有重要的意义。
[1] WEI P P, ZHAO F L, WANG Z, et al.Sesame (Sesamum indicum L.):A comprehensive review of nutritional value, phytochemical composition, health benefits, development of food, and industrial applications[J].Nutrients, 2022, 14(19):4079.
[2] LALALEO L, ALCAZAR R, PALAZON J, et al.Comparing aryltetralin lignan accumulation patterns in four biotechnological systems of Linum album[J].Journal of Plant Physiology, 2018, 228:197-207.
[3] AHMAD DAR A, KANCHARLA P K, CHANDRA K, et al.Assessment of variability in lignan and fatty acid content in the germplasm of Sesamum indicum L[J].Journal of Food Science and Technology, 2019, 56(2):976-986.
[4] SARKIS J R, MICHEL I, TESSARO I C, et al.Optimization of phenolics extraction from sesame seed cake[J].Separation and Purification Technology, 2014, 122:506-514.
[5] ELLEUCH M, BESBES S, ROISEUX O, et al.Quality characteristics of sesame seeds and by-products[J].Food Chemistry, 2007, 103(2):641-650.
[6] FITWI M, TADESSE G.Effect of sesame cake supplementation on feed intake, body weight gain, feed conversion efficiency and carcass parameters in the ration of sheep fed on wheat bran and teff (Eragrostis teff) straw[J].Momona Ethiopian Journal of Science, 2013, 5(1):89.
[7] KAMAL-ELDIN A, MOAZZAMI A, WASHI S.Sesame seed lignans:Potent physiological modulators and possible ingredients in functional foods &nutraceuticals[J].Recent Patents on Food, Nutrition &Agriculture, 2011, 3(1):17-29.
[8] PETERSON J, DWYER J, ADLERCREUTZ H, et al.Dietary lignans:Physiology and potential for cardiovascular disease risk reduction[J].Nutrition Reviews, 2010, 68(10):571-603.
[9] FUKUDA Y, OSAWA T, NAMIKI M, et al.Studies on antioxidative substances in sesame seed[J].Agricultural and Biological Chemistry, 1985, 49(2):301-306.
[10] KATSUZAKI H, KAWAKISHI S, OSAWA T.Sesaminol glucosides in sesame seeds[J].Phytochemistry, 1994, 35(3):773-776.
[11] MOAZZAMI A A, ANDERSSON R E, KAMAL-ELDIN A.HPLC analysis of sesaminol glucosides in sesame seeds[J].Journal of Agricultural and Food Chemistry, 2006, 54(3):633-638.
[12] SUJA K P, JAYALEKSHMY A, ARUMUGHAN C.Antioxidant activity of sesame cake extract[J].Food Chemistry, 2005, 91(2):213-219.
[13] SHYU Y S, HWANG L S.Antioxidative activity of the crude extract of lignan glycosides from unroasted Burma black sesame meal[J].Food Research International, 2002, 35(4):357-365.
[14] 彭珍, 孟庆然, 陈璐, 等.芝麻粕中芝麻素酚三糖苷的提取、纯化与结构鉴定[J].中国油脂, 2016, 41(1):68-71.
PENG Z, MENG Q R, CHEN L, et al.Extraction, purification and structure identification of sesaminol triglucoside in sesame meal[J].China Oils and Fats, 2016, 41(1):68-71.
[15] 汪学德. 亚临界萃取芝麻脂溶性和水溶性木酚素及其生物活性研究[D].广州:广东工业大学,2016.
WANG X D.Subcritical extraction of fat-soluble and water-soluble ligans of sesame and their’s bioactivity[D].Guangzhou:Guangdong University of Technology, 2016.
[16] EOM S J, ZU H D, LEE J, et al.Development of an ultrasonic system for industrial extraction of unheated sesame oil cake[J].Food Chemistry, 2021, 354:129582.
[17] OHTSUKI T, AKIYAMA J, SHIMOYAMA T, et al.Increased production of antioxidative sesaminol glucosides from sesame oil cake through fermentation by Bacillus circulans strain YUS-2[J].Bioscience Biotechnology and Biochemistry, 2003, 67(10):2304-2306.
[18] DAS R, BHATTACHARJEE C, GHOSH S.Novel approach to recover natural antioxidants from oil seed meal in ultrafiltration-nanofiltration-based technique[J].Industrial &Engineering Chemistry Research, 2011, 50(21):12124-12133.
[19] ZHU X L, ZHANG X, SUN Y K, et al.Purification and fermentation in vitro of sesaminol triglucoside from sesame cake by human intestinal microbiota[J].Journal of Agricultural and Food Chemistry, 2013, 61(8):1868-1877.
[20] 李丹丹. 芝麻饼粕中木酚素的提取及抗氧化活性研究[D].南京:南京农业大学, 2010.
LI D D.Study on extraction, isolation and antioxidant activity of lignans of sesame cake[D].Nanjing:Nanjing Agricultural University, 2010.
[21] BYRNE N J, RAJASEKARAN N S, ABEL E D, et al.Therapeutic potential of targeting oxidative stress in diabetic cardiomyopathy[J].Free Radical Biology and Medicine, 2021, 169:317-342.
[22] FORRESTER S J, KIKUCHI D S, HERNANDES M S, et al.Reactive oxygen species in metabolic and inflammatory signaling[J].Circulation Research, 2018, 122(6):877-902.
[23] GLOIRE G, LEGRAND-POELS S, PIETTE J.NF-kappaB activation by reactive oxygen species:Fifteen years later[J].Biochemical Pharmacology, 2006, 72(11):1493-1505.
[24] SARMIENTO-SALINAS F L, PEREZ-GONZALEZ A, ACOSTA-CASIQUE A, et al.Reactive oxygen species:Role in carcinogenesis, cancer cell signaling and tumor progression[J].Life Sciences, 2021, 284:119942.
[25] UM M Y, AHN J Y, KIM M K, et al.Sesaminol glucosides protect β-amyloid induced apoptotic cell death by regulating redox system in SK-N-SH cells[J].Neurochemical Research, 2012, 37(4):689-699.
[26] NANTARAT N, MUELLER M, LIN W C, et al.Sesaminol diglucoside isolated from black sesame seed cake and its antioxidant, anti-collagenase and anti-hyaluronidase activities[J].Food Bioscience, 2020, 36:100628.
[27] AFROZ M, ZIHAD S M N K, UDDIN S J, et al.A systematic review on antioxidant and anti-inflammatory activity of sesame (Sesamum indicum L.) oil and further confirmation of anti-inflammatory activity by chemical profiling and molecular docking[J].Phytotherapy Research, 2019, 33(10):2585-2608.
[28] SUJA K P, JAYALEKSHMY A, ARUMUGHAN C.Free radical scavenging behavior of antioxidant compounds of sesame (Sesamum indicum L.) in DPPH· system[J].Journal of Agricultural and Food Chemistry, 2004, 52(4):912-915.
[29] CHEN B, ZHAO J J, ZHANG R, et al.Neuroprotective effects of natural compounds on neurotoxin-induced oxidative stress and cell apoptosis[J].Nutritional Neuroscience, 2022, 25(5):1078-1099.
[30] SULTANA R, RAVAGNA A, MOHMMAD-ABDUL H, et al.Ferulic acid ethyl ester protects neurons against amyloid beta-peptide(1-42)-induced oxidative stress and neurotoxicity:Relationship to antioxidant activity[J].Journal of Neurochemistry, 2005, 92(4):749-758.
[31] MILLUCCI L, GHEZZI L, BERNARDINI G, et al.Conformations and biological activities of amyloid beta peptide 25-35[J].Current Protein &Peptide Science, 2010, 11(1):54-67.
[32] LEE S Y, HA T Y, SON D J, et al.Effect of sesaminol glucosides on β-amyloid-induced PC12 cell death through antioxidant mechanisms[J].Neuroscience Research, 2005, 52(4):330-341.
[33] KANG M H, KAWAI Y, NAITO M, et al.Dietary defatted sesame flour decreases susceptibility to oxidative stress in hypercholesterolemic rabbits[J].The Journal of Nutrition, 1999, 129(10):1885-1890.
[34] UM M Y, CHOI W H, AHN J Y, et al.Sesaminol glucosides improve cognitive deficits and oxidative stress in SAMP8 mice[J].Food Science and Biotechnology, 2009, 18(6):1311-1315.
[35] GAO J H, WANG R D, LU X, et al.Enzymatic preparation and structure-activity relationship of sesaminol[J].Journal of Oleo Science, 2021, 70(9):1261-1274.
[36] JAN K C, CHANG Y W, HWANG L S, et al.Tissue distribution and cytochrome P450 inhibition of sesaminol and its tetrahydrofuranoid metabolites[J].Journal of Agricultural and Food Chemistry, 2012, 60(35):8616-8623.
[37] FULLERTON J N, GILROY D W.Resolution of inflammation:A new therapeutic frontier[J].Nature Reviews Drug Discovery, 2016, 15(8):551-567.
[38] LEE S Y, SON D J, LEE Y K, et al.Inhibitory effect of sesaminol glucosides on lipopolysaccharide-induced NF-κB activation and target gene expression in cultured rat astrocytes[J].Neuroscience Research, 2006, 56(2):204-212.
[39] JAN K C, KU K L, CHU Y H, et al.Tissue distribution and elimination of estrogenic and anti-inflammatory catechol metabolites from sesaminol triglucoside in rats[J].Journal of Agricultural and Food Chemistry, 2010, 58(13):7693-7700.
[40] YU H, LIN L B, ZHANG Z Q, et al.Targeting NF-κB pathway for the therapy of diseases:Mechanism and clinical study[J].Signal Transduction and Targeted Therapy, 2020, 5:209.
[41] SUN S C.The non-canonical NF-κB pathway in immunity and inflammation[J].Nature Reviews Immunology, 2017, 17(9):545-558.
[42] HANAHAN D, WEINBERG R A.Hallmarks of cancer:The next generation[J].Cell, 2011, 144(5):646-674.
[43] WATANABE M, IIZUMI Y, SUKENO M, et al.The pleiotropic regulation of cyclin D1 by newly identified sesaminol-binding protein ANT2[J].Oncogenesis, 2017, 6(4):e311.
[44] SHENG H Q, HIROSE Y, HATA K, et al.Modifying effect of dietary sesaminol glucosides on the formation of azoxymethane-induced premalignant lesions of rat colon[J].Cancer Letters, 2007, 246(1-2):63-68.
[45] JAN K C, HWANG L S, HO C T.Biotransformation of sesaminol triglucoside to mammalian lignans by intestinal microbiota[J].Journal of Agricultural and Food Chemistry, 2009, 57(14):6101-6106.
[46] LIU H D, LIU J R, WANG S W, et al.Enterolactone has stronger effects than enterodiol on ovarian cancer[J].Journal of Ovarian Research, 2017, 10(1):49.
[47] ANIKET V M, ASAVARI A J, MAHABALESHWAR V H, et al.Enterolactone modulates the ERK/NF-κB/Snail signaling pathway in triple-negative breast cancer cell line MDA-MB-231 to revert the TGF-β-induced epithelial-mesenchymal transition[J].Cancer Biology &Medicine, 2018, 15(2):137.
[48] SHIN M K, JEON Y D, JIN J S.Apoptotic effect of enterodiol, the final metabolite of edible lignans, in colorectal cancer cells[J].Journal of the Science of Food and Agriculture, 2019, 99(5):2411-2419.
[49] ZHANG H Y, CHEN N H, DENG Z H, et al.Suppression of ANT2 by miR-137 inhibits prostate tumorigenesis[J].Frontiers in Genetics, 2021, 12:687236.
[50] KOLAPALLI S P, SAHU R, CHAUHAN N R, et al.RNA-binding RING E3-ligase DZIP3/hRUL138 stabilizes cyclin d1 to drive cell-cycle and cancer progression[J].Cancer Research, 2021, 81(2):315-331.
[51] AVEROUS J, FONSECA B D, PROUD C G.Regulation of cyclin D1 expression by mTORC1 signaling requires eukaryotic initiation factor 4E-binding protein 1[J].Oncogene, 2008, 27(8):1106-1113.
[52] WROBEL A G, BENTON D J, ROUSTAN C, et al.Evolution of the SARS-CoV-2 spike protein in the human host[J].Nature Communications, 2022, 13:1178.
[53] DAI W H, ZHANG B, JIANG X M, et al.Structure-based design of antiviral drug candidates targeting the SARS-CoV-2 main protease[J].Science, 2020, 368(6497):1331-1335.
[54] KHANAL P, DUYU T, PATIL B M, et al.Screening of JAK-STAT modulators from the antiviral plants of Indian traditional system of medicine with the potential to inhibit 2019 novel coronavirus using network pharmacology[J].3 Biotech, 2021, 11(3):119.
[55] CÉLIND J, BYGDELL M, MARTIKAINEN J, et al.Childhood overweight and risk of obesity-related adult cancer in men[J].Cancer Communications, 2022, 42(6):576-579.
[56] CYPESS A M, WEINER L S, ROBERTS-TOLER C, et al.Activation of human brown adipose tissue by a β3-adrenergic receptor agonist[J].Cell Metabolism, 2015, 21(1):33-38.
[57] FELDMANN H M, GOLOZOUBOVA V, CANNON B, et al.UCP1 ablation induces obesity and abolishes diet-induced thermogenesis in mice exempt from thermal stress by living at thermoneutrality[J].Cell Metabolism, 2009, 9(2):203-209.
[58] LEITNER B P, HUANG S, BRYCHTA R J, et al.Mapping of human brown adipose tissue in lean and obese young men[J].Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(32):8649-8654.
[59] HAN S P, YANG Y F, LU Y N, et al.Cyanidin-3-O-glucoside regulates the expression of Ucp1 in brown adipose tissue by activating Prdm16 gene[J].Antioxidants, 2021, 10(12):1986.
[60] JAHAGIRDAR A, USHARANI D, SRINIVASAN M, et al.Sesaminol diglucoside, a water-soluble lignan from sesame seeds induces brown fat thermogenesis in mice[J].Biochemical and Biophysical Research Communications, 2018, 507(1-4):155-160.
[61] NAGHAVI M, WANG H D, LOZANO R, et al.Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1 990-2013:A systematic analysis for the Global Burden of Disease Study 2013[J].The Lancet, 2015, 385(9963):117-171.
[62] SHOKRI Y, VARIJI A, NOSRATI M, et al.Importance of paraoxonase 1 (PON1) as an antioxidant and antiatherogenic enzyme in the cardiovascular complications of type 2 diabetes:Genotypic and phenotypic evaluation[J].Diabetes Research and Clinical Practice, 2020, 161:108067.
[63] MOCHIZUKI M, TSUCHIE Y, NAKAMURA Y, et al.Identification and characterization of sesaminol metabolites in the liver[J].Journal of Agricultural and Food Chemistry, 2009, 57(21):10429-10434.
[64] MOCHIZUKI M, TSUCHIE Y, YAMADA N, et al.Effect of sesame lignans on TNF-α-induced expression of adhesion molecules in endothelial cells[J].Bioscience, Biotechnology, and Biochemistry, 2010, 74(8):1539-1544.
[65] SNYDER A G, OBERST A.The antisocial network:Cross talk between cell death programs in host defense[J].Annual Review of Immunology, 2021, 39:77-101.
[66] SERRANO-POZO A, FROSCH M P, MASLIAH E, et al.Neuropathological alterations in Alzheimer disease[J].Cold Spring Harbor Perspectives in Medicine, 2011, 1:a006189.
[67] UM M Y, AHN J Y, KIM S, et al.Sesaminol glucosides protect β-amyloid peptide-induced cognitive deficits in mice[J].Biological and Pharmaceutical Bulletin, 2009, 32(9):1516-1520.
[68] GELSE K, PÖSCHL E, AIGNER T.Collagens—Structure, function, and biosynthesis[J].Advanced Drug Delivery Reviews, 2003, 55(12):1531-1546.
[69] PAPAKONSTANTINOU E, ROTH M, KARAKIULAKIS G.Hyaluronic acid:A key molecule in skin aging[J].Dermato-Endocrinology, 2012, 4(3):253-258.
[70] RINNERTHALER M, BISCHOF J, STREUBEL M K, et al.Oxidative stress in aging human skin[J].Biomolecules, 2015, 5(2):545-589.