食源性疾病是人类长期面对的公共卫生难题之一。微生物污染易引起食源性疾病爆发,严重影响人们正常的生活节奏、阻碍各国经济和社会的发展[1]。据世界卫生组织报道[2],全球每年约有42万人因食源性疾病而死亡。摄入细菌(如沙门氏菌、单核增生李斯特菌等)、真菌(如黄曲霉菌等)、病毒(如诺如病毒、轮状病毒等)、寄生虫(如弓形虫、牛带绦虫等)等污染的食物会引起疾病,全球每年因此生病的人数多达6亿[2-3]。在我国,大多数食源性疾病由细菌(如金黄色葡萄球菌、沙门氏菌、副溶血性弧菌等)引起,食品安全问题不容小觑[4]。另外,由腐败菌导致的食品腐败浪费也是世界普遍存在的巨大挑战[5]。联合国粮食及农业组织的一项研究显示,供人类食用的粮食有1/3(13亿t/年)因腐败而损失浪费[6]。
目前,热处理是食品工业中使用最广泛的微生物灭活方法。然而,热加工常会破坏食品品质,包括风味、色泽、质地、营养价值等。光动力杀菌技术(photodynamic anti-microbial technology,PDAT)是一种基于光源、光敏剂和分子氧相结合的新型非热杀菌技术[7],其杀菌作用首次报道于1984年[8]。PDAT的杀菌机理是当分子氧存在时,光敏剂可被特定波长的光源所激发,而后产生一系列以单线态氧(1O2)为主的活性氧(reactive oxygen species,ROS),通过持续的氧化损伤来破坏菌体中核酸、蛋白质及脂质等生物大分子,最终导致细胞死亡[9]。光敏剂一般具有组织选择性,能穿透并积累于生长旺盛的肿瘤细胞或微生物中而不破坏正常组织[10]。由于PDAT的多靶点作用模式,其靶标菌不易产生耐药性[11]。同时,PDAT具有广谱灭菌、耗能低、无毒副作用、杀菌速度快等优点[12-13]。因此,PDAT有望成为食品非热杀菌处理的新技术。
本文主要对PDAT在食品保鲜领域的研究进展进行了综述,包括光敏剂、光源的分类、杀菌效果与作用机理及其在不同种类食品中的应用,旨在为生鲜食品的非热杀菌保鲜技术提供新思路。
1 PDAT的作用机制
PDAT的作用是通过一定波长的光源、光敏剂和分子氧的组合发生光化学反应而产生一系列ROS,主要包括1O2、·OH、·O2-、H2O2[14]。PDAT杀菌在分子水平上主要有2种机制:Ⅰ型和Ⅱ型(图1)。Ⅰ型:由特定波长的光照射激活后,光敏剂分子首先由基态暂时向单重激发态跃迁,然后通过系间窜越形成三重激发态并由电子转移直接与附近的底物反应,从而产生![]() 等自由基与自由基离子。反应场所主要位于菌体细胞膜,不饱和磷脂分子由抽氢反应置换后继续与分子氧结合,最终导致脂质过氧化,细胞膜结构完整性遭到破坏以及细胞内容物泄漏而灭活微生物。Ⅱ型:三重激发态的光敏剂分子在光照后与基态氧发生能量转移而形成1O2。1O2作为ROS中高反应活性分子之一,可以使得核酸、不饱和脂类、多肽和酶等重要分子成分发生严重的氧化损伤,进而灭活微生物[15]。由于1O2的半衰期较短(<0.04 μs)且作用半径小(<0.02 μm)[16],因此,光敏剂的定位对于PDAT杀菌效果影响很大,应考虑选择合适的光敏剂并使其附着于细胞膜/壁或渗透微生物细胞内以充分发挥光动力效果。
等自由基与自由基离子。反应场所主要位于菌体细胞膜,不饱和磷脂分子由抽氢反应置换后继续与分子氧结合,最终导致脂质过氧化,细胞膜结构完整性遭到破坏以及细胞内容物泄漏而灭活微生物。Ⅱ型:三重激发态的光敏剂分子在光照后与基态氧发生能量转移而形成1O2。1O2作为ROS中高反应活性分子之一,可以使得核酸、不饱和脂类、多肽和酶等重要分子成分发生严重的氧化损伤,进而灭活微生物[15]。由于1O2的半衰期较短(<0.04 μs)且作用半径小(<0.02 μm)[16],因此,光敏剂的定位对于PDAT杀菌效果影响很大,应考虑选择合适的光敏剂并使其附着于细胞膜/壁或渗透微生物细胞内以充分发挥光动力效果。
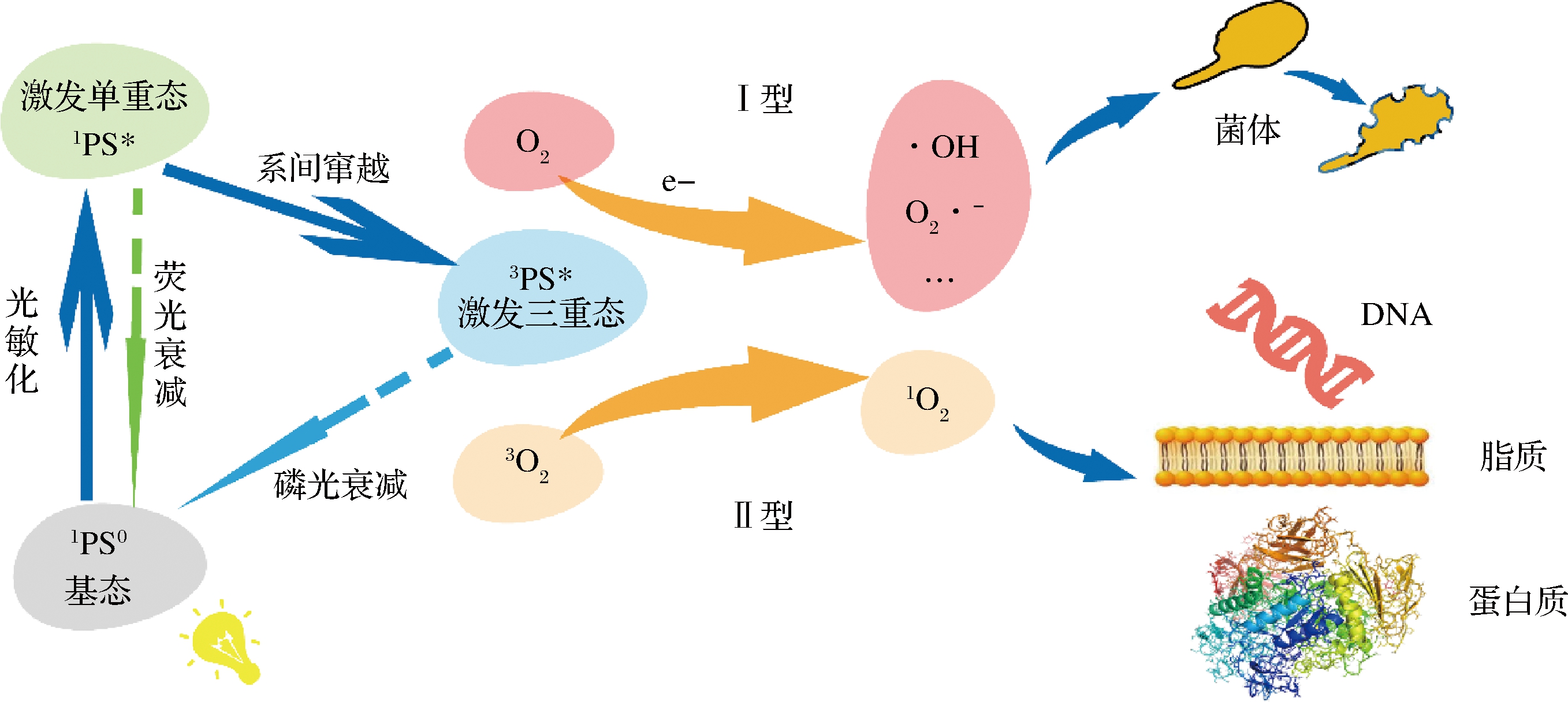
图1 光敏剂在光照条件下的光动力杀菌作用机制
Fig.1 Photodynamic anti-microbial mechanism of photosensitizer under light conditions
2 光敏剂与光源
2.1 光敏剂
光敏剂是一类具有光活性的化学物质,可以有选择性地富集在靶细胞中,由特定的光源来激发后可以灭活不同种类的微生物。根据其在生物体中的存在位置又可分为内源性和外源性。光敏剂选择的合适与否会直接影响PDAT的适用范围、效果和安全性。因此,筛选和评估合适的光敏剂引起了研究者们的广泛关注[7]。理想的光敏剂应具有以下特点:(1)低暗毒性,对环境友好;(2)在样品体系中溶解度高;(3)能被特定波长的光源激发,在激发光谱区有较高的光吸收系数;(4)具有足够长的三重态寿命以确保与周围物质充分反应;(5)能够产生高浓度ROS,对目标微生物破环性强,对机体无毒副作用;(6)稳定性强,易于保存。此外,根据菌体结构的差异,阳离子光敏剂或光敏剂结合富含阳离子的试剂可以作用于革兰氏阴性菌外膜和真菌细胞壁上的负电荷,在光激发后能有效灭菌[17]。
2.1.1 内源性光敏剂
微生物本身存在内源性光敏剂,经光激发后可直接灭活微生物,其化学本质是一类杂环大分子,包括原卟啉、粪卟啉和尿卟啉[7]。有研究表明,光敏剂的前体物质5-氨基酮戊酸可以促进内源性卟啉的合成[18]。另外,核黄素(维生素B2)也是一种内源性光敏剂,可以由470~490 nm波长的光源激发而发挥光动力杀菌效果[11]。为了提高食源性病原菌和腐败菌的失活效率,可以借助一些外源性光敏剂。
2.1.2 外源性光敏剂
外源性光敏剂主要分为人工合成的和天然存在2类。如表1所示,合成的光敏剂主要是卟啉类化合物(细菌卟吩等)、酞菁及其衍生物[锌(Ⅱ)酞菁等]和一系列有机染料(亚甲基蓝、荧光黄等)。天然光敏剂主要包括金丝桃素、竹红菌素、α-三联噻吩(万寿菊属)、呋喃香豆素、叶绿素、姜黄素和核黄素。近年来,随着人们对于食品安全的持续关注,天然光敏剂因其毒副作用小、来源广泛而受研究者的青睐。
表1 用于PDAT的外源性光敏剂
Table 1 Exogenous photosensitizers used in PDAT

续表1

光敏剂吸收波长/nm单线态氧产率参考文献 荧光黄430~5300.03(水)[27] 孟加拉玫瑰红480~5500.76(水)0.80(甲醇)[27][28] 赤藓红500~6000.62(水)[29] 曙红Y500~6000.57(磷酸缓冲液)[29]天然光敏剂 姜黄素400~4750.1(甲苯)[30] 核黄素470~4900.54~0.59(甲醇)[11] 金丝桃素6300.73(乙醇)[27] 竹红菌素4365780.74~0.84(苯)[31-32] α-三联噻吩(万寿菊属)3540.86(乙醇)[33] 叶绿素-a6660.60(苯)[34] 呋喃香豆素4500.012(苯)[35]
注:DMSO-二甲基亚砜;DMPC-二肉豆蔻酰基卵磷脂;TritonX-100-聚乙二醇辛基苯基醚。
2.2 光源
光源作为PDAT的三要素之一,常根据光敏剂的分子结构进行选择[36],同时要考虑成本、安全性、性能等因素。另外,对于光源的可穿透深度,一般长波长光源比短波长光源对基质的穿透深度更深,接近红外范围波长的光源在照射时会出现显著的热效应,可能破坏基质外观和成分而应尽量减少使用。目前,PDAT的光源主要包括激光(连续激光、脉冲激光)、强脉冲光、发光二极管(light emitting diode, LED)和常规灯(卤钨灯、氙灯等)[11]。激光是一种高能光源,在传统医学领域应用广泛,但是成本高、难操作,鲜少用于食品领域。近年来,LED由于其安全无害、成本低廉、可控性强,且作为一种冷光源,能有效减少热效应带给食品基质的破坏,在食品加工领域越来越受关注。另外,LED发射波长的范围可以从UV-A(320~400 nm)到近红外(1 100 nm),辐照度可以高达150 mW/cm2[37]。除了安全性外,食品领域PDAT研究中常见的问题还有辐照强度不足与照射角度单一,LED凭借其可以阵列排布与多几何体形组合的特点而较好地解决了上述问题。
3 PDAT对食源性有害微生物的体外灭活作用
PDAT作为一种有潜力的非热杀菌技术,已被广泛用于研究灭活各种类型的微生物中,包括细菌(金黄色葡萄球菌、大肠杆菌等[11])、真菌(黄曲霉菌[38]、白色念珠菌[39]等)和病毒(诺如病毒[40]等)。迄今为止与食品相关的PDAT研究主要集中于灭活食源性有害细菌,少量为灭活真菌及病毒的研究[41-44],表2总结了近年来国内外PDAT对食源性有害微生物的灭活作用。
表2 PDAT对食源性有害微生物的灭活作用
Table 2 Inactivation of foodborne harmful microorganisms by PDAT
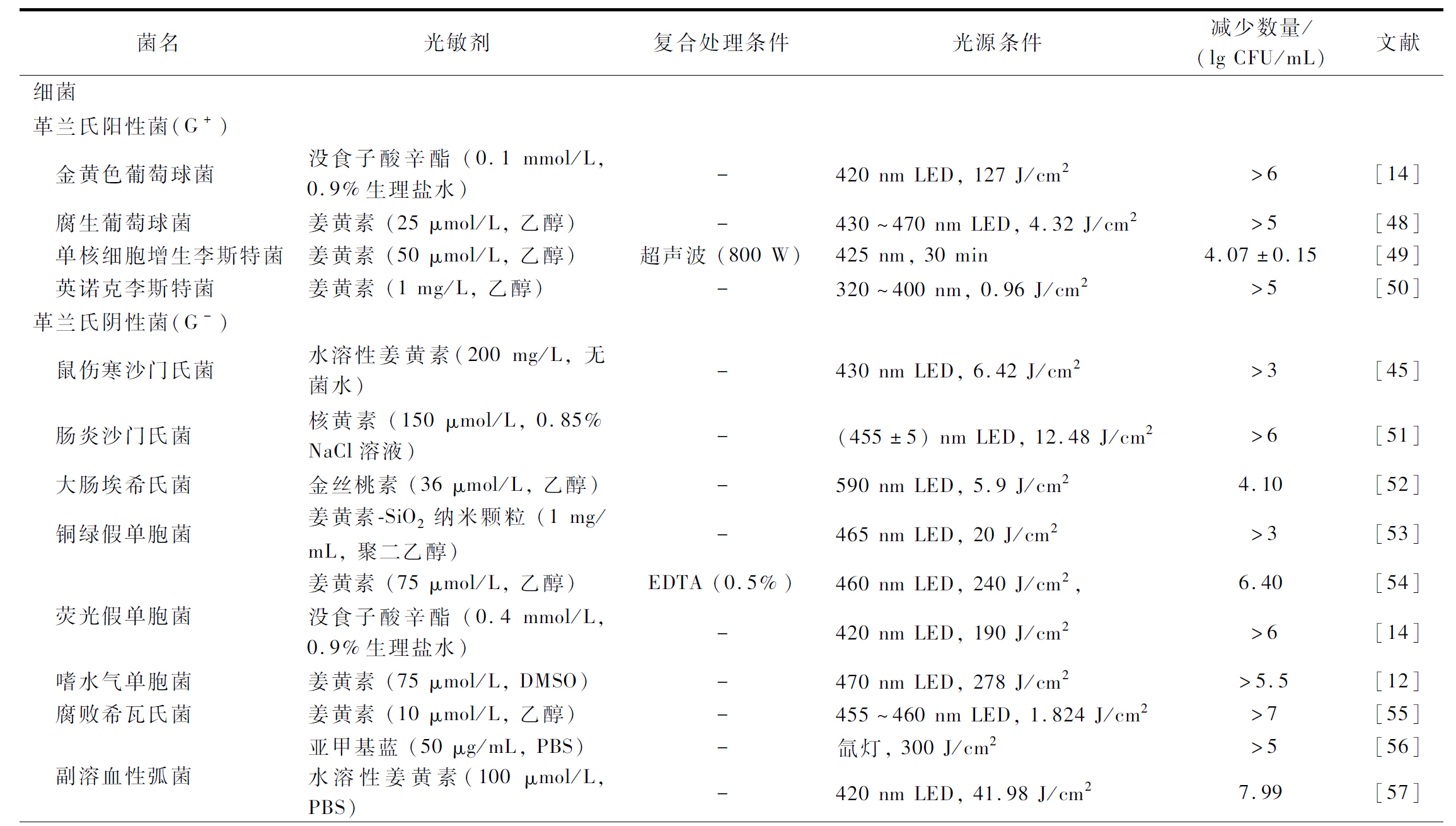
续表2

菌名光敏剂复合处理条件光源条件减少数量/(lg CFU/mL)文献 洋葱伯克霍尔德菌姜黄素 (50 μmol/L, 乙醇)EDTA (0.1%)425 nm LED, 28.8 J/cm2>4[58] 福氏志贺氏菌姜黄素 (40 μmol/L, 乙醇)ε-PL(10 μL)405 nm LED, 3 J/cm2>6[17]真菌及孢子 黄曲霉菌及其孢子姜黄素(50 μmol/L, 乙醇)-420 nm 弧光灯, 60 J/cm2>2[38] 白色念珠菌姜黄素 (20 μmol/L, DMSO)-440~460 nm LED, 37.5 J/cm2>6[39]5-氨基乙酰丙酸 (2.5 mmol/L, PBS)葡萄糖 (1%)+EDTA (5 mmol/L)630 nm激光二极管, 189 J/cm24.01;被膜菌灭活率达96.5%[59] 灰霉菌及其孢子姜黄素 (500 μmol/L, 乙醇)-420 nm 弧光灯, 86 J/cm2孢子灭活率>96%[60]病毒 诺如病毒姜黄素 (20 μmol/L, 乙醇)-470 nm LED, 3.6 J/cm2病毒滴度下降>3 lg PFU/mL[43]
注:EDTA为乙二胺四乙酸;ε-PL为ε-聚赖氨酸;“-”表示文中未涉及。
目前,国内外已有不少与PDAT灭活多种食源性有害细菌的相关报道,且其对许多食源性有害菌均有显著的灭活效果,对于G+菌尤为突出。由于G-菌细胞壁外有带负电荷的致密外膜(主要成分是脂多糖和脂蛋白),能阻挡阴离子光敏剂和中性光敏剂对于菌体穿透与吸附,相较于G+菌,光动力灭活G-菌效果不佳[45]。有研究报道使用阳离子光敏剂(如卟啉类和吩噻嗪类染料)或利用改造和修饰后的光敏剂可以提高对靶向G-菌的杀菌效果。YUE等[46]利用阳离子多糖壳聚糖(chitosan,CS)和二氢卟吩e6(chlorin e6,Ce6)构建了一种新型光敏剂(CS-Ce6偶联物),与CS和Ce6相比,CS-Ce6偶联物的杀菌效果明显增强。照射10 min,CS-Ce6偶联物在光激发后可以灭活约7 lg CFU/mL 的金黄色葡萄球菌,灭活大肠杆菌>5 lg CFU/mL。另外,WANG等[47]构建了负载光敏剂Ce6的聚乙烯亚胺基纳米胶束。纳米粒子与细菌表面之间的静电和疏水作用协同促进了纳米粒子对目标菌的锚定,产生大量的ROS对细菌外膜造成不可逆损伤,不仅比游离光敏剂的杀菌效率更高,更增强了对G-菌的杀灭作用。此外,相同光动力处理对于不同食源性有害微生物灭活效果不同的问题还有待进一步考察。
4 PDAT在不同种类食品基质中的应用
PDAT由于其成本低、安全环保、精准高效,有望成为减少热效应带给食品感官品质严重损害的一项重要的杀菌技术,已被广泛用于果蔬制品、奶制品、肉制品以及水产品的保鲜研究中。
4.1 果蔬制品
与新鲜果蔬相关的食源性疾病的爆发常常与大肠杆菌、沙门氏菌与单核增生李斯特菌密切相关[12]。PDAT对番茄、草莓、葡萄和樱桃等4种水果表面的总菌落数和大肠菌群数的灭活率可达80%以上[61]。CHAI等[62]将鲜切梨浸泡于菌悬液中,10 μmol/L姜黄素介导的PDAT(420 nm LED)使单核增生李斯特菌减少了3.43 lg CFU/g,并保持了梨的色泽、硬度等品质。由于细菌内部可能存在内源性卟啉,经光激发后也能产生以1O2为主的ROS从而灭活微生物。GHATE等[63]报道在16 ℃时,460 nm LED照射接种了沙门氏菌的鲜切菠萝片,沙门氏菌减少1.72 lg CFU/g。
此外,PDAT的杀菌效果与光敏剂浓度、光照时间、孵育时间与基质状态有关,必要时可以结合其他杀菌手段(如超声波等)来提高杀菌效果。王小情等[64]利用叶绿素镁钠盐(10-5 mol/L)和400~415 nm LED进行光动力处理后,荔枝清汁和浊汁中的金黄色葡萄球菌分别灭活了4.39和0.14 lg CFU/mL。由此可见,液体食品的浊度高可能会干扰光的穿透而降低灭菌效果。为了解决这一问题,BHAVYA等[65]结合50 W/cm2的超声波处理,发现50 μmol/L姜黄素介导的PDAT使得橙汁中的大肠杆菌减少量从1.06 lg CFU/mL提高至4.26 lg CFU/mL。
4.2 肉制品
目前,国内外有关PDAT作用于肉制品中有害菌的相关报道还比较少。其中,CORR A等[42]使用40 μmol/L姜黄素和450 nm LED(15 J/cm2)处理牛肉、鸡肉和猪肉,样品中的金黄色葡萄球菌分别减少了1.5、1.4和0.6 lg CFU/mL。为了提高杀菌效果,王洋等[54]在75 μmol/L姜黄素中加入0.5% EDTA喷洒于猪肉片上,使用460 nm LED照射猪肉样品20 min后发现荧光假单胞菌下降了3.23 lg CFU/g,而不添加EDTA的处理组仅下降2.68 lg CFU/g,后续可以继续联合其他处理以提高其杀菌效果。
A等[42]使用40 μmol/L姜黄素和450 nm LED(15 J/cm2)处理牛肉、鸡肉和猪肉,样品中的金黄色葡萄球菌分别减少了1.5、1.4和0.6 lg CFU/mL。为了提高杀菌效果,王洋等[54]在75 μmol/L姜黄素中加入0.5% EDTA喷洒于猪肉片上,使用460 nm LED照射猪肉样品20 min后发现荧光假单胞菌下降了3.23 lg CFU/g,而不添加EDTA的处理组仅下降2.68 lg CFU/g,后续可以继续联合其他处理以提高其杀菌效果。
4.3 奶制品
牛奶、奶酪等奶制品在保藏不当、杀菌处理不到位时易造成食物腐败变质甚至引起食源性疾病。食物基质的特征往往影响PDAT的杀菌效果,特别是对于光线较难穿透的基质类型。奶制品的结构复杂,不利于光敏剂的均匀分布以及光线的穿透。SARAIVA等[66]以DMSO或乙醇为增溶剂,用62.5 μg/mL姜黄素介导的PDAT(450 nm LED, 0.81 J/cm2)灭活荧光假单胞菌>7 lg CFU/mL,同时,将姜黄素与食用明胶制成可食涂层体的光动力处理(450 nm, 4.86 J/cm2)对于湿奶酪上的荧光假单胞菌虽然只表现出姜黄素的暗毒性,但也增加了奶酪的咀嚼性。在特定条件下,选择合适的光敏剂以及复合处理条件可以使PDAT增效显著。GALSTYAN等[67]用610 nm氙灯(10 mW/cm2)对10 μmol/L亚甲基蓝或酞硅菁进行照射,在牛奶含量为20%时,10 μmol/L酞硅菁介导的PDAT使牛奶中的葡萄球菌数量减少5个对数级以上,同剂量的亚甲基蓝只能使其减少约1个对数级。此外,光动力处理后一些营养成分(如脂质)可能会由于ROS的产生而加速氧化变质,如何更好地发挥PDAT在奶制品上的杀菌效果以及保持其品质有待进一步探索。
4.4 水产品
水产品中也存在许多致病菌和腐败菌(如副溶血性弧菌、荧光假单胞菌、沙门氏菌等),给人们的健康带来严重威胁。最近一项研究报道了150 μmol/L核黄素介导的光动力处理可以灭活体外沙门氏菌>6 lg CFU/mL。当光照剂量达到93.6 J/cm2时,金枪鱼表面的沙门氏菌减少了2.1 lg CFU/mL,尽管加速了脂质氧化,但是对于鱼肉总蛋白和挥发性盐基氮无明显影响[52]。该结果与GHATE等[63]报道类似,高光照剂量依然无法改变光动力处理对食品基质的灭菌效果比体外灭菌效果差的事实,这与食品基质表面几何形态各异、光敏剂在基质上分布不均匀密切有关。由于PDAT中光源穿透深度有限,WANG等[68]将400 nmol/g姜黄素介导的PDAT(425 nm LED,30 min)与超声波(300 W)结合,证明了两者复合处理可以延缓虾糜中细菌的生长,同时减少挥发性盐基氮和硫代巴比妥酸反应物的产生。因此,PDAT实际应用到水产品中不仅需要研究如何进一步提高其杀菌效果,还要深入考察其对于水产品的感官品质与营养价值的影响,减少其给食品带来的品质劣变。
5 总结与展望
“民以食为天”,食品质量与安全关系到每个人的健康,是食品科学研究和生产加工中的2个重要方面。PDAT作为一种安全高效、价格低廉、性能稳定的非热杀菌技术,可以弥补热处理对食品品质带来的严重影响,并保持感官特性和营养价值的完整性。此外,消费者对健康、新鲜和高品质食品的需求也在增加,不含化学防腐剂的食品也更受消费者的青睐。鉴于此,以金丝桃素和姜黄素等天然光敏剂介导的PDAT有望成为替代热处理的重要非热杀菌方式之一。目前,已有不少有关天然光敏剂介导的PDAT灭活不同微生物的文献报道,而大多数研究集中于使用某一种天然光敏剂。不难发现,不论是对于不同种类与数量的微生物进行相同条件的光动力处理,还是对于同种微生物进行不同条件的光动力处理,均会得到显著的杀菌效果。在后续的PDAT研究中,可以进一步考察光动力处理条件以及不同种类与数量的微生物对于PDAT杀菌效果的关联性,以强杀菌效果为导向,挖掘更多安全、经济、稳定的光敏剂以丰富食品级光敏剂宝库。此外,也可以尝试使用多种光敏剂和不同光源结合的复合光动力处理来扩大PDAT的杀菌谱。
另一方面,PDAT可多方位直接照射目标样品,特别是使用LED可以进行多种三维阵列排序,对于不同形状食品基质表面、食品包装表面与加工设备的杀菌效果较为理想,而对于固体、半固体以及浑浊液体食品的内部(食品表面除外)而言,由于光照穿透力不足、光敏剂在样品中的溶解度不高、稳定性不强等因素,往往达不到预期的杀菌效果。现有的研究主要是利用微波、超声波等辅助杀菌技术以及对光敏剂本身进行结构改性、结合其他材料进行改造与修饰(如形成纳米颗粒、复合脂质体、光敏剂/β-环糊精包合物)等方式来提高PDAT的杀菌性能。虽然杀菌性能有了明显提升,但对于食品本身色泽、硬度等感官品质以及对脂质、蛋白质等营养成分影响的研究不深入。目前PDAT杀菌过程中存在引起食物褐变,产生ROS氧化破坏食品中的脂质和抗环血酸等成分,难以对货架期进行评估等问题。此外,大多数食品领域的光动力杀菌研究都在体外和严格的实验室条件下进行的,尽管已取得一定成效,但是还要考虑放大技术,优化光动力杀菌设备,建立规范的行业标准与管理体系,使之能够更好地投入于食品工业化应用场景中。
[1] PIRES S M, DESTA B N, MUGHINI-GRAS L, et al.Burden of foodborne diseases:Think global, act local[J].Current Opinion in Food Science, 2021, 39:152-159.
[2] World Health Organization.WHO estimates of the global burden of foodborne diseases[R].Geneva:WHO, 2015.
[3] World Health Organization.WHO’s first ever global estimates of foodborne diseases find children under 5 account for almost one third of deaths[R].Geneva:WHO, 2015.
[4] 王佳慧, 李楠, 陶婉婷, 等.2014—2019年媒体报道食源性疾病事件分析[J].中国食品卫生杂志, 2021, 33(2):181-185.
WANG J H, LI N, TAO W T, et al.Epidemiological characteristics of foodborne disease events reported by the media from 2014 to 2019[J].Chinese Journal of Food Hygiene, 2021, 33(2):181-185.
[5] ODEYEMI O A, ALEGBELEYE O O, STRATEVA M, et al.Understanding spoilage microbial community and spoilage mechanisms in foods of animal origin[J].Comprehensive Reviews in Food Science and Food Safety, 2020, 19(2):311-331.
[6] Food and Agriculture Organization.Moving forward on food loss and waste reduction[R].Rome:FAO, 2019.
[7] GHATE V S, ZHOU W B, YUK H G.Perspectives and trends in the application of photodynamic inactivation for microbiological food safety[J].Comprehensive Reviews in Food Science and Food Safety, 2019, 18(2):402-424.
[8] BERTOLONI G, SALVATO B, DALL‘ACQUA M, et al.Hematoporphyrin-sensitized photoinactivation of Streptococcus faecalis[J].Photochemistry and Photobiology, 1984, 39(s1):811-816.
[9] 郑宝东, 林少玲, 曾绍校, 等.光动力技术研究进展及其在食品工业中的应用前景[J].食品与生物技术学报, 2020, 39(5):6-15.
ZHENG B D, LIN S L, ZENG S X, et al.Photodynamic technology and its application in food industry[J].Journal of Food Science and Biotechnology, 2020, 39(5):6-15.
[10] 杨晨. 光动力灭菌技术研究及灭菌仪开发[D].杭州:浙江工业大学, 2015.
YANG C.The research of photodynamic disinfection technology and apparatus for debtal surgery[D].Hangzhou:Zhejiang University of Technology, 2015.
[11] DO PRADO-SILVA L, BRANCINI G T P, BRAGA G  L, et al.Antimicrobial photodynamic treatment (aPDT) as an innovative technology to control spoilage and pathogenic microorganisms in agri-food products:An updated review[J].Food Control, 2022, 132:108527.
L, et al.Antimicrobial photodynamic treatment (aPDT) as an innovative technology to control spoilage and pathogenic microorganisms in agri-food products:An updated review[J].Food Control, 2022, 132:108527.
[12] PENHA C B, BONIN E, DA SILVA A F, et al.Photodynamic inactivation of foodborne and food spoilage bacteria by curcumin[J].LWT-Food Science and Technology, 2017, 76:198-202.
[13] ZHANG X, LU N, LI Z J, et al.Effects of curcumin-mediated photodynamic treatment on lipid degradation of oysters during refrigerated storage[J].Journal of the Science of Food and Agriculture, 2022, 102(5):1978-1986.
[14] SHI Y G, JIANG L, LIN S, et al.Ultra-efficient antimicrobial photodynamic inactivation system based on blue light and octyl gallate for ablation of planktonic bacteria and biofilms of Pseudomonas fluorescens[J].Food Chemistry, 2022, 374:131585.
[15] LI C C, LIN F M, SUN W, et al.Self-assembled rose bengal-exopolysaccharide nanoparticles for improved photodynamic inactivation of bacteria by enhancing singlet oxygen generation directly in the solution[J].ACS Applied Materials &Interfaces, 2018, 10(19):16715-16722.
[16] MOAN J, BERG K.The photodegradation of porphyrins in cells can be used to estimate the lifetime of singlet oxygen[J].Photochemistry and Photobiology, 1991, 53(4):549-553.
[17] LIANG Z X, LIU X L, QIN Z R, et al.Photodynamic inactivation of Shigella flexneri by curcumin[J].LWT, 2022, 153:112491.
[18] LUKSIENE Z, BROVKO L.Antibacterial photosensitization-based treatment for food safety[J].Food Engineering Reviews, 2013, 5(4):185-199.
[19] WANG P, QIN F, WANG L, et al.Luminescence and photosensitivity of gadolinium labeled hematoporphyrin monomethyl ether[J].Optics Express, 2014, 22(3):2414.
[20] BAUER D, MONTFORTS F P, LOSI A, et al.Photoprocesses of chlorin e6 glucose derivatives[J].Photochemical &Photobiological Sciences, 2012, 11(6):925-930.
[21] MOJZISOVA H, BONNEAU S, MAILLARD P, et al.Photosensitizing properties of chlorins in solution and in membrane-mimicking systems[J].Photochemical &Photobiological Sciences, 2009, 8(6):778-787.
[22] DE SOUZA T, ANTONIO F, ZANOTTO M, et al.Photophysical and photochemical properties and aggregation behavior of phthalocyanine and naphthalocyanine derivatives[J].Journal of the Brazilian Chemical Society, 2018, 29(6):1199-1209.
[23] KULU I, MANTAREVA V, KUSSOVSKI V, et al.Effects of metal ion in cationic Pd(II) and Ni(II) phthalocyanines on physicochemical and photodynamic inactivation properties[J].Journal of Molecular Structure, 2022, 1247:131288.
[24] LI C, HOFFMAN M Z.Oxidation of phenol by singlet oxygen photosensitized by the tris(2,2′-bipyridine)ruthenium(II) ion[J].The Journal of Physical Chemistry A, 2000, 104(25):5998-6002.
[25] ARBOGAST J W, DARMANYAN A P, FOOTE C S, et al.Photophysical properties of sixty atom carbon molecule (C60)[J].The Journal of Physical Chemistry, 1991, 95(1):11-12.
[26] BACELLAR I O L, PAVANI C, SALES E M, et al.Membrane damage efficiency of phenothiazinium photosensitizers[J].Photochemistry and Photobiology, 2014,90(4):801-813.
[27] WILKINSON F, HELMAN W P, ROSS A B.Quantum yields for the photosensitized formation of the lowest electronically excited singlet state of molecular oxygen in solution[J].Journal of Physical and Chemical Reference Data, 1993, 22(1):113-262.
[28] LEE P C C, RODGERS M A J.Laser flash photokinetic studies of rose Bengal sensitized photodynamic interactions of nucleotides and DNA[J].Photochemistry and Photobiology, 1987, 45(1):79-86.
[29] BATISTELA V R, PELLOSI D S, DE SOUZA F D, et al.pKa determinations of xanthene derivates in aqueous solutions by multivariate analysis applied to UV-Vis spectrophotometric data[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2011, 79(5):889-897.
[30] CHIGNELL C F, BILSKI P, RESZKA K J, et al.Spectral and photochemical properties of curcumin[J].Photochemistry and Photobiology, 1994, 59(3):295-302.
[31] DIWU Z J, ZHANG C L, LOWN J W.Photosensitization with anticancer agents 13.The production of singlet oxygen by halogenated and metal-ion-chelated perylenequinones[J].Journal of Photochemistry and Photobiology A:Chemistry, 1992, 66(1):99-112.
[32] DIWU Z J, LOWN J W.Photosensitization by anticancer agents 12.Perylene quinonoid pigments, a novel type of singlet oxygen sensitizer[J].Journal of Photochemistry and Photobiology A:Chemistry, 1992, 64(3):273-287.
[33] CIOFALO M, PONTERINI G.Generation of singlet oxygen by 2, 2′:5′, 2″-terthiophene and some of its derivatives[J].Journal of Photochemistry and Photobiology A:Chemistry, 1994, 83(1):1-6.
[34] TANIELIAN C.Photooxygénations sensibilisées par les colorants[J].Biochimie, 1986, 68(6):797-806.
[35] KNOX C N, LAND E J, TRUSCOTT T G.Singlet oxygen generation by furocoumarin triplet states—I.Linear furocoumarins (Psoralens)[J].Photochemistry and Photobiology, 1986, 43(4):359-363.
[36] CALZAVARA-PINTON P G, ROSSI M T, ORTEL B.Chapter 14.photodynamic antifungal chemotherapy[M]//Photodynamic Inactivation of Microbial Pathogens.Cambridge:Royal Society of Chemistry, 2011:361-375.
[37] BRANCALEON L, MOSELEY H.Laser and non-laser light sources for photodynamic therapy[J].Lasers in Medical Science, 2002, 17(3):173-186.
[38] TEMBA B A, FLETCHER M T, FOX G P, et al.Curcumin-based photosensitization inactivates Aspergillus flavus and reduces aflatoxin B1 in maize kernels[J].Food Microbiology, 2019, 82:82-88.
[39] DOVIGO L N, PAVARINA A C, RIBEIRO A P D, et al.Investigation of the photodynamic effects of curcumin against Candida albicans[J].Photochemistry and Photobiology, 2011, 87(4):895-903.
[40] WU J, HOU W, CAO B B, et al.Virucidal efficacy of treatment with photodynamically activated curcumin on murine norovirus bio-accumulated in oysters[J].Photodiagnosis and Photodynamic Therapy, 2015, 12(3):385-392.
[41] DIAS L D, BLANCO K C, MFOUO-TYNGA I S, et al.Curcumin as a photosensitizer:From molecular structure to recent advances in antimicrobial photodynamic therapy[J].Journal of Photochemistry and Photobiology C:Photochemistry Reviews, 2020, 45:100384.
[42] CORR A T Q, BLANCO K C, GARCIA É B, et al.Effects of ultraviolet light and curcumin-mediated photodynamic inactivation on microbiological food safety:A study in meat and fruit[J].Photodiagnosis and Photodynamic Therapy, 2020, 30:101678.
A T Q, BLANCO K C, GARCIA É B, et al.Effects of ultraviolet light and curcumin-mediated photodynamic inactivation on microbiological food safety:A study in meat and fruit[J].Photodiagnosis and Photodynamic Therapy, 2020, 30:101678.
[43] WU J, MOU H J, XUE C H, et al.Photodynamic effect of curcumin on Vibrio parahaemolyticus[J].Photodiagnosis and Photodynamic Therapy, 2016, 15:34-39.
[44] CHEN B W, HUANG J M, LIU Y, et al.Effects of the curcumin-mediated photodynamic inactivation on the quality of cooked oysters with Vibrio parahaemolyticus during storage at different temperature[J].International Journal of Food Microbiology, 2021, 345:109152.
[45] GAO J W, MATTHEWS K R.Effects of the photosensitizer curcumin in inactivating foodborne pathogens on chicken skin[J].Food Control, 2020, 109:106959.
[46] YUE L, ZHENG M H, KHAN I M, et al.Chlorin e6 conjugated chitosan as an efficient photoantimicrobial agent[J].International Journal of Biological Macromolecules, 2021, 183:1309-1316.
[47] WANG Q, ZHANG D D, FENG J, et al.Enhanced photodynamic inactivation for Gram-negative bacteria by branched polyethylenimine-containing nanoparticles under visible light irradiation[J].Journal of Colloid and Interface Science, 2021, 584:539-550.
[48] WANG Z Y, JIA Y T, LI W Y, et al.Antimicrobial photodynamic inactivation with curcumin against Staphylococcus saprophyticus, in vitro and on fresh dough sheet[J].LWT, 2021, 147:111567.
[49] JIA Q Y, SONG Q, LI P, et al.Rejuvenated photodynamic therapy for bacterial infections[J].Advanced Healthcare Materials, 2019, 8(14):e1900608.
[50] DE OLIVEIRA E F, TOSATI J V, TIKEKAR R V, et al.Antimicrobial activity of curcumin in combination with light against Escherichia coli O157:H7 and Listeria innocua:Applications for fresh produce sanitation[J].Postharvest Biology and Technology, 2018, 137:86-94.
[51] LI H H, TAN L J, CHEN B W, et al.Antibacterial potency of riboflavin-mediated photodynamic inactivation against Salmonella and its influences on tuna quality[J].LWT, 2021, 146:111462.
[52] ZHANG J N, ZHANG F, TANG Q J, et al.Effect of photodynamic inactivation of Escherichia coli by hypericin[J].World Journal of Microbiology and Biotechnology, 2018, 34(7):100.
[53] MIRZAHOSSEINIPOUR M, KHORSANDI K, HOSSEINZADEH R, et al.Antimicrobial photodynamic and wound healing activity of curcumin encapsulated in silica nanoparticles[J].Photodiagnosis and Photodynamic Therapy, 2020, 29:101639.
[54] 王洋, 赵瑜玲, 陈孟涵, 等.姜黄素联合乙二胺四乙酸对荧光假单胞菌的光动力灭活作用[J].食品科学, 2022, 43(21):8-15.
WANG Y, ZHAO Y L, CHEN M H, et al.Photodynamic inactivation effect of curcumin combined with ethylene diamine tetraacetic acid on Pseudomonas fluorescens[J].Food Science, 2022, 43(21):8-15.
[55] 檀利军, 胡钰梅, 陈博文, 等.姜黄素介导的光动力技术对副溶血性弧菌与腐败希瓦氏菌的杀灭效果[J].食品科学, 2022, 43(3):83-91.
TAN L J, HU Y M, CHEN B W, et al.Inactivation of curcumin-mediated photodynamic technology on Vibrio parahaemolyticus and Shewanella putrefaciens[J].Food Science, 2022, 43(3):83-91.
[56] DENG X, TANG S, WU Q, et al. Inactivation of Vibrio parahaemolyticus by antimicrobial photodynamic technology using methylene blue[J]. Journal of the Science of Food and Agriculture, 2015, 96(5): 1601-1608.
[57] 董冬丽, 林少玲, 孙崇臻, 等.姜黄素光动力技术对水产食品霍利斯格里蒙特菌和溶藻弧菌的灭活作用[J].中国食品学报, 2022, 22(2):40-48.
DONG D L, LIN S L, SUN C Z, et al.Inactivation of curcumin photodynamic technology on Grimontia hollisae and Vibrio alginolyticus in aquatic food[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(2):40-48.
[58] HU J M, LIN S L, TAN B K, et al.Photodynamic inactivation of Burkholderia cepacia by curcumin in combination with EDTA[J].Food Research International, 2018, 111:265-271.
[59] MALISZEWSKA I, WAWRZY CZYK D, WANARSKA E.The effect of glucose and human serum on 5-aminolevulinic acid mediated photodynamic inactivation of Candida albicans[J].Photodiagnosis and Photodynamic Therapy, 2020, 29:101623.
CZYK D, WANARSKA E.The effect of glucose and human serum on 5-aminolevulinic acid mediated photodynamic inactivation of Candida albicans[J].Photodiagnosis and Photodynamic Therapy, 2020, 29:101623.
[60] WEI C L, ZHANG F, SONG L L, et al.Photosensitization effect of curcumin for controlling plant pathogen Botrytis cinerea in postharvest apple[J].Food Control, 2021, 123:107683.
[61] ZHANG X, WU J A, XU C S, et al.Inactivation of microbes on fruit surfaces using photodynamic therapy and its influence on the postharvest shelf-life of fruits[J].Food Science and Technology International, 2020, 26(8):696-705.
[62] CHAI Z Y, ZHANG F, LIU B J, et al.Antibacterial mechanism and preservation effect of curcumin-based photodynamic extends the shelf life of fresh-cut pears[J].LWT, 2021, 142:110941.
[63] GHATE V, KUMAR A, KIM M J, et al.Effect of 460 nm light emitting diode illumination on survival of Salmonella spp.on fresh-cut pineapples at different irradiances and temperatures[J].Journal of Food Engineering, 2017, 196:130-138.
[64] 王小情, 刘忠义, 余元善, 等.叶绿素镁钠盐对液态食品中Staphylococcus aureus的光动力杀菌研究[J].现代食品科技, 2013, 29(3):463-466;478.
WANG X Q, LIU Z Y, YU Y S, et al.Photodynamic sterilization of Staphylococcus aureus in liquid food by Na-chlorophyllin[J].Modern Food Science and Technology, 2013, 29(3):463-466;478.
[65] BHAVYA M L, HEBBAR H U.Sono-photodynamic inactivation of Escherichia coli and Staphylococcus aureus in orange juice[J].Ultrasonics Sonochemistry, 2019, 57:108-115.
[66] SARAIVA B B, RODRIGUES B M, DA SILVA R C Jr, et al.Photodynamic inactivation of Pseudomonas fluorescens in Minas Frescal cheese using curcumin as a photosensitizer[J].LWT, 2021, 151:112143.
[67] GALSTYAN A, DOBRINDT U.Determining and unravelling origins of reduced photoinactivation efficacy of bacteria in milk[J].Journal of Photochemistry and Photobiology B:Biology, 2019, 197:111554.
[68] WANG D H, ZHOU F, LAI D N, et al.Curcumin-mediated sono/photodynamic treatment preserved the quality of shrimp surimi and influenced its microbial community changes during refrigerated storage[J].Ultrasonics Sonochemistry, 2021, 78:105715.