微藻是一类结构简单、形态微小的水生生物,含有叶绿体,能够进行光合作用吸收CO2,生产有机物。微藻的生物固碳能力较强,光合效率是陆地植物的10~50倍[1],可缓解由大气中CO2浓度升高引起的温室效应等环境问题,是实现“碳中和”的有效途径。此外,微藻往往通过二分裂式繁殖,细胞生长周期短,在恶劣环境中的生存能力强。与传统农作物相比,微藻的养殖方式灵活且不占用耕地资源,是极具经济和环保价值的新食品原料之一,受到学者的广泛关注。
微藻种类繁多,目前已发现超过15.7×104种[2],其中用于大规模养殖或生产的微藻主要分为4个藻门:蓝藻门、绿藻门、红藻门和金藻门。我国已批准可作为新食品原料的微藻及其主要成分分布如表1所示。作为一种良好的新型蛋白质来源,微藻蛋白不仅含量丰富,且氨基酸组成全面均衡,营养价值极高,可添加于食品或用于营养补剂和保健食品的开发。此外,微藻蛋白能够调节机体健康和预防疾病,具有抗疲劳、降血糖、抗肿瘤、抗病毒、抗氧化、抗炎、抗血栓等功效[3-6],因此可被用于制作护肤品、化妆品、药物、疫苗等。LIU等[7]研究了螺旋藻蛋白对小鼠皮肤创伤修复的潜在机制,证明了螺旋藻蛋白具有促进小鼠皮肤创伤修复的作用。此外,藻红蛋白、藻蓝蛋白等还具有良好的荧光特性和光敏特性,在分子探针、荧光染料等的研制方面应用广泛[8-10]。
表1 我国已批准可作为新食品原料的微藻及其主要成分分布
Table 1 Microalgae that have been approved as new food raw materials in China and their main components
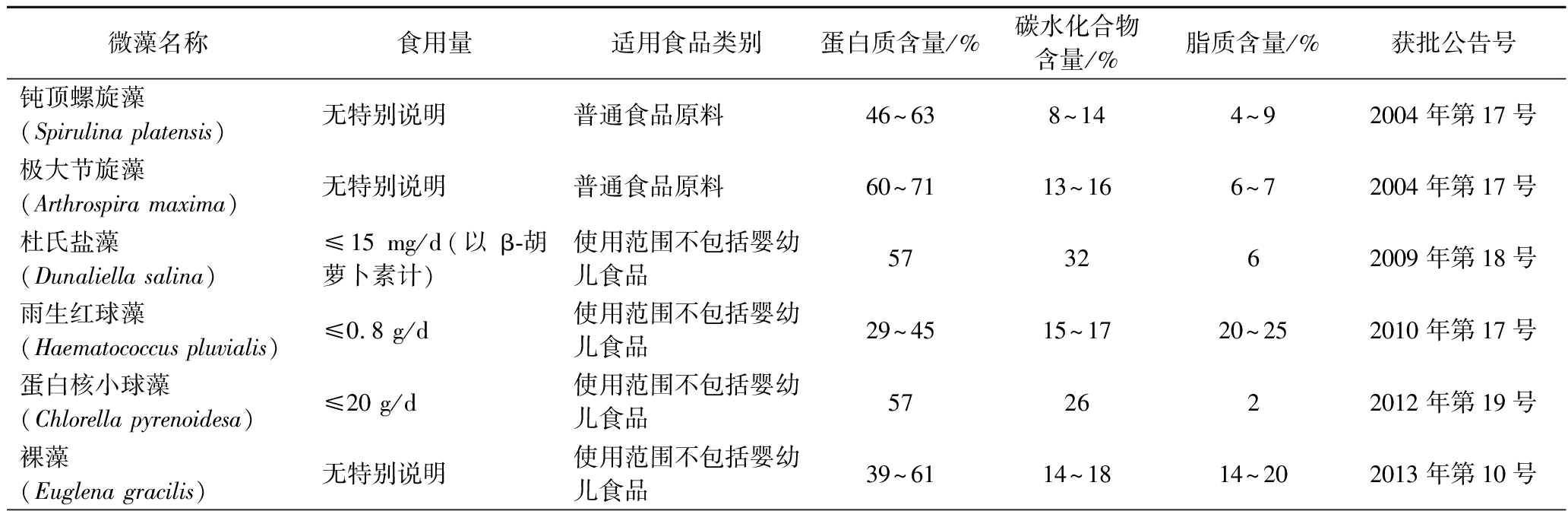
微藻名称食用量适用食品类别蛋白质含量/%碳水化合物含量/%脂质含量/%获批公告号钝顶螺旋藻(Spirulina platensis)无特别说明普通食品原料46~638~144~92004年第17号极大节旋藻(Arthrospira maxima)无特别说明普通食品原料60~7113~166~72004年第17号杜氏盐藻(Dunaliella salina)≤15 mg/d(以β-胡萝卜素计)使用范围不包括婴幼儿食品573262009年第18号雨生红球藻(Haematococcus pluvialis)≤0.8 g/d使用范围不包括婴幼儿食品29~4515~1720~252010年第17号蛋白核小球藻(Chlorella pyrenoidesa)≤20 g/d使用范围不包括婴幼儿食品572622012年第19号裸藻(Euglena gracilis)无特别说明使用范围不包括婴幼儿食品39~6114~1814~202013年第10号
续表1

微藻名称食用量适用食品类别蛋白质含量/%碳水化合物含量/%脂质含量/%获批公告号球状念珠藻(Nostoc sphaeroides)≤3 g/d(以干品计)婴幼儿、孕妇及哺乳期妇女不宜食用28~5224~355~92018年第10号拟微球藻(Nannochloropsis gaditana)≤2 g/d(以干品计)婴幼儿、孕妇及哺乳期妇女不宜食用4722172021年第5号莱茵衣藻(Chlamydomonas reinhardtii)无特别说明使用范围不包括婴幼儿食品4817212022年第2号
微藻蛋白质的提取一般包括培养采收、湿藻干燥、破壁提取和分离纯化。由于微藻种类繁多,细胞壁结构、组成差异较大,且大都坚韧难以破坏,使得高效打破微藻细胞壁,释放胞内活性物质成为微藻蛋白质提取的关键。因此本文主要从破壁的角度,综述了提取微藻蛋白质的方法,阐明现有常规方法的研究进展以及各方法的优势与不足,旨在为高效提取微藻中的蛋白质提供指导,促进微藻及其蛋白产品的高值化利用。
1 传统微藻蛋白提取方法
微藻蛋白的提取方法可分为机械法和非机械法。机械方法主要是通过物理手段,打破细胞屏障,破坏植物细胞壁,使微藻蛋白从细胞中释放出来,常用的有超声波、球磨、高压均质和脉冲电场等。非机械法有反复冻融法、水酶法和离子液体提取等[11]。
1.1 机械方法
1.1.1 球磨法
球磨法是一种机械细胞破碎方法,所用设备为球磨机,小球直径通常小于1 mm;经过搅拌器使得微藻细胞悬液与珠子之间充分混合,通过珠子与细胞之间的互相碰撞、剪切,造成细胞壁破裂促进胞内物质溶出[12](图1-a)。球磨法由于细胞破碎率高、通量高以及良好的温度控制而备受关注,且劳动力强度低、细胞破碎连续化程度高,易于工业化实施。迄今为止,使用球磨机破碎微藻细胞壁释放微藻蛋白等活性成分的研究多有报道。

a-球磨法;b-超声辅助法;c-高压均质法;d-脉冲电场法;e-离子液体法
图1 微藻蛋白质提取作用机理图
Fig.1 Mechanism of protein extraction from microalgae
ALAVIJEH等[13]为了提取小球藻蛋白质,采用球磨机对小球藻的细胞壁进行破碎处理,结果表明,仅0.5 min后,大约10%的可溶性蛋白质被释放出来。随着接触时间的增加,微珠与微藻细胞的接触面增加,导致更多的细胞破碎,8 min后可溶性蛋白的释放率达到40%。对球磨后得到的微藻蛋白进行了SDS-PAGE结果显示蛋白质组成并未发生变化,保留了蛋白质原有功能活性。该结果证实了球磨处理破坏微藻细胞壁的有效性,同时,球磨过程可以通过控制操作条件,保证微藻蛋白的结构不被破坏,保留其功能活性。SAFI等[14]在微拟球藻细胞破碎能耗及水溶性蛋白溶出的研究表明,球磨法在20 min内细胞破碎率达到95%以上,蛋白质提取率为53%,能量消耗小于0.5 kWh/kg微藻生物量。类似的效果在SUAREZ GARCIA等[15]的研究中也有体现,在0.433 kWh/kg微藻生物量的中低等能耗条件下,球磨8 min可在可溶性相中释放近95%的蛋白质。
球磨过程所用能耗较大,如何降低能耗,提高蛋白回收率是球磨过程的一大难题,往往需要大量的优化试验确定最佳的提取条件,珠料和尺寸、腔填充率、悬浮液浓度、搅拌速度、停留时间和喂料率都是重要的影响因素。LIU等[16]对球磨、离心和微过滤回收小球藻蛋白质的工艺条件进行了优化实验,得出球磨过程悬浮液浓度为60 g/L,温度10 ℃,离心裂解稀释液浓度为30 g/L,pH为7,温度20 ℃,微滤体积减小率为3时,蛋白回收率为12%,回收每克蛋白质的能量消耗为10 kWh。在球磨悬浮液浓度为90 g/L,pH为7,稀释液浓度为30 g/L,添加0.1 mol/L NaCl,温度20 ℃,微滤体积减小率为20时,蛋白回收率可达25%。POSTMA等[17]研究了珠子尺寸与蛋白质提取率的关系,颗粒越小,动力学速率越高,比能耗最小。此外,球磨过程的比能耗还与微藻的种类、干细胞质量浓度和微藻的培养条件有关[11]。珠磨处理具有温和高效的特点,但需冷却装置控制珠磨的温度,温度对微藻蛋白的功能活性有显著的影响[18]。
1.1.2 超声辅助提取
超声波处理技术由于在处理低剂量样品时操作简便、损失较少,在实验室已普遍应用于细胞破碎处理。超声波能用于破碎细胞壁归功于超声波产生的微尺度涡流和高效传质,以及气泡的生成、变大到最后的破碎形成的空化效应。超声波通过将微藻暴露于高强度的超声波而引起细胞破裂,致使液体介质细胞产生微小的不稳定的空化气泡,由于空化效应,气泡爆炸产生冲击波和能量,形成的高剪切力最终破坏刚性细胞壁并释放胞内物质(图1-b)[19]。
MITTAL等[20]首次报道了利用超声波法对大型海洋藻类中的藻红蛋白(R-phycoerythrin,R-PE)和藻蓝蛋白(R-phycocyanin,R-PC)进行初步提取。对超声处理进行优化后,其单独使用的蛋白提取率并不理想,因此考虑与其他方法联合使用。结果表明,当超声与其他常规一次提取方法联合使用时,观察到协同效应。与超声联合均质比单独均质可提高9.3%的效率。同样,浸软结合超声波处理比单独浸软处理的效率提高了31%。在所有提取方法中,浸软结合超声的提取效率最高,R-PE和R-PC的提取率分别为77%和93%,其次是超声均质(R-PE和R-PC的提取率分别为69.6%和74.1%)。采用高效液相色谱法分析,以确保提取物中存在R-PE,并在处理后仍保持完整。显微研究表明,在给定的初步提取方法中,藻胆蛋白的提取效率与细胞破坏程度之间存在明显的关系。这些组合方法可有效地从大藻中提取藻胆蛋白,类似的规律在微藻蛋白的提取中也同样适用。张会香等[21]比较了反复冻融法、超声波破碎法和超声结合反复冻融提取地木耳藻蓝蛋白的效果,当超声波辅助反复冻融法时,藻蓝蛋白的提取率是反复冻融法的3.8倍,超声波法的1.1倍。表明了超声波辅助的有效性。余佳等[22]通过比较直接水提法和超声波辅助水提法,证实了超声波辅助有助于葛仙米藻胆蛋白的提取。HILDEBRAND等[23]在超声辅助下,用0.4 mol/L NaOH溶液和4 mol/L HCl溶液连续溶剂萃取小球藻蛋白,蛋白回收率为(79.1±5.3)%,比未超声处理的对照组提高了1.32倍。同样,YOSHIDA 等[24]也证实了超声处理能够提高盐溶液对红藻中藻蓝蛋白的提取效率。刘习军[25]以超声辅助球磨机对微拟球藻进行破壁,超声波辅助使得球磨细胞破碎率达到95%的时间从35 min减少到了20 min,并降低了破壁过程的能耗。TAVAKOLI等[26]在试验中发现超声辅助溶剂提取藻蓝蛋白,相比于未经超声处理的对照组具有显著优势。并且,增加超声时间会提高藻蓝蛋白的浓度,但超声时间超过20 min,可能会造成藻蓝蛋白的降解,使产物含量下降。SOMMER等[27]在相同能耗下比较了反复冻融、脉冲电场、超声处理和火花放电提取微藻蛋白的效率,结果表明超声处理后的藻蛋白粗提液中浓度最高,达到53 mg/g。
超声处理的高效性已被广泛证实,然而超声过程会产生热效应,对微藻蛋白的稳定性有一定影响,同时,超声处理所需能耗高,常用于实验室少量样品的处理,实现工业化生产还需解决能量消耗的问题。
1.1.3 高压均质
高压均质是工业上常用的细胞破壁技术之一,其破壁主要是依靠细胞受到高速撞击力和高压剪切力,在突变压差及产生的气泡空化效应作用下最终使得细胞破裂[28](图1-c)。目前,高压均质技术具有较为成熟的工业设备,得到广泛应用。
ZHANG等[29]研究超声及高压均质对凯氏拟小球藻的破壁效率,超声处理后的微藻细胞体中出现了空隙、孔洞和微小裂缝,但该变化在扫描电镜图像中并不明显,而超声后再对微藻进行高压均质,可从扫描电镜图像中明显看出大多数细胞发生破裂,细胞壁丧失完整性,表明了高压均质破壁的高效性。此外,ZHANG等[30]比较了高压放电与高压均质对释放凯氏拟小球藻胞内化合物的影响,高压放电技术能有效提取微藻离子细胞组分及碳水化合物,但对蛋白的提取率不超过15%,而高压均质有利于所有组分的释放,其蛋白提取率是高压放电处理的4.9倍。该结论在证实高压均质的高效性同时,也显示出了高压均质技术对目标产物不具备选择性,因此可能会造成蛋白产品纯度不足,需要进一步纯化操作。
在CANELLI等[31]研究中,微藻细胞经高压均质(high pressure homogenization,HPH)处理后,平均直径由(5.1±0.1) μm减少到(2.0±0.1) μm,表明了该处理使微藻细胞发生解体,进一步支持了HPH是最有效的破壁方法之一,而且与酶处理相比,高压均质能获得更高的蛋白回收率以及脂质回收率。但是,高压均质获得的产品其氧化稳定性较差,因此如何获得稳定性更高的产品是高压均质需解决的问题。
高压均质的蛋白提取率与压力的选择有很大关系,在RUIZ-DOM NGUEZ等[32]研究中发现,随着压力增加,极大螺旋藻中藻蓝蛋白的提取率升高,但压力从1 400 bar增加到1 600 bar过程中藻蓝蛋白含量下降,在压力1 400 bar时获得藻蓝蛋白含量最高(291.9 mg/g)的粗提液。
NGUEZ等[32]研究中发现,随着压力增加,极大螺旋藻中藻蓝蛋白的提取率升高,但压力从1 400 bar增加到1 600 bar过程中藻蓝蛋白含量下降,在压力1 400 bar时获得藻蓝蛋白含量最高(291.9 mg/g)的粗提液。
高压均质法与多数传统方法相比具有易于扩大的显著优势,利于工业化大规模样品的处理。但是该法也存在对产物不具有选择性、只适用于低浓度藻液、高能耗以及对细胞壁坚固的微藻破壁效果差等问题。与其他方法联合使用可改善当前的不足,如ZHANG等[29]使用超声处理和高压均质联合可以提高提取效率并降低能耗。
1.1.4 脉冲电场
脉冲电场处理是依靠外部电场,使细胞壁达到临界电势,诱导细胞壁形成电穿孔,增加了细胞通透性,从而促进胞内物质的溶出[33](图1-d)。脉冲电场并不会破坏细胞结构。其作用效果与温度、介质电导率、电场强度等有关。CARULLO等[34]研究了处理强度、脉冲极性和入口温度对钝顶螺旋藻细胞中蛋白质和藻蓝蛋白等水溶性化合物的损伤和萃取效率的影响。当场强为20 kV/cm,能量输入从60 kJ/kg微藻悬浮液增加到100 kJ/kg微藻悬浮液时,上清液中蛋白质的含量增加了2.7倍。当能量输入为100 kJ/kg微藻悬浮液时,电场强度从10 kV/cm增加到20 kV/cm,蛋白质含量也会显著增加。这表明了蛋白质的释放与电场强度和能量输入强相关。这与张若兵等[35]的结论一致。
脉冲电场处理是一种温和的提取方式,只增加了细胞通透性,并未对细胞造成破坏,因此蛋白质提取率往往不高,但蛋白纯度较高。脉冲电场处理的提取效率与微藻种类有关。在CHITTAPUN等[36]的研究中,脉冲电场处理仅对念珠藻提取蛋白有效,而对颤藻无效。这与微藻的细胞壁结构有关,颤藻的细胞壁强度更大,因此脉冲处理的温和条件不能使蛋白质释放。LEONHARDT等[37]也证实了这一点,脉冲电场对具有刚性细胞壁结构的微藻,提取作用微乎其微。
为了提高产率,将脉冲电场与其他方法结合是一种有效的途径。CARULLO等[38]证实了高剪切均质与脉冲电场联合处理提取钝顶螺旋藻的蛋白质,其水溶性蛋白和藻蓝蛋白的提取率均比单独使用脉冲电场时要高。在CARULLO等[34]此前的研究中发现温和加热也有助于提高脉冲电场处理的提取率。K FERBÖCK等[39]报告了冻融和脉冲电场的协同作用,藻蓝蛋白的释放量是未脉冲电场处理3倍,藻蓝蛋白的回收率为90%,纯度达2.45,为高效提取提供了一种有效的选择。也有研究在脉冲电场处理前加入酶降解细胞壁,去除细胞壁后的蛋白质产量与仅脉冲电场处理相比增加了2倍以上[40]。
FERBÖCK等[39]报告了冻融和脉冲电场的协同作用,藻蓝蛋白的释放量是未脉冲电场处理3倍,藻蓝蛋白的回收率为90%,纯度达2.45,为高效提取提供了一种有效的选择。也有研究在脉冲电场处理前加入酶降解细胞壁,去除细胞壁后的蛋白质产量与仅脉冲电场处理相比增加了2倍以上[40]。
目前关于脉冲电场在微藻蛋白质提取方面的应用尚处于初步阶段,主要优势是处理条件温和,可选择性释放水溶性蛋白质,获得蛋白质的纯度高,节省了纯化步骤。然而该法存在提取率低,不适合大量样品的提取等问题,需要进一步研究脉冲电场处理的条件,以及考虑与其他方法的结合。
1.2 非机械法
1.2.1 反复冻融法
反复冻融法会使细胞内形成冰晶,剩余细胞液盐浓度增高,使细胞破裂,损坏细胞结构,释放细胞内目的产物。GHOSH等[41]在磷酸盐缓冲液中对螺旋藻分别进行反复冻融、超声波和人工破碎处理,其中冻融法获得的藻红蛋白回收率和纯度均最高,总蛋白回收率也最高。采用反复冻融法提取微藻蛋白时,不同浸泡时间、料液比、冻融时间以及不同冻融次数都会对微藻蛋白提取率产生影响。俞建峰等[42]在研究中发现反复冻融次数为4次时,藻蓝蛋白得率最高达到8.26%。罗爱国等[43]以钝顶螺旋藻藻粉为试验材料,采用反复冻融法提取藻蓝蛋白。结果表明4个因素影响效果为:冻融时间最大,其次是冻融次数、浸泡时间,最后是料液比,最优提取工艺条件为料液比1∶20(g∶mL)、浸泡时间22 h、冻融时间6 h、冻融次数6次。最优条件下藻蓝蛋白提取率可达近30%。CHITTAPUN等[36]用反复冻融法对2种不同的蓝藻进行处理,结果表明缓冲液浓度和冻融循环次数均对蛋白质提取率有显著影响,细胞壁结构较为简单的蓝藻仅需3次循环释放蛋白质的浓度和纯度即达最高值,而细胞壁结构更复杂的种类则需18个循环周期才可达最高浓度和纯度。冻融循环次数过高还会造成蛋白质的降解。因此对不同物种的微藻,冻融条件要具体考虑。类似的,GHOSH等[41]对反复冻融法提取螺旋藻藻红蛋白进行了响应面优化实验,证实了低摩尔浓度的缓冲液有利于藻红蛋白的提取,并且在0.1 mol/L磷酸盐缓冲液,pH为8,冻融循环7次时得到藻红蛋白回收率最高。朱孝晨[3]在螺旋藻藻粉中加入磷酸盐缓冲溶液浸提,经反复冻融后得到纯度为0.56的藻蓝蛋白粗提液,经纯化后,藻蓝蛋白回收率为83.81%,纯度1.08。
然而冻融法提取胞内蛋白耗时长,且不适用于大规模生产,只适合实验室小部分产品的处理。因为大量的藻类样品无法在短时间内冻融。在邱月[44]的研究中冻融法提取雨生红球藻蛋白时,耗时约36 h,提取率为30%,提取时间显著高于研磨法和高速匀浆法达到同等提取率的时长。使用冻融法提取蛋白时,为了提高得率,通常需要消耗大量溶剂。张文怡[8]通过研究发现,采用冻融法提取红毛菜藻红蛋白,达到与双酶法相同提取率时,冻融法需要消耗酶法10倍的溶剂量。此外,在SOMMER等[27]的研究中发现,冻融细胞密度较低时冻融法更为有效,而在实际生产中,低细胞密度往往不现实,高能耗也是阻碍实际应用的原因之一。
1.2.2 水酶法提取
水酶法最初应用于植物细胞油脂的提取,由于该法提取油脂后废水中存在大量蛋白质会造成环境污染,之后越来越多研究者们开始应用水酶法提取蛋白质。水酶法可以直接从湿藻中提取蛋白质,省去了干燥微藻的过程,减少了大量的能耗。此外,与传统的碱提法相比,酶法反应条件温和,而且不易引入杂质,且能更好地维持蛋白质的构型、构象和光学特性,具有专一性。例如,赵丽[45]用纤维素酶提取藻红蛋白,处理时长15 h,纯度可达0.37。
酶制剂的成本高是水酶法应用的一个主要问题,除了依靠固定化酶技术的发展,还可以与其他方法联合,减少酶的用量,从而降低酶制剂成本。TAVANANDI等[46]比较了酶法和表面活性剂提取藻蓝蛋白的效率,并分别结合超声处理,结果显示采用超声辅助溶菌酶提取藻蓝蛋白得率最高,为92.73 mg/g干物质,提取率为77.92%,纯度为1.09。FERREIRA-SANTOS等[47]采用欧姆加热和酶法联合提取可高效打破螺旋藻细胞壁,选择性地回收藻胆蛋白,与常规热提法相比,其产率提高了100%以上。
由于不同植物细胞壁组成不同,因此选用不同的酶提取微藻植物蛋白质时,效果也不相同。SIERRA等[48]比较了自溶酶、胰蛋白酶、溶菌酶和胶原蛋白酶4种酶对莱茵衣藻的破壁效果,通过显微分析得出自溶酶对莱茵衣藻细胞壁的破坏效果最好。溶菌酶也有一定的活性,但不如对富含糖蛋白的细胞壁有专一性的自溶酶效果显著。此外,研究还证实了自溶酶联合超声处理可以使蛋白质完全溶解。且自溶酶是由莱茵衣藻原位产生,极大降低了酶的成本。为了更高效地提取莱茵衣藻胞内蛋白质,SOTO-SIERRA等[49]做了进一步试验,选用原位产生的自溶酶打破莱茵衣藻细胞壁提取胞内蛋白质,经自溶酶处理后可释放50%的蛋白质,再经二级胰蛋白酶处理,蛋白质释放率达64%。该方法酶的专一性更高,降低了酶的成本,省去了能量消耗大的机械处理过程。
复合酶比单一酶在藻体组织细胞壁降解效果上更有优势[50],为微藻蛋白的规模化生产提供了新思路。施瑛等[51]比较了纤维素酶、果胶酶对紫菜藻红蛋白的提取效果,研究发现纤维素酶和果胶酶的最佳酶配比为7∶3的复合酶液提取效果更好,得率可达2.26%,纯度可达1.66。COELHO等[52]筛选了大量碳水化合物酶和硫酸盐酶,评估它们单独和联合使用时对钝顶螺旋藻的破壁能力,结果证实了溶菌酶和α-淀粉酶的混合酶处理破壁效果最显著,能够提高蛋白质的释放。CANELLI等[31]选用几丁质酶、鼠李糖水解酶和半乳糖酶组合对小球藻进行酶解,酶促处理释放的蛋白质由对照组的(49.2±3.9)%增加到(58.7±3.5)%。说明了复合酶解能够高效释放胞内蛋白,并且酶法能够保持细胞完整性,从而保证胞内化合物的稳定性。
水酶法在应用时,酶解效率受诸多因素的影响,如酶解时间、温度、pH等。温度和pH通过影响酶的活性进一步影响蛋白质的回收率。孙媛媛等[53]通过单因素试验,确定了蛋白酶酶解螺旋藻的最佳工艺条件:酶解pH为8,酶解时间24 h,温度100 ℃,此时蛋白回收率最高,为51.78%。
1.2.3 离子液体提取
离子液体是由有机阳离子和无机或有机阴离子构成的在室温下呈液态的有机盐,离子液体作为萃取溶剂相比于传统有机挥发性溶剂的主要优点是挥发性低,可重复使用,化学稳定性好。
离子液体有良好的溶解性能,会与蛋白质形成多种强相互作用,特别是氢键,使蛋白质在离子液体中的溶解度升高,从而增加蛋白质提取率(图1-e)。然而该方法离子液体成本高,反应时间长,因此有必要同其他预处理方式结合如球磨、超声波辅助提取、高压均质等,来降低提取时间和成本。MOTLAGH等[54]评估了6种离子液体对微拟球藻蛋白质提取的影响,与蒸馏水处理的对照组相比,添加离子液体能显著提高蛋白质的提取率。其中[Ch][Ac]效果最佳。为了解决离子液体成本高的问题,该研究在水介质中使用离子液体,同时增加了微波辅助提取,在最优条件下获得的蛋白质提取率为65.06%。RODRIGUES等[55]在试验中采用合成的质子离子液体对藻胆蛋白进行提取,其提取率比采用磷酸钠缓冲液和非质子离子液体更高,加以超声波辅助提取,在2-HEAA+2-HEAF为溶剂,萃取频率为25 kHz,pH为6.5,溶剂与生物量比为7.93 mg/L,提取时间为30 min时,得率最佳。LEE等[56]采用超声辅助离子液体提取小球藻蛋白质,并探索了离子液体浓度、超声时间、超声功率和藻浆浓度对得率的影响,在最优条件下蛋白质提取率为25.3%,释放率达到95%。
离子液体的回收再利用也是降低成本的方法之一。并且在FUJITA等[57]的研究中已证实回收再利用的离子液体对细胞的破碎能力不会下降。然而在RODRIGUES等[55]的研究中,采用(NH4)2SO4沉淀回收离子液体,回收后的离子液体再用于藻胆蛋白提取时,藻蓝蛋白和别藻蓝蛋白的得率受到了很大的影响,而对藻红蛋白几乎无影响,原因是由于回收溶剂中残留的(NH4)2SO4会使藻蓝蛋白沉淀,而只有在(NH4)2SO4饱和度高于80%时藻红蛋白才会受到影响[55]。因此,如何回收离子液体溶剂是亟待解决的问题。
2 新型微藻蛋白提取方法
除传统方法之外,超临界流体法、微射流处理法和阳离子聚合物涂膜法等新型细胞破碎方法具有环保、高效等优点,已被用于微藻油脂、叶黄素、β-胡萝卜素及其他生物活性成分的提取,在微藻蛋白提取方面也具有很大潜力。
2.1 超临界流体法
超临界流体是指流体处于超临界状态,此时流体具有类似于气体的黏度和扩散率,以及类似于液体的密度和溶解性[58]。CO2是一种惰性、无毒、环保、价廉的流体,其临界温度(31.3 ℃)和临界压力(72.9 bar)都较低,被广泛用作超临界流体[59]。超临界流体法破碎细胞是利用CO2等通过高压将其渗透入细胞内,再瞬时降压,利用细胞内外的突变压差使细胞发生破裂[18]。由于在降压过程中,流体体积增大,温度降低,因此避免了类似于超声、球磨等传统细胞破碎技术的局部过热现象,有效保护了胞内化合物的稳定。
在微藻生物分子的提取中,超临界流体法由于其萃取时间短、萃取效率高、绿色安全等优点被广泛应用于多不饱和脂肪酸[60]、维生素[61]等的回收。但对于极性化合物的提取,由于CO2的极性较低,提取率往往不理想,可以使用少量的CO2极性添加剂,例如,乙醇、正己烷等。在CHRONOPOULOU等[61]的研究中,用柠檬烯和甲醇作为超临界流体CO2共溶剂,从斜生栅藻中提取类胡萝卜素,可以提取到16.14%角黄素和1.25%叶黄素,而在仅使用CO2的条件下无法获得如此高的提取率。
在超临界流体法提取胞内活性物质过程中,温度、压力、处理时间、流体与生物量的比值以及共溶剂的增加等,均会影响目标产物的提取率。LORENZEN等[62]研究发现,在压力12 MPa、20 ℃和CO2与生物量的比值为100时,可从栅藻中获得高达92%油脂回收率。MORADI-KHEIBARI等[63]研究了不同萃取时间、压力、增加乙醇对小球藻脂质提取率的影响,结果表明,随着萃取压力的增加、萃取时间的延长和乙醇的增加,总脂质得率增加。然而,乙醇和温度的升高会导致蛋白质变性并转化为二级结构,这对于蛋白质的提取不利。因此利用超临界流体法提取微藻蛋白时,温和的萃取条件或有利于蛋白质的提取。
研究已证实了超临界流体法从微藻中回收活性物质的有效性,但较低的提取率需要进一步考虑操作条件的优化以及与其他方法的联合使用。此外,该法应用于微藻蛋白质的提取还需进一步探究。由于高成本和规模化问题,超临界流体法的商业化应用仍有待发展。
2.2 微射流处理法
微射流处理是一种新型的均质技术,与传统高压均质不同,该技术综合了水射流技术、冲击流技术和传统高压均质技术的优点,在微射流处理过程中,生物质受到强剪切、湍流、高速冲击、高频振动、瞬时降压和流体动力空化力的综合作用从而发生变化[64]。微射流处理方法采用微射流器,利用高压和细胞悬浮液在几何形状的相互作用腔内碰撞实现细胞结构的破裂。在破坏细胞结构时,常常选用相互作用腔为Z型结构的微射流器[65]。
微射流处理技术通过破坏细胞结构、减小颗粒尺寸、增加比表面积、提高液体物质的扩散速率等途径增加了多糖、多酚和黄酮类等化合物的释放,提高了提取效率,被认为是一种有效的提取胞内活性物质的方法[66-67]。CHA等[68]在模拟消化模型中,采用微射流处理法增加小球藻中类胡萝卜素的生物可及性,在20 000 psi的高压下进行微射流处理后,小球藻的平均粒径从2 463 nm显著降低至361 nm,可释放32.60%玉米黄素和18.19%β-胡萝卜素,与未处理组相比,类胡萝卜素的生物可及性增加了10倍以上。该结果证实了微射流处理技术能够有效地破坏小球藻细胞,有利于胞内化合物的释放。XIA等[69]利用微射流技术从碎米中提取蛋白质,加以酶辅助提取,可获得81.87%的蛋白回收率,且纯度高达87.89%,同时蛋白结构不发生改变。实验数据表明酶辅助微射流处理技术是一种温和有效的蛋白质提取方法,但目前尚未在微藻蛋白质的提取中应用,为后续提取微藻蛋白工艺研究提供了新的方向。
微射流的处理效率受相互作用腔流道设计、处理压力、循环次数、温度等的影响,可通过优化工艺参数有效地破裂细胞。STUPAK等[70]优化了微射流处理提取反硝化奈瑟氏菌胞内产物的工艺,对预处理时间、pH、细胞浓度等进行研究,发现在最佳条件下,细胞破坏率提高了2倍,胞内化合物产量提高了26%,1 g细胞可产生(113.2±8.2) mg蛋白质、(12.1±0.7) mg核酸以及(21.0±1.2) mg多糖等其他化合物。结果表明,将已知的预处理方法与破碎方法进行优化组合,可显著提高细胞破碎效率。
微射流处理技术耗时短,提取效率高,条件温和,不会造成生物活性物质的降解,同时不引入外源化学物质,可连续操作,安全环保,在细胞破碎方面有良好的前景。但该法设备成本高,处理量小,耗能高,目前较难实现工业化。此外,微射流处理技术在微藻蛋白提取方面的应用仍需探究,与酶法、预处理等其他方法联合使用或是一种有效提高产率、降低成本与能耗的途径。

2.3 阳离子聚合物涂膜法
阳离子聚合物涂膜法是一种新型细胞破碎技术,通过扰乱细胞的局部静电平衡使细胞发生破裂,该法温和高效,且聚合物可重复利用降低成本,在破裂微藻复杂的细胞壁方面已有应用。YOO等[71]使用涂有阳离子聚合物的功能膜,直接从湿微藻中提取细胞内脂质。使用一种涂有带正电荷的含叔胺聚合物的膜,扰乱微藻磷脂双分子层的静电平衡,诱导带负电荷的磷脂双分子层发生局部重排,引起细胞破裂,细胞破碎率达(25.6±2.2)%。阳离子聚合物涂膜法与其他方法联合使用,也是一种提高细胞破壁率的有效途径。在ZHENG等[72]的研究中,使用热聚合物协助酶裂解小球藻细胞壁,细胞破碎率高达68%。
GEJJI等[73]采用羧基功能化纤维素颗粒和鸡蛋清蛋白模拟藻细胞和藻蛋白,在不同pH条件下利用聚二烯丙基二甲基氯化铵(poly diallyl dimethyl ammonium chloride,polyDADMAC)在水-有机溶剂两相体系中,从藻细胞模型中选择性分离蛋白。实验结果显示,在水-己烷两相体系中,当pH值为4.5(接近蛋白质等电点)时,约75%的蛋白质被分离到水相中。此外,GEJJI等[74]还成功地利用polyDADMAC从小球藻湿藻中分理出蛋白质、脂质和色素。研究发现,悬浮粒子的等电点是决定各组分分离效率的关键,当水-正己烷体系的pH调整到接近大多数微藻蛋白质的等电点4时,可使80%的蛋白质保留在水相中。随着pH值接近碱度,微藻细胞碎片上的负电荷增加,使得95%的小球藻细胞碎片迁移到己烷相,同时脂质也被提取到正己烷相。该过程证实了polyDADMAC通过水-有机相从微藻中分离化合物的能力,说明了阳离子聚合物从微藻细胞碎片中选择性分离微藻蛋白质是一种有前景的技术,但目前相关研究不足,仍需进一步探究。
3 结论与展望
微藻蛋白质是一种新型蛋白质资源,且它们具有营养、调节机体健康等特性,在食品、化妆品、医疗保健方面有诸多应用。此外,微藻养殖周期短,不占用土地资源,同时微藻光合作用吸收CO2,对环境十分友好。因此,微藻的开发利用越来越深入。获取微藻胞内蛋白质的方法就是要打破细胞屏障,破坏微藻细胞壁。在破壁方法选择时,要综合考虑到蛋白质回收率、产品纯度、能量消耗以及活性物质在提取过程中不遭到破坏等问题。本文介绍的微藻蛋白提取方法各有优缺点(表2),但物理方法、化学方法、生物法之间的联合使用可能会提高破壁效率、产品得率和蛋白质纯度,降低能耗,减少成本,如超声辅助有机溶剂萃取,珠磨联合酶解等。随着微藻生物的开发利用,微藻蛋白质的提取有望取得更大突破。
[1] WANG B, LI Y Q, WU N, et al.CO2 bio-mitigation using microalgae[J].Applied Microbiology and Biotechnology, 2008, 79(5):707-718.
[2] SIDDIKI S Y A, MOFIJUR M, KUMAR P S, et al.Microalgae biomass as a sustainable source for biofuel, biochemical and biobased value-added products:An integrated biorefinery concept[J].Fuel, 2022, 307:121782.
[3] 朱孝晨. 钝顶螺旋藻藻蓝蛋白与多糖的制备及生物活性研究[D].烟台:烟台大学, 2018.
ZHU X C.Preparation and biological activity of phycocyanin and polysaccharide from Spirulina platensis[D].Yantai:Yantai University, 2018.
[4] GEADA P, MOREIRA C, SILVA M, et al.Algal proteins:Production strategies and nutritional and functional properties[J].Bioresource Technology, 2021, 332:125125.
[5] PRABAKARAN G, SAMPATHKUMAR P, KAVISRI M, et al.Extraction and characterization of phycocyanin from Spirulina platensis and evaluation of its anticancer, antidiabetic and antiinflammatory effect[J].International Journal of Biological Macromolecules, 2020, 153:256-263.
[6] 余程明, 屈思雨, 许怡宁, 等.钝顶螺旋藻蛋白提取物的延缓衰老功效研究[J].食品科技, 2018, 43(4):228-234.
YU C M, QU S Y, XU Y N, et al.Anti-aging effect of the Spirulina platensis protein extract[J].Food Science and Technology, 2018, 43(4):228-234.
[7] LIU P, CHOI J, LEE M, et al.Spirulina protein promotes skin wound repair in a mouse model of full-thickness dermal excisional wound[J].International Journal of Molecular Medicine, 2020, 46(1):351-359.
[8] 张文怡. 红藻中藻胆蛋白的分离纯化及应用[D].福州:福州大学, 2018.
ZHANG W Y.Separation, purification and application of phycobiliprotein in red algae[D].Fuzhou:Fuzhou University, 2018.
[9] RUMIN J, NICOLAU E, JUNIOR R G O, et al.Analysis of scientific research driving microalgae market opportunities in Europe[J].Marine Drugs, 2020, 18(5):264.
[10] KHAVARI F, SAIDIJAM M, TAHERI M, et al.Microalgae:Therapeutic potentials and applications[J].Molecular Biology Reports, 2021, 48(5):4757-4765.
[11] VAILETH T, KUDAKWASHE M, LI Z X, et al.A comprehensive review on the application of novel disruption techniques for proteins release from microalgae[J].Critical Reviews in Food Science and Nutrition, 2022, 62(16):4309-4325.
[12] PHONG W N, SHOW P L, LING T C, et al.Mild cell disruption methods for bio-functional proteins recovery from microalgae:Recent developments and future perspectives[J].Algal Research, 2018, 31:506-516.
[13] ALAVIJEH R S, KARIMI K, WIJFFELS R H, et al.Combined bead milling and enzymatic hydrolysis for efficient fractionation of lipids, proteins, and carbohydrates of Chlorella vulgaris microalgae[J].Bioresource Technology, 2020, 309:123321.
[14] SAFI C, CABAS RODRIGUEZ L, MULDER W J, et al.Energy consumption and water-soluble protein release by cell wall disruption of Nannochloropsis gaditana[J].Bioresource Technology, 2017, 239:204-210.
[15] SUAREZ GARCIA E, VAN LEEUWEN J, SAFI C, et al.Selective and energy efficient extraction of functional proteins from microalgae for food applications[J].Bioresource Technology, 2018, 268:197-203.
[16] LIU S L, GIFUNI I, MEAR H, et al.Recovery of soluble proteins from Chlorella vulgaris by bead-milling and microfiltration:Impact of the concentration and the physicochemical conditions during the cell disruption on the whole process[J].Process Biochemistry, 2021, 108:34-47.
[17] POSTMA P R, SUAREZ-GARCIA E, SAFI C, et al.Energy efficient bead milling of microalgae:Effect of bead size on disintegration and release of proteins and carbohydrates[J].Bioresource Technology, 2017, 224:670-679.
[18] 曾剑华, 杨杨, 石彦国, 等.适度破碎微藻细胞释放功能性蛋白的技术研究进展[J].食品工业科技, 2018, 39(17):319-327;334.
ZENG J H, YANG Y, SHI Y G, et al.Research progress on mild disruption technology of microalgae for functional protein releasing[J].Science and Technology of Food Industry, 2018, 39(17):319-327;334.
[19] GREENLY J M, TESTER J W.Ultrasonic cavitation for disruption of microalgae[J].Bioresource Technology, 2015, 184:276-279.
[20] MITTAL R, TAVANANDI H A, MANTRI V A, et al.Ultrasound assisted methods for enhanced extraction of phycobiliproteins from marine macro-algae, Gelidium pusillum (Rhodophyta)[J].Ultrasonics Sonochemistry, 2017, 38:92-103.
[21] 张会香, 陈晶晶, 杨世军, 等.地木耳细胞的破碎和藻蓝蛋白提取工艺的研究[J].食品工业, 2017, 38(10):112-116.
ZHANG H X, CHEN J J, YANG S J, et al.Study of cell breaking and extraction of phycocyanin from Nostoc cmmune[J].The Food Industry, 2017, 38(10):112-116.
[22] 余佳, 赵岚, 张瑞华, 等.葛仙米藻胆蛋白的提取工艺优化及其纯化研究[J].食品研究与开发, 2018, 39(2):82-89.
YU J, ZHAO L, ZHANG R H, et al.Research on optimization of phycobiliprotein extraction from Nostoc sphaeroids kutzing and the purification of phycobiliprotein[J].Food Research and Development, 2018, 39(2):82-89.
[23] HILDEBRAND G, POOJARY M M, O’DONNELL C, et al.Ultrasound-assisted processing of Chlorella vulgaris for enhanced protein extraction[J].Journal of Applied Phycology, 2020, 32(3):1709-1718.
[24] YOSHIDA C, MURAKAMI M, NIWA A N, et al.Efficient extraction and preservation of thermotolerant phycocyanins from red Alga Cyanidioschyzon merolae[J].Journal of Bioscience and Bioengineering, 2021, 131(2):161-167.
[25] 刘习军. 超声波辅助珠磨法破壁微拟球藻细胞[D].广州:华南理工大学, 2019.
LIU X J.Ultrasonic-assisted bead milling method for breaking the cell wall of Microcystis miconioides[D].Guangzhou:South China University of Technology, 2019.
[26] TAVAKOLI S, HONG H, WANG K, et al.Ultrasonic-assisted food-grade solvent extraction of high-value added compounds from microalgae Spirulina platensis and evaluation of their antioxidant and antibacterial properties[J].Algal Research, 2021, 60:102493.
[27] SOMMER M C, BALAZINSKI M, RATAJ R, et al.Assessment of phycocyanin extraction from Cyanidium caldarium by spark discharges, compared to freeze-thaw cycles, sonication, and pulsed electric fields[J].Microorganisms, 2021, 9(7):1452.
[28] YAP B H J, DUMSDAY G J, SCALES P J, et al.Energy evaluation of algal cell disruption by high pressure homogenisation[J].Bioresource Technology, 2015, 184:280-285.
[29] ZHANG R, GRIMI N, MARCHAL L, et al.Effect of ultrasonication, high pressure homogenization and their combination on efficiency of extraction of bio-molecules from microalgae Parachlorella kessleri[J].Algal Research, 2019, 40:101524.
[30] ZHANG R, GRIMI N, MARCHAL L, et al.Application of high-voltage electrical discharges and high-pressure homogenization for recovery of intracellular compounds from microalgae Parachlorella kessleri[J].Bioprocess and Biosystems Engineering, 2019, 42(1):29-36.
[31] CANELLI G, MURCIANO MART NEZ P, MAUDE HAUSER B, et al.Tailored enzymatic treatment of Chlorella vulgaris cell wall leads to effective disruption while preserving oxidative stability[J].LWT, 2021, 143:111157.
NEZ P, MAUDE HAUSER B, et al.Tailored enzymatic treatment of Chlorella vulgaris cell wall leads to effective disruption while preserving oxidative stability[J].LWT, 2021, 143:111157.
[32] RUIZ-DOM NGUEZ M C, J
NGUEZ M C, J UREGUI M, MEDINA E, et al.Rapid green extractions of C-phycocyanin from Arthrospira maxima for functional applications[J].Applied Sciences, 2019, 9(10):1987.
UREGUI M, MEDINA E, et al.Rapid green extractions of C-phycocyanin from Arthrospira maxima for functional applications[J].Applied Sciences, 2019, 9(10):1987.
[33] POSTMA P R, PATARO G, CAPITOLI M, et al.Selective extraction of intracellular components from the microalga Chlorella vulgaris by combined pulsed electric field-temperature treatment[J].Bioresource Technology, 2016, 203:80-88.
[34] CARULLO D, PATARO G, DONS F, et al.Pulsed electric fields-assisted extraction of valuable compounds from Arthrospira platensis:Effect of pulse polarity and mild heating[J].Frontiers in Bioengineering and Biotechnology, 2020, 8:551272.
F, et al.Pulsed electric fields-assisted extraction of valuable compounds from Arthrospira platensis:Effect of pulse polarity and mild heating[J].Frontiers in Bioengineering and Biotechnology, 2020, 8:551272.
[35] 张若兵, 傅贤, 寇梅如.高压脉冲电场对小球藻破碎效果的影响[J].高电压技术, 2016, 42(8):2668-2674.
ZHANG R B, FU X, KOU M R.Influence of high voltage pulsed electric fields on disrupture of Chlorella[J].High Voltage Engineering, 2016, 42(8):2668-2674.
[36] CHITTAPUN S, JONJAROEN V, KHUMRANGSEE K, et al.C-phycocyanin extraction from two freshwater cyanobacteria by freeze thaw and pulsed electric field techniques to improve extraction efficiency and purity[J].Algal Research, 2020, 46:101789.
[37] LEONHARDT L, K FERBÖCK A, SMETANA S, et al.Bio-refinery of Chlorella sorokiniana with pulsed electric field pre-treatment[J].Bioresource Technology, 2020, 301:122743.
FERBÖCK A, SMETANA S, et al.Bio-refinery of Chlorella sorokiniana with pulsed electric field pre-treatment[J].Bioresource Technology, 2020, 301:122743.
[38] CARULLO D, DONS F, FERRARI G, et al.Extraction improvement of water-soluble compounds from Arthrospira platensis through the combination of high-shear homogenization and pulsed electric fields[J].Algal Research, 2021, 57:102341.
F, FERRARI G, et al.Extraction improvement of water-soluble compounds from Arthrospira platensis through the combination of high-shear homogenization and pulsed electric fields[J].Algal Research, 2021, 57:102341.
[39] K FERBÖCK A, SMETANA S, DE VOS R, et al.Sustainable extraction of valuable components from Spirulina assisted by pulsed electric fields technology[J].Algal Research, 2020, 48:101914.
FERBÖCK A, SMETANA S, DE VOS R, et al.Sustainable extraction of valuable components from Spirulina assisted by pulsed electric fields technology[J].Algal Research, 2020, 48:101914.
[40] ‘T LAM G P, VAN DER KOLK J A, CHORDIA A, et al.Mild and selective protein release of cell wall deficient microalgae with pulsed electric field[J].ACS Sustainable Chemistry &Engineering, 2017, 5(7):6046-6053.
[41] GHOSH T, MISHRA S.Studies on extraction and stability of C-phycoerythrin from a marine Cyanobacterium[J].Frontiers in Sustainable Food Systems, 2020, 4:102.
[42] 俞建峰, 傅剑, 马潇, 等.细胞破壁对螺旋藻藻蓝蛋白提取效果的影响[J].食品与机械, 2017, 33(5):173-177.
YU J F, FU J, MA X, et al.Comparison of cell disruption methods for the extraction of Phycocyanin from Spirulina platensis[J].Food &Machinery, 2017, 33(5):173-177.
[43] 罗爱国, 范瑶瑶, 杨艳君, 等.多目标因素钝顶螺旋藻藻蛋白提取工艺分析[J].食品工业, 2021, 42(2):100-103.
LUO A G, FAN Y Y, YANG Y J, et al.Optimal extraction process analysis of Spirulina platensis protein based on multi-objective factors[J].The Food Industry, 2021, 42(2):100-103.
[44] 邱月. 雨生红球藻中藻蛋白制备工艺及其蛋白的结构与功能性研究[D].济南:济南大学, 2020.
QIU Y.Study on algae protein preparation process and protein structure and function in Haematococcus pluvialis[D].Jinan:University of Jinan, 2020.
[45] 赵丽. 藻胆蛋白清洁分离纯化技术研究[D].哈尔滨:哈尔滨工业大学, 2015.
ZHAO L.Study on clean separation and purification technology of phycobiliprotein[D].Harbin:Harbin Institute of Technology, 2015.
[46] TAVANANDI H A, RAGHAVARAO K S M S.Ultrasound-assisted enzymatic extraction of natural food colorant C-Phycocyanin from dry biomass of Arthrospira platensis[J].LWT, 2020, 118:108802.
[47] FERREIRA-SANTOS P, MIRANDA S M, BELO I, et al.Sequential multi-stage extraction of biocompounds from Spirulina platensis:Combined effect of ohmic heating and enzymatic treatment[J].Innovative Food Science &Emerging Technologies, 2021, 71:102707.
[48] SIERRA L S, DIXON C K, WILKEN L R.Enzymatic cell disruption of the microalgae Chlamydomonas reinhardtii for lipid and protein extraction[J].Algal Research, 2017, 25:149-159.
[49] SOTO-SIERRA L, WILKEN L R, DIXON C K.Aqueous enzymatic protein and lipid release from the microalgae Chlamydomonas reinhardtii[J].Bioresources and Bioprocessing, 2020, 7(1):1-14.
[50] 于娇, 胡晓, 杨贤庆, 等.海洋藻类藻胆蛋白的提取、纯化与应用研究进展[J].食品工业科技, 2018, 39(11):314-318;326.
YU J, HU X, YANG X Q, et al.Advances in extraction, purification and application of phycobiliprotein from marine algae[J].Science and Technology of Food Industry, 2018, 39(11):314-318;326.
[51] 施瑛, 裴斐, 周玲玉, 等.响应面法优化复合酶法提取紫菜藻红蛋白工艺[J].食品科学, 2015, 36(6):51-57.
SHI Y, PEI F, ZHOU L Y, et al.Optimization of phycoerythrin extraction from lavers by mixed enzymes using response surface methodology[J].Food Science, 2015, 36(6):51-57.
[52] COELHO D, LOPES P A, CARDOSO V, et al.A two-enzyme constituted mixture to improve the degradation of Arthrospira platensis microalga cell wall for monogastric diets[J].Journal of Animal Physiology and Animal Nutrition, 2020, 104(1):310-321.
[53] 孙媛媛, 郑雪君, 崔春, 等.螺旋藻蛋白酶解工艺的优化及螺旋藻肽的制备[J].中国调味品, 2019, 44(6):1-4.
SUN Y Y, ZHENG X J, CUI C, et al.Optimization of proteolysis technology of Spirulina platensis and preparation of Spirulina platensis peptides[J].China Condiment, 2019, 44(6):1-4.
[54] MOTLAGH S R, ELGHARBAWY A A, KHEZRI R, et al.Ionic liquid-based microwave-assisted extraction of protein from Nannochloropsis sp.biomass[J].Biomass Conversion and Biorefinery, 2023, 13(9):8327-8338.
[55] RODRIGUES R D P, DE CASTRO F C, DE SANTIAGO-AGUIAR R S, et al.Ultrasound-assisted extraction of phycobiliproteins from Spirulina (Arthrospira) platensis using protic ionic liquids as solvent[J].Algal Research, 2018, 31:454-462.
[56] LEE S Y, SHOW P L, LING T C, et al.Single-step disruption and protein recovery from Chlorella vulgaris using ultrasonication and ionic liquid buffer aqueous solutions as extractive solvents[J].Biochemical Engineering Journal, 2017, 124:26-35.
[57] FUJITA K, KOBAYASHI D, NAKAMURA N, et al.Direct dissolution of wet and saliferous marine microalgae by polar ionic liquids without heating[J].Enzyme and Microbial Technology, 2013, 52(3):199-202.
[58] CORR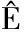 A P S, MORAIS W G Jr, MARTINS A A, et al.Microalgae biomolecules:Extraction, separation and purification methods[J].Processes, 2020, 9(1):10.
A P S, MORAIS W G Jr, MARTINS A A, et al.Microalgae biomolecules:Extraction, separation and purification methods[J].Processes, 2020, 9(1):10.
[59] ZHANG R, PARNIAKOV O, GRIMI N, et al.Emerging techniques for cell disruption and extraction of valuable bio-molecules of microalgae Nannochloropsis sp.[J].Bioprocess and Biosystems Engineering, 2019, 42(2):173-186.
[60] MOLINO A, MARTINO M, LAROCCA V, et al.Eicosapentaenoic acid extraction from Nannochloropsis gaditana using carbon dioxide at supercritical conditions[J].Marine Drugs, 2019, 17(2):132.
[61] CHRONOPOULOU L, DAL BOSCO C, DI CAPRIO F, et al.Extraction of carotenoids and fat-soluble vitamins from Tetradesmus obliquus microalgae:An optimized approach by using supercritical CO2[J].Molecules, 2019, 24(14):2581.
[62] LORENZEN J, IGL N, TIPPELT M, et al.Extraction of microalgae derived lipids with supercritical carbon dioxide in an industrial relevant pilot plant[J].Bioprocess and Biosystems Engineering, 2017, 40(6):911-918.
[63] MORADI-KHEIBARI N, AHMADZADEH H.Supercritical carbon dioxide extraction and analysis of lipids from Chlorella vulgaris using gas chromatography[J].Journal of the Iranian Chemical Society, 2017, 14(11):2427-2436.
[64] LI Y T, DENG L Z, DAI T T, et al.Microfluidization:A promising food processing technology and its challenges in industrial application[J].Food Control, 2022, 137:108794.
[65] MERT I D.The applications of microfluidization in cereals and cereal-based products:An overview[J].Critical Reviews in Food Science and Nutrition, 2020, 60(6):1007-1024.
[66] HUANG X Q, TU Z C, JIANG Y, et al.Dynamic high pressure microfluidization-assisted extraction and antioxidant activities of lentinan[J].International Journal of Biological Macromolecules, 2012, 51(5):926-932.
[67] ZHANG L, TU Z C, WANG H, et al.Response surface optimization and physicochemical properties of polysaccharides from Nelumbo nucifera leaves[J].International Journal of Biological Macromolecules, 2015, 74:103-110.
[68] CHA K H, KOO S Y, SONG D G, et al.Effect of microfluidization on bioaccessibility of carotenoids from Chlorella ellipsoidea during simulated digestion[J].Journal of Agricultural and Food Chemistry, 2012, 60(37):9437-9442.
[69] XIA N, WANG J M, GONG Q, et al.Characterization and in vitro digestibility of rice protein prepared by enzyme-assisted microfluidization:Comparison to alkaline extraction[J].Journal of Cereal Science, 2012, 56(2):482-489.
[70] STUPAK R, MAKAUSKAS N, RADZEVI IUS K, et al.Optimization of intracellular product release fromNeisseria denitrificans Using microfluidizer[J].Preparative Biochemistry and Biotechnology, 2015, 45(7):667-683.
IUS K, et al.Optimization of intracellular product release fromNeisseria denitrificans Using microfluidizer[J].Preparative Biochemistry and Biotechnology, 2015, 45(7):667-683.
[71] YOO G, YOO Y, KWON J H, et al.An effective, cost-efficient extraction method of biomass from wet microalgae with a functional polymeric membrane[J].Green Chemistry, 2014, 16(1):312-319.
[72] ZHENG Y, XIAO R, ROBERTS M.Polymer-enhanced enzymatic microalgal cell disruption for lipid and sugar recovery[J].Algal Research, 2016, 14:100-108.
[73] GEJJI V, FERNANDO S D.Simultaneous separation of carboxyl functionalized cellulose and egg albumin using ionic polyelectrolytes in an aqueous-organic multi-phase system[J].Separation and Purification Technology, 2020, 237:116316.
[74] GEJJI V, LACEY R, FERNANDO S D.The use of polyelectrolytes for simultaneous dewatering and fractionation of microalgal proteins, lipids, and pigments[J].Algal Research, 2019, 44:101675.