近年来,随着聚酰胺产品需求量在全球范围内的迅速增长[1],戊二胺作为己二胺结构类似物[2],可与己二酸聚合制备性能优良的新型生物基聚酰胺PA56,可解决由石油为原料的化学生产制备己二胺所导致的能源短缺和环境污染等问题[3]。戊二胺应用广泛,如在农业上,其作为“第二信使”可调节植物延缓衰老、促进植物开花结实[4-5]等;在医药领域,其可作为一种治疗痢疾的有效药物[6];还参与微生物细胞内铁离子浓度的调节及关闭微生物蛋白通道等[7-9]。目前,利用微生物生产戊二胺已成为研究的热点[10-11]。
赖氨酸脱羧酶是一种折叠型I型5′-磷酸吡哆醛依赖酶[12],催化L-赖氨酸生产戊二胺,存在于植物[13]、动物[14]和各种微生物中[15-19]。2011年,KANJEE等[20-21]发现pH值为5.5时,大肠杆菌CadA具有高催化活性,但在碱性条件下,CadA的催化活性和稳定性显著降低,不利于戊二胺(强碱)的生产。2016年,李乃强等[22]对产酸克雷伯氏菌的赖氨酸脱羧酶进行异源表达并研究其酶学性质,结果表明,粗酶最适pH为5.5,随着pH增加,酶活力逐渐降低。另外,鉴于已报道的赖氨酸脱羧酶对其酶学性质研究的尚不多见,因此,开展赖氨酸脱羧酶酶学性质的研究,不仅可以丰富数据库,而且还为获得具有碱性条件下稳定和高催化活性的赖氨酸脱羧酶,实现高产戊二胺奠定基础。
本文主要通过克隆来源于大肠杆菌K12 MG1655中经过密码子优化后的赖氨酸脱羧酶基因,将该基因在E.coli BL21(DE3)中进行异源表达,利用pET-28a(+)中的His标签分离纯化重组酶Ldc,并对其进行酶学性质研究。本研究将为后期该酶的分子改造及工业化生产应用提供科学基础。
1 材料与方法
1.1 材料
大肠杆菌(Escherichia coli)BL21(DE3)由本实验室鉴定及保存;质粒载体pET-28a(+),上海生工生物工程有限公司;限制性内切酶BamH I和Hind III,美国New England Biolabs公司;质粒抽提试剂盒,南京诺唯赞生物科技股份有限公司;DL10000 DNA Marker、蛋白质电泳Marker、6×loading Buffer、5×蛋白上样缓冲液,TaKaRa有限公司;异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG),纯度>99.9%,Calbiochem公司;Ni-Agarose His标签蛋白纯化试剂盒,北京康为世纪生物科技有限公司;L-赖氨酸,上海源叶生物科技有限公司;乙腈(HPLC级,>99.99%),北京迈瑞达科技有限公司;丹磺酰氯,ACMEC/吉至生化公司;其他试剂为国产或进口分析纯;PCR引物合成及测序由北京擎科生物科技有限公司武汉分公司完成。
1.2 实验方法
1.2.1 重组表达载体的构建及验证
通过在苏州金唯智公司进行全基因合成大肠杆菌K12 MG1655中赖氨酸脱羧酶基因序列,经过密码子优化后,本文中涉及到的引物如表1所示,添加BamH I和Hind III酶切位点,将基因克隆至表达载体pET-28a(+),并转化大肠杆菌BL21(DE3)中,转化后,取适量菌液涂布在含50 μg/mL卡那霉素的LB培养基平板上,37 ℃避光培养,挑取正确的克隆宿主进行培养,使用质粒抽提试剂盒提取重组质粒pET-28a(+)-Ldc(图1),用内切酶进行双酶切验证,命名为重组菌株E.coli BL21(DE3)/pET-28a(+)-Ldc。

图1 重组表达载体pET-28a(+)-Ldc结构示意图
Fig.1 Structural diagram of the recombinant expression vector pET-28a(+)-Ldc
表1 本研究使用到的引物
Table 1 Primers used in this study
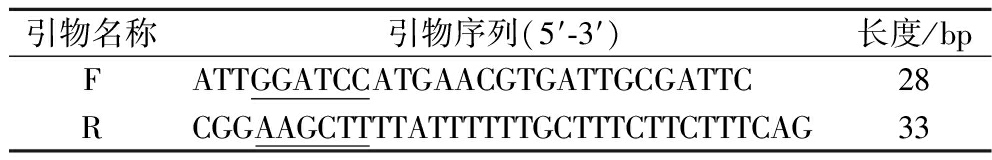
引物名称引物序列(5′-3′)长度/bpFATTGGATCCATGAACGTGATTGCGATTC28RCGGAAGCTTTTATTTTTTGCTTTCTTCTTTCAG33
注:下划线为限制性内切酶位点。
1.2.2 重组菌株培养
挑取在卡那霉素抗性LB平板培养基上,含有重组表达质粒的单菌落接入含50 μg/mL卡那霉素的10 mL LB液体培养基中,37 ℃、200 r/min过夜培养,作为种子液。按OD600值为4的比例接种至100 mL摇瓶培养基中,23 ℃、200 r/min培养至OD600为0.6左右,加入IPTG使终浓度为0.5 mmol/L,23 ℃诱导16~18 h,表达目的蛋白。8 000 r/min离心10 min收集菌体细胞,用缓冲液洗涤后,-80 ℃备用。
1.2.3 赖氨酸脱羧酶Ldc纯酶制备
所有的纯化步骤均在冰水浴下进行。将离心收集的菌体细胞悬浮于缓冲液中(20 mmol/L Tris-HCl,10 mmol/L咪唑,0.5 mol/L NaCl,100 mmol/L PMSF,pH 7.2),超声波破碎30 min(工作4 s,停6 s),4 ℃、10 000 r/min离心10 min取上清液。
粗酶液使用Ni-Agarose柱分离纯化,将具有His标签的目的蛋白上清液经0.45 μm滤膜过滤后上柱,分别用10倍柱体积Binding Buffer(20 mmol/L Tris-HCl,20~500 mmol/L咪唑,0.5 mol/L NaCl,pH 7.2)进行洗杂洗脱,并按每1 mL流出液分管收集,保存于4 ℃备用。蛋白样品经SDS-PAGE检测,记录并分析结果。
1.2.4 蛋白的分析与测定
重组蛋白分析采用SDS-PAGE[23],考马斯亮蓝R-250染色显示蛋白条带;采用Bradford法[24]测定蛋白浓度。
1.2.5 重组酶Ldc活力测定方法
采用高效液相色谱仪定量检测赖氨酸脱羧酶的酶活力。测定方法:总反应体积1 mL,包括600 μL 100 mmol/L磷酸盐缓冲液(pH 7.0)及200 μL 25 mmol/L L-赖氨酸缓冲液,加入5′-磷酸吡哆醛至终浓度为0.1 mmol/L,温育5 min,最后加入100 μL纯酶液,在37 ℃反应30 min,煮沸5 min终止反应,离心取上清液进行衍生反应,HPLC测定戊二胺生成量。酶活力定义:在37 ℃、pH 7.0条件下,每1 min催化生成1 μmol戊二胺所需的酶量定义为1 U。并按公式(1)计算酶活力:
酶活力![]()
(1)
式中:c,戊二胺的浓度,μmol/L;V总,总反应体积,mL;t,反应时间,min;V,酶液添加体积,mL。
1.2.6 戊二胺测定方法
参照文献[25]的方法,稍加修改。取400 μL待测样品溶液于2 mL容量瓶中,加入40 μL 2 mol/L NaOH溶液和120 μL饱和NaHCO3溶液,振荡10 s,加入800 μL丹磺酰氯溶液,振荡混匀,40 ℃避光反应45 min。衍生反应完毕后,在混合液中加入40 μL氨水,混匀,静置30 min进行终止反应,用乙腈定容,振荡混匀,用2 mL注射器吸取适量溶液,0.22 μm滤膜过滤至进样小瓶中,HPLC测定。
色谱柱C18反相色谱柱(250 mm×4.6 mm,5 μm);流动相V(乙腈)∶V(0.1 mol/L乙酸铵)=8∶2;柱温35 ℃;流速1 mL/min;检测波长254 nm;进样量20 μL。
1.2.7 重组酶Ldc的酶学性质研究
1.2.7.1 重组酶Ldc的pH稳定性考察
分别将纯酶液溶解于pH 4.0~10.0(pH 4.0、5.0、5.7、6.0采用柠檬酸-柠檬酸钠体系;pH 7.0、8.0采用磷酸盐体系;pH 9.0、10.0采用甘氨酸-NaOH体系)的100 mmol/L缓冲液中,37 ℃保温2 h,按照1.2.5节的方法测定不同pH值下赖氨酸脱羧酶Ldc的相对酶活力,考察此酶的pH稳定性。
1.2.7.2 重组酶Ldc的温度稳定性考察
取适量纯酶液,采用pH 7.0的磷酸盐缓冲液,置于20~80 ℃条件下保温2 h,按照1.2.5节的方法测定不同温度下赖氨酸脱羧酶Ldc的酶残留活性,考察温度对酶稳定性的影响。
1.2.7.3 不同金属离子对纯酶酶活力的影响
在反应体系中分别加入终浓度为5 mmol/L的金属离子(Mn2+、Mg2+、Co2+、Fe2+、Cu2+、Ni2+、Ca2+),测定相对酶活力,研究金属离子对赖氨酸脱羧酶的影响,以不加金属离子的作为空白对照。
1.2.7.4 重组酶Ldc的动力学参数Km、Vmax、kcat和催化特异性常数kcat/Km测定
在Ldc最适pH值下的酶反应体系中加入0.25~1.25 mmol/L等不同浓度的L-赖氨酸,测定在一定时间(保证酶的催化处于一级动力学范围内)内生成戊二胺的量,以此来计算赖氨酸脱羧酶的反应速率。利用Lineweaver-Burk双倒数作图,计算出此酶的Km、Vmax值。依据1.2.4节的方法测定酶的蛋白含量。酶的转换数kcat是一个催化常数,可以根据公式kcat=Vmax/[Et]计算得出。其中,[Et]表示酶的初始总浓度。kcat/Km值是衡量酶的催化效率参数,又称特异性常数。
2 结果与分析
2.1 赖氨酸脱羧酶Ldc在大肠杆菌中的诱导表达与重组酶的纯化
2.1.1 重组质粒pET-28a(+)-Ldc的验证
对正确的阳性克隆重组质粒pET-28a(+)-Ldc经BamH Ⅰ和Hind Ⅲ双酶切,1.0%琼脂糖凝胶电泳分析,结果如图2所示,可见有2条带,一条为载体片段,约5.3 kb;另一条为目的基因片段,约2.1 kb,插入的外源片段大小与预期相符,全长为2 148 bp,包含715个氨基酸的编码序列。

M-DL 10000 DNA Marker;1,2-BamH Ⅰ和Hind Ⅲ双酶切重组质粒pET-28a(+)-Ldc
图2 重组质粒pET-28a(+)-Ldc的酶切电泳图谱
Fig.2 Digestion electrophoresis of the recombinant expression plasmid pET-28a(+)-Ldc
2.1.2 咪唑洗脱浓度的探索
将湿菌体细胞超声波破碎后进行SDS-PAGE检测蛋白表达情况。由于目的蛋白N端融合的His-Tag与咪唑可以竞争性结合在氮基三乙酸表面,因此通过改变咪唑浓度,可以调节蛋白质在镍柱上的结合或洗脱。使用Ni-Agarose柱,并采用不同咪唑浓度(50、100、200、300、400、500 mmol/L)的缓冲液进行洗脱并收集洗脱液。由图3可知,50 mmol/L咪唑缓冲液能洗下大部分杂蛋白和目的蛋白,咪唑缓冲液浓度在200 mmol/L时洗出全部目的蛋白。因此,采用含有20 mmol/L咪唑的缓冲液充分洗涤杂蛋白,然后再使用200 mmol/L咪唑的缓冲液洗脱目的蛋白。此外,诱导的重组菌破碎的上清液和沉淀中均出现蛋白条带,结合Ldc的蛋白质数据,则为81.2 kDa,由此可知,该赖氨酸脱羧酶在宿主菌大肠杆菌BL21(DE3)中表达成功,但少部分以包涵体形式不可溶表达。
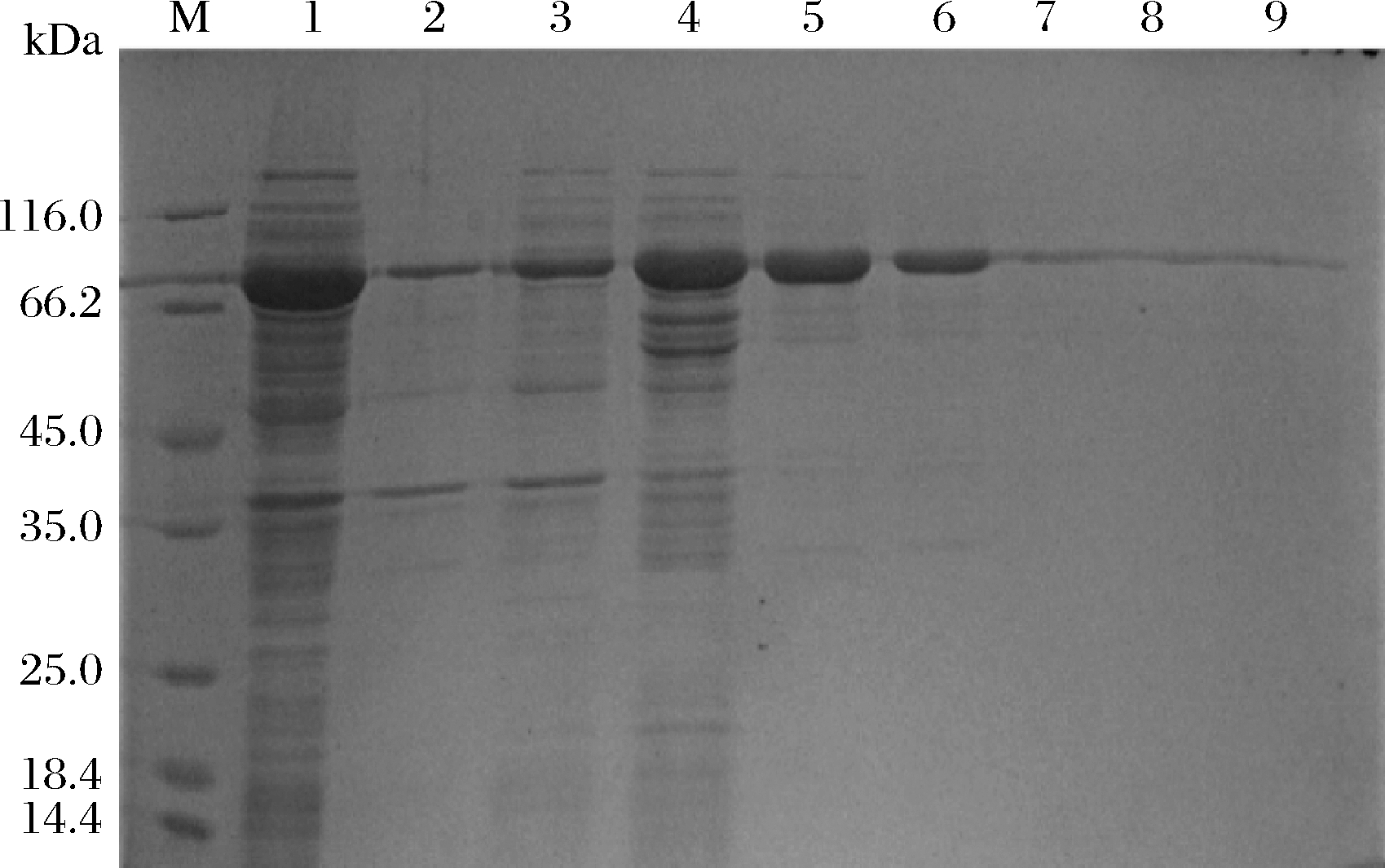
M-蛋白Marker;1-粗酶液;2-诱导重组菌破碎沉淀;3-镍柱流穿液;4~9:50、100、200、300、400、500 mmol/L咪唑洗脱液
图3 目的蛋白Ldc咪唑洗脱结果
Fig.3 Imidazole elution of the Ldc protein
2.1.3 目的蛋白SDS-PAGE检测
采用1.2.2节重组菌株诱导培养的湿菌体细胞,按照1.2.3节的方法经Ni-Agarose柱亲和层析纯化后,与重组菌菌体破壁上清液相比,纯化后的目的蛋白条带较单一(图4泳道5)。洗脱液总蛋白含量为15.99 mg,比酶活力为0.56 U/mg。

M-蛋白Marker;1-粗酶液;2-镍柱流穿液;3,4-镍柱洗杂液;5-洗脱液
图4 重组蛋白纯化样品的SDS-PAGE图谱
Fig.4 SDS-PAGE pattern of the recombinant protein
2.2 重组酶Ldc的酶学性质研究
2.2.1 重组酶Ldc的pH稳定性考察
本研究考察重组酶Ldc在pH 4.0~10.0的纯酶酶活力变化。由图5可知,重组酶Ldc在pH 5.7~8.0,相对酶活力保持80%上,说明该酶稳定性较好,具有很好的pH适应性。在pH低于5.7和高于8.0条件下,重组酶相对酶活力下降较快,表明在实际操作中要控制好催化环境的酸碱性。KIM等[26]报道来自肺炎克雷伯菌的赖氨酸脱羧酶LdcC也采用His标签表达重组得到,其酶pH稳定范围较窄,最稳定的pH值为7.0。重组酶Ldc耐酸碱性的能力为该酶的分子改造提供了依据。

图5 重组酶Ldc的pH稳定性
Fig.5 pH stability of the recombinant carbonyl reductase Ldc
2.2.2 重组酶Ldc的温度稳定性考察
由图6可知,该酶在20~60 ℃的温度范围内稳定性很好,相对酶活力保持在80%以上,但温度达到60 ℃以上,酶稳定性下降很快,图6显示,重组酶T50值为72 ℃,经验证,72.1 ℃时重组酶活力降低为原来的50%,表明该酶的耐热稳定性较好。OSIRE等[27]报道来自氧化葡糖杆菌DSM3504的赖氨酸脱羧酶(GoLDC)采用His-TrapTMHP色谱柱的AKTA Prime系统纯化蛋白,其酶的温度稳定性范围跟本研究基本一致,最适温度为30 ℃。
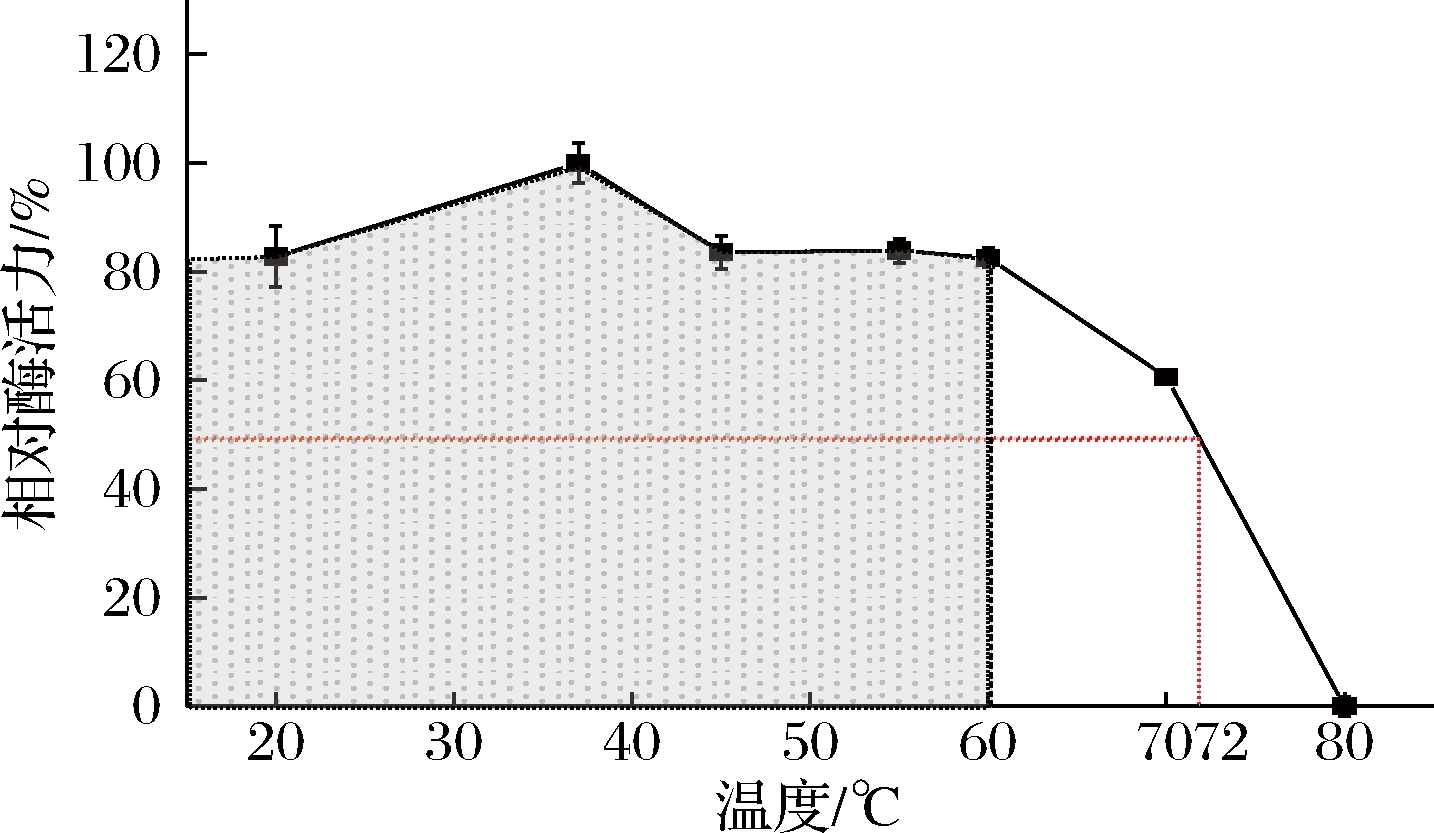
图6 重组酶Ldc温度稳定性
Fig.6 Temperature stability of the recombinant carbonyl reductase Ldc
2.2.3 金属离子对重组酶Ldc活性的影响
很多酶促反应需要金属离子作为辅因子,因此在酶促反应中经常添加某金属离子来促进或抑制酶促反应的进行。由图7可知,赖氨酸脱羧酶的酶活力在一定浓度下受金属离子的影响较大。在终浓度为5 mmol/L条件下,除Mg2+和Ca2+外,其他5种金属离子均对赖氨酸脱羧酶具有抑制影响。抑制作用最明显的是Cu2+,其次是Ni2+。而Mg2+和Ca2+对赖氨酸脱羧酶有微弱的激活作用。杨颖等[28]研究发现,属于肺炎克雷伯杆菌属的菌株GXW-1在5 mmol/L的Cu2+作用下,强烈抑制了酶活性,相对酶活力下降到初始酶活力的20%以下,这与本研究结果大体一致。因此,我们认为赖氨酸脱羧酶可能存在结合位点能够与这些金属离子结合,从而改变了酶的构象并影响了酶的活性。

图7 金属离子对重组酶Ldc活力的影响
Fig.7 Effect of metal ions on the activity of Ldc
2.2.4 重组酶Ldc的动力学参数及催化特性参数
在酶促反应体系中设定不同的L-赖氨酸浓度梯度,在一定反应时间内使其成为酶促反应的限制因素。利用Lineweaver-Burk双倒数作图,计算出此酶的Km为0.011 mol/L,Vmax值为0.643 mmol/(L·min),比活力为0.56 U/mg,酶的转换数kcat经计算为0.23 s-1,kcat/Km值为20.91 L/(mmol·s)。
3 结论
本实验在大肠杆菌BL21(DE3)中成功实现了经过密码子优化的大肠杆菌K12 MG1655中赖氨酸脱羧酶Ldc基因的异源表达。结果表明,该赖氨酸脱羧酶Ldc的基因序列全长2 148 bp,编码715个氨基酸,重组酶分子质量大小在81.2 kDa左右。采用Ni-Agarose亲和层析对重组酶Ldc分离纯化后,对底物L-赖氨酸的比活力为0.56 U/mg。重组酶Ldc适宜pH范围在5.7~8.0,随着戊二胺的生产,有利于在生产过程中,减少酸性缓冲液的加入,既节省试剂,又利于后期产品纯化和提高产品质量,此外,还可通过分子定向进化进一步提升其适应范围。重组酶Ldc在60 ℃以下稳定性很好,相对酶活力保持在80%以上,但随着温度的升高,酶稳定性下降很快。常见金属离子实验表明,Cu2+对该酶的抑制作用最强,Mg2+和Ca2+却有微弱的激活作用。后期将对该酶进行分子改造,筛出高酶活力的突变菌株,并研究其酶学性质及产物戊二胺的初步分离纯化,为工业化生产及应用提供重要的基础数据。
[1] 李秀峥, 李澜鹏, 曹长海, 等.生物基聚酰胺及其单体研究进展[J].工程塑料应用, 2018, 46(7):138-141;145.
LI X Z, LI L P, CAO C H, et al.Research progress of bio-based polyamide and its monomer[J].Engineering Plastics Application, 2018, 46(7):138-141;145.
[2] 李东霞, 黎明, 王洪鑫, 等.生物法合成戊二胺研究进展[J].生物工程学报, 2014, 30(2):161-174.
LI D X, LI M, WANG H X, et al.Progress in biosythesis of diaminopentane[J].Chinese Journal of Biotechnology, 2014, 30(2):161-174.
[3] 陈建新, 马海燕, 徐燕, 等.生物基聚己二酸戊二胺(PA56)纤维的研究进展[J].化工新型材料, 2021, 49(S1):286-288.
CHEN J X, MA H Y, XU Y, et al.Research advance on bio-based polypentanediamineadipate(PA56) fiber[J].New Chemical Materials, 2021, 49(S1):286-288.
[4] 王晓云, 邹琦.多胺与植物衰老关系研究进展[J].植物学通报, 2002, 37(1):11-20.
WANG X Y, ZOU Q.Advances in studies on relationship between polyamines and plant senescence[J].Chinese Bulletin of Botany, 2002, 37(1):11-20.
[5] 陈学好, 于杰, 李伶利.高等植物开花结实的多胺研究进展[J].植物学通报, 2003, 38(1):36-42.
CHEN X H, YU J, LI L L.Advances in study on polyamines during flowering and fruit setting and development in higher plants[J].Chinese Bulletin of Botany, 2003, 38(1):36-42.
[6] CASALINO M, CARMELA LATELLA M, PROSSEDA G, et al.Molecular evolution of the lysine decarboxylase-defective phenotype in Shigella sonnei[J].International Journal of Medical Microbiology, 2005, 294(8):503-512.
[7] FRANCISCO F, JAVIER R, JUAN M.Characterization of the iron-regulated desA promoter of Streptomyces pilosus as a system for controlled gene expression in actinomycetes[J].Microbial Cell Factories, 2003, 2(1):5.
[8] DELAVEGA A L, DELCOUR A H.Cadaverine induces closing of E.coli porins[J].The EMBO Journal, 1995, 14(23):6058-6065.
[9] IGARASHI K, KASHIWAGI K.Modulation of cellular function by polyamines[J].The International Journal of Biochemistry &Cell Biology, 2010, 42(1):39-51.
[10] MA W C, CAO W J, ZHANG H, et al.Enhanced cadaverine production from L-lysine using recombinant Escherichia coli co-overexpressing CadA and CadB[J].Biotechnology Letters, 2015, 37(4):799-806.
[11] OH Y H, KANG K H, KWON M J, et al.Development of engineered Escherichia coli whole-cell biocatalysts for high-level conversion of L-lysine into cadaverine[J].Journal of Industrial Microbiology &Biotechnology, 2015, 42(11):1481-1491.
[12] 刘思敏, 齐海山.赖氨酸脱羧酶分子改造及固定化合成1, 5-戊二胺研究进展[J].生物工程学报, 2022, 38(12):4403-4419.
LIU S M, QI H S.Research progress on molecular modification and immobilization of lysine decarboxylase to synthesize 1, 5-pentanediamine[J].Chinese Journal of Biotechnology, 2022, 38(12):4403-4419.
[13] GIBBS N M, SU S H, LOPEZ-NIEVES S, et al.Cadaverine regulates biotin synthesis to modulate primary root growth in Arabidopsis[J].The Plant Journal, 2021, 107(5):1283-1298.
[14] HAMANA K, MATSUZAKI S, INOUE K.Changes in polyamine levels in various organs of Bombyx mori during its life cycle[J].The Journal of Biochemistry, 1984, 95(6):1803-1809.
[15] CHEN W, KAI Z, CHEN Z J, et al.Directed evolution and mutagenesis of lysine decarboxylase from Hafnia alvei AS1.1009 to improve its activity toward efficient cadaverine production[J].Biotechnology and Bioprocess Engineering, 2015, 20(3):439-446.
[16] YAMAMOTO Y, MIWA Y, MIYOSHI K, et al.The Escherichia coli ldcC gene encodes another lysine decarboxylase, probably a constitutive enzyme[J].Genes &Genetic Systems, 1997, 72(3):167-172.
[17] TAKATSUKA Y, YAMAGUCHI Y, ONO M, et al.Gene cloning and molecular characterization of lysine decarboxylase from Selenomonas ruminantium delineate its evolutionary relationship to ornithine decarboxylases from eukaryotes[J].Journal of Bacteriology, 2000, 182(23):6732-6741.
[18] 寇凤雨. L-赖氨酸脱羧酶的酶学性质及其应用研究[D].上海:华东理工大学, 2016.
KOU F Y.Enzymatic properties and application of L-lysine decarboxylase[D].Shanghai:East China University of Science and Technology, 2016.
[19] HAN L F, YUAN J J, AO X L, et al.Biochemical characterization and phylogenetic analysis of the virulence factor lysine decarboxylase from Vibrio vulnificus[J].Frontiers in Microbiology, 2018, 9:3082.
[20] KANJEE U, GUTSCHE I, ALEXOPOULOS E, et al.Linkage between the bacterial acid stress and stringent responses:The structure of the inducible lysine decarboxylase[J].The EMBO Journal, 2011, 30(5):931-944.
[21] KANJEE U, GUTSCHE I, RAMACHANDRAN S, et al.The enzymatic activities of the Escherichia coli basic aliphatic amino acid decarboxylases exhibit a pH zone of inhibition[J].Biochemistry, 2011, 50(43):9388-9398.
[22] 李乃强, 于丽珺, 徐岩.产酸克雷伯氏菌赖氨酸脱羧酶的异源表达及粗酶性质[J].生物工程学报, 2016, 32(4):527-532.
LI N Q, YU L J, XU Y.Heterologous expression and characterization of Klebsiella oxytoca lysine decarboxylase[J].Chinese Journal of Biotechnology, 2016, 32(4):527-532.
[23] 刘宇轩. 基于赖氨酸脱羧酶的高纯度戊二胺的合成工艺开发[D].天津:天津大学, 2020.
LIU Y X.Development of synthesis process of high purity pentanediamine based on lysine decarboxylase[D].Tianjin:Tianjin University, 2020.
[24] ZHANG L, LU X Z, HAN F, et al.Purification and refolding of a novel β-agarase from inclusion body of E.coli[J].Journal of Ocean University of China, 2007, 6(1):80-84.
[25] 乔长晟, 林青, 张娟琨, 等.L-赖氨酸脱羧酶活力测定方法的研究[J].现代食品科技, 2013, 29(1):189-192.
QIAO C S, LIN Q, ZHANG J K, et al.A method for assay of the activity of L-lysine decarboxylase[J].Modern Food Science and Technology, 2013, 29(1):189-192.
[26] KIM J H, KIM H J, KIM Y H, et al.Functional study of lysine decarboxylases from Klebsiella pneumoniae in Escherichia coli and application of whole cell bioconversion for cadaverine production[J].Journal of Microbiology and Biotechnology, 2016, 26(9):1586-1592.
[27] OSIRE Tolbert, 杨套伟, 乔郅钠, 等.赖氨酸脱羧酶分子改造及其催化合成戊二胺[J].食品与发酵工业, 2022, 48(1):8-14.
OSIRE T, YANG T W, QIAO Z N, et al.Molecular modification of lysine decarboxylase for catalytic synthesis of pentanediamine[J].Food and Fermentation Industries, 2022, 48(1):8-14.
[28] 杨颖, 邓洁, 张亮, 等.一株产赖氨酸脱羧酶的菌株Klebsiella pneumoniae sp.GXW-1的鉴定[J].基因组学与应用生物学, 2015, 34(12):2639-2643.
YANG Y, DENG J, ZHANG L, et al.Identification of a Klebsiella pneumoniae sp.GXW-1 which produced lysine decarboxylase[J].Genomics and Applied Biology, 2015, 34(12):2639-2643.