不饱和脂肪酸是维持人体生存的必需营养物质之一。Omega族不饱和脂肪酸属于多不饱和脂肪酸,指含有2个或以上双键且碳链长度为18~22个碳原子的直链脂肪酸。按第一个不饱和键位于甲基端的位置不同,分为omega-3和omega-6。二十二碳六烯酸(docosahexaenoic acid,DHA)和二十碳四烯酸(arachidonic acid,AA)分别是omega-3和omega-6中具有代表性的物质。DHA被称为脑黄金,是脑细胞的重要组成部分,可参与神经突触形成,对婴儿的脑发育具有重要意义[1]。具有维护脑和视网膜、延缓脑衰老、预防和治疗心脑血管方面的疾病等多种生物学功能。AA广泛存在于各种细胞中,通常被认为是半必需脂肪酸,但由于婴儿合成AA的能力有限,所以在婴儿时期AA被认为是必需脂肪酸。在细胞内通过花生四烯酸级联,参与细胞的炎症介导及信号传递[2]。AA作为细胞膜上部分磷酸甘油酯的组成部分,对于细胞膜的流动性有一定作用,故对大脑的发育也起着积极的作用。
人类肠道存在着一个复杂的微生物生态系统,该系统由1 000多种微生物组成,总体丰度约为1014,是人体细胞的10倍,正常情况下与宿主处于相互平衡状态[3]。一方面,它们可以为肠道细胞提供必需的营养物质,如维生素K,而肠道也为肠道细菌提供了良好的环境。另一方面,共生菌可以促进肠道屏障的完整,以抵御致病菌进入肠道黏膜,故良好的菌群宿主关系对于维持宿主与微生物区系的稳态是至关重要的。一旦打破了这种平衡,将会导致一系列不良反应发生。肠道微生物的代谢产物短链脂肪酸(short-chain fatty acids,SCFAs)被认为是有益的,对于调节肠道菌群和作为健康状态的指标有着重要的作用。已有研究显示了乙酸在免疫调节方面的潜力[4],而丙酸可以促进阿克曼菌定植并缓解血管钙化,修复肠黏膜损伤[5]。
仿生胃肠道反应器是体外研究消化的关键装备,相较于烧杯厌氧管,其更接近人体真实情况。第一个体外模拟胃肠道的五级系统于1993年由MOLLY等[6]提出,采用5个玻璃套分别模拟小肠和大肠,并通过计算机控制消化液的流加、食糜转运和检测。随后,DE BOEVER等[7]在此基础上又对方法进行完善,使之成为了一个具有模拟人的胃、十二指肠、空肠、回肠、升结肠、横结肠和降结肠的完整体外动态消化模型。另外,1999年荷兰应用科学研究组织(Netherlands Organisation for Applied Scientific Research, TNO)营养与食品研究中心研发了一种新型的大肠环境模拟系统[8]。该系统将代谢物和水的去除与蠕动混合相结合,以获得和处理微生物、干物质和微生物代谢物的生理浓度。基于该理论的胃肠道反应器已经由TNO迭代到TIM-agc[9](TIM advanced gastric compartment),与其他TIM模型类似,其通过调节玻璃夹套和柔性膜之间空间中的水压力来实现收缩。作为国际主流的商业类体外仿生反应器,TNO胃肠模型(TNO gastro-intestinal model, TIM)已被应用到食品医疗的各个方面。
使用体内模型研究食药品在体内的消化过程往往存在周期长、成本高、可靠性差等缺点,因此使用体外消化模型已经成为一种趋势。体外消化模型分为静态模型和动态模型。试管作为传统的静态模型无法在体外模拟剪切、混合和吸收过程,且油脂具有不溶的特性,无法对培养基均一化。而动态模型很好的解决了这一点。目前,DHA、AA的研究多集中在其对脑发育的关键性、防治心脑血管疾病等,有研究表明不同饱和度的脂肪酸可能对肠道菌群产生不同的影响[10],本研究对此展开研究。以期填补了不同饱和度及浓度的脂肪酸对健康人肠道微生物影响的研究空白,为利用脂肪酸调控肠道微生物促进人体健康提出了理论依据和可行性方案。
1 材料与方法
1.1 实验材料
DHA、花生四烯酸油脂,嘉必优生物技术(武汉)股份有限公司;胡姬花花生油,益海嘉里金龙鱼粮油食品股份有限公司;椰子油,菲律宾Kirkland Signature;聚乙烯醇1788,无锡市亚泰联合化工有限公司;厌氧产气袋,日本三菱瓦斯化学株式公社;胆汁盐,美国Sigma-Aldrich公司;黏蛋白,上海麦克林生化科技股份有限公司;其他试剂,国药集团化学试剂有限公司。
1.2 仪器与设备
BGR-03体外仿生大肠反应器,无锡南源生物有限公司;HYQX-Ⅱ厌氧培养箱,上海跃进医疗器械有限公司;7890A气相色谱仪,安捷伦科技有限公司;SBA-40E生物传感仪,山东省科学院生物研究所。
1.3 乳液制作
采用食品工业上常用的乳化方法[11]。取2 g聚乙烯醇1788,加30 mL蒸馏水于磁力搅拌器中50 ℃搅拌30 min,待完全溶解后,自然冷却至室温。以3∶1的比例分别加入各组油脂,15 000 r/min均质5 min,小瓶装好备用。
其中,阳性对照采用混合饱和度的花生油,阴性对照采用纯饱和脂肪酸椰子油,omega-3实验组采用DHA,omega-6实验组采用花生四烯酸油脂。以下各组简称为Peanut、Coco、DHA、AA。
1.4 乳液稳定性
使用显微镜观察和表观观察。
1.5 体外发酵设备及方法设计
1.5.1 仿生大肠反应器概述
实验室自制的仿生大肠反应器从外观、生理、功能相对完整地模拟了人体的大肠[12]。利用硅胶材料,制作了柔性的、具有良好延展性的、透明的仿生大肠膜。将其套在玻璃制成的套管上。利用37 ℃的恒温水浴锅持续向套管内输送稳定水温的压力水。通过间断控制上下产生的水压差,使仿生大肠膜以一定的频率蠕动,从而模拟了食糜在结肠中的状态。且整个密闭空间呈无氧条件。此时如果使用新鲜的粪便中提取的肠道菌群加以定植,就较完全地模拟了结肠生理上的状态。最后,在发酵过程中利用中空纤维滤膜模拟大肠的吸收,如SCFAs。
1.5.2 实验设计
参考M GUEZ 等[13]方法,稍加修改,总体设计思路如图1所示。整个体外反应器发酵过程分为3个阶段,分别为定植期(20 h)、饥饿期(4 h)、控制期(48 h)。
GUEZ 等[13]方法,稍加修改,总体设计思路如图1所示。整个体外反应器发酵过程分为3个阶段,分别为定植期(20 h)、饥饿期(4 h)、控制期(48 h)。
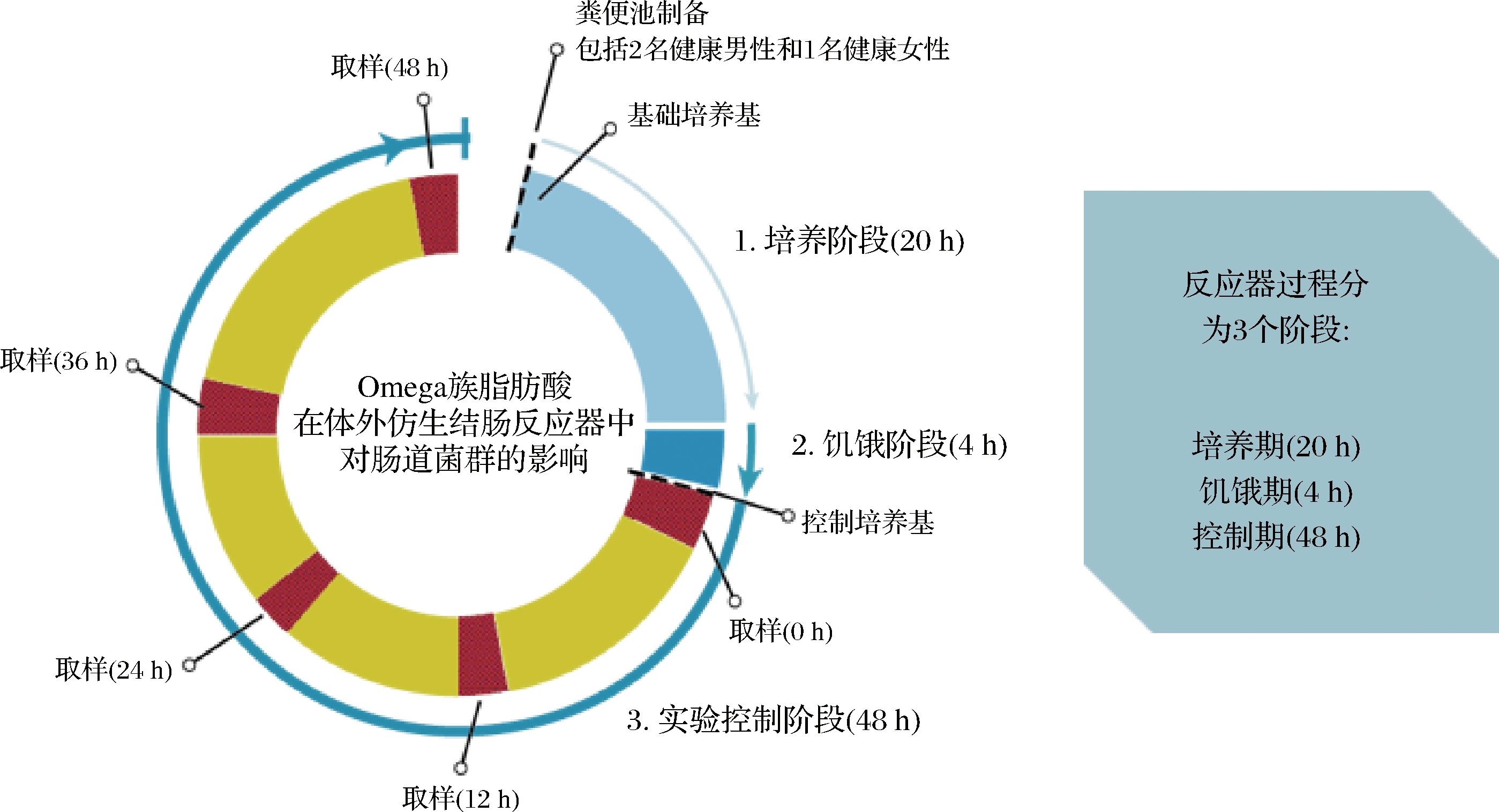
图1 体外仿生大肠反应器中发酵过程的时间线示意图
Fig.1 A schematic diagram of the fermentation process in an in vitro bionic gastrointestinal reactor
在此之前,我们招募了3名健康的6个月内未接受抗生素治疗的健康志愿者,均为江南大学学生,2女1男,身体质量指数(body mass index,BMI)为(26.60±1.64) kg/m2,遵循正常的中国传统饮食且无消化系统疾病。约定同一天,在≤3 h的间隔内有序取新鲜粪便,存放在含有生物冰袋的厌氧产气袋内。之后分别称取粪便样品20 g,于厌氧箱中按1∶2(g∶mL)的比例加入PBS(0.1 mol/L,pH 7.0),搅拌均匀后用4层纱布过滤。取滤液用立式离心管每10 mL分装。立即于液氮中速冻,制成标准粪菌悬液。存放于-40 ℃冰箱内备用。
以下为反应器发酵的具体时期操作。
在定植期,模拟结肠液培养基是必要的,该培养基参考文献[14]的方法,略有修改。该模拟结肠液培养基:1.2 g淀粉、0.2 g阿拉伯半乳糖、0.4 g果胶、0.2 g木聚糖、0.6 g酵母提取物、0.2 g胰蛋白胨、0.4 g黏蛋白、0.1 g L-半胱氨酸、0.2 g KCl、0.9 g NaCl、0.1 g K2HPO4、0.1 g KH2PO4、0.1 g CaCl2·2H2O、0.002 g MgSO4·7H2O、0.001 g FeSO4·7H2O、0.005 g氯化血红素、0.08 g胆汁盐、0.2 mL吐温-80、1.0 mL维生素混合液,200 mL水。调pH至5.8。分别加入DHA、AA、花生油、椰子油,紫外灯过夜灭菌后泵入仿生大肠反应器中。之后以10%的接种量取冻藏的粪菌液于37 ℃水浴锅中孵育30 min,酒精灯旁通过鲁尔接头打入罐体,设定pH低于5.8自动补碱。
20 h后待碳源消耗完毕,进入饥饿期,该阶段持续4 h,使菌体生长状态保持一致。
饥饿期结束后进入实验控制期,通过鲁尔接头用无菌针管抽取发酵液40 mL,模拟营养物质的吸收及取样(记为t=0,n=3)并立刻通入40 mL新鲜的含不同浓度实验物的模拟结肠液培养基。-40 ℃冰箱冻存备用。之后每12 h重复上述步骤,直至控制期结束。
1.6 SCFAs测定
通过使用GC分析SCFAs产量,包括乙酸、丙酸和丁酸。将1 mL发酵液的上清液转移至新的Eppendorf离心管中。将约250 μL HCl和1 mL乙醚添加至上清液,以1 mmol/L(终浓度)2-甲基丁酸作为内标,并将试管涡旋3 min。收集上层的有机组分并用Na2SO4脱水,收集上清液并使其通过0.22 μm孔径的过滤器。使用HP-INNOWAX色谱柱。烘箱温度60 ℃,并在4 min内升至190 ℃。进样器温度220 ℃,检测器温度250 ℃。将5 μL样品以1∶20的分流比注入GC仪器,氮气用作载气,流速1.5 mL/min。根据内标法计算乙酸、丙酸和丁酸含量[15]。
1.7 16S rRNA扩增子测序
16S rRNA基因是一个单一的遗传位点。它全长1 500 bp,9个可变区分布在10个保守区之间。对可变区V3~V4测序以评估种群内的多样性,并比较相似样本之间的相对丰度。
使用PowerFecal® DNA Isolation Kit分别提取48 h后的花生油、DHA、AA、椰子油及0 h空白组的基因组DNA。对提取的DNA采用341F、806R进行扩增,在引物的5′端连接上overhang序列,以便MiSeq使用[16]。待Takara Clontech制得扩增后的PCR产物后,使用Nextera XT Index Kit制备文库。将制备好得文库使用qPCR进行定量纯化,合格后Illumina NovaSeq上机对文库进行双末端测序。测序得到的reads使用DADA2进行降噪,并使用过滤器除去丰度低于5的序列,得到ASV表。使用QIIME2进行注释后使用。
1.8 数据处理
上述实验均独立重复3次,采用SPSS 22软件进行双因素方差分析(two-way ANOVA),采用Tukey法进行多重比较,P<0.05为差异显著。丰度堆积图及聚类热图采用R语言,ggplot2、ggpubr及ComplexHeatmap包[17]制作,其余均使用GraphPad Prism9制作。
2 结果与分析
2.1 乳液稳定性
乳液的稳定性由多种因素决定。常见物理化学因素均会导致乳浊液加速崩解。由于实验中各项理化指数保持相对稳定(如温度37 ℃,pH保持在5.8),且实验中含脂肪酸的阶段会持续48 h,期望乳液在48 h内可以缓慢的走向相对不稳定状态。故对48 h内的DHA、AA、花生油、椰子油进行简单的显微镜观察。如图2所示,4种油脂在0 h时候,无分层现象,且在微观观察下分布也较为均一;24 h时,未观察到分层现象,光学显微镜观察也较为均一;48 h时,观察到较微弱的分层现象,并且明显观察到乳液液滴增大,出现了液滴合并现象。整个乳浊液已经不再稳定。

图2 发酵时间对乳液微观结构的影响
Fig.2 Effect of fermentation time on microstructure of emulsion
2.2 SCFAs
SCFAs是评估肠道菌群发酵结果的重要指标。乙酸、丙酸及丁酸占据了人体肠道总体SCFAs含量的83%,其主要来源于产SCFAs菌,如产丁酸菌、产丙酸菌等[18]。SCFAs是重要的营养能量物质,SCFAs的生成会被肠道上皮细胞快速吸收。并且SCFAs通过多种局部效应改善肠道健康,包括维持肠道屏障完整性、黏液生成、防止炎症以及降低结直肠癌风险[19]。
本研究评估了不同浓度、不同饱和度的脂肪酸对粪菌发酵过程中SCFAs产量的影响,测定了以花生油、DHA、AA、椰子油,含量分别为1、2、3 mL/L粪菌发酵过程中48 h的SCFAs浓度。
2 mL/L的DHA、AA每日摄入被认为是合理的。乙酸已被证明可以通过减少IL-1β、IL-6和TNF-α的表达以及p38 MAPK、JNK和NF-κB的磷酸化来减少炎症信号,同时可被循环系统转运,为脑、肝提供能量[20]。如图3-a所示,在2 mL/L条件下,实验组DHA具有最高的乙酸生成量,阴性对照椰子油具有最低的乙酸生产量,分别为68.36 mmol/L和15.34 mmol/L。DHA组较阳性对照花生油高11.48%,较实验组AA高45.23%,是阴性对照的4.45倍。虽然2 mL/L下DHA和花生油差异不显著,但DHA、AA、椰子油之间差异显著(P<0.05)。丙酸能改善炎症,减轻高血压心血管损伤[21],如图3-b所示,在2 mL/L条件下,阳性对照花生油具有最高的丙酸生成量,阴性对照椰子油具有最低的丙酸生成量,分别为7.80 mmol/L和4.17 mmol/L。2 mL/L下花生油丙酸生成量与DHA丙酸有显著差异(P<0.05),两对照组的丙酸生成量较为接近,但花生油组比AA及椰子油高了32.77%和50.59%。丁酸可以协调肠上皮和免疫细胞间的相互作用,增加肠道内IgA的生成并且可以减少大肠杆菌的黏膜定植[22]。如图3-c所示,2 mL/L条件下,DHA、AA组的丁酸生成量明显高于其他两组,DHA组较花生油组的丁酸生成量高39.81%,较椰子油组高104.03%。

a-乙酸浓度;b-丙酸浓度;c-丁酸浓度;d-总酸浓度
图3 使用不同含量、不同饱和度油脂发酵肠道菌群的SCFAs浓度
Fig.3 Concentration of SCFAs fermented with oils of different saturation and contents
随着DHA含量的升高,乙酸生成量先升高再降低,丙酸的生成量有小幅度的降低,分别为乙酸54.79、68.36、60.50 mmol/L,丙酸8.34、7.68、7.52 mmol /L,而丁酸有较高幅度的提升。
在发酵48 h时,AA的添加使得丙酸、丁酸的含量相对的减少。DHA的添加显著的提升了SCFAs的含量,尤其是丁酸的含量,并且随着质量浓度的增加,丁酸的增加越多。另外2 mL/L的DHA添加相较与1 mL/L和3 mL/L组,提升的乙酸含量最多。DHA的添加,发酵过程中少量的增加了丙酸的含量,但随着DHA添加量的增加,丙酸含量的增加逐渐下降。饱和脂肪的摄入大大的减少了乙酸和丙酸的产生,可能对产乙酸丙酸菌有抑制作用。而对乙酸的产生几乎没有帮助。
2.3 肠道菌群
图4为发酵48 h后的花生油、DHA、AA、椰子油及0 h空白组的门水平丰度堆积图。
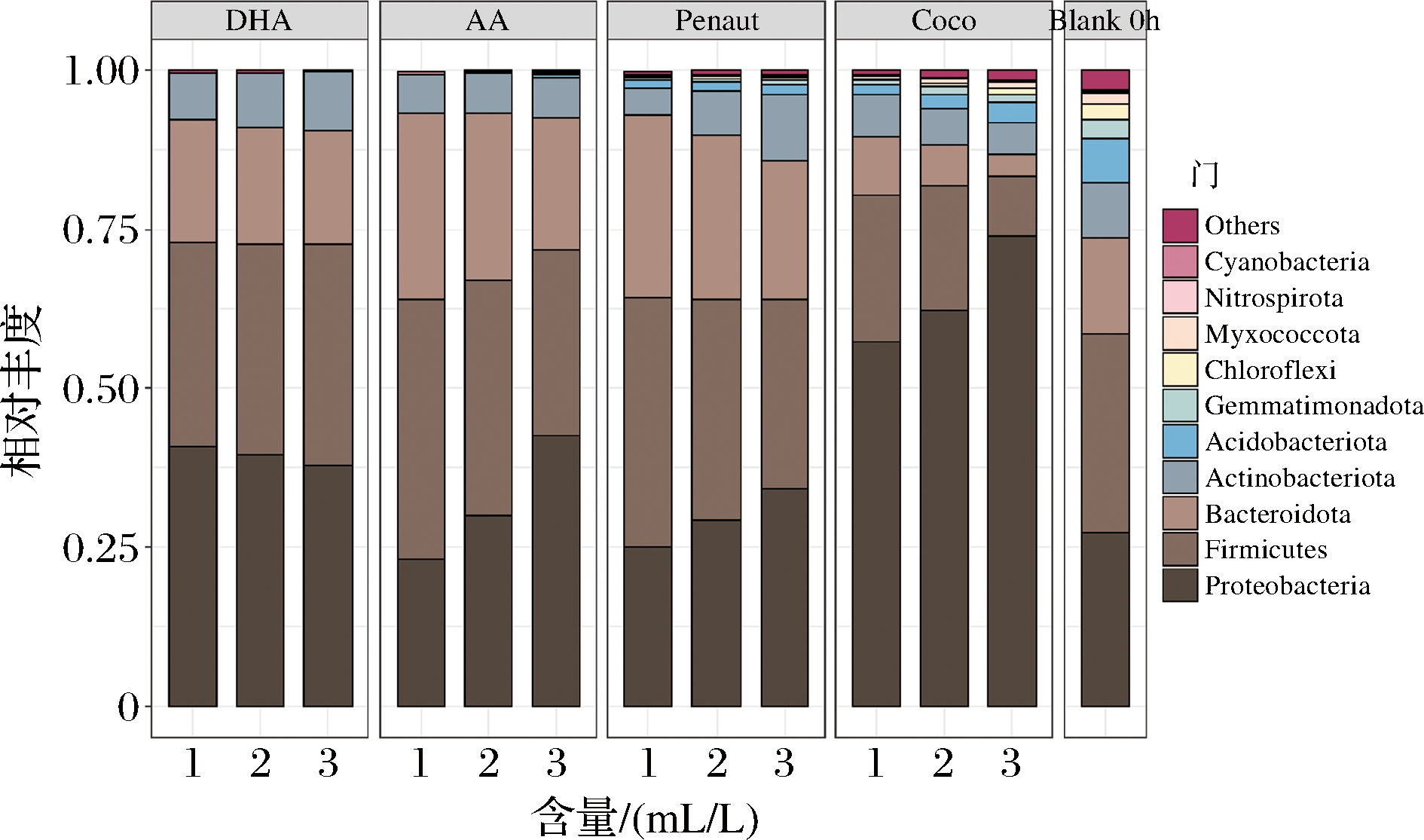
图4 48 h后不同浓度、饱和度油脂发酵的肠道菌群在门水平上的相对丰度堆积图
Fig.4 The intestinal bacteria after 48 h with different concentrations and saturations of the intestinal bacteria after 48 h stacked at the phylum level
总的来说,经过48 h的发酵,以变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)、放线菌门(Actinobacteriota)及酸杆菌门(Acidobacteriota)占据了整体丰度的几乎96%以上。国内外达成共识的一点是,在高脂肪饮食中,变形菌门与厚壁菌门的比例会有显著升高[23]。在本研究中无论是不饱和油脂或是饱和油脂均表现出了这一特性。尤其在纯饱和脂肪酸的椰子油中,在3 mL/L组变形菌门与厚壁菌门比例达到7.78。变形菌门的异常扩增被认为是不正常的,它打破了肠道菌群的稳态,使得整个肠道菌群趋向失衡,并且潜在可能诱发如肥胖病、2型糖尿病在内的多种疾病[24]。尽管随着添加量的增加,AA、花生油、椰子油均表现出了变形菌的增加,而DHA组并没有增加,反而呈现出略微下降,HEREU等[25]认为DHA的摄入可以调节肠道菌群,修复肠道屏障。在本实验中DHA的摄入稳定了变形菌门和厚壁菌门的比例,调节了肠道菌群,使得整体保持稳定。
为了解不同饱和度、不同含量的脂肪酸对肠道菌群变化的影响,将各组的ASV表制成热图(图5)。椰子油组和其他不饱和组形成了截然不同的2块区域。其中,椰子油表现出明显的巨球型菌属(Megasphaera)、Muribaculaceae、严格梭菌属(Clostridium_sensu_stricto_1)、罗姆布茨菌属(Romboutsia)、克雷伯菌属(Klebsiella)、志贺氏菌属(Escherichia-Shigella)的上调。巨球型菌属被认为可能是亚洲人群的特征[26],但也有相关报道表明巨球型菌属与溃疡性结肠炎、注意力缺陷等呈正相关。克雷伯氏菌在免疫力正常的人群中几乎没有破坏力,且不会出现丰度的过度增长,而当肠道菌群紊乱的时候,可引发多种疾病,特别是腹泻、腹膜炎和软组织感染。免疫能力正常的人类,100个志贺氏菌就足以导致感染,志贺氏菌通常会侵入结肠上皮细胞的内层,引起严重的炎症和结肠内层细胞死亡。可导致痢疾的发生。而DHA含量高(3 mL/L)时,表现出不动杆菌属(Agathobacter)、纺锤链杆属(Fusicatenibacter)、杀雄菌属(Arsenophonus)、双歧杆菌属(Bifidobacterium)明显增加;不动杆菌属为丁酸产生菌,这与SCFAs中含量高的DHA丁酸生成量高一致;杀雄菌属一般是昆虫共生菌,此处可能与ASV阈值有关;双歧杆菌属中有部分被认为是益生菌,它们广泛存在于结肠黏膜,在人体中有至关重要的作用,帮助人体消化并抑制抵御其他致病菌。AA含量为1、2 mL/L时,花生油含量为1 mL/L时表现出乳杆菌属(Lactobacillus)、CAG-352、经黏液真杆菌属(Blautia)较明显增加。乳酸菌是常见的益生菌之一,它可以帮助治疗腹泻、阴道感染和湿疹等皮肤疾病。

图5 48 h后不同浓度、饱和度油脂发酵的肠道菌群在属水平上的聚类热图
Fig.5 Cluster heatmap of intestinal flora after 48 h fermentation of oil with different content and saturation
注:第一个字母D表示DHA,A表示AA,P表示花生油,C表示椰子油;第二个字母H表示高含量(3 mL/L), M表示中含量(2 mL/L), L表示低含量(1 mL/L)。
3 结论
本研究以花生油、DHA、AA、椰子油为研究对象,探究了不同饱和度的脂肪酸在体外仿生大肠反应器中,对肠道菌群及代谢物生成的影响。这项工作首先克服了传统静态发酵存在的无法较好的利用油脂的问题,利用聚乙烯醇1788对实验用的油脂进行乳化,再利用仿生大肠反应器进行动态发酵。结果表明不饱和度对肠道菌群及代谢物有影响,具体表现在,omega-3不饱和度的DHA摄入稳定了整体肠道菌群结构,并在局部上增加了不动杆菌属和双歧杆菌属等有益菌属丰度,omega-6不饱和度的AA摄入增加了乳杆菌属、经黏液真杆菌属等丰度,而饱和的椰子油上调了志贺氏菌属、克雷伯菌属等有害菌属的丰度。在代谢物水平上,omega-3不饱和DHA的摄入极大的提高了乙酸、丙酸及丁酸的含量,omega-6不饱和度的AA次之。而饱和脂肪酸椰子油抑制它们的生成。综上,低饱和度的油脂对健康人的肠道菌群的组成和相关代谢有正向作用。
[1] VAN DIJK S J, ZHOU J, PETERS T J, et al.Effect of prenatal DHA supplementation on the infant epigenome:Results from a randomized controlled trial[J].Clinical Epigenetics, 2016, 8(1):1-13.
[2] TALLIMA H, EL RIDI R.Arachidonic acid:Physiological roles and potential health benefits -A review[J].Journal of Advanced Research, 2018, 11:33-41.
[3] MART N R, MIQUEL S, ULMER J, et al.Gut ecosystem:How microbes help us[J].Beneficial Microbes, 2014, 5(3):219-233.
N R, MIQUEL S, ULMER J, et al.Gut ecosystem:How microbes help us[J].Beneficial Microbes, 2014, 5(3):219-233.
[4] ARPAIA N, CAMPBELL C, FAN X Y, et al.Metabolites produced by commensal bacteria promote peripheral regulatory T-cell generation[J].Nature, 2013, 504(7480):451-455.
[5] YAN J L, PAN Y B, SHAO W M, et al.Beneficial effect of the short-chain fatty acid propionate on vascular calcification through intestinal microbiota remodelling[J].Microbiome, 2022, 10(1):195.
[6] MOLLY K, WOESTYNE M, VERSTRAETE W.Development of a 5-step multi-chamber reactor as a simulation of the human intestinal microbial ecosystem[J].Applied Microbiology and Biotechnology, 1993, 39(2):254-258.
[7] DE BOEVER P, WOUTERS R, VERSCHAEVE L, et al.Protective effect of the bile salt hydrolase-active Lactobacillus reuteri against bile salt cytotoxicity[J].Applied Microbiology and Biotechnology, 2000, 53(6):709-714.
[8] MINEKUS M, SMEETS-PEETERS M, BERNALIER A, et al.A computer-controlled system to simulate conditions of the large intestine with peristaltic mixing, water absorption and absorption of fermentation products[J].Applied Microbiology and Biotechnology, 1999, 53(1):108-114.
[9] THUENEMANN E C.Dynamic Digestion Models:General Introduction[M]// The Impact of Food Bioactives on Health.Cham:Springer, 2015:33-36.
[10] MENNI C, ZIERER J, PALLISTER T, et al.Omega-3 fatty acids correlate with gut microbiome diversity and production of N-carbamylglutamate in middle aged and elderly women[J].Scientific Reports, 2017, 7:11079.
[11] LI H, WU C C, YIN Z W, et al.Emulsifying properties and bioavailability of clove essential oil Pickering emulsions stabilized by octadecylaminated carboxymethyl curdlan[J].International Journal of Biological Macromolecules, 2022, 216:629-642.
[12] LI Z T, ZHU L, ZHANG W L, et al.New dynamic digestion model reactor that mimics gastrointestinal function[J].Biochemical Engineering Journal, 2020, 154:107431.
[13] M GUEZ B, VILA C, VENEMA K, et al.Prebiotic effects of pectooligosaccharides obtained from lemon peel on the microbiota from elderly donors using an in vitro continuous colon model (TIM-2)[J].Food &Function, 2020, 11(11):9984-9999.
GUEZ B, VILA C, VENEMA K, et al.Prebiotic effects of pectooligosaccharides obtained from lemon peel on the microbiota from elderly donors using an in vitro continuous colon model (TIM-2)[J].Food &Function, 2020, 11(11):9984-9999.
[14] AGUIRRE M, ECK A, KOENEN M E, et al.Evaluation of an optimal preparation of human standardized fecal inocula for in vitro fermentation studies[J].Journal of Microbiological Methods, 2015, 117:78-84.
[15] 胡国奥, 詹晓北, 李志涛, 等.低谷蛋白大米在仿生大肠反应器中对肠道菌群结构及代谢的影响[J].食品与发酵工业, 2021, 47(13):23-29.
HU G A, ZHAN X B, LI Z T, et al.Effects of flow glutelin rice on composition and metabolism of intestinal flora in bionic large intestinal reactor[J].Food and Fermentation Industries, 2021, 47(13):23-29.
[16] SASABE J, MIYOSHI Y, RAKOFF-NAHOUM S,et al.Interplay between microbial D-amino acids and host D-amino acid oxidase modifies murine mucosal defence and gut microbiota[J].Nature Microbiology, 2016, 1(10):16125.
[17] GU Z G.Complex heatmap visualization[J].iMeta, 2022, 1(3):e43.
[18] ROMBEAU J L, KRIPKE S A, SETTLE R G.Short-chain fatty acids[M]//Dietary Fiber.Boston, MA:Springer US, 1990:317-337.
[19] MARTIN-GALLAUSIAUX C, MARINELLI L, BLOTTI RE H M, et al.SCFA:Mechanisms and functional importance in the gut[J].The Proceedings of the Nutrition Society, 2021, 80(1):37-49.
RE H M, et al.SCFA:Mechanisms and functional importance in the gut[J].The Proceedings of the Nutrition Society, 2021, 80(1):37-49.
[20] CHIDAMBARAM S B, ESSA M M, RATHIPRIYA A G, et al.Gut dysbiosis, defective autophagy and altered immune responses in neurodegenerative diseases:Tales of a vicious cycle[J].Pharmacology &Therapeutics, 2022, 231:107988.
[21] HENDRIK B, ANDR S B, MINA Y, et al.Short-chain fatty acid propionate protects from hypertensive cardiovascular damage[J].Circulation, 2019, 139(11):1407-1421.
S B, MINA Y, et al.Short-chain fatty acid propionate protects from hypertensive cardiovascular damage[J].Circulation, 2019, 139(11):1407-1421.
[22] TAKEUCHI T, MIYAUCHI E, KANAYA T, et al.Acetate differentially regulates IgA reactivity to commensal bacteria[J].Nature, 2021, 595(7868):560-564.
[23] AGANS R, GORDON A, KRAMER D L, et al.Dietary fatty acids sustain the growth of the human gut microbiota[J].Applied and Environmental Microbiology, 2018, 84(21):e01525-e01518.
[24] SHIN N R, WHON T W, BAE J W.Proteobacteria:Microbial signature of dysbiosis in gut microbiota[J].Trends in Biotechnology, 2015, 33(9):496-503.
[25] HEREU M, RAMOS-ROMERO S, BUSQUETS C, et al.Effects of combined D-fagomine and omega-3 PUFAs on gut microbiota subpopulations and diabetes risk factors in rats fed a high-fat diet[J].Scientific Reports, 2019, 9:16628.
[26] YACHIDA S, MIZUTANI S, SHIROMA H, et al.Metagenomic and metabolomic analyses reveal distinct stage-specific phenotypes of the gut microbiota in colorectal cancer[J].Nature Medicine, 2019, 25(6):968-976.