红枣是鼠李科枣属植物果实,因同时拥有食用和药用价值、富含活性成分使其成为极佳的功能性食品原料[1]。我国的红枣产量世界第一,现年产量已达750万t左右,约占世界红枣总产量的90%[2]。但是目前红枣存在着过于甜腻而市场不大、不易储存、附加值低等问题,主要以鲜枣和干枣直接食用的消费形式,导致产量逐年提升但是价格却走低的现象[3]。
乳酸菌是最有代表性的益生菌,被广泛用作天然食品生物防腐剂,因为它们能通过快速合成有机酸进行酸化,防止有害微生物污染而延长食品的储存时间[4]。植物乳酸菌饮料不含乳制品成分,消除了乳糖不耐症等问题隐患,同时植物乳酸菌饮料能提供多种营养元素,且植物中的多酚可作为益生元促进人体肠道菌群的生长及其对肠细胞的黏附[5],通过乳酸菌发酵还会提高多酚类物质的生理活性和吸收率[6]。
随着功能性食品市场的扩大,植物发酵饮料成为备受关注的功能性食品之一,而现红枣发酵产品多为枣酒和红枣醋,技术已趋于成熟但市场较小,对于红枣酸奶、红枣复合饮料来说,有关发酵工艺优化方向的研究偏多[7],但对其成分与风味的研究较少,故红枣虽然历史悠久但在新技术不断发展的今天仍有巨大的开发潜力,红枣发酵饮料作为新型的红枣产品具有广阔的市场前景。
在低糖饮料受到大多人喜爱的趋势下,利用乳酸菌发酵红枣汁可以丰富红枣深加工产品门类、提高红枣产品功能属性、提升红枣产品附加值,具有重要的社会和经济意义。为此,本研究以分离各水果样品中潜在乳酸菌和实验室保藏共计204株菌株为研究对象,判断其产酸能力、耐酸能力和耐胆盐能力的益生菌特性,并分析菌株发酵所得红枣汁理化指标、挥发性风味物质及其香气贡献,最终得到具有优良潜力的乳酸菌菌株。
1 材料与方法
1.1 材料与试剂
河北产金丝小枣,市售;乳酸菌,实验室保藏菌株;有机酸、挥发性化合物标准品为色谱纯,美国Sigma公司;其他试验药品均为分析纯,国药集团化学试剂有限公司。
1.2 培养基
MRS(de Man,Rogosa and Sharpe)培养基用于乳酸菌培养,主要成分包括酵母粉5 g、蛋白胨10 g、牛肉膏10 g、葡萄糖10 g、乙酸钠5 g、柠檬酸氢二铵2 g、MgSO4 0.6 g、MnSO4 0.3 g、吐温-80 1 mL,蒸馏水1 000 mL,琼脂粉20 g(用于固体培养基),115 ℃灭菌15 min。
发酵培养基:调整处理好的红枣汁含糖量为140 g/L,于高压蒸汽灭菌锅105 ℃灭菌10 min。
1.3 实验方法
1.3.1 菌种分离
取不同水果榨汁后,调整糖度至140 g/L,取200 mL倒入无菌三角瓶中,置于37 ℃恒温培养箱中自然发酵48 h,取2 mL菌液用质量分数0.85%生理盐水10倍稀释7个浓度梯度,将稀释的菌液均匀涂布在含有25 mg/L制霉菌素的抗菌MRS平板上,37 ℃厌氧培养2 d,并观察菌落生长情况。每组3个平行。将培养后的MRS平板中具有典型乳酸菌特征的单菌落挑出,在MRS平板中进行二次划线分离。将分离到的单菌落培养后接入甘油管在-80 ℃下保存,并编号。
1.3.2 菌株产酸能力
将甘油管保藏菌株接种于MRS液体试管中,37 ℃、180 r/min培养活化2次后接种的菌株,接种于含有溴甲基酚紫的MRS平板上,37 ℃培养48 h,保留使培养基显著变黄色的菌株进行下一级筛选。
1.3.3 菌株益生菌特性
1.3.3.1 耐酸能力
将上述筛选获得的具有产酸能力的菌株接种于MRS液体试管中,37 ℃活化12~18 h,将活化后菌液分别接种于pH为2的酸性MRS液体培养基和普通MRS液体培养基,37 ℃培养3 h,稀释合适的倍数后涂布MRS平板,计算耐酸存活率,每组3个平行。将存活率≥95%的乳酸菌确定为耐酸能力较强的菌株。
耐酸存活率按公式(1)计算:
耐酸存活率![]()
(1)
式中:N1,耐酸培养基培养后菌落数;N2,MRS培养基培养后菌落数。
1.3.3.2 耐胆盐能力
将上述筛选获得的耐酸能力较强的菌株在MRS液体试管中37 ℃活化12~18 h后,将同一菌株以体积分数1%的接种量分别接种于含质量分数0.3%牛胆盐的MRS液体培养基和普通MRS液体培养基中,在620 nm波长下,同一菌种在不同培养基中增加0.3单位吸光度的时间之差,被认为是菌株在含0.3%胆盐环境中的适应时间,其值越低表示菌株耐胆盐能力越强。实验重复3次。
1.3.4 红枣汁的发酵实验
以红枣汁为原料,调整含糖量至140 g/L,可滴定酸2质 g/L,发酵规模500 mL,装液量60%,105 ℃高压蒸汽灭菌10 min,接种植物乳植杆菌MY-12使其在红枣汁中的菌浓度达到1×107 CFU/mL,37 ℃发酵48 h,发酵结束后测定发酵液基本理化指标,并进行感官品评分析。
1.4 分析检测方法
1.4.1 基础理化指标测定
参照GB/T 31121—2014 《果蔬汁类及其饮料》和GB 4789.35—2016 《食品安全国家标准 食品微生物学检验 乳酸菌检验》中的方法,测定红枣发酵饮料的可溶性固形物含量、pH值、总酸、总糖、活菌数和酒精度。
1.4.2 抗氧化指标测定
1.4.2.1 DPPH自由基清除率测定
使用无水乙醇溶解DPPH并配制0.3 mmol/L的DPPH溶液,现配现用并于黑暗避光处保存。
取0.1 mL待测样品或无水乙醇对照加入0.4 mL DPPH溶液,在室温下避光反应30 min,在517 nm处测定吸光值。根据公式(2)计算清除率:
DPPH自由基清除率![]()
(2)
式中:A0,DPPH溶液+无水乙醇;A1,DPPH溶液+样品。
1.4.2.2 ABTS阳离子自由基清除率测定
取5 mL的7 mmol/L ABTS溶液和88 μL的140 mmol/L K2S2O8在室温下避光放置24 h生成ABTS阳离子自由基,现配现用,用无水乙醇稀释至734 nm处吸光度为0.70±0.02。
取0.2 mL待测样品和无水乙醇对照加入ABTS自由基4.8 mL,在室温下于暗处反应30 min,测定734 nm处吸光值,按公式(3)计算:
ABTS阳离子自由基清除率![]()
(3)
式中:A0,ABTS溶液+无水乙醇;A1,ABTS溶液+样品。
1.4.2.3 铁离子还原力(ferric reducing antioxidant power,FRAP)测定
0.3 mol/L醋酸钠缓冲液:1.82 g无水醋酸钠和16 mL冰醋酸,加水定容至1 L,用1 mol/L HCl调节pH至3.6。10 mmol/L氯化三苯四氮唑(2,3,5-triphenyltetrazolium chloride,TPTZ)溶液:TPTZ溶于40 mmol/L HCl。20 mmol/L FeCl3溶液:FeCl3溶于去离子水。上述3种溶液按照10∶1∶1的体积比混合后,即为FRAP工作液,现配现用。
取待测液0.1 mL加入工作液3 mL,37 ℃反应10 min,于593 nm处测定吸光值。
1.4.2.4 总多酚含量的测定(福林酚法)
取1 mL样品置于100 mL容量瓶中,加入60 mL去离子水和5 mL福林酚试剂,混匀后加入15 mL Na2CO3(200 mg/L),添加去离子水至100 mL,充分混合。20 ℃反应2 h后,在波长765 nm处测定吸光度,以相应试剂作为空白对照。
1.4.2.5 游离酚类物质含量的测定
样品预处理:将3 g的样品加入到10 mL的甲醇-水溶液中[V(甲醇)∶V(水)=8∶2]中,涡旋1 min后10 000 r/min离心15 min,取上清液过有机膜后-20 ℃保存。
采用超高效液相色谱-四极杆飞行时间质谱鉴定不同酚类化合物及含量。色谱分离条件:色谱柱BEH C18柱(50 mm×2.1 mm I.D,1.7 mm粒度),波长扫描范围设置200~600 nm。流动相A为100%乙腈,流动相B为0.1%甲酸在超纯水中,采用梯度洗脱方式,流速0.3 mL/min。进样量5 μL,梯度洗脱顺序:98%~80% B(0~15 min)、80%~60%B(15~20 min)、60%~20%B(20~25 min)、20%~0B(25~27 min)、0~98%B(0.1 min)、98% B(27.1~30 min)。
质谱条件:电喷雾离子源(ESI)负离子模式检测,全扫描模式,质量范围m/z 50~2 000。喷雾电压3.0 kV,氮气流速50 L/min,辅助气流速50 L/min,毛细管温度400 ℃,加热器温度100 ℃。
数据采集和处理使用美国Waters公司的MassLynx4.1 SCN805软件。
1.4.3 非挥发性物质测定
1.4.3.1 有机酸含量的测定
将样品适当稀释后,经C18固相萃取柱过滤后用0.22 μm水系滤膜过滤备用。色谱条件:色谱柱Waters X Select HSS T3(4.6 mm×250 mm);流动相:0.02 mol/L(pH 2.5)KH2PO4缓冲液;流速0.5 mL/min;检测波长210 nm;进样量10 μL;柱温30 ℃。根据峰保留时间和峰面积与相应标准品比较作定量测定。
1.4.3.2 糖与多元醇含量的测定
葡萄糖、果糖、蔗糖、甘油和山梨醇的含量通过Waters1525 HPLC折射率检测器,使用Sugarpak 16.5 mm×300 mm阳离子交换柱进行分析,流动相为超纯水,流速0.3 mL/min,柱温85 ℃,进样体积10 L。
1.4.4 挥发性物质测定
通过固相微萃取-气质联用法测定样品中挥发性化合物,样品处理条件:将8 mL样品加入20 mL洁净螺口顶空瓶中,并加入2.0 g NaCl和2-辛醇内标(终质量浓度50 μg/L)。45 ℃预热5 min,萃取60 min。萃取结束后,将75 μm CAR/PDMS萃取头插入进样口,250 ℃解吸附5 min。分析条件为:EG-20 m弹性石英毛细管柱,30 m×0.25 m×0.25 μm;载气为高纯氦气,恒定流量0.8 mL/min,升温程序:从180 ℃开始,保持2 min,以3 ℃/min升温到230 ℃,保持10 min;进样口温度250 ℃,出样口温度200 ℃;检测电压350 V。
质谱条件:电子轰击(EI)源,发射电流200 μA,电子能量70 eV,扫描范围20~550 U。未知化合物定性通过与NIST05质谱库中标准谱图比对确定,化合物定量通过在体积分数10%乙醇溶液中配制待测化合物标准溶液,根据定量化合物与内标化合物峰面积比值与定量化合物浓度绘制标准曲线,依据标准曲线确定样品中挥发性化合物浓度。
1.4.5 感官品评
感官品评小组由4位具有专业品评经验的老师和16名经品评训练选拔出的研究生组成,小组成员定期开展红枣饮料感官品评训练后作为品评员完成感官品评。在评价中,将枣汁样品的酸、腻、涩味和花香、果香、臭或异味进行描述,并要求小组成员评价枣浆的外观、发酵性和整体接受程度。专家组成员对每个样品的感官属性的强度进行评分,评分标准为10分,从“几乎感受不到”(1分)到“感受极强”(10分)。
1.4.6 菌株16S rDNA鉴定
将甘油管保藏菌株于10 mL MRS培养基中,37 ℃、180 r/min过夜活化,随后转接至10 mL MRS培养基中,37 ℃、180 r/min培养12~16 h。取适量培养液离心1 min(12 000 r/min),弃上清液,采用细菌DNA提取试剂盒提取基于16S rDNA的菌株的分子鉴定基因组DNA。16S rDNA基因的扩增准备使用引物:5′-AGAGTTTGATCCTGGCTCAG-3′和5′-TACGGYACCTTGTTACGACTT-3′。采用BLAST方式将测定的16S rDNA序列与GenBank中的菌株进行比对,构建系统发育树。
1.4.7 数据处理与分析
使用GraphPadPrism8.4.3软件绘图,SPSS 26.0软件作显著性、主成分等统计分析,数据以3个独立试验的平均值±标准差表示。
2 结果与分析
2.1 乳酸菌株的筛选
试验从红枣、梨和桃子等十几种水果的自然培养基中分离得到乳酸菌株123株,加上实验室保藏乳酸菌株81株,共204株乳酸菌株用于下一步试验筛选,结果见表1。
表1 菌株筛选结果
Table 1 Strain screening results

产酸显色情况菌株个数耐酸存活率菌株个数胆盐适应时间/h菌株个数黄色、橙色89>95%11<36>82-350%~95%27<50%51无明显变色115
注:表中“-”以上数目为进入下一筛选阶段菌株个数。
使用含有溴甲基酚紫的产酸能力检测琼脂培养基,通过显色程度对富集得到的乳酸菌进行产酸能力表征检测。其中89株菌株在产酸培养基上为黄色或橙色,即表示菌株产酸能力好,48 h内的生长代谢旺盛。益生菌需要通过人体消化系统到肠道才能发挥作用,根据人体消化途径,是否有着耐强酸能力和高胆盐浓度的适应力是优良益生菌的筛选标准。研究将上述菌株依次开展耐酸能力和耐胆盐能力测试,考察其耐酸和耐胆盐性能,如表1所示,耐酸存活率>95%的有11株菌,对胆盐培养基适应时间<3 h的菌株共有6株。后续研究进一步以这6株菌株为研究对象,开展红枣汁发酵实验。
2.2 红枣汁乳酸菌发酵
2.2.1 基本理化指标分析
将筛选出的6株乳酸菌接种于红枣汁中37 ℃发酵48 h,测定发酵液基础理化指标,结果如表2所示。红枣汁中的可溶性固形物最高,接种乳酸菌后,可溶性固形物含量有不同程度下降,其中M-48发酵样品减少了多达61.15%的可溶性固形物,MY-41对可溶性固形物的减少最低,仅有3.60%。不同菌株发酵液中的总酸和总糖测定结果比较可知,M-48发酵液含有的总糖量最少,仅为26.85 g/L,而总酸含量最高,达到14.63 g/L。菌株MY-17和MY-23发酵液中总酸较高而总糖含量较低,MY-41和YM-51发酵液中总酸较低而总糖含量较高,相比之下,菌株MY-12的总糖和总酸含量均处于中等水平,其酸和糖的含量水平有着更为合适的发酵口味优势潜力。6株乳酸菌经48 h发酵完成后的活菌数都符合国家对乳酸菌饮料的活菌数控制标准(>6 lg CFU/mL),其中MY-12发酵液中活菌数最高,达到9.74 lg CFU/mL,这表明其在枣汁中生长能力强。而酒精度指标方面,除M-48发酵样品外,其他菌株发酵的样品酒精度均<0.5%,隶属于无酒精饮料的范畴。
表2 红枣饮料理化指标
Table 2 Physicochemical indices of jujube beverage

样品可溶性固形物/%pH值总酸/(g/L)总糖/(g/L)活菌数/(lg CFU/mL)酒精度/%vol红枣汁13.90±0.11a4.73±0.16a3.31±0.13g134.61±0.13a0.00±0.000.00±0.00fMY-1213.20±0.31c4.31±0.04c6.24±0.12d121.68±1.13c9.74±0.280.09±0.01eMY-1713.00±0.20d4.13±0.28c9.52±0.03b118.52±2.21d9.18±0.310.12±0.09dMY-2312.80±0.21e4.19±0.09c8.82±0.26c113.37±1.68e8.67±0.120.31±0.13bMY-4113.40±0.24b4.70±0.06a3.53±0.14f126.00±0.73b7.24±0.110.23±0.07cM-485.40±0.20f2.94±0.34d14.63±0.41a26.85±0.16f9.42±0.461.46±0.17aYM-5113.20±0.17c4.54±0.24b4.56±0.37e125.45±1.26b6.74±0.130.08±0.04e
注:不同字母表示同一列数据存在显著差异(P<0.05)。
2.2.2 红枣乳酸菌发酵液抗氧化性测定
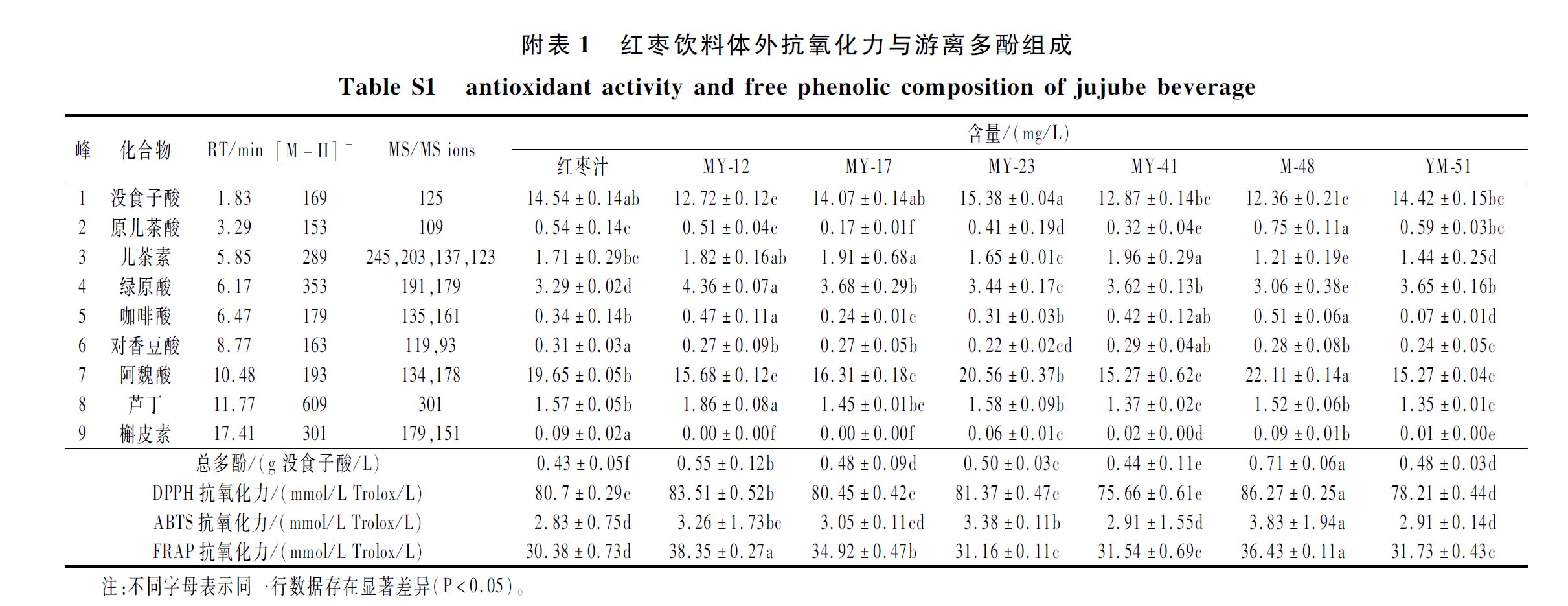
6株乳酸菌发酵后红枣汁的抗氧化活性如电子版中的增强出版附表1所示(https://doi.org/10.13995/j.cnki.11-1802/ts.034909)。相较于对照红枣汁,6株乳酸菌发酵后均能提升对DPPH、ABTS和FRAP的自由基清除能力。其中,乳酸菌MY-12发酵液对于DPPH自由基和FRAP的清除能力较强,相较对照组分别提升了2.81和7.97 mmol Trolox/L;而菌株M-48发酵液对ABTS阳离子自由基清除能力最强,比对照样品提升了35.34%。以上结果表明,红枣汁接种乳酸菌发酵对其抗氧化能力的提升具有正向影响。乳酸菌MY-12和M-48发酵后总多酚含量分别较红枣汁增加了27.90%和65.12%,这可能由于菌株中相关水解酶将复杂的酚类化合物水解成更简单的形式[8],例如将糖基化的酚类物质脱糖,并从植物细胞壁上释放出游离的酚类化合物[9],而乳酸菌发酵后体外抗氧化力的增强可以归于游离多酚类物质的变化[10]。
因此,进一步研究提取游离酚类化合物进行质谱检测,可以看出红枣汁及其乳酸菌发酵液中游离酚类化合物主要是没食子酸、阿魏酸、绿原酸等。红枣汁被乳酸菌发酵后原儿茶酸含量的下降可能是由于脱羧基反应,通过该反应被代谢为儿茶酚,对香豆酸含量降低的原因是其脱羧基生成对乙烯基苯酚,然后酚酸还原酶把其还原为4-乙基苯酚[11]。此外,糖、有机酸和氨基酸的代谢,即乳酸菌的能量代谢,也会影响酚酸的脱羧基和还原反应[12]。酚类化合物的生物转化已被证明是与脱羧酶或还原酶活性有关[13]。
2.2.3 红枣饮料感官品评
采用“描述性感官分析”方法对红枣发酵液的感官特征进行了评价[14],表3显示了各菌株发酵所得发酵红枣汁感官品评得分结果。由表3可知,未经处理的红枣汁的涩味和腻味分别可达到8.2和7.1分,不同菌种发酵后,酸味和花香明显增加,并占主导地位。香气指标下各菌株具有一定差异,其中菌株MY-12,MY-41发酵红枣汁香气较馥郁,花香果香感官得分最高,而MY-17酸味最强并红枣典型性强,MY-23和YM-51发酵红枣香气愉悦度低,有轻微异杂味,整体香味不足,M-48的发酵液酸臭味明显,气味比较刺鼻,令人不悦。在口味上,MY-12和MY-23酸甜适中,酸味分别为6.3和5.0分;MY-41和YM-51偏甜而酸味不足,酸味为3.4和4.0分;MY-17和M-48酸味太过突出,酸味达到9.0和9.1分。
表3 红枣饮料感官得分
Table 3 Organoleptic evaluation of jujube beverage

项目红枣汁MY-12MY-17MY-23MY-41M-48YM-51果香7.09.47.63.08.02.17.3花香5.48.76.55.39.11.47.1臭味1.11.02.24.01.99.72.8腻味7.13.02.69.18.16.65.7酸味3.06.39.05.03.49.14.0涩味8.23.63.25.39.34.15.1发酵性1.49.08.26.03.28.06.0外观7.07.14.06.85.83.45.9总体接受度5.69.68.86.77.81.26.9
2.2.4 红枣饮料非挥发性物质测定
红枣乳酸菌饮料中的非挥发性成分主要由糖和有机酸组成,不同菌种发酵红枣汁的测定结果如表4所示。就对于糖利用而言,这些菌株可以优先利用葡萄糖和蔗糖,而同时有研究表明乳酸菌的水解酶也可以代谢低聚果糖[15]。甘油和山梨糖醇因其对光滑度、甜度和复杂性的影响而成为饮料中的感官化合物[16]。发酵后的甘油含量均降低,这是因为乳酸菌会代谢甘油生成醛类物质[17],而山梨糖醇除M-48外其他组较对照组无显著变化。
表4 红枣饮料中非挥发性物质组成 单位:g/L
Table 4 Non-volatile components in jujube beverage

组分红枣汁MY-12MY-17MY-23MY-41M-48YM-51糖与多元醇蔗糖40.89±0.07a38.53±0.01ab35.63±0.05b36.48±0.07b38.89±0.06ab31.25±0.06c37.35±0.01b葡萄糖52.83±0.01a45.97±0.06b41.29±0.03c36.16±0.03d44.26±0.01bc21.38±0.06c42.18±0.05e果糖37.42±0.03a34.52±0.04a35.24±0.01a31.48±0.04b34.95±0.01a30.23±0.10b35.24±0.02a甘油0.73±0.03a0.58±0.04b0.27±0.02d0.19±0.01e0.21±0.02e0.03±0.00f0.39±0.00c山梨糖醇0.05±0.01b0.07±0.01ab0.06±0.01b0.05±0.01b0.05±0.00b0.13±0.02a0.05±0.01b有机酸草酸0.01±0.00d0.02±0.02c0.05±0.00b0.01±0.00d0.01±0.00d0.09±0.01a0.01±0.00d酒石酸0.04±0.01f0.18±0.04d0.21±0.03c0.17±0.03d0.11±0.02e0.31±0.01a0.26±0.02b丙酮酸0.02±0.00e0.04±0.01d0.16±0.00c0.02±0.00e0.02±0.00e0.35±0.03b0.64±0.01a苹果酸0.09±0.01f0.12±0.01f1.97±0.03b0.92±0.01d0.42±0.08e4.12±0.02a1.12±0.04c乳酸6.24±0.05d8.92±0.07a9.04±0.04a7.92±0.06bc7.17±0.04cd8.24±0.05b7.64±0.06cd乙酸0.15±0.01d0.24±0.03d1.03±0.05b0.64±0.01c0.21±0.03d3.21±0.04a0.18±0.01d柠檬酸0.04±0.02d0.07±0.01d0.94±0.06b0.07±0.02d0.02±0.00d2.13±0.04a0.18±0.03c
注:不同字母表示同一行数据存在显著差异(P<0.05)。
红枣饮料中有机酸种类丰富,共检出有机酸7种,其中含量最高的有机酸为乳酸。有机酸有助于中和红枣甜腻口感,丰富饮料层次,提高整体品质,但含量过高则表现酸感突出、口感粗糙。乳酸口感柔和,增加酒体醇厚度[18],MY-12和MY-17发酵的红枣汁乳酸含量最高,达8.92和9.04 g/L,作为一种温和有机酸,更高浓度乳酸可能使饮料更柔滑。但MY-17的柠檬酸和苹果酸相较更高,柠檬酸酸味较长,口感圆润清爽,但过量则有辛辣感[19],苹果酸酸感清爽,呈味持久且略带刺激性。
2.2.5 红枣饮料挥发性物质组成分析
通过GC-MS检测到红枣饮料中31种不同的香气化合物,包括醇、醛、酮、酯、挥发酚和酸等。在这些化合物中,确定了11个酸类、4个醇类、5个醛类、5个酮类和6个酯类化合物,总体而言,乳酸菌发酵的样品的香气化合物总量均高于发酵前的对照样品,而酸类化合物含量最高,占所有挥发性物质的53.84%~81.18%。由电子增强出版附件图1所示(https://doi.org/10.13995/j.cnki.11-1802/ts.034909),菌株MY-12发酵的样品提高了异戊醇、苯甲醇、己醛、辛酸乙酯和乙酸乙酯等挥发性物质含量,菌株MY-23发酵的样品2-甲基丁酸、己酸、壬酸和十二烷酸乙酯等物质的含量得到提升,菌株M-48发酵样品的丁酸、糠醛、乙酸和仲辛酮等含量最高。综上,乳酸菌发酵后整体酸类物质得到提升,而醛被认为是通过与氨基酸的反应或不饱和脂肪酸的β-氧化形成的,而发酵会促进这些反应[20],同时研究表明,醛类化合物在微生物作用下是不稳定的,在食物基质中很容易被还原为醇或氧化为酸[21]。此外,发酵过程增加了酮的形成,这些酮类物质被认为具有草药、水果甚至是花的芳香,可能为枣汁提供更宜人的香气,醇被认为是由乳糖代谢、脂肪酸降解、氨基酸代谢和酮类物质还原形成的[14]。某些酯类的降低可能通过发酵过程降解为相应的酸和醇[22]。并不是所有挥发物都对枣汁的感官特征有显著影响,可能与某些强效微量挥发物阈值较低有关。

a-挥发性化合物;b-菌株产品样本
图1 红枣饮料主成分分析
Fig.1 Principal component analysis of jujube beverage
2.2.6 红枣饮料主要挥发性化合物的香气活力值(odor activity value,OAV)
为进一步评价每种挥发物的风味作用,对菌株发酵和未处理样品进行定量分析和OAV计算。OAV用来表征化合物对样品香气的贡献程度,通过该挥发性风味化合物在样品中浓度与该化合物气味阈值比值计算[23],OAV>1则表示该化合物对整体香气具有显著贡献[24]。由电子增强出版附件表2(https://doi.org/10.13995/j.cnki.11-1802/ts.034909)可知,红枣饮料25种挥发性化合物中共有14种化合物OAV>1,为关键香气化合物。其中苯甲醇和苯乙醇是各种风味优秀的果汁和具有花香的葡萄酒中的成分,是苯丙氨酸分解代谢的结果[25],己醛具有青草和水果的清香,乙酸乙酯有着水果的特征香气,这些化合物可给酒体贡献积极的果香味和花香。MY-12发酵液样品中以上几种化合物OAV相较最高,分别为1.29、3.61和1.23,这也是表3中感官品评结果中MY-12发酵液具有更强烈的花香水果气味的重要原因。酸类物质是饮料中重要呈味物质,可赋予酒体协调的口感,但高浓度下产生脂肪、腐臭等异味,给产品带来负面影响。十二烷酸乙酯、肉豆蔻酸甲酯和月桂酸乙酯具有脂肪和奶油等负面腻味,而通过乳酸菌的发酵将其分解为酸和醇,故大多样品发酵后含量均下降,发酵前红枣汁和M-48样品的含量最高。糠醛、苯甲醛和苯甲酸甲酯具有杏仁和坚果味道,其含量过高时会有焦糊味和酸涩味等不悦风味,原枣汁中上述物质含量较高,为枣汁涩味的来源,MY-41样品中上述化合物浓度更高,在感官结果可以得到证实。
研究进一步对OAV>1的14种挥发性化合物作主成分分析,结果如图1所示。
由图1-a可以看出,前2个主成分描述90.84%方差,其中第一主成分(PC1)占方差67.55%,与乙酸乙酯等呈正相关,与己酸等呈负相关。第二主成分(PC2)占方差24.59%,与戊酸等呈正相关,与月桂酸乙酯等呈负相关。化合物之间主成分得分有重叠,表明其含量具有相似特征。基于PC1和PC2计算得到每个菌株发酵饮料样本分数FAC1和FAC2,分别对应图1-b中x和y轴,该图显示7个样品在坐标系中差异,样品相距越远其差异值越大。
综合上述研究,经相同发酵时间,菌株MY-12发酵红枣汁酸甜适中,对红枣中游离多酚增强效果明显,挥发性风味物质组成较优,感官评价口感协调,香气馥郁,对红枣甜腻和涩味口感改善明显,具有发酵优秀品质功能性红枣乳酸菌饮料的潜力。
2.3 菌株鉴定
对优选菌株MY-12提取菌体DNA后,进行16S rDNA测序分析,采用BLAST 方式将测定的16S rDNA 序列与GenBank中序列作比对,生成系统发育树结果,如图2所示。可以看出,所筛选菌株为植物乳植杆菌(Lactiplantibacillus plantarum)。
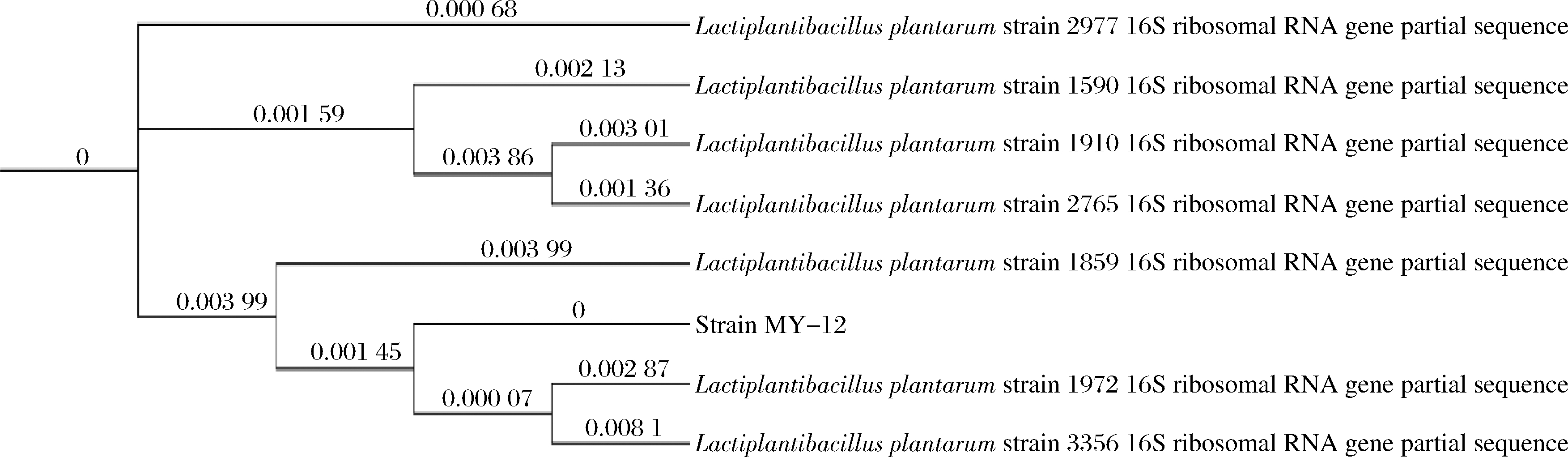
图2 基于16S rDNA 测序所构建乳酸菌菌株系统发育树
Fig.2 Phylogenetic tree of Lactobacillus strain based on 16S rDNA sequencing
3 主要结论与展望
用乳酸菌发酵红枣汁可以通过一定数量的乳酸菌活菌数(>6 lg CFU/mL)到达肠道以实现益生作用,同时植物饮料所能提供的多酚等多种功能因子可以对人体有多种益处,通过乳酸菌发酵可以增强体外抗氧化力和游离多酚含量,同时利用功能性食品原料—红枣作为植物基,通过乳酸菌发酵不仅可以提升食品质量,还可以增加感官表达提高其营养特性。
本试验以水果自然发酵液和实验室保藏菌株为筛选源,基于产酸能力、耐酸能力、耐胆盐能力、发酵性能试验和产品挥发性风味化合物分析,筛选获得优良植物乳植杆菌菌株MY-12。该菌株产酸能力强,有着益生菌特性,在含糖量140 g/L的红枣汁中,37 ℃发酵48 h可产生的活菌数超过9 lg CFU/mL、糖酸比为20、口感协调的红枣乳酸菌饮料。使用该菌株发酵所得红枣饮料中多种挥发性风味化合物如异戊醇、苯甲醇等均优于其他菌株或处于较高水平,使得发酵后产品口感清爽,极大改善了红枣汁原本甜腻的风味,感官品评结果优于其他菌株。目前,乳酸菌发酵植物饮料是近几年的研究热点,但很少聚焦于红枣深加工产品的解决办法。研究乳酸菌在红枣饮料中的发酵特性,提供系统的选育方法,并筛选得到具有优良发酵品质的乳酸菌菌株,对于未来发酵型植物益生饮料的研发具有较强的理论意义和工业应用参考价值。


[1] SHI Q Q, HAN G, LIU Y, et al.Nutrient composition and quality traits of dried jujube fruits in seven producing areas based on metabolomics analysis[J].Food Chemistry, 2022, 385:132627.
[2] 戴俊生, 包艳丽, 张永恩, 等.我国红枣市场与产业调查分析报告[J].农产品市场, 2021(4):49-51.
DAI J S, BAO Y L, ZHANG Y E, et al.Investigation and analysis report on Chinese jujube market and industry[J].Agricultural Products Market, 2021(4):49-51.
[3] 汪弘扬, 张传辉, 刘雨涵.后疫情时代红枣市场调查与预测[J].中国市场, 2022(15):142-144.
WANG H Y, ZHANG C H, LIU Y H.Investigation and forecast of jujube market in post-epidemic era[J].China Market, 2022(15):142-144.
[4] BANCALARI E, CASTELLONE V, BOTTARI B, et al.Wild Lactobacillus casei group strains:Potentiality to ferment plant derived juices[J].Foods, 2020, 9(3):314.
[5] 赵媚, 常凌, 宋泽和, 等.植物多酚与肠道微生物群的相互作用及其对代谢性疾病影响的研究进展[J].食品科学, 2021, 42(5):305-313.
ZHAO M, CHANG L, SONG Z H, et al.Interactions between plant polyphenols and intestinal microbiota and their effects on metabolic diseases[J].Food Science, 2021, 42(5):305-313.
[6] JAMAR G, ESTADELLA D, PISANI L P.Contribution of anthocyanin-rich foods in obesity control through gut microbiota interactions[J].BioFactors, 2017, 43(4):507-516.
[7] 张云亮, 范洪臣, 窦博鑫, 等.红枣相关产品的研究进展[J].保鲜与加工, 2021, 21(4):146-150.
ZHANG Y L, FAN H C, DOU B X, et al.Research progress of red jujube related products[J].Storage and Process, 2021, 21(4):146-150.
[8] VIVEK K, MISHRA S, PRADHAN R C, et al.Effect of probiotification with Lactobacillus plantarum MCC 2974 on quality of Sohiong juice[J].LWT, 2019, 108:55-60.
[9] BENINCASA C, MUCCILLI S, AMENTA M, et al.Phenolic trend and hygienic quality of green table olives fermented with Lactobacillus plantarum starter culture[J].Food Chemistry, 2015, 186:271-276.
[10] LI T L, JIANG T, LIU N, et al.Biotransformation of phenolic profiles and improvement of antioxidant capacities in jujube juice by select lactic acid bacteria[J].Food Chemistry, 2021, 339:127859.
[11] FILANNINO P, BAI Y P, DI CAGNO R, et al.Metabolism of phenolic compounds by Lactobacillus spp.during fermentation of cherry juice and broccoli puree[J].Food Microbiology, 2015, 46:272-279.
[12] RIZZELLO C G, FILANNINO P, DI CAGNO R, et al.Quorum-sensing regulation of constitutive plantaricin by Lactobacillus plantarum strains under a model system for vegetables and fruits[J].Applied and Environmental Microbiology, 2014, 80(2):777-787.
[13] FILANNINO P, CARDINALI G, RIZZELLO C G, et al.Metabolic responses of Lactobacillus plantarum strains during fermentation and storage of vegetable and fruit juices[J].Applied and Environmental Microbiology, 2014, 80(7):2206-2215.
[14] BEZERRA T K A, DE OLIVEIRA ARCANJO N M, DE ARA JO A R R, et al.Volatile profile in goat Coalho cheese supplemented with probiotic lactic acid bacteria[J].LWT-Food Science and Technology, 2017, 76:209-215.
JO A R R, et al.Volatile profile in goat Coalho cheese supplemented with probiotic lactic acid bacteria[J].LWT-Food Science and Technology, 2017, 76:209-215.
[15] 赖鲸慧, 祝元婷, 陈媛, 等.乳酸菌代谢低聚果糖/菊粉途径及机理的研究进展[J].食品科学, 2022, 43(9):364-372.
LAI J H, ZHU Y T, CHEN Y, et al.Recent progress in understanding metabolic pathways and mechanisms of fructooligosaccharides/inulin by lactic acid bacteria[J].Food Science, 2022, 43(9):364-372.
[16] BALLESTER-TOM S L, PRIETO J A, GIL J V, et al.The Antarctic yeast Candida sake:Understanding cold metabolism impact on wine[J].International Journal of Food Microbiology, 2017, 245:59-65.
S L, PRIETO J A, GIL J V, et al.The Antarctic yeast Candida sake:Understanding cold metabolism impact on wine[J].International Journal of Food Microbiology, 2017, 245:59-65.
[17] FILANNINO P, DI CAGNO R, TRANI A, et al.Lactic acid fermentation enriches the profile of biogenic compounds and enhances the functional features of common purslane (Portulaca oleracea L.)[J].Journal of Functional Foods, 2017, 39:175-185.
[18] KUMAZAWA K.Food science studies on beverage flavors[J].Nippon Shokuhin Kagaku Kogaku Kaishi, 2011, 58(3):81-87.
[19] CAPPELLO M S, ZAPPAROLI G, LOGRIECO A, et al.Linking wine lactic acid bacteria diversity with wine aroma and flavour[J].International Journal of Food Microbiology, 2017, 243:16-27.
[20] LIZARDO R C M, CHO H D, WON Y S, et al.Fermentation with mono-and mixed cultures of Lactobacillus plantarum and L.casei enhances the phytochemical content and biological activities of cherry silverberry (Elaeagnus multiflora Thunb.) fruit[J].Journal of the Science of Food and Agriculture, 2020, 100(9):3687-3696.
[21] 张洋洋, 张伟国, 徐建中, 等.米酒液态发酵过程中理化指标和风味物质变化规律[J].东北农业大学学报, 2020, 51(12):79-89.
ZHANG Y Y, ZHANG W G, XU J Z, et al.Changes of physicochemical indices and flavor substances in rice wine during liquid fermentation[J].Journal of Northeast Agricultural University, 2020, 51(12):79-89.
[22] KAPRASOB R, KERDCHOECHUEN O, LAOHAKUNJIT N, et al.B vitamins and prebiotic fructooligosaccharides of cashew apple fermented with probiotic strains Lactobacillus spp., Leuconostoc mesenteroides and Bifidobacterium longum[J].Process Biochemistry, 2018, 70:9-19.
[23] FENG Z H, LI M, LI Y F, et al.Characterization of the orchid-like aroma contributors in selected premium tea leaves[J].Food Research International, 2020, 129:108841.
[24] GAROFALO C, BERBEGAL C, GRIECO F, et al.Selection of indigenous yeast strains for the production of sparkling wines from native Apulian grape varieties[J].International Journal of Food Microbiology, 2018, 285:7-17.
[25] SEVINDIK O, GUCLU G, AGIRMAN B, et al.Impacts of selected lactic acid bacteria strains on the aroma and bioactive compositions of fermented gilaburu (Viburnum opulus) juices[J].Food Chemistry, 2022, 378:132079.