L-丙氨酸(L-α-丙氨酸)是一种重要的天然氨基酸,是人体血液中含量最多的氨基酸,与糖代谢密切相关,是转氨反应中重要的氨基供体,具有重要的生理功能。此外,其还具有防止其他氨基酸褐变、缓冲酸碱以及螯合重金属的作用[1]。L-丙氨酸被广泛应用于医药、食品、饲料等领域。在食品领域,L-丙氨酸是甜味最强的氨基酸,甜味约为蔗糖的70%,是甘氨酸甜度的1.6倍[2]。除作甜味剂外,L-丙氨酸还可以增强鲜味,调和食品的咸味、酸味,缓和辣味、苦味、涩味等刺激性味道[3]。L-丙氨酸能够被细胞直接吸收,有利于提高在食品和饮料中的蛋白利用率,而且与其他调味剂相比,它的独特优势在于国家标准中并未限定L-丙氨酸的用量[4]。在医药领域,L-丙氨酸是合成氨基丙醇的重要原料,也是组成复合氨基酸注射液和口服液的原料;还是潜在的胰高血糖素分泌刺激剂,已用于急性和慢性胰腺炎患者的高血糖素的研究中。另外,L-丙氨酸可以缓解酒精对肝脏的伤害,且具有减肥的功效。在饲料领域,L-丙氨酸对一些幼畜内脏的氮循环具有一定的生理作用和积极意义,例如在实验小鼠糖代谢方面起到重要的作用[5]。饲料中添加一定量的L-丙氨酸,可以促进动物生长、缓解应激、预防疾病,具有增强免疫的作用[6]。L-丙氨酸在工业上主要发挥螯合作用,以L-丙氨酸为原料生产的二羧甲基丙氨酸(N, N-dicarboxymethyl alanine, MGDA),具有高效的螯合能力[7]。MGDA对人类和环境无危害,可用于农业、纺织业、化妆品等行业的清洗工序,其良好的生态和毒理学特性、高效的清洁能力、对皮肤的无刺激性将引领新型螯合剂的发展[8]。
目前,L-丙氨酸的工业生产主要采用微生物发酵法,和其他方法相比,微生物发酵法反应条件温和、成本较低、可实现大规模生产。生产效率主要取决于所应用的工程菌株,L-丙氨酸的生产菌株主要为大肠杆菌(Escherichia coli)。为了提高L-丙氨酸直接前体物丙酮酸的供应,LEE等[9]将表达球形芽孢杆菌(Bacillus sphaericus)丙氨酸脱氢酶基因alaD的质粒导入aceF和ldhA双突变的大肠杆菌宿主,来生产L-丙氨酸。该菌株需要乙酸作为额外碳源,通过先好氧、后限氧两阶段发酵27 h,L-丙氨酸产量达到32 g/L。随后,他们进一步敲除了宿主丙酮酸代谢相关基因pfl、pps和poxB,优化发酵控制工艺后,通过两阶段发酵30 h,L-丙氨酸产量达到88 g/L[10]。ZHANG等[11]以大肠杆菌W菌株出发,敲除了mgsA和dadX基因,在ldhA位点表达来源于嗜热脂肪地芽孢杆菌(Geobacillus stearothermophilus)的丙氨酸脱氢酶基因,该菌株L-丙氨酸合成过程中,NADH的氧化与ATP再生和细胞生长相耦联,因此采用适应性进化筛选生长加快的菌株即为L-丙氨酸合成能力提高的菌株,最终进化菌株XZ132发酵48 h时产生113.8 g/L L-丙氨酸。与大肠杆菌相比,谷氨酸棒杆菌在工业发酵领域具有特殊优点:不产生内毒素,为食品安全级菌株,对碳源及目标产物具有高浓度耐受性,缺乏限制修饰系统,具有较强的遗传稳定性,不易污染噬菌体[12-13]。近年来,随着谷氨酸棒杆菌全基因组测序的完成[14]和基因编辑技术的成熟[15-16],利用代谢工程技术改造谷氨酸棒杆菌生产氨基酸等产品受到越来越多的关注。
本研究以谷氨酸棒杆菌(Corynebacterium glutamicum)ATCC 13032 strpR[17]为出发菌株,首先,筛选不同来源的丙氨酸脱氢酶并多拷贝整合到基因组中来促进L-丙氨酸的合成;然后,在敲除ldhA的同时整合大肠杆菌来源的丙氨酸输出蛋白基因alaE,引入非磷酸转移酶系统(phosphotransferase system, PTS)来促进葡萄糖的吸收和细胞的生长;最后,对比研究强化糖酵解关键基因和引入Entner-Doudoroff(ED)途径来促进前体物丙酮酸的供应。L-丙氨酸在谷氨酸棒杆菌中的合成路径和上述代谢工程改造策略见图1。工程菌株在5 L发酵罐中发酵48 h,L-丙氨酸产量达到104 g/L。
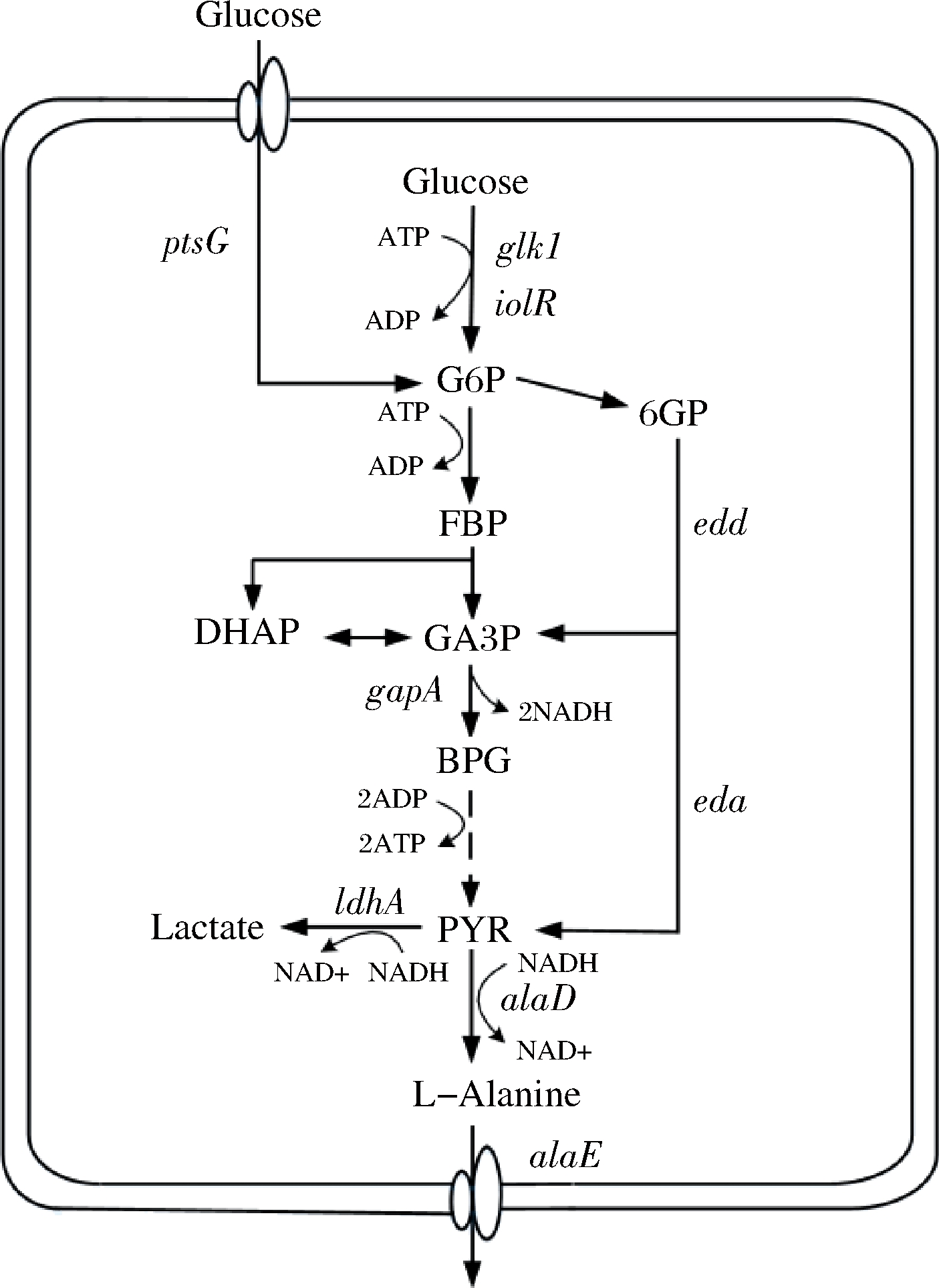
图1 谷氨酸棒杆菌中L-丙氨酸合成途径及代谢工程改造策略
Fig.1 L-Alanine biosynthetic pathway in Corynebacterium glutamicum and metabolic engineering strategies
注:蓝色代表基因过表达;红色代表敲除;绿色代表引入外源基因。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
本研究所用菌株与质粒见表1。
表1 本研究所用的菌株和质粒
Table 1 Strains and plasmids used in this study

菌株/质粒描述来源E.coli DH5α大肠杆菌克隆宿主,F-, △(lacZYA-argF) U169, hsdR17 (rk-mk+), recA1, endA1, relA1实验室保藏C.glutamicum strpRC.glutamicum ATCC 13032 rpsLK43T,链霉素抗性实验室保藏Ala1-113032 rpsLK43T/pXTuf本研究Ala1-213032 rpsLK43T/pXTuf-alaDVna本研究Ala1-313032 rpsLK43T/pXTuf-alaDBsu本研究Ala1-413032 rpsLK43T/pXTuf-alaDNge本研究Ala1-513032 rpsLK43T/pXTuf-alaDLcb本研究Ala2-113032 rpsLK43Tcg1960::Ptuf-alaDBsu本研究Ala2-2Ala2-1 cg2037::Ptuf-alaDBsu本研究Ala2-3Ala2-2 cg07180719::Ptuf-alaDBsu本研究Ala3-1Ala2-3 ldhA::PgapA-alaE本研究Ala3-2Ala2-3△ldhA本研究Ala4Ala3-1iolR::Psod-glk1本研究Ala5Ala4 cg1890::Ptrc-ptsG本研究Ala6Ala5 hdpA::Ptuf-gapA本研究Ala7-1Ala2-3/pXTuf本研究Ala7-2Ala2-3/pXTuf-eddedaEco本研究Ala7-3Ala2-3/pXTuf-eddedaVna本研究Ala7-4Ala2-3/pXTuf-eddedaXcc本研究Ala8Ala6 cg1895::Ptuf-eddedaEco本研究pXTuf来源于谷氨酸棒杆菌/大肠杆菌穿梭质粒pXMJ19,将lacI和Ptac替换为Ptuf,氯霉素抗性实验室保藏[17]pXTuf-alaDVna表达需钠弧菌(Vibrio natriegens)丙氨酸脱氢酶基因alaD本研究pXTuf-alaDBsu表达枯草芽胞杆菌(Bacillus subtilis)丙氨酸脱氢酶基因alaD本研究pXTuf-alaDNge表达格氏嗜盐碱杆菌(Natronobacterium gregoryi)丙氨酸脱氢酶基因alaD本研究pXTuf-alaDLcb表达干酪乳杆菌(Lactobacillus casei)丙氨酸脱氢酶基因alaD本研究pXTuf-eddedaEco表达大肠杆菌(E.coli)eddeda操纵子本研究pXTuf-eddedaVna表达需钠弧菌(V.natriegens)eddeda操纵子本研究pXTuf-eddedaXcc表达野油菜黄单胞菌(Xanthomonas campestris pv. campestris)eddeda操纵子本研究pK18mobrpsL来源于自杀型质粒pK18mobsacB,将sacB替换为Ptuf-rpsL表达框,卡纳霉素抗性实验室保藏[15]pK18-cg1960::Ptuf-alaDBsupK18mobrpsL质粒携带cg1960上下游同源臂含中间Ptuf-alaDBsu表达框片段,用于基因组整合本研究pK18-cg2037::Ptuf-alaDBsu携带cg2037上下游同源臂含中间Ptuf-alaDBsu片段本研究pK18-cg07180719::Ptuf-alaDBsu携带cg07180719上下游同源臂含中间Ptuf-alaDBsu片段本研究pK18-ldhA::PgapA-alaE携带ldhA上下游同源臂含中间PgapA-alaE片段本研究pK18-iolR::Psod-glk1携带iolR上下游同源臂含中间Psod-glk1片段本研究pK18-cg1890::Ptrc-ptsG携带cg1890上下游同源臂含中间Ptrc-ptsG片段本研究pK18-hdpA::Ptuf-gapA携带hdpA上下游同源臂含中间Ptuf-gapA片段本研究pK18-cg1895::Ptuf-eddedaEco携带cg1895上下游同源臂含中间Ptuf-eddedaEco片段本研究
1.1.2 培养基
LB(Luria-Bertani)培养基(g/L):胰蛋白胨10,酵母粉5,NaCl 5,pH 7.0,121 ℃灭菌20 min。
脑心浸液液体(brain heart infusion broth,BHIB)培养基(g/L):脑心浸液38.5,121 ℃灭菌20 min。
脑心浸液琼脂(brain heart infusion agar,BHIA)固体培养基(g/L):脑心浸液38.5,琼脂粉2%(质量分数),121 ℃灭菌20 min。
BHIS(brain heart infusion supplemented)复苏液(g/L):脑心浸液38.5,葡萄糖5,115 ℃灭菌15 min。
摇瓶种子培养基(g/L):葡萄糖40,(NH4)2SO4 1,KH2PO4 1.5,MgSO4·7H2O 0.4,FeSO4·7H2O 10 mg/L,MnSO4·H2O 10 mg/L,维生素B1、维生素B3、维生素B5、维生素B12各0.4 mg/L,生物素0.1 mg/L,酵母粉5,蛋氨酸0.3,谷氨酸1,丝肽粉2,苯酚红2%(体积分数),消泡剂少许,pH 7.0~7.2,115 ℃灭菌15 min。
摇瓶发酵培养基(g/L):葡萄糖80,(NH4)2SO4 3,KH2PO4 2.5,MgSO4·7H2O 1.6,FeSO4·7H2O 10 mg/L,MnSO4·H2O 10 mg/L,维生素B1、维生素B3、维生素B5、维生素B12各0.3 mg/L,酵母粉2,蛋氨酸0.2,谷氨酸2,丝肽粉5,苯酚红2%,消泡剂少许,pH 7.0~7.2,115 ℃灭菌15 min。
发酵罐种子培养基(g/L):葡萄糖40,KH2PO4 2,MgSO4·7H2O 1.2,MnSO4·H2O 10 mg/L,FeSO4 10 mg/L,维生素B1 0.5 mg/L,生物素0.1 mg/L,酵母粉5,蛋氨酸0.3,玉米浆30(121 ℃、20 min单独灭菌),豆粕水解液20 mL/L,消泡剂少许,pH 7.0~7.2,115 ℃灭菌15 min。
发酵罐发酵培养基(g/L):葡萄糖60,KH2PO4 2.5,MgSO4·7H2O 1.6,MnSO4·H2O 10 mg/L,FeSO4 10 mg/L,维生素B1 0.5 mg/L,生物素0.05 mg/L,谷氨酸2,蛋氨酸0.4,玉米浆35(121 ℃、20 min单独灭菌),豆粕水解液30 mL/L,消泡剂少许,pH 7.0~7.2,115 ℃灭菌15 min。
1.1.3 主要试剂
限制性内切酶Xba I、Kpn I、Hind III、BamH I、Primer STAR HS DNA Polymerase、Solution I连接酶,TaKaRa公司;2×Taq Master Mix、ClonExpress II(重组酶),诺唯赞生物科技有限公司;质粒提取试剂盒、DNA直接回收试剂盒、DNA凝胶回收试剂盒,美国Omega Bio-Tek公司;1 kb DNA Marker,北京博迈德科技发展有限公司;硫酸卡那霉素、硫酸链霉素、氯霉素,美国Sigma公司。
1.2 实验方法
1.2.1 质粒构建
本研究所用引物见电子增强出版附件(https://doi.org/10.13995/j.cnki.11-1802/ts.034924)。过表达质粒的构建:分别以需钠弧菌ATCC 14048、枯草芽孢杆菌168、格氏嗜盐碱杆菌ATCC 43098和干酪乳杆菌BL23基因组为模板,扩增编码丙氨酸脱氢酶基因alaD的目的片段,并在上下游引物中设计携带与pXtuf酶切后线性载体两端同源的序列。用限制性核酸内切酶Hind III和BamH I酶切线性化pXtuf载体。利用同源重组的方法将目的基因和线性化载体连接,获得过表达质粒pXtuf-alaDVna、pXtuf-alaDBsu、pXtuf-alaDNge和pXtuf-alaDLcb。采用类似的方法,分别以大肠杆菌W3110、需钠弧菌ATCC 14048和野油菜黄单胞菌ATCC 33913基因组为模板克隆eddeda操纵子序列,通过同源重组方法与线性化载体连接,获得过表达质粒pXtuf-eddedaEco、pXtuf-eddedaVna和pXtuf-eddedaXcc。
基因组编辑质粒的构建:首先扩增基因组上靶基因位点的上下游同源臂、启动子片段、目的基因片段,将以上片段通过重叠PCR方法连接起来。用限制性核酸内切酶Xba I和Kpn I双酶切pK18mobrpsL进行载体线性化。利用同源重组的方法将重叠片段和线性载体进行连接,获得一系列用于基因组编辑的pK18mobrpsL衍生质粒。
大肠杆菌DH5α感受态细胞的制备采用CaCl2介导的方法。将同源重组连接体系转化至大肠杆菌DH5α感受态细胞,于氯霉素或卡那霉素抗性平板培养,筛选转化子验证正确的接入LB培养基37 ℃过夜培养,抽提质粒并送至金唯智公司测序以确认重组质粒构建成功。
1.2.2 菌株构建
过表达菌株的构建:将上述构建过表达质粒电转化入谷氨酸棒杆菌感受态细胞,验证正确的菌株并培养保存。
基因组编辑采用基于自杀型质粒的2次同源重组方法,第1次同源重组采用卡那霉素筛选,为了提高第2次重组的筛选效率,前期研究中将蔗糖筛选标记替换为链霉素筛选标记[15]。将pK18mobrpsL衍生质粒电转化入谷氨酸棒杆菌感受态细胞,通过2次同源重组筛选,将PCR验证正确的菌株送至金唯智公司测序以确认构建成功。
1.2.3 摇瓶发酵
首先利用BHIA斜面培养基将菌体传代2次,完成菌种活化。用接种环从二代斜面划取2环接到装液量为30 mL种子培养基的500 mL圆底三角瓶中,于200 r/min、32 ℃培养12~14 h,测定OD600值。将摇瓶种子液按10%(体积分数)的接种量接入装液量为30 mL的500 mL挡板三角瓶中,于200 r/min、32 ℃进行摇瓶培养48 h,取样检测发酵液中L-丙氨酸的含量。
1.2.4 发酵罐发酵
种子培养:将茄形瓶斜面上活化好的二代菌种通过无菌水洗脱下来,接种到5 L发酵罐进行种子培养,培养液定容至3 L,温度控制在32~34 ℃,自动流加氨水控制发酵液pH值在6.7~7.2,控制初始通气量为2 L/min,初始搅拌转速为200 r/min,溶氧维持在10%~40%。
发酵培养:种子培养至OD600为20~30时,按照20%(体积分数)的接种量,将培养好的种子液接入发酵培养基中,将初始发酵液体积定容至3 L,温度控制在32~34 ℃,通过自动流加氨水控制培养基pH在6.7~7.2,通过搅拌和通风控制溶氧在10%~40%,当葡萄糖浓度降至5 g/L以内时流加80%的葡萄糖溶液。定期取样并测定OD600值,发酵48 h时测定L-丙氨酸含量。
1.3 分析方法
对发酵液进行适当稀释,用紫外可见分光光度计测定在600 nm处的吸光值。葡萄糖的浓度采用生物传感分析仪SBA-40E测定。采用HPLC测定L-丙氨酸的浓度,所用仪器为岛津LC-20A高效液相色谱仪,色谱柱为ZORBAX Eclipse AAA(150 mm×3.0 mm,美国安捷伦公司);流动相为50%(体积分数)的乙腈溶液和50 mmol/L乙酸钠溶液;柱温33 ℃;检测波长360 nm;流速1.0 mL/min。
2 结果与分析
2.1 筛选和强化丙氨酸脱氢酶的表达
2.1.1 优化不同来源的丙氨酸脱氢酶
多数微生物(包括谷氨酸棒杆菌)通过转氨反应生成L-丙氨酸,转氨酶以磷酸吡哆醛为辅酶,需要谷氨酸或缬氨酸作为氨基供体[18]。自然界存在一些微生物利用NADH依赖的丙氨酸脱氢酶直接催化丙酮酸和氨合成L-丙氨酸[19-21]。为了构建高效合成L-丙氨酸的谷氨酸棒杆菌菌株,本研究首先比较了不同来源丙氨酸脱氢酶对L-丙氨酸合成的影响。将过表达来源于需钠弧菌、枯草芽胞杆菌、格氏嗜盐碱杆菌和干酪乳杆菌的丙氨酸脱氢酶基因的载体,同空质粒pXtuf一起转入谷氨酸棒杆菌ATCC 13032 strpR[17]中,得到菌株Ala1-1、Ala1-2、Ala1-3、Ala1-4和Ala1-5。将这些菌株进行摇瓶发酵48 h,测定L-丙氨酸产量(图2-a)。对照菌株Ala1-1产生4.28 g/L L-丙氨酸,Ala1-5的L-丙氨酸产量与之相当,其他3株菌产量显著提升,尤其Ala1-3的产量达到60 g/L,说明来自枯草芽孢杆菌的alaD基因效果最佳。

图2 质粒过表达不同来源丙氨酸脱氢酶基因(a)和基因组整合不同拷贝数枯草芽胞杆菌丙氨酸脱氢酶基因菌株(b)的L-丙氨酸产量
Fig.2 L-Alanine production by strains with plasmid-borne expressing of different alanine dehydrogenase (alaD) genes(a) and those with genomic integration of alaD with different copies(b)
2.1.2 多拷贝整合丙氨酸脱氢酶基因
WADA等[22]发现以质粒为载体过表达基因会影响菌体生长,将关键基因多拷贝整合到大肠杆菌基因组上,可以有效提高L-丙氨酸的产量。为了方便后续基因操作和保证菌株的遗传稳定性,将枯草芽胞杆菌来源的alaD基因逐次在谷氨酸棒杆菌基因组上整合至3个拷贝,得到菌株Ala2-1、Ala2-2和Ala2-3。摇瓶结果表明,单拷贝整合菌株Ala2-1产生37.58 g/L L-丙氨酸,随着拷贝数的增加,L-丙氨酸的产量也逐渐提高,Ala2-3的产量达到54.89 g/L(图2-b),已经接近质粒过表达的水平。
2.2 增强葡萄糖的摄取途径
为了阻断丙酮酸到乳酸的代谢以及增强L-丙氨酸的输出,在菌株Ala2-3乳酸脱氢酶基因ldhA位点整合了来源于大肠杆菌的丙氨酸输出蛋白基因alaE,得到菌株Ala3-1。摇瓶培养结果发现该菌株的生长和L-丙氨酸的产量受到显著影响(图3)。为了探究原因,进行了ldhA的单独敲除,所得菌株(Ala3-2)与Ala3-1的生长一致(图3-a),说明敲除ldhA确实影响了菌株的生长。可能的原因是乳酸的生成消耗了NADH,促进了NAD+的再生,有利于糖酵解的进行。菌株Ala2-3摇瓶培养产生了1.67 g/L乳酸,敲除ldhA后菌株Ala3-1的培养液中检测不到乳酸的积累。考虑到去除乳酸副产物是必需的,我们保留了ldhA的敲除,试图在Ala3-1菌株基础上通过加强葡萄糖的摄取和糖酵解(Embden-Meyerhof-Parnas, EMP)途径关键基因的表达来促进细胞的生长和提高L-丙氨酸的产量。

a-生长曲线;b-L-丙氨酸产量
图3 不同菌株摇瓶发酵的生长曲线和L-丙氨酸产量
Fig.3 Cell growth and L-alanine production by different engineered strains
2.2.1 激活非PTS葡萄糖摄取途径
谷氨酸棒杆菌主要通过磷酸烯醇式丙酮酸(phosphoenolpyruvate, PEP)介导的PTS途径来摄取葡萄糖。此外,葡萄糖也可以通过非PTS的肌醇透性酶IolT1和IolT2来运输[23]。一个DeoR类转录因子IolR抑制了iolT1基因的表达,甚至可能还抑制葡萄糖激酶基因(包括glk1、glk2和ppgk)的表达[24]。非PTS系统已经在谷氨酸棒杆菌中被广泛应用,主要是用来生产赖氨酸、亮氨酸、鸟氨酸、琥珀酸和透明质酸等。本研究在Ala3-1菌株iolR基因位点整合了Psod启动子驱动的glk1,减除iolT1转录阻遏的同时增强了葡萄糖激酶的表达,得到菌株Ala4。摇瓶培养结果表面,菌株Ala4的生物量比Ala3-1显著提高,恢复到ldhA敲除前(Ala2-3)的水平(图3-a)。L-丙氨酸的产量也达到57.44 g/L,比Ala2-3提高4.6%(图3-b)。
2.2.2 过表达PTS葡萄糖摄取途径
由于增强非PTS葡萄糖摄取途径显著提高了细胞的生长和L-丙氨酸的产量,进一步探索增强PTS系统的影响。为此,在菌株Ala4的基础上整合了Ptrc启动子驱动的ptsG基因,得到菌株Ala5,其L-丙氨酸产量进一步提高到59.00 g/L(图3-b)。
2.3 增强前体物丙酮酸的供应
2.3.1 强化EMP途径关键酶的表达
作为L-丙氨酸合成的直接前体物,增强丙酮酸的合成代谢流对L-丙氨酸的生产至关重要。在谷氨酸棒杆菌中,EMP途径经过10步反应产生终产物丙酮酸。其中,甘油醛3-磷酸脱氢酶(gapA基因编码)是EMP途径唯一生成辅酶NADH的关键酶,KOGURE等[25]发现其催化的反应为莽草酸生产的限速步骤,同时他们观察到在利用非PTS摄糖的谷氨酸棒杆菌中,1,3-二羟基丙酮(1,3-dihydroxyacetone, DHA)和甘油作为主要副产物被积累。因此,在菌株Ala5的dphA(编码DHAP磷酸酶,催化DHA的生成)位点整合了Ptuf启动子驱动的gapA基因,得到菌株Ala6。摇瓶发酵结果表明,其L-丙氨酸产量比Ala5有小幅提高,达到60.45 g/L(图4-a)。

a-基因组整合EMP和ED途径关键基因;b-质粒过表达不同来源ED途径基因
图4 增强丙酮酸供应对L-丙氨酸产量的影响
Fig.4 Effects of enhancing pyruvate supply by overexpressing key genes in EMP and ED pathways on the production of L-alanine
2.3.2 引入ED途径
由于EMP途径步骤多,强化糖酵解反应的代谢流相对较为困难。一些微生物天然具有一条替代糖分解途径:ED途径,其只经过4步反应即可产生丙酮酸。ED途径的关键酶包括6-磷酸葡糖酸脱水酶(edd基因编码)和2-酮-3-脱氧-6-磷酸葡糖酸醛缩酶(eda基因编码)[26],关键步骤是2-酮-3-脱氧-6-磷酸葡糖酸裂解为丙酮酸和3-磷酸甘油醛,其中3-磷酸甘油醛会继续通过EMP途径生成丙酮酸。近年来,已有报道在谷氨酸棒杆菌中引入ED途径能够促进葡萄糖消耗和乙醇、异丁醇等的生产[27-28]。
拟通过引入ED途径来促进丙酮酸的供应和提高L-丙氨酸的生产。首先,在菌株Ala2-3的基础上,引入过表达来源于大肠杆菌、需钠弧菌和野油菜黄单胞菌eddeda操纵子的质粒,菌株分别命名为Ala7-2、Ala7-3和Ala7-4,携带pXtuf空质粒的菌株为Ala7-1。摇瓶发酵结果表明,过表达ED途径菌株的L-丙氨酸产量均有提高,其中Ala7-2产量最高,达到65.84 g/L(图4-b),说明表达大肠杆菌eddeda操纵子的效果最佳。于是将大肠杆菌eddeda操纵子整合到Ala6基因组上,获得菌株Ala7。其摇瓶发酵产生64.31 g/L L-丙氨酸,比Ala6产量提高6.4%(图4-a)。
2.4 工程菌株5 L发酵罐发酵测试
将菌株Ala7进行5 L发酵罐发酵,L-丙氨酸产量几乎呈线性增长趋势,在48 h达到104 g/L,最大OD值接近300(图5)。发酵液中基本检测不到其他氨基酸和有机酸(乙酸、乳酸和琥珀酸)。

图5 工程菌株5 L发酵罐生产L-丙氨酸
Fig.5 Production of L-alanine by the engineered strain in a 5 L fermentor
3 结论
本文以具有链霉素抗性的野生型谷氨酸棒杆菌ATCC 13032出发,通过优化和过表达外源丙氨酸脱氢酶,增强葡萄糖摄取途径,引入ED途径强化前体物丙酮酸的供应,最终获得高产L-丙氨酸的工程菌株。该菌株不含质粒、遗传稳定、生长良好。5 L发酵罐测试L-丙氨酸产量达到104 g/L,且检测不到有明显副产物积累,为高纯度L-丙氨酸的工业化生产奠定了基础。本研究发现的非PTS葡萄糖摄取途径可以显著提高谷氨酸棒杆菌的细胞生长,引入ED途径可以有效促进丙酮酸供应和L-丙氨酸合成,为谷氨酸棒杆菌其他代谢工程研究提供了参考。


[1] IKEDA M.Amino Acid Production Processes[M]//Microbial Production of L-Amino Acids.Berlin, Heidelberg:Springer Berlin Heidelberg, 2002:1-35.
[2] 郭媛, 王丽娟, 邱婷, 等.L-丙氨酸在食品工业中的应用潜力[J].中国调味品, 2017, 42(7):177-180.
GUO Y, WANG L J, QIU T, et al.Application potential of L-alanine in food industry[J].China Condiment, 2017, 42(7):177-180.
[3] KARAU A, GRAYSON I.Amino Acids in Human and Animal Nutrition[M]//Advances in Biochemical Engineering/Biotechnology.Berlin, Heidelberg:Springer Berlin Heidelberg, 2014:189-228.
[4] EDWARDS C H, ROSSI M, CORPE C P, et al.The role of sugars and sweeteners in food, diet and health:Alternatives for the future[J].Trends in Food Science &Technology, 2016, 56:158-166.
[5] DANDARE S U, EZEONWUMELU I J, SHINKAFI T S, et al.L-alanine supplementation improves blood glucose level and biochemical indices in alloxan-induced diabetic rats[J].Journal of Food Biochemistry, 2021, 45(1):e13590.
[6] PAUL K, WANG S B, CHEN S F, et al.Effects of central administration of glutamine and alanine on feed intake and hypothalamic expression of orexigenic and anorexigenic neuropetides in broiler chicks[J].Journal of Integrative Agriculture, 2012, 11(7):1173-1180.
[7] BRETTI C, CIGALA R M, DE STEFANO C, et al.Thermodynamic solution properties of a biodegradable chelant (MGDA) and its interaction with the major constituents of natural fluids[J].Fluid Phase Equilibria, 2017, 434:63-73.
[8] BRETTI C, CIGALA R M, DE STEFANO C, et al.Understanding the bioavailability and sequestration of different metal cations in the presence of a biodegradable chelant MGDA in biological fluids and natural waters[J].Chemosphere, 2017, 183:107-118.
[9] LEE M, SMITH G M, EITEMAN M A, et al.Aerobic production of alanine by Escherichia coli aceF ldhA mutants expressing the Bacillus sphaericus alaD gene[J].Applied Microbiology and Biotechnology, 2004, 65(1):56-60.
[10] SMITH G M, LEE S A, REILLY K C, et al.Fed-batch two-phase production of alanine by a metabolically engineered Escherichia coli[J].Biotechnology Letters, 2006, 28(20):1695-1700.
[11] ZHANG X L, JANTAMA K, MOORE J C, et al.Production of L-alanine by metabolically engineered Escherichia coli[J].Applied Microbiology and Biotechnology, 2007, 77(2):355-366.
[12] LEUCHTENBERGER W, HUTHMACHER K, DRAUZ K.Biotechnological production of amino acids and derivatives:Current status and prospects[J].Applied Microbiology and Biotechnology, 2005, 69(1):1-8.
[13] 张晓梅, 高宇洁, 杨玲, 等.谷氨酸棒杆菌中氨基酸分泌转运蛋白及其代谢改造研究进展[J].生物工程学报, 2020, 36(11):2250-2259.
ZHANG X M, GAO Y J, YANG L, et al.Amino acid exporters and metabolic modification of Corynebacterium glutamicum:A review[J].Chinese Journal of Biotechnology, 2020, 36(11):2250-2259.
[14] KALINOWSKI J, BATHE B, BARTELS D, et al.The complete Corynebacterium glutamicum ATCC 13032 genome sequence and its impact on the production of L-aspartate-derived amino acids and vitamins[J].Journal of Biotechnology, 2003, 104(1-3):5-25.
[15] WANG T, LI Y J, LI J, et al.An update of the suicide plasmid-mediated genome editing system in Corynebacterium glutamicum[J].Microbial Biotechnology, 2019, 12(5):907-919.
[16] SU R, WANG T, BO T D, et al.Enhanced production of D-pantothenic acid in Corynebacterium glutamicum using an efficient CRISPR-Cpf1 genome editing method[J].Microbial Cell Factories, 2023, 22(1):3.
[17] MA H K, FAN X G, CAI N Y, et al.Efficient fermentative production of L-theanine by Corynebacterium glutamicum[J].Applied Microbiology and Biotechnology, 2020, 104(1):119-130.
[18] HASHIMOTO S I, KATSUMATA R.L-alanine fermentation by an alanine racemase-deficient mutant of the DL-alanine hyperproducing bacterium Arthrobacter oxydans HAP-1[J].Journal of Fermentation and Bioengineering, 1998, 86(4):385-390.
[19] GIFFIN M M, MODESTI L, RAAB R W, et al.ald of Mycobacterium tuberculosis encodes both the alanine dehydrogenase and the putative glycine dehydrogenase[J].Journal of Bacteriology, 2012, 194(5):1045-1054.
[20] LERCHNER A, JARASCH A, SKERRA A.Engineering of alanine dehydrogenase from Bacillus subtilis for novel cofactor specificity[J].Biotechnology and Applied Biochemistry, 2016, 63(5):616-624.
[21] VAN WIEREN A, COOK R, MAJUMDAR S.Characterization of alanine dehydrogenase and its effect on Streptomyces coelicolorA3(2) development in liquid culture[J].Microbial Physiology, 2020, 29(1-6):57-65.
[22] WADA M, NARITA K, YOKOTA A.Alanine production in an H+-ATPase and lactate dehydrogenase-defective mutant of Escherichia coli expressing alanine dehydrogenase[J].Applied Microbiology and Biotechnology, 2007, 76:819-825.
[23] IKEDA M, MIZUNO Y, AWANE S I, et al.Identification and application of a different glucose uptake system that functions as an alternative to the phosphotransferase system in Corynebacterium glutamicum[J].Applied Microbiology and Biotechnology, 2011, 90(4):1443-1451.
[24] ZHOU Z H, WANG C, XU H T, et al.Increasing succinic acid production using the PTS-independent glucose transport system in a Corynebacterium glutamicum PTS-defective mutant[J].Journal of Industrial Microbiology &Biotechnology, 2015, 42(7):1073-1082.
[25] KOGURE T, KUBOTA T, SUDA M, et al.Metabolic engineering of Corynebacterium glutamicum for shikimate overproduction by growth-arrested cell reaction[J].Metabolic Engineering, 2016, 38:204-216.
[26] EGAN S E, FLIEGE R, TONG S, et al.Molecular characterization of the Entner-Doudoroff pathway in Escherichia coli:Sequence analysis and localization of promoters for the edd-eda operon[J].Journal of Bacteriology, 1992, 174(14):4638-4646.
[27] JOJIMA T, IGARI T, NOBURYU R, et al.Coexistence of the Entner-Doudoroff and Embden-Meyerhof-Parnas pathways enhances glucose consumption of ethanol-producing Corynebacterium glutamicum[J].Biotechnology for Biofuels, 2021, 14(1):45.
[28] HASEGAWA S, JOJIMA T, SUDA M, et al.Isobutanol production in Corynebacterium glutamicum:Suppressed succinate by-production by pckA inactivation and enhanced productivity via the Entner-Doudoroff pathway[J].Metabolic Engineering, 2020, 59:24-35.