根据国际葡萄与葡萄酒组织2021年的统计数据显示,世界葡萄产量为7 474.8万t,其中鲜食葡萄占比43.3%。鲜食葡萄产量增长1.5%,但世界鲜食葡萄消费量仍然低于产量。同在陕西省据果业局统计公报显示,2021年陕西省鲜食葡萄产量为85.15万t,相比去年增长了5.5%。鲜食葡萄产量不断上涨,已出现季节性供大于求的趋势[1],为解决生产相对过剩的问题,需要进行葡萄的深加工来提高产品附加值,葡萄酒酿造就是其中一种,但目前在鲜食葡萄酿酒方面的研究较少[2-4],很难实现产品的增值增效。而且国内大多数消费者对于干型红葡萄酒的口感接受度不高,为此很多人选择鲜食葡萄进行家庭酿造葡萄酒。
葡萄酒的品质受到葡萄品种[5]、气候和栽培方式[6]、酿造工艺[7-8]、酵母[9-10]等多种因素的影响。而对于鲜食葡萄而言,原料方面存在皮薄、肉质坚硬、出汁率低、含糖量不高的缺陷[11],目前使用的鲜食葡萄的酿造工艺,容易引起葡萄酒微生物污染、甲醇超标、颜色较浅、高级醇含量高、口感寡淡等问题[12-13]。因此,需要对鲜食葡萄酿酒的关键工艺技术进行系统的研究,而鲜食葡萄发酵菌种的筛选就是其中重要的环节之一。鲜食葡萄酿酒缺乏专用酵母菌,这是鲜食葡萄酒品质较差的重要原因之一。要获得品质优秀、具有鲜食葡萄特色的葡萄酒,筛选合适的酵母菌十分重要[14]。目前针对鲜食葡萄酿酒的酵母种类较少,使得鲜食葡萄酒失去了特征,无法展现鲜食葡萄酒的特点[15]。
因此,本实验选取陕西主栽品种之一的“户太8号”为原料,进行鲜食葡萄自然发酵过程中酵母的分离筛选,以期获得适合鲜食葡萄酿造的菌株,增加家庭酿造葡萄酒的多样性。从商业酵母和专用酵母两方面对比筛选,对未来鲜食葡萄酵母筛选研究方向提供了一定的参考。
1 材料与方法
1.1 材料
1.1.1 葡萄原料
户太8号,采自陕西省西安市鄠邑区崔家湾村(东经108.6,北纬34.1),采收时间为2020年10月,原料含糖量170 g/L,可滴定酸含量为3.60 g/L(以酒石酸计)。
1.1.2 商业酵母
酿酒酵母SY,安琪酵母股份有限公司;酿酒酵母ST,法国Laffort公司;酿酒酵母LA-PE,法国OENOFRANCE公司;酿酒酵母EC1118,法国Lallemand公司。
1.1.3 培养基
YPD培养基(g/L):葡萄糖20,蛋白胨20,酵母浸粉10,琼脂20(固体培养基加入);WL培养基,北京陆桥技术股份有限公司。
1.2 仪器与设备
Cary-60紫外-可见分光光度计,安捷伦科技(中国)有限公司;FTIR Lyza 5000 Wine葡萄酒分析仪,奥地利Anton Paar公司。
1.3 实验方法
1.3.1 酵母菌种分离鉴定
取自然发酵过程中5个时期(除梗破碎后Z1、酒精发酵前期Z2、中期Z3、后期Z4和末期Z5)的葡萄酒样1 mL进行梯度稀释(10-3、10-4、10-5),均匀涂布在WL培养基上28 ℃恒温培养48 h。随机挑取单菌落,多次划线纯化,并接种单菌落于YPD液体培养基中活化24 h,之后划线接种于WL鉴别培养基上,于28 ℃培养48 h,进行初步归类[16]。
将酵母菌菌种委托深圳华大基因股份有限公司鉴定。在离心管中加入200 μL预处理液与适量菌样品,充分研磨。再加入20 μL Proteinase K溶液,混匀,37 ℃放置30~60 min。加入200 μL裂解液,混匀,70 ℃放置10 min。加200 μL无水乙醇,混匀,短离心。过吸附柱室温放置5~10 min。向吸附膜中间位置悬空滴加50~100 μL ddH2O,室温放置5~10 min,12 000 r/min离心2 min,收集溶液于离心管中。16S/18S扩增后进行1.0%的琼脂糖凝胶检测,观察条带性状并按照磁珠纯化标准,上机检测。并将测序结果进行NCBI-BLAST比对。
1.3.2 酵母一级筛选
将分离纯化得到的酵母菌株活化2 d,至其活性高度旺盛期,接入放有倒置杜氏管的YPD液体培养基中,28 ℃恒温培养2 d,每隔12 h观察其产气情况,记录杜氏管内气体体积[17]。筛选出起酵速度快,产气较多的菌株,并用于二级筛选。
1.3.3 酵母二级筛选
1.3.3.1 高酒精耐受性试验
在装有YPD液体培养基的试管中,放入倒置的杜氏管(不含空气)。液体培养基先于121 ℃灭菌20 min,试管中培养基冷却至室温,作为基础YPD培养基。在无菌条件下加入无水乙醇,使试管中酒精含量为8%、10%、12%、14%。将一级筛选出酵母菌株活化后按2%的接种量接入培养基中,28 ℃培养2 d,每隔12 h观测其生长状况,判断其酒精耐受性。以商业酿酒酵母及空白试验作为对照。
1.3.3.2 低pH值耐受性试验
无菌条件下用1 mol/L的盐酸溶液分别调整YPD液体培养基的pH值为2.0、2.5、3.0、3.5。酵母菌接种与观察方法同1.3.3.1节。
1.3.3.3 高糖耐受性试验
无菌条件下使用葡萄糖调整YPD液体培养基的葡萄糖含量分别为20%、30%、40%、50%(质量分数)。酵母菌接种与观察方法同1.3.3.1节。
1.3.3.4 高SO2耐受性试验
在无菌条件下分别向YPD培养基中加入不同量的亚硫酸溶液,使培养基中SO2含量为200、250、350、450 mg/L。酵母菌接种与观察方法同1.3.3.1节。
1.3.4 发酵性能测定
1.3.4.1 葡萄酒发酵工艺
按小容器酿造法酿造葡萄酒[18],将800 g经挑选与除梗后的户太8号葡萄破碎为葡萄醪,装入1 L发酵罐中,调整总糖至216 g/L。在20 ℃下,采用二级筛选获得的酵母及4种商业酵母(SY、ST、LA-PE、EC1118),使用YPD培养基活化扩培至108 CFU/mL后以5×106 CFU/L的接种量接种到葡萄醪中进行发酵。
1.3.4.2 葡萄酒发酵曲线
每12 h测定发酵过程葡萄醪中还原糖的变化,并绘制发酵曲线。在发酵结束后进行皮渣分离并澄清过滤。
1.3.4.3 基本理化指标测定
葡萄酒中酒精度、可滴定酸、挥发酸、pH、甘油及总酚含量使用葡萄酒分析仪测定;葡萄酒中还原糖的含量采用菲林试剂热滴定法测定;葡萄酒CIELab值采用葡萄酒颜色分析仪测定。所有指标均重复测定3次。
1.3.4.4 葡萄酒的感官评价
成立10人的感官品评小组,均经过专业的感官培训。小组成员从葡萄酒外观、香气、口感、平衡性4个方面进行打分,得出葡萄酒的感官质量整体评价。
1.3.4.5 数据分析
采用Mircosoft EXCEL 2019软件进行数据分析和作图;Origin 2021软件进行作图。
2 结果与分析
2.1 酵母的分离
从鲜食葡萄自然发酵过程中5个时期共分离出110株酵母菌,将其按不同时期编号划分,除梗破碎时期、发酵前期、发酵中期及发酵后期及发酵末期编号分别为Z101~Z130、Z201~Z220、Z301~Z320、Z401~Z420、Z501~Z520,以商业酵母SY做对照。对分离出的110株酵母菌进行形态学观察,按照其形态类型分类汇总,分为六类,如表1所示。
表1 自然发酵汁中分离的菌落形态描述
Table 1 Description of colony morphology isolated from natural fermented juice

菌株类别分离菌株数菌株编号菌落形态16Z114、Z116-Z120白色菌株,细胞呈现椭圆形略显糖果状,中心为白色,外层包裹一层透明圈23Z121、Z122、Z214白色菌株,细胞呈现圆形实心,无透明圈36Z102-103、Z106、Z111-Z112、Z130白色菌株,细胞圆润光滑,周围有微弱的透明圈461Z101、Z104-Z105、Z113、Z115、Z125、Z204-Z210、Z212-Z213、Z217、Z301-Z303、Z305、Z307-Z311、Z313、Z315-Z319、Z402-Z408、Z410、Z412-Z415、Z417、Z501-Z502、Z503-Z506、Z508-Z518、Z520白色菌株,细胞呈现圆形,中心微微凸起524Z123-Z124、Z126-Z128、Z201、Z211、Z215-Z216、Z218-Z220、Z304、Z306、Z312、Z314、Z320、Z401、Z409、Z416、Z418-Z420、Z519绿色菌株,中心为绿色圆润凸起,外层包裹一层透明圈610Z107-Z110、Z129、Z202-Z203、Z206、Z411、Z507绿色菌株,微微偏白,形状不规则,大多偏圆形,外层透明圈不明显
2.2 酵母种群的动态变化
从每一类菌株中挑选1~2个长势较好的菌落进行检测鉴定。结果显示(图1)从自然发酵汁中分离得到的110株酵母菌株分属5大类,分别为毕赤酵母属、拟威克酵母属、酿酒酵母属、有孢汉逊酵母属和Starmerella属。除梗破碎时期在鲜食葡萄醪液中的酵母种群数量最丰富,其中毕赤酵母是优势种群,随着酒精发酵的启动,拟威克酵母属和毕赤酵母属菌株逐渐消失;在发酵过程的前、中、后期,有孢汉逊酵母和酿酒酵母是优势种群,尤其在发酵中期只分离到了有孢汉逊酵母和酿酒酵母;随着发酵时间的延长,酿酒酵母逐渐显示出比有孢汉逊酵母更强的生长优势;发酵后期,Starmerella属酵母再次活跃;发酵末期,发酵液中分离到酿酒酵母占比最高。

图1 五个时期的酵母种群变化
Fig.1 Variations in yeast species over five periods
2.3 耐受性分析
通过产气筛选得到了20株发酵性能好、产气能力强的菌株。再根据耐受性实验分析,得到4种酵母菌,耐受性强度表现如表2所示。
表2 酵母菌耐受能力对比分析表
Table 2 Comparative analysis of yeast tolerance ability
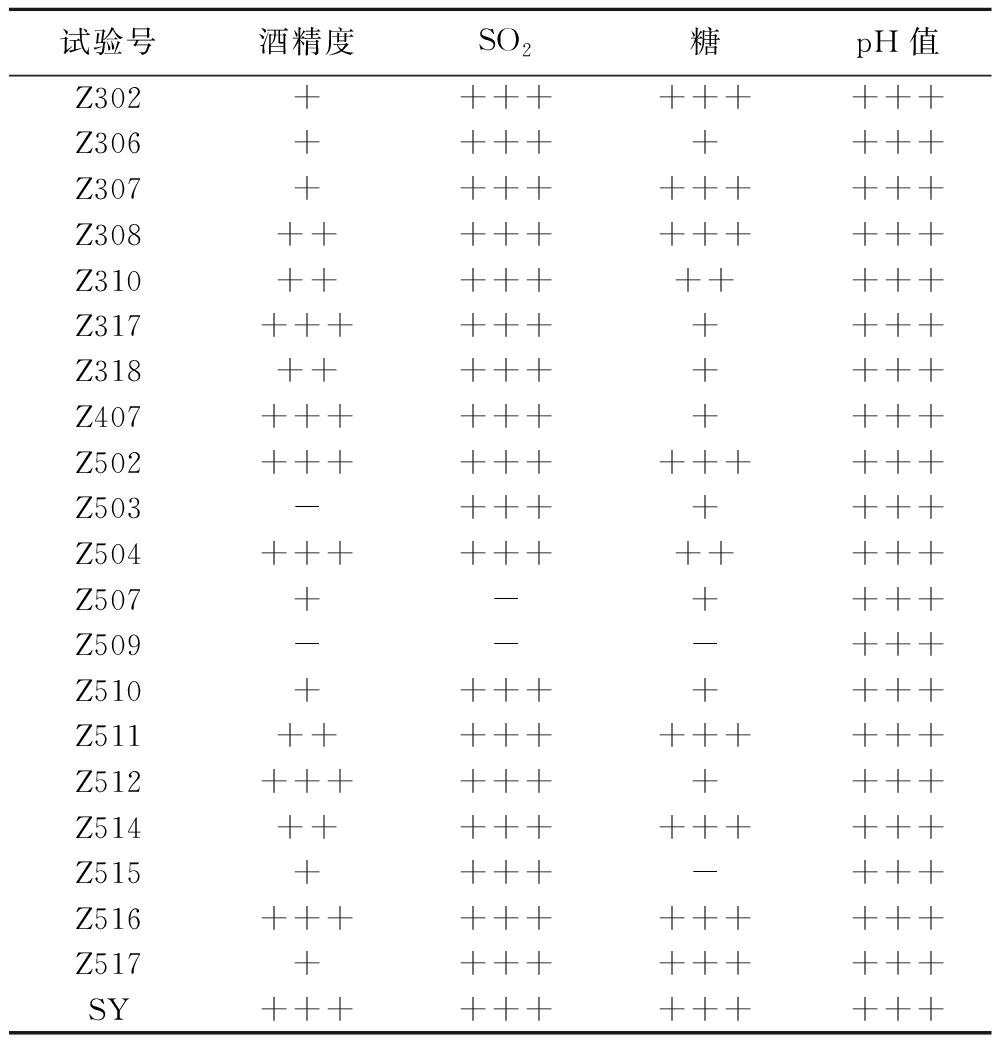
试验号酒精度SO2糖pH值Z302++++++++++Z306++++++++Z307++++++++++Z308+++++++++++Z310++++++++++Z317++++++++++Z318+++++++++Z407++++++++++Z502++++++++++++Z503-+++++++Z504+++++++++++Z507+-++++Z509---+++Z510++++++++Z511+++++++++++Z512++++++++++Z514+++++++++++Z515++++-+++Z516++++++++++++Z517++++++++++SY++++++++++++
注:“-”代表耐受性低;“+”代表耐受性中等、“++”代表耐受性良、“+++”代表耐受性优。
随着发酵的不断进行,酒精度会不断升高,不耐酒精的酵母活动会受到抑制,导致发酵提前终止[19],因此耐酒精能力反应了其酒精发酵的可持续性[20]。结果显示6株酵母菌高酒精耐受性性能优,6株良,6株中等,菌株Z503和Z509高酒精耐受性低;酿酒前一般会添加抑菌剂,如SO2,这对酵母的SO2耐受能力提出了要求[21]。菌株的SO2耐受性,18株表现为优,菌株Z507和Z509的耐受性差。葡萄醪液是酸性环境,这需要酵母具有一定耐酸能力,pH值为3.5、3和2.5时,20株酵母菌产生气泡的量均可充满杜氏管,均能耐受葡萄酒的酸性环境,Z507和Z515表现更为突出。葡萄酒酿造时,糖含量一般为20%左右,因此需要筛选耐高糖的酵母。菌株高糖耐受性能,8株高糖性能优,3株良,7株中等,其中菌株Z509和Z515耐糖性极低。对于商业酵母来说,4种性能表现均为优。
最后综合4种发酵耐受性能,筛选出了5株综合能力较强的菌株,编号分别为Z308、Z502、Z504、Z511和Z516。
2.4 酵母菌发酵性能研究
不同酵母菌发酵葡萄酒还原糖变化见图2。Z502起酵最慢,Z504发酵速度最慢,Z511发酵速度最快。Z502、Z511、Z516、ST、LA-PE、EC1118在108 h时还原糖含量已降至4 g/L以下,完成了酒精发酵。而Z308、Z504、SY在发酵进行120 h时完成了酒精发酵。由此可见,各酵母菌均能正常完成酒精发酵,Z502、Z511、Z516、ST、LA-PE、EC1118 6种酵母菌的完成酒精发酵的速度更快。
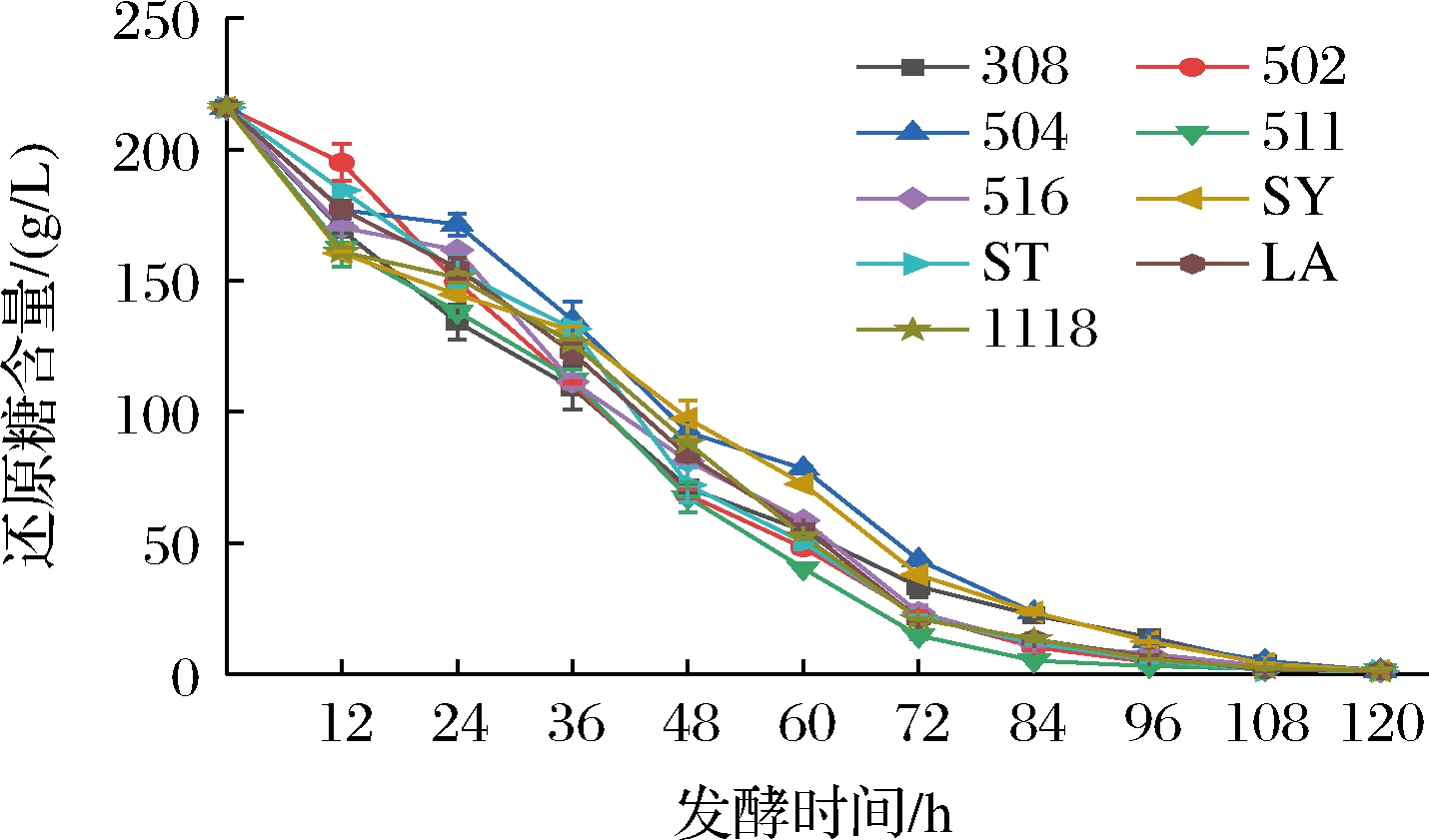
图2 发酵期间不同酵母葡萄酒发酵还原糖变化曲线
Fig.2 Curve of reducing sugar in wine during fermentation
2.5 不同酵母对葡萄酒理化指标的影响
如表3所示,各组成品酒的总糖均在4 g/L以下,均为干型酒,且发酵完全。每个处理组初始糖含量为216 g/L,潜在酒度为12%(体积分数),各组在实际发酵过程中,酒精度变化范围为11.84%~12.58%。所有处理组可滴定酸含量均高于初始可滴定酸的量,SY组最高,Z511组最低。各组间挥发酸含量与pH值相差不大,且挥发酸含量均低于国家限量标准(1.2 g/L),符合国家标准。
表3 不同酵母发酵葡萄酒的主要理化指标
Table 3 Main physical-chemical indexes of wines fermented by different yeasts

试验号酒精度/%总糖/(g/L)可滴定酸/(g/L)挥发酸/(g/L)pH甘油/(g/L)总酚/(g/L)Z30812.2±0.01ab1.55±0.07ab5.79±0.20a0.41±0.01ab3.56±0.20a6.70±0.05b0.46±0.01dZ50212.23±0.35ab1.25±0.02d5.73±0.02ab0.37±0.02bc3.62±0.21a6.57±0.02b0.51±0.01cdZ50412.19±0.43ab1.56±0.04ab5.76±0.15ab0.45±0.02a3.67±0.2a7.00±0.15a0.62±0.02abZ51112.07±0.12ab1.63±0.06a5.38±0.17c0.36±0.02bc3.63±0.24a6.07±0.06cd0.61±0.04abZ51612.05±0.37ab1.40±0.01c5.70±0.02ab0.38±0.01bc3.63±0.07a6.83±0.09ab0.66±0.02aSY11.84±0.06b1.57±0.09ab5.83±0.11a0.44±0.03a3.68±0.24a6.63±0.15b0.57±0.04bcST12.39±0.25ab1.32±0.06cd5.45±0.11bc0.38±0.02bc3.66±0.15a5.87±0.14d0.38±0.01eLA-PE12.58±0.23a1.40±0.05c5.37±0.03c0.36±0.01bc3.69±0.14a6.23±0.07c0.47±0.03dEC111812.57±0.17a1.43±0.04bc5.46±0.06bc0.35±0.02c3.69±0.26a5.90±0.08d0.36±0.02e
注:同列不同小写字母表示不同处理间差异显著(P<0.05)。
2.6 不同酵母对颜色的影响
CIELab颜色模型是用来描述人眼可见的所有颜色的最完备的色彩模型[22]。明亮度(L*)、红/绿色彩通道(a*)、黄/蓝色彩通道(b*)是其3个基本坐标。a*值越高代表酒样更偏向红色色调;b*值越高代表酒样更偏向黄色色调;色度Cab值越大,表明酒样色彩饱和度越高;色调角Hab通常为0°~90°,其值越大表明葡萄酒颜色越倾向紫红色,反之则越倾向砖红色。
测定不同酵母发酵葡萄酒酒样的CIELab颜色参数L*、a*、b*、Cab和Hab,结果如图3所示。9组酒样整体明亮度均较高,均在95°以上,这与鲜食葡萄本身的特点一致;LA-PE组酒样a*值最高,b*值最低,Hab最小,表现出更强的红色色调。ST组b*值最高,Hab值最大,与其他组相比表现出更强的黄色色调。SY组L*值最高,a*值最低,b*值较低,Cab值最低,表明该组酒样颜色较浅。
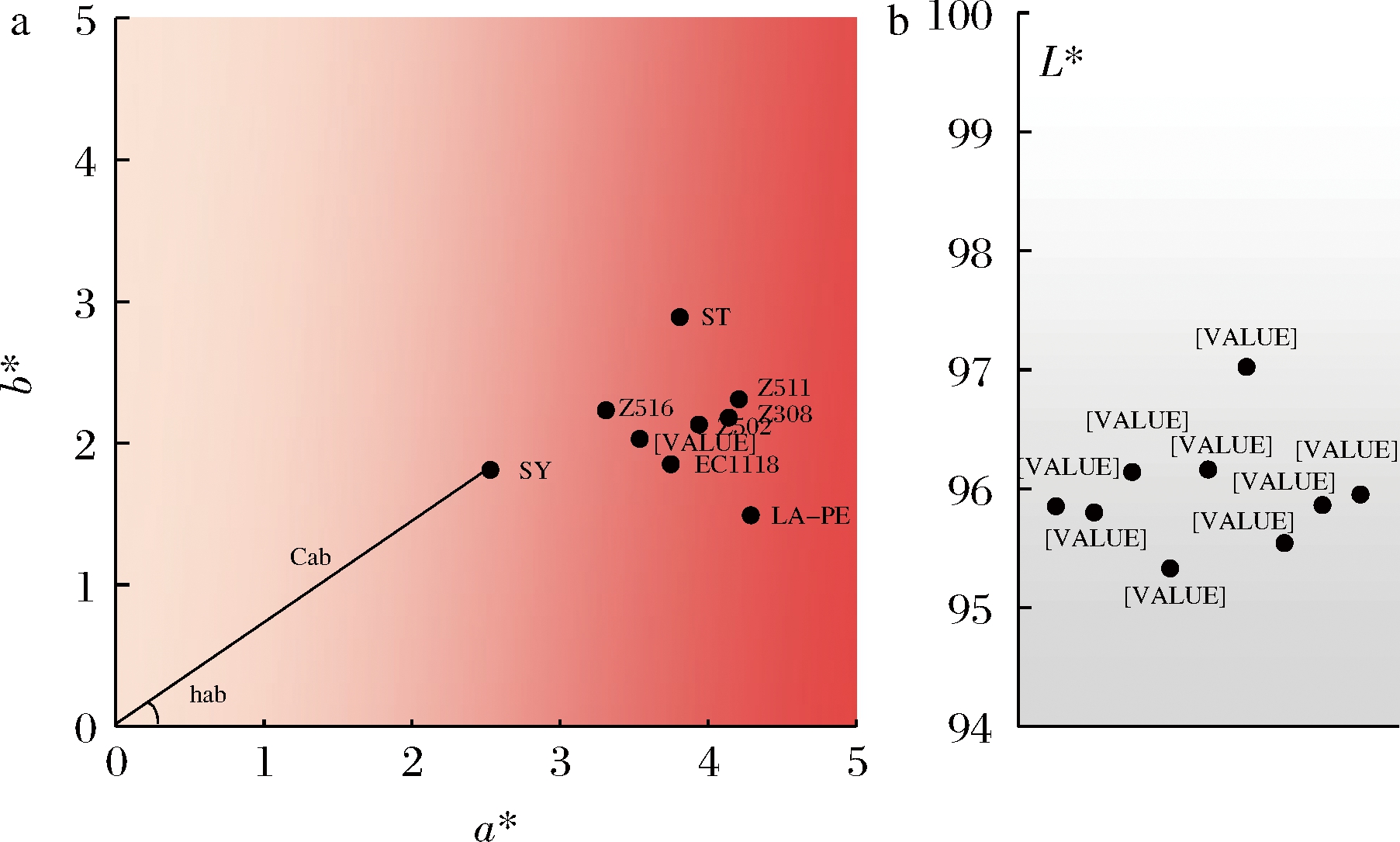
a-彩度;b-明度
图3 不同酵母发酵的葡萄酒彩度与明度分布图
Fig.3 Colorfulness and lightness distributions of wines fermented by different yeasts
2.7 不同酵母对感官品质的影响
根据感官品评结果对不同酵母所酿葡萄酒感官品质做定量描述分析如图4所示。在外观方面,LA-PE组酒样(0.91)得分最高,SY组酒样(0.82)得分最低,与上文中酒样颜色分析相符合;Z308、Z516、SY3组整体表现相对较差,整体评分低于0.8;Z511在各方面表现居中,在香气、整体平衡方面均比不上Z504;口感方面表现最好的是Z502组酒样;Z504组在香气、口感与整体上均评分较高。

图4 不同酵母发酵的葡萄酒感官定量描述分析
Fig.4 Sensory quantitative descriptive analysis of wines fermented by different yeasts
3 讨论
葡萄酒的酒精发酵是多酵母属、种及菌株共同参与的过程,发酵过程中的酵母菌的种类组成变化及其酿酒特性对葡萄酒的感官质量有重要贡献[23]。本研究对户太8号自然发酵过程的微生物进行了研究,得出了发酵过程菌种的动态变化过程。户太8号自然发酵前期非酿酒酵母占据主导地位,而随发酵进行到中后期酿酒酵母成为了优势菌,这与前人研究一致[16-17]。
酵母菌选择是葡萄酒酿造的关键技术之一,通过对不同酵母酿造的葡萄酒进行CIELab颜色分析得到,LA-PE组酒样表现出最强的红色色调,ST组最强的黄色色调,SY组酒样的颜色较浅;从感官评价上可以发现Z502在口感上表现最好,Z504在香气上表现最佳。由此可见采用相同葡萄原料但不同酵母发酵生产的葡萄酒,在颜色、感官质量等方面存在较大差异。
一味的使用商业活性干酵母会导致葡萄酒品质同质化,不利于葡萄酒产业的持续发展,因此需要对葡萄酒微生物进行研究推进葡萄酒差异化,突出其典型性。近年来,不少研究筛选了具有本土特色的酵母菌株,并取得了可观的成果。温雅骄[24]从5个地区不同酿酒葡萄种植基地采集样品,分离纯化得到97株酵母菌株,对其生长速率、耐受性和生长特性进行评价,以及通过小容器酿酒对比试验,筛选出5株优良酿酒酵母菌株。杨诗妮等[17]从甘肃祁连产区筛选出3株本土戴尔有孢圆酵母,研究发现其对高乙醇、高糖浓度等逆境具有良好的耐受性,生长能力较好,具有酿造优良葡萄酒的潜力。张文静等[25]优选本土毕赤克鲁维酵母(Pichia kluyveri HS-2-1)在混菌发酵过程中具有良好的定殖能力。这些有关葡萄酒酿造的微生物研究多集中于酿酒葡萄,从鲜食葡萄筛选酵母的研究较少,分离所得的酵母数量少。为此本研究从鲜食葡萄中分离110株酵母菌株,对其进行耐受性筛选,并与商业酵母对比研究获得了2株适合鲜食葡萄酿酒的酵母菌株,其各项性能指标接近商品化酿酒酵母,可以用于陕西地区鲜食葡萄酒酿造的商品化菌株。
4 结论
本研究从户太8号鲜食葡萄自然发酵过程中筛选出了110株酵母,通过杜氏管发酵和耐受性实验筛选出了5株耐受性能较好的菌株,经过鉴定均为酿酒酵母。经过CIELab颜色分析发现所有鲜食葡萄酒的明亮度高,LA-PE组酒样表现出最强的红色色调,ST组最强的黄色色调,SY组酒样的颜色较浅。将这些葡萄酒经过感官评价后得到了口感较好和综合性评价高的两株酵母,编号为Z502和Z504,Z502在口感上表现最好,Z504在香气上表现最佳。上述的商业酵母和从葡萄自身筛选的酵母均能用于鲜食葡萄酿酒,且各有自身的特点。从葡萄自身筛选的酵母可以突出品种和产地特色,可以避免葡萄酒品质低、同质化严重问题,从葡萄自身筛选的酵母无疑是鲜食葡萄酒微生物研究的一个重要趋势。
[1] 刘蕾. 鲜食葡萄需求和市场规律[J]. 现代农业, 2020(2):81-82.
LIU L. Demand and market law of table grapes[J]. Modern Agriculture, 2020(2):81-82.
[2] WANG X Z, WANG Z G, FENG T. Screening of yeast in various vineyard soil and study on its flavor compounds from brewing grape wine[J]. Molecules, 2022, 27(2):512.
[3] 崔长伟, 马彤彤, 李洋, 等. 黑虎香与巨峰葡萄酒的调配工艺研究[J]. 楚雄师范学院学报, 2019, 34(3):114-120.
CUI C W, MA T T, LI Y, et al. Study on different blending techniques of fox wine and gigantic peak wine[J]. Journal of Chuxiong Normal University, 2019, 34(3):114-120.
[4] 龙凤. 贵州省三都县葡萄产业发展问题研究[D]. 广州: 仲恺农业工程学院, 2017.
LONG F. Study on the development of grape industry in Sandu County, Guizhou Province[D].Guangzhou: Zhongkai University of Agriculture and Engineering, 2017.
[5] 赵昊, 王雪薇, 宋晶晶, 等. 不同品种葡萄酒香气特征及成分分析[J]. 中外葡萄与葡萄酒, 2020(6):28-33.
ZHAO H, WANG X W, SONG J J, et al. Analysis of aroma components of different variety wines[J]. Sino-Overseas Grapevine &Wine, 2020(6):28-33.
[6] YAO H, JIN X Q, FENG M X, et al. Evolution of volatile profile and aroma potential of table grape Hutai-8 during berry ripening[J]. Food Research International, 2021, 143:110330.
[7] ROSSI S, ![]() E, HORVAT I, et al. Comparison of different winemaking processes for improvement of phenolic composition, macro- and microelemental content, and taste sensory attributes of Teran (Vitis vinifera L.) red wines[J]. LWT, 2022, 154:112619.
E, HORVAT I, et al. Comparison of different winemaking processes for improvement of phenolic composition, macro- and microelemental content, and taste sensory attributes of Teran (Vitis vinifera L.) red wines[J]. LWT, 2022, 154:112619.
[8] CHEN X Y, LIU S, YUAN J L, et al. Application of different pre-fermentation techniques in the winemaking using Guankou table grape (Vitis vinifera×Vitis labrusca)[J]. Food Bioscience, 2023, 51:102272.
[9] 刘晓柱, 张远林, 曾爽, 等. 阳光玫瑰葡萄酵母菌多样性及酿造学特性分析[J]. 食品研究与开发, 2020, 41(24):212-218.
LIU X Z, ZHANG Y L, ZENG S, et al. Analysis of the yeasts biodiversity and theirs oenological property from shine Muscat[J]. Food Research and Development, 2020, 41(24):212-218.
[10] 曹炜玉, 路文鹏, 舒楠, 等. 葡萄酒风味物质及其影响因素研究进展[J]. 中国酿造, 2022, 41(5):1-7.
CAO W Y, LU W P, SHU N, et al. Research progress on wine flavor substances and their influencing factors[J]. China Brewing, 2022, 41(5):1-7.
[11] 白杜娟. 家酿葡萄酒工艺及应注意的问题[J]. 安徽农业科学, 2012, 40(5):2893-2896.
BAI D J. Technology and attention problems of home-brewing grape wine[J]. Journal of Anhui Agricultural Sciences, 2012, 40(5):2893-2896.
[12] 李旭升, 潘振东, 吴碧玉, 等. 四川家庭自酿葡萄酒质量现状的初步调查[J]. 中国酿造, 2015, 34(8):115-118.
LI X S, PAN Z D, WU B Y, et al. Preliminary investigation on quality status of home-brewed wine in Sichuan Province[J]. China Brewing, 2015, 34(8):115-118.
[13] 叶林林, 杨娟, 陈通, 等. 红提和糯米复合发酵葡萄酒工艺优化及香气成分分析[J]. 食品科学, 2019, 40(18):182-188.
YE L L, YANG J, CHEN T, et al. Wine made from a blend of red globe and glutinous rice: Optimization of fermentation process and analysis of aroma components[J]. Food Science, 2019, 40(18):182-188.
[14] 赵敏, 陈环, 唐婉莹, 等. 7种酵母酿造摩尔多瓦葡萄酒的发酵特性比较[J]. 中国酿造, 2020, 39(8):102-106.
ZHAO M, CHEN H, TANG W Y, et al. Comparison of fermentation characteristics of 7 yeasts in brewing Moldovan wine[J]. China Brewing, 2020, 39(8):102-106.
[15] 冯涛, 王旭增, 王一非, 等. 葡萄园土壤中酿酒酵母的分离鉴定及其发酵葡萄酒香气成分分析[J]. 食品科学, 2018, 39(14):213-220.
FENG T, WANG X Z, WANG Y F, et al. Isolation and identification of Saccharomyces cerevisiae from vineyard soil and analysis of aroma components in fermented wine[J]. Food Science, 2018, 39(14):213-220.
[16] 杨美景, 陈小波, 赵静静, 等. 赤霞珠葡萄自然发酵过程中酵母菌的分离与鉴定[J]. 食品与发酵工业, 2011, 37(7):22-27.
YANG M J, CHEN X B, ZHAO J J, et al. Identification of yeasts isolated from spontaneous fermentation of cabernet sauvignon[J]. Food and Fermentation Industries, 2011, 37(7):22-27.
[17] 杨诗妮, 叶冬青, 贾红帅, 等. 本土戴尔有孢圆酵母在葡萄酒酿造中的应用潜力[J]. 食品科学, 2019, 40(18):108-115.
YANG S N, YE D Q, JIA H S, et al. Oenological potential of indigenous Torulaspora delbrueckii for winemaking[J]. Food Science, 2019, 40(18):108-115.
[18] 李华. 小容器酿造葡萄酒[J]. 酿酒科技, 2002(4):70-71; 74.
LI H.Grape wine brewing in small containers[J]. Liquor-Making Science &Technology, 2002(4):70-71; 74.
[19] 栗甲, 李娇娇, 施云鹏. 葡萄酒发酵过程比重与还原糖消耗及酒精生成量关系研究[J]. 酿酒科技, 2015(2):76-77; 80.
LI J, LI J J, SHI Y P. The relationship between the proportion and reducing sugar consumption and alcohol yield in the fermenting process of grape wine[J]. Liquor-Making Science &Technology, 2015(2):76-77; 80.
[20] 甘祥武, 赵乐怡, 李学优, 等. 巨峰葡萄源酿酒酵母筛选与酿造指标研究[J]. 食品科技, 2022, 47(4):1-5.
GAN X W, ZHAO L Y, LI X Y, et al. Screening and brewing characteristics of grape-derived Saccharomyces cerevisiae[J]. Food Science and Technology, 2022, 47(4):1-5.
[21] 乔喜玲. 干红葡萄酒酿酒酵母的优选及其酿酒特性研究[D]. 呼和浩特: 内蒙古农业大学, 2020.
QIAO X L. Selection of dry red wine Saccharomyces cerevisiae and its brewing characteristics[D]. Hohhot: Inner Mongolia Agricultural University, 2020.
[22] 李运奎, 韩富亮, 张予林, 等. 基于CIELAB色空间的红葡萄酒颜色直观表征[J]. 农业机械学报, 2017, 48(6):296-301.
LI Y K, HAN F L, ZHANG Y L, et al. Visualization for representation of red wine color based on CIELAB color space[J]. Transactions of the Chinese Society for Agricultural Machinery, 2017, 48(6):296-301.
[23] 孙悦, 张方方, 褚遂兴, 等. 接种不同嗜杀特性的酿酒酵母对赤霞珠发酵中酵母多样性的影响[J]. 食品科学, 2020, 41(2):166-172.
SUN Y, ZHANG F F, CHU S X, et al. Effects of Saccharomyces cerevisiae strains with different killer activities on yeast diversity during inoculated fermentation of cabernet sauvignon[J]. Food Science, 2020, 41(2):166-172.
[24] 温雅骄. 干红葡萄酒酿酒酵母的优选与鉴定及其酿酒品质评价[D]. 呼和浩特: 内蒙古农业大学, 2019.
WEN Y J. Optimization and identification of Saccharomyces cerevisiae for dry red wine and its brewing quality evaluation[D].Hohhot: Inner Mongolia Agricultural University, 2019.
[25] 张文静, 杨诗妮, 杜爽, 等. 本土毕赤克鲁维酵母与酿酒酵母混合发酵葡萄酒的增香潜力分析[J]. 食品科学, 2020, 41(12):84-90.
ZHANG W J, YANG S N, DU S, et al. Potential application of mixed starter cultures of indigenous Pichia kluyveri and Saccharomyces cerevisiae to wine aroma enhancement[J]. Food Science, 2020, 41(12):84-90.