大口黑鲈(Micropterus salmoides)隶属鲈亚目(Percoidei)棘臀鱼科(Centrarchidae)黑鲈属(Micropterus),20世纪80年代引入我国,经过多年的养殖发展,已成为国内重要的淡水养殖品种之一[1]。大口黑鲈具有适应性强、生长快、易起捕、养殖周期短等优点,加之肉质鲜美细嫩,无肌间剌,外形美观,深受养殖者和消费者欢迎[2]。然而宰杀后的大口黑鲈由于其特殊的营养成分及特征极易发生腐败变质,因此,常采用涂膜、保鲜剂或气调包装结合冷藏、微冻或冻藏来延缓其腐败变质的进程[3]。
普鲁兰多糖是一种由出芽短梗霉发酵产生的胞外多糖,又名普聚多糖[4-5]。因其具有高水溶性、可降解性、成膜性和阻氧性良好等优点,近年来其涂膜已广泛应用于食品保鲜[6-8]。胡云峰等[9]探究了普鲁兰多糖水溶液对鸡蛋的保鲜效果,结果发现普鲁兰多糖涂膜液可将蛋壳的气孔覆盖,阻止外界微生物侵入和鸡蛋内容物流失,极大延长了鸡蛋的货架期。羧甲基壳聚糖是壳聚糖的一种衍生物,因为有良好的水溶性、保湿性、成膜性,安全无毒并具有抑菌、抗病毒、抗凝血等多种作用,在医药、化工、环保、保健品等方面应用十分广泛[10]。为了增强羧甲基壳聚糖保鲜膜的性能和保鲜效果,目前关于羧甲基壳聚糖与其他成分复合制备保鲜膜已成为国内外研究的热点。陈露珠等[11]在羧甲基壳聚糖膜液中加入普鲁兰多糖,所制成的羧甲基壳聚糖-普鲁兰多糖复合膜的理化性能和抗菌效果均得到提升,罗氏沼虾的劣变受到抑制,货架期延长近2倍。黄原胶又称汉生胶,是由糖类经黄单胞杆菌发酵产生的胞外微生物多糖,具有多种功能,可作为膜成型剂、凝胶增稠剂、稳定剂等,广泛应用于各领域[12]。樊彦玲[13]采用黄原胶/果胶/海藻酸钠复合涂膜保鲜马铃薯,发现黄原胶复合膜能有效降低马铃薯的失重率及褐变度,保持鲜切马铃薯的感官品质和总酚含量。胶原蛋白作为天然的生物高分子,具有良好的生物相容性、可降解性、成膜性和抗菌等特点,适合作为“绿色”食品包装膜在食品工业中发挥作用[14-15]。因此将普鲁兰多糖、羧甲基壳聚糖、黄原胶与胶原蛋白进行复配,可制备出一种可食用、环保、性能优良的多糖复合保鲜膜。
近年来,普鲁兰多糖、羧甲基壳聚糖、黄原胶与鱼皮胶原蛋白作为一种天然的保鲜剂已被广泛研究,但是制成复合涂膜剂协同用于大口黑鲈的保鲜较为鲜见。本实验将普鲁兰多糖、羧甲基壳聚糖、黄原胶添加至胶原蛋白中,研究成膜剂质量浓度、成膜剂质量比及超声时间对复合膜理化性能的影响,并用制备的复合膜液对大口黑鲈进行涂膜保鲜,在-2 ℃条件下贮藏,对大口黑鲈进行pH、挥发性盐基氮(total volatile base nitrogen,TVB-N)、菌落总数(total viable count,TVC)、持水力(water holding capacity,WHC)、肌动球蛋白含量、巯基(—SH)含量和Ca2+-ATP酶活性的测定,以研究复合膜对大口黑鲈的保鲜效果。本文可为普鲁兰多糖/羧甲基壳聚糖/黄原胶/胶原蛋白复合膜的进一步研究及其在食品中的开发利用提供一定的理论基础。
1 材料与方法
1.1 试剂材料与仪器
1.1.1 材料与试剂
活体大口黑鲈鱼购于上海市南汇新城镇小马海鲜批发店,每条质量约0.7 kg、体长约26 cm。
普鲁兰多糖,上海阿拉丁生化科技股份有限公司;黄原胶,上海麦克林生化科技股份有限公司;羧甲基壳聚糖,上海吉至生化科技有限公司;鱼皮胶原蛋白,上海源叶生物科技有限公司;氯化钠,上海艾希尔化工有限公司;氧化镁(轻质),上海启仁化工有限公司;平板计数琼脂培养基(PCA),广州天骏生物科技有限公司;总蛋白定量测定试剂盒(BCA法),南京建成正浩科技有限公司;总巯基测定试剂盒,北京峰格生物技术有限公司;超微量Ca2+-ATP酶试剂盒,柏吉生物科技有限公司。
1.1.2 仪器与设备
pH计,奥豪斯仪器(上海) 有限公司;BS-210型电子天平,德国Sartorius Instruments有限公司;Kjeltec8400全自动凯氏定氮仪,丹麦 FOSS 公司;SPARK型酶标仪,瑞士TECAN仪器公司;H-1850离心机,湖南湘怡实验室仪器开发有限公司;SZ-130010型磁力搅拌器,上海禾汽玻璃仪器有限公司;SP-723可见光分光光度计,上海光谱仪器有限公司;TESA外径千分尺,上海捷沪仪器仪表有限公司;HD-B617-S型电子拉力试验机,海达仪器检测有限公司。
1.2 实验方法
1.2.1 普鲁兰多糖复合膜的制备与条件优化
将成膜剂普鲁兰多糖、羧甲基壳聚糖与黄原胶按不同比例混合,加入100 mL去离子水。在45 ℃水浴磁力搅拌器中搅拌均匀,将搅拌均匀的膜液添加到3 g/100 mL的鱼皮胶原蛋白溶液中继续搅拌,均匀后加入溶液总体积比2%的甘油,继续搅拌并将膜液在超声仪中240 W处理不同时间。最后,取膜液20 mL倒于水平放置的培养皿(直径为100 mm),自然干燥后揭膜备用,即制得测定用普鲁兰多糖复合膜[15]。实验分别对成膜剂(普鲁兰多糖、羧甲基壳聚糖、黄原胶)质量比2∶1∶1(CPX1)、2∶1∶2(CPX2)、2∶2∶1(CPX3)、2∶2∶2(CPX4),成膜剂质量浓度1 g/100 mL(CPX5)、1.2 g/100 mL(CPX6)、1.4 g/100 mL(CPX7)、1.6 g/100 mL(CPX8)和超声时间5 min(CPX9)、10 min(CPX10)、15 min(CPX11)、20 min(CPX12)进行优化,考察以上因素对复合膜性能的影响。
1.2.2 复合膜性能的测定
1.2.2.1 抗拉强度和断裂伸长率的测定
参考曹立妤等[16]的方法稍加改动,将复合膜裁剪为20 mm×60 mm的矩形条状,在相对湿度40%,温度25 ℃的干燥器中平衡24 h备用。
测试条件:测试环境温度25 ℃,相对湿度56%,设置初始上下夹片距离为40 mm,拉伸速率40 mm/min。记录薄膜的拉伸强度(MPa)和断裂伸长率(%),每个样品平行测定5次,取其平均值。
1.2.2.2 溶胀率的测定
溶胀率的测定参考PEI等[17]所述的方法,并略作修改。将普鲁兰多糖复合膜裁剪为20 mm×20 mm大小并称其干重Wa后浸入30 ℃、25 mL蒸馏水中,2 h后取出用滤纸吸干复合膜的水,直到达到平衡之前,测量溶胀后膜的质量Wb。根据公式(1)计算其溶胀率:
溶胀率![]()
(1)
式中:Wb为溶胀后复合膜的质量,g;Wa为干燥复合膜的质量,g。每组膜测量重复3次。
1.2.2.3 复合膜厚度的测定
膜厚度采用千分尺测定,在被测膜上随机抽取3点测量取平均值。
1.2.2.4 复合膜透光率的测定
参考邹丽娜等[18]的方法并稍加改动,将复合膜裁剪为10 mm×40 mm大小,紧贴在比色皿的内侧。以空皿作为空白对照,在600 nm处测定其透光率。
1.2.2.5 复合膜水蒸气透过率的测定
参考吴秀华等[19]的方法略加改动。取20 mL蒸馏水倒入50 mL烧杯中,用膜包裹住杯口并用橡皮筋进行固定,在25 ℃条件下,放入干燥器中。每隔3 h称量1次,称取5次,每组膜取2个平行样品,按照公式(2)计算复合膜水蒸气透过系数。
水蒸气透过系数![]()
(2)
式中:x为膜厚,mm;S为有效面积,S=16.61×10-4 m2;Δm为水分透过的质量,g;t为间隔时间,s;ΔP为膜两边的压强差,ΔP=3.17 MPa(25 ℃)。
1.2.3 最优工艺条件下复合膜对大口黑鲈鱼保鲜效果的影响
1.2.3.1 原料的处理及贮藏
活体大口黑鲈鱼洗净宰杀,去皮、去头尾、去内脏,取背部肌肉切成约3 cm×3 cm×1 cm的均一鱼片,擦干表面水分后,分装于保鲜袋中,每袋分装300 g左右。将分装好的鱼肉分为2组,一组为实验组(CPX-G组),在膜液中浸渍15 min;另一组为未涂膜的对照组(CK组)。将处理后的两组鱼肉在-2 ℃的冰箱中贮藏10 d,每隔2 d测1次各组鱼肉的物化指标。
1.2.3.2 TVB-N值的测定
依照GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》,测定大口黑鲈鱼肉的TVB-N值。
1.2.3.3 K值的测定
准确称取10 g剁碎的鱼肉加入10%的高氯酸20 mL,在4 ℃下12 000 r/min离心10 min,取上清液,再加入5%的高氯酸20 mL,在4 ℃下12 000 r/min离心5 min重复3次,最后合并上清液,将pH值调至6.5,后定容于50 mL容量瓶,最后用0.22 μm微孔滤膜过滤待用。
HPLC条件:C18色谱柱(5 μm,4.6 mm×250 mm),采用pH值为6.7的0.05 mol/L磷酸缓冲液洗脱,样品进样量为10 μL,流速1 mL/min,柱温30 ℃,检测波长254 nm。按公式(3)计算K值:
(3)
式中:A为次黄嘌呤核苷含量;B为次黄嘌呤含量;C为三磷酸腺苷含量;P为二磷酸腺苷含量;M为腺苷酸含量;N为肌苷酸含量。
1.2.3.4 pH值的测定
称取20 g绞碎的鲈鱼肌肉,加入200 mL去离子水,均质2 min浸提2 h后过滤,取上清液测定pH值,每个样品重复测定3次,取平均值。
1.2.3.5 TVC的测定
依照GB 4789.2—2016《食品安全国家标准 食品微生物学检验菌落总数》,测定大口黑鲈鱼肉的TVC。
1.2.3.6 肌动球蛋白的测定
参考ZHOU等[20]的方法提取肌动球蛋白并稍加修改。
提取方法:准确称取10 g大口黑鲈鱼肉于烧杯中,绞碎后加入50 mL预冷的KCl溶液(0.6 mol/L,pH 7.0),在冰浴条件下均质5 min,为防止溶液过热,每均质20 s停10 s。均质结束后,15 000 r/min、4 ℃条件下离心20 min,收集上清液。向上清液加入3倍体积预冷的蒸馏水,15 000 r/min、4 ℃条件下离心10 min,收集沉淀后加入等体积的预冷KCl溶液(1.2 mol/L,pH 7.0),冰浴条件下搅拌20 min,再次离心收集上清液,上清液即为肌动球蛋白。
测定方法:参照南京建成蛋白定量测试盒(BCA法)说明书,在波长562 nm处测定OD值。
1.2.3.7 总巯基的测定
以肌动球蛋白为待测样,参照北京峰格总巯基测定试剂盒说明书的方法进行测定,在412 nm处测定OD值。
1.2.3.8 Ca2+-ATP酶活性的测定
以肌动球蛋白为待测样,参考柏吉生物超微量Ca2+-ATP酶试剂盒说明书进行测定,在636 nm处测定OD值。
1.2.3.9 持水力的测定
参照刘欣荣等[21]的方法。精确称取10 g左右鱼肉(W1),擦干鱼肉表面的水分后置于干燥离心管4 ℃、10 000 r/min离心10 min,再精确称重(W2),按照公式(4)计算持水力。
持水力![]()
(4)
1.3 数据处理
采用Excel 2019、SPSS 26进行数据记录和整理,采用Excel 2019进行图形的绘制。
2 结果与分析
2.1 不同成膜剂质量比对复合膜性能的影响
研究成膜剂的质量浓度1.4 g/100 mL、超声时间15 min条件下,普鲁兰多糖、羧甲基壳聚糖与黄原胶质量之比对复合膜性能的影响,结果如图1所示。m(普鲁兰多糖)∶m(羧甲基壳聚糖)∶m(黄原胶)=2∶2∶1(CPX3组)时溶胀率最大,水蒸气透过率最小。透光率是反映普鲁兰多糖、羧甲基壳聚糖、黄原胶与鱼皮胶原蛋白相容性的指标,透光性越高则说明各组分相互协同的作用越好当,从图1中可看出各组复合膜的透光率均>90%,随着普鲁兰多糖添加量占比的增加,复合膜的透光率逐渐增大,即CPX1>CPX3>CPX2>CPX4,这可能是因为普鲁兰多糖呈白色,而羧甲基壳聚糖与黄原胶为淡黄色物质,因此普鲁兰多糖比例的增加会提高复合膜液的透明度。抗拉伸强度反映保鲜膜的力学强度,是表征复合膜机械性能的重要指标,当普鲁兰多糖和黄原胶的质量比一定时(CPX1与CPX3、CPX2与CPX4),复合膜的抗拉伸强度随羧甲基壳聚糖添加量的增加而增加,且各组间存在显著差异,即CPX3>CPX1;CPX4>CPX2。这可能是普鲁兰多糖中的羟基与羧甲基壳聚糖中的羧基之间所形成氢键作用所致,随着复合膜中羧甲基壳聚糖比例的增加,羟基的数目也相应增加,从而增强了多糖分子间的氢键作用,从而使复合膜具有较强的抗拉伸作用[22]。水蒸气透过率的大小反映了复合膜透湿性的高低,透过率越小透湿性越低,即说明复合膜的隔水性越好,越有利于食品的保鲜[23]。当普鲁兰多糖和羧甲基壳聚糖的质量比一定时(CPX3与CPX4),增大黄原胶的添加量,水蒸气透过率随之增加,即CPX4>CPX3,该结果可能与黄原胶具有良好的亲水性有关。综合考虑,制备普鲁兰多糖复合膜选择的最佳成膜剂质量比为m(普鲁兰多糖)∶m(羧甲基壳聚糖)∶m(黄原胶)=2∶2∶1(CPX3组)。
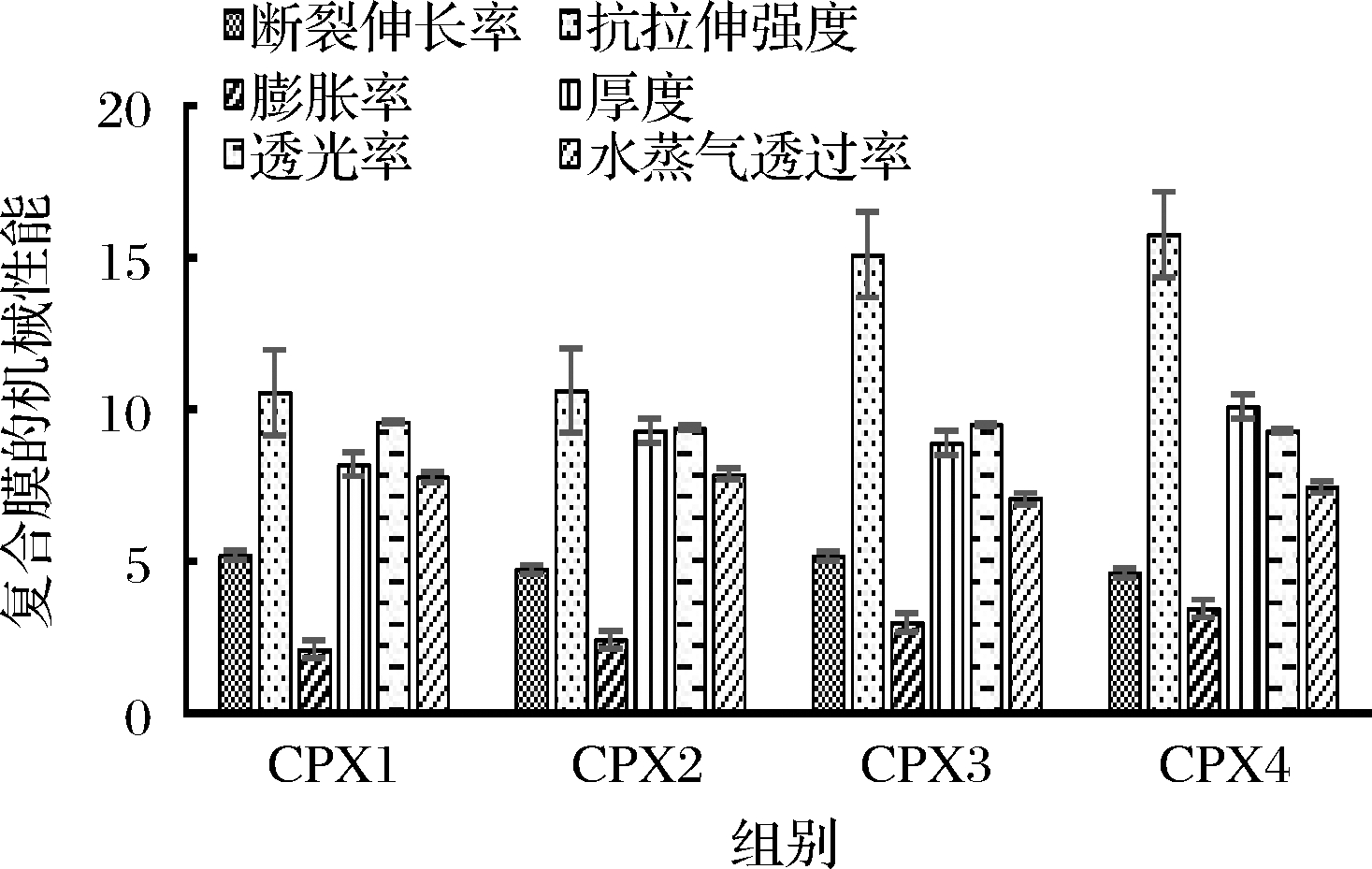
图1 不同成膜剂质量比对普鲁兰多糖复合膜性能的影响
Fig.1 Effect of different film former mass ratios on the performance of pullulan composite films
注:各指标的单位分别是:断裂伸长率:10·%;抗拉伸强度: MPa;溶胀率:102·%;厚度:10-2 mm;透光率:10·%; 水蒸气透过率:10-12 g/(m·s·Pa)(下同)。
2.2 不同成膜剂质量浓度对复合膜性能的影响
确定m(普鲁兰多糖)∶m(羧甲基壳聚糖)∶m(黄原胶)=2∶2∶1之后,研究了超声15 min条件下,不同成膜剂质量浓度对普鲁兰多糖复合膜性能的影响,结果如图2所示。随着质量浓度的增加复合膜厚度和溶胀率逐渐增大,溶胀率增大是因为羧甲基壳聚糖、胶原蛋白与黄原胶均为亲水性的,具有较强的吸水能力。水蒸气透过系数先减小后增大,且在质量浓度为1.4 g/100 mL (CPX7)时最小,为7.07×10-12 g/(m·s·Pa)。可能是当质量浓度<1.4 g/100 mL时,随着质量浓度的增加,单位体积内成膜物质的量增多,水分子及其他成膜基质与呈现有序的螺旋结构的黄原胶分子之间借助范德华力和氢键形成致密的三维网状结构,因此水蒸气透过率降低[24]。当质量浓度超过1.4 g/100 mL时,膜液黏度变大,难以形成均一的复合膜,膜液内向收缩,脱气泡困难,造成复合膜性能下降,水蒸气透过率增大。抗拉伸强度先增大后减小,膜液质量浓度为1.4 g/100 mL(CPX7)时达到最大值15.78 MPa。抗拉伸强度降低的原因可能是高质量浓度下成膜剂极易发生组分聚集,网状结构不稳定,增加了膜结构中的大孔比例,从而对复合膜的拉伸强度产生影响。综合考量,制备普鲁兰多糖复合膜选择的最佳成膜剂质量浓度为1.4 g/100 mL(CPX7组)。

图2 不同成膜剂质量浓度对普鲁兰多糖复合膜性能的影响
Fig.2 Effect of different mass concentrations of film formers on the performance of pullulan composite films
2.3 不同超声时间对复合膜性能的影响
在成膜剂质量比为m(普鲁兰多糖)∶m(羧甲基壳聚糖)∶m(黄原胶)=2∶2∶1,成膜剂质量浓度为1.4 g/100 mL的条件下,研究不同超声时间对复合膜性能的影响,结果如图3所示。随超声时间的延长,普鲁兰多糖复合膜的厚度呈现降低的趋势,这可能是因为过度超声情况下,复合膜的网状结构被打散,从而使普鲁兰多糖复合膜的性能变差。超声15 min以内时,随超声时间的延长,普鲁兰多糖复合膜的水蒸气透过率先降低后微微升高,当超声时间为15 min时,水蒸气透过率最小,为7.11×10-12 g/(m·s·Pa),继续超声至20 min时,水蒸气透过率略微增大。水蒸气透过率先降低的原因是因为在超声作用下,水分子迅速均匀地渗透到了普鲁兰多糖、羧甲基壳聚糖、黄原胶和胶原蛋白缔结的网络结构中,加速形成了牢固的网状结构;水蒸气透过率后微微升高是因为超声作用产生的空化效应以及某些机械振动对普鲁兰多糖的构象产生了一定的影响,使得化学键遭到破坏,相互作用力减弱,所以水蒸气透过系数增大[25]。普鲁兰多糖复合膜的抗拉伸强度呈先增大后减小的趋势,在超声时间为15 min时达到最大值15.89 MPa,这是因为超声产生的空穴作用与振荡作用大大增加了膜液不同分子之间的接触次数,促进了分子间的相互作用,继续超声,则会导致膜液网状结构被打散,抗拉伸强度降低[26]。综合考虑,制备普鲁兰多糖复合膜选择的最佳超声时间为15 min(CPX11组)。
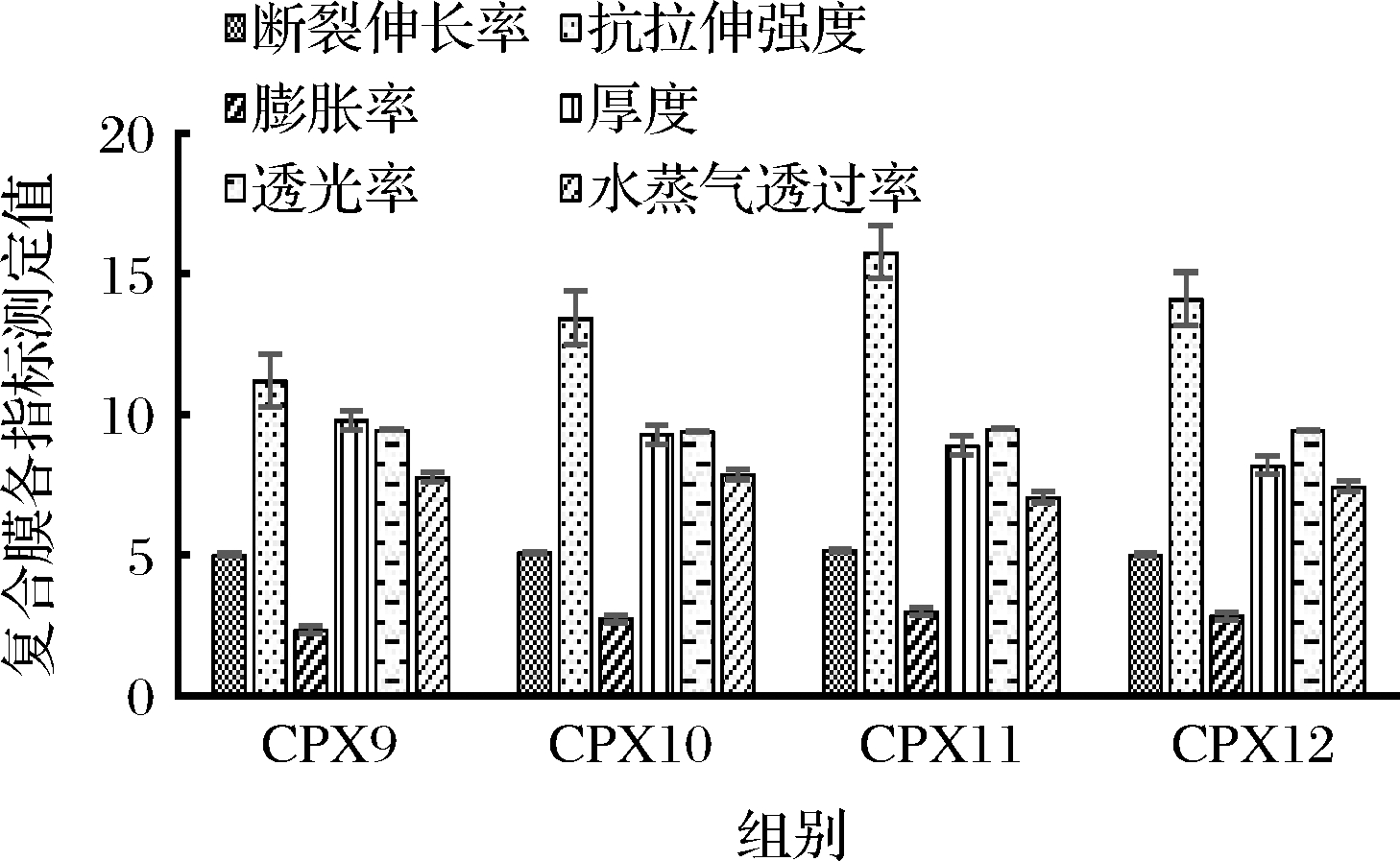
图3 不同超声时间对普鲁兰多糖复合膜性能的影响
Fig.3 Effect of different ultrasonic times on the performance of pullulan composite films
2.4 普鲁兰多糖复合膜对大口黑鲈保鲜效果的影响
2.4.1 TVB-N的变化
TVB-N值常用来判断鱼肉氨基酸被破环的程度,对水产品质量评估的主要参数之一。普鲁兰多糖复合膜对大口黑鲈鱼TVB-N值的影响见图4。两组鱼肉的TVB-N值均呈上升趋势,0~2 d两组鱼肉的TVB-N值的变化幅度较小,这是因为在微冻创造的低温条件下鱼肉自身酶和腐败微生物所分解的胞外酶的活性受到抑制,蛋白质分解产生氨以及胺类等碱性含氮物质的速率降低,因此TVB-N值上升速度较慢。2 d后CK组TVB-N值上升速度较快,贮藏至第10天由初始值(8.19±0.24) mg/100 g上升至(12.55±0.44) mg/100 g,达二级鲜度,而CPX-G组TVB-N仅上升至(11.35±0.17) mg/100 g,仍处于一级鲜度,且贮藏期内CPX-G组TVB-N值始终低于CK组。CPX-G组上升速度较慢是因为复合膜具有良好的包裹作用,可以有效隔绝外界的空气和水,抑制鱼肉内微生物的生长以及防止外界微生物的进一步侵染[27],因此贮藏期内经涂膜处理的鱼肉其TVB-N值优于对照组。
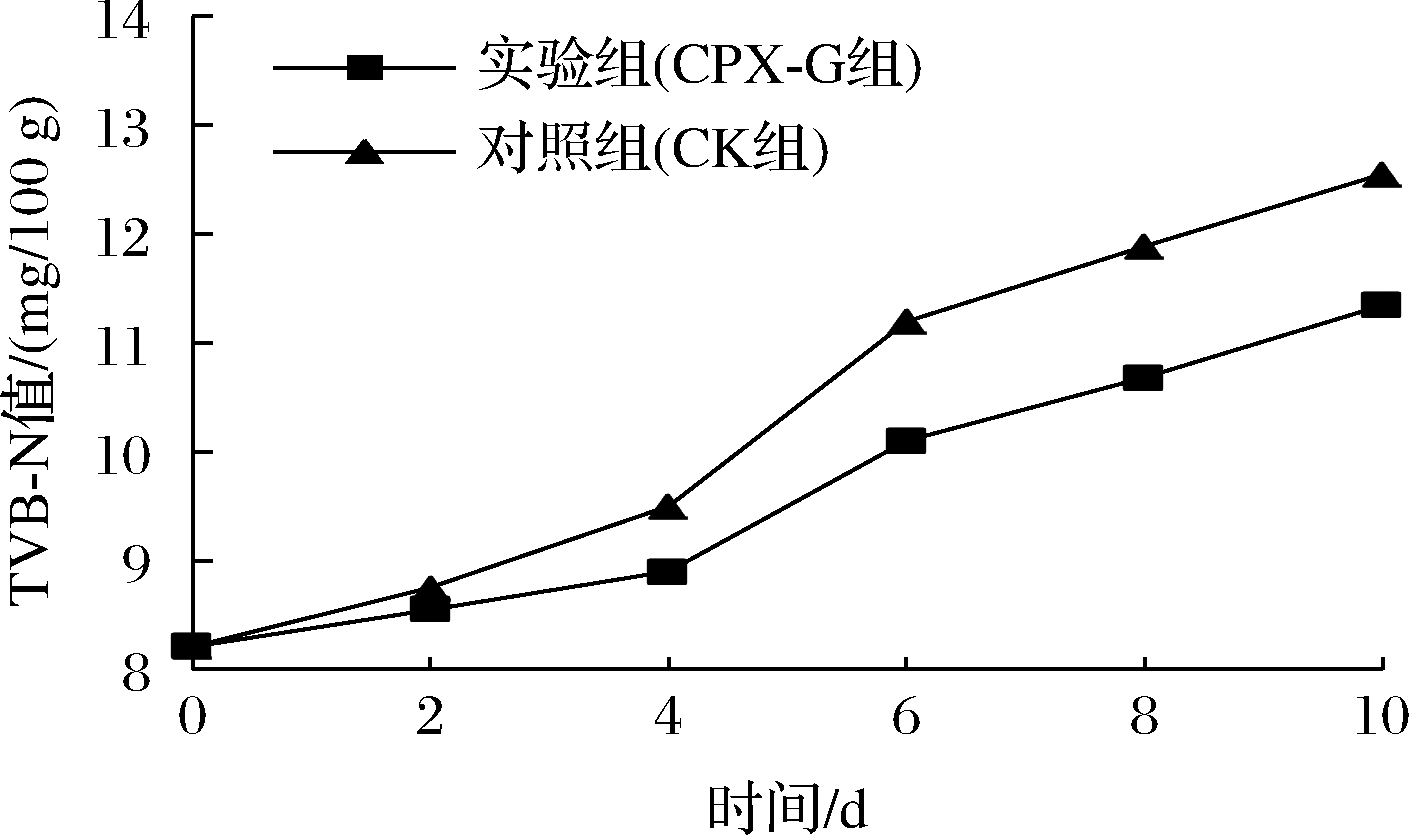
图4 大口黑鲈贮藏过程中TVB-N值的变化
Fig.4 Changes in TVB-N values during storage of Micropterus salmoides
2.4.2 K值的变化
K值可反映核苷酸的降解程度,是评价水产品新鲜度程度的常用指标,一般认为K值≤20%时样品非常新鲜,20%<K值<50%为中度新鲜,K值>70%为不新鲜。由图5可知,各组鱼肉K值总体呈现增长的趋势,这与TVB-N值的变化趋势相似,但是K值作为水产品前期鲜度评价的指标,上升趋势比TVB-N值更明显,更能代表水产品贮藏前期的鲜度变化[28]。新鲜鱼肉K值为3.11%,此后随着贮藏时间的延长不断增加,CK组增长速度较快,到第10天已增至20.11%,处于中度新鲜;CPX-G组增长速度相对较慢,至贮藏期结束(10 d)仍为非常新鲜,可见,贮藏期内CPX-G组的K值要优于CK组。本实验中经涂膜处理的鱼肉K值更低,ZHU等[29]认为这可能是由于羧甲基壳聚糖的强抑菌特性减缓了微生物生长繁殖对ATP的分解作用,从而降低了K值。
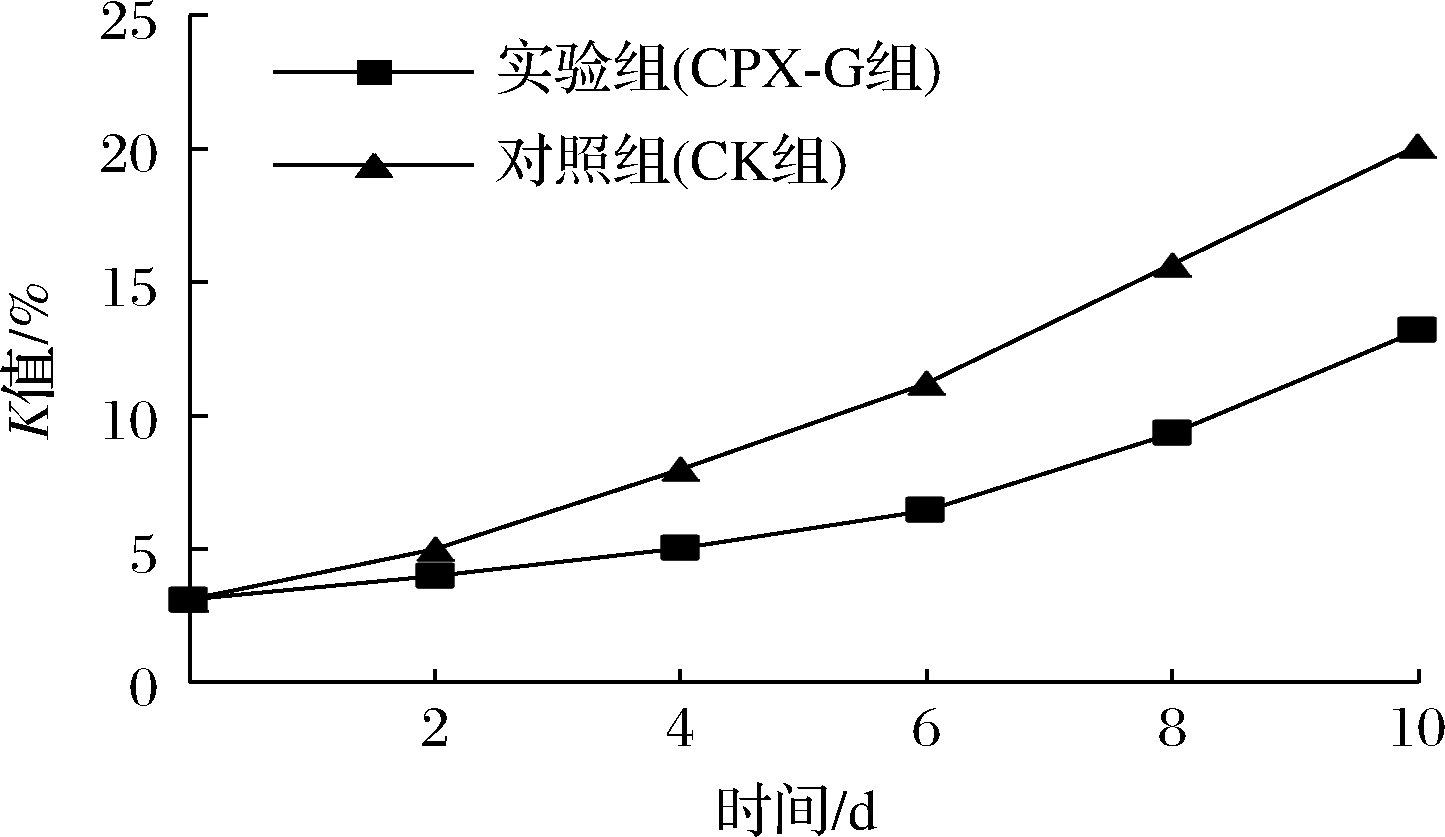
图5 大口黑鲈贮藏过程中K值的变化
Fig.5 Changes in K value during storage of Micropterus salmoides
2.4.3 pH值的变化
pH值的变化情况可在一定程度上表征大口黑鲈的新鲜程度,是评价鱼肉品质的指标之一。普鲁兰多糖复合膜对大口黑鲈鱼pH值的影响见图6。2组鱼肉pH值均呈先下降后上升的趋势,pH值下降可能与鱼死后鱼体内的磷酸肌酸和ATP等物质分解产生乳酸等酸性物质有关,pH值回升则可能与鱼肉蛋白质在微生物和酶的作用下不断的分解产生碱性物质有关。CK组鱼肉pH值在第4天降低到最小值6.58,而CPX-G组pH值在第7天降低到最小值6.24,且贮藏期内CK组pH值始终高于CPX-G组,原因可能是膜液中的黄原胶与鱼肉中的蛋白质发生了共凝胶作用, 使蛋白网状结构稳固, 减缓了蛋白质的变性进程,进而使pH值变化缓慢[30];也有可能与普鲁兰多糖的抗氧化作用阻碍了鱼肉中肌原纤维蛋白的氧化,抑制了游离氨基酸和多肽的生成有关[31]。
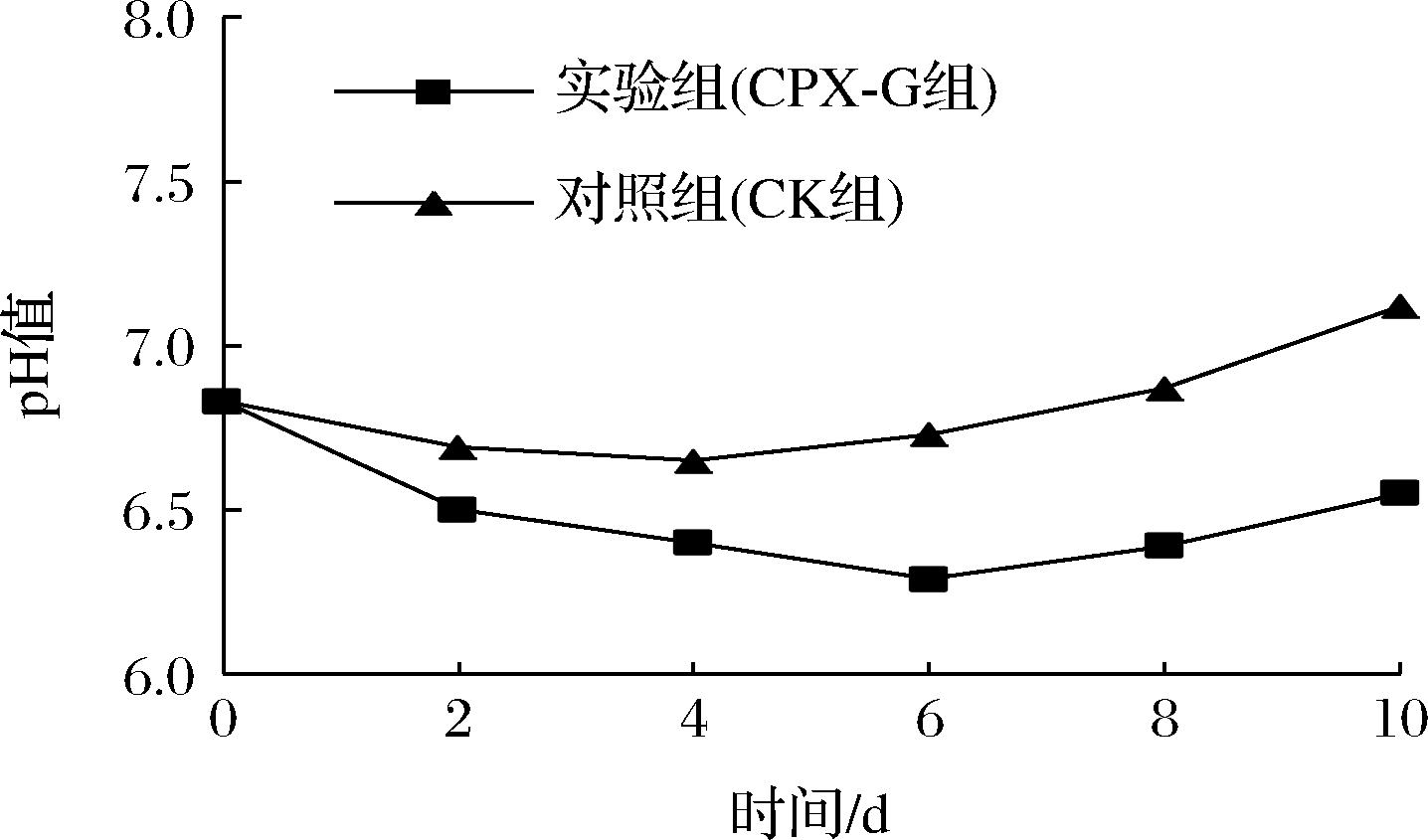
图6 大口黑鲈贮藏过程中pH值的变化
Fig.6 Changes in pH during storage of Micropterus salmoides
2.4.4 TVC的变化
普鲁兰多糖复合膜对大口黑鲈鱼TVC的影响如图7所示。2组鱼肉TVC均呈现先降低后升高的趋势,TVC降低的原因可能是微冻时鱼肉温度降低过快,鱼体表面的嗜温菌出现死亡。新鲜鱼肉的TVC为3.11 lg CFU/g,处于一级鲜度。2 d后CK组TVC开始上升,到第10天已超过5.0 lg CFU/g,达到二级鲜度,而CPX-G组TVC从第6天开始上升,到第10天时TVC仍处于一级鲜度,并且贮藏期内CPX-G组TVC始终低于CK组,这是因为大口黑鲈鱼的优势腐败菌为巴氏葡萄球菌,属革兰氏阳性菌,细胞壁外的酸性环境与相对亲水性的细胞表面,有利于羧甲基壳聚糖的渗入,在羧甲基壳聚糖的作用下,巴氏葡萄球菌的生长繁殖受到极大抑制,所以CPX-G组的TVC值相较于CK组增加的更为缓慢[32-33]。由此可见,复合膜抑制TVC上升的效果明显。
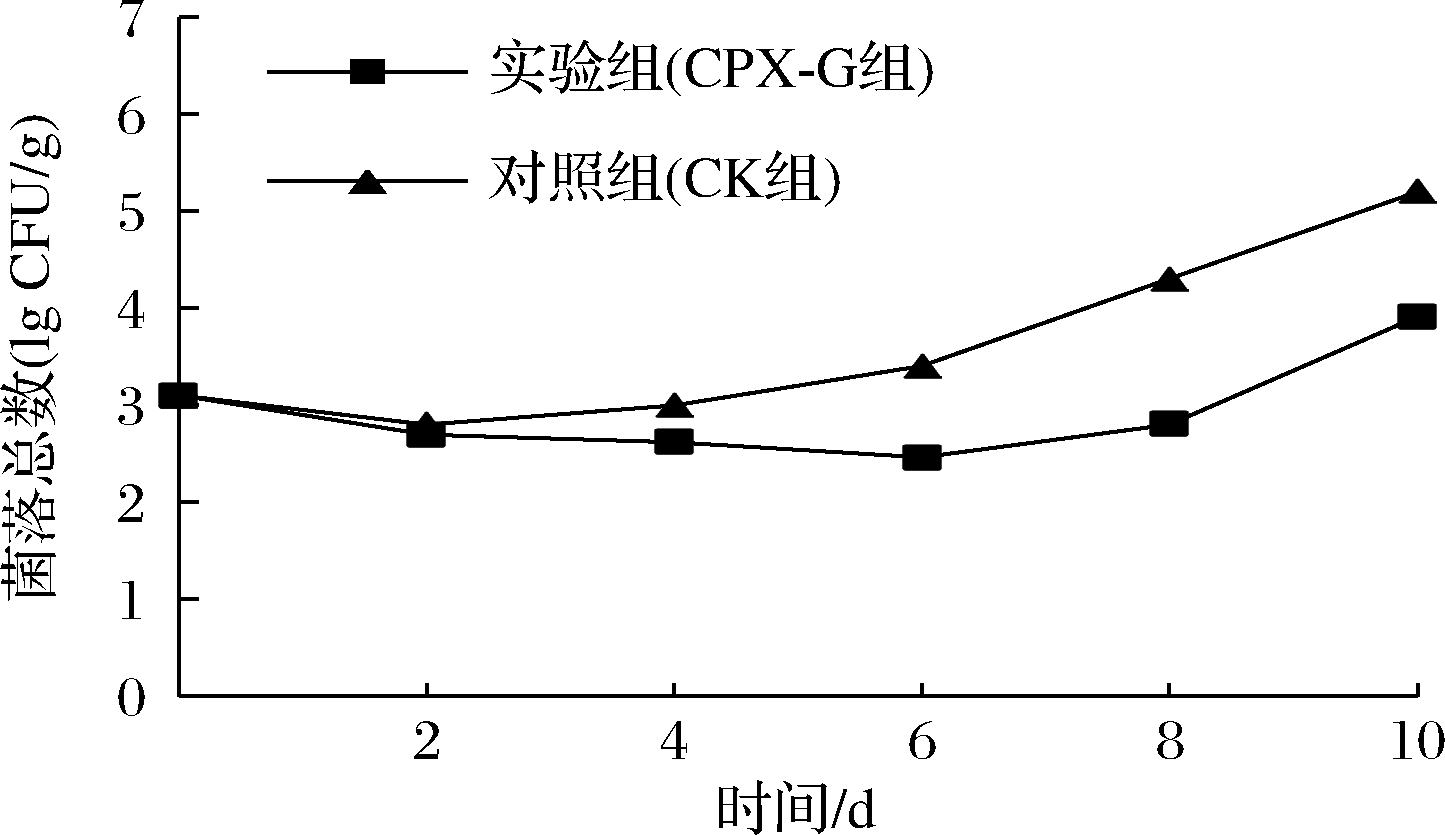
图7 大口黑鲈贮藏过程中TVC的变化
Fig.7 Changes in TVC during storage of Micropterus salmoides
2.4.5 肌动球蛋白含量的变化
肌动球蛋白是构成肌原纤维蛋白的重要组成部分,在一定程度上可以表征鱼肉蛋白质的变性程度。大口黑鲈贮藏过程中肌动球蛋白含量的变化情况如图8所示。2组鱼肉的肌动球蛋白含量均呈现先上升后下降的趋势,上升的原因可能是肌动蛋白与肌球蛋白在ATP的作用下产生聚合,形成了大分子质量的分子聚集沉淀起来,这与高萌等[34]的研究结果相似。贮藏期内,肌动球蛋白含量总体呈下降趋势,到第10天,CK组鱼肉由初始值33.1 mg/g下降至27.09 mg/g,下降了18.16%,而CPX-G组下降了12.05%,说明相较于CPX-G组,CK组鱼肉肌动球蛋白的变性更加严重,这是因为复合膜使肌动球蛋白的组织结构更加紧密, 改善了肌动球蛋白的性能, 防止肌动球蛋白发生变性。
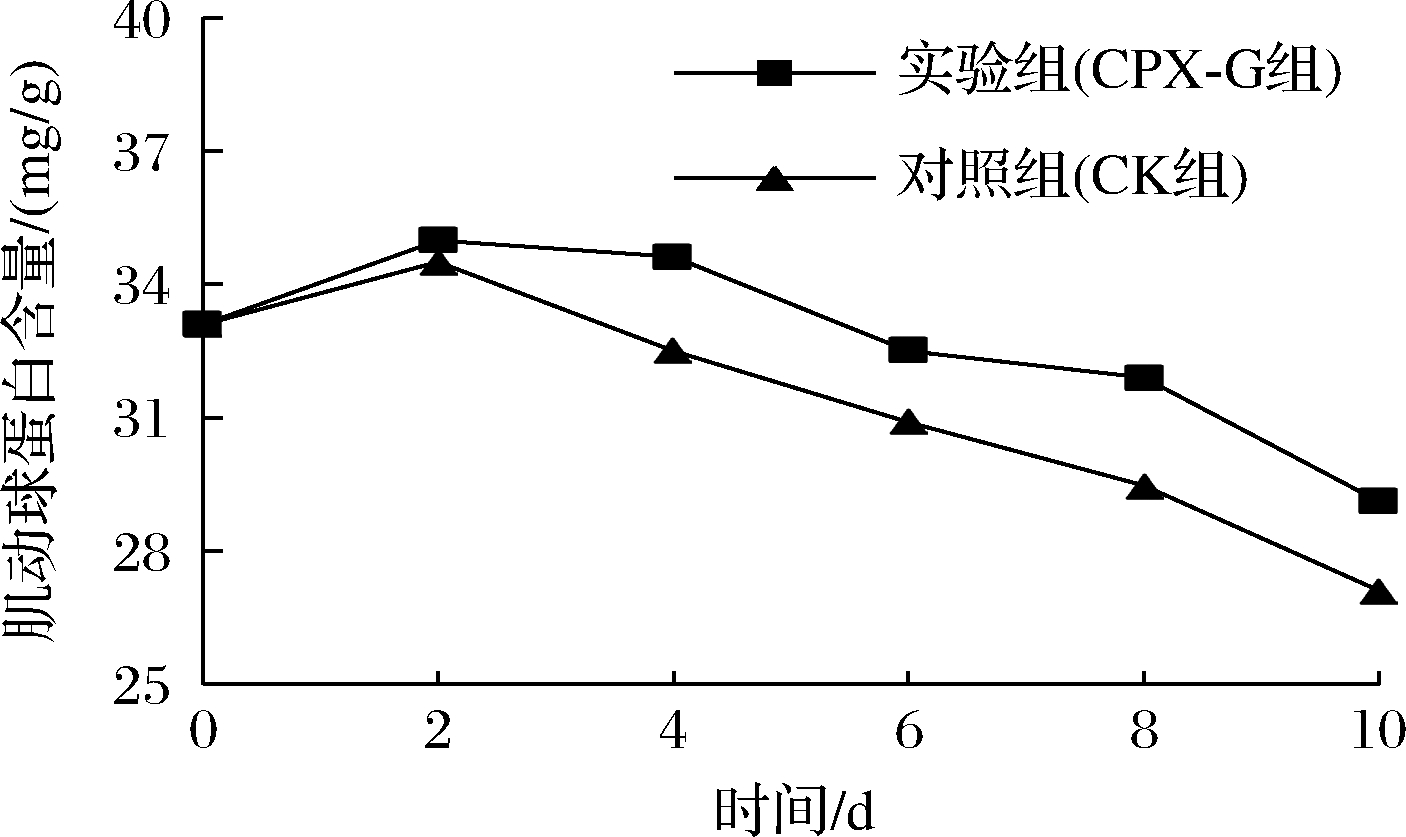
图8 大口黑鲈贮藏过程中肌动球蛋白含量的变化
Fig.8 Changes in actin content in Micropterus salmoides during storage
2.4.6 巯基含量的变化
—SH是肌原纤维蛋白中最具活性的功能基团,可反映鱼肉蛋白质变性聚合的程度,其含量越高,说明鱼肉蛋白质变性聚合程度越低,品质越好[35]。大口黑鲈贮藏过程中—SH含量的变化情况如图9所示。2组鱼肉的—SH含量均呈下降的趋势,这是因为鱼肉蛋白质发生氧化时, 蛋白内部的巯基会因活性巯基的不稳定性形成二硫键(—S—S—), 伴随时间的延长,肌动球蛋白结构发生变化, 巯基位置也随之发生改变, 使巯基暴露于蛋白质外部, 氧化形成了—S—S—,因而随着贮藏时间的延长两组鱼肉的—SH含量均逐渐降低[36],这也与于林[37]的研究结论相似。CK组—SH含量下降速度较快,至第10天已由初始值5.98×10-5 mol/g降低至3.8×10-5 mol/g,下降了36.45%,而CPX-G组仅下降了23.75%,这说明普鲁兰多糖复合膜能够有效减缓—SH的氧化变性的趋势。此外,贮藏期内CPX-G组的—SH含量始终高于CK组,这是由于复合膜的包裹作用有效的阻碍了外界的氧气,抑制了——SH的自动氧化,降低了蛋白质的变性程度,进而影响了—SH含量的变化。结合图7发现,大口黑鲈鱼—SH含量的变化趋势与肌动球蛋白相似,这可能与—SH氧化产生的—S—S—使肌动球蛋白发生重链聚合,降低其盐溶性有关[38]。相比于对照组,经涂膜的大口黑鲈鱼—SH含量的变化更慢,品质更高。
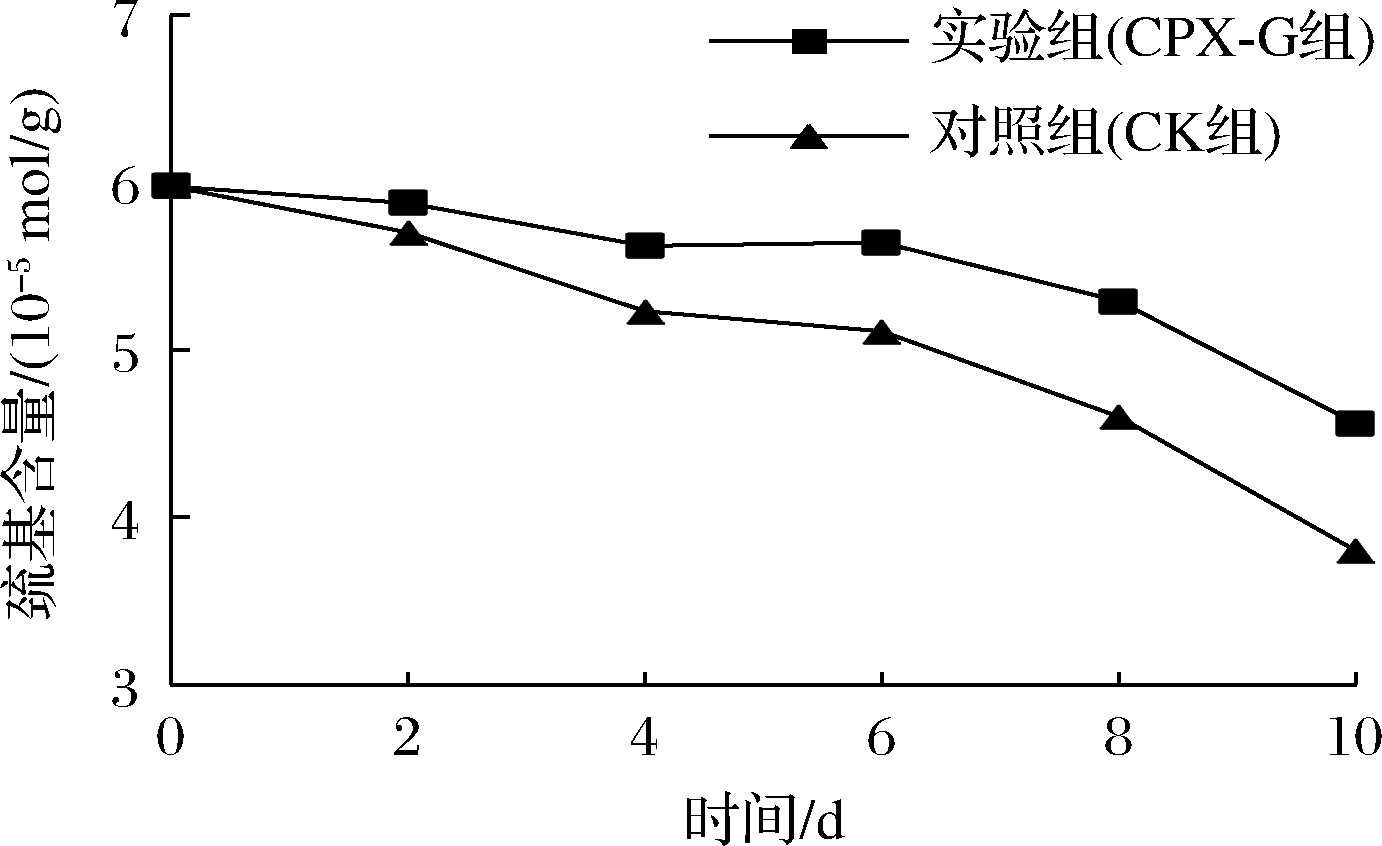
图9 大口黑鲈贮藏过程中巯基含量的变化
Fig.9 Changes in sulfhydryl content during storage of Micropterus salmoides
2.4.7 Ca2+-ATP酶活性的变化
Ca2+-ATP酶活性是评估鱼肉肌原纤维蛋白变性程度的指标,活性越低表明鱼肉蛋白质变性越严重,鱼肉品质越差。大口黑鲈贮藏过程中Ca2+-ATP酶活性的变化见图10。新鲜鱼肉的Ca2+-ATP酶活性为4.3 μmol Pi/(mg pro·h),随贮藏时间的延长两组鱼肉的Ca2+-ATP酶活性均逐渐下降,这可能与巯基发生氧化和蛋白交联有关[39]。其中,CK组下降速度较快,至贮藏结束Ca2+-ATP酶活性降低至2.8 μmol Pi/(mg pro·h),下降了34.88%,而CPX-G组下降了25.35%。CPX-G组下降幅度较小是因为复合膜中的普鲁兰多糖与胶原蛋白具有抗氧化能力以及抑制微生物破坏蛋白的能力,从而抑制了蛋白质的变性,减缓了Ca2+-ATP酶活性的下降趋势;也可能是由于普鲁兰多糖、羧甲基壳聚糖与黄原胶含有的羟基改变了蛋白质分子内自由水的结构,抑制了蛋白质的聚集和变性的程度[40],进而使CPX-G组Ca2+-ATP酶活性的下降速度降低。再结合图8,发现Ca2+-ATP酶活性的下降趋势与—SH相似,这是由于复合膜对鱼肉的包裹作用,使得—SH的氧化程度降低,抑制了微生物破坏蛋白质的能力,进而降低了Ca2+-ATP酶活性下降的趋势[35]。综上可得,复合膜可有效延缓大口黑鲈鱼Ca2+-ATP酶活性的下降,在保持鱼肉品质方面效果更佳。
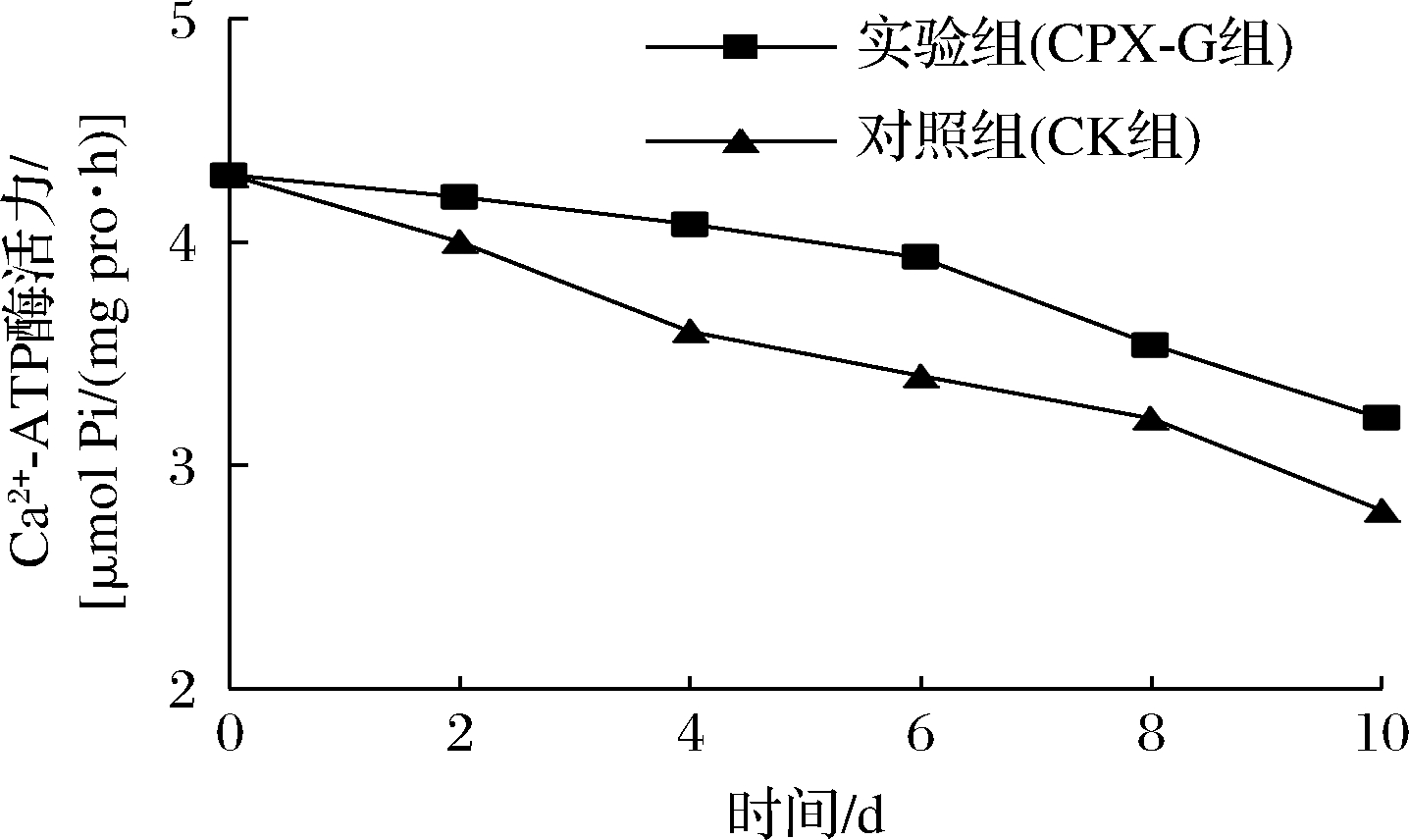
图10 大口黑鲈贮藏过程中Ca2+-ATP酶活性的变化
Fig.10 Changes in Ca2+-ATPase activity during storage of Micropterus salmoides
2.4.8 WHC的变化
WHC能直接反映鱼肉抑制水分流失的能力,是评价鱼肉品质的重要指标。大口黑鲈贮藏过程中持水力的变化见图11。

图11 大口黑鲈贮藏过程中持水力的变化
Fig.11 Changes in water holding capacity during storage of Micropterus salmoides
2组鱼肉的WHC均呈下降的趋势,下降的原因可能是随着贮藏时间的延长,大口黑鲈鱼肌肉的大分子网状结构被冰晶破坏[35]。CK组鱼肉WHC下降速度较快,贮藏至第10天由初始值85.55%下降至76.02%,下降了11.14%,而CPX-G组仅下降了7.81%,且在贮藏期内CPX-G组WHC始终高于CK组。CK组WHC下降速度较CPX-G组更快是因为鱼肉肌原纤维蛋白在微冻过程中溶解性下降、疏水基团暴露,造成蛋白与水分子之间的相互作用减弱,导致持水力下降速度加快,而CPX-G组膜液中的黄原胶可与鱼肉蛋白发生共凝胶作用, 使鱼肉蛋白凝胶网络结构更加致密, 增强了体系截留水分的能力,从而使CPX-G组WHC的下降速度变缓[41]。综上可见,复合膜在抑制鱼体内水分流失方面效果明显。
3 结论
普鲁兰多糖复合膜的最佳制备条件为m(普鲁兰多糖)∶m(羧甲基壳聚糖)∶m(黄原胶)=2∶2∶1,膜液质量浓度为1.4 g/100 mL,超声时间为15 min。将复合膜应用在大口黑鲈鱼的保鲜上,发现复合膜能显著抑制鱼肉肌动球蛋白、总巯基、Ca2+-ATP酶活性及WHC的降低,有效延缓TVB-N、K值、TVC与pH值的增加。说明普鲁兰多糖/羧甲基壳聚糖/黄原胶/胶原蛋白复合膜对大口黑鲈鱼具有良好的保鲜效果,维持鱼肉品质、延长保质期效果明显。
[1] 王寿兵,王心怡,刘兴国,等.基于文献数据的大口黑鲈养殖池水温生态适宜度评价基准初探[J].复旦学报(自然科学版),2023,62(4):535-541;522.
WANG S B, WANG X Y, LIU X G, et al. Preliminary study on ecological suitability evaluation benchmark of water temperature in largemouth bass aquaculture pond based on literature data. Journal of Fudan University (Natural Science), 2023, 62(4):535-541; 552.
[2] CAI L Y, WAN J L, LI X X, et al.Effects of different thawing methods on physicochemical properties and structure of largemouth bass (Micropterus salmoides)[J].Food Science, 2020,0(0):1-5.
[3] XIE X A, LIU X L, FEI Y, et al.Single and combined effects of tea polyphenols and edible chitosan coating on the shelf life improvement of refrigerated dagger-tooth pike conger (Muraenesox cinereus)[J].International Journal of Food Properties, 2020, 23(1):2110-2122.
[4] ![]() K, GNIEWOSZ M, KOSAKOWSKA O, et al.Preservation of Brussels sprouts by pullulan coating containing oregano essential oil[J].Journal of Food Protection, 2016, 79(3):493-500.
K, GNIEWOSZ M, KOSAKOWSKA O, et al.Preservation of Brussels sprouts by pullulan coating containing oregano essential oil[J].Journal of Food Protection, 2016, 79(3):493-500.
[5] WU S J, LU M S, WANG S J.Effect of oligosaccharides derived from Laminaria japonica-incorporated pullulan coatings on preservation of cherry tomatoes[J].Food Chemistry, 2016, 199:296-300.
[6] JIANG L F.Pullulan-based coatings for preservation of razor clam Sinonovacula constricta[J].International Journal of Biological Macromolecules, 2016, 92:134-137.
[7] MORSY MOHAMED K, SHAROBA ASHRAF M, KHALAF HASSAN H, et al.Efficacy of antimicrobial pullulan-based coating to improve internal quality and shelf-life of chicken eggs during storage[J].Journal of Food Science, 2015, 80(5):1066-1074.
[8] 刘磊, 孙卫东, 黄利华, 等.壳聚糖/普鲁兰多糖/聚乙烯醇/胶原蛋白食品膜的理化性质及结构特征[J].现代食品科技, 2023,39(5):81-88.
LIU L, SUN W D, HUANG L H, et al.Physical and chemical properties and structural characteristics of chitosan/pullulan polysaccharide/polyvinyl alcohol/collagen food film[J].Modern Food Science and Technology, 2023,39(5):81-88.
[9] 胡云峰, 张利苹, 位锦锦, 等.普鲁兰多糖涂膜剂的制作及其在鸡蛋保鲜中的应用[J].食品研究与开发, 2019, 40(23):38-42.
HU Y F, ZHANG L P, WEI J J, et al. Production of pululan polysaccharide coating method and its application in the preservation of the egg. Food Research and Development, 2019, 40(23):38-42.
[10] ZIMET P, ![]() D, et al.Physico-chemical and antilisterial properties of nisin-incorporated chitosan/carboxymethyl chitosan films[J].Carbohydrate Polymers, 2019, 219:334-343.
D, et al.Physico-chemical and antilisterial properties of nisin-incorporated chitosan/carboxymethyl chitosan films[J].Carbohydrate Polymers, 2019, 219:334-343.
[11] 陈露珠, 李念, 裴诺, 等.普鲁兰多糖/羧甲基壳聚糖复合膜的制备及其对罗氏沼虾的保鲜效果[J].食品与发酵工业, 2021, 47(24):137-143.
CHEN L Z, LI N, PEI N, et al.Preparation of pullulan/carboxymethyl chitosan composite membrane and its fresh-keeping effect on Macrobrachium rosenbergii[J].Food and Fermentation Industries, 2021, 47(24):137-143.
[12] ABU ZARIM N, ZAINUL ABIDIN S, ARIFFIN F. Shelf life stability and quality study of texture-modified chicken rendang using xanthan gum as thickener for the consumption of the elderly with dysphagia[J]. Food Bioscience, 2021, 42:101054.
[13] 樊彦玲. 基于果胶/海藻酸钠/黄原胶的可食性膜的制备及应用研究[D].太原:中北大学, 2021.
FAN Y L.Preparation and application of edible film based on pectin/sodium alginate/xanthan gum[D].Taiyuan:North University of China, 2021.
[14] 吴钟龙, 公维洁, 卓先勤, 等.鱼皮胶原蛋白膜的研究进展[J].化工技术与开发, 2018, 47(12):30-34.
WU Z L, GONG W J, ZHUO X Q, et al. Research progress on fish skin collagen films. Technology &Development of Chemical Industry, 2018, 47(12):30-34.
[15] PENG Y, LI Y F. Combined effects of two kinds of essential oils on physical, mechanical and structural properties of chitosan films[J]. Food Hydrocolloids, 2014, 36:287-293.
[16] 曹立妤, 陈澄, 周治, 等.羧甲基壳聚糖/氧化羧甲基纤维素/姜黄素复合膜的制备及其在草莓涂膜保鲜中的应用[J].现代食品科技,2022,38(12):247-254.
CAO L Y, CHEN C, ZHOU Z, et al. Fabrication of a carboxymethyl chitosan/oxidized carboxymethylcellulose/curcumin composite film and its application in the film-coating preservation of strawberry[J]. Modern Food Science and Technology, 2022, 38(12):247-254.
[17] PEI Y, YANG J, LIU P, et al.Fabrication, properties and bioapplications of cellulose/collagen hydrolysate composite films[J].Carbohydrate Polymers, 2013, 92(2):1752-1760.
[18] 邹丽娜, 李晓楠, 周小婉, 等. 柠檬醛纳米乳对壳聚糖涂膜性能和保鲜效果的影响[J]. 食品与发酵工业, 2023, 49(9):179-185.
ZOU L N, LI X N, ZHOU X W, et al. Effect of citral nanoemulsion on properties of chitosan coating and preservation performance[J]. Food and Fermentation Industries, 2023, 49(9):179-185.
[19] 吴秀华, 罗欣, 何鹏.壳聚糖精油复合涂膜对生鲜猪肉的保鲜效果研究[J].食品科技, 2022, 47(6):140-145.
WU X H, LUO X, HE P.Effect of coating treatment by chitosan-basil oil solution on preservation of fresh pork[J].Food Science and Technology, 2022, 47(6):140-145.
[20] ZHOU A M, LIN L Y, LIANG Y,et al.Physicochemical properties of natural actomyosin from threadfin bream (Nemipterus spp.) induced by high hydrostatic pressure[J].Food Chemistry, 2014, 156:402-407.
[21] 刘欣荣, 申亮, 齐凤生, 等.微冻保鲜对红鳍东方鲀贮藏品质的影响[J].食品与发酵工业, 2020, 46(18):128-135.
LIU X R, SHEN L, QI F S, et al. Effects of micro-frozen storage on the quality of Takifugu rubripes[J]. Food and Fermentation Industries, 2020, 46(18):128-135.
[22] 吴佳. 普鲁兰壳聚糖复合可食用膜的性质研究[D].无锡:江南大学, 2012.
WU J. Study on properties of pullulan chitosan composite edible film[D].Wuxi: Jiangnan University, 2012.
[23] 张立挺, 蒋子文, 高磊, 等.壳聚糖明胶可食用复合膜的制备与抗菌性能研究[J].食品研究与开发, 2020, 41(6):106-111;180.
ZHANG L T, JIANG Z W, GAO L, et al.Preparation and antimicrobial properties of the edible food packaging film composited by chitosan and gelatin[J].Food Research and Development, 2020, 41(6):106-111;180.
[24] ![]() K,
K, ![]() I, GNIEWOSZ M, et al.Effect of pullulan coating on postharvest quality and shelf-life of highbush blueberry (Vaccinium corymbosum L.)[J].Materials, 2017, 10(8):965-977.
I, GNIEWOSZ M, et al.Effect of pullulan coating on postharvest quality and shelf-life of highbush blueberry (Vaccinium corymbosum L.)[J].Materials, 2017, 10(8):965-977.
[25] KODA S, MORI H, MATSUMOTO K, et al.Ultrasonic degradation of water-soluble polymers[J].Polymer, 1994, 35(1):30-33.
[26] INTROZZI L, BLOMFELDT T O J, TRABATTONI S, et al.Ultrasound-assisted pullulan/montmorillonite bionanocomposite coating with high oxygen barrier properties[J].Langmuir the Acs Journal of Surfaces &Colloids, 2012, 28(30):11206-11214.
[27] 左映平, 孙国勇, 黎春怡, 等.利用石莼与肉桂提取液制备复合涂膜保鲜液及在鲜虾保鲜中的效果评价[J].农产品加工, 2018(11):13-16.
ZUO Y P, SUN G Y, LI C Y, et al.The preparation of compound coating antistaling liquid using Ulva, cinnamon extract and evaluate the effect of preservation of fresh shrimp[J].Farm Products Processing, 2018(11):13-16.
[28] 倪渠峰, 李婷婷, 傅玉颖, 等.冷藏大黄鱼肌肉蛋白质的生化特性及降解规律[J].中国食品学报, 2014, 14(6):41-47.
NI Q F, LI T T, FU Y Y, et al.Biochemical properties and degradation rule of muscle protein from large yellow croaker (Pseudosciaena crocea) during chilled storage[J].Journal of Chinese Institute of Food Science and Technology, 2014, 14(6):41-47.
[29] ZHU Y C, MA L Z, YANG H, et al.Super-chilling(-0.7 ℃)with high CO2 packaging inhibits biochemical changes of microbial origin in catfish(Clarias gariepinus)muscle during storage[J].Food Chemistry, 2016, 206:182-190.
[30] 林瑞榕, 杨清羽, 罗富靖, 等.黄原胶对卤肉酱品质及风味的影响[J].食品安全质量检测学报, 2022, 13(21):6844-6854.
LIN R R, YANG Q Y, LUO F J, et al.Effects of xanthan gum on the quality and flavor of braised meat sauce[J].Journal of Food Safety &Quality, 2022, 13(21):6844-6854.
[31] 刘金昉, 刘红英, 齐凤生, 等.复合生物保鲜剂结合冰温贮藏对南美白对虾的保鲜效果[J].食品科学, 2014, 35(20):286-290.
LIU J F, LIU H Y, QI F S, et al.Preservation effect of complex biological preservative combined with ice temperature storage on Penaeus vannamei[J].Food Science, 2014, 35(20):286-290.
[32] 刘舒彦, 熊光权, 李海蓝, 等.加州鲈优势腐败菌的分离鉴定[J].现代食品科技, 2019, 35(11):120-125;230.
LIU S Y, XIONG G Q, LI H L, et al.Isolation and identification of the dominant spoilage bacteria from california bass (Micropterus salmoides)[J].Modern Food Science and Technology, 2019, 35(11):120-125;230.
[33] 杨声, 冯小强, 伏国庆, 等.水溶性壳聚糖对几种常见菌的抑制作用及其机理初探[J].中国酿造, 2007,26(5):15-18.
YANG S, FENG X Q, FU G Q, et al.Initial study on antibacterial activity and mechanism of hydrosoluble chitosan on common bacteria[J].China Brewing, 2007,26(5):15-18.
[34] 高萌, 张宾, 王强, 等.流化冰保鲜对鲣鱼蛋白质功能特性的影响[J].食品科学, 2014, 35(22):304-309.
GAO M, ZHANG B, WANG Q, et al.Effect of slurry ice treatment on functional properties of muscle proteins of skipjack tuna[J].Food Science, 2014, 35(22):304-309.
[35] 李亮, 柏韵, 尚宏丽, 等.自由基氧化对中国对虾肌原纤维蛋白的影响[J].食品工业科技, 2017, 38(24):75-78;83.
LI L, BAI Y, SHANG H L, et al.Effects of free radical oxidation on Chinese Penaeus myofibrillar protein[J].Science and Technology of Food Industry, 2017, 38(24):75-78;83.
[36] 吴春华. 壳聚糖衍生物分子修饰机理及其在银鲳鱼保鲜中的应用研究[D].杭州:浙江大学, 2017.
WU C H.Study on molecular modification mechanism of chitosan derivatives and its application in preservation of silver pomfret[D].Hangzhou:Zhejiang University, 2017.
[37] 于林. 白鲢鱼鳞胶原蛋白复合膜的制备以及保鲜效果研究[D].上海:上海海洋大学, 2017.
YU L.Study on preparation and preservation effect of silver carp scale collagen composite membrane[D].Shanghai:Shanghai Ocean University, 2017.
[38] 黄晓春, 侯温甫, 杨文鸽, 等.冰藏过程中美国红鱼生化特性的变化[J].食品科学, 2007, 28(1):337-340.
HUANG X C, HOU W F, YANG W G, et al.Study on changes of biochemical properties of Sciaenops ocellatus during frozen storage[J].Food Science, 2007, 28(1):337-340.
[39] 卢涵. 鳙鱼肉低温贮藏过程中蛋白氧化组织蛋白酶活性与品质变化规律的研究[D].北京:中国农业大学, 2017.
LU H. Changes of protein oxidation, cathepsin activity and quality of bighead carp meat during low temperature storage[D].Beijing: China Agricultural University, 2017.
[40] 吕卫金, 赵进, 汪金林, 等.茶多酚延缓冷藏大黄鱼肌原纤维蛋白变性降解机理研究[J].中国食品学报, 2014, 14(1):60-67.
LYU W J, ZHAO J, WANG J L, et al. Effects of tea polyphenols on preservation mechanism of myofibrillar protein from large yellow croaker[J]. Journal of Chinese Institute of Food Science and Technology, 2014, 14(1):60-67.
[41] 郑小善, 洪学正, 张迪, 等.黄原胶-鱼肉蛋白共凝胶作用制备高性能虾肉糜凝胶[J].食品与发酵工业, 2022, 48(19):137-143.
ZHENG X S, HONG X Z, ZHANG D, et al.Preparation of high-performance shrimp surimi gel by xanthan gum-fish protein co-gelation[J].Food and Fermentation Industries, 2022, 48(19):137-143.