肠道菌群对人体新陈代谢和身体健康有着深远的影响,它能够帮助人体从碳水化合物中提取能量并产生维生素[1],在维持机体免疫力[2]和抑制微生物病原体[3]等方面有重要作用,且影响着人体内分泌系统和精神情感[4]。乳酸菌作为人体肠道中重要的益生菌,能够调节肠道微生物群的生长、抑制破坏性细胞、增强人体免疫力、保护肠黏膜屏障和降低肠道pH值[5-6]。同时乳酸菌是制备发酵乳的主要发酵剂,在原料奶的酸化和发酵乳制品的生产中发挥着至关重要的作用,是影响发酵乳品质的主要因素之一[7]。不同乳酸菌制备的发酵乳拥有不同的风味和滋味,其主要通过生产有机酸(乳酸等)使原料快速酸化,同时产生乙酸、乙醇、芳香化合物和胞外多糖等副产品,有效延长产品保质期、改善质地,并有助于产品产生愉悦的感官特征[8]。有研究发现分离自婴儿肠道中的鼠李糖乳杆菌(Lacticaseibacillus rhamnosus)可作为益生菌帮助儿童预防腹泻和食物过敏[9-10],其中干酪乳杆菌鼠李糖亚种GG(Lacticaseibacillus casei subsp.rhamnosus GG)[11]和L.rhamnosus MP108[12]作为配料应用于婴儿配方奶粉和发酵乳中,因此从肠道中分离乳酸菌并将其应用于乳品发酵具有极强的可行性。
银川市是宁夏回族自治区首府,位于我国西北地区,恩施市是恩施土家族自治州首府,位于我国南部,两地气候差异大,且人口复杂。本研究对湖北恩施和宁夏银川地区的青年人肠道乳酸菌进行了分离鉴定,利用分离出的乳酸菌制备发酵乳,并基于电子鼻和电子舌对发酵乳品质进行了评价,以期筛选出发酵品质优良的乳酸菌菌种。
1 材料与方法
1.1 材料与试剂
粪便样本,恩施和银川地区青年人肠道;脱脂乳粉和蔗糖,市售;DNeasy mericon Food Kit DNA基因组提取试剂盒,德国QIAGEN公司;脱氧核糖核苷三磷酸、10×聚合酶链式反应缓冲液和DNA聚合酶(5 U/μL),北京全式金生物技术有限公司;Axygen清洁试剂盒,康宁生命科学吴江有限公司;MRS培养基、胰蛋白胨、酵母粉、琼脂糖(生化试剂)、氯化钠(分析纯),上海国药集团化学试剂有限公司;pMD18-T克隆载体,宝生物工程(大连)有限公司;引物M13F(-47)、M13R(-48)、27F与1495R,金斯瑞生物科技有限公司。
1.2 仪器与设备
Vetiri梯度基因扩增仪,美国AB公司;Fluor Chem FC3型化学发光凝胶成像系统,美国Protein Simple公司;CT15E台式高速离心机、CR21 N型高速离心机,日本HITACHI公司;DG250厌氧工作站:英国DWS公司;LRH-150生化培养箱,上海一恒科学仪器有限公司;YXQ-L31-400立式压力蒸汽灭菌器,上海博迅实业有限公司医疗设备厂;PEN3电子鼻,德国Airsense公司;SA-402B电子舌,日本Insent公司。
1.3 试验方法
1.3.1 志愿者招募与样品采集
银川市是宁夏回族自治区首府,位于我国西北地区,属中温带大陆性气候[13],本地人口主要包括汉族、回族、满族和蒙古族等,饮食以面食、肉类和油炸食品为主[14];恩施市是湖北省恩施土家族苗族自治州首府驻地,位于我国华中地区,属亚热带季风性山地湿润气候,土壤中富含硒元素,本地人口主要包括汉族和土家族等,具有食用腌制食品和泡菜等发酵食品的习惯[15]。本研究从宁夏回族自治区银川市志愿者14名(YC1~YC14),年龄在17~22岁,招募湖北省恩施土家族苗族自治州招募青年人志愿者13名(ES1~ES13),BMI值为20~25,两周内未服用药物。将样品用无菌勺采集于无菌离心管后,快速置于装有冰袋的采样箱中运回实验室进行处理。
1.3.2 青年人肠道乳酸菌的分离鉴定与筛选
乳酸菌分离与鉴定:将粪便样品10倍梯度稀释后,取10-5和10-6梯度的稀释液涂布于含有CaCO3的MRS琼脂培养基中,于厌氧工作站(85% N2,5% CO2及10% H2)37 ℃培养2 d后,选取有透明圈且菌落形态不同的单个菌落在MRS固体培养基中纯化3代。将纯化完成的菌落进行过氧化氢酶试验及细胞形态观测,将过氧化氢酶试验阴性及革兰氏染色阳性的菌株定为疑似乳酸菌,并用30%的甘油冻存于-80 ℃备用。将待定乳酸菌按照CTAB法提取基因组DNA[16]后进行PCR扩增,扩增体系和条件按照李娜等[17]的方法。使用Axygen PCR清洁试剂盒清洁PCR产物后克隆,挑选阳性克隆子送至上海桑尼生物科技有限公司测序。测序所得序列在美国国家生物技术信息中心(NationaL CENTER OF BIOTECHNOLOGY INFORMAtion.NCBI)数据库进行比对。
菌株筛选:根据《可用于食品的菌种名单》选取分离的乳酸菌进行发酵乳制备[18]。
1.3.3 发酵乳的制备
将水(82.0%,体积分数)、脱脂乳粉(115 g/L)和蔗糖(65 g/L)按比例混合后60 ℃水合30 min,然后在95 ℃条件下水浴保温杀菌5 min,使用冰水将其降至常温后按照5×106CFU/mL的比例接入菌体,37 ℃发酵24 h后迅速冷却至4 ℃,在4 ℃培养箱中后熟24 h。
1.3.4 发酵乳品质检测
取15.0 g发酵乳样品置于顶空瓶中,参照CAI等[19]的方法使用电子鼻对发酵乳的风味品质进行分析。
在30.0 g发酵乳样品中加入90 mL的去离子水10 000 r/min离心5 min后,取上清液抽滤后备用,参照ZHAO等[20]的方法使用电子舌对发酵乳滋味品质进行分析。
1.4 多元统计学分析
利用主成分分析(principal component analysis, PCA)发酵乳样品的品质进行分析;使用GraphPad Prism 9.0绘制小提琴图;使用SAS 9.0软件进行数据分析,使用Origin 2021软件绘制散点图,使用EXCEL绘制饼图。
2 结果与分析
2.1 不同地区青年人肠道乳酸菌的分离鉴定
乳酸菌作为人体肠道中重要的益生菌,不仅广泛存在于人体肠道中,还能够调节人体肠道菌群的平衡。本研究对两地区青年人肠道中的乳酸菌进行了分析,其中银川地区青年人肠道分离株分析结果见图1。

图1 银川地区青年人肠道乳酸菌分析
Fig.1 Analysis of intestinal lactic acid bacteria in young people in Yinchuan area
由图1可知,从银川地区青年人肠道中分离出83株疑似乳酸菌,经16S rRNA序列分析被鉴定为9个属的22个种,其中隶属于肠球菌属(Enterococcus,32.52%)的4个种,分别为屎肠球菌(Enterococcus faecium,27.71%)、耐久肠球菌(Enterococcus durans,2.41%)、粪肠球菌(Enterococcus faecalis,1.20%)和泰国肠球菌(Enterococcus thailandicus,1.20%);其次为隶属于链球菌属(Streptococcus,30.11%)的4个种,分别为黄体链球菌(Streptococcus lutetiensis,24.10%)、马其顿链球菌(Streptococcus macedonicus,3.61%)、马链球菌(Streptococcus equinus,1.20%)和巴氏链球菌(Streptococcus pasteurianus,1.20%);隶属于魏斯氏菌属(Weissella,10.84%)的2个种分别为融合魏斯氏菌(Weissella confusa,9.64%)和食窦魏斯氏菌(Weissella cibaria,1.20%);隶属于乳杆菌属(Lactobacillus,6.02%)的菌株可分为3个种,包括淀粉乳杆菌(Lactobacillus amylovorus,2.41%)、约氏乳杆菌(Lactobacillus johnsonii,2.41%)和卷曲乳杆菌(Lactobacillus crispatus,1.20%);隶属于黏液乳杆菌属(Limosilactobacillus,4.81%)的3个种分别为发酵黏液乳杆菌(Limosilactobacillus fermentum,2.41%)、黏膜黏液乳杆菌(Limosilactobacillus mucosae,1.20%)和口黏液乳杆菌(Limosilactobacillus oris,1.20%);隶属于联合乳杆菌属(Ligilactobacillus,6.02%)的2个种分别为瘤胃联合乳杆菌(Ligilactobacillus ruminis,4.82%)和唾液联合乳杆菌(Ligilactobacillus salivarius,1.20%);隶属于片球菌属(Pediococcus)酸性乳片球菌(Pediococcus acidilactici,4.55%);隶属于乳植物杆菌属(Lactiplantibacillus,2.40%)的2个种分别为植物乳植物杆菌(Lactiplantibacillus plantarum,1.20%)和植物乳植物杆菌植物亚种(Lactiplantibacillus plantarum subsp.plantarum,1.20%);隶属于明串珠菌属(Leuconostoc)的乳明串珠菌(Leuconostoc lactis,1.20%)。
恩施地区青年人肠道乳酸菌分析结果见图2。

图2 恩施地区青年人肠道乳酸菌分析
Fig.2 Analysis of intestinal lactic acid bacteria in young people in Enshi area
由图2可知,从恩施地区青年人肠道中分离出88株乳酸菌,经16S rRNA序列分析被鉴定为9个属的20个种,其中隶属于Streptococcus的3个种相对含量为30.68%,分别为黄体链球菌(Streptococcus lutetiensis,26.14%),马其顿链球菌(Streptococcus macedonicus,2.27%)和巴氏链球菌(Streptococcus pasteurianus,2.27%);隶属于Weissella的2个种相对含量为23.86%,分别为Weissella confusa(21.59%)和Weissella cibaria(2.27%);隶属于Enterococcus的3个种相对含量为15.92%,分别为Enterococcus faecium(13.64%)、鸟肠球菌(Enterococcus avium,1.14%)和乳酸肠球菌(Enterococcus lactis,1.14%);隶属于黏液乳杆菌属(Limosilactobacillus,7.95%)的2个种分别为L.fermentum(5.68%)和罗伊氏黏液乳杆菌(Limosilactobacillus reuteri,2.27%);隶属于Lactobacillus的3个种相对含量为5.69%,分别为德氏乳杆菌(Lactobacillus delbrueckii,3.41%)、嗜酸乳杆菌(Lactobacillus acidophilus,1.14%)和L.johnsonii(1.14%);隶属于Pediococcus的2个种相对含量为5.69%,分别为Pediococcus acidilactici(4.55%)和戊糖片球菌(Pediococcus pentosaceus,1.14%);隶属于乳植物杆菌属(Lactiplantibacillus,4.55%)的2个种分别为L.plantarum subsp.plantarum(3.41%)和L.plantarum(1.14%);隶属于联合乳杆菌属(Ligilactobacillus,3.41%)的2个种分别为L.ruminis(2.27%)和敏捷联合乳杆菌(Ligilactobacillus agilis,1.14%);隶属于乳球菌属(Lactococcus)的1个种为格氏乳球菌(Lactococcus garvieae,2.27%)。
对两地区青年人肠道乳酸菌分析可以发现,从银川地区青年人肠道中分离的乳酸菌多样性较高于恩施地区,且两地区青年人肠道中分离出的乳酸菌种类略有差异。从银川地区青年人肠道中分离出5种在恩施地区青年人肠道中未分离出的乳酸菌,分别为L.amylovorus、L.crispatus、L.mucosae、L.oris和L.salivarius;同时恩施青年人肠道中也分离出4种在银川青年人肠道中未分离出的乳酸菌,分别为L.delbrueckii、L.reuteri、L.acidophilus和L.agilis,造成这种差异的原因可能与两地区饮食文化和风俗习惯的不同有关[21]。乳酸杆菌属作为人体肠道中重要的益生菌,能够分解代谢肠道内益生元,抑制有害菌的生长[22]。研究发现,L.plantarum和L.acidophilus能够将游离亚油酸转化为有抗糖尿病、抗炎和抗癌特性的共轭亚油酸[23-24];L.delbrueckii作为天然益生菌具有调节肠道菌群的功能,其常存在于一些发酵食品中[25];L.fermentum能产生多种有效的抗菌肽,可用作食品防腐剂或抗生素的替代品,且其能够降低血胆固醇水平,可以作为降胆固醇剂[26];FRANCAVILLA等[27]研究发现L.reuteri能够对幽门杆菌的生长产生抑制作用,且能明显降低抗生素带来的副作用并提高根除率。
2.2 乳酸杆菌制备发酵乳品质的评价
本研究进一步依据《可用于食品的菌种名单》选取23株乳酸菌进行发酵乳制备并对其品质进行评价,以确定这些乳酸菌制备的发酵乳特性。选取菌株分别为7株L.fermentum(YC3-5、YC9-1、ES1-1、ES5-8、ES1-7、ES1-9和ES4-12),4株L.plantarum subsp.plantarum(YC2-5、ES1-6、ES1-8和ES9-5),3株L.johnsonii(YC7-6、YC8-7和ES4-10)和3株L.delbrueckii(ES5-5、ES8-7和ES8-8),2株L.plantarum(YC8-8和ES5-1)和2株L.reuteri(ES4-9和ES4-11)以及L.salivarius(YC4-1)和L.acidophilus(ES3-4)各1株。选取的23株乳酸菌中有7 株分离自银川青年人肠道,编号分别为YC2-5、YC3-5、YC4-1、YC7-6、YC8-7、YC8-8和YC9-1,其余16株分离自恩施青年人肠道。发酵乳风味品质特征分析结果见表1。
表1 电子鼻各传感器对发酵乳的响应值
Table 1 Response values of electronic nose sensors to fermented milk
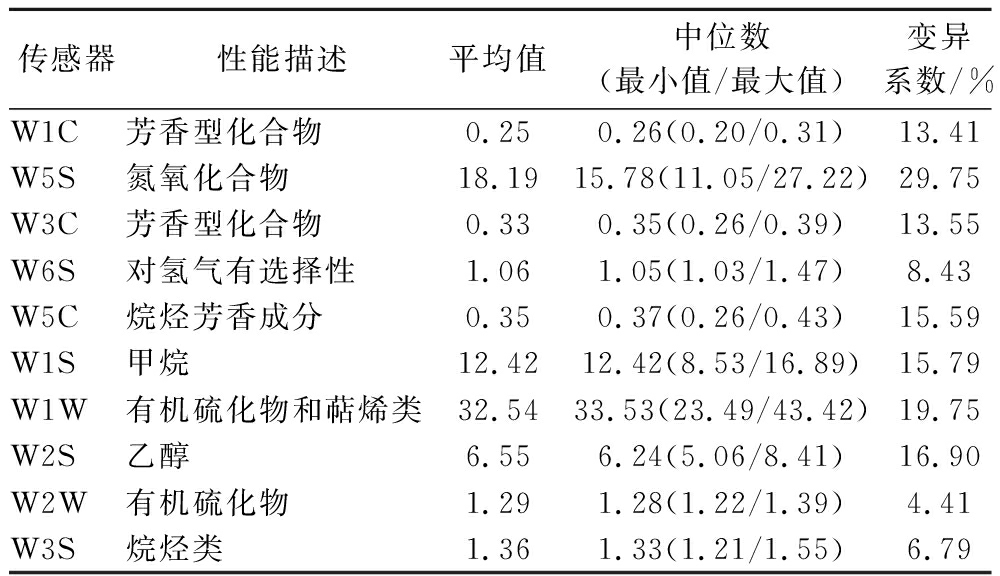
传感器性能描述平均值中位数(最小值/最大值)变异系数/%W1C芳香型化合物0.25 0.26(0.20/0.31)13.41W5S氮氧化合物18.19 15.78(11.05/27.22)29.75 W3C芳香型化合物0.33 0.35(0.26/0.39)13.55 W6S对氢气有选择性1.06 1.05(1.03/1.47)8.43 W5C烷烃芳香成分0.35 0.37(0.26/0.43)15.59 W1S甲烷12.42 12.42(8.53/16.89)15.79 W1W有机硫化物和萜烯类32.54 33.53(23.49/43.42)19.75 W2S乙醇6.55 6.24(5.06/8.41)16.90 W2W有机硫化物1.29 1.28(1.22/1.39)4.41 W3S烷烃类1.36 1.33(1.21/1.55)6.79
由表1可知,电子鼻传感器W2W的变异系数最小,而传感器W1C、W5S、W3C、W5C、W1S、W1W和W2S的变异系数均大于10%,因此乳酸菌制备的发酵乳风味在有机硫化物的差异最小,而在香型化合物、氮氧化合物、甲烷、萜烯类和乙醇的差异大。由此可知,不同乳酸菌制备的发酵乳风味品质存在较大的差异。发酵乳的风味品质是影响消费者感官体验的一项重要因素,除此之外,发酵乳的滋味品质也极大的影响着消费者的感官体验[28]。本研究通过电子舌对发酵乳的各滋味指标进行了测定,其相对强度值如图3所示。
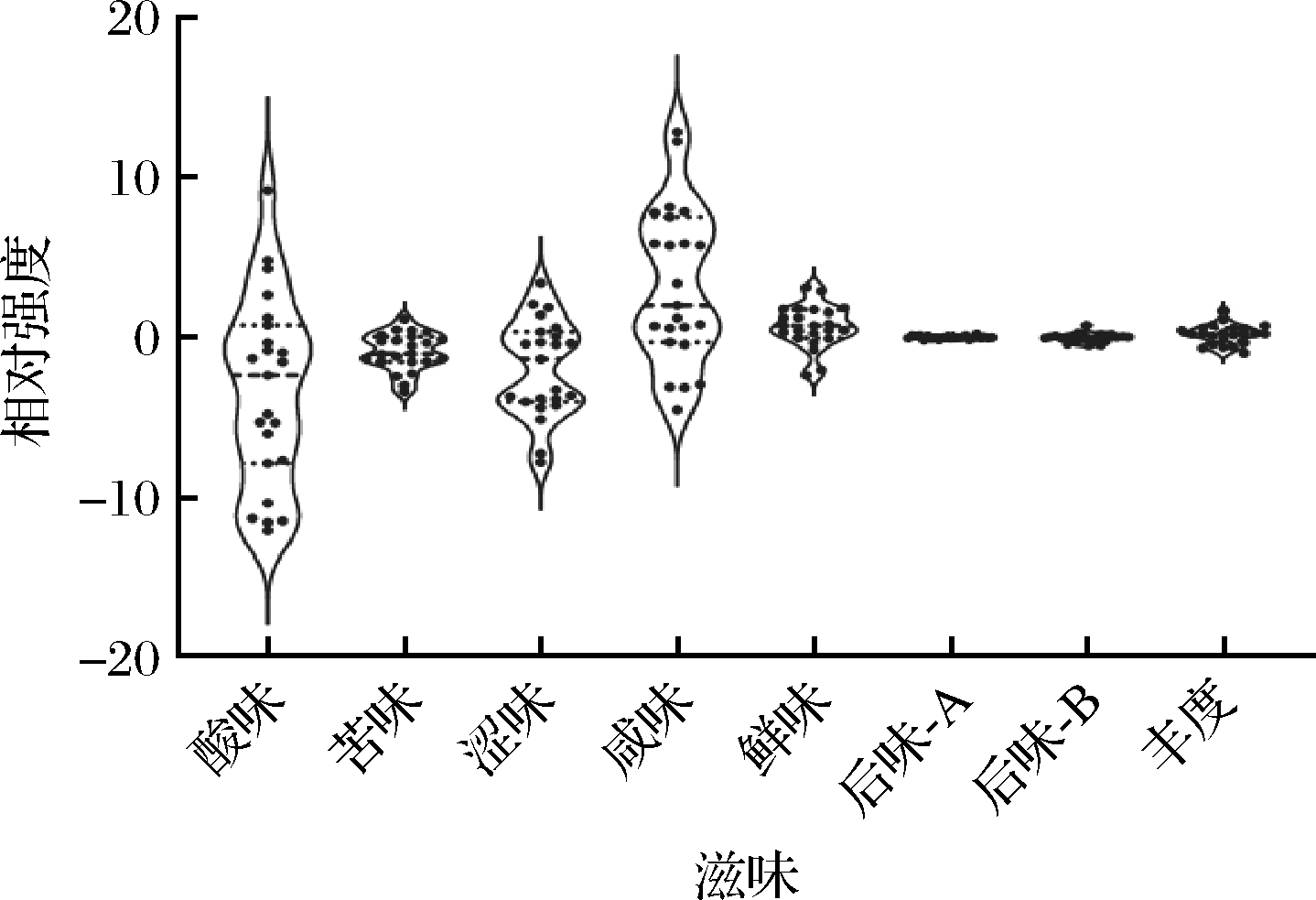
图3 基于乳酸菌制备发酵乳滋味品质分析
Fig.3 Analysis of taste and quality of fermented milk prepared by lactic acid bacteria
由图3可知,不同乳酸菌制备的发酵乳中后味-A(涩味的回味)的极差值小于1,而酸味、苦味、涩味、咸味、鲜味、后味-B(苦味的回味)和丰度(鲜味的回味)的极差值大于1。说明不同乳酸菌制备的发酵乳间后味-A差异较小,感官差异不明显;而在酸味、苦味、涩味、咸味、鲜味、后味-B和丰度间的差异较大,且滋味指标酸味、涩味和鲜味的极差值最大,分别为21.25、11.17和17.32。由此可知,不同乳酸菌制备的发酵乳滋味品质各异,且乳酸菌对发酵乳滋味品质的影响主要体现在酸味、涩味和鲜味方面。
本研究进一步使用PCA对发酵乳的品质进行了评价。经PCA发现,不同乳酸菌制备发酵乳品质的信息主要集中在前4个主成分,累计方差贡献率为87.02%,其中前2个主成分的贡献率分别为41.22%和28.12%,可视化分析结果见图4和图5。
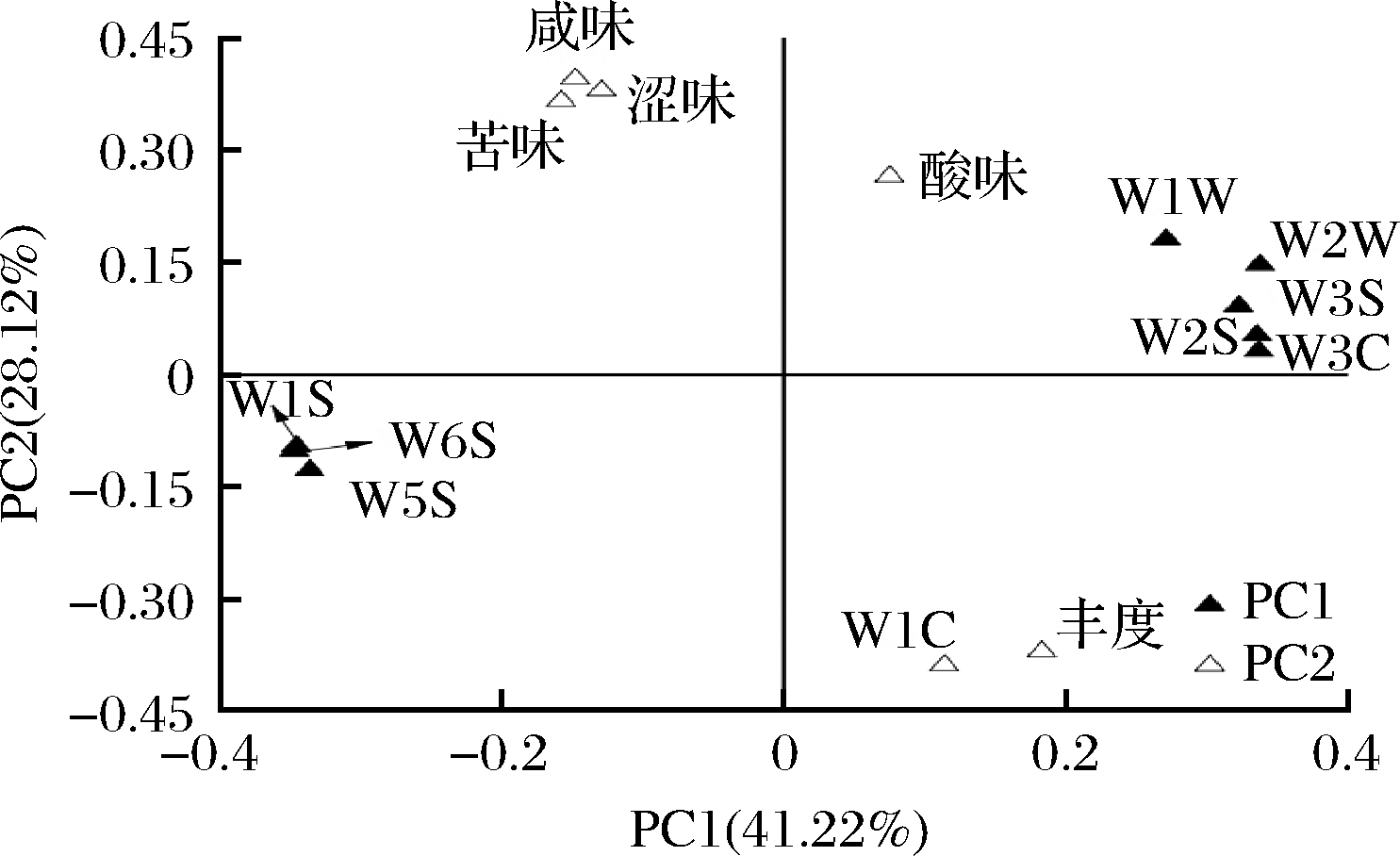
图4 基于发酵乳品质主成分分析的因子载荷图
Fig.4 Factor load diagram based on principal component analysis of fermented milk quality

图5 基于发酵乳品质主成分分析的因子得分图
Fig.5 Factor score chart based on principal component analysis of fermented milk quality
由图4可知,第一主成分由W1S、W2S、W3S、W5S、W6S、W1W、W2W和W3C 8个风味传感器指标构成,第二主成分由W1C、酸味、苦味、涩味、咸味和丰度6个指标构成。其中酸味、W3C、W1W、W2W、W3S和W2S位于第一象限,咸味、涩味和苦味位于第二象限,传感器W1S、W5S和W6S位于第三象限,传感器W1C和丰度位于第四象限。
由图5可知,有3株乳酸菌ES3-4、ES8-7和ES8-8制备的发酵乳样品分布在第一象限,3株乳酸菌ES1-8、ES4-11和ES9-5制备的发酵乳分布在第二象限,9株乳酸菌YC7-6、YC8-7、YC8-8、ES1-6、ES1-7、ES1-9、ES4-9、ES4-10和ES4-12制备的发酵乳分布在第三象限,8株乳酸菌YC2-5、YC3-5、YC4-1、YC9-1、ES1-1、ES5-1、ES5-5和ES5-8制备的发酵乳位于第四象限。据PCA发现,菌株ES3-4(L.acidophilus)制备的发酵乳有明显的酸味,而ES1-1(L.fermentum)制备的发酵乳芳香风味更明显。由此可知,乳酸菌Lactobacillus acidophilus ES3-4可增加发酵乳的酸味,而乳酸菌L.fermentum ES1-1可增加发酵乳的香气。嗜酸乳杆菌作为第三代乳酸菌发酵剂具有良好的耐酸胆汁盐的耐受性[29],其不仅广泛应用于乳制品等的生产,还可增机体强免疫力,平衡肠道菌群[30]。任然等[31]使用4株益生菌,即双歧杆菌、植物乳杆菌、干酪乳杆菌和嗜酸乳杆菌结合基础发酵剂发酵了酸奶并对其品质进行了分析,结果显示嗜酸乳杆菌的产酸能力是最强的,本研究从青年人肠道中分离的嗜酸乳杆菌也可增加发酵乳的酸味。发酵乳杆菌具有调节机体免疫的功能、缓解胃肠道疾病的作用和对致病菌的拮抗作用[32]。LIM等[33]研究发现从人肠道中分离出的L.fermentum IM12能够通过抑制NF-κb-STAT3信号通路来减轻炎症。ALE等[34]研究显示,L.fermentum LF2制备的发酵乳可以改变发酵乳的流变特性,同时可保护小鼠免受沙门氏菌感染。分离自婴儿肠道中的菌株L. acidophilus Lb和L.rhamnosus GG可用于牛奶、发酵乳和婴儿配方奶粉的膳食补充剂,帮助预防儿童腹泻;分离自人体粪便中的菌株L.casei subsp.Shirota制备的发酵乳饮料对人体肠道具有一定的调理作用[35]。由此表明本研究中来源于青年人肠道的L.fermentum和L. acidophilus可以筛选作为发酵优良的乳酸菌进行后续发酵乳产品的开发。
3 结论
本研究从银川地区青年人肠道中分离出83株乳酸菌,被鉴定为9个属的22个种,其中9个属分别为Lactobacillus、Limosilactobacillus、Ligilactobacillus、Lactiplantibacillus、Enterococcus、Streptococcus、Leuconostoc、Weissella和Pediococcus;恩施地区青年人肠道中分离出88株乳酸菌,被鉴定为9个属的20个种,其中9个属分别为Lactobacillus、Limosilactobacillus、Ligilactobacillus、Lactiplantibacillus、Streptococcus、Enterococcus、Weissella、Pediococcus和Lactococcus。依据《可用于食品的菌种名单》选取23株乳酸菌制备的发酵乳,其中7株分离自银川青年人肠道,16株分离自恩施青年人肠道,其制备的发酵乳感官品质差异明显,其中分离自恩施青年人肠道的L.acidophilus ES3-4制备的发酵乳酸味强于其他菌株,分离自恩施青年人肠道的L.fermentum ES1-1制备的发酵乳芳香物质较高,香味更突出。
[1] LIN D, WANG R, LUO J J, et al. The core and distinction of the gut microbiota in Chinese populations across geography and ethnicity[J]. Microorganisms, 2020, 8(10):1579.
[2] SI H F, YANG Q, HU H, et al. Colorectal cancer occurrence and treatment based on changes in intestinal flora[J]. Seminars in Cancer Biology, 2021, 70:3-10.
[3] GIUFFR M, CAMPIGOTTO M, CAMPISCIANO G, et al. A story of liver and gut microbes: How does the intestinal flora affect liver disease? A review of the literature[J]. American Journal of Physiology. Gastrointestinal and Liver Physiology, 2020, 318(5): G889-G906.
M, CAMPIGOTTO M, CAMPISCIANO G, et al. A story of liver and gut microbes: How does the intestinal flora affect liver disease? A review of the literature[J]. American Journal of Physiology. Gastrointestinal and Liver Physiology, 2020, 318(5): G889-G906.
[4] LI X, LI C T. Analysis of changes in intestinal flora and intravascular inflammation and coronary heart disease in obese patients[J]. Experimental and Therapeutic Medicine, 2018, 15(5): 4538-4542.
[5] ALISHAHI M, DEZFULY Z T, MOHAMMADIAN T, et al. Effects of two probiotics, Lactobacillus plantarum and Lactobacillus bulgaricus on growth performance and intestinal lactic acid bacteria of Cyprinus carpio[J]. Iranian Journal of Veterinary Medicine, 2018, 12:207-218.
[6] 张振东, 王玉荣, 向凡舒, 等. 老年人肠道乳酸菌的分离与鉴定及其来源发酵乳杆菌的遗传进化分析[J]. 食品科学, 2021, 42(22):105-112.
ZHANG Z D, WANG Y R, XIANG F S, et al. Isolation and identification of lactic acid bacteria from the elderly gut and genetic evolution of isolated Lactobacillus fermentum[J]. Food Science, 2021, 42(22):105-112.
[7] BERNARDEAU M, VERNOUX J P, HENRI-DUBERNET S, et al. Safety assessment of dairy microorganisms: The Lactobacillus genus[J]. International Journal of Food Microbiology, 2008, 126(3):278-285.
[8] AYIVI R D, GYAWALI R, KRASTANOV A, et al. Lactic acid bacteria: Food safety and human health applications[J]. Dairy, 2020, 1(3):202-232.
[9] RIAZ RAJOKA M S, MEHWISH H M, SIDDIQ M, et al. Identification, characterization, and probiotic potential of Lactobacillus rhamnosus isolated from human milk[J]. LWT, 2017, 84:271-280.
[10] GUANDALINI S. Probiotics for prevention and treatment of diarrhea[J]. Journal of Clinical Gastroenterology, 2011, 45 Suppl: S149-S153.
[11] COSENZA L, NOCERINO R, DI SCALA C, et al. Bugs for atopy: The Lactobacillus rhamnosus GG strategy for food allergy prevention and treatment in children[J]. Beneficial Microbes, 2015, 6(2):225-232.
[12] ZHANG B, LYNCH B, ZHAO J, et al. Lactobacillus rhamnosus MP108: Toxicological evaluation[J]. Journal of Food Science, 2021, 86(1): 228-241.
[13] 冯克鹏, 田军仓. 宁夏地区气候变化及其对农业灌溉用水量的影响研究[J]. 灌溉排水学报, 2014, 33(S1):218-223.
FENG K P, TIAN J C. Climate change and its impact on agricultural irrigation water requirement in Ningxia[J]. Journal of Irrigation and Drainage, 2014, 33(S1):218-223.
[14] 马成明. 市场经济、人口流动与移民饮食文化的在地化: 基于宁夏银川的人类学考察[J]. 青海民族大学学报(社会科学版), 2021, 47(2):141-148.
MA C M. Market economy, population mobility and localization of immigrants' dietary culture—An anthropological investigation based on Yinchuan, Ningxia[J]. Journal of Qinghai Minzu University (Social Sciences), 2021, 47(2):141-148.
[15] 姚虹. 武陵民族地区农村女性老年人的生活状况以及对养老服务的需求研究: 以恩施市为例[J]. 云南民族大学学报(哲学社会科学版), 2020, 37(4):80-85.
YAO H. Living conditions and needs of elderly care services for rural elderly women in Wuling ethnic minority area: A case study of Enshi[J]. Journal of Yunnan Minzu University (Social Sciences), 2020, 37(4):80-85.
[16] 郭壮, 蔡宏宇, 杨成聪, 等. 六名襄阳地区青年志愿者肠道菌群多样性的研究[J]. 中国微生态学杂志, 2017, 29(9):998-1004.
GUO Z, CAI H Y, YANG C C, et al. The diversity of gut microflora in six young people in Xiangyang area[J]. Chinese Journal of Microecology, 2017, 29(9):998-1004.
[17] 李娜, 崔梦君, 马佳佳, 等. 基于Illumina MiSeq测序和传统可培养方法的洪湖鲊广椒乳酸菌多样性研究[J]. 食品与发酵工业, 2021, 47(4):110-115, 122.
LI N, CUI M J, MA J J, et al. Lactic acid bacterial diversity of Zha-chili in Honghu County based on Illumina Miseq sequencing and traditional culture method[J]. Food and Fermentation Industries, 2021, 47(4):110-115, 122.
[18] 段昊, 吕燕妮, 闫文杰. 益生菌在我国保健食品中的应用进展[J]. 食品工业科技, 2022, 43(3):384-394.
DUAN H, LV Y N, YAN W J. Application progress of probiotics in functional food in China[J]. Science and Technology of Food Industry, 2022, 43(3):384-394.
[19] CAI W C, TANG F X, GUO Z, et al. Effects of pretreatment methods and leaching methods on jujube wine quality detected by electronic senses and HS-SPME-GC-MS[J]. Food Chemistry, 2020, 330:127330.
[20] ZHAO N, ZHANG C C, YANG Q, et al. Selection of taste markers related to lactic acid bacteria microflora metabolism for Chinese traditional Paocai: A gas chromatography-mass spectrometry-based metabolomics approach[J]. Journal of Agricultural and Food Chemistry, 2016, 64(11):2415-2422.
[21] PAREEK S, KURAKAWA T, DAS B, et al. Comparison of Japanese and Indian intestinal microbiota shows diet-dependent interaction between bacteria and fungi[J]. NPJ Biofilms and Microbiomes, 2019, 5:37.
[22] 刘苗苗, 毕冉冉, 孙玉敬. 果蔬与肠道菌群互作及其健康功效研究进展[J]. 中国食品学报, 2022, 22(4):387-407.
LIU M M, BI R R, SUN Y J. Recent advances on the interaction between fruits or vegetables and intestinal flora and its effect on health[J]. Journal of Chinese Institute of Food Science and Technology, 2022, 22(4):387-407.
[23] MAGGIORA M, BOLOGNA M, CER M P, et al. An overview of the effect of linoleic and conjugated-linoleic acids on the growth of several human tumor cell lines[J]. International Journal of Cancer, 2004, 112(6):909-919.
M P, et al. An overview of the effect of linoleic and conjugated-linoleic acids on the growth of several human tumor cell lines[J]. International Journal of Cancer, 2004, 112(6):909-919.
[24] MIKELSAAR M, SEPP E,  T
T EPETOVA J, et al. Biodiversity of intestinal lactic acid bacteria in the healthy population[M]//Advances in Experimental Medicine and Biology. Cham: Springer International Publishing, 2016:1-64.
EPETOVA J, et al. Biodiversity of intestinal lactic acid bacteria in the healthy population[M]//Advances in Experimental Medicine and Biology. Cham: Springer International Publishing, 2016:1-64.
[25] 文伟, 杨泰, 韦良开, 等. 德氏乳杆菌的生物学功能及其在动物生产中的应用[J]. 动物营养学报, 2019, 31(4):1533-1539.
WEN W, YANG T, WEI L K, et al. Biological function of Lactobacillus delbrueckii and its application in animal production[J]. Chinese Journal of Animal Nutrition, 2019, 31(4):1533-1539.
[26] NAGHMOUCHI K, BELGUESMIA Y, BENDALI F, et al. Lactobacillus fermentum: A bacterial species with potential for food preservation and biomedical applications[J]. Critical Reviews in Food Science and Nutrition, 2020, 60(20):3387-3399.
[27] FRANCAVILLA R, POLIMENO L, DEMICHINA A, et al. Lactobacillus reuteri strain combination in Helicobacter pylori infection[J]. Journal of Clinical Gastroenterology, 2014, 48(5):407-413.
[28] GRANATO D, BRANCO G F, CRUZ A G, et al. Probiotic dairy products as functional foods[J]. Comprehensive Reviews in Food Science and Food Safety, 2010, 9(5):455-470.
[29] 李子叶, 李柏良, 关嘉琪, 等. 嗜酸乳杆菌KLDS 1.0901对酸奶发酵特性及抗氧化活性的影响[J]. 食品研究与开发, 2019, 40(22):49-56.
LI Z Y, LI B L, GUAN J Q, et al. Effect of Lactobacillus acidophilus KLDS 1.0901 on characteristics and antioxidant activity of fermented yoghurt[J]. Food Research and Development, 2019, 40(22):49-56.
[30] DICKS L, BOTES M. Probiotic lactic acid bacteria in the gastro-intestinal tract: Health benefits, safety and mode of action[J]. Beneficial Microbes, 2010, 1(1):11-29.
[31] 任然, 唐善虎, 李思宁, 等. 四株益生菌对发酵酸奶保质期理化特性和益生菌数的影响[J]. 食品与发酵工业, 2020, 46(18):85-90.
REN R, TANG S H, LI S N, et al. Effect of four probiotics on the physicochemical properties and probiotics viability of fermented yogurt[J]. Food and Fermentation Industries, 2020, 46(18):85-90.
[32] 赵岩. 中国人群肠道中发酵乳杆菌的基因差异及其对肠道的生理调节作用[D]. 无锡: 江南大学, 2021.
ZHAO Y. Gene difference of Lactobacillus fermentum in intestinal tract of China population and its physiological regulation on intestinal tract[D].Wuxi: Jiangnan University, 2021.
[33] LIM S M, JANG H M, JANG S E, et al. Lactobacillus fermentum IM12 attenuates inflammation in mice by inhibiting NF-κB-STAT3 signalling pathway[J]. Beneficial Microbes, 2017, 8(3):407-419.
[34] ALE E C, PEREZLINDO M J, BURNS P, et al. Exopolysaccharide from Lactobacillus fermentum Lf2 and its functional characterization as a yogurt additive[J]. Journal of Dairy Research, 2016, 83(4):487-492.
[35] COX A, MAKINO H, CRIPPS A, et al. Recovery of Lactobacillus casei strain Shirota (LcS) from faeces with 14 days of fermented milk supplementation in healthy Australian adults[J]. Asia Pacific Journal of Clinical Nutrition, 2019, 28(4): 734-739.