羊肚菌(Morchella)属子囊菌门羊肚菌科羊肚菌属,其表面由不规则网格交叉形成蜂巢状,整体酷似羊肚而得名[1]。羊肚菌在我国分布广泛,近年来,由于人工栽培的成功,关于羊肚菌的研究越来越多。研究表明,羊肚菌富含矿物质、维生素和一些必需的生物大分子,如多糖、蛋白质等,具有显著的药用和生物学特性[2]。羊肚菌多糖(Morchella polysaccharide, MEP)是子实体中含量最丰富的成分之一,也是主要活性物质,PAN等[3]发现羊肚菌多糖羊肚菌多糖(Morchella importuna polysaccharide, MIP)可以通过调节糖尿病小鼠肠道微生物丰度来改善糖尿病引起的肠道疾病,并且MIP干预后小鼠肝脏代谢物紊乱也得到改善;ZHANG等[4]发现羊肚菌多糖羊肚菌子实体多糖可作为免疫调节剂通过刺激巨噬细胞的免疫反应,减轻氯霉素诱导的斑马鱼免疫损伤;此外羊肚菌多糖还具有抗肿瘤、抗衰老等生物活性[5],因此羊肚菌多糖作为天然生物活性物质在生物医药、食品和保健品等领域具有较好的开发潜力和应用前景。
多糖的活性受其化学组成和空间构象影响,多糖结构和成分又因提取方法而异[6],因此高效提取羊肚菌多糖并维持生物活性,是充分利用羊肚菌多糖的重要前提。热水提取是羊肚菌多糖提取最常用的方法,但是该方法提取时间长、提取得率较低,通常辅以酸、碱或超声等物理化学方法。据赵炳杰等[7]报道,羊肚菌中含有较多蛋白结合多糖,通常采用碱法破坏细胞结构后与糖蛋白作用,使胞内不溶性多糖转变为可溶性多糖提高得率;但是碱浓度需严格控制,浓度过低达不到提取效果,过高会导致多糖分子降解、活性降低[8]并且产生废水污染环境。
电解饱和电解质生产的电解水,可以分为酸性电解水和碱性电解水,其中碱性电解水(alkaline electrolyzed water, AEW)是具有碱性特质、强渗透性的小分子水,可以破坏细胞膜并渗入,用于活性成分的提取,并且具有一定的负氧化还原电位(oxidation-reduction potential, ORP),作为溶剂在提取过程中可以保护活性基团[9]。提取后碱性电解水无需特殊处理,其活性成分可自然状态下与光、活性氧等接触逐渐分解,还原为普通水,对环境友好[10]。SOQUETTA等[11]用碱性电解水从柑桔皮中提取生物活性化合物,与纯水相比多酚得率提高15.7%,黄酮得率提高21.6%,并可缩短提取时间;苗雨欣等[12]用碱性电解水替代同pH值碱水提取灵芝多糖,得率提高74.72%;LI等[13]用碱性电解水提杏蛋白,提取率提高了10.4%,且碱性电解水所提蛋白比碱水得蛋白表现出较好的起泡能力和乳液稳定性。
现有的研究多集中在如何利用电解水提高提取成分的提取率,对其影响提取成分的理化性质的研究很少,关于碱性电解水提取羊肚菌多糖的研究尚未见报道。本实验以羊肚菌粉为原料,以碱性电解水为溶剂,提取羊肚菌子实体多糖,并以碱水和纯水提取的多糖为对照,比较其结构和抗氧化活性方面差异,以期为羊肚菌多糖高效绿色提取和应用提供理论支持。
1 材料与方法
1.1 材料与试剂
羊肚菌,重庆市城口县松坤菌草有限责任公司;葡萄糖、D-半乳糖醛酸等均为标准品,北京Solarbio试剂公司;木瓜蛋白酶、DPPH、ABTS、1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolinone, PMP),天津市北辰区索罗门生物试剂销售中心;其他试剂为分析纯,重庆兴光化玻公司。
1.2 仪器与设备
CJ120超微粉碎机,河南瀚华科技有限公司;Agilent 1260高效液相色谱仪,美国安捷伦公司;X射线衍射仪,辽宁通达科技有限公司;ALPH2-1/LD冷冻干燥机,珀金埃尔默公司;XK-A7电解水生成器,广东新康公司;UV-759紫外分光光度计,成都析谱仪器有限公司;Spectrum100红外光谱仪,珀金埃尔默公司;pH计,上海仪电科学仪器有限公司。
1.3 实验方法
1.3.1 碱性电解水的制备
碱性电解水由多功能电解水制备器制备。电解槽阳极加入饱和KCl溶液,阴极接入纯水,施加20 V电压,电解一定时间测定得到pH值12的碱性电解水。
1.3.2 羊肚菌粗多糖的提取方法
将羊肚菌子实体烘干至恒重,经超微粉碎机粉碎过250目筛,得到均匀的粉末样品。
1.3.2.1 纯水提取法
根据前期预实验结果,将样品(5.0 g)用纯水在指定的料液比(1∶30,g∶mL)、提取温度(80 ℃)、提取时间(1 h)提取。提取液5 500 r/min离心12 min,上清液4倍体积无水乙醇4 ℃沉淀8 h,收集沉淀,冷冻干燥得到粗多糖。置于干燥、避光处保存。将纯水提多糖命名为WE-MEP。
1.3.2.2 碱水提取法
将1.3.2.1节中纯水替换为pH值12的KOH溶液,其余步骤相同。将碱水提多糖命名为AW-MEP。
1.3.2.3 碱性电解水提取法
将1.3.2.1节中纯水替换为pH值12的碱性电解水,其余步骤相同。将碱性电解水提多糖命名为AEW-MEP。
1.3.3 多糖分离及初步纯化
分离及纯化参考ZHU等[14]的方法略作修改,采用酶法除蛋白,分别将多糖溶解配制成溶液,加入质量分数为3%木瓜蛋白酶(200 U/mg),55 ℃酶解35 min,灭酶、冷却,加入体积分数为8%的H2O2溶液脱色,4 500 r/min离心13 min,除去沉淀。上清液用4倍体积无水乙醇4 ℃沉淀8 h,收集沉淀冷冻干燥,得到3种方法提取的初步纯化羊肚菌多糖。
1.3.4 纯度鉴定和分子质量测定
凝胶渗透色谱法测定多糖分子质量分布和纯度,配制样品液(2 mg/mL)过0.45 μm微孔滤膜进入系统。
使用Sepax SRT SEC-100(7.8 mm×300 mm)凝胶柱;流速1 mL/min,柱温40 ℃;通过一系列不同分子质量(708、344、107、47、5 908 Da)标准聚钠盐(苯乙烯磺酸钠)校准,根据保留时间计算待测多糖的分子质量。
1.3.5 纯化多糖理化性质分析
1.3.5.1 纯化多糖中总糖含量及提取率测定
采用苯酚-硫酸法测定糖含量,取10 mg纯化多糖溶于10 mL纯水配成溶液,取出1 mL加入1 mL体积分数为5%的苯酚、5 mL浓硫酸反应25 min,测定490 nm处吸光值。以葡萄糖标准溶液(0.1 mg/mL)绘制标准曲线计算样品多糖质量,提取率的计算如公式(1)所示:
多糖提取率![]()
(1)
式中:m,测得多糖质量,g;c,稀释倍数;M,样品质量,g。
将上述溶液稀释一定体积后,按同样方法测定总糖含量,总糖含量的计算如公式(2)所示:
总糖含量![]()
(2)
式中:n,测得多糖质量,g;0.9,多糖校正系数;N,所取羊肚菌多糖质量,g。
1.3.5.2 蛋白含量测定
考马斯亮蓝法测定蛋白含量,参考ZHANG等[15]的方法略作修改,从1 mg/mL纯化多糖溶液取1 mL上清液与5 mL考马斯亮蓝混合,反应7 min测定595 nm处吸光值。以牛血清蛋白标准溶液(0.1 mg/mL)绘制标准曲线计算蛋白含量。
1.3.5.3 糖醛酸含量测定
参考HUO等[16]的方法略作修改,从1 mg/mL纯化多糖溶液取0.25 mL,加1.5 mL四硼酸钠-浓硫酸溶液,沸水浴6 min,降至室温加入3-苯基酚溶液25 μL,室温反应15 min,测定520 nm处吸光值。以半乳糖醛酸溶液(0.1 mg/mL)绘制标准曲线计算糖醛酸含量。
1.3.6 单糖组成测定
单糖组成参考LI等[17]的方法略作修改,取10 mg纯化多糖三氟乙酸水解2 h,取1 mL水解液加入1 mL甲醇摇匀,70 ℃水浴同时N2吹干;分别取0.5 mL样品水解液与单糖标准溶液混合,加入0.5 mL的PMP-甲醇溶液混匀,70 ℃反应2 h,调节pH值至7.0±0.05,过0.22 μm水系膜进液相系统分析。
使用Agilent EC-C18色谱柱(4.6 mm×250 mm,5 μm),进样量8 μL,流速0.8 mL/min,流动相A为25 mmol/L乙酸铵缓冲液,流动相B为乙腈,二者比例为80∶20。
1.3.7 傅里叶红外光谱(Fourier transform infrared spectroscopy,FT-IR)检测
将干燥预处理的羊肚菌多糖样品3 mg置于压片模具中,在400~4 000 cm-1波数范围内以空气为背景进行扫描。
1.3.8 X-射线衍射检测
将干燥的羊肚菌多糖样品均匀置于X射线衍射仪样品池,测试条件为:X射线的波长λ=0.154 nm;管压40 kV;扫描范围(2θ)10~65 °,扫描速度5 °/min。
1.3.9 体外抗氧化活性测定
参考LI等[18]的方法略作修改,以抗坏血酸为标品,测定不同溶剂所得羊肚菌多糖对DPPH自由基清除能力、ABTS阳离子自由基清除能力及Fe3+还原力。
1.3.9.1 DPPH清除率测定
准确称取DPPH用无水乙醇配制成浓度为0.2 mmol/L的溶液。配制不同质量浓度(2.5、2、1.5、1、0.5 mg/mL)的多糖样品溶液与等体积DPPH混合,纯水、乙醇做空白对照,摇匀后避光反应25 min,测吸光值,清除率的计算如公式(3)所示:
清除率![]()
(3)
式中:A0,纯水组吸光度;A1,乙醇组吸光度;A2,样品吸光度。
1.3.9.2 Fe3+还原力测定
分别取0.50 mL不同质量浓度(2.5、2、1.5、1、0.5 mg/mL)的样品,与等体积磷酸缓冲液(pH=6.6)、10 g/L铁氰化钾混合,50 ℃水浴25 min,冷却至室温,再加入1.00 mL 100 g/L三氯乙酸,混匀取1 mL上清液加入0.25 mL 1 g/L氯化铁溶液,避光反应30 min,于700 nm测吸光度值。通过比较样品和维生素C的吸光度,判断多糖的还原能力。
1.3.9.3 ABTS阳离子自由基清除能力测定
配制ABTS溶液(7 mmol/L)和过硫酸钾溶液(2.45 mmol/L)等体积混合,4 ℃过夜放置,用pH值为7.4的磷酸盐缓冲液调整其734 nm处吸光度为0.70±0.02。分别取1 mL不同质量浓度(2.5、2、1.5、1、0.5 mg/mL)的多糖样品加入3 mL ABTS工作液,混合均匀,避光放置5 min,在波长734 nm处测定吸光度,清除率的计算如公式(4)所示:
清除率![]()
(4)
式中:A0为纯水组吸光度;A1为磷酸盐缓冲液组吸光度;A2为样品吸光度。
1.4 数据处理
所有结果均表示为平均值±标准差,使用SPSS 25通过Tukey检验分析结果,差异显著性为P<0.05。采用OriginPro 2018软件绘制图表。
2 结果与分析
2.1 不同溶剂提取对羊肚菌多糖提取率的影响
分别采用纯水提取、碱水提取、碱性电解水提取从羊肚菌中分离多糖,提取率如表1所示。碱性电解水提取法提取率为(7.12±0.33)%,显著高于碱水法和纯水法提取率[(6.65±0.27)%,(5.46±0.15)%,P<0.05]。这是因为碱性条件可以加速细胞壁破裂,释放胞内多糖,羊肚菌含有较多糖蛋白,碱性条件使糖蛋白更好地转化为可溶性多糖[7],因此AW-MEP与AEW-MEP有更高的提取率。但是与传统碱水不同,碱性电解水是通过外加电场,破坏水分子氢键,形成由较少水分子组成的小水分子团簇,不会引入杂质,且含有较多OH-[19],作为溶剂不仅可以提供碱性环境而且较碱水制备简单、绿色安全。
表1 多糖提取率及主要化学组成
Table 1 Main compositions and yields of polysaccharide fractions
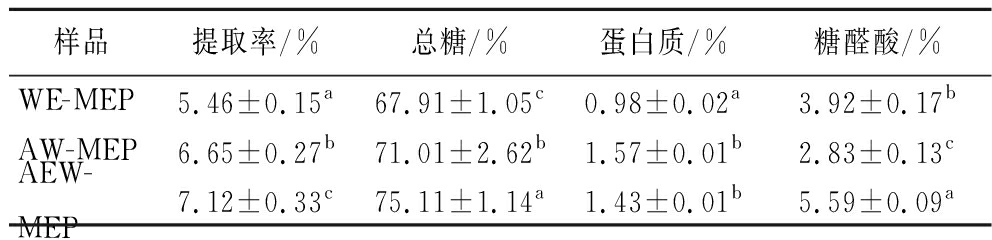
样品 提取率/%总糖/%蛋白质/%糖醛酸/%WE-MEP5.46±0.15a67.91±1.05c0.98±0.02a3.92±0.17bAW-MEP6.65±0.27b71.01±2.62b1.57±0.01b2.83±0.13cAEW-MEP7.12±0.33c75.11±1.14a1.43±0.01b5.59±0.09a
注:不同字母表示存在显著性差异(P<0.05)。
2.2 不同溶剂提取对羊肚菌多糖化学成分组成的影响
3种方法所得羊肚菌多糖中主要化学成分如表1所示,AEW-MEP中糖醛酸含量[(5.59±0.09)%]显著高于WE-MEP和AW-MEP的糖醛酸含量[(3.92±0.17)%,(2.83±0.13)%,P<0.05];WE-MEP蛋白含量为(0.98±0.02)%,显著低于其余2种方法,说明碱性条件下更多蛋白类物质被溶出;AEW-MEP总糖含量(75.11±1.14)%,显著高于WE-MEP[(67.91±1.05)%]、AW-MEP[(71.01±2.62)%]。碱水在提取过程中会破坏链结构,断裂形成的小分子糖需高浓度醇沉析出,因此AW-MEP总糖含量、提取率低于AEW-MEP。
LI等[20]采用亚临界水、纯水2种方法提取羊肚菌多糖,亚临界水溶解能力更强,获得更高的糖醛酸、蛋白质和脂肪含量,说明不同溶剂提取对多糖化学成分组成有显著影响;本研究中碱性电解水是强渗透性的小分子水,多糖类物质分子中含有大量极性基团,对水分子具有较大亲和力,多糖与小分子水缔结,增加溶解度[10],并且碱性条件下酸性多糖更易溶出,碱性电解水所提多糖表现出更高的提取率和糖醛酸含量,其中多糖中的糖醛酸含量会影响抗氧化活性、降血糖活性、免疫活性等[21],因此AEW-MEP可能具有更好的生物活性。
2.3 不同溶剂提取对多糖基本性质的影响
2.3.1 分子质量分布
采用凝胶色谱法对羊肚菌多糖的分子质量进行测定,分子质量分布如表2所示。WE-MEP与AEW-MEP所得多糖均具有2种不同分子质量分布范围,羊肚菌多糖WE-MEP平均分子质量分布为9.0×105、3.9×105 Da,所占比例为22.84%、77.16%;羊肚菌多糖AEW-MEP平均分子质量分布为8.9×105、3.8×105 Da,分别占23.93%、76.07%。而羊肚菌多糖AW-MEP具有3种分子质量分布范围,分别为8.1×105、3.6×105、1.7×104 Da,分别占比13.12%、72.9%、13.97%;羊肚菌多糖AW-MEP峰1和峰2平均分子质量分别显著低于WE-MEP与AEW-MEP峰1和峰2平均分子质量,并且分散性较差,可能是在强碱性、加热条件下导致糖苷键断裂,产生小分子多糖,使得AW-MEP峰1、峰2面积占比明显减小,产生的峰3是不规则断裂后的小分子片段,分散度较差。
表2 多糖相对分子质量及其分布
Table 2 Results of monosaccharide composition
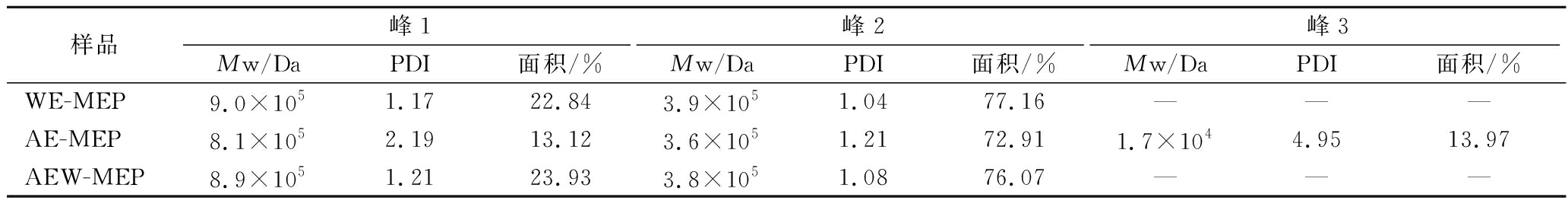
样品峰1峰2峰3Mw/DaPDI面积/%Mw/DaPDI面积/%Mw/DaPDI面积/%WE-MEP9.0×1051.1722.843.9×1051.0477.16———AE-MEP8.1×1052.1913.123.6×1051.2172.911.7×1044.9513.97AEW-MEP8.9×1051.2123.933.8×1051.0876.07———
注:PDI(polymer dispersity index)是聚合物分散性指数,-表示无检测结果数据。
与其他研究相比,YIN等[22]比较不同方法提取海带多糖的影响,采用酸法辅助提取海带多糖过程中糖苷键断裂,多糖分子质量分布范围更广且较纯水提取法低,而相同条件下酶法辅助提取不影响分子质量分布;在本实验中碱水提取过程中可能会导致氧原子连接侧链、β-(1→4)和β-(1→6)连接的部分残基发生断裂[7],使多糖分子质量分布更广;碱性电解水中含有带电离子和自由基团,具有一定负氧化还原电位(-900~-1 000 mV),可以保护多糖结构不被破坏[9],碱性电解水所提多糖,多分散系数更接近1,说明多糖分子聚合度高且分布集中,多糖结构保持较好,碱性电解水提取不会对多糖的分子质量分布造成显著影响。
2.3.2 单糖组成分析
采用高效液相色谱法对羊肚菌单糖组成进行测定,与混合单糖标准品对照,结果如图1所示,羊肚菌多糖WE-MEP、AW-MEP、AEW-MEP均由3种单糖组成,分别为甘露糖、葡萄糖、半乳糖,摩尔质量百分比分别为4.18%、54.77%、41.05%;3.87%、46.19%、49.94%;3.32%、56.03%、40.65%。单糖组成结果表明,羊肚菌多糖主要由葡萄糖和半乳糖组成,含有少量甘露糖;3种提取方法所得多糖在单糖组成种类上没有显著区别,在比例上AW-MEP与其他2种多糖具有显著差异,有更高的半乳糖比例,较低的葡萄糖比例;造成差异的原因可能是多糖分子在提取过程中受高温、碱性条件影响部分降解,导致单糖组成比例不同[6]。

Man-甘露糖;Rib-核糖;Rha-鼠李糖;Xyl-木糖; Glc-葡萄糖;Gal-半乳糖 a-单糖混标;b-3种多糖样品
图1 单糖组成结果
Fig.1 Results of monosaccharide composition
ZHANG等[23]采用深共熔溶剂提取香菇多糖,与纯水提取所得多糖的单糖组成种类相同,在比例上具有显著差异,说明不同的方法可能改变所提取多糖的基本结构,并可能影响多糖的活性。结合本实验分子量分析结果,与纯水提取法相比,碱水提取会改变多糖分子链结构进而影响单糖组成比例,碱性电解水提取法对多糖的基本结构无显著影响,因此不影响其单糖组成种类及比例。
2.3.3 红外光谱分析
常用FT-IR光谱鉴定多糖的特征有机基团,扫描结果如图2所示,3种多糖出峰位置无显著差异,3 399 cm-1处由多糖的O—H伸缩振动引起波数变化;1 620 cm-1处峰是由C![]() O弯曲振动产生,结合1 405 cm-1的峰可以认定有半乳聚糖的存在[4];出现于1 200~1 000 cm-1的吸收峰如1 076、1 147 cm-1处的小峰通常是多糖中的吡喃糖和呋喃糖结构[24],是构成多糖中糖醛酸的基本单元,符合糖醛酸测定结果;845、922 cm-1处的吸收峰,表明多糖既含有α构型糖苷键也含有β构型糖苷键[25],YAN等[26]研究发现适当碱性条件下提取猴头菇多糖,可以得到更高含量的β-D-葡聚糖或β-(1→3)/(1→6)糖苷键的杂聚糖,并且所得多糖均表现出优异抗氧化活性,可以有效降低活性氧。与纯水提取法相比,碱水提取法与碱性电解水提取法都不会对多糖特征基团造成显著影响,但碱性电解水作为溶剂提取羊肚菌多糖得率更高,可能获得更多具有优异活性的β构型多糖。
O弯曲振动产生,结合1 405 cm-1的峰可以认定有半乳聚糖的存在[4];出现于1 200~1 000 cm-1的吸收峰如1 076、1 147 cm-1处的小峰通常是多糖中的吡喃糖和呋喃糖结构[24],是构成多糖中糖醛酸的基本单元,符合糖醛酸测定结果;845、922 cm-1处的吸收峰,表明多糖既含有α构型糖苷键也含有β构型糖苷键[25],YAN等[26]研究发现适当碱性条件下提取猴头菇多糖,可以得到更高含量的β-D-葡聚糖或β-(1→3)/(1→6)糖苷键的杂聚糖,并且所得多糖均表现出优异抗氧化活性,可以有效降低活性氧。与纯水提取法相比,碱水提取法与碱性电解水提取法都不会对多糖特征基团造成显著影响,但碱性电解水作为溶剂提取羊肚菌多糖得率更高,可能获得更多具有优异活性的β构型多糖。
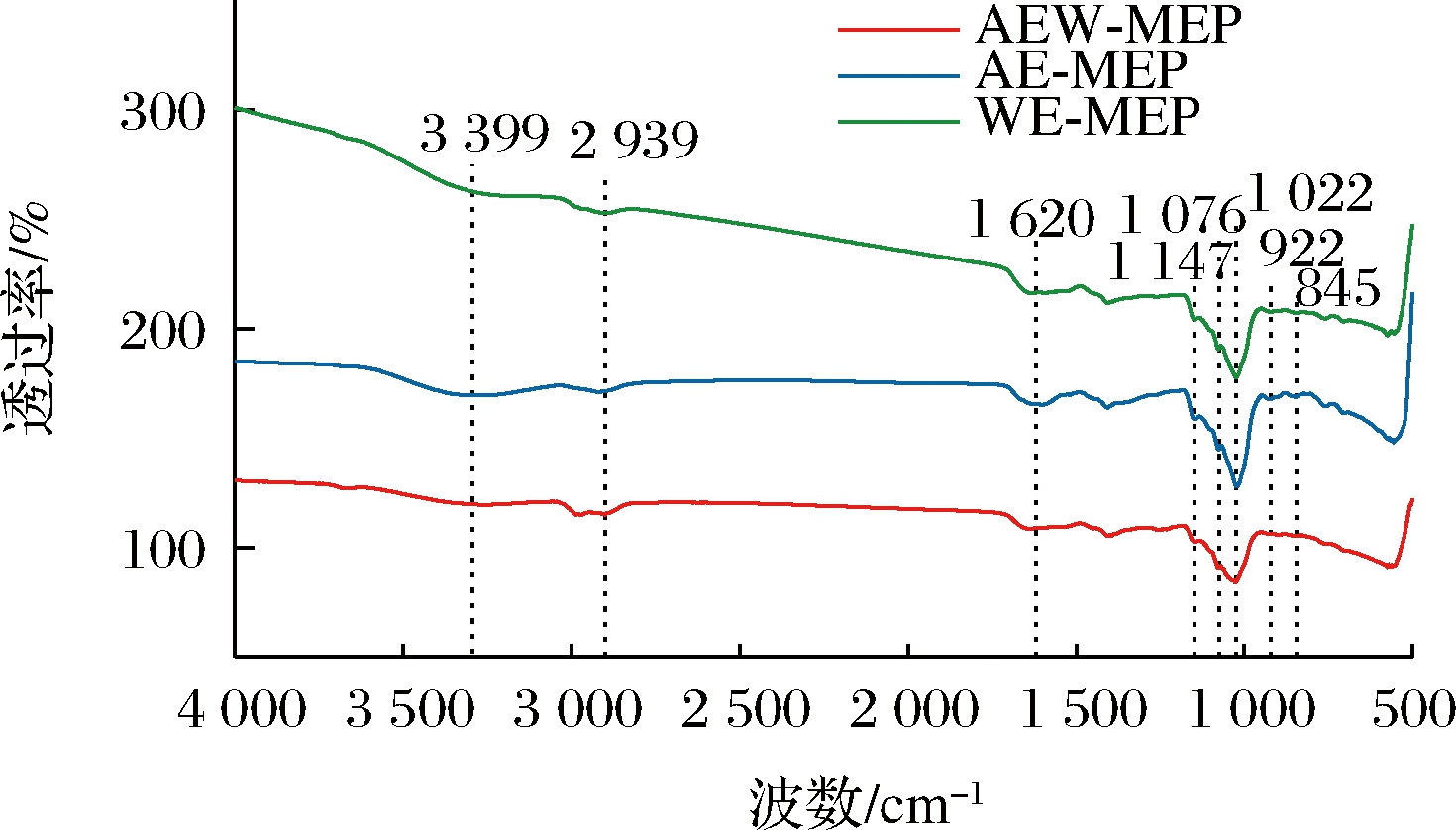
图2 羊肚菌多糖的红外吸收光谱
Fig.2 The FT-IR spectra of MEPs
2.3.4 X-射线衍射分析
3种多糖在10~30 °均出现峰宽较宽、强度较大的衍射峰,表明MEP内部结晶度较低不能形成单晶体,而是以非晶体形式存在,符合真菌多糖结晶特性[27]。LI等[28]采用纯水提取、酶辅助提取、超声提取、微波提取4种方法提取元菇多糖,4种多糖X射线衍射曲线均呈面包状,没有尖峰,说明提取方法不会影响多糖的结晶性。碱性电解水所提多糖在2θ为5~60 °内,与纯水提取法所得多糖相比,X射线衍射曲线无显著区别,未出现尖锐的小峰,这说明碱性电解水提取不会改变羊肚菌多糖结晶性。具体见图3。

图3 多糖的X衍射图
Fig.3 X-ray diffraction histogram of MEPs
2.4 抗氧化活性测定结果
2.4.1 DPPH自由基、ABTS阳离子自由基清除能力分析
DPPH自由基清除率如图4-a所示,3种方法所得多糖均具有一定的自由基清除能力并且在一定浓度范围内清除率随质量浓度的增大而增加,在质量浓度高于1.0 mg/mL后,各质量浓度AEW-MEP的DPPH清除率显著高于WE-MEP(P<0.05),相同质量浓度下,AW-MEP清除率始终显著低于另外两者(P<0.05);在质量浓度2.5 mg/mL时,AEW-MEP自由基清除率达到83.12%。经计算AEW-MEP、WE-MEP与AE-MEP的IC50分别为0.125 8、0.129 1、0.137 9 mg/mL,总体上AEW-MEP的DPPH自由基清除能力强于WE-MEP和AE-MEP。

a-DPPH自由基清除率;b-ABTS阳离子自由基清除率;c-Fe3+还原力
图4 三种方法提取所得羊肚菌多糖DPPH自由基清除率、ABTS阳离子自由基清除率、Fe3+还原力比较
Fig.4 The in vitro antioxidant activities of MEPs extracted with three solvents
ABTS阳离子自由基清除率如图4-b所示,3种方法所得多糖对ABTS阳离子自由基的清除率随质量浓度的增加而上升,质量浓度低于1 mg/mL时WE-MEP和AEW-MEP各浓度还原能力相近;质量浓度高于1 mg/mL后AEW-MEP清除率明显升高;在2.5 mg/mL时AEW-MEP的自由基清除率达到77.95%,高于WE-MEP清除率72.12%,较AE-MEP高15.62%。经计算AEW-MEP的IC50值为1.637 mg/mL显著低于WE-MEP与AE-MEP的IC50值,分别为1.919 4、2.343 8 mg/mL(P<0.05),因此ABTS阳离子自由基清除能力:AEW-MEP>WE-MEP>AE-MEP。
自由基由在人体内积累会引发如动脉粥样硬化、心脏病、抑郁症等慢性疾病[29]。多糖作为能清除自由基且安全、健康的天然抗氧化剂,受到人们广泛关注。FU等[30]的研究表明,多糖对自由基清除能力与多糖支链上的基团、糖醛酸含量和葡萄糖含量有关,结合单糖组成和化学成分结果,AEW-MEP与WE-MEP较AW-MEP有更高的糖醛酸和葡萄糖含量,并且碱性电解水具有氧化还原电位,提取过程可以对多糖支链上的羰基、醛基起保护作用,而碱水提取过程中可能破坏多糖结构,影响生物活性,因此可能是AEW-MEP具有更高的清除率,AW-MEP清除率最低的原因。
2.4.2 Fe3+还原力分析
Fe3+还原力测定结果如图4-c所示,3种方法所得羊肚菌多糖均具有一定的Fe3+还原能力且多糖还原能力随质量浓度的增加而上升,在质量浓度超过1.5 mg/mL后还原能力随质量浓度增加的递增趋势逐渐变缓,在2.5 mg/mL时还原力达到最高,此时AEW-MEP还原力较AE-MEP高0.179 mmol/L。总体上相同质量浓度下的Fe3+还原能力:AEW-MEP>WE-MEP>AE-MEP。
由于糖醛酸中羧基与离子形成交联[21],从而多糖表现出对金属离子的还原能力;结合糖醛酸测定结果AE-MEP中糖醛酸含量较低,这可能是导致其活性较低的原因。
3 结论
本研究发现,纯水提取法对多糖结构和功能影响较小,但得率较低;碱水提取法可提高多糖得率,但会改变分子质量分布和单糖组成比例,进而影响多糖抗氧化活性;碱性电解水法提取羊肚菌多糖得率较纯水法提高42.4%,并且提取过程不影响其分子质量分布,不改变基团结构,不影响结晶性,并且所得多糖具有更好的抗氧化能力。此外碱性电解水制备简单、提取过程对环境友好,可作为一种绿色高效的新提取技术用于羊肚菌多糖提取。
[1] 兰秀华. 羊肚菌营养品质形成因素分析、功能成分鉴定及液体发酵应用[D].成都:电子科技大学, 2022.
LAN X H.Analysis of nutritional quality formation factors, identification of functional components and application of liquid fermentation in Morchella spp.[D].Chengdu:University of Electronic Science and Technology of China, 2022.
[2] WU H S, CHEN J, LI J L, et al.Recent advances on bioactive ingredients of Morchella esculenta[J].Applied Biochemistry and Biotechnology, 2021, 193(12):4197-4213.
[3] PAN X, MENG J L, XU L J, et al.In-depth investigation of the hypoglycemic mechanism of Morchella importuna polysaccharide via metabonomics combined with 16S rRNA sequencing[J].International Journal of Biological Macromolecules, 2022, 220:659-670.
[4] ZHANG N N, MA H, ZHANG Z F, et al.Characterization and immunomodulatory effect of an alkali-extracted galactomannan from Morchella esculenta[J].Carbohydrate Polymers, 2022, 278:118960.
[5] TIETEL Z, MASAPHY S.True morels (Morchella)-nutritional and phytochemical composition, health benefits and flavor:A review[J].Critical Reviews in Food Science and Nutrition, 2018, 58(11):1888-1901.
[6] GUO H, YUAN Q, FU Y, et al.Extraction optimization and effects of extraction methods on the chemical structures and antioxidant activities of polysaccharides from Snow Chrysanthemum (Coreopsis tinctoria)[J].Polymers (Basel), 2019, 11(2):215.
[7] 赵炳杰, 郭岩彬.食用菌多糖的提取纯化及生物活性研究进展[J].中国生物工程杂志, 2022, 42(S1):146-159.
ZHAO B J, GUO Y B.Advances in extraction, purification and bioactivity of polysaccharides from edible fungi[J].China Biotechnology,2022,42(S1):146-159.
[8] GONG P, WANG S Y, LIU M, et al.Extraction methods, chemical characterizations and biological activities of mushroom polysaccharides:A mini-review[J].Carbohydrate Research, 2020, 494:108037.
[9] ZHAO L, LI S B, YANG H S.Recent advances on research of electrolyzed water and its applications[J].Current Opinion in Food Science, 2021, 41:180-188.
[10] BRASIL C C B, DE MENEZES C R, JACOB-LOPES E, et al.Combined application of electrolysed water and ultrasound to improve the sanitation of knives in the meat industry[J].International Journal of Food Science &Technology, 2020, 55(3):1136-1144.
[11] SOQUETTA M B, TONATO D, QUADROS M M, et al.Ultrasound extraction of bioactive compounds from Citrus reticulata peel using electrolyzed water[J].Journal of Food Processing and Preservation, 2019, 43(12).
[12] 苗雨欣, 刘旭, 宁慧娟, 等.碱性电解水提取灵芝子实体多糖的工艺优化[J].中国食用菌, 2020, 39(11):62-67;74.
MIAO Y X, LIU X, NING H J, et al.Optimization of alkaline electrolyzed water extraction process of Ganoderma lucidum polysaccharides by response surface methodology[J].Edible Fungi of China, 2020, 39(11):62-67;74.
[13] LI Z H, ZHOU B, LI X T, et al.Effect of alkaline electrolyzed water on physicochemical and structural properties of apricot protein isolate[J].Food Science Biotechnology, 2019, 28(1):15-23.
[14] ZHU Z P, CHEN J, CHEN Y, et al.Extraction, structural characterization and antioxidant activity of turmeric polysaccharides[J].LWT, 2022, 154: 112805.
[15] ZHANG Z Y, HE S D, LIU H Y, et al.Effect of pH regulation on the components and functional properties of proteins isolated from cold-pressed rapeseed meal through alkaline extraction and acid precipitation[J].Food Chemistry, 2020, 327:126998.
[16] HUO S H, WANG H Y, CHEN J, et al.A preliminary study on polysaccharide extraction, purification, and antioxidant properties of sugar-rich filamentous microalgae Tribonema minus[J].Journal of Applied Phycology, 2022,34(6): 2755-2767.
[17] LI J L, WU H S, LIU Y T, et al.The chemical structure and immunomodulatory activity of an exopolysaccharide produced by Morchella esculenta under submerged fermentation[J].Food &Function, 2021, 12(19):9327-9338.
[18] LI F, JIN Y, WANG J, et al.Structure identification of two polysaccharides from Morchella sextelata with antioxidant activity[J].Foods, 2022, 11(7): 982.
[19] 黎礼丽, 朱伯和, 黄静文, 等.水分子结构及其应用研究综述[J].农业与技术, 2019, 39(16):50-51.
LI L L, ZHU B H, HUANG J W, et al.Review on structure and applications water molecules[J].Agriculture and Technology, 2019, 39(16):50-51.
[20] LI F, LEI H J, XU H D.Influences of subcritical water extraction on the characterization and biological properties of polysaccharides from Morchella sextelata[J].Journal of Food Processing and Preservation, 2022, 46(9):e16024.
[21] WANG S Q, LI G, ZHANG X F, et al.Structural characterization and antioxidant activity of Polygonatum sibiricum polysaccharides[J].Carbohydrate Polymers, 2022, 291:119524.
[22] YIN D F, SUN X J, LI N, et al.Structural properties and antioxidant activity of polysaccharides extracted from Laminaria japonica using various methods[J].Process Biochemistry, 2021, 111:201-209.
[23] ZHANG Z, SHI M H, ZHENG H Y, et al.Structural characterization and biological activities of a new polysaccharide isolated from Morchella sextelata[J].Glycoconjugate Journal, 2022, 39(3): 369-380.
[24] ZHAO G H, KAN J Q, LI Z X, et al.Structural features and immunological activity of a polysaccharide from Dioscorea opposita Thunb roots[J].Carbohydrate Polymers, 2005, 61(2):125-131.
[25] LIU Y, ZHOU Y F, LIU M D, et al.Extraction optimization, characterization, antioxidant and immunomodulatory activities of a novel polysaccharide from the wild mushroom Paxillus involutus[J].International Journal of Biological Macromolecules, 2018, 112:326-332.
[26] YAN J K, DING Z C, GAO X L, et al.Comparative study of physicochemical properties and bioactivity of Hericium erinaceus polysaccharides at different solvent extractions[J].Carbohydrate Polymers, 2018, 193:373-382.
[27] SEIDI F, YAZDI M K, JOUYANDEH M, et al.Crystalline polysaccharides:A review[J].Carbohydrate Polymers, 2022, 275:118624.
[28] LI X Y, WANG L.Effect of extraction method on structure and antioxidant activity of Hohenbuehelia serotina polysaccharides[J].International Journal of Biological Macromolecules, 2016, 83:270-276.
[29] 唐兰芳, 王锋, 苏小军, 等.低共熔溶剂提取对黄精多糖性质及抗氧化活性的影响[J].食品与发酵工业, 2021, 47(11):151-157.
TANG L F, WANG F, SU X J, et al.Effects of deep eutectic solvents on the properties and antioxidant activity of polysaccharides from Polygonatum cyrtonema Hua[J].Food and Fermentation Industries, 2021, 47(11):151-157.
[30] FU Y, FENG K L, WEI S Y, et al.Comparison of structural characteristics and bioactivities of polysaccharides from loquat leaves prepared by different drying techniques[J].International Journal of Biological Macromolecules, 2020, 145:611-619.