紫陀螺菌[Gomphus purpuraceu (Iwade) Yokoyamas]是一种夏秋季生长在阔叶混交林地的菌根食用菌,隶属于担子菌亚门(Basidiomycotina)、非褶菌目(Aphyllophorales)、陀螺菌科(Gomphaceae)、陀螺菌属(Gomphus),零星分布于湖北、甘肃、云南、贵州、四川等省的部分地区[1-3]。由于紫陀螺菌属于外生菌根食用菌,它们需要与松科或壳斗科等木本植物共生,需共生宿主植物长大到一定年限后才能稳定地出菇,一般需用时3~5年,具有较高的经济价值和生态保护价值,目前尚未实现人工栽培[2-4],只能采集野生资源,且产量极易受降雨量等环境因素的影响。紫陀螺菌味道鲜美,营养价值高,肉质厚实,易保鲜,易加工,且富含蛋白质、氨基酸、维生素、糖类以及微量元素等多种营养成分,而脂肪含量较低,也是一种价格较高的珍稀食用菌[1,5-11]。紫陀螺菌中含有倍半萜烯、多糖等活性物质,这类活性物质可能具有护肝脏、抗氧化、降血压、降血脂等药用功能[6,12-14]。此外,倍半萜烯类物质已被证实能抑制癌症中的DNA合成,可能是制备抗氧化剂和抗癌剂的理想来源,在食品和医药领域具有较大的开发价值[6,13-15]。
目前国内外对紫陀螺菌的研究和报道甚少,自笔者团队1999年首次在我国湖北宜昌发现,并报道该菌的存在[3],后续研究工作也多集中于其生境描述[2,5]、营养成分[1,5-11]、菌种的分离纯化[16-18]、培养基的筛选[19-20]和药理活性[5-6,13-14]等方面的探究。本文以紫陀螺菌的菌丝体生物量为主要测定指标,系统性地探究了其液体培养的条件,希望通过液体发酵进一步开发利用紫陀螺菌的菌丝体,为其菌丝体发酵产品的加工、液体接种剂的规范化制种、以及紫陀螺菌的野生种质资源的保育促繁和驯化栽培奠定基础。
1 材料与方法
1.1 供试菌株
紫陀螺菌供试菌株GP01,从宜昌西陵峡针阔叶混交林下的野生子实体GPA中分离所得,由湖北三峡职业技术学院食用菌研究所保存,子实体GPA及其分离纯化后的GP01菌株的形态特征见图1。经华中农业大学应用真菌研究所分子鉴定无误后,该菌株备份于中国典型培养物保藏中心(武汉),保藏编号为CCTCCM 2021376。

A-紫陀螺菌子实体(GPA)的形态特征(生长15~20 d); B-紫陀螺菌株GP01的菌落形态特征(生长60 d)
图1 紫陀螺菌子实体和供试紫陀螺菌菌落的形态特征
Fig.1 Morphological characteristics of fruiting bodies and tested G.purpuraceus strains
1.2 供试培养基
A固体培养基(斜面试管、平板,g/L)[20]:去皮马铃薯200,葡萄糖20,磷酸二氢钾3,硫酸镁1.5,蛋白胨2,琼脂18,pH值自然。
A液体培养基:在固体培养基的基础上,去掉琼脂即可。
1.3 显著性分析
采用IBM SPSS Statistics 26.0和GraphPad Prism v8.3.0两个软件进行数据处理,大多采用One-way ANOVA(and nonparametric or Mixed)进行单因素和多重比较方差分析,显著性水平设置为0.05。本文所有的科研绘图,主要借助GraphPad Prism v8.3.0完成。
1.4 菌株分离,纯化与鉴定
在湖北省宜昌市三峡西陵峡地区针阔叶林下采集紫陀螺菌子实体,从中选择新鲜饱满的紫陀螺菌子实体,进行组织分离,取内部菌肉均匀地接种于A培养基上,大约7~10 d后组织块开始萌发。转接萌发后无污染的尖端菌丝于另一A培养基的平皿中进行纯化,于24 ℃恒温培养箱中暗培养 50 d 后,纯化后的菌落,待分子鉴定无误后,可进行后续的发酵试验。
紫陀螺菌子实体GPA和其分离纯化GP01菌株的基因组DNA提取采用CTAB法[21],ITS-PCR扩增体系和反应程序等参照文献[22-23]的方法,具体引物序列如表1所示。PCR产物经1.2%的琼脂糖凝胶电泳检测后,条带单一的产物直接送测序公司(武汉华煜基因),用ITS1/4双向测序。测序结果经手动去除低质量碱基和拼接并后,先通过NCBI Blast序列比对,初步鉴定供试菌株是否为紫陀螺菌,并下载与供试菌株亲缘关系较近的ITS序列作参考,采用ClustalW和MEGA 7.0构建系统发育树,选择极大释然法(ML),泊松值设定为1 000(bootstrap=1 000),以准确鉴定供试菌株的分类地位。
表1 用于扩增ITS引物
Table 1 Primers used for ITS

引物名称序列(5’-3’)ITS1TCCGTAGGTGAACCTGCGGITS4TCCTCCGCTTATTGATATGC
1.5 液体菌种制备
制备供试的液体培养基A,分装于250 mL三角锥形瓶中,除了装液量试验需要不同体积的液体培养基外,其余的装量均为100 mL/瓶,每种处理3瓶,即重复3次,灭菌冷却后,待用。选取其中3瓶,接入10块经活化的直径4 mm的菌种圆片,于24 ℃、150 r/min的恒温摇床中连续振荡培养25 d,使菌丝球型号和活力相对均一,制成一级种子液,备用。
1.6 液体菌丝生物量的测定
将菌丝体用80目的食品级滤网筛出,再用ddH2O冲洗2~3次,用滤纸将菌丝压干后,放入45 ℃的烘箱内烘干至恒重,再用万分之一天平精确称量其干重,紫陀螺菌菌丝生物量的计算如公式(1)所示:
S=m/V
(1)
式中:S为菌丝生物量,g/L;m为菌丝体干质量,g;V为发酵液体积,L。
1.7 液体静置培养条件试验
1.7.1 培养温度的筛选试验
在装有100 mL液体培养基A的250 mL三角锥形瓶中,各接入1块经活化的直径4 mm的菌种圆片,分别置于16、18、20、22、24、26、28、30、32 ℃恒温避光培养,每个培养温度处理重复3次。60 d后,将菌丝收集起来,用ddH2O洗净后烘干,称其干重,按1.6节方法测定菌丝体生物量,比较每一培养温度下的菌丝生物量,并进行方差分析。
1.7.2 培养基初始pH值的筛选试验
制备供试液体培养基A,用KH2PO4或K2HPO4,将其自然初始pH值分别调整到5.0、5.3、5.6、5.9、6.2、6.5、6.8、7.1,再将其分装于250 mL三角锥形瓶中,装量仍为100 mL/瓶,每种pH值重复3次。灭菌冷却后,各接入1块经活化的直径4 mm的菌种圆片,经24 ℃恒温避光静置培养60 d后收取菌丝,洗干净后烘干,称取其干重,按1.6节方法测定菌丝体生物量,比较每一培养pH值下的菌丝体生物量,并进行方差分析。
1.8 振荡培养条件试验
1.8.1 装液量的筛选试验
制备液体培养基A,分别按体积比(装液量∶容器总容量)10%、20%、30%、40%、50%、60%、70%的装液量分装于250 mL的三角锥形瓶中,每种装液量重复处理3次。灭菌冷却后分别接入6 mL事先准备好的液体菌种,于24 ℃、150 r/min的恒温摇床中连续振荡培养15 d,按1.6节方法测定菌丝体生物量,比较不同装液量下的菌丝体生物量,并进行方差分析。
1.8.2 接种量的筛选试验
制备液体培养基A,按100 mL/瓶的装液量分装于250 mL的三角锥形瓶中。灭菌冷却后分别按体积分数6%、8%、10%、12%、14%、16%的接种量,接入事先准备好的液体菌种,每种接种量重复3次。于24 ℃、150 r/min的恒温摇床中连续振荡培养15 d,按1.6节方法测定菌丝体生物量,比较不同接种量下的菌丝体生物量,并进行方差分析。
1.8.3 摇床转速的筛选试验
制备液体培养基A,按100 mL/瓶的装液量分装于250 mL的三角锥形瓶中。灭菌冷却后分别接入6 mL事先准备好的液体菌种。分别置于转速为90、120、150、180、210 r/min的恒温(24 ℃)摇床中连续振荡培养15 d,每种转速处理重复3次。按1.6节方法测定菌丝体生物量,比较不同转速下的菌丝体生物量,并进行方差分析。
1.8.4 培养时间对紫陀螺菌菌丝生长的影响
制备足量的液体培养基A,按100 mL/瓶的装液量分装于250 mL的三角锥形瓶中。灭菌冷却后分成a、b、c 3组,每组处理重复60瓶。a组接种量为6%(体积分数),培养温度为24 ℃,摇床转速为150 r/min。b组接种量为10%(体积分数),培养温度为24 ℃,摇床转速为180 r/min。c组接种量为10%(体积分数),培养温度为24 ℃,摇床转速为150 r/min。在摇床中连续振荡培养20 d,培养期间每间隔1 d(24 h)从a、b、c 3组各取出3瓶测定菌丝体的生物量,菌丝体生物量的测定方法同1.6节所述,比较不同培养时间下a、b、c 3组的菌丝体生物量。
2 结果与分析
2.1 紫陀螺菌株GP01的分离和纯化
湖北宜昌西陵峡紫陀螺菌子实体GPA特征的描述:子实体高10~20 cm,夏秋季于混交林地上单生或成群丛生,幼嫩时呈柱状或陀螺状,成熟后呈喇叭状,菌盖呈扇形,边缘呈波浪状,外表皮紫色,内部菌肉皮实,近白色。菌盖与菌柄无明显界线,菌褶呈分叉的条棱状,相互连接或相互交织(图1-A)。紫陀螺菌组织分离的菌丝体呈白色,短粗绒毛状,由于其外生菌根真菌特性,紫陀螺菌株GP01菌落生长速度较慢,约0.4~0.6 mm/d(图1-B)。
2.2 供试紫陀螺菌材料的分子鉴定和系统发育分析
通过通用引物ITS1和ITS4,PCR扩增供试紫陀螺菌子实体和菌丝体的ITS基因片段(图2),可以看出GP01菌株和GPA子实体的ITS-PCR的目的条带大小约700 bp。经过测序,在NCBI的Blast比对框中输入2个样本的序列,匹配结果皆为紫陀螺菌属中紫陀螺菌(G.purpuraceus)及其近缘种(Gomphus spp.),这可能是由于研究紫陀螺菌,并上传其ITS序列的分类学者较少,且早期由于测序技术的不足,部分上传的ITS序列仅400 bp,致使NCBI早期收录的部分序列可能存在着一定的偏差。因此,为了更准确地鉴定供试菌株,选取NCBI数据库中公开上传列长序度近700 bp的紫陀螺菌ITS序列作为参考,联合本文测序的2个供试样品的ITS序列,采取极大似然法构建系统发育树。紫陀螺菌参考菌株可以很好地聚类在不同的分支下(图3),其中,以子囊菌梯棱羊肚菌Morchella importuna作为外群;G.crassipes、G.ludovicianus、G.clavatus isolate和G.purpuraceus分别聚类在各自的分支上;其中供试材料(GPA,GP01)和7个紫陀螺菌(ON000129.1 Gomphus purpuraceus isolate AL PM1、ON000128.1 G.purpuraceus isolate LL PM1、ON000126.1 G.purpuraceus isolate GZAAS22-0001、ON000127.1 G.purpuraceus isolate GZAAS22-0002、ON000130.1 G.purpuraceus isolate GZAAS22-0004、OL673001.1 Gomphus sp.JL-2021a voucher HKAS122605)参考序列能聚类在一个分支内,置信度高达99%,且分支内的遗传距离为0。根据参考文献[24]的研究结论,当序列的置信度在99%以上时,可认为是相同的种,因此本研究供试的2个紫陀螺菌的来源是一致的(图3)。

M-BM 2 000+DNA marker;1~2泳道-紫陀螺菌GPA子实体、 GP01菌株的ITS片段
图2 供试紫陀螺菌样品的ITS基因凝胶电泳图谱
Fig.2 The gel electrophoresis patterns of ITS amplification of two G.purpuraceus materials
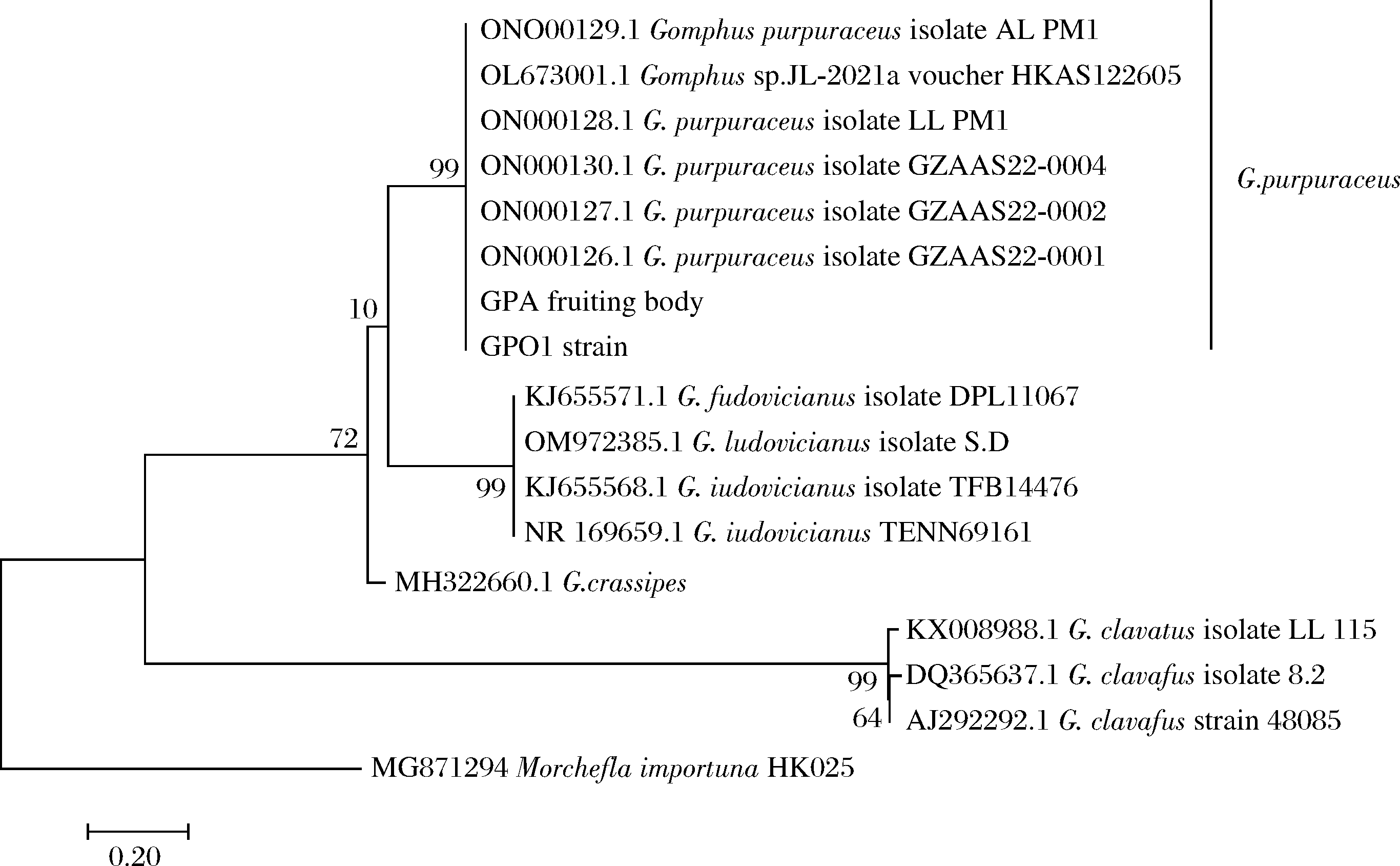
图3 供试紫陀螺菌材料的ITS系统发育分析
Fig.3 The ITS phylogenetic cluster analysis of tested G.purpuraceus strain GP01 and its fruitbody GPA by maximum likelihood method
2.3 供试紫陀螺菌株GP01液体培养的特征
紫陀螺菌菌丝体的培养较腐生菌困难,但要比多数珍稀外生菌根食用菌容易。紫陀螺菌株GP01在液体培养基A中静置培养,能在液体培养基与空气接触面上形成一层厚实的白色菌丝团(图4-A);紫陀螺菌株GP01在液体振荡培养下,能形成大量黄白色的菌丝球,绝大多数菌丝球外表相对光滑,极少数外表面可见短粗浓毛(图4-B)。因此,为了更加方便和快捷地筛选出液体发酵培养的最佳条件,选择在液体静置培养条件下,筛选温度和pH值两大因素;而装液量、接种量、摇床转速和培养时间等因素与液体振荡培养密切相关,本研究选择在液体振荡培养条件下进行。

A-紫陀螺菌株GP01在液体静置培养下的形态(生长60 d); B-紫陀螺菌株GP01在液体振荡培养下的形态(生长15 d)
图4 供试紫陀螺菌株GP01在液体静置培养和 振荡培养条件下菌丝体形态特征
Fig.4 Morphological characteristics of mycelia of the tested G.purpuraceus strain GP01 under the conditions of static liquid culture and shaking culture
2.4 温度对紫陀螺菌株GP01菌丝体静置培养的影响
不同培养温度下紫陀螺菌株GP01菌丝的生物量见图5。由图5可知,紫陀螺菌菌丝在16~28 ℃内均能生长,在以2 ℃为温度梯度的条件下培养,24 ℃时紫陀螺菌株GP01菌丝生物量最大(约1.23 g/L),与其他处理组有显著差异(P<0.05),当温度低于24 ℃时,菌丝生长速度随温度升高而加快,当温度高于24 ℃时,菌丝生物量随温度升高而明显减缓,故紫陀螺菌株GP01菌丝最适生长温度为24 ℃。当温度高于30 ℃时,菌丝均未明显生长,30、32 ℃培养的菌丝体最终生物量与初始接种量相近,说明30 ℃是紫陀螺菌株GP01菌丝生长的极限致死高温。

图5 温度对紫陀螺菌株GP01株GP01菌丝生长速度的影响
Fig.5 The effect of temperature on the mycelium growth rate of G.purpuraceus strain GP01
注:不同字母表示差异显著(P<0.05)(下同)。
2.5 培养基初始pH值对紫陀螺菌株GP01菌丝体静置培养的影响
不同培养基初始pH值对紫陀螺菌株GP01液体静置培养菌丝体生物量的影响见图6,紫陀螺菌菌丝在培养基初始pH值5.0~7.1均能生长,最适初始pH值为6.5,此时菌丝体生物量最大(约1.34 g/L),在pH值为5~6.5,菌丝体生物量随初始pH值升高而逐渐增多,在pH值为6.5~7.1,菌丝体生物量随初始pH值升高而明显减少。
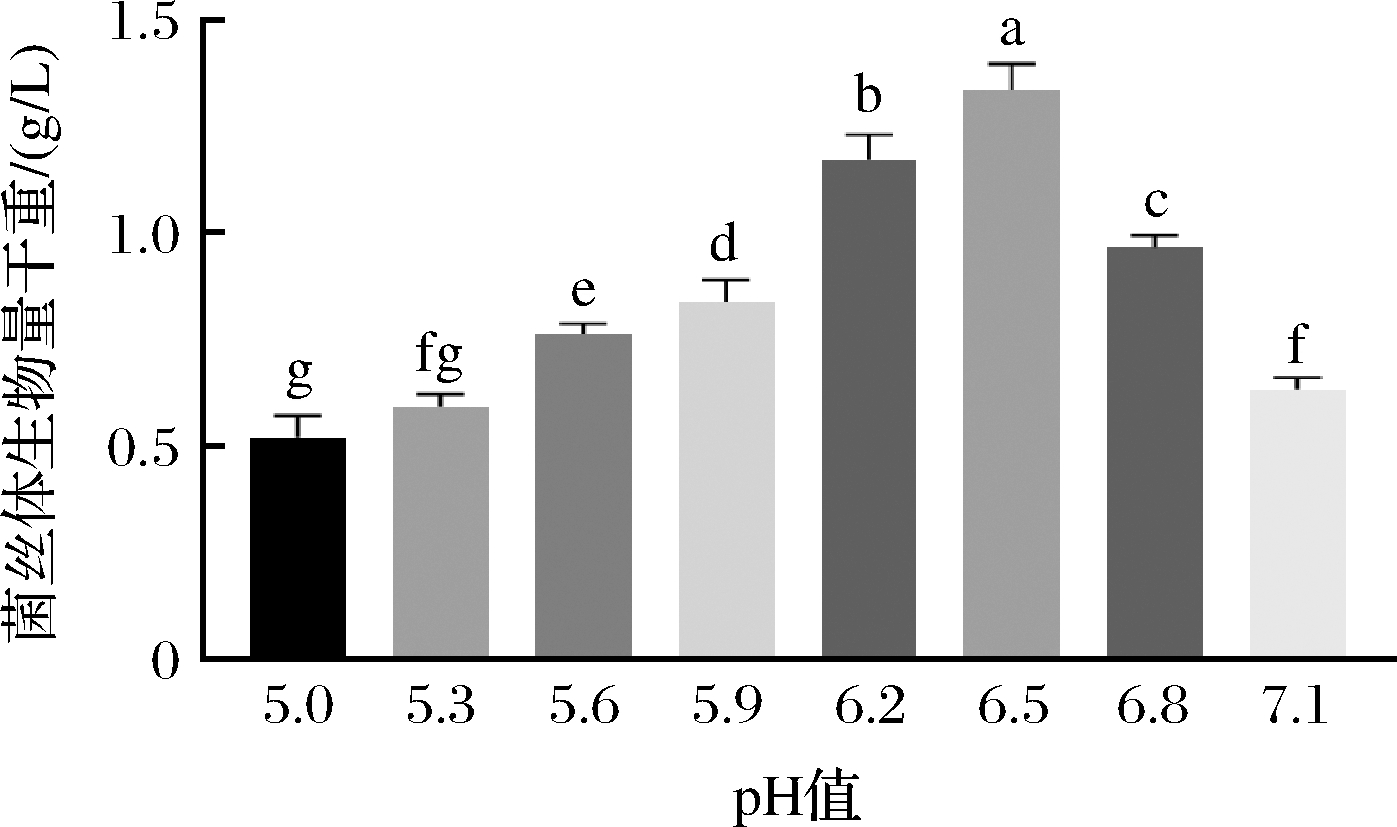
图6 初始pH值对紫陀螺菌株GP01液体静置培养 菌丝体生物量的影响
Fig.6 The effect of initial pH on the mycelia biomass of G.purpuraceus strain GP01 in static liquid culture
2.6 装液量对紫陀螺菌GP01菌丝体振荡培养的影响
不同装液量对紫陀螺菌株GP01振荡培养菌丝体生物量的影响见图7,液体振荡培养15 d后,当装液量≥20%时,紫陀螺菌株GP01的菌丝体生物量会随着装液量的增加而降低,当装液量为20%时,菌丝体生物量最大(约1.57 g/L),证明紫陀螺菌是一种好氧真菌。综合考虑紫陀螺菌液体菌种培养的通气量和菌种生产成本等因素,认为紫陀螺菌液体菌种培养的适宜装液量为20%。
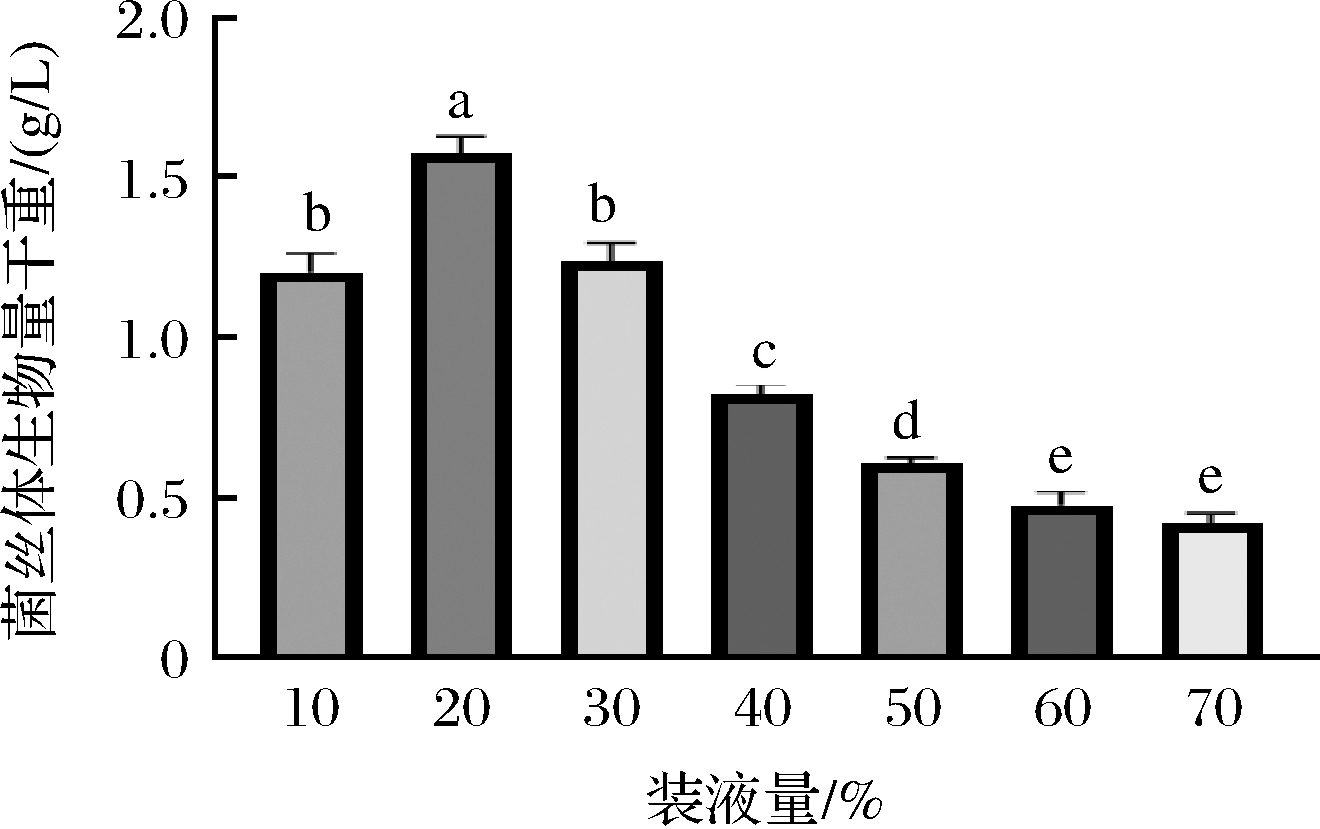
图7 装液量对紫陀螺菌株GP01菌丝体振荡培养的影响
Fig.7 The effect of liquid volume on the mycelia biomass of G.purpuraceus strain GP01 in shaken liquid culture
2.7 接种量对紫陀螺菌GP01菌丝体振荡培养的影响
不同接种量对紫陀螺菌株GP01液体振荡培养菌丝体生物量的影响,如图8所示。液体振荡培养15 d后,在接种量为6%~16%(体积分数)时,紫陀螺菌株GP01的菌丝体生物量会随着接种量的增多而增多,当接种量为14%~16%(体积分数)时,菌丝体的生物量最大,为1.44~1.72 g/L。综合考虑紫陀螺菌液体菌种生产成本等因素,认为紫陀螺菌液体菌种培养的适宜接种量为14%。

图8 接种量对紫陀螺菌株GP01菌丝体振荡培养的影响
Fig.8 The effect of inoculation volume on the mycelia biomass of G.purpuraceus strain GP01 in shaken liquid culture
2.8 摇床转速对紫陀螺菌株GP01菌丝生长的影响
在摇床不同的振荡速度下,紫陀螺菌株GP01菌丝在液体培养基A中的生物量见图9。可以看出,紫陀螺菌菌丝体的生物量随着转速的增加而增加。收取菌丝体时,当摇床转速≤120 r/min时,菌球体积相对较大,菌球中心因菌丝缺氧生长缓慢,导致菌丝体生物量较低。当摇床转速为150~180 r/min时,菌丝体生物量较高,在1.35~1.45 g/L,可能因培养基中溶氧度高,有利于菌丝快速生长。当转速增至210 r/min时,菌丝体生物量干重比180 r/min时的低,可能因转速过高对菌丝造成机械损伤影响菌丝正常生长。由此认为,紫陀螺菌株GP01液体振荡培养时摇床转速设置为180 r/min较为适宜。

图9 转速对紫陀螺菌株GP01菌丝体振荡培养的影响
Fig.9 The effect of shaking speed on the mycelia biomass of G.purpuraceus strain GP01 in shaken liquid culture
2.9 培养时间对紫陀螺菌株GP01菌丝生长的影响
不同培养时间对a、b、c 3组培养组合的紫陀螺菌株GP01菌丝体振荡培养的影响见图10。由图10可知,在100 mL固定体积的液体培养基A中紫陀螺菌菌丝体的生物量,3种不同的组合处理组的生长曲线都均呈现典型“S”形。在培养的第1天~第3天(适应期),菌丝体生长缓慢,生物量也增长平缓。培养3 d以后进入对数增长期,菌丝体生长迅速,生物量显著上升。a、b、c 3组分别培养至第16、13、14天时,菌丝体生物量达到最高(分别为1.473、1.481、1.480 g/L)。从第15天开始,3组的菌丝体生物量开始出现交差与重迭,此时应该是结束发酵的最佳时期,此后继续培养,由于菌丝自溶,生物量逐渐下降。由此认为,紫陀螺菌液体发酵菌丝体的生物量和发酵终点因接种量、培养温度、摇床转速(通气量)而异,适当增加接种量和摇床转速有助于提高菌丝体生物量和缩短发酵时间。

图10 培养时间对紫陀螺菌株GP01菌丝体振荡培养的影响
Fig.10 The effect of culture duration on the mycelia biomass of G.purpuraceus in shaken liquid culture
3 讨论与结论
国内有关紫陀螺菌的研究很少,本研究从野外采集紫陀螺子实体进行菌种的分离、纯化和分子鉴定,基于ITS1和ITS4的测序结果,以子囊菌梯棱羊肚菌KH025为外群,采用极大似然法构建了一个系统发育树,发现野生菌株GP01与宜昌原始采集地的紫陀螺菌子实体的ITS序列完全重合,均为紫陀螺菌G.purpuraceus。同时,液态发酵产物的制备不仅能用于食品加工业,也是培养菌根苗的先决条件[4],而建立合适的液体发酵体系是获得大量菌丝体的基础。
基于课题组前期的研究成果,本试验选取了培养基A作为基础培养基。由于紫陀螺菌株GP01菌丝体只在平板培养基的上表面匍匐生长(未深入基质),长速十分缓慢,生物量也很低,而且培养基因培养时间过长(2.5~3个月长满9 cm平板),最终也很容易变干萎缩,因此,本试验采用液态培养法,对紫陀螺菌菌丝的生长进行了单因子控制条件的研究。液体培养试验结果显示,在液体培养基A上,紫陀螺菌菌丝体能在温度16~30 ℃,初始pH值为5.0~7.1的环境中生长,最适宜的温度是24 ℃,最适宜的pH值6.5。同时,紫陀螺菌也是一种好氧真菌,综合考虑通气量和生产成本等因素,认为紫陀螺菌液体培养装液量20%(体积分数)为宜,接种量14%~16%(体积分数)为宜,摇床转速180 r/min为宜。在固定体积(100 mL)的液体培养基中,紫陀螺菌菌丝体的生物量因培养时间而异,但变化趋势和最终的菌丝体生物量基本相同,呈现S型曲线,这与杏鲍菇等真菌在有限的物质和空间条件下的液体发酵特性类似[25]。值得注意的是,在适宜的条件下,适当加大接种量和摇床转速,可以促进菌丝生物量的增加,减少液体发酵时间。这表明,通过液体培养技术,可以在短时间内得到一定量的紫陀螺菌的菌丝,并且不会受到季节、环境的制约,从而在一定程度上减少了紫陀螺菌资源的开发成本。虽然野生紫陀螺菌子实体和液体发酵菌丝体的培养条件不同,二者的营养成分可能也有差异,但是液体发酵也不失为一种快速获取紫陀螺菌多糖等营养物质的途径或方法,且大量菌丝体也能用于菌根苗的批量合成,具有一定的应用前景。随着测序技术和生物信息学技术的高速发展以及紫陀螺菌基因组信息的陆续公布,建议未来可根据其基因组信息中的CAZymes(carbohydrate-active enzymes)等的分布特征,进一步地优化紫陀螺菌液体深层培养的工艺条件和培养基配方,尤其是紫陀螺菌可能对蔗糖和麦芽糖等二糖的利用效率较高[26],深入探究紫陀螺菌的生态作用、食品应用开发途径及其潜在的人工驯化。
[1] 宋锡全, 王素英, 张胜博, 等.黔产紫陀螺菌深层发酵条件的优化及成分分析[J].贵州师范大学学报(自然科学版), 2014, 32(5):1-4.
SONG X Q, WANG S Y, ZHANG S B, et al.Study on submerged fermentation and analysis of Gomphus purpuraceus grow in GuiZhou[J].Journal of Guizhou Normal University (Natural Sciences), 2014, 32(5):1-4.
[2] 谭爱华, 刘发志, 余运岚, 等.紫陀螺菌生态研究初报[J].食用菌学报, 2002, 9(3):22-25.
TAN A H, LIU F Z, YU Y L, et al.A primary study on the ecology of Gomphus purpuraceus[J].Acta Edulis Fungi, 2002, 9(3):22-25.
[3] 谭爱华, 刘发志.紫陀螺菌的形态特征及生长环境初报[J].中国食用菌, 2002, 21(1):6-7.
TAN A H, LIU F Z.First report of the characteristic form and growing up environment of Gomphus purpuraceus[J].Edible Fungi of China, 2002, 21(1):6-7.
[4] 陈新, 康恒, 边银丙.乳菇类外生菌根食用菌研究进展[J].菌物学报, 2018, 37(12):1562-1571.
CHEN X, KANG H, BIAN Y B.Advances in studies of edible Lactarius sensu lato[J].Mycosystema, 2018, 37(12):1562-1571.
[5] 谭爱华, 李方桥, 邓梦匀, 等.珍稀食用菌紫陀螺菌三峡区域资源调查与化学成分分析[J].中国食用菌, 2022, 41(2):43-47.
TAN A H, LI F Q, DENG M J, et al.Resource investigation and chemical components analysis of rare edible fungus Gomphus purpuraceus in three gorges area[J].Edible Fungi of China, 2022, 41(2):43-47.
[6] 何艳艳, 谭爱华, 蔡晓蓉, 等.紫陀螺菌化学成分及其抑制肿瘤细胞增殖活性的研究[J].菌物学报, 2022, 41(6):991-998.
HE Y Y, TAN A H, CAI X R, et al.Chemical constituents of Gomphus purpuraceus and its antiproliferative activities against cancer cells[J].Mycosystema, 2022, 41(6):991-998.
[7] 谭爱华, 刘发志, 卢君, 等.野生紫陀螺菌及其液体培养菌丝体营养成分分析比较[J].食用菌, 2016, 38(6):61-62.
TAN A H, LIU F Z, LU J, et al.Analysis and comparison of the nutritional components of wild purple gyro fungus and its liquid culture mycelium[J].Edible Fungi, 2016, 38(6):61-62.
[8] 宋锡全, 王素英, 陈娟.黔产紫陀螺菌营养成分分析[J].价值工程, 2012, 31(22):297-299.
SONG X Q, WANG S Y, CHEN J.Analysis of the nutritive components of Gomphus purpuraceus in Guizhou[J].Value Engineering, 2012, 31(22):297-299.
[9] 谭爱华, 刘发志.紫陀螺菌蛋白质的氨基酸组成分析[J].长江大学学报(自科版), 2006, 3(8):172-173;103.
TAN A H, LIU F Z.Amino acid composition of Gomphus purpuraceus protein[J].Journal of Yangtze University (Natural Science Edition), 2006, 3(8):172-173;103.
[10] 谭爱华, 张曙光, 刘发志.紫陀螺菌蛋白质的营养评价[J].食用菌学报, 2003, 10(4):24-28.
TAN A H, ZHANG S G, LIU F Z.The nutritional assessment of Gomphus purpuraceus protein[J].Acta Edulis Fungi, 2003, 10(4):24-28.
[11] 谭爱华, 张曙光, 刘发志.紫陀螺菌营养成分分析[J].食用菌学报, 2001,8(4):15-18.
TAN A H, ZHANG S G, LIU F Z.Analysis of the nutritive components of Gomphus purpuraceus[J].Acta Edulis Fungi, 2001,8(4):15-18.
[12] DING X, HOU Y L, ZHU Y X, et al.Structure elucidation, anticancer and antioxidant activities of a novel polysaccharide from Gomphus clavatus Gray[J].Oncology Reports, 2015, 33(6):3162-3170.
[13] HE Y Y, WAN Y Y, ZHOU Y Q, et al.Two new alliacane sesquiterpenes from the fruiting bodies of edible mushroom Gomphus purpuraceus[J].Phytochemistry Letters, 2022, 50:85-88.
[14] JIANG M Y, YANG X L, FANG L Z, et al.Purpuracolide:A new alliacane sesquiterpene from the basidiomycete Gomphus purpuraceus[J].Zeitschrift Für Naturforschung B, 2008, 63(8):1012-1014.
[15] SHARMA S H, THULASINGAM S, NAGARAJAN S.Terpenoids as anti-colon cancer agents-A comprehensive review on its mechanistic perspectives[J].European Journal of Pharmacology, 2017, 795:169-178.
[16] 谭爱华, 马富英, 罗信昌, 等.紫陀螺菌菌株的分离及鉴定(英文)[J].华中农业大学学报, 2004(1):54-57.
TAN A H, MA F Y, LUO X C, et al.Isolation and identification of Gomphus purpuraceus[J].Journal of Huazhong Agricultural University, 2004(1):54-57.
[17] 谭爱华. 紫陀螺菌菌株的分离及鉴定研究[D].武汉:华中农业大学, 2004.
TAN A H.The study of isolation and identification of Gomphus purpuraceus[D].Wuhan:Huazhong Agricultural University, 2004.
[18] 谭爱华, 鲁修琼, 刘发志.紫陀螺菌组织分离试验[J].中国食用菌, 2003, 22(5):18-20.
TAN A H, LU X Q, LIU F Z.Tissue isolation test of Gomphus purpuraceus[J].Edible Fungi of China, 2003, 22(5):18-20.
[19] 谭爱华, 刘发志, 李方桥.八种培养基培养紫陀螺菌菌丝的观察比较[J].食用菌, 2020, 42(5):30-31;52.
TAN A H, LIU F Z, LI F Q.Preliminary screening of stock spawn culture medium and mycelium growth characteristics observation of Gomphus purpuraceus[J].Edible Fungi, 2020, 42(5):30-31;52.
[20] 谭爱华, 刘发志.不同培养基对紫陀螺菌菌丝生长的影响[J].中国食用菌, 2013, 32(6):15-16;24.
TAN A H, LIU F Z.The effects of different medium on mycelial growth of Gomphus purpuraceus[J].Edible Fungi of China, 2013, 32(6):15-16;24.
[21] PIPE N D, AZCOITIA V, SHAW D S.Self-fertility in Phytophthora infestans:Heterokaryons segregate several phenotypes[J].Mycological Research, 2000, 104(6):676-680.
[22] DU X H, ZHAO Q, O′DONNELL K, et al.Multigene molecular phylogenetics reveals true morels (Morchella) are especially species-rich in China[J].Fungal Genetics and Biology, 2012, 49(6):455-469.
[23] 陈新, 吕首云, 马瑞欣, 等.梯棱羊肚菌营养类型的研究[J].菌物学报, 2020, 39(2):323-334.
CHEN X, LYU SY, MA R X, et al.A study on the nutritional pattern of Morchella importuna[J].Mycosystema, 2020, 39(2):323-334.
[24] LANDEWEERT R, LEEFLANG P, KUYPER T W, et al.Molecular identification of ectomycorrhizal Mycelium in soil horizons[J].Applied and Environmental Microbiology, 2003, 69(1):327-333.
[25] 周峰, 王涛, 李玉, 等.杏鲍菇液体菌种发酵过程相关指标变化规律[J].安徽农业科学, 2017, 45(18):9-10;14.
ZHOU F, WANG T, LI Y, et al.Study on the variation rule of relative index during Pleurotus eryngii liquid fermentation process[J].Journal of Anhui Agricultural Sciences, 2017, 45(18):9-10;14.
[26] GENG Y, ZHANG S X, YANG N, et al.Whole-Genome sequencing and comparative genomics analysis of the wild edible mushroom (Gomphus purpuraceus) provide insights into its potential food application and artificial domestication[J].Genes, 2022, 13(9):1628.