刺梨(Rosa roxburghii Tratt.),又名茨梨、木梨子,属蔷薇科蔷薇属,主要分布于我国西南部和中南部海拔1 000~1 600 m的山区山谷和灌木丛中[1],果实富含膳食纤维、维生素C、多酚类等活性物质,具有免疫调节、抗癌和抗氧化损伤等功效[2-3]。刺梨汁是刺梨产品中市场占有率最高的产品类型,刺梨榨汁后会残留40%~50%的果渣[4]。贵州省作为刺梨的主产地,其每年生产刺梨汁而产生的刺梨渣高达15 000 t[5]。刺梨果渣富含膳食纤维、多酚、黄酮类、粗蛋白等功能和营养成分,是开发功能性食品的良好资源[3]。目前刺梨果渣仅有少量做饲料用,并且在堆积存放过程中极易霉变,从而造成资源浪费和环境污染。深度挖掘刺梨果渣功能性组分,开发其更广阔的应用空间,是解决刺梨渣资源浪费的有效途径。
膳食纤维是一种碳水化合物聚合物和寡聚体,根据溶解性不同,将其分为不可溶性膳食纤维(insoluble dietary fiber, IDF)和可溶性膳食纤维(soluble dietary fiber, SDF)[6]。不可溶性膳食纤维包括纤维素、木质素和少量半纤维素,主要来自于谷物麸皮、豆类外皮以及植物茎叶,不参与人体血液循环,但能刺激肠道蠕动,起到润肠通便的作用[7];可溶性膳食纤维主要包括树脂、果胶和一些半纤维素等,具有生理保健活性,如预防高血压、糖尿病、冠心病、心血管疾病等慢性疾病发生的作用[3]。刺梨果渣可溶性膳食纤维含量占刺梨果渣总膳食纤维含量的30%以上[8]。
目前,制备膳食纤维的方法主要有酸法、碱法、酶法、发酵法、膜分离法或多种方法联合使用,其中,尤以酸法、碱法和酶法为主[8]。采用不同提取方法所制备的膳食纤维样品在功能性质,分子结构方面具有差异性。研究表明,与酸法提取相比,酶法制备的猕猴桃可溶性膳食纤维表现出更高的持油力和葡萄糖吸附能力[9],而碱法提取的胡麻渣可溶性膳食纤维的持水力、持油力和溶胀力均显著高于酶法提取[8]。DU等[10]对比了酶化学萃取、亚临界水萃取和超声化学萃取,结果表明亚临界水萃取法提取得的脱脂椰子粉可溶性膳食纤维表现出最高持水力、持油力及葡萄糖吸附能力。因此,膳食纤维样品的理化性质和功能活性取决于原料类型和提取方法。现有研究多涉及采用不同方法提取不同物料来源的膳食纤维,但是,对于由于方法的差异性所引发的膳食纤维样品的分子结构、单糖组成及功能活性等方面的差异性,以及各差异性之间的内在联系方面的研究相对较少。
本研究以富含可溶性膳食纤维的刺梨果渣为原料,采用酸法提取可溶性膳食纤维(SDF1)、碱法提取可溶性膳食纤维(SDF2)、酶法提取可溶性膳食纤维(SDF3),对比分析酸法、碱法和酶法对刺梨果渣可溶性膳食纤维样品的晶体结构、光谱特征、单糖组成和含量、稳定性、功能性(油脂、葡萄糖吸附能力)等的影响。深度解析提取刺梨果渣可溶性膳食纤维方法之间的差异性,为刺梨果渣可溶性膳食纤维的开发利用提供研究基础。
1 材料与方法
1.1 材料与试剂
刺梨果渣由贵州省生物技术研究所提供,经粉碎过筛60目后,存放在干燥阴凉处备用。
3,5-二硝基水杨酸(DNS)试剂,福州飞净生物科技有限公司;磷酸盐缓冲液(PBS)(pH=6.0)、α-高温淀粉酶(20 000 U/g)、三氟乙酸、甲醇,南京都莱生物技术有限公司;乙醇(95%,体积分数)、氯化钠、柠檬酸、葡萄糖、氢氧化钠、盐酸、1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP)、磷酸二氢钠、硝酸银,均为分析纯,成都科龙化工试剂有限公司。
1.2 仪器与设备
CHY-6001多功能研磨机,金华市莫菲家有电器有限公司;D8 DVANCE X-射线衍射仪,德国布鲁克公司;GZX-GF101-1-BS电热恒温鼓风干燥箱,上海跃进医疗器械有限公司;H3-18K台式高速离心机,湖南可成仪器设备有限公司;HH-4数显恒温水浴锅,金坛市易晨仪器制造有限公司;Nicolet 380傅里叶红外光谱仪,赛默飞世尔科技公司;STA 449C同步热分析仪,德国耐驰仪器制造有限公司;UV-5100紫外分光光度计,上海元析仪器有限公司;U3000高效液相色谱分析仪,赛默飞世尔科技公司。
1.3 实验方法
1.3.1 不同方式提取可溶性膳食纤维
1.3.1.1 酸法制备可溶性膳食纤维
参考麦馨允等[11]的报道,准确称取10.0 g刺梨果渣粉,按料液比1∶25(g∶mL)加入质量分数2%的柠檬酸溶液,反应液的pH值为2.48,70 ℃下浸提1 h,用2 mol/L NaOH调节溶液pH至中性,4 000 r/min离心10 min,上清液用4倍体积95%乙醇醇沉过夜,再次离心,沉淀物烘干至恒重,即得酸法制备的可溶性膳食纤维样品SDF1。
1.3.1.2 碱法制备可溶性膳食纤维
参考仝文玲等[8]的报道,准确称取10.0 g刺梨果渣粉,按料液比1∶25(g∶mL)加入质量分数2%NaOH溶液,80 ℃浸提1 h,用浓盐酸调节溶液pH至中性,4 000 r/min离心10 min,取上清液用4倍体积95%乙醇醇沉过夜,再次离心,沉淀物烘干至恒重,即得碱法制备的可溶性膳食纤维样品SDF2。
1.3.1.3 酶法制备可溶性膳食纤维
参考何晓琴[12]的报道,准确称取10.0 g刺梨果渣粉,按料液比1∶20(g∶mL)加入PBS缓冲液(pH=6.0)和200 μL α-高温淀粉酶液混匀,95 ℃浸提40 min,4 000 r/min离心10 min,上清液用4倍体积95%乙醇醇沉2 h,再次同条件下离心,沉淀物烘干至恒重,即得酶法制备的可溶性膳食纤维样品SDF3。
1.3.2 可溶性膳食纤维基本理化性质测定
1.3.2.1 持水力[13]
准确称取0.50 g刺梨果渣可溶性膳食纤维样品,加入25 mL蒸馏水混匀,室温下静置12 h,4 000 r/min离心10 min,弃上清液,称重m1。持水力的计算如公式(1)所示:
持水力![]()
(1)
式中:m,样品干重,g;m1,样品湿重,g。
1.3.2.2 膨胀力[13]
准确称取0.50 g刺梨果渣可溶性膳食纤维样品于10 mL量筒中振荡均匀,记录体积V1。加入8 mL蒸馏水混匀,室温下静置12 h,记录样品吸水膨胀后体积V2。膨胀力的计算如公式(2)所示:
膨胀力![]()
(2)
式中:V1,干品体积,mL;V2,吸水膨胀后体积,mL;m,样品质量,g。
1.3.2.3 水溶性[6]
准确称取0.50 g刺梨果渣可溶性膳食纤维样品,加入20 mL蒸馏水混匀,75 ℃水浴1 h,4 000 r/min离心10 min,弃上清液,残渣烘干至恒重得m1。水溶性的计算如公式(3)所示:
水溶性![]()
(3)
式中:m,样品质量,g;m1,水溶后残留样品质量,g。
1.3.3 可溶性膳食纤维功能性质测定
1.3.3.1 阳离子交换能力
参考MA等[14]的报道,分别称取2.00 g样品,按1∶70(g∶mL)料液比加入HCl溶液(0.1 mol/L)反应24 h。过滤后,样品用蒸馏水洗涤,并用100 mg/mL硝酸银检测不含Cl-为止,烘干。称取上述干燥样品0.10 g分散于50 mL 5%的NaCl溶液中,加入2滴酚酞指示剂,采用0.01 mol/L的NaOH滴定,至溶液呈微红色且5 min内不褪色,记录碱液消耗体积,并以蒸馏水作空白对照。结果以每克样品对NaOH的消耗量表示。阳离子交换能力的计算如公式(4)所示:
阳离子交换能力![]()
(4)
式中:V0,NaOH滴定空白体积,mL;V1,NaOH滴定样品体积,mL;C,NaOH滴定浓度,mol/L;m,样品质量,g。
1.3.3.2 油脂吸附能力
方法参考周笑犁等[15]的报道,取3.0 g样品,加入食用花生油或猪油,37 ℃下静置1 h,4 000 r/min离心20 min,去掉上层油,残渣用滤纸吸干游离的花生油或猪油,称重得m1。吸油量的计算如公式(5)所示:
吸油量![]()
(5)
式中:m,样品质量,g;m1,吸附油脂后样品质量,g。
1.3.3.3 葡萄糖吸附能力
方法参考何晓琴[12]的报道,分别称取0.25 g样品,加入25 mL葡萄糖溶液(50、100、200 mmol/L)混匀,37 ℃下反应6 h,4 000 r/min离心20 min。取上清液20 μL,采用DNS法测定溶液中葡萄糖含量,并以蒸馏水作空白对照。葡萄糖吸附能力的计算如公式(6)所示:
葡萄糖吸附能力![]()
(6)
式中:Ci,葡萄糖初始浓度,mmol/L;Cs,上清液葡萄糖浓度,mmol/L;V,上清液体积,mL;m,样品质量,g。
1.3.4 可溶性膳食纤维结构性质测定
a)傅里叶红外光谱[14]
在充分干燥环境中,分别称取2 mg样品与200 mg溴化钾粉末于玛瑙研钵中混匀并研磨,将研磨好的粉末均匀加入压膜器中,压片5 min,然后迅速取出进行扫描分析,扫描波长为400~4 000 cm-1,光谱分辨率为4 cm-1,每个样品扫描32次。
b)X-射线衍射[16]
将样品在45 ℃条件下干燥4 h,然后在Cu靶,Kα射线,测试电压40 kV,电流30 mA条件下,以ω方式扫描样品,扫描范围为5°≤2θ≤70°,扫描速率为4°/min,步长为0.02°。
1.3.5 热重(thermal gravity, TG)分析[14]
使用热重分析仪测定样品的热稳定性。将样品置于铂金坩埚中,在流速为50 mL/min的氮气气氛中,以10 ℃/min的速度将温度从30 ℃升至800 ℃。
1.3.6 可溶性膳食纤维单糖组成
PMP衍生法测定可溶性膳食纤维单糖组成:精确称取各膳食纤维样品0.1 mg于20 mL的钳口瓶中,加入5 mL的2 mol/L 三氟乙酸(trifluoroacetic acid,TFA),充氮气封管(10 L/min,1 min),120 ℃烘箱中水解2 h;冷却后取1 mL该反应液与1 mL甲醇混匀,70 ℃水浴下用氮气吹干,如此重复加甲醇并用氮气吹干2次,以去除TFA;加入1 mL 0.3 mol/L NaOH溶液充分溶解残渣,得样品水解液。分别取 400 μL的混合单糖标准液或样品水解液于5 mL的具塞试管中,加 400 μL PMP甲醇溶液,涡旋混匀;于70 ℃水浴中反应2 h后,冷却至室温;加400 μL 0.3 mol/L的HCl中和(pH 6~7);加水1 200 μL,再加等体积的氯仿,涡旋混匀,静置,弃去氯仿相,如此萃取2次。将水相用0.45 μm微孔膜(水系)过滤后供HPLC进样分析。
色谱条件:色谱柱C18柱,250 mm×4.6 mm,粒度5 μm;流动相A:100 mmol/L磷酸钠缓冲液(pH=6.4);流动相B:乙腈;检测波长:245 nm;柱温30;流速1 mL/min;进样量20 μL。
标准品制备:将甘露糖、核糖、鼠李糖、氨基葡萄糖、葡萄糖醛酸、半乳糖醛酸、氨基半乳糖、葡萄糖、半乳糖、木糖、阿拉伯糖、岩藻糖标准品分别用甲醇溶解,制备成不同质量浓度的标准品溶液(0~29.6 μg/mL),经0.22 μm有机滤膜过滤后上样。按照上述色谱条件制作标准曲线。以标准品质量浓度为横坐标x (μg/mL),以峰面积为纵坐标y,绘制标准曲线,得各回归方程:y(甘露糖)=2.475x-0.227 3,R2=0.999 98;y(核糖)=3.230 9x-0.841,R2=0.999 89;y(鼠李糖)=2.638 4x-0.284,R2=0.999 99;y(氨基葡萄糖)=2.300 9x-0.381 8,R2=0.999 98;y(葡萄糖醛酸)=3x-0.228 2,R2=1;y(半乳糖醛酸)=1.502 3x+0.619 1,R2=0.999 34;y(氨基半乳糖)=1.576 6x-0.405 2,R2=0.999 97;y(葡萄糖)=2.327 1x-0.091 4,R2=1;y(半乳糖)=2.667 3x-0.107 1,R2=0.999 99;y(木糖)=3.429 3x-0.336 2,R2=0.999 97;y(阿拉伯糖)=3.377 4x-0.515 9,R2=0.999 69;y(岩藻糖)=2.775 3x-0.123 6,R2=1。
1.4 数据处理
每组实验重复3次。数据采用Excel、SPSS 26.0统计计算和方差分析,图表运用Origin 2021绘制。结果表示为平均值±标准偏差 (X±SD),P<0.05为差异显著。
2 结果与分析
2.1 不同提取方法对刺梨果渣可溶性膳食纤维理化性质的影响
持水力和膨胀力作为衡量膳食纤维品质的重要指标,二者分别体现了膳食纤维与过量水接触后的质量与体积变化情况,反映出膳食纤维与水相互结合的能力。高持水力和高膨胀力则表明膳食纤维对水的吸附能力更强,有助于调整食品体系水分分布,改善产品组织结构,防止水分流失,从而提高膳食纤维的加工适度性[17]。良好的持水力和膨胀力有助于膳食纤维在肠道内吸水膨胀,形成更大体积的凝胶状物质,促进肠胃蠕动,预防便秘和结肠癌发生[5]。由图1可看出,3种可溶性膳食纤维的持水力大小为SDF2>SDF3>SDF1;膨胀力大小为SDF2>SDF1>SDF3;水溶性大小为SDF3>SDF1>SDF2,3组之间均存在显著性差异(P<0.05)。其中,SDF2的持水力和膨胀力最大,原因在于碱液使得刺梨果渣中不可溶性膳食纤维分子之间链接被打断并向可溶性小分子转变,暴露出更多的极性基团或侧链[18],从而提高膳食纤维的持水力和膨胀力。
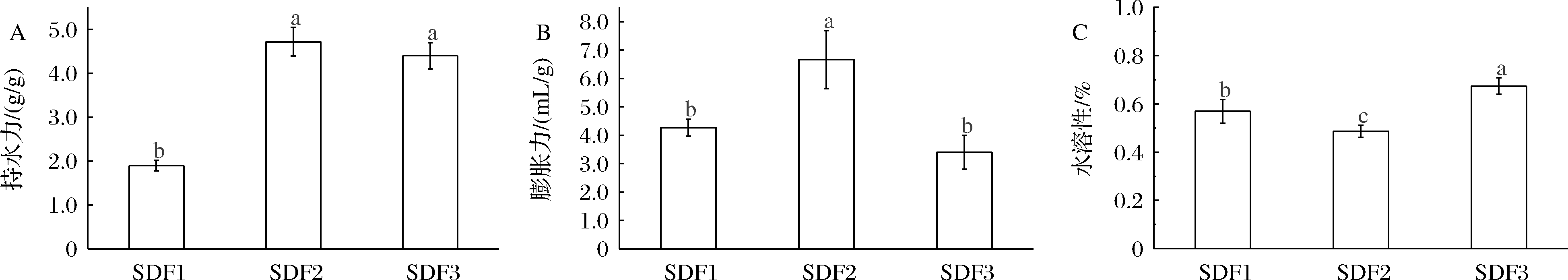
A-持水力;B-膨胀力;C-水溶性
图1 酸法、碱法、酶法对刺梨果渣可溶性膳食纤维持水力、膨胀力和水溶性的影响
Fig.1 Effect of acid, alkaline, and enzymatic methods on the physicochemical properties of soluble dietary fiber from Rosa roxburghii Tratt.Pomace
注:SDF1-酸法提取可溶性膳食纤维;SDF2-碱法提取可溶性膳食纤维;SDF3-酶法提取可溶性膳食纤维;
图中标注不同小写字母表示组间差异显著(P<0.05)(下同)。
2.2 不同提取方法对刺梨果渣可溶性膳食纤维功能性质的影响
2.2.1 阳离子交换能力
膳食纤维分子中含部分羧基和羟基侧链基团,与阳离子进行可逆交换,可影响消化道的pH值、渗透压以及氧化还原电位,有助于形成较为理想的缓冲体系,从而利于机体消化吸收[18]。膳食纤维可与肠道中Na+、K+进行交换,通过机体排泄和排遗,降低血液中Na+、K+浓度水平,从而起到降压作用[18]。由图2可看出,3种可溶性膳食纤维的阳离子交换能力从高到低依次是:SDF3>SDF2>SDF1,且存在显著性差异(P<0.05)。酸解法提取时,在低pH环境下,溶液中的H+会和阳离子竞争性结合膳食纤维的活性基团,不利于阳离子交换[15]。碱法提取时,pH值增加,羟基、羧基等活性基团去质子化并带负电,使得与阳离子交换的能力提高[16]。酶法处理使可溶性膳食纤维化学结构中的羧基、羟基和氨基等侧链基团更易暴露,可溶性膳食纤维充当类似于弱酸性阳离子交换树脂的角色,与钙、锌、铜、铅等阳离子进行可逆性交换,且优先交换有害金属离子,从而起到解毒和缓冲作用[8]。

图2 酸法、碱法、酶法对刺梨果渣可溶性膳食纤维 阳离子交换能力的影响
Fig.2 Effect of acid, alkaline, and enzymatic methods on the cation exchange capacity of soluble dietary fiber from Rosa roxburghii Tratt.pomace
2.2.2 油脂吸附能力
如表1所示,3种可溶性膳食纤维均表现出类似的吸附饱和油脂(猪油)的能力,SDF1对不饱和油脂(花生油)的吸附能力与SDF2和SDF3的差异不显著,但SDF3对不饱和油脂的吸附能力显著强于SDF2(约是SDF2的2倍)(P<0.05)。3种可溶性膳食纤维样品对饱和油脂表现出较高的吸附能力,约是不饱和油脂吸附能力的3倍。可溶性膳食纤维通过吸附油脂,延缓脂肪的消化吸收,抑制脂肪的摄入,从而发挥降脂作用。膳食纤维还可通过包裹油脂,以减少油脂与胆汁的接触和油脂分解以及阻碍肠道吸收胆固醇,从而起到降血脂作用。此外,可溶性膳食纤维对油脂的吸附能力略强于不可溶性膳食纤维[19]。本实验中各SDF样品对饱和油脂的吸附能力差异不显著,可能由于猪油易凝固(凝固温度约为34 ℃),当SDF与猪油在37 ℃下静置所形成的混合体系不均衡,且流动性差。虽然不同方法制备的SDF样品的分子结构特征和单糖组成等方面可能存在差异性,但由于猪油较为黏稠,猪油与SDF样品二者之间的“黏附效应”可能强于SDF分子对猪油的“吸附效应”。当以黏附效应为主导时,不同样品对饱和油脂—猪油的“吸附”能力没有差异性。花生油在常温下呈液态,液态油脂吸附力的强弱与膳食纤维的颗粒大小等因素相关,且与膳食纤维分子疏水基团的量正相关[20]。酶法制备的可溶性膳食纤维(SDF3)具有较强的饱和和不饱和油脂吸附能力,这可能由于酶法处理破坏了刺梨可溶性膳食纤维的分子间键,导致纤维分子粒径减小,比表面积增大,使得SDF化学结构中羧基、羟基、氨基等侧链增加,从而更易与油脂分子中的氢原子相互吸引和结合[14],表现出较强的油脂吸附能力。酸法处理则有效地保留了SDF的疏水基团,而碱法处理主要破坏细胞壁(溶解部分不溶性膳食纤维的半纤维素)[21],对SDF疏水基团的影响相对较小,故表现出最弱的油脂吸附能力。
表1 酸法、碱法、酶法对刺梨果渣可溶性膳食 纤维油脂吸附能力的影响
Table 1 Effect of acid, alkaline, and enzymatic methods on the oil adsorption capacity of soluble dietary fiber from Rosa roxburghii Tratt.pomace

膳食纤维油脂吸附能力饱和油脂(猪油)不饱和油脂(花生油)SDF13.08±0.16a0.74±0.18abSDF23.01±0.22a0.45±0.27bSDF33.04±0.20a0.92±0.20a
注:表中同一列不同小写字母表示差异显著 (P<0.05)。
2.2.3 葡萄糖吸附能力
膳食纤维有助于抑制葡萄糖扩散,降低血糖水平,并有效控制餐后血糖上升速度。由表2可知,膳食纤维样品对葡萄糖的吸附能力随着葡萄糖溶液浓度的升高而显著增强(P>0.05),具有一定的量效关系,且3种样品对葡萄糖吸附能力的增强效应,基本一致。在葡萄糖低浓度(50 mmol/L)和高浓度(200 mmol/L)条件下,3种可溶性膳食纤维之间对葡萄糖吸附能力相当,在100 mmol/L时,SDF1表现出最高的葡萄糖吸附能力(P>0.05)。膳食纤维对葡萄糖的吸附作用与纤维含量及物理结构有关[12]。可溶性膳食纤维与水接触形成凝胶状物质包裹葡萄糖分子,松散的网状结构将葡萄糖分子包裹其中,从而抑制葡萄糖扩散[15,17]。
表2 酸法、碱法、酶法对刺梨果渣可溶性膳食纤维 葡萄糖吸附能力的影响
Table 2 Effect of of acid, alkaline, and enzymatic methods on glucose adsorption capacity of soluble dietary fiber from Rosa roxburghii Tratt.pomace

样品葡萄糖吸附能力/(mmol/g)50 mmol/L100 mmol/L200 mmol/LSDF14.13±0.15Ca8.34±0.10Ba16.76±0.12AaSDF23.72±0.28Cb8.00±0.11Bb16.50±0.14AaSDF34.05±0.09Cab7.72±0.18Bc15.94±0.15Ab
注:表中同一列不同小写字母表示差异显著(P<0.05);同一行不同大写字母表示差异显著(P<0.05)。SDF1、SDF2、SDF3与图1中的编号一致。
2.3 不同提取方法对刺梨果渣可溶性膳食纤维结构性质的影响
2.3.1 红外光谱分析
由图3可知,3组样品的红外光谱总体形状相似,几个主要吸收峰无明显变化,只存在部分吸收峰位置和强度的改变。不同波数处的特征峰由特定的结构伸展或振动得到。由图3可知,3种可溶性膳食纤维均在3 430 cm-1处出现较强吸收峰,此处峰形较宽。这是由分子间和分子内氢键O—H伸缩振动引起[19]。在2 920 cm-1处的吸收峰由甲基或亚甲基C—H伸缩振动引起,是纤维素的典型结构[22-23]。1 400 cm-1处的吸收峰则对应着C—H的弯曲振动[19]。羟基和烷基是多糖类物质的典型基团,上述峰表明3种样品的主要成分为糖类物质。此外,1 618 cm-1处的吸收峰代表苯环的伸缩振动,表明木质素的存在。1 045 cm-1与1 100 cm-1处的吸收峰由C—O—C上的C—O伸缩振动引起。SDF3在1 472 cm-1处的吸收峰则由C![]() O伸缩振动引起,是半纤维素的特征吸收峰[19];895 cm-1处的吸收峰是C1—H的弯曲振动峰,说明可溶性膳食纤维中糖苷键以β-构型为主。以上结果均表明,酸法、碱法和酶法制备的可溶性膳食纤维样品具有典型膳食纤维结构,即含有纤维素、半纤维素、木质素与果胶。
O伸缩振动引起,是半纤维素的特征吸收峰[19];895 cm-1处的吸收峰是C1—H的弯曲振动峰,说明可溶性膳食纤维中糖苷键以β-构型为主。以上结果均表明,酸法、碱法和酶法制备的可溶性膳食纤维样品具有典型膳食纤维结构,即含有纤维素、半纤维素、木质素与果胶。
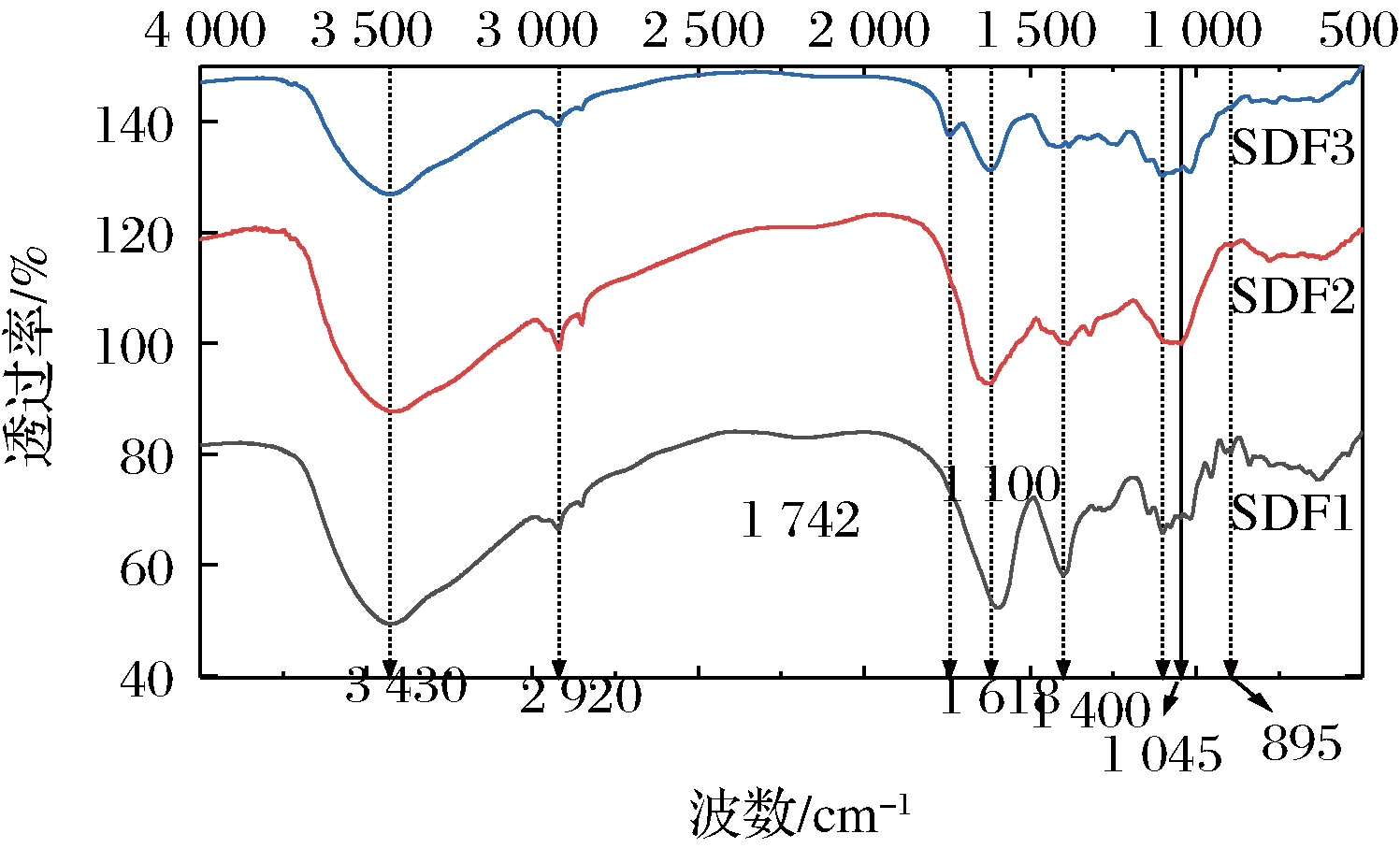
图3 酸法、碱法、酶法提取刺梨果渣可溶性膳食 纤维的红外光谱
Fig.3 FTIR spectra of soluble dietary fiber extracted from Rosa roxburghii Tratt.pomace by acid, alkaline, and enzymatic methods
2.3.2 晶体结构分析
纤维素的结晶结构分为纤维素I~V型5种,其中I型为天然纤维素[22]。由图4可知,3种膳食纤维样品衍射峰的位置没有明显区别,只是衍射强度有所差异,表明纤维样品的晶体没有变换。但SDF1峰多且杂,2θ=23.8°处存在较宽的衍射峰。SDF2在2θ=22.8°处有明显的衍射峰,在2θ=14.1°和2θ=31.5°处出现2个尖锐的衍射峰。SDF3在2θ=21.6°处出现一个较宽的衍射峰,其他位置的衍射峰有所掩盖。3种样品均表现出纤维素I型的X-射线衍射特征曲线[23]。由此可判断刺梨果渣SDF的晶体类型属于纤维素I型,为结晶区与非结晶区两相共存的状态[24-25]。此外,SDF1出现其他峰可能是由于膳食纤维中含有较多影响衍射峰生成的杂质。样品的结晶峰强度与结晶强度相关[24],3种样品的结晶强度有轻微差异,说明不同提取方法可能使纤维的微观结构发生了变化。
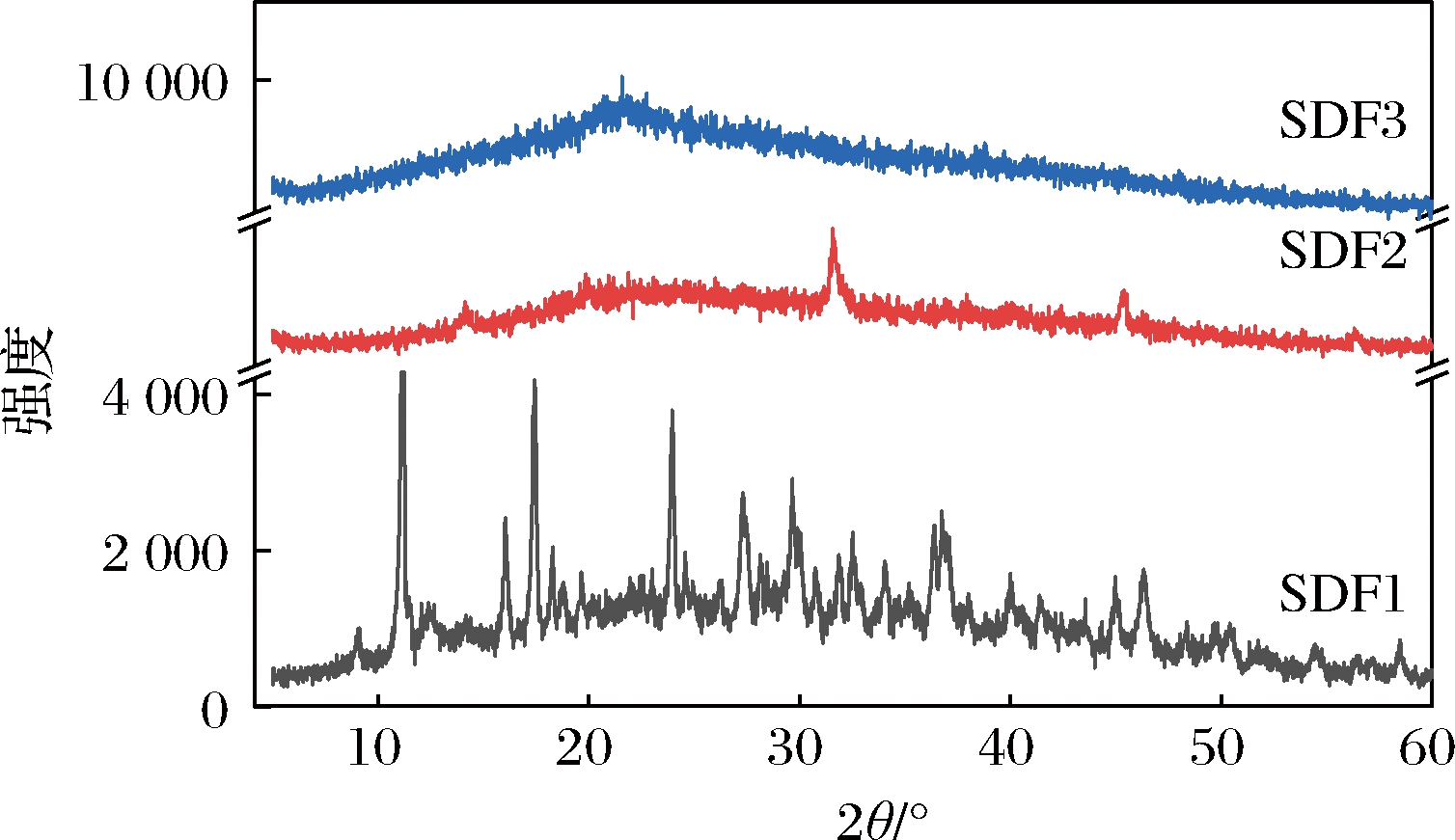
图4 酸法、碱法、酶法提取刺梨果渣可溶性膳食 纤维的X-射线衍射图谱
Fig.4 XRD of soluble dietary fiber extracted from Rosa roxburghii Tratt.pomace by acid, alkaline, and enzymatic methods
2.4 不同提取方法对刺梨果渣可溶性膳食纤维热稳定性的影响
由图5可知,3组样品具有性质相似的TG曲线,且均经历2个显著的质量损失阶段,具有不同的降解速率。第一次失重出现在50~200 ℃,主要是样品中自由水和结合水的蒸发[14]。第二次失重发生在200~650 ℃,速率较快,主要为半纤维素、纤维素和果胶等物质的热解或碳化[25-26]。在650 ℃时,刺梨果渣SDF1、SDF2和SDF3的质量损失分别达到51.13%、60.23%、78.22%。其中,酶法制备的刺梨果渣SDF质量损失最高。随着温度继续升高,膳食纤维继续热解导致失重。以上结果表明,200 ℃以下,3种样品热稳定性良好,但当温度达到650 ℃及以上时,SDF1具有更好的热稳定性。

图5 酸法、碱法、酶法提取刺梨果渣可溶性膳食 纤维的热重分析
Fig.5 TG of soluble dietary fiber extracted from Rosa roxburghii Tratt.pomace by acid, alkaline, and enzymatic methods
2.5 不同提取方式对刺梨果渣可溶性膳食纤维单糖组成的影响
由图6可知,酸法(SDF1)和酶法(SDF3)制备的可溶性膳食纤维均由12种单糖组成,但碱法SDF2只有10种单糖构成,引起该差异性的主要原因可能是不同提取方法对多糖分子、键能的破坏程度不同,进而引起单糖组成比例的改变。由表3可知,酸法提取物中的单糖含量由高到低的顺序为半乳糖醛酸>半乳糖>甘露糖>葡萄糖>阿拉伯糖>鼠李糖,其对应的各单糖含量比例为7.4∶6.0∶4.1∶3.7∶1.2∶1.0。半乳糖醛酸是果胶的主要成分,则表明果胶是SDF1的主要成分。碱法提取物中的单糖含量由高到低的顺序为半乳糖>葡萄糖>甘露糖>阿拉伯糖>鼠李糖>半乳糖醛酸,其对应的各单糖含量比例为8.4∶4.5∶2.3∶1.9∶1.3∶1.0。酶法提取物中的单糖含量由高到低的顺序为葡萄糖>半乳糖>半乳糖醛酸>甘露糖>阿拉伯糖>鼠李糖,其对应的各单糖含量比例为7.2∶6.1∶2.8∶1.3∶1.2∶1.0。碱法提取物中的半乳糖含量是酸法的1.9倍,酸法提取物的木糖含量是酶法的3.15倍。木糖和阿拉伯糖是组成半纤维素的单糖[1,27],酸法和酶法提取所得样品中均含有木糖和阿拉伯糖,可推断刺梨果渣可溶性膳食纤维的部分成分来自于半纤维素。
表3 刺梨果渣可溶性膳食纤维单糖组成及含量
Table 3 The monosaccharide composition and content of soluble dietary fiber extracted from Rosa roxburghii Tratt.pomace by acid, alkaline, and enzymatic methods
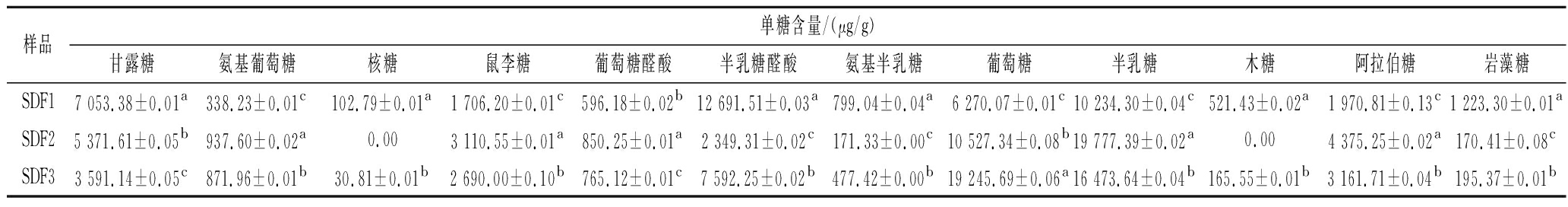
样品单糖含量/(μg/g)甘露糖氨基葡萄糖核糖鼠李糖葡萄糖醛酸半乳糖醛酸氨基半乳糖葡萄糖半乳糖木糖阿拉伯糖岩藻糖SDF17 053.38±0.01a338.23±0.01c102.79±0.01a1 706.20±0.01c596.18±0.02b12 691.51±0.03a799.04±0.04a6 270.07±0.01c10 234.30±0.04c521.43±0.02a1 970.81±0.13c1 223.30±0.01aSDF25 371.61±0.05b937.60±0.02a0.003 110.55±0.01a850.25±0.01a2 349.31±0.02c171.33±0.00c10 527.34±0.08b19 777.39±0.02a0.004 375.25±0.02a170.41±0.08cSDF33 591.14±0.05c871.96±0.01b30.81±0.01b2 690.00±0.10b765.12±0.01c7 592.25±0.02b477.42±0.00b19 245.69±0.06a16 473.64±0.04b165.55±0.01b3 161.71±0.04b195.37±0.01b
注:表中同列上标不同小写字母表示组间差异显著 (P<0.05)。

1-甘露糖;2-氨基葡萄糖;3-核糖;4-鼠李糖;5-葡萄糖醛酸; 6-半乳糖醛酸;7-氨基半乳糖;8-葡萄糖;9-半乳糖; 10-木糖;11-阿拉伯糖;12-岩藻糖
图6 酸法、碱法、酶法提取刺梨果渣可溶性膳食纤维单糖 组成高效液相色谱图
Fig.6 Analysis of soluble dietary fiber monosaccharide composition of Rosa roxburghii Tratt.pomace by high performance liquid chromatography
3 结论
碱法提取的刺梨果渣可溶性膳食纤维具有良好的持水力和膨胀力,酶法制备的纤维样品对油脂尤其是饱和油脂具有较好的油脂吸附能力,3种提取方法制备的可溶性膳食纤维样品表现出相当的吸附葡萄糖的能力。3种提取方法制备的刺梨果渣可溶性膳食纤维均表现为膳食纤维I型结构(天然纤维素结构),且糖苷键以β-构型为主。酸法碱法和酶法制备的刺梨果渣可溶性膳食纤维的热稳定性良好,适合在200 ℃以下加工。3种提取方法制备的可溶性膳食纤维的单糖组成有显著差异,酸法、碱法和酶法可溶性膳食纤维中主要的单糖分别为半乳糖醛酸、半乳糖和葡萄糖。本研究为刺梨果渣可溶性膳食纤维的开发利用提供理论基础。
[1] XU J W, VIDYARTHI S K, BAI W B, et al.Nutritional constituents, health benefits and processing of Rosa roxburghii:A review[J].Journal of Functional Foods, 2019, 60:103456.
[2] MA Y X, ZHU Y, WANG C F, et al.The aging retarding effect of ‘Long-life CiLi’[J].Mechanisms of Ageing and Development, 1997, 96(1-3):171-180.
[3] 郑佳欣. 刺梨渣膳食纤维蒸汽爆破改性及结构、功能性质研究[D].北京:北京林业大学, 2020.
ZHENG J X.Structural and functional properties of dietary fiber from chestnut rose residue modified by steam explosion.[D].Beijing:Beijing Forestry University, 2020.
[4] 陈思奇, 孟满, 杜勃峰,等.基于主成分分析与聚类分析综合评价不同菌种发酵刺梨果渣的香气品质[J].中国酿造, 2019, 38(6):152-159.
CHEN S Q, MENG M, DU B F, et al.Comprehensive evaluation of aroma quality of Rosa roxburghii pomace fermented by different strains based on principal component analysis and cluster analysis[J].China Brewing, 2019, 38(6):152-159.
[5] 周禹佳, 樊卫国.刺梨果渣的营养、保健成分及利用价值评价[J].食品与发酵工业, 2021,47(7):217-224.
ZHOU Y J, FAN W G.Nutrition and health-care composition of Rosa roxburghii Tratt pomace and its utilization potential[J].Food and Fermentation Industries, 2021,47(7):217-224.
[6] WILLIAMS B A, MIKKELSEN D, FLANAGAN B M, et al.“Dietary fibre”:moving beyond the “soluble/insoluble” classification for monogastric nutrition, with an emphasis on humans and pigs[J].Journal of Animal Science and Biotechnology, 2019, 10(1):1-12.
[7] SOLIMAN G A.Dietary fiber, atherosclerosis, and cardiovascular disease[J].Nutrients, 2019, 11(5):1155.
[8] 仝文玲,郭玉如,徐建国.碱法和酶法提取方法对胡麻渣可溶性膳食纤维理化性质的影响[J].食品研究与开发,2019,40(23):93-97.
TONG W L, GUO Y R, XU J G.Effects of alkali and enzyme extraction methods on physicochemical properties of soluble dietary fiber from flax residue[J].Food Research and Development, 2019,40(23):93-97.
[9] WANG K L, LI M, WANG Y X, et al.Effects of extraction methods on the structural characteristics and functional properties of dietary fiber extracted from kiwifruit (Actinidia deliciosa)[J].Food Hydrocolloids, 2021, 110:106162.
[10] DU X J, WANG L, HUANG X, et al.Effects of different extraction methods on structure and properties of soluble dietary fiber from defatted coconut flour[J].LWT, 2021,143:111031.
[11] 麦馨允, 苏仕林, 曾维标, 等.超声波辅助酸法提取蕨菜水溶性膳食纤维[J].农产品加工, 2019(11):5-8.
MAI X Y, SU S L, ZENG W B, et al.Ultrasonic assisted acid extraction of soluble dietary fiber from Pteridium aquilinum[J]. Farm Products Processing, 2019(11):5-8.
[12] 何晓琴. 蒸汽爆破对苦荞麸皮膳食纤维理化特性及降血糖活性的影响[D].重庆:西南大学, 2020.
HE X Q.Effect of steam explosion on the physicochemical properties and hypoglycemic activity of Tartary buckwheat bran dietary fiber[D].Chongqing:Southwest University, 2020.
[13] 祁静. 高吸附性米糠纤维的制备及其吸附特性的研究[D].无锡:江南大学, 2016.
QI J.The research on the preparation and adsorption properties of rice bran fiber with high adsorption capacities[D].Wuxi:Jiangnan University, 2016.
[14] MA Q Y, MA Z Y, WANG W X, et al.The effects of enzymatic modification on the functional ingredient-Dietary fiber extracted from potato residue[J].LWT,2022,153:112511.
[15] 周笑犁, 王瑞, 高蓬明, 等.刺梨果渣膳食纤维的体外吸附性能[J].食品研究与开发, 2018, 39(2):187-191.
ZHOU X L, WANG R, GAO P M, et al.Adsorption capacity of dietary fibers from Roxburgh rose pomace in vitro[J].Food Research and Development, 2018, 39(2):187-191.
[16] 杨兵. 拐枣多糖的分离纯化和结构解析及其降血糖活性研究[D].重庆:西南大学, 2020.
YANG B.Isolation, purification, structural identification and hypoglycemic activity of polysaccharides from Hovenia dulcis[D].Chongqing:Southwest University, 2020.
[17] 李杨, 胡淼, 孙禹凡, 等.提取方式对大豆膳食纤维理化及功能特性的影响[J].食品科学, 2018, 39(21):18-24.
LI Y, HU M, SUN Y F, et al.Effect of different extraction methods on physicochemical and functional properties of soybean dietary fiber[J].Food Science, 2018, 39(21):18-24.
[18] 梁志宏, 尹蓉, 张倩茹, 等.提取方式对枣膳食纤维理化及功能特性的影响[J].食品与发酵工业,2019,45(19):132-137.
LIANG Z H, YIN R, ZHANG Q R, et al.Effects of extraction methods on physicochemical and functional properties of dietary fiber in jujube[J].Food and Fermentation Industries, 2019, 45(19):132-137.
[19] 钟艳萍. 水溶性膳食纤维的制备及性能研究[D].广州:华南理工大学, 2011.
ZHONG Y P.Studies on properties and preparation of soluble dietary fiber[D].Guangzhou:South China University of Technology, 2011.
[20] LI X N, WANG B Y, HU W J, et al.Effect of γ-irradiation on structure, physicochemical property and bioactivity of soluble dietary fiber in navel orange peel[J].Food Chemistry:X, 2022, 14:100274.
[21] WANG S Q, FANG Y Q, XU Y B, et al.The effects of different extraction methods on physicochemical, functional and physiological properties of soluble and insoluble dietary fiber from Rubus chingii Hu.fruits[J].Journal of Functional Foods,2022,93:105081.
[22] 丁莎莎,黄立新,张彩虹, 等.油橄榄果渣水溶性膳食纤维的组成成分和功能特性分析[J].林产化学与工业,2017,37(6):110-116.
DING S S, HUANG L X, ZHANG C H, et al.Compositions and functional properties of soluble dietary fiber from olive pomace[J].Chemistry and Industry of Forest Products, 2017,37(6):110-116.
[23] PARK K H, LEE K Y, LEE H G.Chemical composition and physicochemical properties of barley dietary fiber by chemical modification[J].International Journal of Biological Macromolecules, 2013,60:360-365.
[24] 马晓娟, 黄六莲, 陈礼辉, 等.纤维素结晶度的测定方法[J].造纸科学与技术, 2012, 31(2):75-78.
MA X J, HUANG L L, CHEN L H, et al.Determination methods for crystallinity of cellulose[J].Paper Science &Technology, 2012, 31(2):75-78.
[25] 刘治刚, 高艳, 金华, 等.XRD分峰法测定天然纤维素结晶度的研究[J].中国测试, 2015, 41(2):38-41.
LIU Z G, GAO Y, JIN H, et al.Study on natural cellulose crystallinity determinated by the technology of XRD peak separation[J].China Measurement &Test, 2015, 41(2):38-41.
[26] 周丽珍, 孙海燕, 刘冬, 等.改性方法对豆渣膳食纤维的结构影响研究[J].食品科技, 2011, 36(1):143-147.
ZHOU L Z, SUN H Y,LIU D, et al.Influence of modification methods on the structure of dietary fiber from soybean residue[J].Food Science and Technology, 2011, 36(1):143-147.
[27] 夏洁. 刺梨果渣水不溶性膳食纤维的制备、结构表征及其体外发酵特性研究[D].广州:华南理工大学, 2020.
XIA J.Study on extraction, structural characterization and in vitro fermentation of insoluble dietary fiber from Rosa roxburghii Tratt fruit[D].Guangzhou:South China University of Technology, 2020.