幽门螺杆菌(Helicobacter pylori,Hp)是少数能够在人体胃部生存的细菌之一。作为一种致病菌,Hp的存在与慢性胃炎、消化性胃溃疡等多种胃肠道疾病密切相关[1-3]。研究表明,根除Hp能够显著缓解Hp阳性患者的胃部疾病负担[4]。Hp有着极高的传染率及感染率。在全球范围内,Hp的感染率超过了50%,而我国Hp的感染率高达55.8%,高于全球总体水平[5]。有研究表明,Hp感染能够促进胃癌的发生与发展[6],因此,世界卫生组织在2010年将Hp归类为Ⅰ类致癌物质。目前,对于Hp感染国内外专家都建议采取根除治疗。对于Hp的根除治疗方法,临床上常使用质子泵抑制剂(proton pump inhibitors,PPI)与抗生素的组合,但随着抗生素的不断使用,导致Hp的耐药株出现,使得Hp的根除率不断降低,同时,抗生素的使用还使得患者出现诸如恶心、腹泻等副作用[7]。因此,急需探索具有拮抗Hp作用的非抗生素物质。近年来,大量研究表明直接或者间接给予益生菌干预能够提高Hp阳性患者的转阴率,减轻抗生素治疗带来的副作用[8-9]。
透明质酸(hyaluronan,HA)是一种线性糖胺聚糖,在人体内广泛存在,具有保湿、润滑、抗氧化及抗炎等特性[10]。透明质酸钠作为透明质酸的结合盐,分别于2008年及2021年被批准可以作为食品原料应用于保健及普通食品中。有研究表明,HA参与机体内炎症反应及组织再生,且这种作用的发挥与透明质酸的分子质量息息相关[11]。
前期研究证明,鼠李糖乳酪杆菌CCFM1259具有拮抗Hp的作用[12]。本研究拟通过确定具有拮抗Hp效果的透明质酸钠的分子质量,将其与鼠李糖乳酪杆菌CCFM1259进行复配,探究复配组方在动物及临床上拮抗Hp的效果,以期开发出一款能够干预治疗Hp感染的复配产品。
1 材料与方法
1.1 材料与试剂
1.1.1 实验菌株
鼠李糖乳酪杆菌CCFM1259与Hp SS1,江南大学食品学院食品生物技术中心菌种保藏库。
1.1.2 实验动物
4周龄、雄性、C57BL/6品系小鼠,平均体重为(16.5±0.5) g,购于上海斯莱克实验动物公司,饲养于江苏省血吸虫病防治研究所。
1.1.3 试剂
脑心浸液培养基(BHI),青岛海博公司;胎牛血清,南京诺唯赞公司;哥伦比亚培养基,英国OXOID公司;无菌脱纤维绵羊血,杭州新锐公司;PCR引物,上海生工生物工程公司;透明质酸钠,AbateHPTM透明质酸益生菌粉,山东海御华熙生物医药有限公司。
1.2 仪器与设备
CFX 实时荧光定量仪,美国伯乐(Bio-Rad)公司;MLS-3750高压蒸汽灭菌锅,日本SANYO公司;i160三气培养箱、LYNX4000大容量冷冻离心机、Multiscan Go多功能酶标仪,美国Thermo公司;BSC-1000ⅡA2 型生物安全柜,苏州安泰空气技术有限公司。
1.3 动物实验设计
本研究已经过江苏省血吸虫病防治研究所伦理委员会审核(编号:JlPD-2020071)。小鼠在实验正式开始前适应1周。
1.3.1 不同分子质量HA拮抗Hp感染的动物实验方案
动物实验方案设计参考HONG等[13]的方法并稍做改进,60只小鼠适应性喂养1周后,将其随机分为6组,每组10只。造模组及实验组小鼠隔天灌胃200 μL BHI重悬的Hp菌悬液(浓度为109 CFU/mL)总共灌胃5次。实验组小鼠每天灌胃200 μL用PBS溶解的不同分子质量透明质酸钠(质量浓度为3 mg/mL);空白组及造模组小鼠每天灌胃200 μL PBS。2次灌胃间隔1 h,实验持续9 d,具体实验方案如表1所示。
表1 不同分子质量HA拮抗Hp感染实验方案
Table 1 Experimental scheme of antagonistic effect of HA with different molecular weights on Hp infection
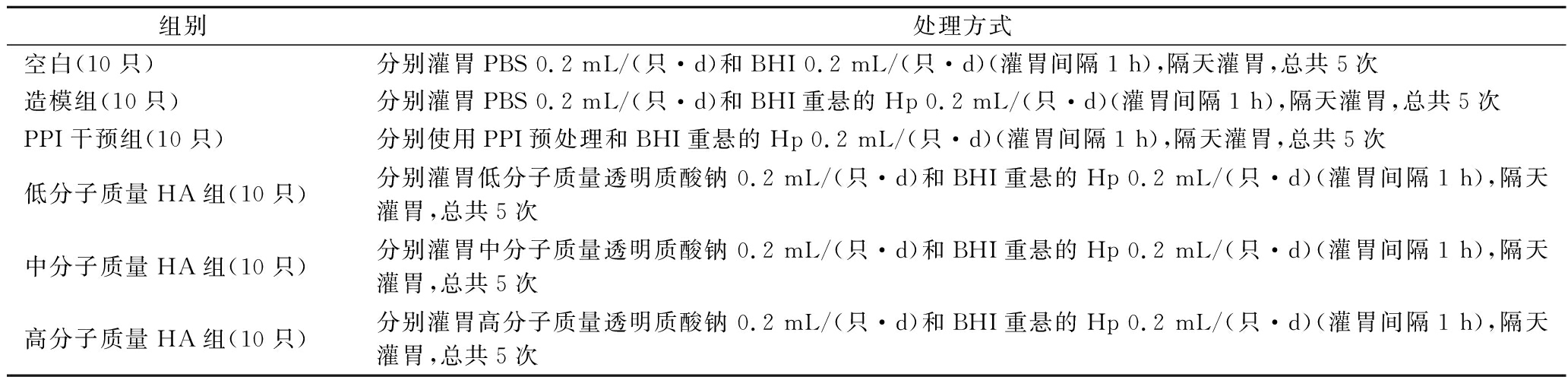
组别处理方式空白(10只)分别灌胃PBS 0.2 mL/(只·d)和BHI 0.2 mL/(只·d)(灌胃间隔1 h),隔天灌胃,总共5次造模组(10只)分别灌胃PBS 0.2 mL/(只·d)和BHI重悬的Hp 0.2 mL/(只·d)(灌胃间隔1 h),隔天灌胃,总共5次PPI干预组(10只)分别使用PPI预处理和BHI重悬的Hp 0.2 mL/(只·d)(灌胃间隔1 h),隔天灌胃,总共5次低分子质量HA组(10只)分别灌胃低分子质量透明质酸钠 0.2 mL/(只·d)和BHI重悬的Hp 0.2 mL/(只·d)(灌胃间隔1 h),隔天灌胃,总共5次中分子质量HA组(10只)分别灌胃中分子质量透明质酸钠 0.2 mL/(只·d)和BHI重悬的Hp 0.2 mL/(只·d)(灌胃间隔1 h),隔天灌胃,总共5次高分子质量HA组(10只)分别灌胃高分子质量透明质酸钠 0.2 mL/(只·d)和BHI重悬的Hp 0.2 mL/(只·d)(灌胃间隔1 h),隔天灌胃,总共5次
注:所述HA的分子质量分别为:低分子质量透明质酸钠分子质量为8~20 wDa,中分子质量透明质酸钠分子质量为50~70 wDa,高分子质量透明质酸钠分子质量为100~150 wDa。
1.3.2 高分子质量HA与乳杆菌复配拮抗Hp感染的动物实验设计
30只小鼠适应性喂养1周后,将其随机分为3组,每组10只。造模组及实验组小鼠隔天灌胃200 μL BHI重悬的Hp菌悬液(浓度为109 CFU/mL)总共灌胃5次。实验组小鼠每天灌胃200 μL 用PBS溶解的高分子质量透明质酸钠与乳杆菌复配溶液(其中高分子质量透明质酸钠质量浓度为3 mg/mL,乳杆菌菌悬液终浓度为109 CFU/mL);空白组及造模组小鼠每天灌胃200 μL PBS。2次灌胃间隔1 h,实验持续9 d,具体实验方案如表2所示。
表2 HA-益生菌复配拮抗Hp感染实验方案
Table 2 Experimental scheme of antagonistic effects of HA-probiotic compounds on Hp infection
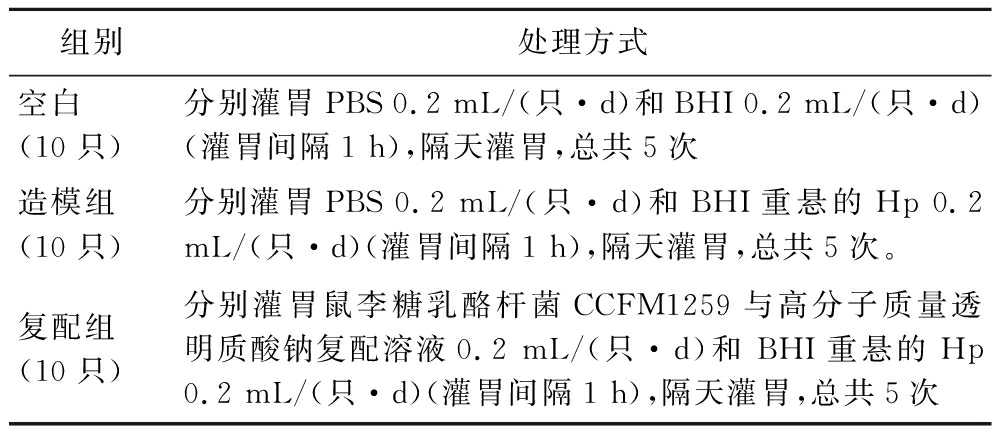
组别处理方式空白(10只)分别灌胃PBS 0.2 mL/(只·d)和BHI 0.2 mL/(只·d)(灌胃间隔1 h),隔天灌胃,总共5次造模组(10只)分别灌胃PBS 0.2 mL/(只·d)和BHI重悬的Hp 0.2 mL/(只·d)(灌胃间隔1 h),隔天灌胃,总共5次。复配组(10只)分别灌胃鼠李糖乳酪杆菌CCFM1259与高分子质量透明质酸钠复配溶液0.2 mL/(只·d)和 BHI重悬的Hp 0.2 mL/(只·d)(灌胃间隔1 h),隔天灌胃,总共5次
注:高分子质量透明质酸钠分子质量为100~150 wDa。
1.3.3 动物实验样本采集及指标测定
1.3.3.1 动物实验样本采集
实验动物在最后一次灌胃后,禁食24 h,采用10 mg/mL的戊巴比妥钠溶液对小鼠进行腹腔注射,使其麻醉,后进行小鼠眼球取血,最后辅以颈椎脱臼法使其死亡,立即解剖取出胃,沿胃大弯剪开,取完整的胃组织(包括胃窦、胃体等),一半用于病理学切片检测,另一半进行Hp定殖量检测。
1.3.3.2 Hp感染小鼠胃部Hp定殖量测定
取2 mL培养好的Hp菌液,用PBS洗涤后,6 000×g离心5 min,重复3次。将Hp菌泥梯度稀释后取100 μL涂板计数,另外一部分使用TRIzol提取Hp RNA,反转录为cDNA,使用荧光定量SYBR Green法测定Ct值,Hp特异性引物参考闫宗宝等[14]的方法设计,序列为:上游 TTTGTTAGAGAAGATAATGACGGTATCTAAC,下游 CATAGGATTTCACACCTGACTGACTAT,建立菌落数(CFU)与Ct值标准曲线。
称量感染小鼠胃组织质量,取200 mg收集到的小鼠胃部组织,用TRIzol法提取小鼠胃组织RNA,反转录为cDNA,使用荧光定量SYBR Green法测定Ct值,使用标准曲线进行比对,计算小鼠胃内Hp的定殖量。
1.3.3.3 Hp感染小鼠胃组织病理学切片观察
感染小鼠胃部病理学切片参照刘阳[15]的方法操作,方法大致如下:小鼠胃部组织使用4%(体积分数)多聚甲醛固定24 h,经过石蜡包埋,冷冻切片及苏木精-伊红染色法 (hematoxylin-eosin staining,HE染色)后,在倒置显微镜下观察。
1.4 临床试验设计
本研究已经通过江苏省盐城市亭湖区人民医院伦理管理委员会审核(编号:ET2021085),并在中国临床注册中心进行注册(注册号:ChiCTR2100053710)。临床试验方法参照张美怡[12]的实验方法设计,临床试验共招募60名受试者,将受试者随机分为3组,每组20人,分别为安慰剂组、透明质酸组及复配组。安慰剂组给予安慰剂产品,透明质酸组给予包含100 mg/条 100~150 wDa透明质酸的产品,复配组给予AbateHPTM透明质酸益生菌粉,菌粉包含100 mg/条 100~150 wDa透明质酸及5×109 CFU/条鼠李糖乳酪杆菌CCFM1259。透明质酸组与复配组产品除已标出的成分外均与安慰剂成分相同。受试者早晚各摄入1条,服用4周。所有产品均为粉末状,外观及包装均无差别。
1.4.1 临床试验受试者纳入及排除标准
招募人群为在实验开始前经过14C呼气实验检测为Hp阳性且无胃肠道病史的人群。在临床试验开始前1个月内服用过抗生素的受试者将被排除在外。
1.4.2 临床试验指标测定
招募人群为在实验开始前经过14C呼气实验检测为Hp阳性且无胃肠道病史的人群。在临床试验开始前1个月内服用过抗生素的受试者将被排除在外。
1.4.2.1 14C呼气检测
受试者在实验开始前1 d及结束后1 d进行14C呼气检测。
1.4.2.2 血常规及血生化指标测定
受试者在研究开始前1 d及结束后1 d抽取空腹肘静脉血,进行血常规检测及血液生化分析。
1.5 数据分析
数据差异性用SPSS 25.0和GraphPad Prism 8 进行分析,计量数据表示为“平均值±标准误差”,多组别间的差异性比较采用单因素方差分析(One-way ANOVA),两组之间差异性比较采用t检验,图形的绘制通过 GraphPad Prism 8 完成。
2 结果与分析
2.1 不同分子质量HA对感染小鼠胃部Hp定殖量的影响
Hp通过定殖在胃上皮细胞上发挥其致病作用。有研究表明,幽门螺杆菌定殖量与其致病程度呈正相关[16]。因此,Hp在小鼠胃内定殖量的变化情况可以直接反映HA对Hp感染作用效果。如图1所示,空白组小鼠胃内Hp含量约为102 CFU左右,而造模组小鼠胃内Hp含量显著高于空白组,在104 CFU左右。经过PPI处理后,小鼠胃内Hp水平显著下降。同时,与造模组相比,中低分子质量HA干预后,感染小鼠体内Hp含量有轻微下降趋势,但在统计学上无显著性差异,而在高分子质量HA干预后,感染小鼠胃内Hp含量显著降低,说明高分子质量HA或可存在拮抗Hp的作用。
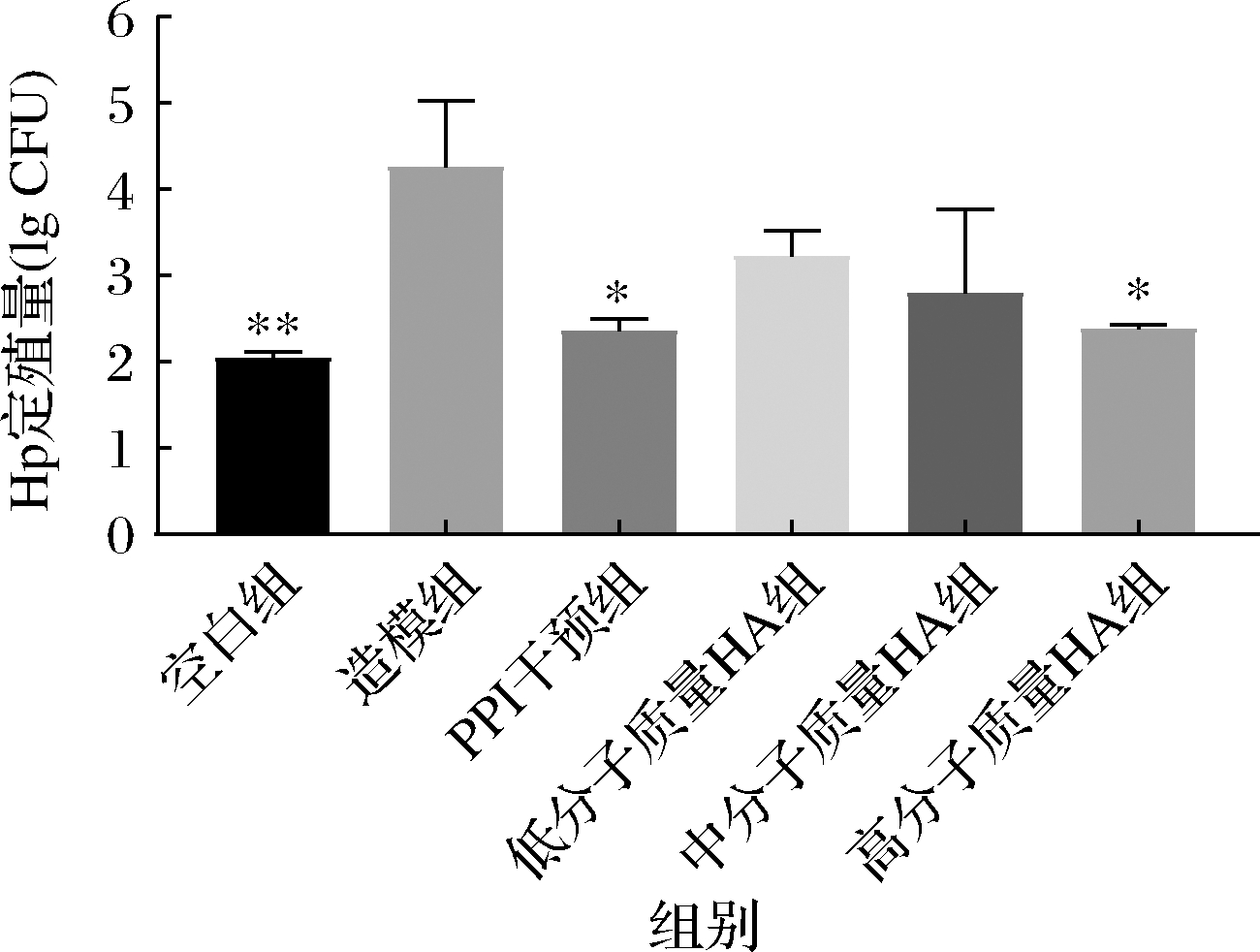
图1 HA对胃部Hp定殖量的影响
Fig.1 Effects of HAs on Hp Colonization in the stomach
注:*表示差异显著(P<0.05),**表示差异极显著(P<0.01),下同。
2.2 不同分子质量HA对感染小鼠胃部病理学切片的影响
为进一步探究不同分子质量HA拮抗Hp的作用,对感染小鼠胃部病理学情况进行观察。Hp感染后胃部的病理情况主要是通过胃部组织病理切片情况进行评价。不同处理组小鼠胃黏膜HE染色后结果如图2所示,感染Hp后小鼠胃黏膜固有层炎症细胞浸润显著性增多。HENRIQUES等[17]利用Hp感染的C57BL/6小鼠评价不同规格乙酰化壳聚糖微球对Hp感染的缓解效果,对感染小鼠胃组织病理学切片进行观察发现,在经过Hp感染后,小鼠胃黏膜上皮结构紊乱,并出现可见的炎性细胞浸润,这与本研究出现的病理结果相似。如图2所示,低分子质量HA没有改善这一情况,而PPI组、中分子质量和高分子质量HA组小鼠胃黏膜与正常对照组类似,基本没有炎症细胞浸润情况,这进一步证明了中分子质量和高分子质量HA能够对Hp感染引起的炎症反应有一定的缓解效果。杭兴伟等[18]的研究证明,透明质酸能够抑制炎性细胞的趋化及移动,表明透明质酸具有缓解炎症的作用,这与本文研究结果基本一致。

A-空白组;B-造模组;C-PPI干预组;D-低分子质量HA组; E-中分子质量HA组;F-高分子质量HA组
图2 HA对小鼠胃黏膜的影响
Fig.2 Effects of HAs on Gastric mucosa of mice
2.3 高分子质量HA与乳杆菌复配对感染小鼠胃部Hp定殖量的影响
诸多研究证明,鼠李糖乳杆菌、植物乳杆菌、罗伊氏乳杆菌及干酪乳杆菌等多种乳杆菌具有拮抗Hp的作用。张美怡[12]研究了多种乳杆菌在体外缓解幽门螺杆菌的作用,证明鼠李糖乳酪杆菌CCFM1259在体外能够拮抗Hp,存在临床上拮抗幽门螺杆菌的潜能。前面的研究已经证明,高分子质量HA能够降低Hp感染小鼠体内Hp定殖量,减轻感染小鼠胃部炎症。为了探究HA与乳杆菌的协同效果,将高分子质量HA与鼠李糖乳酪杆菌CCFM1259复配,利用Hp感染动物模型探究复配组方对Hp的缓解作用。如图3所示,造模组小鼠体内Hp含量显著高于空白组,在鼠李糖乳酪杆菌CCFM1259与高分子质量HA干预后,感染小鼠体内Hp含量得到了显著降低。

图3 HA-益生菌组合物对胃部Hp定殖量的影响
Fig.3 Effects of HA-probiotic compounds on Hp Colonization in the stomach

A-空白组;B-造模组;C-复配组
图4 HA-益生菌组合物对小鼠胃黏膜的影响
Fig.4 Effects of HA-probiotic compounds on Gastric mucosa of mice
注:HE染色(200×)。
2.4 高分子质量HA与乳杆菌复配对感染小鼠胃部病理学切片的影响
观察乳杆菌与高分子质量HA干预后Hp感染小鼠胃部组织切片。在经过Hp感染后,小鼠胃部组织出现了明显的黏膜脱落,与上述实验结果一致,在经过Hp感染后,小鼠胃组织中出现明显的炎性浸润,且这种炎性浸润作用在经过鼠李糖乳酪杆菌CCFM1259与高分子质量HA复配组方干预后获得了一定的缓解。因此,鼠李糖乳酪杆菌CCFM1259与高分子质量HA复配能够显著降低Hp定殖量,缓解因Hp感染引发的胃部炎症,具有较好拮抗Hp的潜力。
2.5 临床试验受试者基本信息
基于上述动物实验研究结果,对具有较好表现的鼠李糖乳酪杆菌CCFM1259与高分子质量HA复配组方(AbateHPTM)进行临床干预,评价其临床功效。实验共招募60名符合条件的受试者,最终有48人完成了本次研究。具体实验完成情况如图5所示。

图5 临床试验完成情况
Fig.5 Completion of clinical trials
完成实验的48名受试者的基本信息如表3所示。在完成实验的48名受试者中,各组之间的年龄无统计学上的差异性,具有可比性。
表3入组受试者基本信息
Table 3 Basic information of the enrolled subjects

组别人数男/女年龄/岁安慰剂组165/1153.69±16.87HA组155/1049.56±13.40复配组176/1143.24±8.73
2.6 高分子质量HA与鼠李糖乳酪杆菌CCFM1259复配对受试者转阴率及有效率的影响
临床上经常使用14C呼气检测的方法来诊断受试者是否存在Hp感染。有研究表明,呼气试验可以反映受试者体内Hp的密度[19],因此,在受试者在实验开始前一天及结束后一天进行14C呼气实验以检测在经过干预后受试者体内Hp的变化情况。表4反映了HA及复配组方干预后受试者转阴率的变化情况。在完成实验的48人中,安慰剂组的16人中有5名受试者转为阴性,转阴率为31.25%,而HA组的15人中,有8名受试者转为阴性,转阴率为53.33%,为安慰剂组的2倍,表明经过HA干预可以降低Hp患者体内Hp定殖密度。在复配组的17人中有11人转变为阴性,转阴率为64.71%,略高于HA组,表明HA与鼠李糖乳酪杆菌CCFM1259联合使用具有协同增效的效果。以上实验结果说明,HA及复配组方均能够降低Hp阳性患者体内Hp的定殖密度,复配组方的拮抗效果略高于单摄入透明质酸。HOLZ等[20]的一项随机临床试验探究了具有Hp共聚能力的罗伊氏乳杆菌对Hp阳性患者的影响,与本实验结果相似,在经过罗伊氏乳杆菌干预后,受试者体内Hp定殖量也表现出显著降低。
表4 HA-益生菌对Hp根除率的影响
Table 4 Effects of HA-probiotic compounds on eradication rates of Hp

组别人数阴性阳性转阴率/%安慰剂组1651131.25HA组 158753.33复配组 1711664.71
为更加直观地观察各组干预对受试者体内Hp变化的影响,定义受试者在干预前后14C呼气值下降超过100为有效,对各组受试者进行有效人数统计,计算有效率。如表5所示,在经过安慰剂干预后,16名受试者中有6名受试者在干预前后呼气值下降超过100,有效率为37.50%,而在15名受试者的HA组及17名受试者的复配组中,分别有10名和13名受试者在干预前后呼气值降低超过了100,有效率分别为66.67%和76.47%,表明HA及复配组方干预均能有效拮抗Hp感染,且复配组方的拮抗效果略高于单摄入透明质酸。
表5 HA-益生菌组合物对Hp感染的拮抗作用
Table 5 Antagonistic effects of HA-probiotic compounds on Hp infection
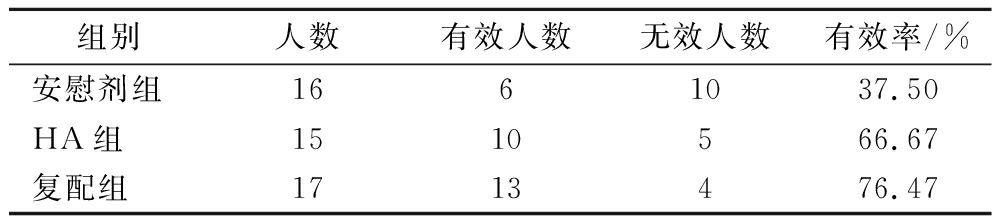
组别人数有效人数无效人数有效率/%安慰剂组1661037.50HA组1510566.67复配组1713476.47
2.7 高分子质量HA与鼠李糖乳酪杆菌CCFM1259复配对受试者血常规及血生化指标的影响
为了进一步测定HA及复配组干预对受试者基本生理状态的影响,对受试者在干预前后进行血常规及血液生化检测。受试者在实验开始前一天及结束后一天抽取空腹肘静脉血进行血常规及肝脏、肾脏相关血液生化指标检测,检测结果如图6所示。在经过HA或复配组方干预后,受试者白细胞、红细胞、血小板及血红蛋白浓度等血常规基本指标并未发生显著变化,肝功能相关血液生化指标谷草转氨酶、总胆红素及肾脏相关指标尿素氮等也未发生明显改变,说明HA及复配组方干预并不会对受试者肝脏及肾脏相关指标产生明显影响。MEHLING等[21]探究了罗伊氏乳杆菌DSM17648干预对Hp感染阳性患者的影响,结果表明经过罗伊氏乳杆菌DSM17648干预并不会对Hp感染阳性患者血常规及血液生化指标产生不利影响,这与本文的研究结果基本一致。

a-白细胞;b-红细胞;c-血红蛋白浓度;d-血小板;e-碱性磷酸酯酶;f-谷草转氨酶;g-总胆红素;h-谷胱甘肽还原酶;i-尿素氮
图6 干预对受试者血常规及血生化指标的影响
Fig.6 Effects of intervention on blood routine and blood biochemical indexes of subjects
3 结论
前期研究表明,鼠李糖乳酪杆菌CCFM1259在体外具有拮抗幽门螺杆菌的作用,主要表现在能够显著抑制Hp生长以及抑制Hp与AGS细胞的黏附。动物实验结果证明,单使用高分子质量HA或者使用高分子质量HA与鼠李糖乳酪杆菌CCFM1259复配均能够显著降低感染小鼠体内Hp定殖量,减轻小鼠因Hp感染引起的胃部炎症。进一步的临床试验结果表明,HA及复配组方干预均提高了受试者Hp转阴率及有效率,特别是在复配组方干预后,并且干预未发现对受试者基本生理状态产生影响。
[1] MARSHALL B, WARREN J R.Unidentified curved bacilli in the stomach of patients with gastritis and peptic ulceration[J].The Lancet, 1984, 232(8390):1311-1315.
[2] AMIEVA M, PEEK JR R M.Pathobiology of Helicobacter pylori-induced gastric cancer[J].Gastroenterology, 2016, 150(1):64-78.
[3] LANAS A, CHAN F K L.Peptic ulcer disease[J].The Lancet, 2017, 390(10094):613-624.
[4] DU L J, CHEN B R, KIM J J, et al.Helicobacter pylori eradication therapy for functional dyspepsia:Systematic review and meta-analysis[J].World Journal of Gastroenterology, 2016, 22(12):3486-3495.
[5] HOOI J K Y, LAI W Y, NG W K, et al.Global prevalence of Helicobacter pylori infection:Systematic review and meta-analysis[J].Gastroenterology, 2017, 153(2):420-429.
[6] OHNISHI N, YUASA H, TANAKA S, et al.Transgenic expression of Helicobacter pylori CagA induces gastrointestinal and hematopoietic neoplasms in mouse[J].Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(3):1003-1008.
[7] CHEY W D, LEONTIADIS G I, HOWDEN C W, et al.ACG clinical guideline:Treatment of Helicobacter pylori infection[J].American Journal of Gastroenterology, 2017, 112(2):212-239.
[8] CHEN L Y, XU W L, LEE A, et al.The impact of Helicobacter pylori infection, eradication therapy and probiotic supplementation on gut microenvironment homeostasis:An open-label, randomized clinical trial[J].EBioMedicine, 2018, 35:87-96.
[9] 张美怡, 翟齐啸, 赵建新, 等.鼠李糖乳杆菌JS-SZ-2-1抗幽门螺杆菌感染的临床效果评价[J].食品与发酵工业, 2020, 46(23):29-34.
ZHANG M Y, ZHAI Q X, ZHAO J X, et al.Clinical efficacy evaluation of Lactobacillus rhamnosus JS-SZ-2-1 against Helicobacter pylori infection[J].Food and Fermentation Industries, 2020, 46(23):29-34.
[10] ZHENG X L, WANG B T, TANG X, et al.Absorption, metabolism, and functions of hyaluronic acid and its therapeutic prospects in combination with microorganisms:A review[J].Carbohydrate Polymers, 2023, 299:120153.
[11] 黄佳星, 刘语菲, 冯丽安, 等.透明质酸水凝胶在组织修复中的应用[J].离子交换与吸附, 2022, 38(1):87-94.
HUANG J X, LIU Y F, FENG L A, et al.Application of hyaluronic acid hydrogel in tissue engineering[J].Ion Exchange and Adsorption, 2022, 38(1):87-94.
[12] 张美怡. 具有抗幽门螺杆菌感染作用乳杆菌的筛选及其临床效果评价[D].无锡:江南大学,2020.
ZHANG M Y.Screening and clinical functional evaluation of Lactobacillus strains for their anti-Helicobacter pylori effects[D].Wuxi:Jiangnan University, 2020.
[13] HONG S S, LEE H A, KIM J Y, et al. In vitro and in vivo inhibition of Helicobacter pylori by Lactobacilllus paracasei HP7[J].Laboratory Animal Research, 2018, 34(4):216-222.
[14] 闫宗宝, 毛方圆, 单治国, 等.幽门螺杆菌感染对胃黏膜上皮细胞REDD1表达的影响及调控机制[J].陆军军医大学学报, 2022, 44(5):413-420.
YAN Z B, MAO F Y, SHAN Z G, et al.Effect and mechanism of H.pylori in regulation of REDD1 expression in gastric mucosa[J].Journal of Army Medical University, 2022, 44(5):413-420.
[15] 刘阳. Akkermansia muciniphila菌对肠道屏障的调节作用及相关基因研究[D].无锡:江南大学,2021.
LIU Y.The research on the regulation of Akkermansia muciniphila strains on intestinal barrier and related functional genes[D].Wuxi:Jiangnan University, 2021.
[16] SOUISSI S, MAKNI C, BELHADJ AMMAR L, et al.Correlation between the intensity of Helicobacter pylori colonization and severity of gastritis:Results of a prospective study[J].Helicobacter, 2022, 27(4):e12910.
[17] HENRIQUES P C, COSTA L M, SEABRA C L, et al.Orally administrated chitosan microspheres bind Helicobacter pylori and decrease gastric infection in mice[J].Acta Biomaterialia, 2020, 114:206-220.
[18] 杭兴伟, 增田泰伸, 木村守, 等.硫酸氨基葡萄糖对口服透明质酸缓解小鼠佐剂性关节炎的增效作用[J].食品科学, 2015, 36(5):189-194.
HANG X W, YASUNOBU M, MAMORU K, et al.Synergism of glucosamine sulfate in relieving effect of hyaluronic acid by oral administration on mice with adjuvant arthritis[J].Food Science, 2015, 36(5):189-194.
[19] PATEL S K.Diagnosis of Helicobacter pylori:What should be the gold standard?[J].World Journal of Gastroenterology, 2014, 20(36):12847.
[20] HOLZ C, BUSJAHN A, MEHLING H, et al.Significant reduction in Helicobacter pylori load in humans with non-viable Lactobacillus reuteri DSM17648:A pilot study[J].Probiotics and Antimicrobial Proteins, 2015, 7(2):91-100.
[21] MEHLING H, BUSJAHN A.Non-viable Lactobacillus reuteri DSMZ 17648 (pylopassTM) as a new approach to Helicobacter pylori control in humans[J].Nutrients, 2013, 5(8):3062-3073.