多糖凝胶在食品质量改进、热量控制和营养改善等方面扮演着重要角色,因此在食品工业中具有广阔的应用前景。魔芋葡甘露聚糖(konjac glucomannan,KGM)是来自魔芋根茎的一种中性杂多糖,其在碱存在下加热能脱除乙酰基生成热不可逆凝胶,但该凝胶的颜色褐变严重且具有碱的苦涩味[1]。当前研究发现,脱乙酰魔芋葡甘露聚糖(deacetylated konjac glucomannan,DKGM)在一定脱乙酰度和浓度下经加热可自聚集形成凝胶,与加碱凝胶相比,其颜色和风味能得到改善。但是DKGM的吸水性、溶解性和黏稠性随脱乙酰度的增加而降低,这将对DKGM的益生性和所制备凝胶的品质产生不利影响[2]。氧化魔芋葡甘露聚糖(oxidized konjac glucomannan,OKGM)是KGM氧化降解的产物,具有醛基或羧基等亲水基团,能制备溶胀率高、吸水性强的医用敷料水凝胶,且其较小的分子质量还能在凝胶网络中发挥填充作用以增强凝胶性能[3]。本实验室采用微波-臭氧法制备的OKGM解决了化学氧化试剂残留的问题,具有绿色安全性,能满足健康食品的要求[4]。田红媚等[5]将该OKGM 应用于面制品中,发现其可提高面粉的吸水率、增强贮藏期间面包的保水性和抑制有害微生物的生长繁殖。不过当前探究OKGM对DKGM凝胶特性影响的研究还未有报道。
鉴于OKGM对DKGM功能活性和性质上可能存在的潜在互补性[6],本实验将两者共混并通过分析检测复合凝胶的持水性、凝胶强度、冻融稳定性、溶胀率、质构特性、流变学特性和微观结构,探讨不同氧化程度的OKGM对DKGM凝胶性能的影响,以期为OKGM在凝胶食品中的应用提供一定的理论指导。
1 材料与方法
1.1 实验材料
纯化魔芋精粉(纯度>95%),湖北十堰花仙子魔芋制品有限公司。
1.2 仪器与设备
FL-815Y臭氧消毒机,深圳市飞立电器科技有限公司;XH-300B微波超声波组合催化/合成萃取仪,北京祥鸽科技发展有限公司;TA-XT plus质构仪,英国Stable Micro Systems公司;DHR-1流变仪,美国TA公司;LGJ-10型冷冻干燥机,北京松源华兴科技有限公司;AXTG16G型离心机,盐城市安信实验仪器有限公司;Spectrum100红外光谱仪,美国Perking Elmer公司;Phenom Pro扫描电镜,荷兰Phenom World公司。
1.3 实验方法
1.3.1 DKGM的制备和脱乙酰度测定
参考官孝瑶等[7]的方法并稍作修改。将含有12 g KGM和360 mL 30%(体积分数)乙醇溶液的混合体系在50 ℃下搅拌30 min,然后加入26 mL 0.1 mol/L的NaOH溶液继续搅拌30 min进行脱乙酰反应,反应结束后经梯度乙醇溶液(50%、75%、95%和100%,体积分数)脱水,最后真空冷冻干燥得到DKGM。按XIAO等[8]的方法测得该DKGM的脱乙酰度为66.81%。
1.3.2 OKGM的制备和分子质量测定
根据LI等[4]的方法并稍作修改。准确称取3.0 g KGM均匀分散至装有300 mL蒸馏水的三口烧瓶中,30 ℃水浴1 h。设置微波功率500 W,恒定温度65 ℃,同时通入臭氧(15 g/h),处理一定时间得到悬浮液,将其醇沉后真空冷冻干燥12 h,粉碎研磨后得到OKGM粉末。根据处理时间0、30、60、90、120 min分别标记样品为K、O-30、O-60、O-90和O-120。同时根据LI等[4]的方法测得K、O-30、O-60、O-90和O-120的分子质量分别为1.78×106、1.48×105、2.60×104、1.28×104、1.06×104 Da。
1.3.3 DKGM-OKGM复合凝胶的制备
准确称取3.60 g DKGM和0.40 g OKGM,将两者同时缓慢倒进装有96 mL蒸馏水的烧杯中,搅拌至均匀分散后在50 ℃水浴中溶胀1 h,然后再90 ℃加热2 h,最后冷却至室温得到DKGM-OKGM复合凝胶备用。将添加K、O-30、O-60、O-90、O-120的复合凝胶分别命名为D-K、D-O-30、D-O-60、D-O-90、D-O-120。以不添加OKGM的凝胶作为空白并命名为D。
1.3.4 白度
参考HOU等[9]的方法并稍作修改。将3 cm厚的凝胶样品置于白色A4纸上,仪器经白板校正后测定色泽参数(L*、a*、b*值)。根据公式(1)计算白度值(W):
(1)
1.3.5 凝胶强度
参考杨悦等[10]的方法并稍作修改。选择质构分析(texture profile analysis,TPA)压缩模式,P/0.5探头,设置测前速度:1.5 mm/s,测中和测后速度:1 mm/s,压缩距离为10 mm。
1.3.6 持水性
参考范盛玉等[11]的方法并稍作修改。将复合凝胶样品切成3 mm×3 mm×3 mm大小的均匀颗粒,称取1.0 g样品于离心管中,12 000 r/min离心20 min,结束后用滤纸拭干外部水分并称重。根据公式(2)计算持水力:
持水力![]()
(2)
式中:m1,离心前样品质量,g;m2,离心后样品质量,g。
1.3.7 溶胀率
参考YANG等[12]的方法并稍作修改。称取3.0 g复合凝胶样品放入装有50 mL磷酸盐缓冲液(0.1 mol/L,pH 7.0)的离心管中,于25 ℃溶胀24 h后取出,拭干表面水分后称重。根据公式(3)计算溶胀率:
溶胀率![]()
(3)
式中:m1,溶胀前复合凝胶的质量,g;m2,溶胀后复合凝胶的质量,g。
1.3.8 冻融稳定性
根据冻融循环期间凝胶的脱水收缩率来确定冻融稳定性。称取15.0 g凝胶样品于离心管中,然后在-18 ℃下冷冻22 h后于30 ℃水浴解冻2 h算作一个循环,最多循环5次,然后样品以3 000 r/min离心10 min,拭干样品表面水分后称重[12]。根据公式(4)计算脱水率:
脱水率![]()
(4)
式中:m0,空离心管的质量,g;mn,离心前凝胶质量,g;mn′,离心后凝胶的质量,g;n,冻融循环的次数。
1.3.9 质构
参考TONG等[13]的方法稍作修改。选择TPA模式,P/0.5探头,设置测试速度1 mm/s,压缩形变50%,触发力5 g。
1.3.10 动态流变学特性
动态流变测定选择PP25平板,平板间隙2 mm,应变为0.6%,加载样品后去除平板边缘多余样品,再沿平板边缘涂抹二甲基硅油,防止试验过程中水分蒸发[10]。
频率扫描:设定温度25 ℃,平衡2 min后在0.1~100 rad/s角频率下进行扫描,观察样品储能模量(G′)和损耗模量(G″)对频率的依赖性。
温度扫描:设置温度从25 ℃升至90 ℃,升温速率为5 ℃/min,监测样品G′和G″随温度变化的趋势。
1.3.11 红外光谱分析
将冷冻干燥的凝胶样品研磨并过200目筛,取适量样品进行测定,以空气为背景扫描,设置光谱扫描范围为4 000~600 cm-1,分辨率为32 cm-1[14]。
1.3.12 扫描电镜(scanning electron microscope,SEM)观察
取0.5 cm厚的冷冻干燥凝胶样品,在载样台上固定并喷金进行观测,记录放大倍数为300的图像[15]。
1.4 数据处理与分析
实验重复3次,结果以平均值±标准偏差表示。采用SPSS 26.0对实验数据进行方差分析,Origin 2021b作图。
2 结果与分析
2.1 表观形态及白度
图1-a显示了DKGM-OKGM复合凝胶的表观形态。单一DKGM凝胶和添加OKGM的复合凝胶均形成了形态完整、表面光滑、质地紧实的白色固体凝胶。图1-b显示了DKGM-OKGM复合凝胶的白度。各凝胶组的白度在13.86~9.68,添加OKGM的复合凝胶与D组凝胶相比白度显著降低,说明OKGM对DKGM凝胶的颜色略有不利影响。

a-表观状态;b-凝胶白度
图1 DKGM-OKGM复合凝胶的表观状态及凝胶白度
Fig.1 The appearanceand whiteness of DKGM-OKGM composite gels
注:不同字母表示差异显著(P<0.05)(下同)。
2.2 凝胶强度
凝胶强度取决于物质的分子质量和它们之间的相互作用[16]。如图2所示,与D组相比,D-K和D-O-30组的凝胶强度分别减小15.12、8.44 g/cm2。这一方面可能是因为KGM和O-30分子较大的分子质量会妨碍体系中规整有序的凝胶网络结构的形成;另一方面可能是因为KGM分子和O-30分子上乙酰基产生的空间位阻效应会阻碍DKGM分子之间的缠结聚集,破坏体系中的凝胶网络结构,导致复合凝胶的凝胶强度减弱[17-18]。D-O-60、D-O-90和D-O-120组的凝胶强度分别为155.56、154.11、156.49 g/cm2,均高于D组凝胶。这一方面可能归因于O-60、O-90和O-120分子能利用其分子质量小的优势发挥填充作用以增强凝胶网络结构的紧密性;另一方面可能归因于O-60、O-90和O-120分子上的乙酰基数量少,产生的空间位阻效应弱,分子链的有序性增大,与DKGM分子纠缠聚集的机率增加,从而有利于形成稳定的凝胶网络结构,使得复合凝胶的凝胶强度增强[19-20]。
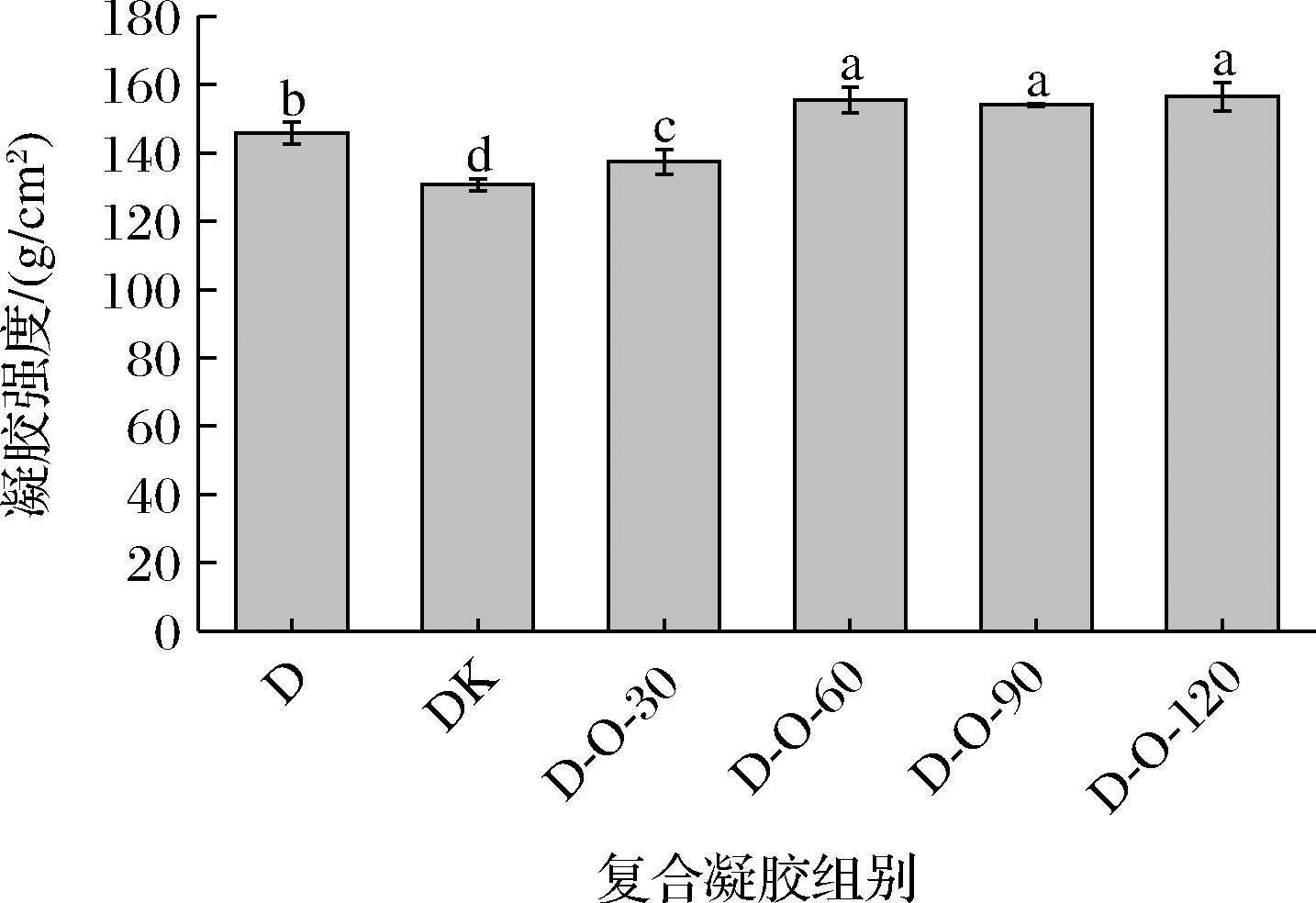
图2 DKGM-OKGM复合凝胶的凝胶强度
Fig.2 Gel strength of DKGM-OKGM composite gels
2.3 持水性
如图3所示,各组复合凝胶的持水性均在98%以上,相互之间没有显著性差异,都表现出优良的持水性。许多研究都表明凝胶强度对凝胶的持水性有着密切的影响[10,12],但具有低凝胶强度的D-K组凝胶的持水性却与其他凝胶没有差别,这可能是因为KGM本身结合水的能力强[21]。
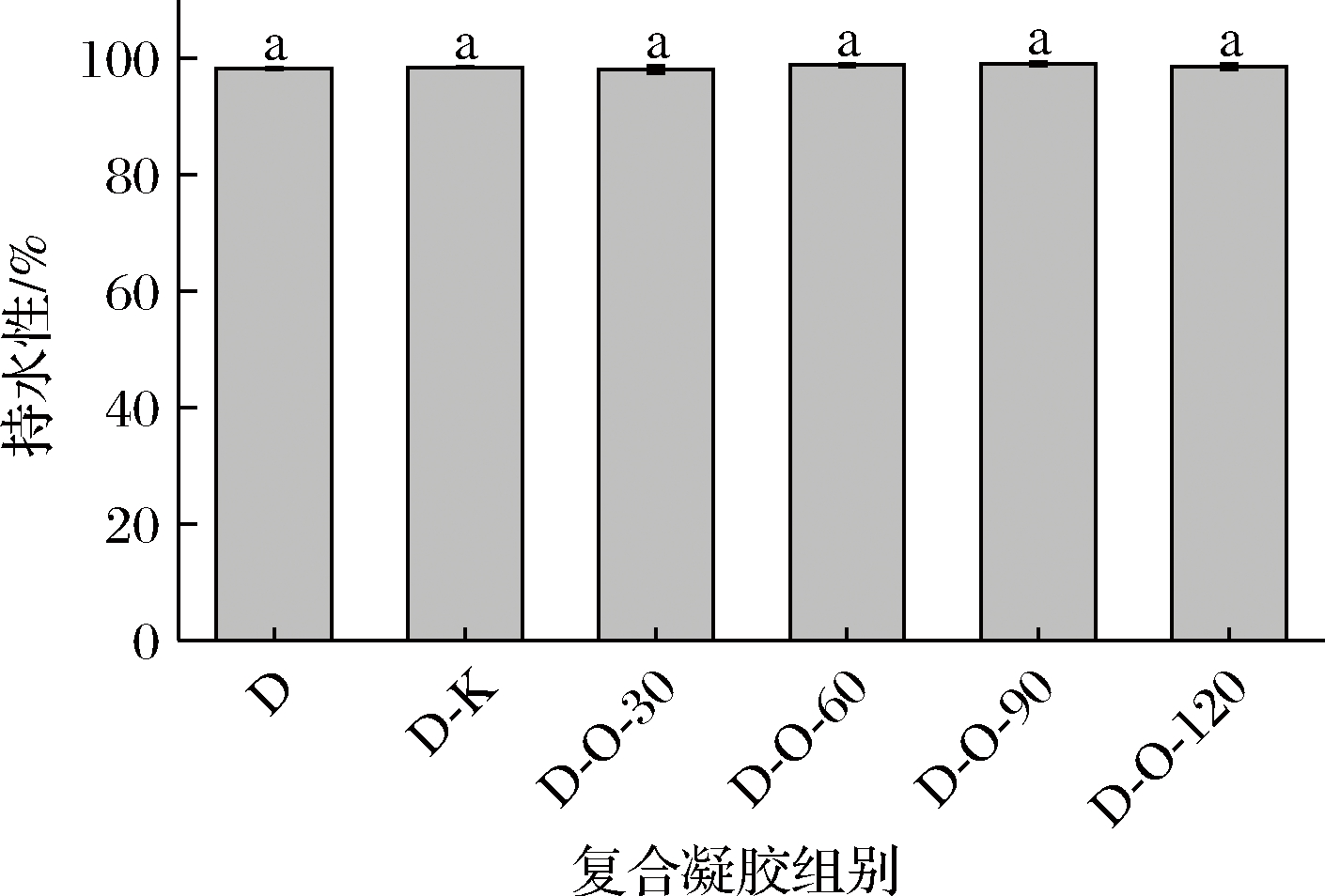
图3 DKGM-OKGM复合凝胶的持水性
Fig.3 Water holding capacity of DKGM-OKGM composite gels
2.4 溶胀率
凝胶的溶胀率受凝胶物质的亲水性和疏水性等固有性质的影响[3]。如图4所示, D组的溶胀率为15.96%,低于其余凝胶组,这可能是由于去除部分乙酰基后的DKGM疏水性增强[20]。D-K组的溶胀率为28.20%,高于其余凝胶组,这可能是由于KGM本身具有较强的亲水性[21],能促使凝胶对缓冲液的吸收,从而提高凝胶的溶胀率。D-O-30、D-O-60、D-O-90和D-O-120组的溶胀率介于D组和D-K组之间,这是由于OKGM分子上减少的乙酰基数量和增加的羧基亲水基团共同作用的结果[4]。
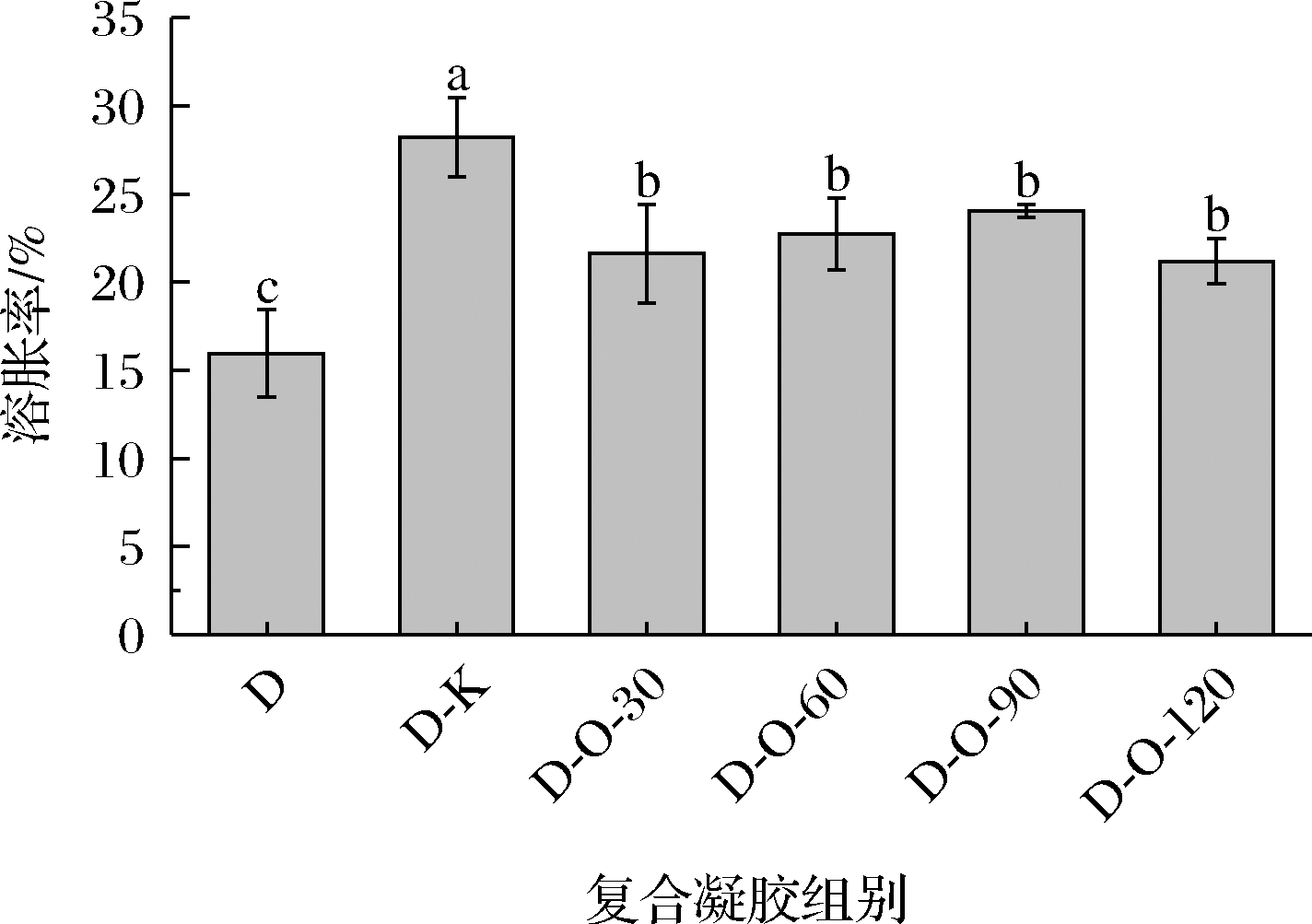
图4 DKGM-OKGM复合凝胶的溶胀率
Fig.4 Swelling capacity of DKGM-OKGM composite gels
2.5 冻融稳定性
如图5所示,所有凝胶样品的脱水率随着冻融循环次数的增加而增加,表明凝胶网络结构被逐渐破坏。这是由于在冻融循环过程中形成或再生的冰晶会刺穿或损坏初始凝胶网络,产生大的孔洞[12]。与D组相比,OKGM降低了复合凝胶的脱水率,说明OKGM能增强凝胶的冻融稳定性。其中,D-O-120组和D-K组的冻融稳定性最好。对于D-O-120组凝胶来说,这归因于O-120的分子质量低,在体系中具有可忽略的空间位阻,从而易与冰晶结合并限制冰晶在某些方向上的生长[22]。对于D-K组凝胶而言,这可能是因为KGM分子链上的大量羟基通过氢键与水分子结合,从而减少了复合凝胶在冻融循环过程中的水分流失[21]。

图5 DKGM-OKGM复合凝胶的冻融稳定性
Fig.5 Freeze-thaw stability of DKGM-OKGM composite gels
2.6 质构特性
质构特性能从多个维度对凝胶品质进行客观评价。硬度是指在牙齿之间或舌与颚之间压缩样品所用的力[10]。如表1所示,添加OKGM能降低凝胶的硬度,并在D-O-30组获得最小硬度值(292.18 g)。弹性可用于模拟样品在齿间压缩后恢复到原来形状的程度[23]。从表1可知,D-K组的弹性为0.92,与D组的弹性没有显著性差异;D-O-30、D-O-60、D-O-90和D-O-120组的弹性分别为0.98、097、0.98、0.97,各组弹性相互之间没有显著性差异,但是都显著高于D组凝胶,说明适度氧化的OKGM可以增强DKGM凝胶的弹性。内聚性可用于模拟食物被牙齿咀嚼之前的压缩程度,能反映样品内部的紧密程度[23]。从表1可以看出,OKGM凝胶的内聚性随OKGM氧化程度的增加而增大,并在D-O-120组获得最大内聚性,说明OKGM对凝胶内部紧密程度具有调节作用。咀嚼性是指为抵抗来自食物的持续弹性阻力而费力咀嚼其至可吞咽时所需的能量[15]。D-O-30组的咀嚼性比D组减小了84.04,表现出显著性差异;D-O-120组的咀嚼性与D组相比没有显著性差异,说明OKGM的氧化程度对DKGM凝胶的咀嚼性具有很大影响。综上,说明可以通过控制OKGM氧化程度来调节DKGM凝胶的硬度、咀嚼性等质构特性,为开发硬度适宜,利于咀嚼吞咽的相关食品提供参考。
表1 DKGM-OKGM复合凝胶的质构特性
Table 1 Texture characteristics of DKGM-OKGM composite gels
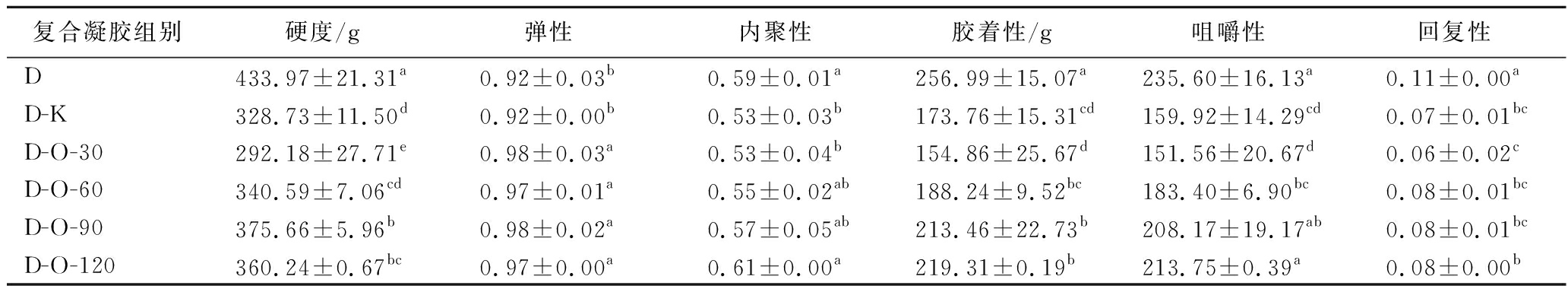
复合凝胶组别硬度/g弹性内聚性胶着性/g咀嚼性回复性D433.97±21.31a0.92±0.03b0.59±0.01a256.99±15.07a235.60±16.13a0.11±0.00aD-K328.73±11.50d0.92±0.00b0.53±0.03b173.76±15.31cd159.92±14.29cd0.07±0.01bcD-O-30292.18±27.71e0.98±0.03a0.53±0.04b154.86±25.67d151.56±20.67d0.06±0.02cD-O-60340.59±7.06cd0.97±0.01a0.55±0.02ab188.24±9.52bc183.40±6.90bc0.08±0.01bcD-O-90375.66±5.96b0.98±0.02a0.57±0.05ab213.46±22.73b208.17±19.17ab0.08±0.01bcD-O-120360.24±0.67bc0.97±0.00a0.61±0.00a219.31±0.19b213.75±0.39a0.08±0.00b
2.7 流变学特性
储能模量(G′)又称弹性模量,反映聚合物的弹性和类固体性质。损耗模量(G″)又称黏性模量,反映聚合物的黏性和类液体性质[24]。图6-a表示在25 ℃下,各凝胶组的G′和G″对角频率的依赖性。在整个角频率范围内,各凝胶组的G′均大于G″,在体系中处于主导地位,凝胶表现出典型的类固体性质[25]。随着频率的增加,所有凝胶的G′和G″均快速增大,强烈的频率依赖性说明所有凝胶均是由非共价键相互作用形成的弱物理凝胶[26]。同一角频率下,随着OKGM氧化程度的增加,G′和G″均减小,说明OKGM的氧化程度对DKGM凝胶的弹性有较大影响。凝胶黏弹性下降的原因可能是因为OKGM分子的分子质量随氧化程度加剧而减小,使得它们伸展后仅有较短的自由线链用于凝胶缠结[17]。

a-角频率扫描;b-温度
图6 DKGM-OKGM复合凝胶的动态流变曲线
Fig.6 The dynamic flow curve of DKGM-OKGM composite gels
如图6-b所示,在25~90 ℃内对各凝胶样品进行温度扫描,进而探究凝胶G′和G″的温度依赖性。在整个温度范围内,所有凝胶的G′和G″均随温度的升高呈现先减小后增大的趋势。这是由于温度从25 ℃缓慢升高时,凝胶分子链之间的氢键被破坏,同时又不足以产生强烈交联,因此导致G′和G″先逐渐减小;升至较高温度时,分子链的运动加剧,疏水相互作用增强,形成更多的缠结,从而引起G′和G″急剧增加[14]。在整个温度范围内,各凝胶组之间也存在明显不同。OKGM的加入使得各凝胶组的G′在加热过程中获得最小值时所对应的温度增大,说明OKGM的加入能促进凝胶中氢键的形成,这可能是因为分子上乙酰基数量的差异[27]。
2.8 红外光谱分析
对凝胶样品进行红外光谱分析,以进一步了解DKGM和OKGM之间潜在的分子相互作用。不同氧化程度OKGM凝胶的红外光谱如图7所示。所有凝胶的红外谱图均展现出相似频率和形状的吸收峰,仅在吸收峰峰强和峰宽上稍有差异。在3 344 cm-1处的宽峰表示分子间和分子内—OH的伸缩振动,与D组凝胶相比,复合凝胶在此处的吸收峰强度略有增强,说明DKGM和OKGM分子链之间存在通过氢键形成的相互作用[28]。1 726 cm-1左右出现的峰是由—CHO的—C![]() O基团引起,表明分子内乙酰基的存在[29],OKGM的加入引起此处峰强的略微增强。1 638 cm-1处的吸收峰归因于分子内氢键,OKGM的加入使得凝胶在此处的峰稍有变宽,说明分子内氢键增强[30]。各凝胶组之间基团的峰强和峰宽差异又反过来对凝胶的流变学特性(图6)产生一定影响。
O基团引起,表明分子内乙酰基的存在[29],OKGM的加入引起此处峰强的略微增强。1 638 cm-1处的吸收峰归因于分子内氢键,OKGM的加入使得凝胶在此处的峰稍有变宽,说明分子内氢键增强[30]。各凝胶组之间基团的峰强和峰宽差异又反过来对凝胶的流变学特性(图6)产生一定影响。
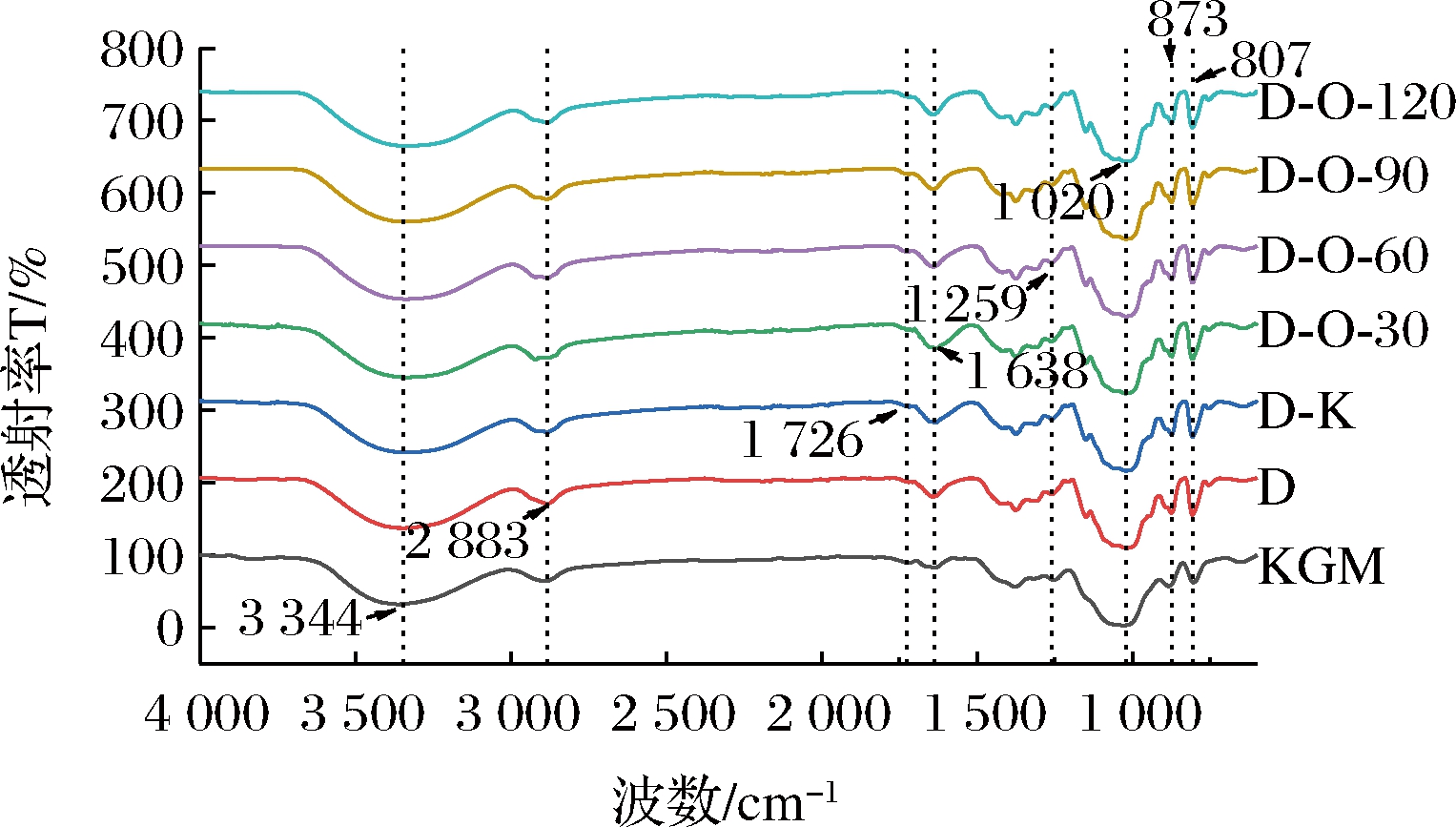
图7 DKGM-OKGM复合凝胶的红外光谱图
Fig.7 The infrared spectroscopy of DKGM-OKGM composite gels
2.9 SEM分析
采用SEM观察不同氧化程度OKGM对DKGM凝胶三维网络结构的影响,结果如图8所示。各组凝胶的空间网络结构均呈排列良好的带孔三维片层网络结构,并表现出多孔和疏松的状态。相较于D组凝胶、D-K组和D-O-30组的凝胶片层结构之间的间隙增大,同时还产生一些较大的空腔,这可能是由于低氧化程度的OKGM分子质量相对更大,会破坏凝胶网络的有序性[18]。D-O-60、D-O-90和D-O-120组的凝胶片层结构之间的距离缩短,片层内孔洞尺寸减小且分布更均匀。这既是因为高氧化程度的OKGM分子的分子质量小,在凝胶网络中能起到填充作用,也是因为高氧化程度的OKGM分子上减少的乙酰基可减弱分子间和分子内的空间位阻效应,促进分子间的缔合,使得凝胶网络结构更致密有序[24]。各凝胶组的凝胶网络结构差异又反过来对凝胶强度(图2)产生一定影响。

图8 DKGM-OKGM复合凝胶的SEM图(300×)
Fig.8 SEM of DKGM-OKGM composite gels(300×)
3 结论
本研究通过凝胶持水性、质构、流变特性、红外光谱等指标表征了不同氧化程度OKGM与DKGM复合凝胶的性质。研究表明,与空白组相比,OKGM能降低凝胶的白度,提高其溶胀率和冻融稳定性;OKGM能降低凝胶的硬度,D组和D-K组的弹性高于其余组,D-O-30组的咀嚼性最小;D-O-60、D-O-90和D-O-120组的凝胶强度显著提高;流变特性表明复合凝胶属于弱凝胶。上述结果说明OKGM可改善DKGM的凝胶特性。红外光谱及SEM分析表明,复合凝胶特性的改善与OKGM改变了体系中氢键的作用强度和凝胶网络结构的片层距离及孔洞大小有关。综上,可根据实际生产需要,选择不同氧化程度的OKGM对DKGM凝胶的性能进行适当调整。
[1] MANZOOR A, DAR A H, PANDEY V K, et al.Recent insights into polysaccharide-based hydrogels and their potential applications in food sector:A review[J].International Journal of Biological Macromolecules, 2022, 213:987-1006.
[2] DU X Z, LI J, CHEN J, et al.Effect of degree of deacetylation on physicochemical and gelation properties of konjac glucomannan[J].Food Research International, 2012,46(1):270-278.
[3] LI G Y, JIANG Y C, LI M Y, et al.Investigation on the tunable effect of oxidized konjac glucomannan with different molecular weight on gelatin-based composite hydrogels[J].International Journal of Biological Macromolecules, 2021, 168:233-241.
[4] LI Y, LIU H B, XIE Y, et al.Preparation, characterization and physicochemical properties of konjac glucomannan depolymerized by ozone assisted with microwave treatment[J].Food Hydrocolloids, 2021, 119:106878.
[5] 田红媚, 谢勇, 龙明秀, 等.氧化魔芋葡甘聚糖对面团特性及面包品质的影响[J/OL].2022.DOI:10.13995/j.cnki.11-1802/ts.030487.
TIAN H M, XIE Y, LONG M X, et al.Effect of oxidized konjac glucomannan on dough properties and bread quality[J/OL].Food and Fermentation Industries, 2022.DOI:10.13995/j.cnki.11-1802/ts.030487.
[6] SRIVASTAVA N, ROY CHOUDHURY A.Recent advances in composite hydrogels prepared solely from polysaccharides[J].Colloids and Surfaces B:Biointerfaces, 2021, 205:111891.
[7] 官孝瑶, 谢勇, 陈朝军, 等.不同脱乙酰度魔芋葡甘露聚糖对面团特性和面包品质的影响[J].食品与发酵工业, 2023,49(9):221-228.
GUAN X Y, XIE Y, CHEN Z J, et al.Effects of konjac glucomannan with different degrees of deacetylation on dough properties and bread quality[J].Food and Fermentation Industries, 2023,49(9):221-228.
[8] XIAO M, DAI S H, WANG L, et al.Carboxymethyl modification of konjac glucomannan affects water binding properties[J].Carbohydrate Polymers, 2015, 130:1-8.
[9] HOU Y, LIU H S, ZHU D, et al.Influence of soybean dietary fiber on the properties of konjac glucomannan/κ-carrageenan corn oil composite gel[J].Food Hydrocolloids, 2022, 129:107602.
[10] 杨悦, 任元元, 邓利玲, 等.基于碱性电解水形成的魔芋热不可逆凝胶性质研究[J].食品与发酵工业, 2022,48(18):149-154.
YANG Y, REN Y Y, DENG L L, et al.Study on properties of thermal irreversible konjac gel formed by alkaline electrolyzed water[J].Food and Fermentation Industries, 2022,48(18):149-154.
[11] 范盛玉, 严竟, 朱坤, 等.辣椒红色素对魔芋葡甘聚糖-大豆分离蛋白复合凝胶性质的影响[J/OL].食品与发酵工业, 2023,49(8):216-222.
FAN S Y, YAN J, ZHU K, et al.Effects of capsanthin on the properties of konjac glucomannan-soybean protein isolate composite gel[J].Food and Fermentation Industries, 2023,49(8):216-222.
[12] YANG Q, WANG Y R, LI-SHA Y J, et al.Physicochemical, structural and gelation properties of arachin-basil seed gum composite gels:Effects of salt types and concentrations[J].Food Hydrocolloids, 2021, 113:106545.
[13] TONG C L, LIU L, LIN Q W, et al.Insights into the formation of konjac glucomannan gel induced by ethanol equilibration[J].Food Hydrocolloids, 2022, 126:107469.
[14] LI Z Y, ZHANG L, MAO C L, et al.Preparation and characterization of konjac glucomannan and gum Arabic composite gel[J].International Journal of Biological Macromolecules, 2021, 183:2121-2130.
[15] YUAN C, XU D Y, CUI B, et al.Gelation of κ-carrageenan/konjac glucommanan compound gel:Effect of cyclodextrins[J].Food Hydrocolloids, 2019, 87:158-164.
[16] CHENG Z H, ZHANG B J, QIAO D L, et al.Addition of κ-carrageenan increases the strength and chewiness of gelatin-based composite gel[J].Food Hydrocolloids, 2022, 128:107565.
[17] XU C L, WILLFÖR S, HOLMBOM B.Rheological properties of mixtures of spruce galactoglucomannans and konjac glucomannan or some other polysaccharides[J].Bioresources, 2008, 3(3):713-730.
[18] JIAN W J, WU H Y, WU L L, et al.Effect of molecular characteristics of konjac glucomannan on gelling and rheological properties of Tilapia myofibrillar protein[J].Carbohydrate Polymers, 2016, 150:21-31.
[19] XIN C, CHEN J, LIANG H S, et al.Confirmation and measurement of hydrophobic interaction in sol-gel system of konjac glucomannan with different degree of deacetylation[J].Carbohydrate Polymers, 2017, 174:337-342.
[20] YUAN L, YU J M, MU J L, et al.Effects of deacetylation of konjac glucomannan on the physico-chemical properties of surimi gels from silver carp (Hypophthalmichthys molitrix)[J].RSC Advances, 2019, 9(34):19828-19836.
[21] ZHANG C, CHEN J D, YANG F Q.Konjac glucomannan, a promising polysaccharide for OCDDS[J].Carbohydrate Polymers, 2014, 104:175-181.
[22] ![]() A, MATUSIAK M, SAMBORSKA K, et al.The influence of kappa carrageenan and its hydrolysates on the recrystallization process in sorbet[J].Journal of Food Engineering, 2015, 167:162-165.
A, MATUSIAK M, SAMBORSKA K, et al.The influence of kappa carrageenan and its hydrolysates on the recrystallization process in sorbet[J].Journal of Food Engineering, 2015, 167:162-165.
[23] JIANG S, SHANG L C, LIANG H S, et al.Preparation of konjac glucomannan/xanthan gum/sodium alginate composite gel by freezing combining moisture regulation[J].Food Hydrocolloids, 2022, 127:107499.
[24] WU D, YU S M, LIANG H S, et al.The influence of deacetylation degree of konjac glucomannan on rheological and gel properties of konjac glucomannan/κ-carrageenan mixed system[J].Food Hydrocolloids, 2020, 101:105523.
[25] PU X L, ZHANG M Y, LIN X D, et al.Development and characterization of acid-induced whey protein concentrate and egg white protein composite gel[J].LWT-Food Science and Technology, 2022, 164:113624.
[26] TARHAN O, SPOTTI M J, SCHAFFTER S, et al.Rheological and structural characterization of whey protein gelation induced by enzymatic hydrolysis[J].Food Hydrocolloids, 2016, 61:211-220.
[27] CHEN J, LI J, LI B.Identification of molecular driving forces involved in the gelation of konjac glucomannan:Effect of degree of deacetylation on hydrophobic association[J].Carbohydrate Polymers, 2011, 86(2):865-871.
[28] YUAN Y, WANG L, MU R J, et al.Effects of konjac glucomannan on the structure, properties, and drug release characteristics of agarose hydrogels[J].Carbohydrate Polymers, 2018, 190:196-203.
[29] ACAR H, KURT A.Purified salep glucomannan synergistically interacted with xanthan gum:Rheological and textural studies on a novel pH-/thermo-sensitive hydrogel[J].Food Hydrocolloids, 2020, 101:105463.
[30] ZHU J S, EID M, LI J, et al.Synergistic interactions between konjac glucomannan and welan gum mixtures[J].LWT-Food Science and Technology, 2022, 162:113425.