近年来,环境污染问题越来越引起人们的重视,大量使用传统的聚乙烯、聚氯乙烯等包装材料造成的污染极为严重[1]。因此,开发由大分子生物聚合物作为原材料制备可降解食品包装材料一直以来是研究的重要方向。在天然聚合物中,壳聚糖(chitosan, CS)和魔芋葡甘聚糖(konjac glucomannan, KGM)因其良好的成膜性能受到越来越多的关注[2-3]。CS是一种天然碱性多糖,由D-葡萄糖胺和N-乙酰-D-葡萄糖胺单元组成,无毒、可生物降解,有良好的生物相容性,纯CS薄膜制备工艺简便,但具有机械性能不佳、亲水性强等缺点[4]。KGM是一种天然大分子聚合物,无毒,其分子链由D-葡萄糖和D-甘露糖以β-(1,4)-糖苷键连接而成,具有较强的吸水性、高膨胀率及高黏度[5]。有研究将CS和KGM作为复合成膜基材,发现所得CS/KGM复合薄膜的机械性能、阻湿性能优于CS薄膜[2,6]。但KGM的特性导致CS/KGM复合薄膜仍具有以下不足之处:a)KGM表面丰富的羟基使其与水分子之间存在很强的相互作用,因此复合薄膜的吸水溶胀性强于CS薄膜[7],不利于其在表面含水量高的食品上的包装;b)KGM的分子质量可达100~1 000 kDa,其水溶胶黏度极大,这大大地增加了薄膜制备和加工的难度[8]。因此,可通过物理、化学和酶解等方法对KGM进行降解或改性以改变KGM的某些性质,增加其在薄膜制备中的应用性。
本课题组通过前期实验探究,使用安全、快速、无化学残留的微波辅助臭氧氧化方法对KGM进行化学降解,得到氧化魔芋葡甘聚糖(oxidized konjac glucomannan,OKGM),并对OKGM的物理化学性质做了详细的研究,发现该降解方法能够显著降低KGM的分子质量、黏度和吸水溶胀性,降低程度与臭氧氧化降解的时间成正比,且OKGM分子链上引入了羧基基团,羧基基团增加量与臭氧氧化时间成正比[9-10]。有研究将经2, 2, 6, 6-四甲基哌啶氧化物氧化的KGM应用于硬胶囊的制备中,说明了氧化法改性KGM在薄膜制备上的可行性[11]。迄今为止,未见经臭氧降解制备的OKGM应用于可降解薄膜的报道。
因此,本研究基于OKGM的优点,将其与CS制备复合薄膜,探究经不同臭氧降解时间制备的OKGM水溶胶对CS薄膜物理性能及结构的影响,为提高CS薄膜性质以及KGM在可降解薄膜领域的进一步应用提供理论参考。
1 材料与方法
1.1 材料与试剂
纯化魔芋微粉(纯度≥86%),湖北十堰花仙子魔芋制品有限公司;壳聚糖(生化试剂,脱乙酰度80.0%~95.0%),国药集团化学试剂有限公司;丙三醇(分析纯),成都市科隆化学品有限公司。
1.2 仪器与设备
FL-815Y臭氧消毒机,深圳市飞立电器科技有限公司;XH-300B微波超声波组合合成萃取仪,北京祥鹄科技发展有限公司;FA2004A型电子分析天平,上海精天电子仪器有限公司;DHG-9240A型电热恒温鼓风干燥箱,上海龙跃仪器设备有限公司;BSC-150恒温恒湿箱,上海博迅实业有限公司医疗设备厂;NDJ-8S数显黏度计,上海衡平仪器仪表厂;XLW智能电子拉力试验机,济南兰光机电技术有限公司;W3/060水蒸气透过率测试系统,济南兰光机电技术有限公司;UV-2450型紫外分光光度计,日本岛津公司;Phenom Pro-17A0040型扫描电镜,荷兰Phenom World公司。
1.3 实验方法
1.3.1 OKGM水溶胶的制备
OKGM水溶胶的制备方法参考本课题组已有的方法[9]。称取3.0 g KGM粉末加入300 mL去离子水中,采用微波协同臭氧氧化降解方法制备OKGM水溶胶,处理时间为30、60、90、120 min。反应结束后,补足减失水分,即得到不同降解时间的1% OKGM水溶胶(质量分数),标记为OKGM-30、OKGM-60、OKGM-90和OKGM-120。
1.3.2 CS/OKGM成膜液及复合膜的制备
将CS溶于体积分数为1%的乙酸溶液中,60 ℃水浴并搅拌80 min至完全溶解,制备3%(质量分数)CS溶液。将CS溶液与OKGM水溶胶等体积混合,加入1%(质量分数)甘油,在室温下磁力搅拌1 h使其充分混匀,混匀后于6 000 r/min离心20 min以脱除气泡,制得CS/OKGM成膜液。同时按照上述方法制备2%(质量分数)CS成膜液以及CS/KGM成膜液作为对照。以上6组成膜液分别取15.0 g均匀地铺展在直径为90 mm的一次性培养皿中。将培养皿置于电热恒温鼓风干燥箱中,45 ℃干燥12 h成膜。成膜后将薄膜置于25 ℃、相对湿度50%的环境中平衡24 h,测定膜的各项性能指标。CS、CS/KGM以及CS/OKGM(不同降解时间)薄膜分别标记为CS、CK、CO-30、CO-60、CO-90和CO-120。
1.3.3 成膜液的流变学性能
参考WU等[12]的方法并稍作修改。取6组制备好的成膜液,选择PP 60平板,间隙设置为1.0 mm,剪切速率0.1~100 s-1,恒定25 ℃下测定成膜液的流变行为。使用1%的应变进行动态频率扫描,角频率范围1~100 rad/s,温度25 ℃。
1.3.4 薄膜厚度的测定
对于所有薄膜,在薄膜上随机选择5个点,使用千分尺测定薄膜的厚度,结果取平均值。用于薄膜物理性能的测定。
1.3.5 抗拉强度与断裂伸长率
参考GB/T 1040.3—2006 《塑料 拉伸性能的测定 第3部分:薄塑和薄片的试验条件》测定,使用智能电子拉力试验机测定。将薄膜裁剪成矩形试样(70 mm × 10 mm),设置拉伸速率为50 mm/min,上下夹片初始距离为52 mm。记录每组薄膜样品的抗拉强度和断裂伸长率。
1.3.6 水蒸气透过系数
参考GB/T 1037—2021 《塑料薄膜与薄片水蒸气透过性能测定 杯式增重与减重法》测定。使用透湿杯称重法,将薄膜样品固定在透湿杯杯口,将透湿杯放入干燥器中,每间隔3 h称重1次,循环7次,仪器软件计算薄膜样品的水蒸气透过系数。
1.3.7 颜色与不透明度
参考HUA等[13]的方法测定薄膜的颜色并稍作修改。使用便携式色差计测定,测定前用标准白板校准,测试期间用该白板作为背景,测定薄膜的L*(亮度)、a*(+,红色;-,绿色)和b*(+,黄色;-,蓝色),并根据公式(1)计算薄膜的总色差值ΔE。将薄膜裁剪成40 mm×10 mm的长方形,贴于比色皿的一侧,用分光光度计在600 nm波长处测定薄膜吸光度,按照公式(2)计算薄膜的不透明度。
(1)
式中:ΔE,薄膜样品的总色差值;L*、a*和b*,薄膜样品的颜色指数;L、a和b,标准白板的颜色参数。
不透明度![]()
(2)
式中:A600nm为薄膜样品在波长600 nm处的吸光度;x为薄膜样品的厚度,mm。
1.3.8 溶解度
薄膜溶解度的测定参考孙彦峰等[1]的方法。将膜切割成20 mm×20 mm的正方形,置于105 ℃烘箱,干燥至恒重后取出称重,作为膜的初始质量。然后将膜浸泡于30 mL去离子水中,放置24 h后取出,用滤纸轻轻擦去表面的水分,将膜再次放入105 ℃烘箱,干燥至恒重后取出称重,为膜的最终质量。按照公式(3)计算薄膜的溶解度:
溶解度![]()
(3)
式中:m0,膜样品初始质量,g;m1,膜样品最终质量,g。
1.3.9 溶胀指数
薄膜溶胀指数的测定参考NISAR等[14]的方法,并稍作修改。将薄膜裁剪成10 mm×40 mm样,每2片为一组称重,作为膜样品的初始质量。将样品浸泡于30 mL去离子水中,4 h后取出,用滤纸吸干表面水分,称量薄膜的重量,为膜样品溶胀后的质量。由公式(4)计算薄膜溶胀指数:
溶胀指数![]()
(4)
式中:m2,膜样品的初始质量,g;m3,膜样品溶胀后质量,g。
1.3.10 红外光谱分析
按照1.3.2节的方法制备KGM薄膜以及OKGM-60薄膜,设置红外光谱测定的样品组为CS、KGM、OKGM-60、CK、CO-60和CO-120,将薄膜切成小片,置于载样台,波长范围4 000~600 cm-1,扫描次数32次,分辨率4 cm-1。
1.3.11 热稳定性分析
参考WU等[3]的方法并稍作修改。使用热重分析仪测定薄膜的热稳定性。样品重量约为5 mg,测定温度范围30~600 ℃,升温速率10 ℃/min。
1.3.12 扫描电镜观察
参考孙海涛等[15]的方法,用扫描电子显微镜观察薄膜的表面(5 000×)和横截面(2 000×)形态。将薄膜样品干燥,裁剪成合适的大小,用导电胶固定在铜板上,真空喷金处理,加速电压为20 kV。
1.4 数据处理与分析
所有试验重复3次,结果以平均值±标准偏差表示。采用SPSS 26软件对数据进行处理,ANOVA法进行方差分析,Duncan多重比较检验法进行显著性分析(P<0.05)。
2 结果与分析
2.1 成膜液的流变学性能
不同组分成膜液的表观黏度见图1。各组成膜液的表观黏度随着剪切速率的增加而逐渐降低,表现出伪塑性行为[16]。在同一剪切速率下,添加了KGM的CK成膜液表观黏度最大。而将KGM降解为OKGM后,CS/OKGM成膜液的表观黏度明显降低,且随OKGM降解时间的增加而逐渐降低。这是因为臭氧降解处理会导致KGM分子链的断裂,分子质量的减小使得OKGM水溶胶的黏度降低[9]。当降解时间达到120 min时,CO-120成膜液的表观黏度在任一剪切速率下均略低于CS成膜液。
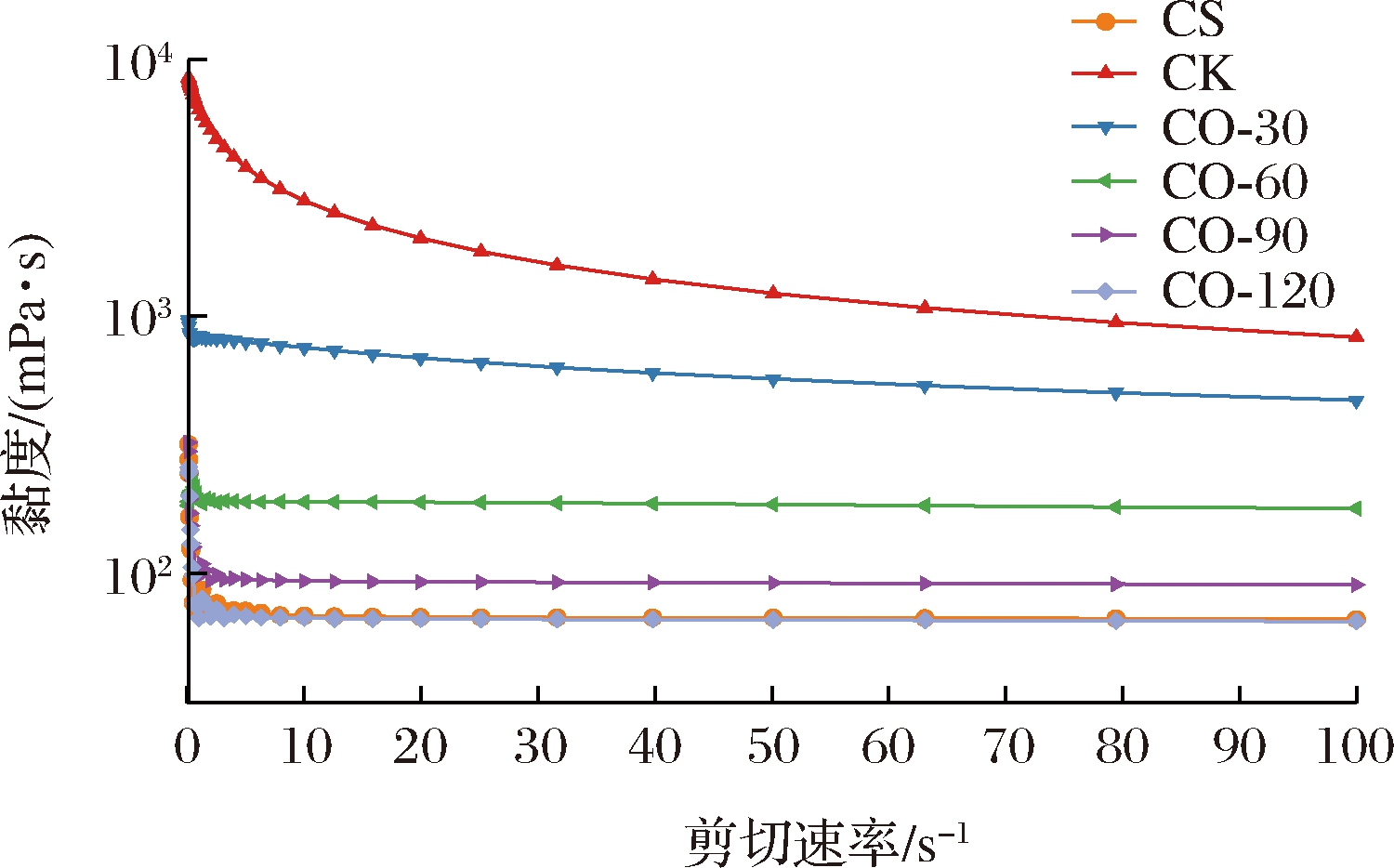
图1 OKGM水溶胶对成膜液表观黏度的影响
Fig.1 The influence of OKGM hydrosols on the apparent viscosity of film-forming solutions
成膜液的动态流变学特性见图2。各组成膜液的储能模量(G′)和耗能模量(G″)都随着角频率的增加而升高。在1~100 rad/s的频率内,CS成膜液的G″大于G′,表明其始终表现出液体性质。CK成膜液G′和G″曲线在高频率下发生交叉,表现出类固体性质,而CS/OKGM 4组成膜液的G″在低频率和高频率下始终高于G′,且随OKGM降解时间的延长,G″和G′均逐渐降低。表明臭氧降解KGM会使其分子链间及与CS分子链的网络纠缠减弱,从而引起其黏弹性降低,故其成膜液表现出液体黏性的性质[17],该发现可解决CK成膜液黏度高的问题,其中CO-120成膜液的流动性最好。

图2 OKGM水溶胶对成膜液储能模量(G′)和 耗能模量(G″)的影响
Fig.2 The influence of OKGM hydrosols on the G′ and G″ of film-forming solutions
2.2 机械性能分析
薄膜的机械性能由抗拉强度和断裂伸长率2个指标表示。如图3所示,所有复合薄膜的抗拉强度均高于CS薄膜(21.16 MPa)。这是因为CS与KGM(或OKGM)复合成膜使得分子链交联程度增加,从而提高薄膜的内聚力[7],而微观网络结构的增强能够提高复合薄膜的抗拉强度[14]。然而,相比于CK复合薄膜的抗拉强度(39.22 MPa),OKGM与CS所得复合薄膜的抗拉强度显著降低,且与臭氧降解时间呈负相关。这是由于臭氧降解导致OKGM分子链长逐渐变短,弱化了其与CS的相互作用,致使复合薄膜的网络结构逐渐松散[18]。此外,CS薄膜的断裂伸长率最高(81.38%),KGM、OKGM的加入降低了CS薄膜的断裂伸长率。其中CO-120薄膜断裂伸长率最低(54.11%),仍具有较好的延展性[8]。综上,CK薄膜机械性能最佳,CS/OKGM 4组薄膜均可在一定程度上提高CS薄膜的机械性能。

图3 OKGM对薄膜抗拉强度和断裂伸长率的影响
Fig.3 The influence of OKGM on the tensile strength and the elongation at break of films
注:不同大写字母或小写字母标注表示差异显著(P<0.05),下同。
2.3 水蒸气透过系数
不同薄膜类型的水蒸气透过系数见图4。CK和CO-30薄膜的水蒸气透过系数与CS薄膜无显著性差异,均表现出良好的水蒸气阻隔性能。随OKGM降解时间的延长,其复合膜的水蒸气透过系数逐渐增加,这是由于臭氧降解能够减小OKGM的分子质量[9],水分子更容易通过低分子质量OKGM形成的复合薄膜基质扩散[18]。水蒸气透过系数相对较低的CO-30薄膜有望用于高水分含量食品的包装,可以减少食品与周围环境之间的水分交换,有利于保持食品的品质。而水蒸气透过系数相对较高的CO-60、CO-90和CO-120薄膜有可能适用于新鲜水果包装方面,有利于水果的有氧呼吸,从而减少水珠挂膜而造成的细菌繁殖,降低水果腐烂率[19]。

图4 OKGM对薄膜水蒸气透过系数的影响
Fig.4 The influence of OKGM on the water vapor permeability of films
2.4 颜色与不透明度
用色差值和不透明度来表征薄膜的外观。如表1所示,CK薄膜的L*、b*和ΔE最低,表明其亮度、黄度和总色差最低[20],且其不透明度最高。而CS/OKGM 4组薄膜L*提高,表明降解能够提高复合薄膜的亮度;b*升高,说明薄膜黄度增加;CO-30与CK薄膜的b*和ΔE没有显著差别。此外,与CS薄膜相比,CO-30、CO-60和CO-90薄膜的不透明度更低,这意味着具有良好透明度的CO-30、CO-60和CO-90薄膜有利于展示食物的外观。
表1 OKGM对薄膜颜色参数和不透明度的影响
Table 1 The influence of OKGM on the color parameters and opacity of films

样品 L*a*b*ΔE不透明度CS93.59±0.24ab-0.82±0.09bc4.09±0.45a8.20±0.48a0.13±0.04cCK93.39±0.33b-0.42±0.25a2.22±0.44c6.40±0.48c0.36±0.06aCO-3094.02±0.23a-0.61±0.06ab2.51±0.44c6.56±0.46c0.12±0.04cCO-6093.97±0.29a-0.86±0.05c3.54±0.20b7.60±0.21b0.08±0.01cCO-9093.99±0.20a-0.86±0.20c3.83±0.29ab7.89±0.30ab0.10±0.04cCO-12093.96±0.53a-0.86±0.20c4.08±0.28a8.14±0.30a0.20±0.08b
2.5 溶解度
CS和KGM均为大分子聚合物,具有较强的亲水性,水溶性较高[21]。如表2所示,CK薄膜溶解性比CS低7.12%,这可能由于KGM分子质量极大,其分子链与CS分子缠绕紧密,形成致密的网络结构[18]。CO-30和CO-60薄膜的溶解度与CK薄膜没有显著差异,且低于CS薄膜,说明较短时间的适度氧化降解不会显著影响复合膜的溶解度,因此能够改善CS薄膜的溶解性。然而,随着KGM进一步氧化降解,CO-90和CO-120薄膜的溶解度较高,这可能是因为降解时间长的OKGM中部分低分子质量短链从薄膜网络结构中溶出,臭氧处理过程中引入的羧基基团也能够提高OKGM在水中的溶解度[9]。
表2 OKGM对薄膜溶解度和溶胀指数的影响
Table 2 The influence of OKGM on the solubility and swelling ratio of films

样品溶解度/%溶胀指数CS22.74±0.14c1.64±0.02cCK21.12±0.50d2.76±0.08aCO-3021.88±0.37cd2.02±0.02bCO-6021.90±0.73cd1.70±0.02cCO-9023.89±0.02b1.37±0.02dCO-12024.81±0.68a1.18±0.04e
2.6 溶胀指数
溶胀指数可以反映薄膜的吸水膨胀程度。由表2可知,CS薄膜的溶胀指数为1.64,而CK薄膜为2.76,表明KGM会显著增加CS薄膜的吸水性,这是因为KGM分子链中含有大量可与水分子形成氢键的羟基[7],导致CK薄膜吸水能力大大增加。CS/OKGM 4组薄膜的溶胀指数随OKGM降解时间增加而降低,这可能是由于臭氧降解后OKGM分子质量减小,与水分子结合的能力逐渐减弱[9]。其中CO-60薄膜的溶胀指数与CS薄膜无显著差异,CO-90和CO-120两组薄膜的溶胀指数低于CS薄膜。该结果表明臭氧降解方法能在很大程度上改善CK薄膜高溶胀性的问题。
2.7 红外光谱分析
图5显示了4 000~600 cm-1区域内所有薄膜样品的代表性红外光谱,其中设置了KGM和OKGM-60薄膜的对照组以表示臭氧降解对KGM基团的变化。在KGM和OKGM-60薄膜的光谱中,1 725 cm-1的吸收带为C![]() O拉伸振动[12],868 cm-1和812 cm-1处的吸收峰是魔芋多糖中甘露糖单元的拉伸振动。通过对比分析,OKGM-60光谱中1 725 cm-1的吸收峰有所增强,这是由于臭氧将魔芋多糖分子中活跃的羟基氧化为羧基的缘故[22],表明臭氧氧化处理能够改变KGM的基团。此外,CS薄膜3 300 cm-1处的宽吸收带为O—H基团和N—H基团的伸缩振动吸收峰,KGM与OKGM加入后,该吸收峰变宽,可能是由于魔芋多糖中的—OH与CS中的—NH2产生相互作用,缔合成氢键,以至于出现更宽的吸收峰[1]。2 924 cm-1处的吸收峰为大分子中—CH3和—CH2的C—H伸缩振动吸收峰[15]。1 640 cm-1和1 558 cm-1处的吸收带分别对应于CS的酰胺Ⅰ和酰胺Ⅱ基团,1 558 cm-1处酰胺Ⅱ略向低波数移动,表明CS与OKGM产生氢键相互作用[3]。CS与OKGM红外光谱的变化表明,两者具有良好的兼容性,从而可以增强复合薄膜的力学性能及其他物理性能。
O拉伸振动[12],868 cm-1和812 cm-1处的吸收峰是魔芋多糖中甘露糖单元的拉伸振动。通过对比分析,OKGM-60光谱中1 725 cm-1的吸收峰有所增强,这是由于臭氧将魔芋多糖分子中活跃的羟基氧化为羧基的缘故[22],表明臭氧氧化处理能够改变KGM的基团。此外,CS薄膜3 300 cm-1处的宽吸收带为O—H基团和N—H基团的伸缩振动吸收峰,KGM与OKGM加入后,该吸收峰变宽,可能是由于魔芋多糖中的—OH与CS中的—NH2产生相互作用,缔合成氢键,以至于出现更宽的吸收峰[1]。2 924 cm-1处的吸收峰为大分子中—CH3和—CH2的C—H伸缩振动吸收峰[15]。1 640 cm-1和1 558 cm-1处的吸收带分别对应于CS的酰胺Ⅰ和酰胺Ⅱ基团,1 558 cm-1处酰胺Ⅱ略向低波数移动,表明CS与OKGM产生氢键相互作用[3]。CS与OKGM红外光谱的变化表明,两者具有良好的兼容性,从而可以增强复合薄膜的力学性能及其他物理性能。
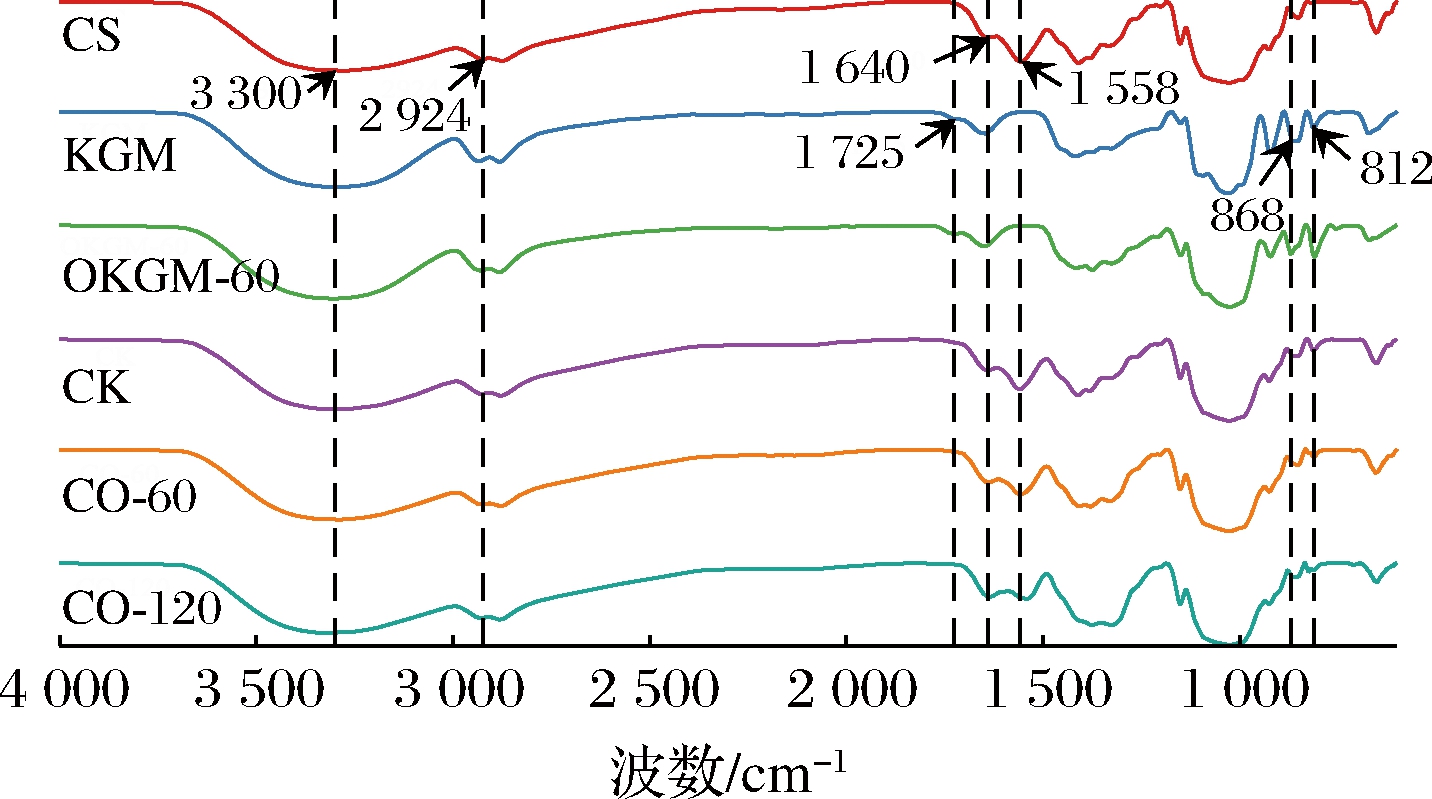
图5 不同薄膜的红外光谱图
Fig.5 The infrared spectra of different films
2.8 热稳定性分析
薄膜的热稳定性如图6所示。薄膜重量损失主要有3个阶段(30~120 ℃、150~350 ℃和400~600 ℃)。第一个阶段(30~120 ℃)下薄膜的重量损失是由薄膜中游离水的蒸发造成的。第二个阶段(150~350 ℃)中150~220 ℃区间内的失重由作为增塑剂的甘油分解引起,220~350 ℃内是由于多糖在热作用下的分解造成的重量损失,生成气体产物和固体焦炭[6]。多糖的分解主要在这个阶段,其中CK薄膜的重量损失率最大(47.26%),其次为CO-30薄膜(46.61%),均高于CS薄膜(45.53%),表现出较差的热稳定性。而CO-60、CO-90和CO-120薄膜的重量损失率分别为44.85%、44.44%和45.34%,低于CS薄膜的重量损失率。第三个阶段(400~600 ℃)的质量变化归因于焦炭的热分解,最终形成一个部分被破坏、紧凑堆叠的固体炭[23]。因此由图6可以看出,相比于CK薄膜,经臭氧降解的OKGM与CS制得的薄膜具有更好的热稳定性,且CO-60、CO-90和CO-120薄膜的热稳定性优于CS薄膜。结果表明经较长时间臭氧降解的OKGM能够减缓CS薄膜的热分解,其中CO-90薄膜的热稳定性最佳。

图6 不同类型复合薄膜的热重曲线
Fig.6 The thermogravimetric curves of different types of composite films
2.9 薄膜微观结构分析
不同类型薄膜表面和横截面的微观结构如图7所示。CS薄膜表面光滑平整无裂痕,其横截面有微小的孔洞存在。当KGM加入薄膜中,CK薄膜表面出现有较大的结团,横截面孔洞减少,结构更加致密,表明KGM与CS之间形成了交联网络结构,两者具有良好的相容性和混溶性[20],GOMES等[7]和WU等[3]的研究中也得到了类似结果。结团的存在可能是由于未降解的KGM分子质量大,黏度大,部分KGM分子链发生缠结,在薄膜表面形成结团。而在薄膜中加入不同臭氧时间降解的OKGM也会出现结团,但随着臭氧降解时间的增加,OKGM分子质量和黏度逐渐减小,薄膜表面结团现象愈加改善,横截面结构也呈较紧密的结构。CO-120薄膜表面出现裂痕,可能是由于OKGM-120能够显著降低复合薄膜的溶胀性,导致薄膜皱缩,出现微小裂缝。裂缝的出现可能是CO-120薄膜水蒸气透过系数显著提高的原因。

A、a-CS;B、b-CK;C、c-CO-30;D、d-CO-60;E、e-CO-90;F、f-CO-120
图7 不同类型复合薄膜的扫描电镜图
Fig.7 The scanning electron microscope images of different types of composite films
注:大写字母代表薄膜表面的微观结构(5 000×),小写字母代表薄膜横截面的微观结构(2 000×)。
3 结论
添加KGM以及不同臭氧降解时间的OKGM对CS薄膜的物理性质和微观结构有显著的影响。CK成膜液的表观黏度最大,降解为OKGM后复合成膜液的表观黏度显著降低。与CS薄膜相比,KGM和OKGM都能够增强CS薄膜的机械性能,且KGM和适度降解的OKGM-30能够降低CS薄膜的水蒸气透过系数。表明KGM和OKGM均可在一定程度上改善CS薄膜的力学性质和阻湿性能。CO-30和CO-60薄膜黄度显著低于CS薄膜,且透明度高,具有较好的外观。CK薄膜的溶胀指数最大,CS/OKGM薄膜的溶胀指数随OKGM降解时间的增加而降低,且CO-90和CO-120薄膜的溶胀指数显著低于CS薄膜。红外光谱图可知,KGM和OKGM与CS之间存在氢键相互作用,分子间相互作用的产生有利于薄膜理化性质的提高。SEM结果表明,KGM和OKGM与CS均具有良好的相容性,其中CO-60和CO-90薄膜表面相对平整且无裂痕,横截面结构致密,具有更为良好的微观结构。因此,在生产应用中,可以通过控制OKGM降解的程度,以获得具有不同性质的CS/OKGM复合薄膜。本研究为新型可降解生物复合薄膜的开发以及改性魔芋葡甘聚糖的应用提供参考。
[1] 孙彦峰, 罗爱国, 冯佳, 等.壳聚糖/绿球藻多糖复合膜的制备及性能研究[J].食品与发酵工业, 2019, 45(5):170-176.
SUN Y F, LUO A G, FENG J, et al.Preparation and properties of chitosan/Chlorococcum sp.GD polysaccharide composite films[J].Food and Fermentation Industries, 2019, 45(5):170-176.
[2] CHEN M, MEENU M, XU B J.Effect of konjac glucomannan and chitosan-based film coatings on the quality of fresh sea bass (Lateolabrax maculatus) under refrigerated condition[J].Journal of Future Foods, 2021, 1(2):187-195.
[3] WU H W, WU H Y, QING Y L, et al.KGM/chitosan bio-nanocomposite films reinforced with ZNPs:Colloidal, physical, mechanical and structural attributes[J].Food Packaging and Shelf Life, 2022, 33:100870.
[4] CHENG S Q, LI F F, MEI X H.Structure, mechanical and physical properties of hordein/chitosan composite films[J].LWT, 2022, 163:113596.
[5] 蔡梦思, 谢勇, 周勇军, 等.魔芋葡甘露聚糖对β-葡聚糖复合凝胶性质的影响[J].食品与发酵工业,2022,48(16):223-229.
CAI M S, XIE Y, ZHOU Y J, et al.Effect of konjac glucomannan on the properties of β-glucan composite gel[J].Food and Fermentation Industries,2022,48(16):223-229.
[6] 陈晓涵, 庞杰, 吴春华.魔芋葡甘聚糖/壳聚糖复合抗菌食品包装膜的制备及其特性[J].食品科学, 2021, 42(7):232-239.
CHEN X H, PANG J, WU C H.Fabrication and characterization of antimicrobial food packaging materials composed of konjac glucomannan, chitosan and fulvic acid[J].Food Science, 2021, 42(7):232-239.
[7] GOMES NETO R J, GENEVRO G M, DE ALMEIDA PAULO L, et al.Characterization and in vitro evaluation of chitosan/konjac glucomannan bilayer film as a wound dressing[J].Carbohydrate Polymers, 2019, 212:59-66.
[8] NI Y S, LIU Y L, ZHANG W T, et al.Advanced konjac glucomannan-based films in food packaging:Classification, preparation, formation mechanism and function[J].LWT, 2021, 152:112338.
[9] LI Y, LIU H B, XIE Y, et al.Preparation, characterization and physicochemical properties of konjac glucomannan depolymerized by ozone assisted with microwave treatment[J].Food Hydrocolloids, 2021, 119:106878.
[10] 田红媚, 谢勇, 龙明秀, 等.氧化魔芋葡甘聚糖对面团特性及面包品质的影响[J].食品与发酵工业,2023,49(6):247-253.
TIAN H M, XIE Y, LONG M X, et al.Effect of oxidized konjac glucomannan on dough properties and bread quality[J].Food and Fermentation Industries,2023,49(6):247-253.
[11] CHEN Y Y, ZHAO H Y, LIU X W, et al.TEMPO-oxidized konjac glucomannan as appliance for the preparation of hard capsules[J].Carbohydrate Polymers, 2016, 143:262-269.
[12] WU C H, LI Y Z, DU Y, et al.Preparation and characterization of konjac glucomannan-based bionanocomposite film for active food packaging[J].Food Hydrocolloids, 2019, 89:682-690.
[13] HUA L, DENG J Y, WANG Z M, et al.Improving the functionality of chitosan-based packaging films by crosslinking with nanoencapsulated clove essential oil[J].International Journal of Biological Macromolecules, 2021, 192:627-634.
[14] NISAR T, WANG Z C, YANG X, et al.Characterization of citrus pectin films integrated with clove bud essential oil:Physical, thermal, barrier, antioxidant and antibacterial properties[J].International Journal of Biological Macromolecules, 2018, 106:670-680.
[15] 孙海涛, 赵婉竹, 赵兵兵, 等.改性处理对大豆分离蛋白/壳聚糖/黑木耳多糖复合膜性质的影响[J].食品科学,2022,43(18):76-82.
SUN H T, ZHAO W Z, ZHAO B B, et al.Effect of modification treatment on the properties of soy protein isolate/chitosan/Auricularia auricular polysaccharide composite film[J].Food Science,2022,43(18):76-82.
[16] SUN J S, JIANG H X, LI M W, et al.Preparation and characterization of multifunctional konjac glucomannan/carboxymethyl chitosan biocomposite films incorporated with epigallocatechin gallate[J].Food Hydrocolloids, 2020, 105:105756.
[17] 唐兰兰, 张世奇, 刘雄, 等.热处理下不同有机酸对魔芋水溶胶流变行为的影响[J].食品与发酵工业, 2022, 48(8):227-232.
TANG L L, ZHANG S Q, LIU X, et al.Research on the rheological behavior of konjac glucomannan under different organic acids with heat treatment[J].Food and Fermentation Industries, 2022, 48(8):227-232.
[18] CHENG L H, ABD KARIM A, SEOW C C.Effects of acid modification on physical properties of konjac glucomannan (KGM) films[J].Food Chemistry, 2007, 103(3):994-1002.
[19] 周文艺, 蔡文韬, 吴泽玲, 等.植物精油壳聚糖基活性包装膜的制备及保鲜效果研究[J/OL].食品与发酵工业,2022,48(24):157-165.
ZHOU W Y, CAI W T, WU Z L, et al.Study on preparation and fresh-keeping effect of chitosan-based active packaging film of plant essential oil[J/OL].Food and Fermentation Industries,2022,48(24):157-165.
[20] SUN J S, JIANG H X, WU H B, et al.Multifunctional bionanocomposite films based on konjac glucomannan/chitosan with nano-ZnO and mulberry anthocyanin extract for active food packaging[J].Food Hydrocolloids, 2020, 107:105942.
[21] SANTOS N L, RAGAZZO G DE O, CERRI B C, et al.Physicochemical properties of konjac glucomannan/alginate films enriched with sugarcane vinasse intended for mulching applications[J].International Journal of Biological Macromolecules, 2020, 165(Pt B):1717-1726.
[22] 娄广庆, 林向阳, 彭树美, 等.臭氧降解魔芋葡甘露聚糖的效果研究[J].食品科学, 2009,30(20):203-206.
LOU G Q, LIN X Y, PENG S M, et al.Degradation of konjac glucomannan with ozone[J].Food Science, 2009,30(20):203-206.
[23] LEI Y L, WU H J, JIAO C, et al.Investigation of the structural and physical properties, antioxidant and antimicrobial activity of pectin-konjac glucomannan composite edible films incorporated with tea polyphenol[J].Food Hydrocolloids, 2019, 94:128-135.