乳酸菌(lactic acid bacteria, LAB)能够直接发酵降解碳水化合物产生乳酸,具有降糖降脂、抗炎、调节自身免疫、促进机体发育等多种生物活性,是一种有益人体健康的益生菌[1-2]。乳酸菌胞外多糖(exopolysaccharides, EPS)是乳酸菌在正常生长、代谢活动过程中被分泌到宿主细胞壁膜外的次级代谢产物,可以大致分为荚膜多糖和黏液多糖。乳酸菌产生的胞外多糖能够改善肠道屏障[3]、调节肠道菌群[4],具有抗高血压[5]、降胆固醇[6]、抗氧化[7]、抗肿瘤[8]等多种生物活性。EPS可以广泛应用于化工和医药领域,也可以作为食物级多糖的一级来源。
已有多项研究证实乳酸菌的胞外多糖可以起到天然的强效抗氧化剂作用,参与自由基的清除,同时其安全无毒,因此可以作为化学合成的抗氧化剂的良好代替品。瑞士乳杆菌(Lactobacillus helveticus)KLDS1.8701体内外均证实具有高抗氧化能力,体外对DPPH自由基、超氧自由基、羟自由基具有较强的清除能力,体内可以抑制D-gal诱导的小鼠肝脏氧化应激和损伤[9]。DI等[8]评价了9株乳酸菌胞外多糖的抗肿瘤作用,发现其中4株干酪乳酪杆菌(Lacticaseibacillus casei)的EPS对HT-29细胞增殖都具有较强的抑制作用。瑞士乳杆菌MB2-1的胞外多糖LHEPS-1可以以活性氧(reactive oxygen species, ROS)依赖性途径和线粒体依赖性途径诱导HT-29细胞凋亡[10]。从母乳中分离的鼠李糖乳酪杆菌(Lacticaseibacillus rhamnosus)的EPS对大肠杆菌和鼠伤寒沙门氏菌表现出强烈的抗菌活性[11]。
课题组前期从酱香型白酒酒醅自行筛选分离得到一株乳酸片球菌Pediococcus acidilactici HAO2018[12],发现其具有较好的抗肿瘤活性,但其耐酸、耐胆盐及耐药性等特性尚不清楚,而其胞外多糖是否具备生物学功能也尚未深入研究。因此,本研究中主要探究了该菌株的耐酸、耐胆盐及耐药性等特性,进一步经过乙醇沉淀及三氯乙酸去除蛋白提取胞外多糖,对该菌株EPS的多种生物学活性包括抗氧化活性、抗菌及抗肿瘤活性进行了评价,以期为益生菌相关药食资源开发和利用提供试验依据。
1 材料与方法
1.1 试验材料
1.1.1 菌株与细胞
乳酸片球菌HAO2018,本实验室从酱香型白酒酒醅中筛选分离得到;结肠癌细胞HT-29,中国科学院上海细胞库。
1.1.2 主要试剂
MRS培养基、噻唑蓝(thiazolyl blue tetrazolium bromide, MTT)、Biomerieux药敏检测试纸,北京索莱宝科技有限公司;无水乙醇,天津市立元化工有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO),上海生工生物工程有限公司;葡萄糖、水杨酸、三氯化铁、铁氰化钾、苯酚及浓硫酸均为国产分析纯。
1.1.3 仪器与设备
超净工作台,苏州净化设备有限公司;SPX-150型生化培养箱,湖南凯达科学仪器有限公司;高速冷冻离心机,日本HITACHI公司;多功能酶标仪,北京亚星仪科科技发展有限公司。
1.2 试验方法
1.2.1 菌种培养
将活化后的乳酸片球菌HAO2018取1 mL接种到MRS固体培养基上,37 ℃培养3~4 d。
1.2.2 菌株耐酸能力测定
将乳酸片球菌HAO2018以3%(体积分数)接种量接种于pH值为2.0、3.0、4.0的MRS液体培养基中,置于37 ℃厌氧箱中培养24 h[13];将过夜培养的菌液置于96孔板中,加入20 μL的MTT(5 mg/mL)厌氧培养4 h,用酶标仪测量各组OD490nm值,将pH值为7.0的MRS作为阴性对照,测定存活率。
1.2.3 菌株耐胆盐性质
将乳酸片球菌HAO2018以3%(体积分数)接种于装有不同胆盐质量浓度的MRS液体培养基中,置于37 ℃厌氧箱中培养过夜[13];参考1.2.2节的方法用酶标仪测量490 nm处各孔的吸光值,测定存活率。
1.2.4 药敏试验
采用K-B纸片扩散法[14],使用药敏试剂盒Biomerieux检测试纸检测菌株耐药性;取100 μL菌液(0.5麦氏浊度)均匀涂布于MRS固体培养基上,待培养基表面无明显水滴,用镊子轻轻夹取药敏纸片并使纸片边缘均匀平整地贴在固体平板表面上,将各组平板倒置(37 ℃)培养24 h后取出测定其抑菌圈直径。
1.2.5 胞外多糖提取及产量测定
将乳酸片球菌HAO2018以3%(体积分数)接种量接种于MRS液体培养基中,置于生化培养箱培养24 h(37 ℃)后,将菌液离心20 min(4 ℃,8 000 r/min),收集上清液;向上清液中加入质量浓度为800 g/L三氯乙酸溶液至终质量浓度为4 g/L,置于4 ℃过夜,离心20 min(4 ℃,8 000 r/min)去除蛋白,收集上清液;向上清液中以V(上清液)∶V(乙醇)的比例加入无水乙醇,置于4 ℃过夜,离心20 min(4 ℃,8 000 r/min),收集沉淀并用少量蒸馏水溶解,向透析袋中缓慢加入溶解液,将透析袋置于4 ℃透析48 h,最后进行真空冷冻干燥,获得粉末状粗多糖。用苯酚-硫酸法及Bradford试剂盒测定多糖中总糖及蛋白质的含量。
1.3 生物活性的研究
1.3.1 抗氧化活性
1.3.1.1 对羟自由基的清除率
参考水杨酸法测定[15],配制不同浓度的胞外多糖样液,分别加入浓度为9 mmol/L的FeSO4 50 μL,摇匀后加入9 mmol/L的H2O2溶液50 μL,充分混匀后置于室温下反应10 min;再加入9 mmol/L的乙醇-水杨酸溶液50 μL(AX),混匀静置;重复上述实验,将水杨酸换成蒸馏水(A0),测量其510 nm处的吸光值;2 mg/mL维生素C作为阳性对照(AX0),羟自由基清除率的计算如公式(1)所示:
羟自由基清除率![]()
(1)
1.3.1.2 对DPPH自由基的清除率
配制不同浓度的胞外多糖样液,分别向试管中加入4 mL样液,再加入4 mL 0.15 mmol的DPPH-乙醇溶液(A1)[15],混匀静置30 min(避光);将样液与相同体积的无水乙醇混合(A0),测量各组在517 nm处的吸光值;2 mg/mL维生素C作为阳性对照(A2),DPPH自由基清除率的计算如公式(2)所示:
DPPH自由基清除率![]()
(2)
1.3.1.3 还原能力
参考铁氰化钾还原法[16],配制不同浓度的胞外多糖样液,分别加入50 μL PBS,摇匀后加入质量分数为1%的铁氰化钾50 μL,反应10 min,再加入质量分数为10%的三氯乙酸50 μL,低速离心10 min(4 ℃,3 000 r/min),取上清液,在上清液中加入100 μL蒸馏水和20 μL质量分数为0.1%的三氯化铁,反应30 min,重复上述实验,测其在700 nm处的吸光值(A);2 mg/mL维生素C作为阳性对照(A0),还原能力的计算如公式(3)所示:
还原能力/%=(A-A0)×100
(3)
1.3.2 抑菌活性
参考滤纸片扩散法[17]探究HAO2018胞外多糖对致病菌的抑菌效果,活化致病菌,并用生理盐水稀释制备菌悬液,均匀地涂布在LB培养基上,分别取无菌水、1 mg/mL青霉素溶液、0.5 mg/mL和1 mg/mL胞外多糖溶液各10 μL滴加在滤纸片上,倒置于37 ℃恒温箱中培养,以无菌水作阴性对照,以青霉素为阳性对照组,16 h后测定抑菌圈直径。
1.3.3 对肿瘤细胞增殖的抑制作用
将HT-29细胞以5×104个细胞/mL接种到96孔板中,每孔100 μL,培养24 h(37 ℃,5% CO2)后,用PBS清洗2次,用无血清的RPMI1640培养基溶解胞外多糖冻干粉,配制成不同浓度,过膜除菌,加入细胞中[18]。分别培养24、48、72 h后加入MTT培养4 h,再加入100 μL DMSO避光振荡10 min,用酶标仪于490 nm测量吸光值,计算EPS对HT-29细胞的抑制率;其计算如公式(4)所示:
抑制率![]()
(4)
式中:A1为加多糖的细胞组,A2为不加多糖的细胞组,A0为无细胞组。
1.4 数据处理
试验涉及的数据均重复3次或3次以上,采用one-way ANOVA方法进行数值分析,用IBM SPSS Statistics 27对数据进行统计分析,以P<0.05表示数据具有统计学差异,并用Origin 2021软件进行绘图。
2 结果与分析
2.1 乳酸片球菌HAO2018菌株耐酸及耐胆盐能力
人体胃液pH值一般为1.5~4.5左右,益生菌耐受胃酸才能在体内发挥作用。人体肠道中胆汁盐质量分数在0.03%~0.3%波动,胆盐会影响菌体外膜的通透性,导致菌体DNA损伤,从而影响菌株的存活率。本研究将乳酸片球菌HAO2018分别在pH值为2.0、3.0、4.0和胆盐质量分数为0.1%、0.2%、0.3%条件下培养4 h,检测菌株存活情况,结果如图1和图2所示。

图1 乳酸片球菌HAO2018的耐酸性
Fig.1 Acid tolerance of P.acidilactici HAO2018
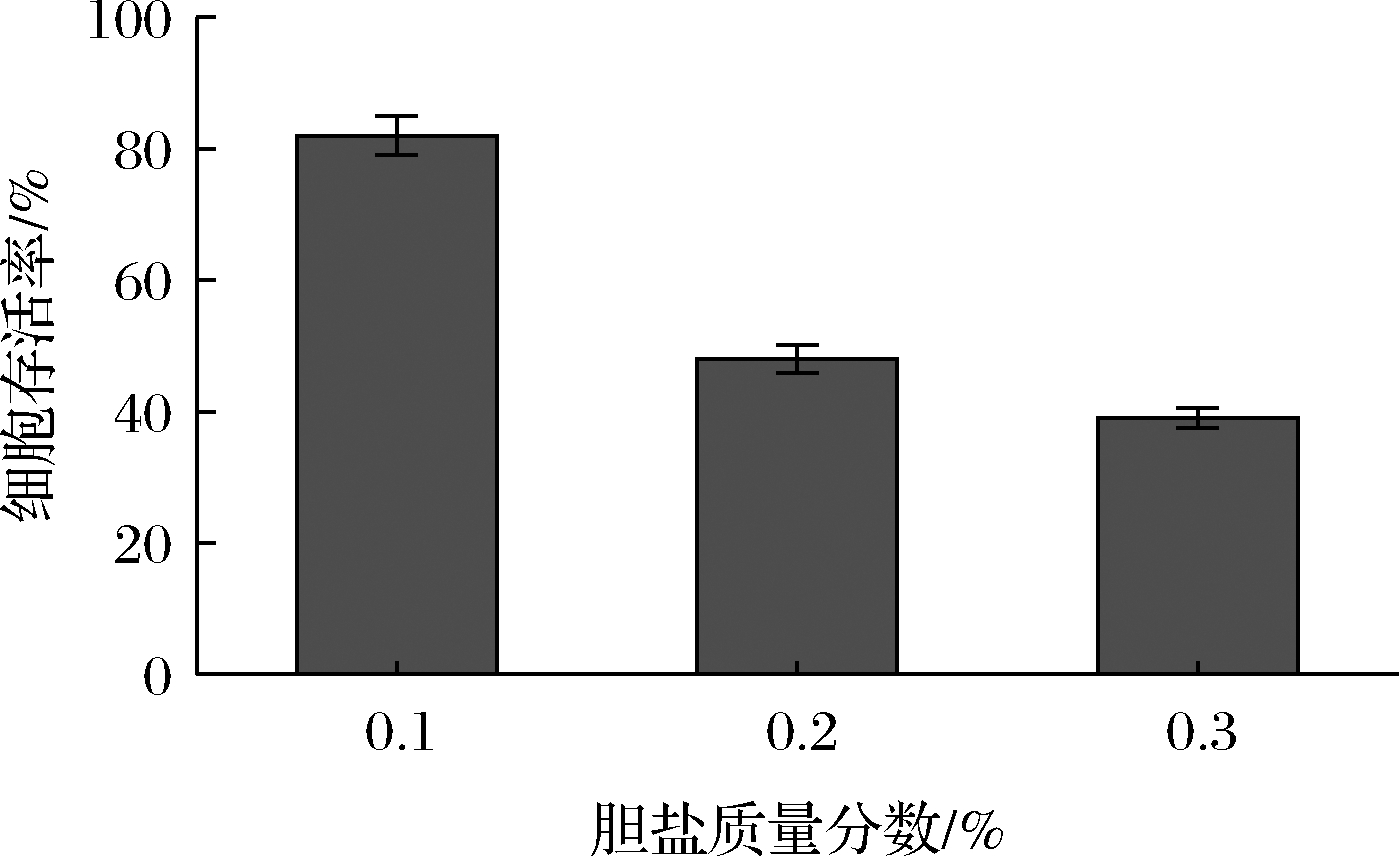
图2 乳酸片球菌HAO2018的胆盐耐受性
Fig.2 Bile salt tolerance of P.acidilactici HAO2018
由图1可知,在pH=2、pH=3和pH=4条件下培养4 h后存活率分别为(21.15±1.37)%、(30.34±2.83)%和(58.33±2.23)%。由图2可知,在胆盐质量分数为0.1%、0.2%、0.3%的条件下培养4 h后存活率分别为(82.07±3.06)%、(48.00±1.96)%和(39.42±1.66)%。因此,乳酸片球菌HAO2018有较强的酸耐受能力和胆盐耐受能力。
2.2 HAO2018菌株药敏试验
随着抗生素的广泛使用,乳酸菌的耐药性问题也越来越严重。乳酸片球菌HAO2018的药敏试验结果见表1,乳酸片球菌HAO2018对卡那霉素、四环素、氯霉素、利福平、头孢噻吩、头孢噻肟、头孢他啶、红霉素、亚胺培南敏感;对环丙沙星中度敏感;对万古霉素、复方新诺明不敏感。
表1 乳酸片球菌HAO2018的药物敏感性
Table 1 Antibiotic susceptibility of P.acidilactici HAO2018
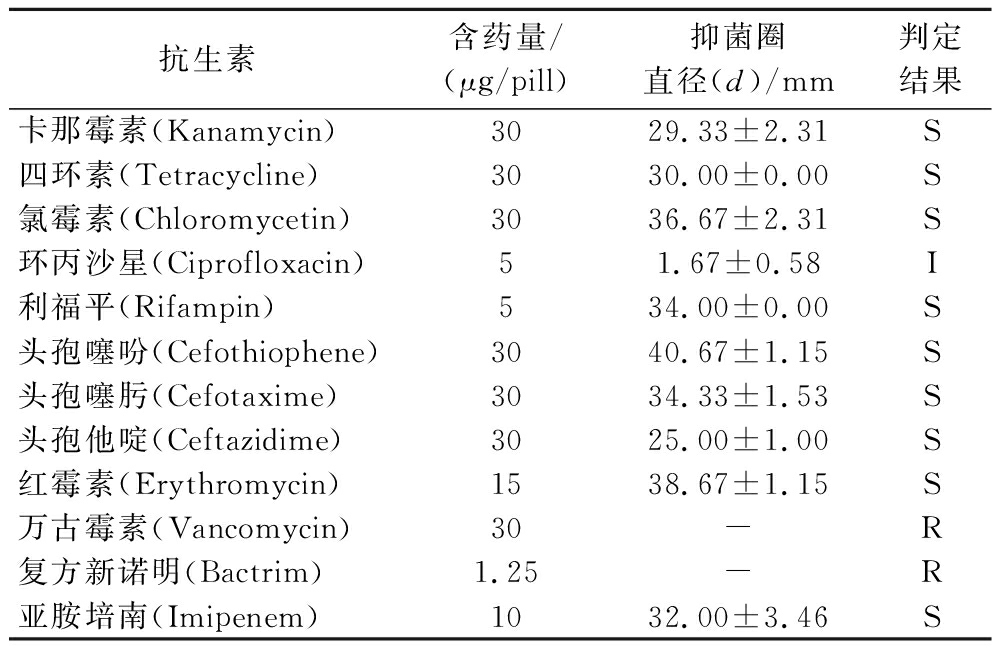
抗生素含药量/(μg/pill)抑菌圈直径(d)/mm判定结果卡那霉素(Kanamycin)3029.33±2.31S四环素(Tetracycline)3030.00±0.00S氯霉素(Chloromycetin)3036.67±2.31S环丙沙星(Ciprofloxacin)51.67±0.58I利福平(Rifampin)534.00±0.00S头孢噻吩(Cefothiophene)3040.67±1.15S头孢噻肟(Cefotaxime)3034.33±1.53S头孢他啶(Ceftazidime)3025.00±1.00S红霉素(Erythromycin)1538.67±1.15S万古霉素(Vancomycin)30-R复方新诺明(Bactrim)1.25-R亚胺培南(Imipenem)1032.00±3.46S
注:R表示耐药(d=0 mm);I表示中度耐药(0<d<16 mm);S表示敏感(d>16 mm);“-”表示无抑菌圈。
2.3 胞外多糖的抗氧化活性
乳酸片球菌HAO2018胞外多糖的产量为5.26 mg/mL,多糖纯度81.76%(质量分数,下同),蛋白含量4.39%(质量分数)。
2.3.1 羟自由基的清除率
羟自由基不能直接被特异的酶促反应降解,易对机体造成危害,因此羟自由基的有效去除可能对生物体预防疾病具有一定意义。乳酸片球菌HAO2018胞外多糖的羟自由基清除率见图3。
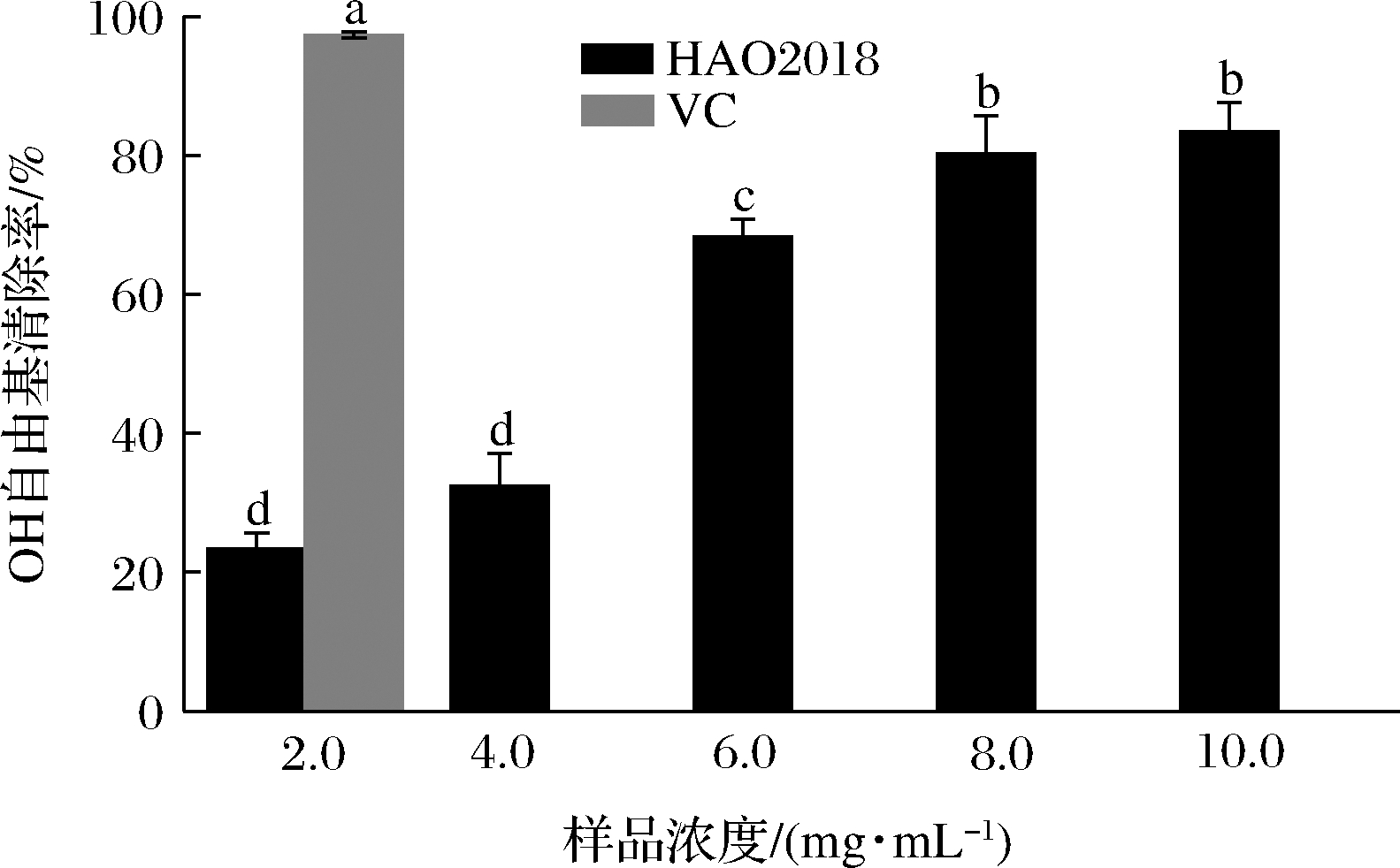
图3 乳酸片球菌HAO2018胞外多糖的羟自由基清除率
Fig.3 The hydroxyl radical scavenging rate of EPS of P.acidilactici HAO2018
注:图中不同小写字母代表差异显著(P<0.05)(下同)。
由图3可知,HAO2018的胞外多糖对羟自由基有一定的清除能力,其清除能力随浓度的增加而增强。当胞外多糖质量浓度为2.0 mg/mL时,其对羟自由基的清除率为(23.35±2.31)%(P<0.05,下同),当质量浓度达到10.0 mg/mL时,其清除率为(83.43±3.87)%。而作为阳性对照的维生素C在2.0 mg/mL时清除率为(97.30±0.46)%。李尧等[19]对乳酸片球菌C6菌株的EPS进行了分离纯化,发现其胞外多糖主要包含3个组分,其中分子质量为2.53×104 Da的EPS-3抗氧化活性最强,在质量浓度为8 mg/mL时对羟自由基的清除率为65.50%。在本研究中,乳酸片球菌HAO2018的胞外多糖在质量浓度为8 mg/mL时清除率为80.24%。这些结果说明乳酸片球菌HAO2018在羟自由基清除方面具有一定的优势。
2.3.2 DPPH自由基的清除率
DPPH自由基可与自由基清除剂(如EPS、多酚和维生素E等)反应,其溶液吸光度值的变化可用于评估自由基清除剂的抗氧化能力。乳酸片球菌HAO2018胞外多糖的DPPH自由基清除率见图4。

图4 乳酸片球菌HAO2018胞外多糖的DPPH 自由基清除率
Fig.4 DPPH free radical scavenging rate of EPS of P.acidilactici HAO2018
由图4可知,HAO2018的胞外多糖能够清除DPPH自由基,高质量浓度的EPS(2.0~10.0 mg/mL)对DPPH自由基的清除效果显著,基本接近100%;当EPS质量浓度逐渐由0.2 mg/mL升至0.6 mg/mL时,EPS对DPPH自由基的清除能力变化较快,且随浓度的升高而呈现逐渐增加的趋势,当EPS质量浓度达到1.0 mg/mL时,对DPPH的清除率为(68.46±4.16)%。而维生素C在2.0 mg/mL时对DPPH的清除率为(97.80±0.46)%。一株从韩国发酵米酒中分离的乳酸片球菌M76的EPS在1 mg/mL的质量浓度时对DPPH自由基具有45.8%清除率[20]。一株乳酸片球菌NCDC252在10 mg/mL的质量浓度时对DPPH自由基清除率达到54.9%[21]。相比于这些乳酸片球菌的胞外多糖的抗氧化活性,低浓度的乳酸片球菌HAO2018已达到较高的DPPH清除率,因此HAO2018在DPPH的清除率上具有一定优势,抗氧化效果更佳。
2.3.3 还原能力
天然活性物质的铁还原能力可作为其电子给体活性的重要指标,常用来评价抗氧化剂的抗氧化能力。乳酸片球菌HAO2018胞外多糖的还原能力见图5。

图5 乳酸片球菌HAO2018胞外多糖的还原能力
Fig.5 Restoring ability of EPS of P.acidilactici HAO2018
由图5可知,HAO2018的胞外多糖有一定的还原能力,当EPS的质量浓度为2.0、4.0、6.0、8.0、10.0 mg/mL,其还原能力分别为(14.03±0.15)%、(25.60±0.06)%、(36.93±0.15)%、(45.50±0.12)%、(54.10±0.15)%。而2.0 mg/mL维生素C的还原能力为(97.80±0.46)%。与我们的研究结果相似,发酵乳杆菌CECT5716[22]和双歧杆菌BB12[23]的胞外多糖均被证实具有较好的抗氧化活性,具有还原Fe3+的能力。
2.4 抑菌活性
滴加无菌水的纸片周围无抑菌圈出现,表明水对细菌的生长无抑制作用。乳酸片球菌HAO2018胞外多糖对7种食源性致病菌的抑菌程度不同,抑菌效果见表2。
表2 乳酸片球菌HAO2018胞外多糖的抑菌效果
Table 2 Antibacterial effect of EPS of P.acidilactici HAO2018

试验菌种抑菌圈直径/mmEPS用量5 μgEPS用量10 μg青霉素用量/10 μg无菌水对照金黄色葡萄球菌9.00±2.0017.67±2.0857.00±2.65-鼠伤寒沙门氏菌-13.67±1.5326.67±3.06-单增李斯特菌--45.00±1.00-铜绿假单胞菌--13.33±1.53-阪崎克罗诺杆菌6.30±0.6110.57±0.5111.00±1.00-大肠杆菌-1.30±0.3617.67±2.08-志贺氏菌10.17±1.7616.67±3.0616.33±1.53-
注:高度敏感:抑菌圈直径>15 mm;中度敏感:抑菌圈直径10~15 mm;低度敏感:抑菌圈直径7~9 mm;不敏感:抑菌圈直径<7 mm;“-”表示无抑菌圈。
由表2可知,不同浓度的HAO2018的EPS抑菌能力有差别,低浓度的EPS可能无明显抑菌效果。随EPS浓度升高,其抑菌能力逐渐增强。HAO2018的EPS对金黄色葡萄球菌、志贺氏菌、鼠伤寒沙门氏菌和阪崎克罗诺杆菌展示出一定的抑制作用,其中高剂量的EPS(10 μg)对志贺氏菌的抑制效果高于相同剂量的青霉素,对阪崎克罗诺杆菌的抑制效果也与青霉素相当。HAO2018的EPS对大肠杆菌的抑制效果较差,对单增李斯特菌和铜绿假单胞菌无抑制作用。丁涛等[24]研究发现短小芽孢杆菌Bacillus pumilus XQ的粗胞外多糖对沙门氏菌、金黄色葡萄球菌、大肠杆菌具有一定的抑制作用。RANI等[25]证实加氏乳杆菌(Lactobacillus gasseri)FR4的异源胞外多糖对单增李斯特菌MTCC657具有较好的抑制效果。
2.5 抗肿瘤活性
乳酸片球菌HAO2018胞外多糖对肿瘤细胞的抑制作用见图6。

a-EPS处理HT-29细胞48 h;b-EPS处理HT-29细胞72 h
图6 乳酸片球菌HAO2018胞外多糖对HT-29细胞 增殖的抑制作用
Fig.6 Inhibitory effect of EPS of P.acidilactici HAO2018 on the proliferation of HT-29 cells
由图6可知,当0.5~2 mg/mL的EPS作用于HT-29细胞48 h时,随着EPS浓度的升高,对细胞增殖的抑制作用逐渐增强;当EPS质量浓度达2.0 mg/mL时,抑制率达到(80.46±5.86)%(P<0.05)。当处理72 h后,低浓度的EPS(0.5 mg/mL)也表现出较高的抑制率(51.23±1.86)%,当EPS质量浓度达2.0 mg/mL时,抑制率达到(96.05±1.06)%。SUN等[26]分析了4株植物乳植杆菌(Lactiplantibacillus plantarun)的胞外粗多糖对HT-29细胞的抑制作用,发现其中植物乳植杆菌12的抗肿瘤效果最好,在质量浓度为0.5 mg/mL处理48 h时抑制率最大,达到(31.3±0.46)%。SONG等[27]证实副干酪乳酪杆菌副干酪亚种(Lacticaseibacillus paracasei subsp. paracasei)M5L胞外多糖在1 mg/mL作用48 h时对HT-29细胞增殖抑制效果最好,达到80%左右,但72 h时抑制率下降到40%左右。综合上述实验结果表明乳酸片球菌HAO2018胞外多糖具有较高的抗肿瘤活性。
3 结论
综上所述,乳酸片球菌HAO2018菌株具有良好的酸耐受能力和胆盐耐受能力,且对卡那霉素等大部分抗生素敏感。其胞外多糖具有强的抗氧化能力、对食源性致病菌志贺氏菌和阪崎克罗诺杆菌具有较好的抑制效果,对肿瘤细胞HT-29具有较强的抑制作用,为进一步揭示乳酸片球菌的抗氧化和抗肿瘤等的功能及作用机制的研究奠定了基础。在本研究中尚未对乳酸片球菌HAO2018的胞外多糖进行结构解析,因此在后续的工作中将进一步对多糖进行分离纯化并解析多糖的结构,分析其构效关系。总之,这些研究可为益生菌及其胞外多糖在相关功能食品、医药产品和化学工业品的开发应用提供理论依据。
[1] SHENG S X, FU Y B, PAN N, et al.Novel exopolysaccharide derived from probiotic Lactobacillus pantheris TCP102 strain with immune-enhancing and anticancer activities[J].Frontiers in Microbiology, 2022, 13:1015270.
[2] STAGE M, WICHMANN A, JØRGENSEN M, et al.Lactobacillus rhamnosus GG genomic and phenotypic stability in an industrial production process[J].Applied and Environmental Microbiology, 2020, 86(6): e02780-19.
[3] ZHOU X T, QI W C, HONG T, et al.Exopolysaccharides from Lactobacillus plantarum NCU116 regulate intestinal epithelial barrier function via STAT3 signaling pathway[J].Journal of Agricultural and Food Chemistry, 2018, 66(37):9719-9727.
[4] LI S J, CHEN T T, XU F, et al.The beneficial effect of exopolysaccharides from Bifidobacterium bifidum WBIN03 on microbial diversity in mouse intestine[J].Journal of the Science of Food and Agriculture, 2014, 94(2):256-264.
[5] AI L Z, ZHANG H, GUO B H, et al.Preparation, partial characterization and bioactivity of exopolysaccharides from Lactobacillus casei LC2 W[J].Carbohydrate Polymers, 2008, 74(3):353-357.
[6] DILNA S V, SURYA H, ASWATHY R G, et al.Characterization of an exopolysaccharide with potential health-benefit properties from a probiotic Lactobacillus plantarum RJF 4[J].LWT-Food Science and Technology, 2015, 64(2):1179-1186.
[7] LIU C F, TSENG K C, CHIANG S S, et al.Immunomodulatory and antioxidant potential of Lactobacillus exopolysaccharides[J].Journal of the Science of Food and Agriculture, 2011, 91(12):2284-2291.
[8] DI W, ZHANG L W, YI H X, et al.Exopolysaccharides produced by Lactobacillus strains suppress HT-29 cell growth via induction of G0/G1 cell cycle arrest and apoptosis[J].Oncology Letters, 2018, 16(3):3577-3586.
[9] LI B L, DU P, SMITH E E, et al.In vitro and in vivo evaluation of an exopolysaccharide produced by Lactobacillus helveticus KLDS1.8701 for the alleviative effect on oxidative stress[J].Food &Function, 2019, 10(3):1707-1717.
[10] XIAO L Y, GE X J, YANG L, et al.Anticancer potential of an exopolysaccharide from Lactobacillus helveticus MB2-1 on human colon cancer HT-29 cells via apoptosis induction[J].Food &Function, 2020, 11(11):10170-10181.
[11] RIAZ RAJOKA M S, JIN M L, ZHAO H B, et al.Functional characterization and biotechnological potential of exopolysaccharide produced by Lactobacillus rhamnosus strains isolated from human breast milk[J].LWT, 2018, 89:638-647.
[12] 何红鹏, 张同存, 王楠, 等.一种具有抗宫颈癌作用的乳酸片球菌及应用:中国, CN111849805B[P].2022-04-22.
HE H P, ZHANG T C, WANG N, et al.A kind of Lactobacillus with anti-cervical cancer effect and its application:China, CN111849805B[P].2022-04-22.
[13] DE OLIVEIRA COELHO B, FIORDA-MELLO F, DE MELO PEREIRA G, et al.In vitro probiotic properties and DNA protection activity of yeast and lactic acid bacteria isolated from a honey-based kefir beverage[J].Foods, 2019, 8(10):485.
[14] GAO X J, WEI J H, HAO T Y, et al.Dysgonomonas mossii strain ShenZhen WH 0221, a new member of the genus dysgonomonas isolated from the blood of a patient with diabetic nephropathy, exhibits multiple antibiotic resistance[J].Microbiology Spectrum, 2022, 10(4):e02381-21.
[15] TAYLAN O, YILMAZ M T, DERTLI E.Partial characterization of a levan type exopolysaccharide (EPS) produced by leuconostoc mesenteroides showing immunostimulatory and antioxidant activities[J].International Journal of Biological Macromolecules, 2019, 136:436-444.
[16] TABIBZADEH F, ALVANDI H, HATAMIAN-ZARMI A, et al.Antioxidant activity and cytotoxicity of exopolysaccharide from mushroom Hericium coralloides in submerged fermentation[J].Biomass Conversion and Biorefinery, 2022:1-11.
[17] LIU Y W, GLOAG E S, HILL P J, et al.Interbacterial antagonism mediated by a released polysaccharide[J].Journal of Bacteriology, 2022, 204(5):e00076-22.
[18] SUN N X, LIU H P, LIU S J, et al.Purification, preliminary structure and antitumor activity of exopolysaccharide produced by Streptococcus thermophilus CH9[J].Molecules, 2018, 23(11):2898.
[19] 李尧, 卢承蓉, 刘丹, 等.乳酸片球菌胞外多糖的分离纯化、结构分析及抗氧化活性研究[J].食品与发酵工业, 2021, 47(19):35-42.
LI Y, LU C R, LIU D, et al.Structure and antioxidant activity of Pediococcus lactis extracellular polysaccharide[J].Food and Fermentation Industries, 2021, 47(19):35-42.
[20] SONG Y R.Exopolysaccharide produced by Pediococcus acidilactici M76 isolated from the Korean traditional rice wine, Makgeolli[J].Journal of Microbiology and Biotechnology, 2013, 23(5):681-688.
[21] KUMAR R, BANSAL P, SINGH J, et al.Purification partial structural characterization and health benefits of exopolysaccharides from potential probiotic Pediococcus acidilactici NCDC 252[J].Process Biochemistry, 2020, 99:79-86.
[22] 方伟, 李佳佳, 耿伟涛, 等.发酵乳杆菌CECT 5716产胞外多糖培养基成分优化及抗氧化活性研究[J].中国酿造, 2022, 41(11):187-192.
FANG W, LI J J, GENG W T, et al.Optimization for medium components of exopolysaccharide production by Lactobacillus fermentum CECT 5716 and antioxidant activity[J].China Brewing, 2022, 41(11):187-192.
[23] 谢莹, 蔡国林, 刘逸凡, 等.双歧杆菌BB12胞外多糖发酵条件优化及抗氧化活性研究[J].食品与发酵工业, 2019, 45(23):55-59.
XIE Y, CAI G L, LIU Y F, et al.Optimization of fermentation conditions and antioxidant activities of exopolysaccharide from Bifidobacterium lactis Bb12[J].Food and Fermentation Industries, 2019, 45(23):55-59.
[24] 丁涛, 靳宝林, 杨晓宇, 等.一株高产胞外多糖的乳酸芽孢杆菌的筛选及功能鉴定[J].四川大学学报(自然科学版), 2021, 58(6):159-166.
DING T, JIN B L, YANG X Y, et al.Screening and functional identification of a Lactobacillus strain with high exopolysaccharide production[J].Journal of Sichuan University (Natural Science Edition), 2021, 58(6):159-166.
[25] RANI R P, ANANDHARAJ M, DAVID RAVINDRAN A.Characterization of a novel exopolysaccharide produced by Lactobacillus gasseri FR4 and demonstration of its in vitro biological properties[J].International Journal of Biological Macromolecules, 2018, 109:772-783.
[26] SUN M Y, LIU W W, SONG Y L, et al.The effects of Lactobacillus plantarum-12 crude exopolysaccharides on the cell proliferation and apoptosis of human colon cancer (HT-29) cells[J].Probiotics and Antimicrobial Proteins, 2021, 13(2):413-421.
[27] SONG W, HU P, GUO S L, et al.Oxidative stress and endoplasmic reticulum stress contribute to L.paracasei subsp.paracasei M5L exopolysaccharide-induced apoptosis in HT-29 cells[J].Food Science &Nutrition, 2021, 9(3):1676-1687.