食品安全问题是世界范围内的重大公共卫生问题,其中食源性致病菌导致的食物中毒事件在世界各地频繁发生,严重影响人类健康和生命安全。单增李斯特菌(Listeria monocytogenes,LM)和金黄色葡萄球菌(Staphylococcus aureus,SP)是常见的食源性致病菌。传统平板培养的检测技术虽然结果可靠,但操作过程繁琐,通常需要4~7 d,结果具有滞后性,不能满足当前快速检测的需求[1-2]。常规PCR检测方法需变温扩增,而且根据电泳分析PCR产物,不能定量分析,不适合高通量分析且难以实现自动化,不能满足现场检测的要求[3]。实时荧光PCR方法通过荧光信号对PCR反应进行实时监测,可定量检测,但对实验操作及环境要求较高[4]。
环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)是由Notomi等提出的一种核酸体外扩增技术[5],可在65 ℃恒温下,利用4条或6条引物和具有链置换特异性的Bst DNA聚合酶在30~60 min将目标基因扩增109~1010倍[6],该方法特异性好、灵敏度高,已在不同检测领域得到广泛应用[7-9]。但多重LAMP检测时要求反应中不能出现引物自联和错配的情况,这就需要精准地设计多个复合引物,使得引物设计较普通PCR技术更加困难[10]。现阶段,应用于LAMP的实时检测主要分为实时浊度法和实时荧光法,实时荧光法主要包括荧光染料法和荧光探针法[11-12]。实时浊度法由于粒径大小不一、空间分布不均匀和焦磷酸镁再溶解等现象,灵敏度相对较低[13]。荧光染料法中引物二聚体或者非特异扩增产物易与荧光染料结合而显色,造成假阳性[12]。因此,上述2种方法均难以应用于多基因的同时检测[14],而基于检测淬灭基团释放(detection of amplification by release of quenching,DARQ)的环介导等温扩增技术(DARQ-LAMP)可以通过不同的荧光和淬灭基团组合实现多目的基因的检测,具有良好的发展前景和应用潜力[15]。
编码李斯特菌溶血素O(listeriolysin O,LLO)毒素的hly基因是单增李斯特菌致病基因组中特有的毒力基因,在单增李斯特菌检测中具有较好的特异性[16]。金黄色葡萄球菌耐热核酸酶基因nuc在其临床分离株中具有高度保守性,是金黄色葡萄球菌核酸鉴定中常用的特异性靶点[17]。为此,本研究针对单增李斯特菌与金黄色葡萄球菌的这2种特异性基因设计引物,建立一种双重DARQ-LAMP方法同时检测单增李斯特菌与金黄色葡萄球菌,能够实现在一次LAMP反应中同时快速、准确地检测两种食源性致病菌,为多重LAMP检测食源性致病菌提供参考。
1 材料与方法
1.1 材料与试剂
目标菌株:单增李斯特菌(Listeria monocytogenes)ATCC 19115、金黄色葡萄球菌(Staphylococcus aureus)CGMCC 1.89,以及非目标菌株:英诺克李斯特菌(L.innocua)ATCC 33090、斯氏李斯特氏菌(L.seeligeri)ATCC 35967、伊氏利斯特菌(L.ivanovii)ATCC 19119、大肠杆菌(Escherichia coli)ATCC 25922、屎肠球菌(Enterococcus faecium)ATCC 29212、福氏志贺氏菌(Shigella flexneri)ATCC 12022、副溶血弧菌(Vibrio parahaemolyticus)ATCC 17802、表皮葡萄球菌(S.epidermidis)CGMCC 26069、铜绿假单胞菌(Pseudomonas aeruginosa)ATCC 9027、枯草芽孢杆菌(Bacillus subtilis)CGMCC 1.1869、马红球菌(Rhodococcus equi)ATCC 6939、产气肠杆菌(Enterobacter aerogenes)ATCC 13048,均于实验室保藏。
Ezup柱式细菌基因组DNA快速抽提试剂盒(B518255)、溶菌酶、Bst DNA聚合酶、Taq PCR Master Mix、Bst LF DNA Polymerase、10×ThermoPol缓冲液、MgCl2溶液、dNTP Mixture、灭菌双蒸水,上海生工(生物工程)股份有限公司;Eve Green(20×水溶液),翌圣生物科技(上海)有限公司;OXOID;Baird-Parker琼脂基础、PALCAM琼脂粉、脑心浸出液肉汤(brain heart infusion broth,BHI),广东环凯微生物科技有限公司。
1.2 仪器与设备
Forma Class Ⅱ生物安全柜,美国Thermo公司;CFX 96TM荧光定量PCR仪,伯乐生命医学产品(上海)有限公司;SP-02生化培养箱,广州市绿向生物科技有限公司;TP600梯度PCR仪,日本TaKaRa仪器有限公司;NanoDrop 2000c超微量分光光度计,赛默飞世尔科技(中国)有限公司;5417R高速冷冻离心机,德国Eppendorf股份有限公司。
1.3 实验方法
1.3.1 菌株的培养
保藏于-80 ℃的单增李斯特菌和金黄色葡萄球菌分别在BHI培养基、TSB培养基中37 ℃,150 r/min活化16 h备用。
1.3.2 DNA模板的制备
采用细菌基因组DNA快速抽提试剂盒提取模板DNA,具体步骤按照试剂盒说明书进行,可立即进行下一步实验或于-20 ℃保存。
1.3.3 LAMP引物和探针的设计与合成
从GenBank数据库获得金黄色葡萄球菌(GenBank:DQ507380.1)、单增李斯特菌(GenBank:HM589597.1)的基因序列,基于序列信息和相关前期研究[16-19],使用LAMP引物设计工具Primer Explorer V5(https://primerexplorer.jp/e/)进行引物设计。由上海生工生物有限公司合成引物和探针,引物序列见表1。利用不同探针的标记物的不同,可形成不同的扩增曲线,具体荧光基团和淬灭基团的参数见表2。
表1 LAMP引物和探针序列
Table 1 Primer and probe sequences of the LAMP

目标基因引物名称引物序列金黄色葡萄球菌nuc基因nuc-F3TCACTACTAGTTGCTTAGTGTTA-ACTnuc-B3CTTCAGGACCATATTTCTCTACACCnuc-FIPACTGTTGGATCTTCAGAACCACT-TCTTTCAAGTCTAAGTAGCTCAG-CAAnuc-BIPAAGCGATTGATGGTGATACGGTTA-ATCAGGTGTATCAACCAATAAT-AGTCTnuc-BIP-QCy5-AAGCGATTGATGGTGATACG-GTTAATCAGGTGTATCAACCAATA-ATAGTCTnuc-Fd*TTAACCGTATCACCATCAATCGCTT-BHQ3单增李斯特氏菌hlyA基因hlyA-F3GAAGTAAATTATGATCCTGAAGGTAhlyA-B3GGTAAGTTCCGGTCATCAAhlyA-FIPATGTGAAATGAGCTAGCTT-GCTCGAAATTGTTCAACATA-AAAACTGGhlyA-BIPTTGCCTGGTAACGCGAGAAATAC-CGTTCTCCACCATTChlyA-BIP*BHQ1-TTGCCTGGTA-ACGCGAGAAATACCGTTCTCCAC-CATTChlyA-FdTTTCTCGCGTTACCAGGCAA-FAM
注:*为标记的淬灭剂为BHQ1或BHQ3,Fd为B1c互补片段设计的探针,FAM、Cy5为标记的荧光基团。
表2 荧光基团和淬灭基团的参数
Table 2 The parameters of fluorescence groups and quenched groups

参数hlyAnuc荧光基团FAMCy5淬灭基团BHQ-1BHQ-3荧光最大激发波长/nm494643荧光最大发射波长/nm518667淬灭剂淬灭范围/nm480~580620~730发射光颜色绿色红色
1.3.4 双重DARQ-LAMP方法的建立
根据本实验室的前期研究,优化前的双重DARQ-LAMP反应体系(20 μL)为hlyA-F3与hlyA-B3各0.1 μmol/L,hlyA-BIP与hlyA-QPD按照一定比例加入,终浓度总和为0.4 μmol/L,hlyA-FIP为0.4 μmol/L,nuc-F3与nuc-B3各0.1 μmol/L,nuc-BIP与nuc-QPD按照滴定比例加入(设置为体系的10%),终浓度总和为0.4 μmol/L,nuc-FIP为0.4 μmol/L,Bst 3.0 DNA聚合酶0.32 U/μL,10×Reation Buffer 2 μL,dNTPs 1.4 mmol/L,Mg2+ 8 mmol/L,金黄色葡萄球菌和单增李斯特的等体积混合DNA模板各1.6 μL,补充无菌蒸馏水至20 μL。反应条件设置为65 ℃ 1 min,共60个循环,每个循环结束时采集荧光信号;反应结束后80 ℃灭酶2 min。
分别对DAQR-LAMP反应的引物浓度比、反应温度、dNTPs浓度以及Mg2+浓度进行优化,其他条件保持不变,进行实时DARQ-LAMP反应,通过Ct值及扩增产物荧光值确定适宜的反应条件。每个反应设置3个复孔。具体优化参数设置见表3。
表3 双重DARQ-LAMP方法条件优化
Table 3 Optimization of the reaction conditions of dual DARQ-LAMP method
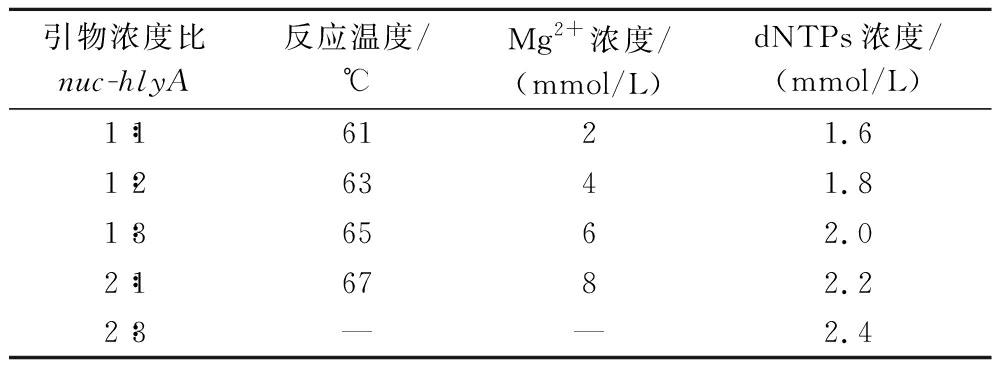
引物浓度比nuc-hlyA反应温度/℃Mg2+浓度/(mmol/L)dNTPs浓度/(mmol/L)1∶16121.61∶26341.81∶36562.02∶16782.22∶3——2.4
注:—表示未设置该条件。
1.3.5 双重DARQ-LAMP特异性和灵敏度评价
以金黄色葡萄球菌和单增李斯特菌标准菌株,以及12株非目标菌株进行双重DARQ-LAMP反应,对该方法的特异性进行验证。荧光扩增曲线为“S”型或类“S”型则判定为阳性,为平的直线则判定为阴性。由于引物、探针标记的荧光物质不同,可同时呈现不同标记物的不同颜色的扩增曲线。
将10倍梯度稀释后的金黄色葡萄球菌DNA模板和单增李斯特菌DNA模板分别等体积混合,形成梯度稀释的混合DNA模板,以ddH2O作为空白对照,进行双重DARQ-LAMP以确定方法的灵敏度。
上述每个反应设置3个复孔,并重复2次实验。
1.3.6 双重DARQ-LAMP方法在样品检测中的应用
1.3.6.1 背景细菌对双重DARQ-LAMP的影响
将常见的污染菌大肠杆菌作为背景细菌,按照1.3.1节的方法制备金黄色葡萄球菌、单增李斯特菌以及大肠杆菌菌悬液。称取10 g未经目标菌株污染的样品,将高浓度非靶标细菌大肠杆菌加入有金黄色葡萄球菌、单增李斯特菌2种目标菌株的混合菌液的样品中。按照1.3.2节的方法进行DNA模板的制备。判定背景细菌对所建立的双重实时荧光LAMP的影响。
1.3.6.2 双重DARQ-LAMP方法在人工模拟样品检测中的灵敏度
取9 mL经GB 4789.10—2016和GB 4789.30—2016检测的无金黄色葡萄球菌和单增李斯特菌污染的新鲜牛奶,分别加入1 mL 10倍梯度稀释的2种目标菌株的菌悬液制备成不同浓度的人工污染样品,将人工污染样品加入至90 mL生理盐水后均质,混匀吸取1 mL匀液,按照1.3.2节的方法进行DNA模板的制备,按照1.3.5节灵敏度实验的反应体系及条件进行检测。
1.3.7 数据处理与统计分析
实验平行进行3次及以上,荧光定量PCR仪中导出LAMP反应扩增曲线,利用Origins 2021(Electronic Arts Inc公司)进行图像处理分析。
2 结果与分析
2.1 双重DARQ-LAMP方法的建立
2.1.1 引物浓度的优化
对于多重反应,靶标数的增加将使每一靶标相应的引物的浓度显著下降,使得扩增速度、信号强度以及检测动态范围也随之下降,因此对多重引物浓度的比例进行优化是有必要的。
当nuc和hlyA引物浓度比为1∶1时,金黄色葡萄球菌和单增李斯特菌扩增的Ct值分别为32、30 min,荧光阈值均为1 700左右(图1-A),说明此浓度比例下,有良好的扩增效率和荧光阈值,且未出现明显差异的扩增效率。将nuc和hlyA引物浓度比调整为1∶2时,单增李斯特菌Ct值减小至26 min,金黄色葡萄球菌Ct值增大至35 min(图1-B),可能是hlyA引物浓度相对增加,使得底物模板更易与之反应。

A-nuc和hlyA引物浓度比1∶1;B-nuc和hlyA引物浓度比1∶2;C-nuc和hlyA引物浓度比1∶3;D-nuc和hlyA引物浓度比2∶1; E-nuc和hlyA引物浓度比2∶3
图1 双重DARQ-LAMP方法反应引物浓度比的优化
Fig.1 Optimization of concentration ratio of primers for dual DARQ-LAMP method
注:FAM为单增李斯特菌hlyA基因的反应通道;Cy5为金黄色葡萄球菌nuc基因的反应通道;NTC为空白对照(下同)。
当nuc和hlyA引物浓度比为1∶3和2∶1时,靶基因的DARQ-LAMP反应的扩增效率出现明显差异。引物浓度比为1∶3时,对单增李斯特菌的扩增并未产生显著影响,但金黄色葡萄球菌扩增的Ct值为41 min,荧光值仅1 000左右(图1-C),说明此时靶基因nuc扩增效率明显降低。相似地,当nuc和hlyA引物浓度比为2∶1时,则金黄色葡萄球菌的扩增未发生显著变化,而单增李斯特菌扩增的Ct值为38 min,且荧光值为1 500左右(图1-D),说明在此引物浓度比下,靶基因hlyA扩增效率明显降低。
若nuc和hlyA引物浓度比为2∶3,金黄色葡萄球菌和单增李斯特菌Ct值分别为37、30 min(图1-E),扩增效率与荧光阈值和引物浓度比为1∶1时类似,说明当nuc和hlyA引物浓度相当时,两者的扩增效率最佳,故确定nuc和hlyA适宜的引物浓度比为1∶1。进一步证实了在多重反应体系中,如引物间浓度配比不合适,可能会导致体系中某一基因扩增量高,而另一基因扩增量低甚至不扩增,即“优势扩增”现象[20]。因此,多重反应体系中合适的引物浓度配比十分重要。
2.1.2 反应温度的优化
由图2可知,在双重的DARQ-LAMP反应中,反应温度为67 ℃时单增李斯特菌无扩增反应,金黄色葡萄球菌的荧光值和扩增效率较低。在65 ℃时金黄色葡萄球菌和单增李斯特菌Ct值为29 min和27 min,荧光值较高。反应温度为63 ℃时,单增李斯特菌Ct值为23 min,金黄色葡萄球菌Ct值增大至35 min,荧光值较高。在61 ℃时金黄色葡萄球菌和单增李斯特菌Ct值均为37 min,扩增效率和荧光值均明显降低。综合考虑检出时间、荧光强度等因素,确定65 ℃为该反应适宜的反应温度。这说明该双重DARQ-LAMP体系对反应温度的变化较为敏感,不适的温度条件将导致体系中基因扩增量降低,甚至出现不扩增的现象。

图2 双重DARQ-LAMP方法反应温度的优化
Fig.2 Optimization of temperature for dual DARQ-LAMP method
2.1.3 Mg2+和dNTPs浓度的优化
如图3-A所示,当Mg2+浓度为2 mmol/L时反应无法正常进行,可能是因为Mg2+浓度过低,无法催化Bst DNA聚合酶启动扩增反应,使体系无明显扩增;浓度升高到4 mmol/L后,金黄色葡萄球菌和单增李斯特菌Ct值为42 min和53 min;当浓度升高到6 mmol/L 时,金黄色葡萄球菌和单增李斯特菌Ct值分别为35 min和29 min,此时扩增效率最高;随着Mg2+浓度增加到8 mmol/L,扩增效率开始降低。考虑双重DARQ-LAMP方法快速、高效的特点,确定反应的最适Mg2+浓度为6 mmol/L。说明Mg2+是该反应必需的,只有当Mg2+浓度高于4 mmol/L后反应才能正常进行,过高浓度的Mg2+又会对反应起抑制作用,这可能与Mg2+可影响Bst DNA聚合酶的活性从而影响催化反应有关[21]。由图3-B可知,在双重DARQ-LAMP体系中,dNTPs浓度对反应的扩增效率无较大影响,主要影响荧光值的大小。当dNTPs浓度为1.8 mmol/L时,两菌荧光值达到最大,而Ct值最小,故确定1.8 mmol/L为双重DARQ-LAMP反应的最优dNTPs浓度。

A-Mg2+;B-dNTPs
图3 双重DARQ-LAMP方法Mg2+以及dNTPs浓度的优化
Fig.3 Optimization of Mg2+ and dNTPs concentrations for dual DARQ-LAMP method
2.2 双重DARQ-LAMP特异性和灵敏度评价
以建立的双重DARQ-LAMP方法对2株目标菌株和12株非目标菌株进行检测,发现仅2株目标菌株被检出,而其他12株非目标菌株均无扩增(图4-A),这表明所建立的双重DARQ-LAMP方法具有较好的特异性。由图4-B可知,在双重DARQ-LAMP反应中,有5个浓度的DNA混合模板出现较好扩增,故该方法对单增李斯特菌的检测限为7.3×102 copies/mL,对金黄色葡萄球菌的检测限为2.3×102 copies/mL。
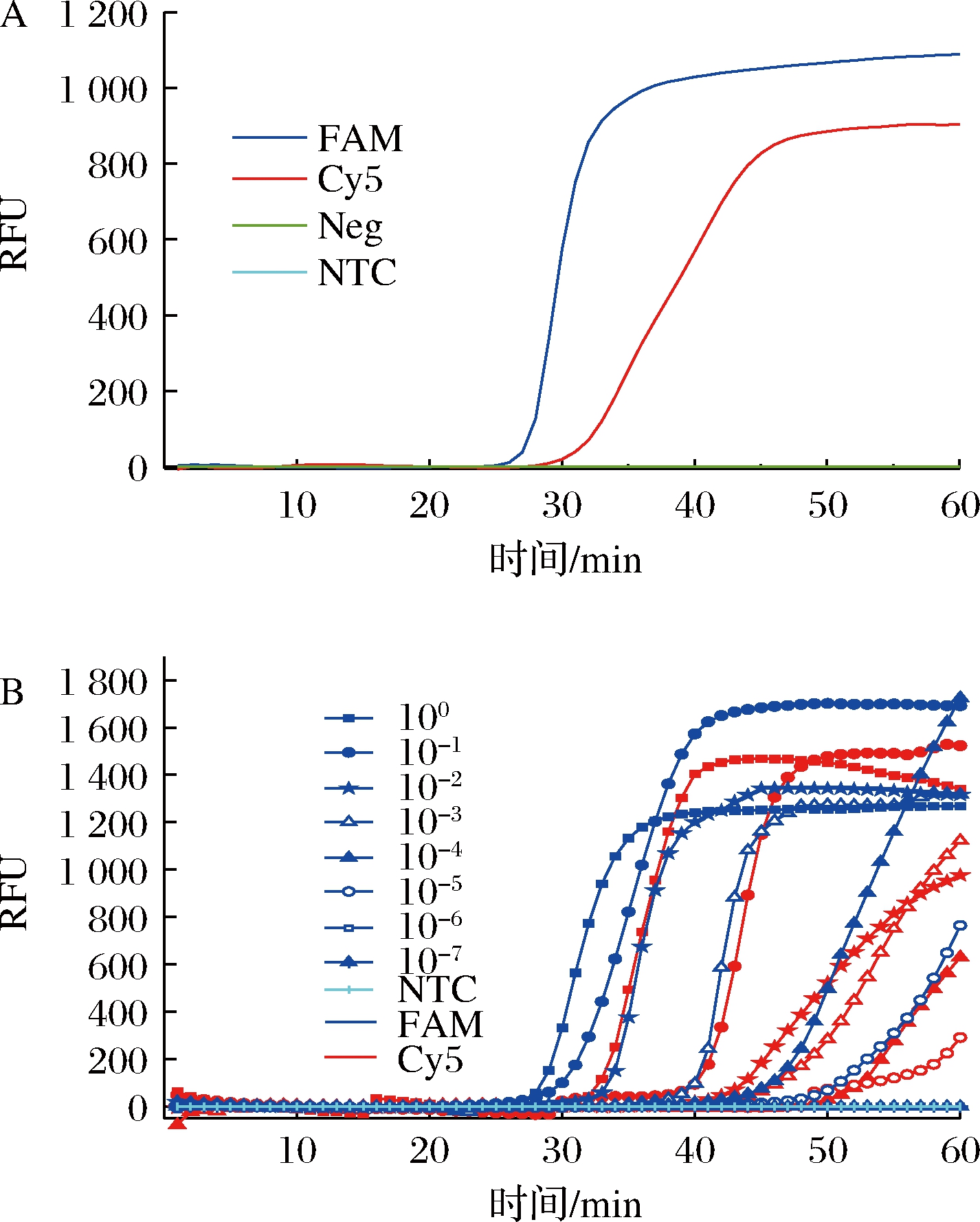
A-特异性;B-灵敏度
图4 双重DARQ-LAMP方法的特异性及灵敏度
Fig.4 The specificity and sensitivity of dual DARQ-LAMP method
注:Neg为阴性对照;100~10-7代表10倍梯度稀释的金黄色葡萄球 菌和单增李斯特菌的混合DNA模板,其对应的模板浓度由大到小 分别为金黄色葡萄球菌2.3×107~2.3×100 copies/mL,单增李斯 特菌7.3×107~7.3×100 copies/mL。
2.3 双重DARQ-LAMP方法在样品检测中的应用
2.3.1 背景细菌对双重DARQ-LAMP的影响
由图5可知,即使在背景细菌存在下,双重DARQ-LAMP反应的检出时间和荧光值都未受影响,背景细菌对于检测金黄色葡萄球菌和单增李斯特菌的影响可以忽略不计。因此,即使在有背景细菌共存的食物基质中,我们建立的双重DARQ-LAMP方法也可得到较好的应用。

图5 背景细菌对双重DARQ-LAMP方法的影响
Fig.5 Effect of background bacteria on dual DARQ-LAMP method
2.3.2 双重DARQ-LAMP方法检测人工模拟样品
对10倍梯度稀释的单增李斯特菌(2.8×101~2.8×107 CFU/mL)和金黄色葡萄球菌(2.4×101~2.4×107 CFU/mL)进行DNA模板提取,进行双重DARQ-LAMP反应。如图6所示,2种细菌均有4个浓度可扩增,其中金黄色葡萄球菌检测限为2.4×104 CFU/mL,单增李斯特菌为2.8×104 CFU/mL。

图6 双重DARQ-LAMP方法对人工模拟样品检测的灵敏度
Fig.6 The sensitivity of dual DARQ-LAMP method for the detection of the spiked samples
3 讨论与结论
近年来,环介导等温扩增技术因其具灵敏度高、特异性强、快速检测、成本低且不依赖精密仪器的特点,已经成为检测困难样品的有效分析方法,广泛应用于致病菌的快速检测。研究表明单重LAMP技术检测单增李斯特菌和金黄色葡萄球菌的灵敏度比PCR方法高10倍[22-24]。为了进一步提高检测效率,多重LAMP技术成为近年来的研究热点。针对沙门氏菌invA基因、金黄色葡萄球菌nuc基因设计引物,建立双重LAMP方法,灵敏度均达到102 fg/μL,有效区分了不同菌株[25]。刘丹等[19]基于实时荧光LAMP建立双重检测体系,该方法对副溶血弧菌及金黄色葡萄球菌的检测限可达到3.62×102 copies/mL和1.45×104 copies/mL。但多重LAMP反应中仍存在较严重的多套引物间相互干扰问题,难以保持较好的特异性和灵敏度。
针对荧光染料存在假阳性和特异性较低的问题,研究者尝试利用荧光探针代替荧光染料承担发射信号的功能,将环引物探针设计成发夹结构,当目标探针与环引物未结合到目的片段时,荧光基团和淬灭基团相互靠近,荧光基团被淬灭而不发荧光,若与目的片段结合,在内切酶作用下发夹结构被打开,荧光基团与淬灭基团分离,荧光基团被激活而发出荧光信号,提升了检测的特异性和灵敏度[26]。若在一条内引物的5′端修饰荧光基团(或淬灭基团),并加入一条能与F1c(或B1c)部分互补且3′端修饰淬灭基团(或荧光基团)的探针,将实现多种靶基因同时检测[27]。TANNER等[16]建立的多重DARQ-LAMP反应体系,对噬菌体λ基因组DNA和HeLa基因组DNA、大肠杆菌基因组DNA以及秀丽隐杆线虫基因组DNA检测时,发现该方法可稳定检测拷贝数差异高达107倍的2种靶基因,检测限达到10 copies/mL,并同时检测3~4种扩增效率不同的靶标。综上说明了DARQ-LAMP方法在食品检测中的广泛适用性。
本研究建立了能同时检测单增李斯特菌和金黄色葡萄球菌的双重DARQ-LAMP方法,并对反应条件进行了优化,确定单增李斯特菌和金黄色葡萄球菌引物浓度比为1∶1,适宜的反应温度为65 ℃,dNTPs和Mg2+浓度为1.8 mmol/L和6 mmol/L。通过添加荧光基团和淬灭基团,利用不同荧光通道检测所携带的荧光基团,实现了在一个反应管中同时检测单增李斯特菌和金黄色葡萄球菌,提高了方法的特异性、灵敏度和检测效率,对单增李斯特菌和金黄色葡萄球菌的检测限分别为7.3×102 copies/mL和2.3×102 copies/mL。然而,多重PCR检测方法对单增李斯特菌和大肠杆菌等细菌的检测限为105~106 CFU/mL,明显高于本研究建立的双重DARQ-LAMP方法[28]。此外,本研究测定了该方法在实际样品中的可行性,发现背景细菌对检测无影响,在模拟样品检测中对单增李斯特菌和金黄色葡萄球菌的检测限分别为2.8×104 CFU/mL和2.4×104 CFU/mL。同类LAMP检测方法中,一种基于芯片技术与LAMP技术联用,可同时检测单增李斯特菌、大肠杆菌和沙门氏菌,检测限均为105 CFU/mL[29]。免疫磁珠分离技术与LAMP技术联用检测牛肉中的金黄色葡萄球菌和鼠伤寒沙门氏菌,灵敏度分别为4.4×104 CFU/mL和1.2×103 CFU/mL[30]。上述2种方法的检测限与本研究的结果基本一致。在实际应用中,结合芯片技术和免疫磁珠分离可能会使检测成本增加,但本研究建立的双重DARQ-LAMP方法简便,并在60 min内即可完成检测,达到了快捷简易的目的。
双重DARQ-LAMP方法操作简单方便,无需昂贵的设备,有良好的特异性和灵敏度,可实现对2种细菌的同时检测,是一种快速、准确的实时分子检测技术。该方法仍存在由多套引物产生的引物相互干扰、形成气溶胶污染等问题,未来我们可以将这种反应体系与微流控技术、芯片实验室等微型实验室技术结合,实现检测技术微型化、自动化,使本研究所建立的反应体系具有更强的应用潜力和发展前景。
[1] 马佳睿, 谢婧, 李瑞乾, 等. LAMP在食源性致病菌检测中的应用进展[J]. 黑龙江畜牧兽医, 2021(17):39-43.
MA J R, XIE J, LI R Q, et al. Application progress on LAMP in detection of food-borne pathogens[J]. Heilongjiang Animal Science and Veterinary Medicine, 2021(17):39-43.
[2] ZHAO X H, LIN C W, WANG J, et al. Advances in rapid detection methods for foodborne pathogens[J]. Journal of Microbiology and Biotechnology, 2014, 24(3):297-312.
[3] LAW J W F, AB MUTALIB N S, CHAN K G, et al. Rapid methods for the detection of foodborne bacterial pathogens: Principles, applications, advantages and limitations[J]. Frontiers in Microbiology, 2015, 5:770.
[4] 刘洪蕾, 王真. 食源性单核细胞增生李斯特氏菌检测方法研究进展[J]. 动物医学进展, 2022, 43(10):111-116.
LIU H L, WANG Z. Progress on detection methods of foodborne Listeria monocytogenes[J]. Progress in Veterinary Medicine, 2022, 43(10):111-116.
[5] NOTOMI T, OKAYAMA H, MASUBUCHI H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Research, 2000, 28(12): e63.
[6] LI Y M, FAN P H, ZHOU S S, et al. Loop-mediated isothermal amplification (LAMP): A novel rapid detection platform for pathogens[J]. Microbial Pathogenesis, 2017, 107:54-61.
[7] LEE J E, MUN H, KIM S R, et al. A colorimetric Loop-mediated isothermal amplification (LAMP) assay based on HRP-mimicking molecular beacon for the rapid detection of Vibrio parahaemolyticus[J]. Biosensors and Bioelectronics, 2020, 151:111968.
[8] ARUTSELVAN R, REDDY M K, MAKESHKUMAR T. Rapid detection of tomato leaf curl Bengaluru virus through loop mediated isothermal amplification assay[J]. VirusDisease, 2017, 28(3):303-308.
[9] YEASMIN S, TAKABATAKE R, KAGIYA Y, et al. Evaluation of a species-specific, stable, and endogenous sequence of eggplant (Solanum melongena) using LAMP for the detection of genetically modified eggplants[J]. Food Hygiene and Safety Science, 2021, 62(6):180-186.
[10] MAYBORODA O, KATAKIS I, O′SULLIVAN C K. Multiplexed isothermal nucleic acid amplification[J]. Analytical Biochemistry, 2018, 545:20-30.
[11] OSCORBIN I P, BELOUSOVA E A, ZAKABUNIN A I, et al. Comparison of fluorescent intercalating dyes for quantitative loop-mediated isothermal amplification (qLAMP)[J]. BioTechniques, 2016, 61(1):20-25.
[12] QUYEN T L, NGO T A, BANG D D, et al. Classification of multiple DNA dyes based on inhibition effects on real-time loop-mediated isothermal amplification (LAMP): Prospect for point of care setting[J]. Frontiers in Microbiology, 2019, 10:2234.
[13] CHUANG T L, WEI S C, LEE S Y, et al. A polycarbonate based surface plasmon resonance sensing cartridge for high sensitivity HBV loop-mediated isothermal amplification[J]. Biosensors and Bioelectronics, 2012, 32(1):89-95.
[14] ALMASI M A, ALMASI G. Colorimetric immunocapture loop mediated isothermal amplification assay for detection of Impatiens necrotic spot virus (INSV) by GineFinderTM dye[J]. European Journal of Plant Pathology, 2018, 150(2):533-538.
[15] TANNER N A, ZHANG Y H, EVANS T C Jr. Simultaneous multiple target detection in real-time loop-mediated isothermal amplification[J]. BioTechniques, 2012, 53(2):81-89.
[16] KÜHBACHER A, NOVY K, QUEREDA J J, et al. Listeriolysin O-dependent host surfaceome remodeling modulates Listeria monocytogenes invasion[J]. Pathogens and Disease, 2018, 76(8): fty082.
[17] HOEGH S V, SKOV M N, BOYE K, et al. Variations in the Staphylococcus aureus-specific nuc gene can potentially lead to misidentification of meticillin-susceptible and-resistant S. aureus[J]. Journal of Medical Microbiology, 2014, 63(7):1020-1022.
[18] 张小雨, 王雯雯, 马臣杰, 等. 金黄色葡萄球菌LAMP检测方法的建立及应用[J]. 农业生物技术学报, 2021, 29(9):1845-1854.
ZHANG X Y, WANG W W, MA C J, et al. Establishment and application of loop-mediated isothermal amplification assay for detection of Staphylococcus aureus[J]. Journal of Agricultural Biotechnology, 2021, 29(9):1845-1854.
[19] 刘丹, 谢加玲, 张孟雨, 等. 基于实时荧光环介导等温扩增技术同时检测副溶血弧菌与金黄色葡萄球菌[J]. 食品与发酵工业, 2022, 48(22):255-262.
LIU D, XIE J L, ZHANG M Y, et al. Simultaneous detection of Vibrio parahaemolyticus and Staphylococcus aureus by real-time LAMP[J]. Food and Fermentation Industries, 2022, 48(22):255-262.
[20] 纪懿芳, 胡文忠, 姜爱丽, 等. LAMP技术快速检测海产品副溶血弧菌的条件优化[J]. 食品工业科技, 2015, 36(20):59-63; 67.
JI Y F, HU W Z, JIANG A L, et al. Optimize of Loop-mediated isothermal amplification technology in detection of Vibrio parahaemolyticus[J]. Science and Technology of Food Industry, 2015, 36(20):59-63; 67.
[21] 胡元庆, 沈子晨, 李凤霞, 等. 基于blaCARB-17基因建立水产品中副溶血弧菌的环介导等温扩增技术检测方法[J]. 食品与发酵工业, 2020, 46(23):198-206.
HU Y Q, SHEN Z C, LI F X, et al. blaCARB-17-based LAMP assay for detecting Vibrio parahaemolyticus in aquatic products[J]. Food and Fermentation Industries, 2020, 46(23):198-206.
[22] ZHANG L, ZENG J, MA D, et al. Application and evaluation of loop-mediated isothermal amplification method for detecting of Listeria monocytogenes in food[J]. Chinese Journal of Preventive Medicine, 2014, 48(3): 213-217.
[23] NATHANIEL B R, GHAI M, DRUCE M, et al. Development of a loop-mediated isothermal amplification assay targeting lmo0753 gene for detection of Listeria monocytogenes in wastewater[J]. Letters in Applied Microbiology, 2019, 69(4):264-270.
[24] WANG C, LI R, QUAN S, et al. GMO detection in food and feed through screening by visual loop-mediated isothermal amplification assays[J]. Analytical and Bioanalytical Chemistry, 2015, 407(16):4829-4834.
[25] 徐文文, 梁玉林, 王云霞, 等. 二重环介导等温扩增法快速检测乳粉中沙门氏菌和金黄色葡萄球菌[J]. 食品与发酵工业, 2021, 47(2):241-246.
XU W W, LIANG Y L, WANG Y X, et al. Rapid detection of Salmonella and Staphylococcus aureus in milk powder by double loop-mediated isothermal amplification[J]. Food and Fermentation Industries, 2021, 47(2):241-246.
[26] DING X, YIN K, LI Z Y, et al. Cleavable hairpin beacon-enhanced fluorescence detection of nucleic acid isothermal amplification and smartphone-based readout[J]. Scientific Reports, 2020, 10:18819.
[27] NANAYAKKARA I A, WHITE I M. Demonstration of a quantitative triplex LAMP assay with an improved probe-based readout for the detection of MRSA[J]. The Analyst, 2019, 144(12):3878-3885.
[28] 冯可, 胡文忠, 姜爱丽, 等. 鲜切果蔬中4种病原微生物多重PCR检测技术[J]. 食品科学, 2018, 39(6):276-283.
FENG K, HU W Z, JIANG A L, et al. Multiplex PCR method for detection of four foodborne pathogens on fresh-cut fruits and vegetables[J]. Food Science, 2018, 39(6):276-283.
[29] DUARTE C, SALM E, DORVEL B, et al. On-chip parallel detection of foodborne pathogens using loop-mediated isothermal amplification[J]. Biomedical Microdevices, 2013, 15(5):821-830.
[30] 吕观, 常彦磊, 石磊. 免疫磁珠-环介导等温扩增快速检测牛肉中的鼠伤寒沙门氏菌与金黄色葡萄球菌[J]. 肉类研究, 2019, 33(7):42-48.
LÜ G, CHANG Y L, SHI L. Rapid detection of Salmonella typhimurium and Staphylococcus aureus in beef by immunomagnetic separation combined with loop-mediated IsothermaL amplification method[J]. Meat Research, 2019, 33(7):42-48.