大肠杆菌O157∶H7(Escherichia coli O157∶H7)是一种常见的食源性致病菌,为革兰氏阴性菌,主要存在于牛肉、牛奶、蔬菜、水果及其制品中。有研究显示大肠杆菌O157∶H7易感人群为儿童和老年人,以及免疫功能低下的人群[1-2]。大肠杆菌O157∶H7可以导致人体非出血性腹泻、出血性结肠炎、血栓性血小板减少性紫癜和溶血性尿毒症综合征[3-5],少数感染者出现肠套叠症状[6],严重感染可导致死亡[7-8]。因此,研制一种准确快速检测食品中大肠杆菌O157∶H7的检测方法至关重要。
目前常用的检测大肠杆菌O157∶H7的方法包括传统的培养鉴定法、基于抗原抗体结合的免疫学检法和基于分子水平的分子生物学检测方法等。传统培养鉴定法被认为是检测大肠杆菌O157∶H7的“金标准”(GB 4789.36—2016《大肠埃希氏菌O157∶H7/NM检验》)。但是,该鉴定方法实验操作复杂,实验周期较长(3~7 d),且鉴定工作繁琐易污染,对操作者有较高的专业技能要求,这影响了食品污染溯源和食源性疾病诊断工作的时效性和及时性。基于分子生物学和免疫学的检测方法能够提供及时准确的检测结果,是近年来研究的主要方向[9]。其中分子生物学检测方法主要包括聚合酶链式反应PCR、多重PCR[10]、环介导等温扩增技术(loop-mediated isothermal amplification, LAMP)[11]等。此类方法尽管检测限低,鉴定时间较短,但是均需要专业仪器或熟练操作的技术人员,并且检测体系容易被污染导致假阳性结果,使得这类检测技术推广应用受限。免疫学检测方法中应用最为广泛的是酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)[12],该方法是利用双抗体夹心原理的定性或定量检测技术,但其检测灵敏度低,检测时间长(6~8 h),达不到及时准确的现场检测的需求。与ELISA检测原理相同的免疫层析试纸条(immunochromatographic strip, ICS)[13-14],可实现对靶标进行快速、精准的检测,并且具有不需要专业操作人员与价格低廉等优势,被广泛的应用于食品生产和监管、环境保护以及临床诊断中[15-16]。
影响ICS检测灵敏度的因素有很多,其中抗体标记物材料的合成与标记是重要因素之一,目前纳米材料被广泛应用于抗原抗体的标记,例如纳米金溶胶(colloidal gold, AuNP)、纳米银、异硫氰酸荧光素(fluorescein Isothiocyanate, FITC)等。其中AuNP纳米颗粒具有与抗体蛋白结合效果好,颜色鲜亮,制备简单等优点,在免疫层析试纸条检测方法中广泛应用。为进一步提升ICS检测灵敏度,可通过对AuNP的表面形状结构进行修饰以扩大其表面积来增加抗体偶联量,如JI等[17]使用金纳米花(gold nanoflowers, AuNFs)作为抗体偶联材料检测黄曲霉毒素B-1,其灵敏度比传统AuNP提升了10倍;ZHANG等[18]使用金纳米星作为免疫传感器的基底,大大增加了偶联抗体量,从而实现对人绒毛膜促性腺激素(human chorionic gonadotrophin, HCG)的超灵敏检测。此外,带刺状金纳米颗粒、类似流星锤[19]等形态各异的AuNP,被用于增加抗体蛋白偶联量,从而提高试纸条的检测灵敏度。因此,通过改变胶体金的大小形态,增加其表面积是降低免疫层析试纸条检测限的有效方法之一。
本研究中,以AuNPs与AuNFs为抗体标记探针,研制了2种基于不同标记材料的免疫层析试纸条,用于检测食品中的大肠杆菌O157∶H7。并对2种不同材料标记的试纸条性能进行了对比。以期建立敏感度高、特异性强,可为大肠杆菌O157∶H7的检测提供简便、快速的可视化方法。
1 材料与方法
1.1 材料与试剂
LB培养基、NB培养基、Agar培养基等,山东拓普生物工程有限公司;四氯金酸(HAuCl4)、牛白蛋白,Sigma ALdrich(上海)贸易有限公司;NC膜,Sartorius公司;样品垫、结合垫、吸水纸、PVC粘板,上海杰一生物技术有限公司;雌性BALB/c雌性小鼠,上海杰思捷实验动物有限公司;其他化学试剂均购自国药集团化学试剂有限公司与上海Sangon Biotech公司。
大肠杆菌O157∶H7(ATCC 43895)等食源性菌(表1)为本实验室保藏。
表1 实验菌株
Table 1 Experimental strains
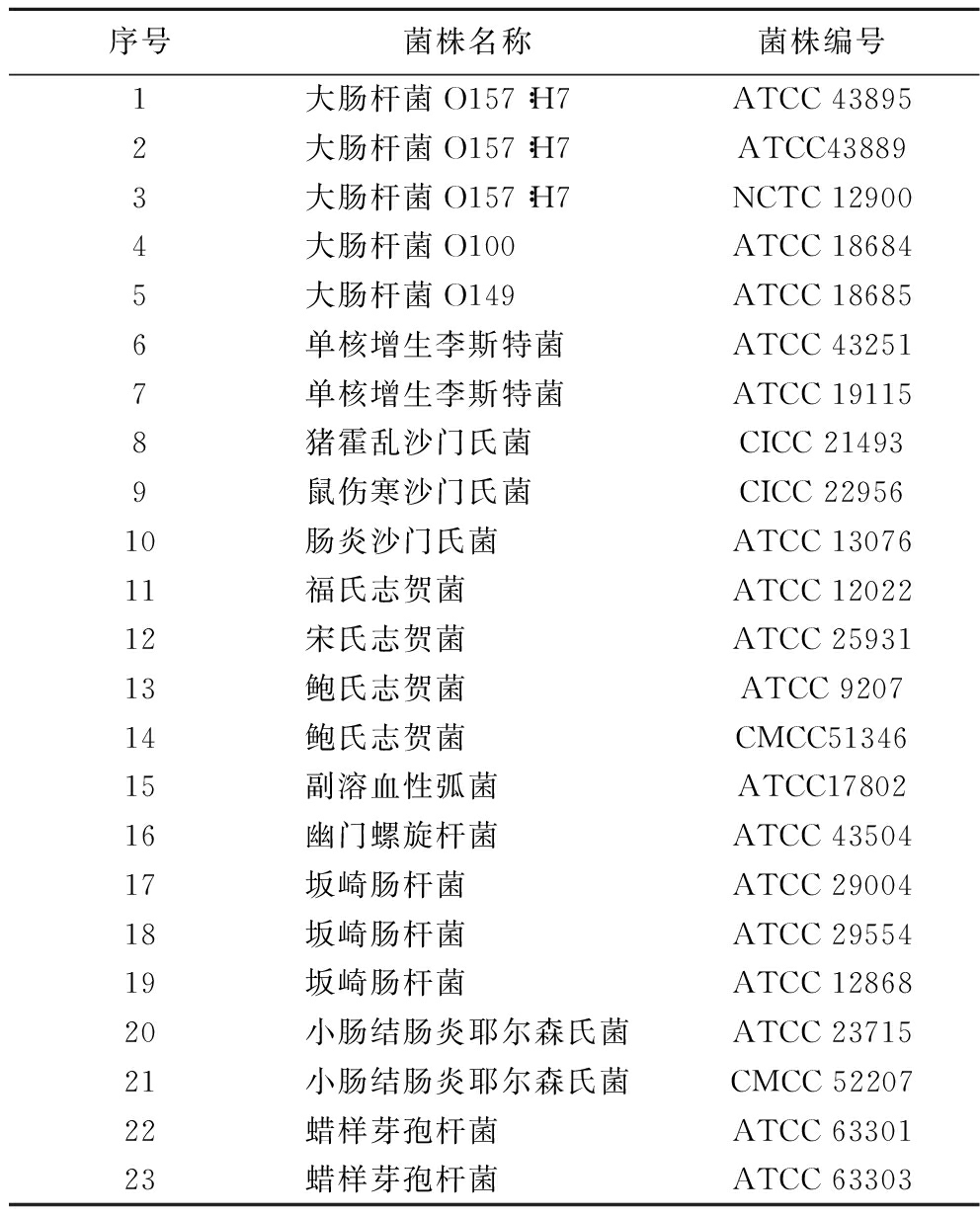
序号菌株名称菌株编号1大肠杆菌O157∶H7ATCC 438952大肠杆菌O157∶H7ATCC438893大肠杆菌O157∶H7NCTC 129004大肠杆菌O100ATCC 186845大肠杆菌O149ATCC 186856单核增生李斯特菌ATCC 432517单核增生李斯特菌ATCC 191158猪霍乱沙门氏菌CICC 214939鼠伤寒沙门氏菌CICC 2295610肠炎沙门氏菌ATCC 1307611福氏志贺菌ATCC 1202212宋氏志贺菌ATCC 2593113鲍氏志贺菌ATCC 920714鲍氏志贺菌CMCC5134615副溶血性弧菌ATCC1780216幽门螺旋杆菌ATCC 4350417坂崎肠杆菌ATCC 2900418坂崎肠杆菌ATCC 2955419坂崎肠杆菌ATCC 1286820小肠结肠炎耶尔森氏菌ATCC 2371521小肠结肠炎耶尔森氏菌CMCC 5220722蜡样芽孢杆菌ATCC 6330123蜡样芽孢杆菌ATCC 63303
牛奶、牛肉、果冻,上海某超市。
1.2 仪器与设备
System 9700 PCR仪,Gene Company公司;CTS300XYZ微电脑自动斩切机购,上海金标生物科技有限公司;S25-2型恒温磁力搅拌器,上海可乐仪器有限公司;SpectraMaxM2酶标仪,美谷分子仪器(上海)有限公司;CC-3073-02 CO2细胞恒温培养箱,Blue pard公司;ZQPZ 288R恒温培养箱,天津市莱玻特瑞仪器设备有限公司;PE28-standard pH测量计,METTLER TOLEDO公司。
1.3 实验方法
1.3.1 大肠杆菌O157∶H7单克隆抗体制备
大肠杆菌O157∶H7单克隆抗体采用动物体内诱生法,具体方法如下:将在55 ℃预热30 min后的不完全弗氏佐剂按0.6 mL/只小鼠腹腔注射进行预处理,3~d腹腔后接种约106个杂交瘤细胞,约10 d后,可见小鼠腹部膨大,用2 mL注射器抽取腹水,即可获得大量大肠杆菌O157∶H7单克隆抗体。
1.3.2 AuNPs与AuNFs的制备与表征
根据化学还原法[20]制备AuNPs溶液,具体制备方法如下:取198.0 mL双蒸水,转速为500 r/min,115 ℃加热至沸腾,立即加入2 mL(10 g/L)HAuCl4溶液,沸腾20 s,同时迅速加入5.4 mL柠檬酸三钠溶液(10 mg/mL)继续加热10 min后,停止加热,冷却至室温。酒红色的AuNPs溶液在4 ℃避光保存。
AuNFs采用对苯二酚还原法[21](也称为金种子介导法)合成。具体步骤如下:将100.0 mL双蒸水加热至50 ℃,然后依次加入2.0 mL金籽溶液(AuNP溶液)、1.0 mL HAuCl4溶液(10 mg/mL)、2.0 mL柠檬酸钠溶液(10 mg/mL)。柠檬酸钠将HAuCl4溶液中的Au3+还原为Au+。保持溶液温度在50 ℃,并快速加入1.2 mL的对苯二酚溶液(30 mmoL/L)。对苯二酚将Au+还原成Au,Au在小的球形纳米颗粒表面形成小的突起,形成花状的外观,即AuNFs。当溶液的颜色变成深蓝色时,继续搅拌加热10 min,然后停止加热,冷却至室温。深蓝色的AuNFs溶液在4 ℃避光保存。
利用紫外分光光度计扫描紫外吸收图谱测定其颗粒大小,采用透射电镜观察其形状和颗粒均匀程度。
1.3.3 AuNPs与AuNFs最适标记pH的确定
AuNPs与AuNFs标记抗体最重要的条件是pH和抗体浓度。因此,对这2个重要条件进行探索优化。优化最适pH时,首先在100 uL AuNPs与AuNFs溶液中加入不同体积(0、0.3、0.6、0.9、1.2、1.5、1.8、2.1 μL)的0.2 mol/L K2CO3,调节纳米金溶液的pH。充分振荡混合均匀后,加入5 μg抗体,振荡10 min,使AuNPs与AuNFs探针与单克隆抗体偶联。将10 μL 复合物用移液枪点在结合垫上,室温下晾干。取100 μL新鲜培养的大肠杆菌O157∶H7缓慢滴加于免疫层析试纸条的样品垫,10 min后观察免疫层析试纸条上的检测线(T线)和质控线(C线)的颜色强度,试纸条每次测定重复3遍。当复合溶液的pH在抗体蛋白的等电点附近(即最适pH)时,抗体蛋白能与纳米金粒子充分结合且不易于析出,因此T线和C线均显示高强度的颜色信号;pH不适宜时,T线和C线均不显示或显示低强度颜色信号。剩余的复合物溶液加入10 μL 10%NaCl溶液,振荡10 min后观察溶液的颜色变化及纳米金析出情况。样品的颜色越深,结合能力越好,pH越合适。
1.3.4 AuNPs与AuNFs最适标记抗体浓度的确定
探索AuNPs与AuNFs最适标记抗体浓度,取100 μL AuNPs与AuNFs溶液中加入上述最适K2CO3添加量(即K2CO3最适添加体积),分别加入等体积、不同质量浓度(0.1、0.3、0.9、1.2、2.4、3.6、4.8、6 μg/100 μL)的大肠杆菌O157∶H7单克隆抗体,充分振荡混匀使AuNPs与AuNFs探针与单克隆抗体偶联。后续操作同上。
1.3.5 AuNPs与AuNFs标记抗体
AuNPs标记抗体的方法如下:将最佳浓度的大肠杆菌O157∶H7抗体逐滴加入(30 μL/min)到最佳pH条件下的AuNPs溶液中,4 ℃下使用磁力搅拌器均匀搅拌1 h。然后加入1/10 AuNPs溶液体积的10%牛白蛋白溶液,持续搅拌1 h。12 000 r/min高速离心15 min,去除上清液。沉淀加入10 mL新鲜配制的抗体保存液重悬,充分混合均匀后,再次12 000 r/min离心15 min,去除上清液。沉淀使用1 mL的新鲜配制的抗体保存液重悬,充分混合均匀后4 ℃低温避光保存。
AuNFs标记抗体的方法如下:将最佳浓度的大肠杆菌O157∶H7抗体逐滴加入(30 μL/min)到最佳pH条件下的AuNFs溶液中,然后在4 ℃下搅拌1 h。将1/2溶液体积10 mg/mL PEG-1500加入溶液中,在4 ℃ 下混合30 min。然后,然后加入1/10 AuNFs溶液体积的20%牛白蛋白溶液,温和搅拌30 min。混合溶液在4 ℃下以5 000 r/min离心20 min,除去上清液,用新鲜配制的抗体保存液重悬沉淀,其体积为AuNFs溶液体积的1/10,在4 ℃低温避光保存。
1.3.6 AuNPs与AuNFs试纸条的制备
AuNPs与AuNFs试纸条主要包括5个部分[22]如图1-b所示。将制备的抗大肠杆菌O157∶H7单克隆抗体和羊抗鼠IgG抗体(1.0 mg/mL)通过点样仪以1.0 μL/cm的速度分别将T线与C线喷涂在NC膜上,置于40 ℃干燥12 h。结合垫使用AuNPs-Ab与AuNFs-Ab溶液浸泡30 min,置与40 ℃干燥12 h。待结合垫和NC膜晾干后,进行组装,切割成3 mm试纸条后备用。

a-AuNPs与AuNFs合成流程图;b-免疫层析试纸条构造图;c-免疫层析试纸条检测原理图
图1 AuNPs与AuNFs合成流程及双抗体夹心试纸条结构图
Fig.1 Preparation procedure of AuNPs/AuNFs and structure of the immunochromatographic test strip
1.3.7 AuNPs与AuNFs灵敏度和特异性测定
灵敏度验证:将大肠杆菌O157∶H7培养至浓度1.0×108 CFU/mL以上,使用pH 7.8 PB缓冲液通过10倍梯度稀释至浓度范围101~108 CFU/mL,分别取各梯度溶液100 μL滴加AuNPs与AuNFs至免疫层析试纸条样品垫,10 min后观察试纸条检测结果确定其灵敏度。
特异性验证:对实验室保藏的3株大肠杆菌O157∶H7标准菌株和20株常见的其他食源性致病菌验证AuNPs与AuNFs试纸条的特异性。
1.3.8 AuNPs与AuNFs试纸条模拟带菌试验
为了证明2种免疫层析试纸条在食品样品检测中的可行性,用AuNPs与AuNFs试纸条试纸条检测人工污染的食品,来模拟检测被大肠杆菌O157∶H7污染的实际样品。具体方法如下:将从本地超市购买的牛奶、牛肉和果冻样品取25 mL或25 g分别添加到LB培养基(225 mL),均质2 min后置于121 ℃高温高压灭菌15 min,待降至室温后在无菌环境中加入约250 CFU大肠杆菌O157∶H7,使其终浓度达到约1 CFU/mL,培养12 h,期间每1 h从细菌培养瓶中收集1 mL培养液并立即加入0.3%的甲醛溶液后置于4 ℃冰箱。待培养结束后分别进行免疫层析试纸条检测和ELISA快速检测试剂盒检测,并对比检测结果。
1.3.9 AuNPs与AuNFs重复性实验
将大肠杆菌O157∶H7培养至浓度1.0×108 CFU/mL以上,使用pH 7.8 PB缓冲液通过10倍梯度稀释至浓度范围104~108 CFU/mL,取3个批号的试纸条进行检测,每个浓度水平3个平行,计算检出概率值(probability of detection, POD)(检出阳性结果次数占所有检测结果的比率)。
2 结果与分析
2.1 AuNPs与AuNFs纳米颗粒的表征
金纳米粒子的粒径大小和形状均匀程度对试纸条的灵敏度和稳定性至关重要。由图2-a和图2-e可知,制备的AuNPs与AuNFs溶液呈清澈透亮。由图2-b和图2-f的TEM结果显示,合成的AuNPs呈现相对大小均匀的球体,而AuNFs呈现相对大小均一且表面为不规则花状的纳米金;通过紫外吸收光谱检测,AuNPs的最大吸收峰为520~530 nm,AuNFs吸收峰为570~580 nm。与AuNPs相比,AuNFs的尺寸更大,表面更不规则,因此与AuNPs相比AuNFs会获得更大的比表面积。较大的比表面积可能会减少抗体与纳米金结合时产生的空间阻抗效应,纳米金能够与更多的目标抗体相结合,从而提升试纸条检测的灵敏度。

a-AuNPs溶液图;b-AuNPs透射电镜;c-AuNPs紫外吸收图谱;d-AuNFs溶液图;e-AuNFs透射电镜;f-AuNFs紫外吸收图谱
图2 AuNPs与AuNFs表征
Fig.2 Characterization of AuNPs and AuNFs
2.2 AuNPs与AuNFs试纸条最适pH值试验结果
不同标记pH值下制备的试纸条检测结果发现,由图3-a可知,当100 μL AuNPs溶液中加入0.9 μL 0.2 mol/L K2CO3时,C、T线颜色最深,且微孔颜色最亮;由图3-b可知,当100 μL AuNFs溶液中加入0.6 μL 0.2 mol/L K2CO3时,C、T线颜色最深,且微孔颜色呈亮蓝色。

a-AuNPs;b-AuNFs
图3 AuNPs与AuNFs最适pH
Fig.3 Optimal pH of AuNPs and AuNFs
因此,后续试验选择100 μL AuNPs溶液中添加0.9 μL 0.2 mol/L K2CO3,100 μL AuNFs溶液中添加0.6 μL 0.2 mol/L K2CO3。
2.3 AuNPs与AuNFs试纸条最适标记抗体浓度试验结果
不同标记抗体浓度下制备的试纸条检测结果发现,由图4-a可知,当100 μL AuNPs溶液中加入1.2 μg抗体时,C、T线颜色最深,且微孔颜色最亮;由图4-b可知,当100 μL AuNFs溶液中加入4.8 μg抗体时,C、T线颜色最深,且微孔颜色最深。

a-AuNPs试纸条最适抗体浓度;b-AuNFs试纸条最适抗体浓度
图4 AuNPs与AuNFs最适抗体浓度
Fig.4 Optimal antibody concentrations of AuNPs and AuNFs
因此,后续试验在所用抗体量比最佳抗体浓度增加20%,即100 μL AuNPs溶液中添加2.88 μg抗体,100 μL AuNFs溶液中添加5.76 μg抗体。
2.4 AuNPs与AuNFs试纸条灵敏度
在本研究中,为了测定两种免疫层析试纸条的灵敏度,将培养至3.2×108 CFU/mL的大肠杆菌O157∶H7稀释成不同浓度梯度的菌悬液(108~101 CFU/mL),以pH 7.8的PB缓冲溶液为阴性对照,分别取100 μL滴加在免疫层析试纸条的样品垫。结果如图5-a所示。AuNPs试纸条检测大肠杆菌O157∶H7的检测限为3.2×105 CFU/mL,图5-b所示AuNFs试纸条检测大肠杆菌O157∶H7的检测限为3.2×104CFU/mL,比AuNPs试纸条检测限高出10倍。表明AuNFs作为抗体标记材料可以降低免疫层析试纸条的检测限。

a-AuNPs;b-AuNFs
图5 AuNPs与AuNFs试纸条灵敏度
Fig.5 Sensitivity of AuNPs and AuNFs strips
2.5 AuNPs与AuNFs试纸条特异性
如图6-a和图6-b可知,AuNPs与AuNFs试纸条只有在检测大肠杆菌O157∶H7(ATCC 43895、ATCC 43889和NCTC 12900)时C线和T线分别出现了条带,而试纸条检测其他20株常见的食源性致病菌结果显示,仅在C线观察到1条条带,T线处均未出现条带。结果表明,AuNPs与AuNFs试纸条均对大肠杆菌O157∶H7检测具有较高的特异性,与其他食源性是病菌没有交叉反应。

a-AuNPs;b-AuNFs
图6 AuNPs与AuNFs试纸条特异性
Fig.6 Specificity of AuNPs and AuNFs strips
2.6 AuNPs与AuNFs试纸条模拟带菌试验结果
对人工污染的果冻、牛奶和牛肉在不同培养时期的样品分别使用AuNPs与AuNFs试纸条进行检测,结果如图7所示,AuNPs试纸条对果冻、牛奶和牛肉样品分别在孵育5、6、5 h时,试纸条的C线和T线均显色,呈阳性结果。AuNFs试纸条对果冻、牛奶和牛肉样品分别在孵育5、5、4 h时,试纸条的C线和T线均显色,呈阳性结果。其中对于牛奶与牛肉样品的检测AuNFs试纸条比AuNPs试纸条提前1 h检出。与ELISA试剂盒检测结果相比,如表2所示,果冻和牛肉样品检测结果均为前增菌8 h时可以检出大肠杆菌O157∶H7;牛奶样品中大肠杆菌O157∶H7前增菌10 h可被ELISA试剂盒检出阳性结果。通过对比检测结果可知,基于AuNPs与AuNFs试纸条检测食品模拟带菌阳性结果检出的前增菌时间比ELISA试剂盒缩短了2~4 h。综上所述,AuNPs与AuNFs试纸条均可以用于果冻、牛奶和牛肉中大肠杆菌O157∶H7的快速检测,且不受食品复杂机制的影响。

a-AuNPs;b-AuNFs
图7 AuNPs与AuNFs试纸条模拟带菌试验
Fig.7 AuNPs and AuNFs test strips simulated bacterial carrier test
注:a、b中从左到右依次表示果冻、牛奶以及牛肉样品。
表2 ELISA试剂盒和AuNPs与AuNFs试纸条检测结果对比
Table 2 Comparison of ELISA kit, AuNPs and AuNFs test strips
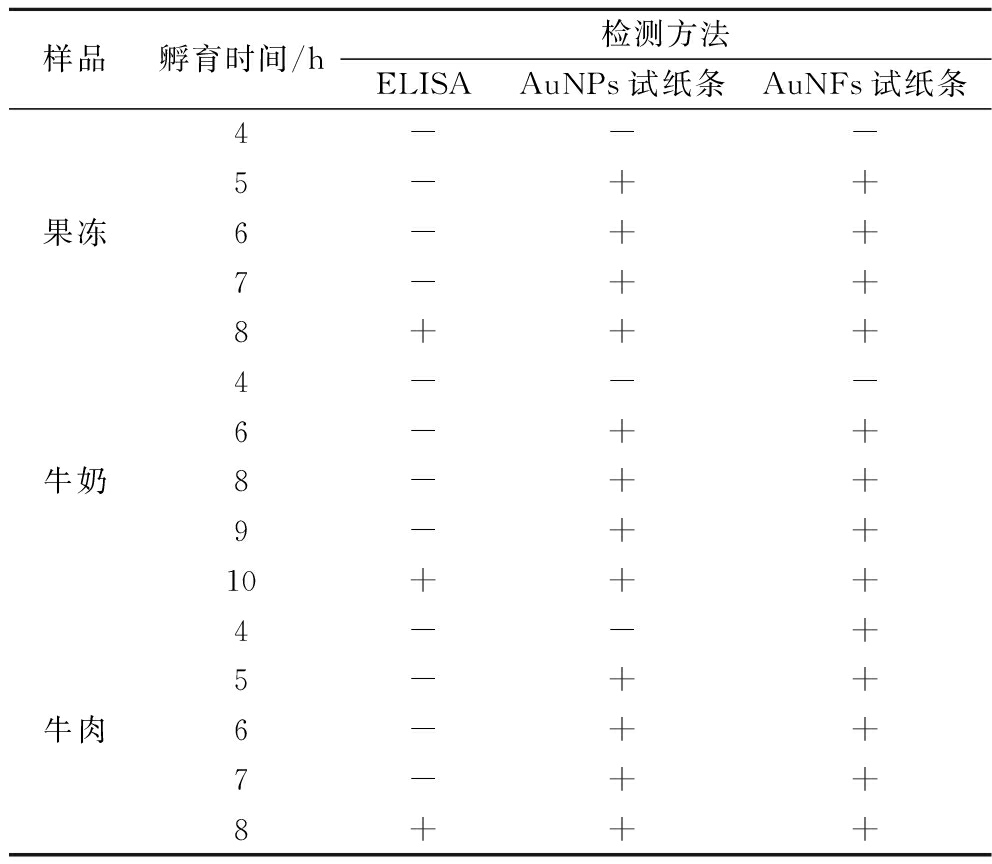
样品孵育时间/h检测方法ELISAAuNPs试纸条AuNFs试纸条4---5-++果冻6-++7-++8+++4---6-++牛奶8-++9-++10+++4--+5-++牛肉6-++7-++8+++
注:根据显色结果判断: “+”:试纸条T线显色;“-”:试纸条T线没有显色,或者肉眼无法辨别。
2.7 AuNPs与AuNFs试纸条重复性结果
由表3可知,3个不同批次的AuNPs试纸条检测结果均在108~105CFU/mL出现阳性结果,AuNPs试纸条检测结果均在108~104CFU/mL出现阳性,并且阴性对照未出现阳性结果,表明方法重复性较好。
表3 重复性测试结果
Table 3 Result of repeatability
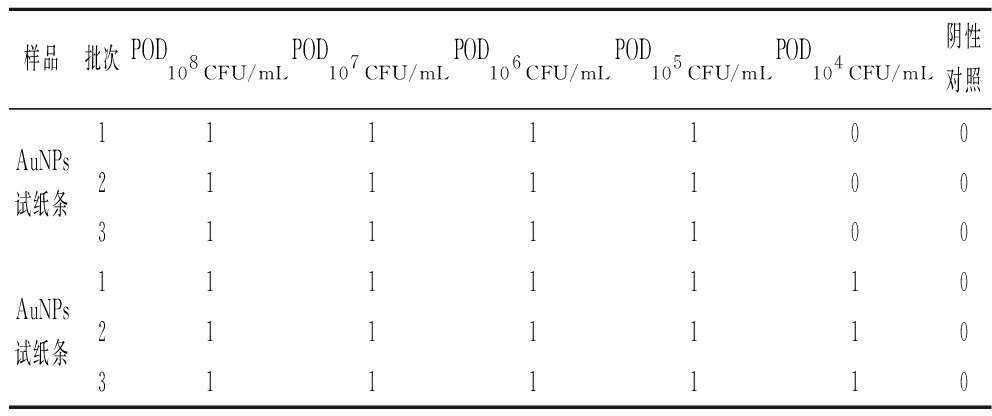
样品批次POD108 CFU/mLPOD107 CFU/mLPOD106 CFU/mLPOD105 CFU/mLPOD104 CFU/mL阴性对照1111100AuNPs试纸条211110031111001111110AuNPs试纸条21111103111110
注:POD为检出概率值(检出阳性结果次数占所有检测结果的比率)。
3 结论
大肠杆菌O157∶H7的主要传播途径是家禽、牲畜及其肉制品与奶制品[23],大多数大肠杆菌O157∶H7感染都与食用未煮熟的碎牛肉或饮用生奶(较少发生)相关。本文成功建立了2种免疫层析试纸条快速检测食品中大肠杆菌O157∶H7,并对2种试纸条进行了灵敏度测定,特异性交叉测定、重复性测定以及选取常见大肠杆菌O157∶H7宿主性食品牛肉(固体)、果冻(半固体)、牛奶(液体)进行模拟带菌实验。
在灵敏度方面,AuNPs试纸条检测限为3.2×105 CUF/mL,AuNFs试纸条检测限为3.2×104 CUF/mL,比AuNPs检测限高出10倍,并且2种试纸条均与常见的食源性致病菌无交叉反应。尽管2种试纸条的灵敏度均略低于PCR与LAMP等分子生物学检测方法,但是该类方法均需要专业仪器或熟练操作的技术人员,并且检测体系容易被污染导致假阳性结果。与传统的分离培养法与ELASA相比,试纸条具有快速、方便的特性,能够实现基层、现场以及大量产品的快速初筛检测。在真实样品模拟带菌检测中,AuNPs试纸条对果冻、牛奶和牛肉样品分别在前增菌5、6、5 h时检出,AuNFs试纸条对果冻、牛奶和牛肉样品分别在前增菌5、5、4 h时检出,对于3种样品增菌检出时间不同,可能是由于不同样品所含的不同基质对大肠杆菌O157∶H7生长繁殖所造成的影响不同导致的,但所建立的检测方法并未受食品基质影响出现假阳性或假阴性结果。并且将检测结果与ELISA试剂盒检测结果相比,AuNPs与AuNFs试纸条检测食品模拟带菌阳性结果检出的前增菌时间比ELISA试剂盒缩短了2~4 h,表明2种试纸条均可以应用于常见食品(肉制品、奶制品以及蔬菜等)中大肠杆菌O157∶H7的检测。经过比较测试,AuNFs是比AuNPs更为灵敏的抗体标记材料,为食源性致病菌快速检测提供了一种高灵敏、高特异性的可视化检测工具,为国家大肠杆菌O157∶H7免疫层析试纸条规模化生产提供参考依据。
[1] LUPINDU A M. Epidemiology of shiga toxin-producing Escherichia coli O157∶H7 in Africa in review[J]. Southern African Journal of Infectious Diseases, 2018, 33(1):24-30.
[2] CHA P I, GURLAND B, FORRESTER J D. First reported case of intussusception caused by Escherichia coli O157∶H7 in an adult: Literature review and case report[J]. Surgical Infections, 2019, 20(1):95-99.
[3] SHAN S, LIU D F, GUO Q, et al. Sensitive detection of Escherichia coli O157∶H7 based on cascade signal amplification in ELISA[J]. Journal of Dairy Science, 2016, 99(9):7025-7032.
[4] DINH A, ANATHASAYANAN A, RUBIN L M. Safe and effective use of eculizumab in the treatment of severe Shiga toxinEscherichia coli-associated hemolytic uremic syndrome[J]. American Journal of Health-System Pharmacy, 2015, 72(2):117-120.
[5] MOSSORO C, GLAZIOU P, YASSIBANDA S, et al. Chronic diarrhea, hemorrhagic colitis, and hemolytic-uremic syndrome associated with HEp-2 adherent Escherichia coli in adults infected with human immunodeficiency virus in Bangui, Central African Republic[J]. Journal of Clinical Microbiology, 2002, 40(8):3086-3088.
[6] GWAVAVA C, CHIHOTA V N, GANGAIDZO I T, et al. Dysentery in patients infected with human immunodeficiency virus in Zimbabwe: An emerging role forSchistosoma mansoni and Escherichia coli O157?[J]. Annals of Tropical Medicine &Parasitology, 2001, 95(5):509-513.
[7] ABONG′O B O, MOMBA M N B, MALAKATE V K, et al. Prevalence of Escherichia coli O157∶H7 among diarrhoeic HIV/AIDS patients in the eastern cape province-south Africa[J]. Pakistan Journal of Biological Sciences, 2008, 11(8):1066-1075.
[8] GRIFFIN P M, TAUXE R V. The epidemiology of infections caused by Escherichia coli O157∶H7, other enterohemorrhagic E. coli, and the associated hemolytic uremic syndrome[J]. Epidemiologic Reviews, 1991, 13(1):60-98.
[9] MOEZI P, KARGAR M, DOOSTI A, et al. Multiplex touchdown PCR assay to enhance specificity and sensitivity for concurrent detection of four foodborne pathogens in raw milk[J]. Journal of Applied Microbiology, 2019, 127(1):262-273.
[10] CHEN H, LI Y K, ZHANG T T, et al. A novel real-time loop-mediated isothermal amplification combined with immunomagnetic beads separation and ethidium bromide monoazide treatment for rapid and ultrasensitive detection of viable Escherichia coli O157∶H7 in milk[J]. Food Analytical Methods, 2021, 14(5):944-956.
[11] BARAKETI A, D′AURIA S, SHANKAR S, et al. Novel spider web trap approach based on chitosan/cellulose nanocrystals/glycerol membrane for the detection of Escherichia coli O157∶H7 on food surfaces[J]. International Journal of Biological Macromolecules, 2020, 146:1009-1014.
[12] XING K Y, PENG J, LIU D F, et al. Novel immunochromatographic assay based on Eu (III)-doped polystyrene nanoparticle-linker-monoclonal antibody for sensitive detection of Escherichia coli O157∶H7[J]. Analytica Chimica Acta, 2018, 998:52-59.
[13] LIU C, FANG S Q, TIAN Y C, et al. Rapid detection of Escherichia coli O157∶H7 in milk, bread, and jelly by lac dye coloration-based bidirectional lateral flow immunoassay strip[J]. Journal of Food Safety, 2021, 41(1): e12862.
[14] LI Y Y, WANG Q, BERGMANN S M, et al. Preparation of monoclonal antibodies against KHV and establishment of an antigen sandwich ELISA for KHV detection[J]. Microbial Pathogenesis, 2019, 128:36-40.
[15] HUANG X Y, HUANG T, LI X J, et al. Flower-like gold nanoparticles-based immunochromatographic test strip for rapid simultaneous detection of fumonisin B1 and deoxynivalenol in Chinese traditional medicine[J]. Journal of Pharmaceutical and Biomedical Analysis, 2020, 177:112895.
[16] PENG T, SUI Z W, HUANG Z H, et al. Point-of-care test system for detection of immunoglobulin-G and-M against nucleocapsid protein and spike glycoprotein of SARS-CoV-2[J]. Sensors and Actuators B: Chemical, 2021, 331: 129415.
[17] JI Y W, REN M L, LI Y P, et al. Detection of aflatoxin B1 with immunochromatographic test strips: Enhanced signal sensitivity using gold nanoflowers[J]. Talanta, 2015, 142:206-212.
[18] ZHANG A M, GUO W W, KE H, et al. Sandwich-format ECL immunosensor based on Au star@BSA-Luminol nanocomposites for determination of human chorionic gonadotropin[J]. Biosensors and Bioelectronics, 2018, 101:219-226.
[19] ZHANG L, HUANG Y J, WANG J Y, et al. Hierarchical flowerlike gold nanoparticles labeled immunochromatography test strip for highly sensitive detection of Escherichia coli O157∶H7[J]. Langmuir, 2015, 31(19): 5537-5544.
[20] WU Y X, WU M J, LIU C, et al. Colloidal gold immunochromatographic test strips for broad-spectrum detection of Salmonella[J]. Food Control, 2021, 126:108052.
[21] WU M J, WU Y X, LIU C, et al. Development and comparison of immunochromatographic strips with four nanomaterial labels: Colloidal gold, new colloidal gold, multi-branched gold nanoflowers and Luminol-reduced Au nanoparticles for visual detection of Vibrio parahaemolyticus in seafood[J]. Aquaculture, 2021, 539:736563.
[22] WANG J H, HE K X, WU Z J, et al. Development of a colloidal gold immunochromatographic strip for the rapid detection of antibodies against Fasciola gigantica in buffalo[J]. Foods, 2022, 11(5):756.
[23] PULIGUNDLA P, LIM S. Biocontrol approaches against Escherichia coli O157∶H7 in foods[J]. Foods, 2022, 11(5):756.