迷迭香酸(rosmarinic acid, RA),又称酪萨维、肉桂醇甙、罗丹酚酸, 广泛存在于唇形科、紫草科、伞形科等天然植物中。RA是咖啡酸和3,4-二羟基苯基乳酸缩合而成的多酚羟基化合物[1](分子结构见图1),2个芳香环上分别有2个羟基,使得其具有清除超氧阴离子自由基和羟自由基的能力[2],RA的抗氧化能力强于维生素E被普遍认可。RA提取方式包括索氏提取、热回流、浸渍、酶解法、超临界流体萃取、超声波/微波辅助提取等技术。工业化生产方式有植物愈伤组织培养、微生物发酵等。RA具有抗氧化、抗癌、抗糖尿病、抗神经毒性、抗病毒、抗过敏、抗菌等多种生物活性,在食品、医药、化妆品等领域被广泛应用。
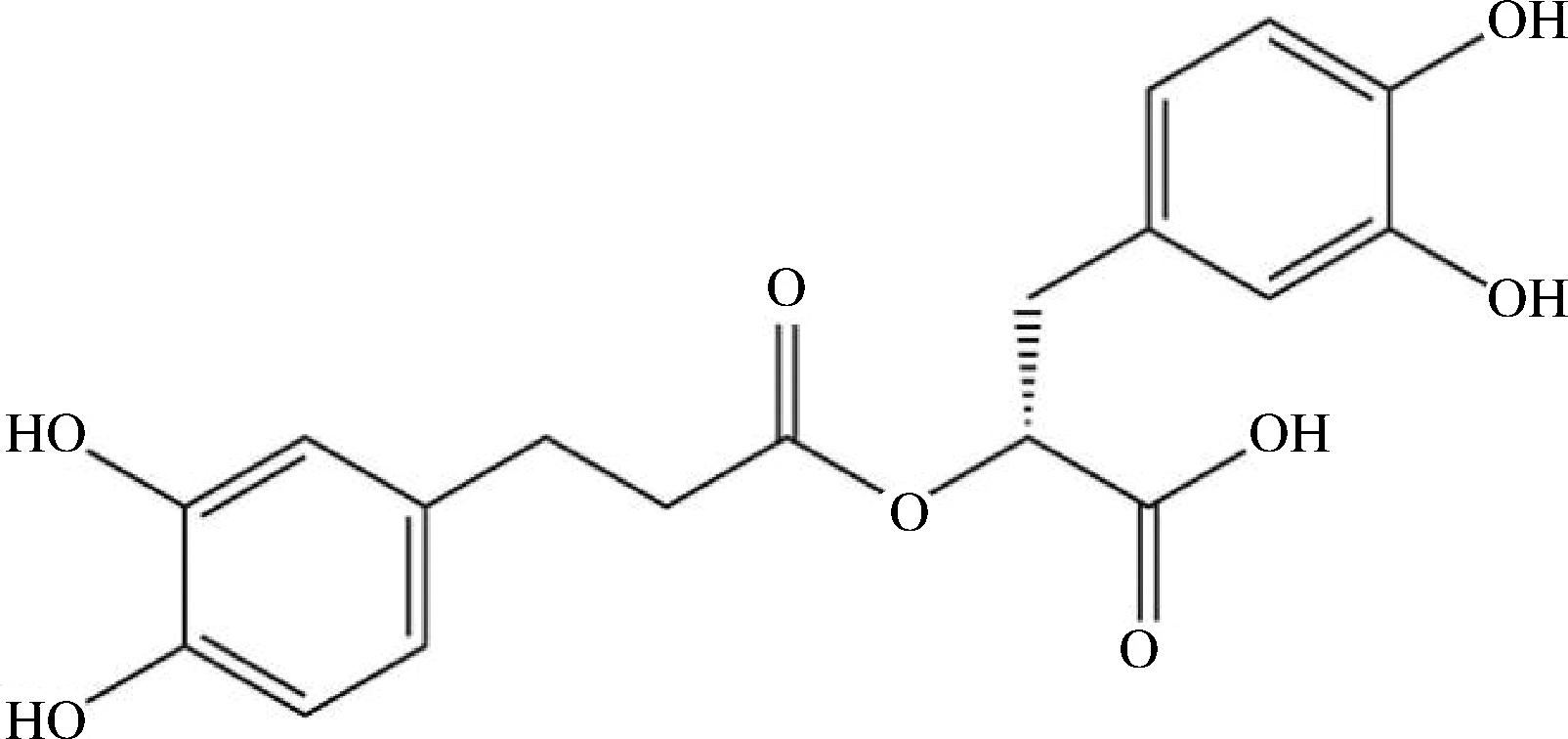
图1 迷迭香酸的分子结构式
Fig.1 Molecular formula of rosmarinic acid
综合近几年研究,本文对RA的来源、生产进行了回顾,重点关注了愈伤组织培养技术和微生物发酵生产等新型的生产途径。并以抗氧化、抗癌、抗代谢性疾病和神经保护为核心阐述了RA的生物活性机制,最后总结了RA的产品开发现状,并对现有研究的不足及未来的发展方向进行了讨论。
1 RA的来源和生产
1.1 来源
RA分布于唇形科:香蜂花、夏枯草[3]、神香草[4]、牛至[5]、薄荷[6]、鼠尾草[7]、迷迭香[8]、丹参[9];紫草科:宿苞厚壳树[10]、蒜味破布木[11]、牛舌草[12]、聚合草[13];伞形科:茴香[14]、欧洲变豆菜[15]、欧当归[16]、扁叶刺芹[17]植物中。此外,RA已从夹竹桃科(沙漠玫瑰)、角苔科(角苔)、乌毛蕨科(红椿蕨)、菊科(藏掖花)、五加科(天胡荽)等植物中被分离[17-19]。除植物资源外,在蜂胶多酚中也发现了RA的存在[20]。迷迭香酸来源见图2。

图2 迷迭香酸的来源
Fig.2 The source of rosmarinic acid
1.2 生产途径
RA传统的提取技术有水酶法、超临界流体萃取、超声波辅助等。近年来,以植物愈伤组织培养技术和微生物发酵生产为代表的新型生产途径也获得更广泛的关注。迷迭香酸各生产途径的优缺点对比见表1。
表1 迷迭香酸各生产途径的优缺点对比
Table 1 Comparison of advantages and disadvantages of different production pathways of rosmarinic acid

方法来源提取率工艺条件优点缺点参考文献水酶法鼠尾草(28.23±0.41) mg/g纤维素酶a和蛋白酶混合物(1∶1,质量比);酶负载量4.49%;水样比25.76 mL/g;温度54.3 ℃;提取时间2 h温和高效;不使用有机溶剂,环保无污染;提取时间短酶活性受提取条件影响[7]超临界流体萃取迷迭香-10%的改性剂[V(EtOH)∶V(水)=50∶50],25 ℃下,10 MPa, 50 min内以3.0 mL/min的速度提取使用绿色溶剂,环保高效成本高[8]超声波辅助提取彩叶草110.8 mg/g纯乙醇;超声波浴30 kHz;45 min效率高,耗时短;材料可再生;提取trans-RA规模化应用受限制[21]愈伤组织培养鼠尾草16.72 mg/g 萘乙酸5 mg/L+苄基氨基嘌呤5 mg/L高效生产酚酸培养环境需严格控制,工艺相对复杂[22]皱叶香茶菜1 732.61 μg/g 噻二唑隆3.0 mg/L+α-萘乙酸1.0 mg/L 生产具有抗氧化和抗衰老作用的化合物得到RA需进一步分离纯化[23]微生物生产酿酒酵母(5.93±0.06) mg/L选择最佳酶变体、增加途径基因的基因拷贝数;芳香氨基酸途径改善前体供应,优化菌株;葡萄糖为唯一碳源的矿物培养基适用于大规模发酵;培养基价廉需进一步优化RA途径酶前体和辅因子供应的表达及定位[24]YRA113-15B菌株208 mg/L-产量高;规模化发酵生产 -[25]
注:-表示无数据。
水酶提取是一种高效且环保的提取方法,提取时间短,且不受有毒溶剂的污染。SU等[7]采用水酶法从鼠尾草中提取RA,发现纤维素酶的提取效率比蛋白酶更高,而2种酶混合使用可以更有效地破坏植物细胞壁和细胞膜,提取效率较单一酶更高。超临界流体萃取也是一种较环保的提取方式,能选择性地提取生物活性物质。LEFEBVRE等[8]用超临界流体萃取法发现RA的开始提取时间随着改性剂用量的提高而缩短,说明可以利用时间差来生产不同的组分。此外,TUNGMUNNITHUM等[21]采用优化后的超声波辅助提取法提取彩叶草中的反式迷迭香酸(trans-RA),结果证明该方法在产量和提取时间方面有明显优势。
因产量高效优势,植物愈伤组织培养和微生物发酵生产RA的新型途径受到更多的关注。应用植物愈伤组织培养获得酚酸体外生产细胞系,MODARRES等[22]发现高蔗糖水平能促进RA的积累,在50 g/L蔗糖培养基中RA的产量最高。ABBASI等[23]研究了以皱皮香茶菜诱导愈伤组织,生产富含酚酸的生物活性提取物,为该生产技术应用于抗氧化和抗衰化妆品制备提供依据。除此之外,MAHSA等[24]通过选择最佳酶变体、增加途径基因的基因拷贝数以及通过芳香氨基酸途径改善前体供应,优化菌株,而后在以葡萄糖为唯一碳源的矿物培养基上,利用酵母菌产生了高达(5.93±0.06) mg/L的RA,该研究显示了应用酿酒酵母发酵生产RA的工艺可行性。ZHOU等[25]构建了菌株YRA113-15B,该菌株在摇瓶培养中产生了208 mg/L RA,这是迄今为止报道的工程微生物细胞的最高迷迭香酸价,这项工作为RA的发酵生产提供了一个有前景的平台。
2 生物活性
2.1 抗氧化
RA是一种强抗氧化剂[26],DPPH法、ABTS法和CUPRAC法测定RA的抗氧化活性IC50分别为(1.21±0.06)、(1.70±0.07)、(1.21±0.01) μg/mL[27]。其抗氧化机制可分为减少氧化应激[28]、降低活性氧(reactive oxygen species,ROS)水平[29]、调节相关酶水平[30]3个方面。RA的抗氧化机制如图3。

图3 迷迭香酸的抗氧化机制
Fig.3 Antioxidant mechanism of rosmarinic acid
注:一磷酸腺苷激活的蛋白激酶(adenosine monophosphate-activated protein kinase, AMPK);活性氧(reactive oxygen species, ROS);迷迭香酸 (rosmarinic acid, RA);超氧化物歧化酶(superoxide dismutase, SOD);酪氨酸羟化酶(tyrosine hydroxylase, TH);谷胱甘肽(L-glutathione, GSH); 1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine, MPTP);帕金森病(parkinson disease, PD);丙二醛(malonaldehyde, MDA);脂肪组织源干细胞(adipose tissue-derived stem cells, ASCs);缺血/再灌注(ischemia/reperfusion, I/R);1,1-二苯基-2-三硝基苯肼 (1,1-diphenyl-2-picryl-hydrazyl, DPPH);天冬氨酸氨基转移酶(aspartate aminotransferase, AST);丙氨酸氨基转移酶(alanine aminotransferase, ALT); Kelch样ECH相关蛋白1(Kelch-like ECH associated protein 1, Keap1);核因子E2相关因子2(nuclear factor erythroid2-related factor 2, Nrf2); 特异巨噬细胞武装因子(specific macrophage arming factor, sMaf);抗氧化反应元件(antioxidant response elements, ARE)。
丙二醛(malondialdehyde,MDA)是显示氧化应激程度的重要指标,RA可通过降低MDA水平减少疾病的氧化应激损伤。![]() 等[31]研究了RA对肝脏缺血/再灌注(ischemia/reperfusion,I/R)损伤的大鼠的保护作用,结果表明RA能有效降低MDA、血清天冬氨酸氨基转移酶、丙氨酸氨基转移酶水平,减少了肝脏I/R损伤后的氧化应激。BARANAUSKAITE等[32]研究了RA对铝诱导的小鼠氧化应激的治疗作用,结果表明RA可显著降低小鼠大脑和肝脏中MDA的水平,抵消铝的负面影响,减少氧化应激。
等[31]研究了RA对肝脏缺血/再灌注(ischemia/reperfusion,I/R)损伤的大鼠的保护作用,结果表明RA能有效降低MDA、血清天冬氨酸氨基转移酶、丙氨酸氨基转移酶水平,减少了肝脏I/R损伤后的氧化应激。BARANAUSKAITE等[32]研究了RA对铝诱导的小鼠氧化应激的治疗作用,结果表明RA可显著降低小鼠大脑和肝脏中MDA的水平,抵消铝的负面影响,减少氧化应激。
RA可以有效地降低ROS水平,减少因ROS损伤。GHORBANI等[33]针对RA能否提高脂肪组织源干细胞在营养缺乏培养条件下的存活率进行研究,发现RA可降低大鼠ROS水平,有助于保护ASCs移植到缺血器官后的存活。H2O2和DPPH自由基是ROS的重要来源。ALDOGHACHI等[26]用DPPH法、H2O2清除法和氧化还原法测试RA的抗氧化能力,RA对DPPH自由基的清除能力大于95%(100 μg/mL),对H2O2的清除能力大于87.83%(100 μg/mL),显示出RA对抑制ROS水平具有较好的作用。FENG等[34]评估RA在17 ℃液态保存过程中对猪精子抗氧化能力的影响,40 μmol/L RA处理可激活一磷酸腺苷激活的蛋白激酶的磷酸化,从而改善由ROS引起的氧化损伤,进而有效提高液态保存条件下猪精子的抗氧化能力。
氧化与抗氧化系统酶的含量对体内氧化与抗氧化平衡有着重要影响,RA可以通过调节相关酶的水平来抑制或减少脂质过氧化反应、氧化应激等带来的损伤。QU等[35]建立MPTP诱导的帕金森病小鼠模型,实验结果得出RA可以抑制MPTP诱导的超氧化物歧化酶和酪氨酸羟化酶的减少。GSH是一种细胞内抗氧化剂,![]() 等[31]发现在RA处理的小鼠红细胞内抗氧化剂GSH的浓度增加。
等[31]发现在RA处理的小鼠红细胞内抗氧化剂GSH的浓度增加。
2.2 抗癌
研究表明RA具有抗癌活性,包括白血病、结肠直肠癌、肝细胞癌、乳腺癌、胃癌和肺小细胞癌等癌症[36]。RA的抗癌机制包括:抑制相关信号通路;抑制癌细胞增殖和扩散;抑制细胞侵袭和迁移以及上皮-间质转化;促进癌细胞凋亡。RA的抗癌机制作用图见图4。
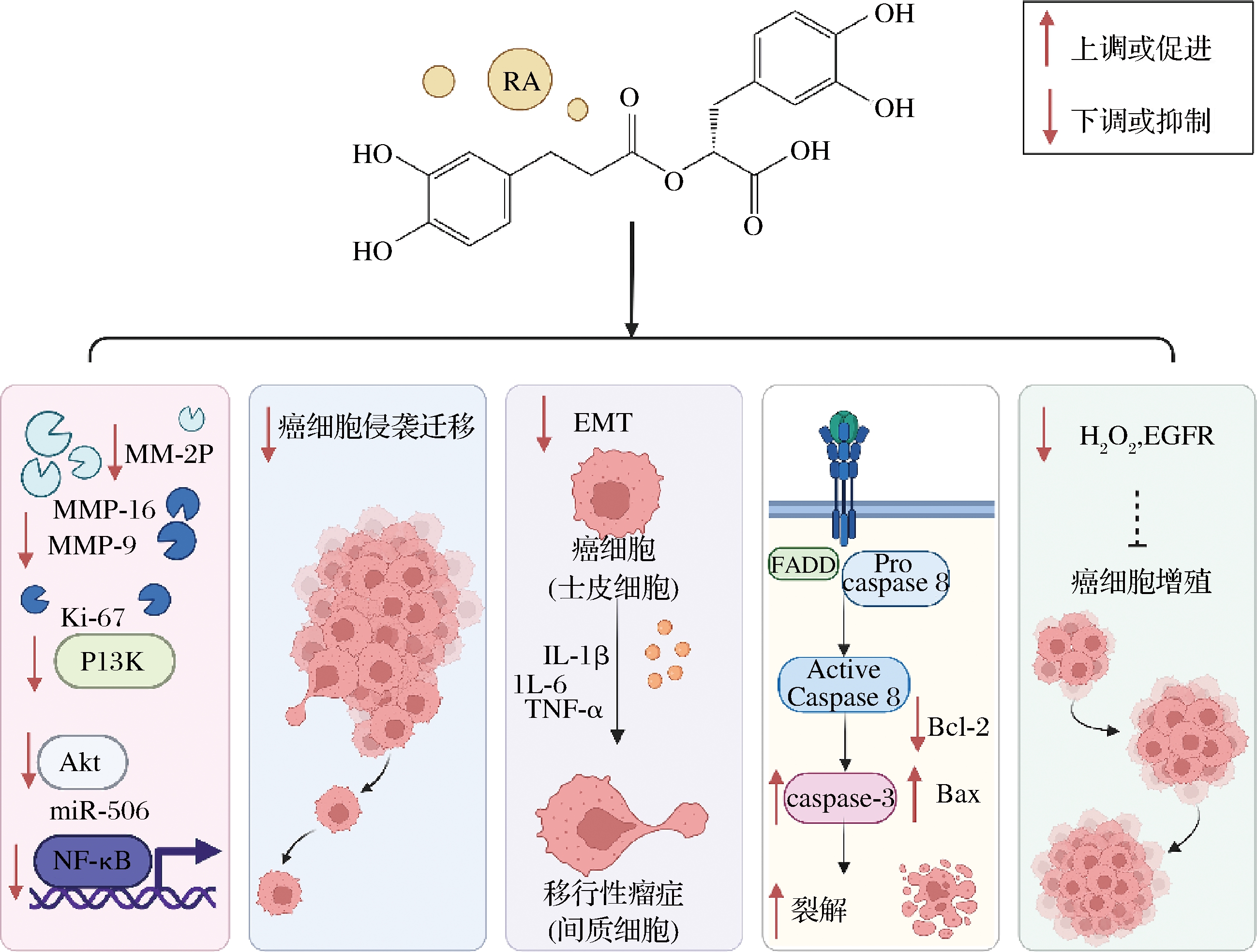
图4 迷迭香酸的抗癌机制
Fig.4 Anticancer mechanism of rosmarinic acid
注:基质金属蛋白酶(matrix metalloproteinase, MMP);增殖细胞核相关抗原(proliferating nucleus associated antigen, Ki-67);3羧基磷脂酰肌醇激酶 (3 carboxyl phosphatidyl inositol kinase, PI3K);蛋白激酶B(protein kinase B, Akt);微小RNA-506(microRNA-506, miR-506);核转录因子-B (nuclear factor-kappa B, NF-κB);上皮-间质转化(epithelia-mesenchymal transition, EMT);白介素(interleukin, IL);肿瘤坏死因子(tumor necrosis factor, TNF-α);Fas相关死亡域蛋白(Fas-associating protein with a novel death domain, FADD);含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase, caspase);增加淋巴细胞瘤-2基因(B cell lymphoma 2, Bcl-2);与Bcl-2-Associated X的蛋白质(Bcl-2-Associated X,Bax)。
MMP中的MMP-2和MMP-9与肿瘤细胞生长、迁移、侵袭密切相关。RA能减少侵袭相关因子MMPs的表达,并通过抑制癌细胞的PI3K/Akt/NF-κB信号传导途径来抑制癌细胞的增殖、迁移和侵袭并诱导其凋亡。AN等[36]用Matrigel®侵袭试验测试了RA对肝癌细胞侵袭的影响,通过Western blot检测MMP-2和MMP-9的表达,结果显示RA能显著降低HepG2细胞中的MMP-2和MMP-9的水平,减少癌细胞的侵袭和迁移。PI3K/Akt/NF-κB信号通路是调节癌细胞发生的重要途径。研究发现RA(100、200、400 μmol/L)处理HepG2细胞能显著抑制PI3K、p-Akt和NF-κB的蛋白表达。RA显著抑制胰腺癌细胞的细胞活力、细胞生长、上皮间质转化,并诱导胰腺细胞凋亡。体内研究显示RA剂量依赖性地抑制胰腺癌细胞的肿瘤生长,增加miR-506的表达,同时抑制来自异种移植裸鼠的解剖肿瘤组织中MMP2/16和Ki-67的表达[37]。
表皮生长因子受体是一种位于细胞表面可调节细胞生长和分化的糖蛋白,RA可以通过减少H2O2水平和抑制表皮生长因子受体的活性来降低癌症相关细胞因子水平。头颈部鳞状细胞癌是全球六大最常见的癌症类型之一。WAER等[38]研究得出RA/蓝光通过减少表皮生长因子受体活性和H2O2的产生,从而有效抑制头颈部鳞状细胞癌细胞的增殖。此外,RA能促进细胞凋亡,降低细胞凋亡相关抑制蛋白的表达水平。AN等[36]研究了RA对HepG2细胞生长、增殖和凋亡的调节作用,RA有效减少细胞凋亡抑制蛋白Bcl-2的表达,增加促凋亡蛋白Bax和裂解的caspase-3的表达,以剂量依赖的方式抑制HepG2细胞增殖。
2.3 抗代谢性疾病
RA能够调节脂肪代谢紊乱,对糖尿病以及与肥胖相关的疾病的治疗有积极的作用,在抗代谢疾病方面发挥着重要作用。
慢性炎症和过量脂质积累是肥胖及其相关代谢性疾病发生发展的重要标志,RA可通过调节NRF2信号的变化来抑制炎症,并通过促进AMPK和乙酰-CoA羧化酶的激活来抑制脂肪酸的合成和增强脂肪酸的氧化,进而缓解因脂质过量积累导致的脂质代谢紊乱,可用于治疗非酒精性脂肪性肝炎[39]。VASILEVA等[40]研究发现RA能促进Simpson-Golabi-Behmel综合征细胞的抗脂肪和抗炎活性,从而预防人类脂肪细胞的炎症和过度的脂肪堆积。
高血糖和氧化低密度脂蛋白(oxidized low density lipoprotein, oxLDL)是造成糖尿病血管病变的氧化应激和炎症过程的关键诱因。在高血糖条件下,oxLDL通过p38-FOXO1-TXNIP途径促进NLRP3炎症体的激活,最终导致NLRP3炎症体介导的内皮功能紊乱。NYANDWI等[41]研究发现RA通过下调p38-FOXO1-TXNIP途径和抑制炎症体的激活来抑制糖尿病动脉粥样硬化的内皮功能障碍,揭示了RA对糖尿病动脉粥样硬化的内皮功能障碍产生保护作用,并推测RA可作为糖尿病和心血管疾病的天然预防剂或治疗剂。季莉莉等[42]研究表明,夏枯草水提物(RA质量分数为0.1%~20%)可以缓解血视网膜屏障损伤导致的伊文氏蓝渗漏,抑制NF-κB信号通路和抑制神经小胶质细胞的激活来缓解视网膜的炎性损伤,即具有改善糖尿病视网膜病的药效活性。
2.4 神经保护
RA可以通过抑制过量谷氨酸的释放来防止神经因兴奋性毒性受到损伤,并能通过调节炎症和氧化应激等非淀粉样蛋白生成途径来发挥其神经保护作用。谷氨酸是中枢神经系统的主要兴奋性神经递质,然而,过量的谷氨酸释放会导致兴奋性毒性。WANG等[43]发现RA能够激活大脑皮层突触体内的γ-氨基丁酸A型受体,减少钙内流,并通过钙调素依赖性激酶II/突触素I途径抑制谷氨酸的释放。MOHAMMADMEHDI等[44]建立了大鼠脑室注射脂多糖的神经炎症模型,观察了RA对炎性细胞因子、神经元结构和氧化应激标志物的影响,结果表明RA以剂量依赖的方式恢复了氧化-抗氧化平衡,并防止了海马和前额皮层中促炎细胞因子的过度产生。
RA通过改善认知功能障碍在治疗神经性疾病中发挥显著作用。乙醇可引起认知障碍,RA能够以剂量依赖的方式预防乙醇引起的氧化损伤、记忆缺陷和认知功能障碍[45]。RA也可改善因阿尔茨海默病引起的认知功能障碍。MIRZA等[46]建立Aβ1-42诱导的小鼠阿尔茨海默病模型,结果表明RA对Aβ1-42所致小鼠空间记忆和再认记忆障碍及焦虑改变均有保护作用。LI等[47]研究了RA是否能影响缺氧/缺血(hypoxia/ischeamic,H/I)损伤引起的白质纤维和认知障碍的变化,发现RA通过改善胼胝体的再髓鞘化,从而缓解了H/I损伤后的认知功能障碍如运动、焦虑行为、学习和空间记忆障碍等[47]。
2.5 其他
除此之外,RA还具有抗病毒、抗菌、抗衰老、抗抑郁、抗炎以及抗过敏[48]等功能活性。
3 迷迭香酸在食品领域的应用
3.1 功能性食品原料
RA具有抗氧化、抗炎等多种生物活性,在功能食品领域应用广泛。RA是王老吉凉茶和中国传统茶饮罗布麻[1]中的主要功能成分之一,与茶饮的抗衰老、抗氧化活性密切相关。LC-MS分析显示, 迷迭香提取物主要含没食子儿茶素和RA,并且RA精油和其提取物安全有益,可作为饮料行业的保健成分[49]。野生百里香提取物中主要酚类化合物为RA,主要挥发性化合物为香芹酚,该提取物安全可靠,能用于生产功能性食品[50]。高村亮宏等[51]发明了以RA衍生物或其盐用于制造预防或改善膀胱过度活动症的食品。一种降尿酸保健品以迷迭香提取物、蒲公英提取物、百合提取物和牡丹根提取物为功效原料,具有显著的降尿酸效果,且不会造成肝肾损伤[52]。仲米存等[53]以迷迭香、鼠尾草等为原料制备了一种具有抗焦虑作用的食品,能供轻、中度抑郁人群日常食用。一种以核桃粉、迷迭香、广沙仁等为成分的功能食品,能缓解疲劳、恢复体力及提高人体工作效率[54]。
3.2 食品保鲜剂
迷迭香提取物中富含RA,RA具有抗氧化、抗菌活性,在食品的贮存、加工、运输中作保鲜剂。周诗雨等[55]发明了一种含有RA的复合抑菌增强剂,能有效抑制金黄色葡萄球菌、枯草芽孢杆菌和大肠杆菌,在冷鲜猪肉中补充此抑菌增强剂能实现预防、减轻、延缓食品腐败所带来的相关问题。他们还发明了一种含RA的复合抗氧化增强剂,能保持猪肉的色泽和鲜度且不产生腐败气味[56]。陈以新[57]发明了一种具有抗菌、抗氧化作用的复合保鲜剂,以明胶、海藻酸钠、RA等为原料,对蘑菇的保鲜效果好。鼠尾草提取物和迷迭香提取物具有协同作用,能应用于保鲜剂制备[58]。黄毅[59]发明了一种添加了RA和美洲花椒素的保鲜剂,具有较好的稳定性并能显著延长食品保质期。
3.3 食品添加剂和调味剂
根据GB 2760—2014《食品安全国家标准 食品添加剂使用标准》,迷迭香提取物被批准为食品添加剂。富含RA的香蜂花提取物具有成为食品的天然添加剂的潜力,可为烘焙产品提供有利的功能特性[60]。左汶骏等[61]发明了一种添加了RA的甜辣酱,酸辣可口并具有开胃作用。
4 小结和讨论
目前,RA的研究涉及面广泛,主要包括3个方面。a)RA的绿色高效生产方式:水酶法在传统酶解法上进行了改进;超临界流体萃取法提取率高并且对环境友好;超声波辅助提取法耗时短;植物愈伤组织生产RA高效;微生物发酵为工业化生产RA提供了新思路。b)RA生物活性机制:RA能抑制氧化应激并提高抗氧化能力;RA通过抑制癌细胞增殖扩散和侵袭迁移以及EMT、抑制癌症相关信号通路的激活、下调凋亡抑制蛋白的表达同时上调凋亡蛋白的表达来发挥对多种癌症的治疗作用;RA具有抗炎活性,能改善脂肪代谢,并能预防治疗糖尿病和心血管疾病;RA还能通过改善认知障碍和炎症及氧化-抗氧化平衡发挥对神经退行性疾病的保护作用。c)RA的产品开发现状:RA在食品领域主要被用于功能性食品原料、食品保鲜剂、食品添加剂及调味剂。
但RA研究的局限性仍然存在,RA的未来研究可以针对培养以下三点展开:
a)开发新型提取技术。BARDOT等[62]报道了一种新技术ipowder®应用于香蜂花中RA的提取,研究发现ipowder®提取的RA含量高,抗氧化活性强,这项技术能在保留植物化合物的完整性的同时使一些活性成分更容易获得。其次,微生物的发酵生产产量高,能实现大规模生产,选育生产RA的高效菌株也是提高RA产量的途径之一。将诱导子(茉莉酸甲酯、水杨酸、多壁碳纳米管)[63]用于处理植物对RA的生物合成途径提供了参考。
b)动物研究模型多样化。RA生物活性的研究模型较为单一,未来可以利用斑马鱼或兔等模型开展研究,为RA的临床应用提供理论依据。
c)提高RA的生物利用度。RA的生物利用度较低,可通过制备RA衍生物、联合其他活性成分使用来提高其利用率。例如,CARDULLO等[64]报道了RA衍生物酰胺1~10,衍生物具有比RA更优越的α-葡萄糖苷酶抑制活性,比抗糖尿病药物阿卡波糖更有效,并被证明是有效的抗氧化剂。百里醌、香芹酚、百里酚、RA的组合具有协同作用[65],可以将这些活性成分联合使用。此外,BANKOLE等[66]将迷迭香多酚封装在一种脂质体中,使得其物理化学及生物性能最佳。此外,将RA进行磷酸化、乙酰化、羧甲基化、硫酸化等修饰处理,研究其是否会产生新的生物活性,或某一生物活性是否能得到提高,这为RA的生物活性研究提供了新思路。
[1] LI C, TAN F, YANG J J, et al. Antioxidant effects of Apocynum venetum tea extracts on d-galactose-induced aging model in mice[J]. Antioxidants, 2019, 8(9):381.
[2] JORD N M J, LAX V, ROTA M C, et al. Relevance of carnosic acid, carnosol, and rosmarinic acid concentrations in the in vitro antioxidant and antimicrobial activities of Rosmarinus officinalis (L.) methanolic extracts[J]. Journal of Agricultural and Food Chemistry, 2012, 60(38):9603-9608.
N M J, LAX V, ROTA M C, et al. Relevance of carnosic acid, carnosol, and rosmarinic acid concentrations in the in vitro antioxidant and antimicrobial activities of Rosmarinus officinalis (L.) methanolic extracts[J]. Journal of Agricultural and Food Chemistry, 2012, 60(38):9603-9608.
[3] CRISTINA C, FINIMUNDY TIANE C, CARLA P, et al. Challenges of traditional herbal teas: Plant infusions and their mixtures with bioactive properties[J]. Food &Function, 2019, 10(9):5939-5951.
![]() T,
T, ![]() L, et al. Antioxidant, antigenotoxic and cytotoxic activity of essential oils and methanol extracts of Hyssopus officinalis L. subsp. aristatus (Godr.) Nyman (lamiaceae)[J]. Plants, 2021, 10(4):711.
L, et al. Antioxidant, antigenotoxic and cytotoxic activity of essential oils and methanol extracts of Hyssopus officinalis L. subsp. aristatus (Godr.) Nyman (lamiaceae)[J]. Plants, 2021, 10(4):711.
[5] PARRA C, MU OZ P, BUSTOS L, et al. UHPLC-DAD characterization of Origanum vulgare L. from Atacama desert Andean region and antioxidant, antibacterial and enzyme inhibition activities[J]. Molecules, 2021, 26(7):2100.
OZ P, BUSTOS L, et al. UHPLC-DAD characterization of Origanum vulgare L. from Atacama desert Andean region and antioxidant, antibacterial and enzyme inhibition activities[J]. Molecules, 2021, 26(7):2100.
![]() S,
S,  I
I KOV
KOV J, KOMZ
J, KOMZ KOV
KOV K, et al. Phenolic compounds and biological activity of selected Mentha species[J]. Plants, 2021, 10(3):550.
K, et al. Phenolic compounds and biological activity of selected Mentha species[J]. Plants, 2021, 10(3):550.
[7] SU C H, PHAM T T T, CHENG H H. Aqueous enzymatic extraction of rosmarinic acid from Salvia officinalis: Optimisation using response surface methodology[J]. Phytochemical Analysis, 2020, 31(5): 575-582.
[8] LEFEBVRE T, DESTANDAU E, LESELLIER E. Sequential extraction of carnosic acid, rosmarinic acid and pigments (carotenoids and chlorophylls) from Rosemary by online supercritical fluid extraction-supercritical fluid chromatography[J]. Journal of Chromatography A, 2021, 1639:461709.
[9] LI M Y, YIN D K, LI J C, et al. Rosmarinic acid, the active component of Salvia miltiorrhizae, improves gliquidone transport by regulating the expression and function of P-gp and BCRP in Caco-2 cells[J]. Die Pharmazie, 2020, 75(1): 18-22.
[10] LE T T, KANG T K, DO H T, et al. Protection against oxidative stress-induced retinal cell death by compounds isolated from Ehretia asperula[J]. Natural Product Communications, 2021, 16(12):1934578X2110679.
[11] FOUSEKI M M, DAMIANAKOS H, KARIKAS G A, et al. Chemical constituents from Cordia alliodora and C. colloccoca (Boraginaceae) and their biological activities[J]. Fitoterapia, 2016, 115:9-14.
[12] LIU Y, HU B C, WANG Y L, et al. Chemical constituents of Anchusa italica Retz. and their protective effects on cardiomyocytes injured by hypoxia/reoxygenation[J]. Phytochemistry Letters, 2020, 38:155-160.
[13] TRIFAN A, ![]() K, GRANICA S, et al. Symphytum officinale L.: Liquid-liquid chromatography isolation of caffeic acid oligomers and evaluation of their influence on pro-inflammatory cytokine release in LPS-stimulated neutrophils[J]. Journal of Ethnopharmacology, 2020, 262:113169.
K, GRANICA S, et al. Symphytum officinale L.: Liquid-liquid chromatography isolation of caffeic acid oligomers and evaluation of their influence on pro-inflammatory cytokine release in LPS-stimulated neutrophils[J]. Journal of Ethnopharmacology, 2020, 262:113169.
[14] SAYAH K, EL OMARI N, KHARBACH M, et al. Comparative study of leaf and rootstock aqueous extracts of Foeniculum vulgare on chemical profile and in vitro antioxidant and antihyperglycemic activities[J]. Advances in Pharmacological and Pharmaceutical Sciences, 2020, 2020:1-9.
[15] ARDA N, GÖREN N, KURU A, et al. Saniculoside N from Sanicula europaea L[J]. Journal of Natural Products, 1997, 60(11):1170-1173.
[16] GHAEDI N, POURABOLI I, ASKARI N. Antidiabetic properties of hydroalcoholic leaf and stem extract of Levisticum officinale: An implication for α-amylase inhibitory activity of extract ingredients through molecular docking[J]. Iranian Journal of Pharmaceutical Research: IJPR, 2020, 19:231-250.
[17] PAUN G, NEAGU E, MOROEANU V, et al. Chemical and bioactivity evaluation of Eryngium planum and Cnicus benedictus polyphenolic-rich extracts[J]. BioMed Research International, 2019, 2019:1-10.
[18] GUAN H Q, LUO W B, BAO B H, et al. A comprehensive review of rosmarinic acid: From phytochemistry to pharmacology and its new insight[J]. Molecules, 2022, 27(10): 3292.
[19] KUMARI S, ELANCHERAN R, KOTOKY J, et al. Rapid screening and identification of phenolic antioxidants in Hydrocotyle sibthorpioides Lam. by UPLC-ESI-MS/MS[J]. Food Chemistry, 2016, 203:521-529.
[20] DUCA A, STURZA A, MOAC E A, et al. Identification of resveratrol as bioactive compound of Propolis from western Romania and characterization of phenolic profile and antioxidant activity of ethanolic extracts[J]. Molecules, 2019, 24(18):3368.
E A, et al. Identification of resveratrol as bioactive compound of Propolis from western Romania and characterization of phenolic profile and antioxidant activity of ethanolic extracts[J]. Molecules, 2019, 24(18):3368.
[21] TUNGMUNNITHUM D, GARROS L, DROUET S, et al. Green ultrasound assisted extraction of trans rosmarinic acid from Plectranthus scutellarioides (L.) R.Br. leaves[J]. Plants (Basel), 2019, 8(3): 50.
[22] MODARRES M, BAHABADI S E, YAZDI M E T. Enhanced production of phenolic acids in cell suspension culture of Salvia leriifolia Benth. using growth regulators and sucrose[J]. Cytotechnology, 2018, 70(2):741-750.
[23] ABBASI B, SIDDIQUAH A, TUNGMUNNITHUM D, et al. Isodon rugosus (wall. ex Benth.) codd in vitro cultures: Establishment, phytochemical characterization and in vitro antioxidant and anti-aging activities[J]. International Journal of Molecular Sciences, 2019, 20(2):452.
[24] MAHSA B, MANUEL B Z G, XIAO C, et al. Metabolic engineering of Saccharomyces cerevisiae for rosmarinic acid production[J]. ACS Synthetic Biology, 2020, 9(8):1978-1988.
[25] ZHOU P P, YUE C L, ZHANG Y C, et al. Alleviation of the byproducts formation enables highly efficient biosynthesis of rosmarinic acid in Saccharomyces cerevisiae[J]. Journal of Agricultural and Food Chemistry 2022, 70 (16): 5077-5087.
[26] ALDOGHACHI F E H, NOOR ALMOUSAWI U M, SHARI F H. Antioxidant activity of rosmarinic acid extracted and purified from Mentha piperita[J]. Archives of Razi Institute, 2021, 76(5):1279-1287.
[27] BAKIR D, AKDENIZ M, ERTA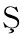 A, et al. A GC-MS method validation for quantitative investigation of some chemical markers in Salvia hypargeia Fisch. &C.A. Mey. of Turkey: Enzyme inhibitory potential of ferruginol[J]. Journal of Food Biochemistry, 2020, 44(9): e13350.
A, et al. A GC-MS method validation for quantitative investigation of some chemical markers in Salvia hypargeia Fisch. &C.A. Mey. of Turkey: Enzyme inhibitory potential of ferruginol[J]. Journal of Food Biochemistry, 2020, 44(9): e13350.
[28] MA Z J, LU Y B, YANG F G, et al. Rosmarinic acid exerts a neuroprotective effect on spinal cord injury by suppressing oxidative stress and inflammation via modulating the Nrf2/HO-1 and TLR4/NF-κB pathways[J]. Toxicology and Applied Pharmacology, 2020, 397:115014.
[29] ZHANG T T, MA S S, LIU C, et al. Rosmarinic acid prevents radiation-induced pulmonary fibrosis through attenuation of ROS/MYPT1/TGFβ1 signaling via miR-19b-3p[J]. Dose Response, 2020, 18(4):155932582096841.
[30] DE OLIVEIRA FORMIGA R, ALVES E B Jr, VASCONCELOS R C, et al. P-cymene and rosmarinic acid ameliorate TNBS-induced intestinal inflammation upkeeping ZO-1 and MUC-2: Role of antioxidant system and immunomodulation[J]. International Journal of Molecular Sciences, 2020, 21(16):5870.
![]() A, BÖYÜK A, EKINCI A, et al. Investigation of antioxidant effects of rosmarinic acid on liver, lung and kidney in rats: A biochemical and histopathological study[J]. Folia Morphologica, 2020, 79(2):288-295.
A, BÖYÜK A, EKINCI A, et al. Investigation of antioxidant effects of rosmarinic acid on liver, lung and kidney in rats: A biochemical and histopathological study[J]. Folia Morphologica, 2020, 79(2):288-295.
[32] BARANAUSKAITE J, SADAUSKIENE I, LIEKIS A, et al. Natural compounds rosmarinic acid and carvacrol counteract aluminium-induced oxidative stress[J]. Molecules, 2020, 25(8):1807.
[33] GHORBANI A, SADEGHNIA H R, AFSHARI A R, et al. Rosmarinic acid protects adipose tissue-derived mesenchymal stem cells in nutrient-deficient conditions[J]. Preventive Nutrition and Food Science, 2019, 24(4):449-455.
[34] FENG T Y, LV D L, ZHANG X, et al. Rosmarinic acid improves boar sperm quality, antioxidant capacity and energy metabolism at 17℃ via AMPK activation[J]. Reproduction in Domestic Animals, 2020, 55(12):1714-1724.
[35] QU L, XU H M, JIA W T, et al. Rosmarinic acid protects against MPTP-induced toxicity and inhibits iron-induced α-synuclein aggregation[J]. Neuropharmacology, 2019, 144:291-300.
[36] AN Y J, ZHAO J D, ZHANG Y R, et al. Rosmarinic acid induces proliferation suppression of hepatoma cells associated with NF-κB signaling pathway[J]. Asian Pacific Journal of Cancer Prevention, 2021, 22(5):1623-1632.
[37] HAN Y G, MA L G, ZHAO L, et al. Rosmarinic inhibits cell proliferation, invasion and migration via up-regulating miR-506 and suppressing MMP2/16 expression in pancreatic cancer[J]. Biomedicine &Pharmacotherapy, 2019, 115:108878.
[38] WAER C N, KAUR P, TUMUR Z, et al. Rosmarinic acid/blue light combination treatment inhibits head and neck squamous cell carcinoma in vitro[J]. Anticancer Research, 2020, 40(2):751-758.
[39] KIM M, YOO G, RANDY A, et al. Lemon balm and its constituent, rosmarinic acid, alleviate liver damage in an animal model of nonalcoholic steatohepatitis[J]. Nutrients, 2020, 12(4):1166.
[40] VASILEVA LILIY V, SAVOVA MARTINA S, DANIEL T, et al. Rosmarinic acid attenuates obesity and obesity-related inflammation in human adipocytes[J]. Food and Chemical Toxicology, 2021, 149:112002.
[41] NYANDWI J B, KO Y S, JIN H N, et al. Rosmarinic acid inhibits oxLDL-induced inflammasome activation under high-glucose conditions through downregulating the p38-FOXO1-TXNIP pathway[J]. Biochemical Pharmacology, 2020, 182(prepublish):114246.
[42] 季莉莉, 王峥涛, 梅茜钰, 等. 夏枯草水提物的医药用途: 中国, CN105106303B[P]. 2020-02-18.
[43] WANG C C, HSIEH P W, KUO J R, et al. Rosmarinic acid, a bioactive phenolic compound, inhibits glutamate release from rat cerebrocortical synaptosomes through GABAA receptor activation[J]. Biomolecules, 2021, 11(7):1029.
[44] MOHAMMADMEHDI H T, ATIYEH A Z, MAHTAB M, et al. Rosmarinic acid attenuates lipopolysaccharide-induced neuroinflammation and cognitive impairment in rats[J]. Journal of Chemical Neuroanatomy, 2021, 117(prepublish):102008-.
[45] WANG R H, JIANG H, ZHOU Z Y, et al. Physiological and transcriptome analysis reveal molecular mechanism in Salvia miltiorrhiza leaves of near-isogenic male fertile lines and male sterile lines[J]. BMC Genomics, 2019, 20(1): 780.
[46] MIRZA F J, AMBER S, SUMERA, et al. Rosmarinic acid and ursolic acid alleviate deficits in cognition, synaptic regulation and adult hippocampal neurogenesis in an Aβ1-42-induced mouse model of Alzheimer’s disease[J]. Phytomedicine: International Journal of Phytotherapy and Phytopharmacology, 2021, 83:153490.
[47] LI M, CUI M M, KENECHUKWU N A, et al. Rosmarinic acid ameliorates hypoxia/ischemia induced cognitive deficits and promotes remyelination[J]. Neural Regeneration Research, 2020, 15(5): 894-902.
[48] YANG L, ZENG Y N, WANG J, et al. Discovery and analysis the anti-pseudo-allergic components from Perilla frutescens leaves by overexpressed MRGPRX2 cell membrane chromatography coupled with HPLC-ESI-IT-TOF system[J]. Journal of Pharmacy and Pharmacology, 2020, 72(6): 852-862.
[49] CHRISTOPOULOU SPYRIDOULA D, CHRYSA A, PANAGIOTIS H, et al. Rosemary extract and essential oil as drink ingredients: An evaluation of their chemical composition, genotoxicity, antimicrobial, antiviral, and antioxidant properties[J]. Foods, 2021, 10(12):3143.
[50] MARINELA N, GIANPIERO P, DANIELE C, et al. High voltage electrical discharges as an alternative extraction process of phenolic and volatile compounds from wild thyme (Thymus serpyllum L.): In silico and experimental approaches for solubility assessment[J]. Molecules, 2020, 25(18):4131.
[51] 高村亮宏, 北村尚也, 山本尚基, 等. 迷迭香酸衍生物或其盐: 中国, CN112313204A[P]. 2021-02-02.
[52] 田双峰. 一种含迷迭香的降尿酸组合物、降尿酸保健品及降尿酸药物: 中国, CN113318183A[P]. 2021-08-31.
[53] 仲米存, 尹雷, 衣洁菡, 等. 一种具有抗焦虑抗抑郁功能的保健食品: 中国, CN113966837A[P]. 2022-01-25.
[54] 郭志强. 一种抗亚健康的功能性食品: 中国, CN104323082A[P]. 2015-02-04.
[55] 周诗雨, 刘爱玲, 毛伟斌, 等. 一种含迷迭香酸的复合抑菌增强剂及其应用: 中国, CN114343006A[P]. 2022-04-15.
[56] 周诗雨, 刘爱玲, 刘德时, 等. 一种含迷迭香酸的复合抗氧化增强剂及其制备: 中国, CN114343005A[P]. 2022-04-15.
[57] 陈以新. 一种蘑菇用明胶-壳聚糖-海藻酸钠复合保鲜剂: 中国, CN108925627A[P]. 2018-12-04.
[58] 谭华. 一种迷迭香提取组合物及其作为保鲜剂的应用: 中国, CN104939267A[P]. 2015-09-30.
[59] 黄毅. 含葡萄糖酸内酯的保鲜剂: 中国, CN103932353A[P]. 2014-07-23.
[60] CALEJA C, BARROS L, BARREIRA J C, et al. Suitability of lemon balm (Melissa officinalis L.) extract rich in rosmarinic acid as a potential enhancer of functional properties in cupcakes[J]. Food Chemistry, 2018, 250:67-74.
[61] 左汶骏, 刘福明, 谢世宏, 等. 一种甜辣酱及其制备方法: 中国, CN111011826A[P]. 2020-04-17.
[62] BARDOT V, ESCALON A, RIPOCHE I, et al. Benefits of the ipowder© extraction process applied to Melissa officinalis L.: Improvement of antioxidant activity and in vitro gastro-intestinal release profile of rosmarinic acid[J]. Food &Function, 2020, 11(1):722-729.
[63] FARZANEH F, REZA A M, ASGHAR M A, et al. Phytochemical, antioxidant, enzyme activity and antifungal properties of Satureja khuzistanica in vitro and in vivo explants stimulated by some chemical elicitors[J]. Pharmaceutical Biology, 2020, 58(1):286-296.
[64] CARDULLO N, CATINELLA G, FLORESTA G, et al. Synthesis of rosmarinic acid amides as antioxidative and hypoglycemic agents[J]. Journal of Natural Products, 2019, 82(3):573-582.
![]() A, et al. In vitro effect of the common culinary herb winter savory (Satureja montana) against the infamous food pathogen Campylobacter jejuni[J]. Foods, 2020, 9(4):537.
A, et al. In vitro effect of the common culinary herb winter savory (Satureja montana) against the infamous food pathogen Campylobacter jejuni[J]. Foods, 2020, 9(4):537.
[66] BANKOLE V, OSUNGUNNA M, SOUZA C R F, et al. Spray-dried proliposomes: An innovative method for encapsulation of Rosmarinus officinalis L. polyphenols[J]. AAPS PharmSciTech, 2020, 21(5): 143.