人类的一日三餐离不开糖的摄入。食用适量的糖,不仅可以满足人们身体机能需求,而且还可以带来幸福感。然而,随着生活水平的提高,人们摄入过多的糖,使得肥胖、糖尿病、龋齿、心脏病等疾病的患病率提高[1]。近些年,具有高吸收、高热量特点的传统食用糖(例如蔗糖、白糖、葡萄糖等)逐渐呈现出被低热量、低吸收特点的稀有糖(例如木糖醇、赤藓糖醇、D-阿洛酮糖等)取代的趋势[2]。国际稀有糖协会(International Society of Rare Sugars, ISRS)定义稀有糖为自然界中存在但含量极少的一类单糖及其衍生物[3]。稀有糖不仅具有甜味,而且热量低,更重要的是具有对人体健康有益的生理功能,发展前景巨大。
稀有糖D-塔格糖,分子式为C6H12O6,分子质量为180.16,结构式如图1所示,是D-半乳糖的同分异构体、D-山梨糖的C-3位差向异构体和D-果糖的C-4位差向异构体,外观为白色晶体颗粒或是白色粉末,易溶于水,微溶于乙醇,是一种天然存在的低热量功能性甜味剂,甜度是蔗糖的92%[4],热量是1.5 kcal/g[5]。D-塔格糖已被美国食品药品监督管理局(Food and Drug Administration, FDA)认可为一般认为安全(Generally Recognized as Safe,GRAS)的成分[5-7]。2014年,我国国家卫生和计划生育委员会批准D-塔格糖为新食品原料[6]。D-塔格糖不仅具有预防龋齿和肥胖、降低血糖等作用,而且对肠道健康有益[8]。

图1 D-塔格糖、D-半乳糖、D-山梨糖和D-果糖的结构式比较
Fig.1 Structural formula comparison of D-tagatose, D-galactose, D-sorbose, and D-fructose
本文简述了D-塔格糖的生理功能及应用,介绍了生物合成D-塔格糖所需主要的生物酶,归纳了近几年D-塔格糖的生物合成研究进展,并对D-塔格糖的生物合成作出了展望。
1 D-塔格糖的生理功能及应用
1.1 低热量甜味剂,可以发生美拉德反应,应用于食品
D-塔格糖的甜度是蔗糖的92%,但热量仅为蔗糖的37.5%(蔗糖热量为4 kcal/g)[5],是一种低热量甜味剂。它能够与食品中的蛋白质发生美拉德反应,从而改善食品的色泽和风味,在烘焙食品、饮料和糖果中具有重要应用。
1.2 预防肥胖,降低血糖,辅助治疗Ⅱ型糖尿病
D-塔格糖是一种低热量功能性甜味剂,可代替蔗糖等传统甜味剂应用于食品中,可以缓解肥胖和降低血糖[9]。在医药保健领域,D-塔格糖可用于制备治疗Ⅱ型糖尿病和肥胖的药物[10-12]。
1.3 优异益生元,有利于人体肠道健康
D-塔格糖能够被结肠中的肠道菌群发酵,刺激肠道内益生菌的生长,而抑制肠道内致病菌的生长[13]。另外,D-塔格糖发酵过程中能够产生对人体肠道健康有益的短链脂肪酸,例如丁酸等,可促进结肠上皮细胞的生长繁殖,抑制结肠癌的发生[14]。
1.4 抗龋齿,有利于保护牙齿健康
因为D-塔格糖不能被口腔中的微生物所利用,所以有利于减少口腔中酸性物质的产生,降低牙齿腐蚀,从而有效预防牙龈炎、龋齿、口臭等牙齿疾病的发生[13]。
1.5 作为底物生产其他稀有糖醇
根据生物转化法生产己糖策略,即Izumoring 策略[15],从 D-塔格糖出发,经合适的酶催化可以得到 D-山梨糖、D-塔格糖醇和半乳糖醇等具有重要生理功能的稀有糖醇(图2)。

图2 生物转化法生产己糖策略[15]
Fig.2 Strategy for bioproduction of hexose [15]
2 D-塔格糖的生产方法
2.1 自然提取法
自然界中的D-塔格糖主要存在于热带常青树树胶、苔藓、地衣、热可可、奶酪和酸奶中,含量及其微少[13,16-17]。从这些物质中直接提取D-塔格糖所需原材料用量大,成本非常高,难以实现D-塔格糖的工业化生产。
2.2 化学合成法
D-塔格糖可以由D-半乳糖通过化学合成法得到,所用化学催化剂为碱金属盐,其催化D-半乳糖与金属氢氧化物发生异构化反应,生成金属氢氧化物-D-塔格糖复合物;再经过酸中和,使得复合物释放出D-塔格糖[13-14,18]。但是化学合成法生产D-塔格糖反应过程比较复杂,容易产生副产物,使得目的产物D-塔格糖的纯度降低,给后期分离纯化带来不便,而且化学试剂的使用会造成环境负担,不符合绿色生产理念[19]。
2.3 生物合成法
D-塔格糖的生物合成主要有两种方式,一种是利用单酶促反应合成D-塔格糖,另一种是利用多酶促反应合成D-塔格糖。根据Izumoring 策略(图2),选择合适的单一的醛糖异构酶、D-塔格糖 3-差向异构酶和氧化还原酶可以分别催化D-半乳糖、D-山梨糖和半乳糖醇生成D-塔格糖。但是,D-半乳糖、D-山梨糖和半乳糖醇的价格比较高,难以真正应用于工业化生产,限制了D-塔格糖的工业化生产。当前,有研究人员选择价格低廉的乳糖、麦芽糊精、牛奶乳清粉等作为底物,利用多酶促反应的方式合成D-塔格糖,并且取得了一定的研究成果。生物合成法生产D-塔格糖具有生产效率高、产物纯度高、反应条件温和、成本低等优点,成为D-塔格糖工业化生产的首选方法[20]。
3 单酶促反应合成D-塔格糖
3.1 L-阿拉伯糖异构酶催化D-半乳糖合成D-塔格糖
单酶法生物合成稀有糖能够充分挖掘该酶的理化性质并应用于稀有糖的生产,具有简便高效、酶催化剂利用率高以及生产效率高等优点。L-阿拉伯糖异构酶(L-arabinose isomerase, L-AI)是目前生物合成D-塔格糖研究最多的一种酶,可以催化D-半乳糖为D-塔格糖。该酶的微生物来源广泛,包括Acidothermus cellulolytics ATCC43068[21],Bacillus subtilis str.168[22], Lactobacillus sakei 23K[23],Lactobacillus fermentum CGMCC2921[24],Bacillus thermoglucosidasius KCTC 1828[25], Alicyclobacillus hesperidum URH17-3-68[26], Bacillus coagulans NL01[27], Pseudoalteromonas haloplanktis ATCC 14393[28],Geobacillus stearothermophilus[4], Clostridium hylemonae DSM 15053[29],Lactobacillus brevis MF 465792[30], Enterococcus faecium DBFIQ E36[31], Bifidobacterium adolescentis CICC 6178[32], Klebsiella pneumoniae DSM 681[33]等。上述微生物来源的L-阿拉伯糖异构酶酶学性质如表1所示,最适反应温度为40~75 ℃,最适反应pH值为5.0~8.0,多种金属离子为该酶的激活剂,如Mn2+,Co2+和Mg2+。其中,大部分L-AI对L-阿拉伯糖和D-半乳糖具有底物特异性,有少部分仅对L-阿拉伯糖具有底物特异性,而对D-半乳糖无底物特异性,例如来自于Bacillus subtilis str.168[22]和 Pseudoalteromonas haloplanktis ATCC 14393[28]的L-AI。另外,来自于Acidothermus cellulolytics ATCC43068[21],Lactobacillus sakei 23K[23],Lactobacillus fermentum CGMCC2921[24],Bifidobacterium adolescentis CICC 6178[32]等的L-AI酶对D-半乳糖表现出较强的底物特异性。
表1 不同微生物来源的L-AI酶学性质
Table 1 Enzymatic properties of L-AI from different microbial sources

来源最适反应温度/℃最适反应pH值金属离子aKcat/Km/[(mmol/L)-1·min-1]参考文献Acidothermus cellulolytics ATCC43068757.5Mn2+, Co2+9.3[21]Bacillus subtilis str.168327.5Mn2+-[22]Lactobacillus sakei 23K30~405.0~7.0Mn2+, Mg2+10.3[23]Lactobacillus fermentum CGMCC2921656.5Mn2+, Co2+9.02[24]Bacillus thermoglucosidasius KCTC 1828407.0Mn2+2.8[25]Alicyclobacillus hesperidum URH17-3-68707.0Co2+1.2[26]Bacillus coagulans NL01607.5Mn2+, Co2+1.0[27]Pseudoalteromonas haloplanktis ATCC 14393408.0Mn2+-[28]Geobacillus stearothermophilus608.0Mn2+0.26[4]Clostridium hylemonae DSM 15053507~7.5Mg2+b3.69[29]Lactobacillus brevis MF 465792657.0Mg2+, Mn2+, Co2+0.12[30]Enterococcus faecium DBFIQ E36 505.5Mn2+-[31]Bifidobacterium adolescentis CICC 6178556.5Mn2+, Zn2+9.3[32]Klebsiella pneumoniae DSM 681408.0Mn2+-[33]
注:a底物为 D-半乳糖;b 单位为[(mmol/L)-1·s-1];-表示参考文献中未报道(下同)。
在大肠杆菌表达系统中异源表达来自于Bacillus coagulans NL01的L-AI,在 60 ℃和 pH 7.5 的条件下进行全细胞催化,当底物D-半乳糖的质量浓度为150 g/L和250 g/L时,所得D-塔格糖的转化率分别为32%和27%,转化时间分别为32 h和48 h [27]。利用来自于Bifidobacterium adolescentis CICC 6178的经纯化的L-AI酶催化100 mmol/L D-半乳糖(含6 mmol/L Mn2+),在 55 ℃和 pH 6.5 的条件下反应10 h,D-塔格糖转化率为56.7% [32]。在大肠杆菌表达系统中异源表达来自于Klebsiella pneumoniae DSM 681的L-AI,底物为100 g/L D-半乳糖(含1 mmol/L Mn2+),在 50 ℃和 pH 8.0 的条件下进行全细胞催化反应30 min,D-塔格糖的转化率为33.5% [33]。
芽孢表面展示技术是通过将目标酶与芽孢衣壳蛋白进行融合表达,依赖于芽孢衣壳蛋白的锚定作用将目标酶展示在芽孢表面,从而实现酶的固定化,固定化酶能够在极端环境下保持催化活性,而且克服了底物和产物穿膜障碍[10],是一种有益的酶固定化方法尝试。LIU等[16]通过芽孢表面展示技术将来源于Lactobacillus fermentum CGMCC2921的L-AI展示在Bacillus subtilis 168芽孢表面,得到的重组L-AI芽孢表现出相对较高的催化活性和较强的热稳定性,在80 ℃下保存30 min仍保留87%的酶活性。利用该重组L-AI芽孢作为生物催化剂,以100 g/L D-半乳糖为底物,在70 ℃反应24 h, D-塔格糖的转化率约为75%。GUO等[10]同样采用芽孢表面展示技术将来源于Lactobacillus brevis PC16的L-AI展示在Bacillus subtilis DB403芽孢表面,利用重组L-AI芽孢作为生物催化剂,以125 g/L D-半乳糖(含1 mmol/L Mn2+)为底物,在 67 ℃和 pH 6.5 的条件下反应28 h,D-塔格糖的转化率为79.7%,而且重组L-AI芽孢具有良好的重复利用性能,5次循环后,比活性仍保留87%,D-塔格糖的转化率为40.7%。芽孢表面展示技术的缺点是芽孢产量较低,难以工业化应用。表2汇总了上述催化D-半乳糖合成D-塔格糖的文献报道。
表2 催化D-半乳糖合成D-塔格糖
Table 2 Synthesis of D-tagatose from D-galactose

L-AI来源宿主菌生物催化剂D-半乳糖质量浓度/(g/L)金属离子D-塔格糖转化率/%参考文献Bacillus coagulans NL01Escherichia coli全细胞 150(或250)-32(或27)[27]Bifidobacterium adolescentis CICC 6178Escherichia coli纯酶 ~18Mn2+56.7[32]Klebsiella pneumoniae DSM 681Escherichia coli全细胞100Mn2+33.5[33]Lactobacillus fermentum CGM-CC2921Bacillus subtilis 168重组芽孢100-75[16]Lactobacillus brevis PC16Bacillus subtilis DB403重组芽孢125Mn2+79.7[10]
因为受到热力学平衡的限制,异构酶催化的反应具有转化率低的特点,降低了生产效率也不利于产品的分离纯化。虽然提高反应温度可以使反应平衡偏向产物一侧,但是过高的温度不仅会降低酶的活性,而且易导致糖的褐变影响产品质量,特别是在碱性条件下。因此,研发反应温度低、反应pH偏酸性、催化活性高、耐热性强的酶催化剂将有益于工业化应用。
3.2 D-塔格糖 3-差向异构酶催化D-山梨糖生产D-塔格糖
D-塔格糖 3-差向异构酶(D-tagatose 3-epimerase, DTE)或D-阿洛酮糖 3-差向异构酶(D-psicose 3-epimerase,DPE)是生物合成D-阿洛酮糖的常用酶,它们具有广泛的底物特异性。例如,来自于Agrobacterium tumefaciens[34]和 Arthrobacter globiformis[35]的DPE酶和来自于Caballeronia fortuita的DTE酶[36]皆能实现D-山梨糖和D-塔格糖之间的相互转化,其中利用来自于Caballeronia fortuita的DTE酶进行生物催化时,D-塔格糖与D-山梨糖之间的平衡比为30.7∶69.3(图3)。但是,由于D-山梨糖价格昂贵,以其为底物生产D-塔格糖在工业生产中缺乏经济性,因此关于催化D-山梨糖生产D-塔格糖的研究不多。
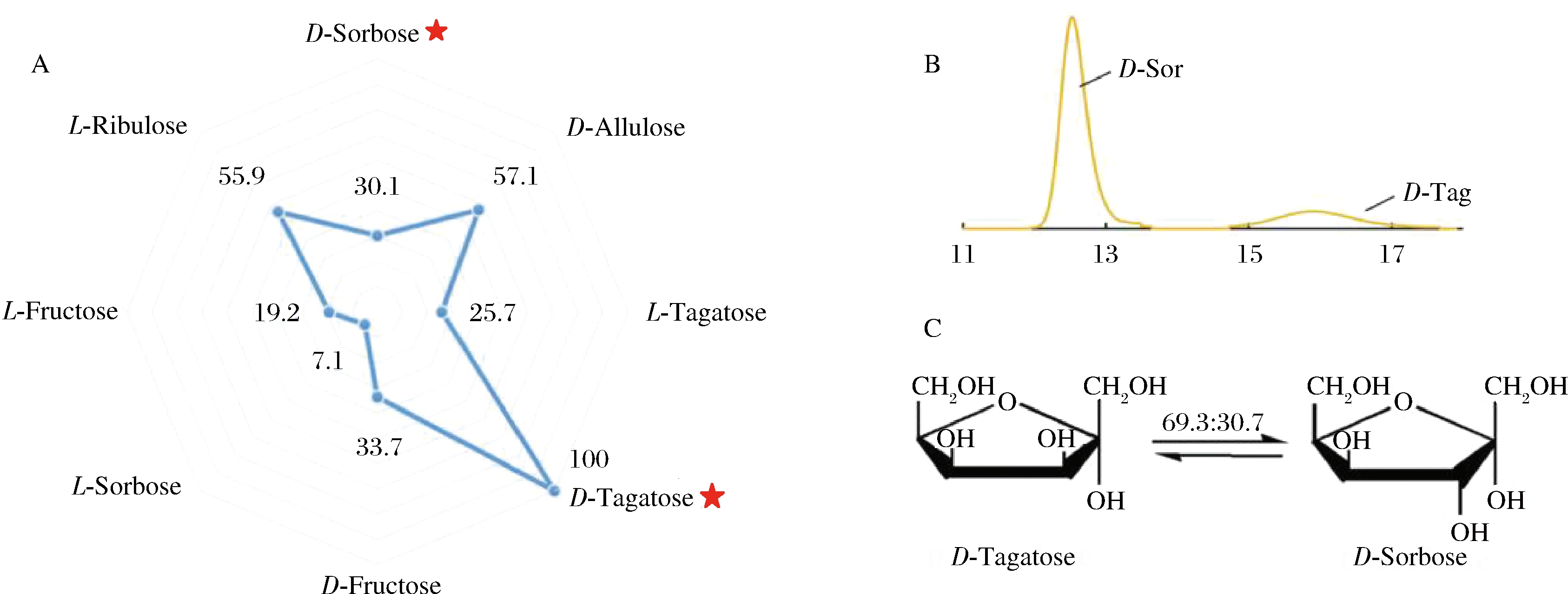
A-雷达分布图(对D-塔格糖的比活性设为100%);B-HPLC图谱;C-平衡化
图3 重组DTE酶底物特异性的雷达分布,D-塔格糖和D-山梨糖的异构化反应HPLC图谱和相应的平衡比(图片修改自文献[36])
Fig.3 The radar distribution of substrate specificity of recombinant DTE, the HPLC profiles of epimerization reactions between the D-tagatose and D-sorbose, and the corresponding equilibriumratios (Image modified from reference[36])
3.3 半乳糖醇脱氢酶催化半乳糖醇生产D-塔格糖
半乳糖醇2-脱氢酶(galactitol 2-dehydrogenase,GDH)能够在辅酶NAD+存在下将多种多价脂肪醇和多元醇分别氧化成相应的酮和酮糖。JAGTAP等[37]在大肠杆菌表达系统中异源表达来自于Rhizobium leguminosarum bv.viciae 3841的GDH酶,采用His-tag亲和层析技术纯化GDH酶蛋白,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳测得酶的分子质量为28 kDa,经凝胶过滤色谱测得酶的分子质量为114 kDa,表明该酶为同四聚体,经酶学性质分析得到其最适温度为35 ℃,最适反应pH值为9.5,当底物为半乳糖醇时动力学参数Km为8.8 mmol/L, Kcat为835 min-1,Kcat/Km为94.9 (mmol/L)-1·min-1,表明该酶对半乳糖醇具有较好的底物特异性。该GDH酶催化半乳糖醇反应30 min,D-塔格糖的转化率高达72%,并通过旋光性的测定,验证氧化产物为D-塔格糖。
虽然利用半乳糖醇脱氢酶催化半乳糖醇生产D-塔格糖可以获得较高的D-塔格糖转化率,但是该氧化反应需要添加辅酶NAD+,并且底物半乳糖醇价格高,作为工业化生产原料缺乏经济性。
4 多酶促反应催化廉价底物合成D-塔格糖
4.1 催化乳糖生产D-塔格糖
乳糖是由一分子D-葡萄糖和一分子D-半乳糖组成的双糖,由于其价格远低于D-半乳糖、D-山梨糖和半乳糖醇,成为生产D-塔格糖的首选底物。ZHANG等[38]构建了Lactiplantibacillus plantarum工程菌株,敲除了半乳糖激酶基因,阻断D-半乳糖代谢;同时表达水解乳糖为D-葡萄糖和D-半乳糖的β-半乳糖苷酶(β-galactosidase,β-GAL)以及催化D-半乳糖为D-塔格糖的L-阿拉伯糖异构酶,从而实现一锅法由乳糖直接生物合成D-塔格糖。利用该工程菌株在65 ℃和pH 7.5条件下进行静息细胞反应,以175 g/L乳糖为底物,反应56 h,D-塔格糖的转化率为33%。
4.2 催化乳清粉生产D-塔格糖
乳制品工业废弃物作为一种廉价原料被用以生产稀有糖产品[39-40]。ZHANG等[41]报道了通过连续全细胞催化和发酵技术将一种富含乳糖的乳制品副产品,即奶酪乳清粉(cheese whey powder,CWP)转化为3种低热量甜味剂D-塔格糖、D-阿拉伯醇和半乳糖醇(图4)。首先,利用一株共表达β-半乳糖苷酶和L-阿拉伯糖异构酶的大肠杆菌工程菌株水解CWP中的乳糖为D-半乳糖和葡萄糖并将D-半乳糖异构化为D-塔格糖。随后,利用Metschnikowia pulcherrima E1发酵D-葡萄糖和剩余的D-半乳糖为D-阿拉伯醇和半乳糖醇。最终,利用428.57 g/L CWP(含300 g/L乳糖)得到68.35 g/L D-塔格糖、60.12 g/L D-阿拉伯醇和28.26 g/L半乳糖醇。该报道同时实现了中间代谢产物D-葡萄糖和残留D-半乳糖的充分利用,利用工业副产物生产出一系列有价值产品。

图4 利用连续全细胞催化和发酵技术将富含乳糖的乳制品 废弃物生物转化生产D-塔格糖、D-阿拉伯醇和半乳糖醇[41]
Fig.4 Biocatalytic conversion of a lactose-rich dairy waste into D-tagatose, D-arabitol and galactitol using sequential whole cell and fermentation technologies[41]
4.3 催化麦芽糊精生产D-塔格糖
DAI等[42]构建了一个由α-葡聚糖磷酸化酶(α-glucan phosphorylase,αGP)、磷酸葡萄糖变位酶(phosphoglucomutase,PGM)、葡萄糖6-磷酸异构酶(glucose 6-phosphate isomerase, PGI)、D-塔格糖1,6-二磷酸醛缩酶(D-tagatose 1,6-bisphosphate aldolase,GatZ)和磷酸乙醇酸磷酸酶(phos-phoglycolate phosphatase,PGP)组成的大肠杆菌全细胞生物催化体系,进一步利用CRISPR-Cas9技术敲除了导致中间产物代谢的基因(图5),以增加中间产物的积累,利用最终得到的大肠杆菌工程菌株作为生物催化剂,以10 g/L 麦芽糊精为底物,反应3 h得到了3.383 g/L D-塔格糖,转化率为33.83 g/L。

图5 重组大肠杆菌模块化途径工程促进麦芽糊精生物合成D -塔格糖[42]
Fig.5 Enhanced biosynthesis of D-tagatose from maltodextrin through modular pathway engineering of recombinant Escherichia coli[42]
多酶促反应在生物合成和转化方面具有很大的潜力。与单酶促反应相比,多酶促反应可以实现更复杂的反应,实现由低成本底物生产高附加值产品,避免中间产物分离,减少中间产物抑制,甚至改变反应平衡[5]。但是由于各种酶的比例不平衡、中间产物的代谢通量不平衡以及各种酶的最佳反应条件不同等原因使得D-塔格糖的转化率不高。后期,可以利用合成生物学、代谢工程、蛋白质工程等技术优化酶的合成与表达、提升酶的性能,增加各种酶分子间的协同作用,提高D-塔格糖的转化率。
5 D-塔格糖的分离纯化及结晶
D-塔格糖的分离纯化是至关重要的一步,影响后期D-塔格糖的结晶和产品品质。黄闻霞等[43]报道了采用Ca2+型离子交换树脂分离D-半乳糖和D-塔格糖,分离得到的D-塔格糖的纯度为98%,回收率为83%;分离得到的D-塔格糖溶液再经阴阳离子交换树脂脱盐脱色,脱盐率达到93%,D-塔格糖的回收率达到87%。随后,通过添加乙醇实现D-塔格糖的结晶。苏齐等[44]利用模拟移动床色谱分离D-塔格糖和D-半乳糖,发现当阀门切换时间为6.43 min 时,分离得到D-塔格糖的纯度达到100%,回收率达到99.93%。近些年,模拟移动床色谱因其具有分离效率高、溶剂利用率高和能耗低等优势在稀有糖的生产过程中被广泛应用。
目前,关于D-塔格糖结晶研究的报道很少。生物合成D-塔格糖时容易产生其他杂糖(例如D-葡萄糖、D-果糖等),且工业分离时往往不能被完全除去从而会影响D-塔格糖晶体的成核和生长,影响D-塔格糖晶体的形态、粒径分布和纯度等。WANG等[45]研究了3种杂质糖(D-麦芽糖、D-果糖、D-葡萄糖)对D-塔格糖晶体成核速率的影响,发现杂质糖在D-塔格糖晶体表面的吸附会阻碍D-塔格糖晶体的生长(图6)。

图6 不同实验条件下D-塔格糖晶体的扫描电子显微镜图像[45]
Fig.6 Scanning electron microscopy images of D-tagatose crystals under different experimental conditions[45]
WANG等还通过单晶生长实验研究了杂质糖对D-塔格糖晶体生长速率的影响,并利用分子动力学模拟揭示了D-塔格糖在分子尺度上的晶体成核和生长机理。D-塔格糖工业结晶工艺目前报道不多。
6 总结与展望
作为一种功能性天然甜味剂,D-塔格糖不仅在食品领域具有重要应用价值,而且在医药和保健领域也发挥着至关重要的作用。我国虽然已经批准D-塔格糖为新食品原料,但是国内D-塔格糖仍未实现大规模生产,原因主要有以下几点:a)仍未获得一种具有生产强度高、热稳定性强和转化率高的酶催化剂;b)食品级宿主菌的开发力度不强;c)底物成本高;d)产物分离纯化难度高。针对以上原因,建议重点研究:a)利用蛋白质工程、酶工程等技术改造酶分子结构,得到催化活性高、转化率高、热稳定性高的酶分子;b)开发经GRAS认证的食品级宿主菌作为生物催化载体,包括枯草芽孢杆菌、酵母菌、乳酸菌等;c)充分发挥多酶促反应在生物合成和转化方面的潜力,平衡各种酶分子的表达水平以及中间代谢通量,增加各种酶分子间的协同作用,利用低成本底物大规模生产D-塔格糖;d)优化 D-塔格糖分离纯化和结晶工艺。通过上述努力,构建工业化生产 D-塔格糖的简单、高效、创新性工艺路线。
[1] SURAPUREDDI S R K, RAVINDHRANATH K, KUMAR G S S, et al. High resolution and high throughput analytical methods for d-tagatose and process related impurities using capillary electrophoresis[J]. Analytical Biochemistry, 2020, 609:113981.
[2] BAPTISTA S L, ROMAN A, OLIVEIRA C, et al. Galactose to tagatose isomerization by the l-arabinose isomerase from Bacillus subtilis: A biorefinery approach for Gelidium sesquipedale valorisation[J]. LWT, 2021, 151:112199.
A, OLIVEIRA C, et al. Galactose to tagatose isomerization by the l-arabinose isomerase from Bacillus subtilis: A biorefinery approach for Gelidium sesquipedale valorisation[J]. LWT, 2021, 151:112199.
[3] BEERENS K, DESMET T, SOETAERT W. Enzymes for the biocatalytic production of rare sugars[J]. Journal of Industrial Microbiology &Biotechnology, 2012, 39(6):823-834.
[4] LAKSMI F A, ARAI S, TSURUMARU H, et al. Improved substrate specificity for D-galactose of L-arabinose isomerase for industrial application[J]. Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics, 2018, 1866(11):1084-1091.
[5] DAI Y W, LI M L, JIANG B, et al. Whole-cell biosynthesis of d-tagatose from maltodextrin by engineered Escherichia coli with multi-enzyme co-expression system[J]. Enzyme and Microbial Technology, 2021, 145:109747.
[6] 王静. 甜味剂D-塔格糖的生产及其在食品中的应用[J]. 中国调味品, 2016, 41(1):140-143.
WANG J. Production of sweetener D-tagatose and its application in food[J]. China Condiment, 2016, 41(1):140-143.
[7] ROY S, CHIKKERUR J, ROY S C, et al. Tagatose as a potential nutraceutical: Production, properties, biological roles, and applications[J]. Journal of Food Science, 2018, 83(11):2699-2709.
[8] LAKSMI F A, ARAI S, ARAKAWA T, et al. Expression and characterization of l-arabinose isomerase from Geobacillus stearothermophilus for improved activity under acidic condition[J]. Protein Expression and Purification, 2020, 175:105692.
[9] BOBER J R, NAIR N U. Galactose to tagatose isomerization at moderate temperatures with high conversion and productivity[J]. Nature Communications, 2019, 10:4548.
[10] GUO Q, AN Y F, YUN J H, et al. Enhanced d-tagatose production by spore surface-displayed l-arabinose isomerase from isolated Lactobacillus brevis PC16 and biotransformation[J]. Bioresource Technology, 2018, 247:940-946.
[11] DE SOUSA M, MELO V M M, HISSA D C, et al. One-step immobilization and stabilization of a recombinant Enterococcus faecium DBFIQ E36 l-arabinose isomerase for d-tagatose synthesis[J]. Applied Biochemistry and Biotechnology, 2019, 188(2):310-325.
[12] SOUZA T C, OLIVEIRA R C, BEZERRA S G S, et al. Alternative heterologous expression of l-arabinose isomerase from Enterococcus faecium DBFIQ E36 by residual whey lactose induction[J]. Molecular Biotechnology, 2021, 63(4):289-304.
[13] 代艺伟. 多酶催化体系转化麦芽糊精合成D-塔格糖的研究[D]. 无锡: 江南大学, 2021.
DAI Y W. Study on synthesis of D-tagatose from maltodextrin by multi-enzyme catalytic system[D].Wuxi: Jiangnan University, 2021.
[14] 郭青青. 利用β-半乳糖苷酶和L-阿拉伯糖异构酶由乳糖生产D-塔格糖[D]. 济南: 山东大学, 2018.
GUO Q Q. Production of D-tagatose from lactose by β-galactosidase and L-Arabinose isomerase[D].Jinan: Shandong University, 2018.
[15] IZUMORI K. Izumoring: A strategy for bioproduction of all hexoses[J]. Journal of Biotechnology, 2006, 124(4):717-722.
[16] LIU Y, LI S, XU H, et al. Efficient production of d-tagatose using a food-grade surface display system[J]. Journal of Agricultural and Food Chemistry, 2014, 62(28):6756-6762.
[17] ZHENG Z J, XIE J X, LIU P, et al. Elegant and efficient biotransformation for dual production of d-tagatose and bioethanol from cheese whey powder[J]. Journal of Agricultural and Food Chemistry, 2019, 67(3): 829-835.
[18] WANG Z H, WANG M M, LYU X M, et al. Recycling preparation of high-purity tagatose from galactose using one-pot boronate affinity adsorbent-based adsorption-Assisted isomerization and simultaneous purification[J]. Chemical Engineering Journal, 2022, 446:137089.
[19] BORTONE N, FIDALEO M. Stabilization of immobilized l-arabinose isomerase for the production of d-tagatose from d-galactose[J]. Biotechnology Progress, 2020, 36(6): e3033.
[20] DE SOUSA M, SILVA GURGEL B, PESSELA B C, et al. Preparation of CLEAs and magnetic CLEAs of a recombinant l-arabinose isomerase for d-tagatose synthesis[J]. Enzyme and Microbial Technology, 2020, 138:109566.
[21] CHENG L F, MU W M, ZHANG T, et al. An L-arabinose isomerase from Acidothermus cellulolytics ATCC 43068: Cloning, expression, purification, and characterization[J]. Applied Microbiology and Biotechnology, 2010, 86(4):1089-1097.
[22] KIM J H, PRABHU P, JEYA M, et al. Characterization of an L-arabinose isomerase from Bacillus subtilis[J]. Applied Microbiology and Biotechnology, 2010, 85(6):1839-1847.
[23] RHIMI M, ILHAMMAMI R, BAJIC G, et al. The acid tolerant l-arabinose isomerase from the food grade Lactobacillus sakei 23K is an attractive d-tagatose producer[J]. Bioresource Technology, 2010, 101(23):9171-9177.
[24] XU Z, QING Y J, LI S, et al. A novel l-arabinose isomerase from Lactobacillus fermentum CGMCC2921 for d-tagatose production: Gene cloning, purification and characterization[J]. Journal of Molecular Catalysis B: Enzymatic, 2011, 70(1-2):1-7.
[25] SEO M. Characterization of an L-arabinose isomerase from Bacillus thermoglucosidasius for D-tagatose production[J]. Bioscience Biotechnology and Biochemistry, 2013, 77(2): 385-388.
[26] FAN C, LIU K Q, ZHANG T, et al. Biochemical characterization of a thermostable l-arabinose isomerase from a thermoacidophilic bacterium, Alicyclobacillus hesperidum URH17-3-68[J]. Journal of Molecular Catalysis B: Enzymatic, 2014, 102:120-126.
[27] MEI W D, WANG L, ZANG Y, et al. Characterization of an L-arabinose isomerase from Bacillus coagulans NL01 and its application for D-tagatose production[J]. BMC Biotechnology, 2016, 16(1):1-11.
[28] XU W, FAN C, ZHANG T, et al. Cloning, expression, and characterization of a novel l-arabinose isomerase from the psychrotolerant bacterium Pseudoalteromonas haloplanktis[J]. Molecular Biotechnology, 2016, 58(11):695-706.
[29] NGUYEN T K, HONG M G, CHANG P S, et al. Biochemical properties of L-arabinose isomerase from Clostridium hylemonae to produce D-tagatose as a functional sweetener[J]. PLoS One, 2018, 13(4): e0196099.
[30] DU M G, ZHAO D Y, CHENG S S, et al. Towards efficient enzymatic conversion of d-galactose to d-tagatose: Purification and characterization of l-arabinose isomerase from Lactobacillus brevis[J]. Bioprocess and Biosystems Engineering, 2019, 42(1):107-116.
[31] MANZO R M, ANTUNES A S L M, SOUSA MENDES J, et al. Biochemical characterization of heat-tolerant recombinant l-arabinose isomerase from Enterococcus faecium DBFIQ E36 strain with feasible applications in d-tagatose production[J]. Molecular Biotechnology, 2019, 61(6):385-399.
[32] ZHANG G Y, AN Y F, PARVEZ A, et al. Exploring a highly D-galactose specific L-arabinose isomerase from Bifidobacterium adolescentis for D-tagatose production[J]. Frontiers in Bioengineering and Biotechnology, 2020, 8:377.
[33] SHIN K C, SEO M J, KIM S J, et al. Characterization of l-arabinose isomerase from Klebsiella pneumoniae and its application in the production of d-tagatose from d-galactose[J]. Applied Sciences, 2022, 12(9):4696.
[34] KIM H J, HYUN E K, KIM Y S, et al. Characterization of an Agrobacterium tumefaciens D-psicose 3-epimerase that converts D-fructose to D-psicose[J]. Applied and Environmental Microbiology, 2006, 72(2):981-985.
[35] YOSHIHARA A, KOZAKAI T, SHINTANI T, et al. Purification and characterization of d-allulose 3-epimerase derived from Arthrobacter globiformis M30, a GRAS microorganism[J]. Journal of Bioscience and Bioengineering, 2017, 123(2):170-176.
[36] LI S N, CHEN Z W, ZHANG W L, et al. Characterization of a d-tagatose 3-epimerase from Caballeronia fortuita and its application in rare sugar production[J]. International Journal of Biological Macromolecules, 2019, 138:536-545.
[37] JAGTAP S S, SINGH R, KANG Y C, et al. Cloning and characterization of a galactitol 2-dehydrogenase from Rhizobium legumenosarum and its application in D[J]. Enzyme and Microbial Technology, 2014, 58-59:44-51.
[38] ZHANG S S, GUO T T, XIN Y P, et al. Biotechnological production of d-tagatose from lactose using metabolically engineering Lactiplantibacillus plantarum[J]. LWT, 2021, 142:110995.
[39] RAI S K, KAUR H, KAULDHAR B S, et al. Dual-enzyme metal hybrid crystal for direct transformation of whey lactose into a high-value rare sugar D-tagatose: Synthesis, characterization, and a sustainable process[J]. ACS Biomaterials Science &Engineering, 2020, 6(12):6661-6670.
[40] ZHANG G Y, ZABED H M, YUN J H, et al. Two-stage biosynthesis of D-tagatose from milk whey powder by an engineered Escherichia coli strain expressing L-arabinose isomerase from Lactobacillus plantarum[J]. Bioresource Technology, 2020, 305:123010.
[41] ZHANG G Y, ZABED H, AN Y, et al. Biocatalytic conversion of a lactose-rich dairy waste into D-tagatose, D-arabitol and galactitol using sequential whole cell and fermentation technologies[J]. Bioresource Technology, 2022, 358: 127422.
[42] DAI Y W, LI C C, ZHENG L H, et al. Enhanced biosynthesis of d-tagatose from maltodextrin through modular pathway engineering of recombinant Escherichia coli[J]. Biochemical Engineering Journal, 2022, 178:108303.
[43] 黄闻霞, 沐万孟, 江波. D-塔格糖的分离纯化[J]. 食品与发酵工业, 2008, 34(6):168-171.
HUANG W X, MU W M, JIANG B. Study on separation and purification of D-tagatose[J]. Food and Fermentation Industries, 2008, 34(6):168-171.
[44] 苏齐, 李会, 査小玲, 等. 模拟移动床色谱拆分D-塔格糖和D-半乳糖的模拟研究[J]. 当代化工, 2014, 43(7):1379-1381, 1385.
SU Q, LI H, ZHA X L, et al. Simulation study on separation of D-tagatose and D-galactose in simulated moving bed[J]. Contemporary Chemical Industry, 2014, 43(7):1379-1381, 1385.
[45] WANG D B, WANG Y, LI Y A, et al. Uncovering the role of impurity sugars on the crystallization of d-tagatose crystal: Experiments and molecular dynamics simulations[J]. Food Chemistry, 2022, 397:133762.