巨噬细胞主要出现在淋巴组织中,在血管中多为单核细胞,在周围淋巴组织中因吞噬多种异物成为巨噬细胞,其通过积极参与机体的先天性免疫和特异性免疫反应发挥保护作用,并形成免疫防御的第一道防线[1-2]。在先天性免疫反应中,激活后的巨噬细胞对外来病菌、凋亡细胞和肿瘤细胞具有极强的吞噬消化作用,并能通过分泌相关酶和介质消灭机体内多种致病菌和有害微生物[3]。在特异性免疫过程中,巨噬细胞对内源或外源性抗原进行识别,递呈给抗原特异性细胞激活特异性免疫应答[4]。食源性生物活性肽以其较高的消化性、营养性和生理效果,逐渐受到国内外研究者的广泛关注[5]。
食源性生物活性肽具有抗氧化、降血压、降血脂、护肝和增强免疫调节等优良的生物学功能[6-9]。食源性生物活性肽由于来源广泛、成本低,在功能保健食品的开发与研究方面具有广阔的市场前景和应用空间,是当前国内外研究的热门课题之一。牡蛎营养极为丰富,富含微量元素、蛋白质、脂肪酸、维生素和牛磺酸等营养成分,自古以来就为功能保健食品,被冠以“海底牛奶”的称号[10]。牡蛎也是我国卫生部门首次批准的药食同源海洋源产品,具有很高的药用价值[11]。据《本草纲目》所述,牡蛎肉具有治虚损、解丹毒、化痰清热、除湿痢下和恢复气血的疗效。众所周知的中药方剂“牡蛎散”对诸虚不足、津液不固、心忪惊惕等症状有显著疗效。据研究表明,牡蛎拥有许多生物活性与保健功能,尤其是其经过蛋白酶水解制备的牡蛎肽具有提高免疫力[12]、抗病毒[13]、抗肿瘤[14]、抗氧化[15]、抗疲劳[16]、降血压[17]和生殖保健[18]等,然而关于牡蛎肽体外免疫保护活性的研究报告较少。
因此,本试验通过采用脂多糖(lipopolysaccharides, LPS)处理并活化RAW264.7巨噬细胞,探讨牡蛎肽对RAW264.7巨噬细胞免疫活性的影响,评估牡蛎肽的体外免疫保护活性,并为牡蛎肽在免疫功能调节方面的研究利用提供参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 实验材料
新鲜长牡蛎(Crassostrea gigas)购自浙江杭州海鲜市场。牡蛎肽(oyster peptide, OP)根据之前的相关报道进行提取制备[9],纯度大于95%,分子质量小于1 000 Da。
1.1.2 实验细胞
小鼠RAW264.7巨噬细胞由浙江省立同德医院提供。
1.1.3 实验试剂
LPS、中性红染色剂,美国Sigma公司;CCK8(cell counting kit-8,CCK8)试剂盒,Biomiky公司;NO检测试剂盒,南京建成生物工程研究所;胎牛血清、DMEM(dulbecco’s modified eagle medium,DMEM)高糖培养基、胰酶、双抗,美国Gibco公司;总RNA提取试剂TRIzol Reagent,美国Invitrogen公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)试剂盒、白细胞介素-6(interleukin-6,IL-6)试剂盒、白细胞介素-10(interleukin-10,IL-10)试剂盒,武汉博士徳生物工程有限公司;反转录试剂盒、SYBR Premix Ex Taq(Tli RNaseH Plus),Takara公司;RIPA裂解液、BCA蛋白浓度测定试剂盒(增强型)、特超敏ECL化学发光试剂盒、苯甲磺酰氟(phenylmethanesulfonyl fluoride,PMSF)膜,上海碧云天生物技术有限公司;SDS-PAGE 4×蛋白上样缓冲液,北京Solarbio科技有限公司;鼠单克隆抗体p-IκBα,美国Novus Biologicals公司;兔单克隆抗体IκBa,美国Abcam公司;兔单克隆抗体p-p65、鼠单克隆抗体p65、兔单克隆抗体 β-actin,美国Cell Signaling公司;山羊抗兔IgG(HRP)、山羊抗鼠IgG(HRP),南京诺唯赞生物科技有限公司;PVDF转印膜,Millipore公司;其余实验所用试剂均为分析纯级别。
1.2 仪器与设备
902型80 ℃超低温冰箱、3111 CO2细胞培养箱,赛默飞世尔科技有限公司;5415D低温高速冷冻离心机,德国Eppendorf;SJ-CJ-2D超净工作台,上海尚净公司;倒置显微镜,德国Leica Microsystems;BP211D电子天平,美国Sartorius;HH-4型恒温水浴锅,国华电器有限公司;Tecan Infinite F200多功能酶标仪,瑞士TECAN 集团公司;ABI ViiATM 7实时荧光定量PCR仪,美国Applied Biosystems;Alpha FluorChem FC3凝胶成像系统,美国ProteinSimple;9556A水平脱色摇床,国产华利达。
1.3 实验方法
1.3.1 RAW264.7细胞的培养
使用含有10%胎牛血清(fetal bovine serum,FBS)和质量浓度100 μg/mL链霉素双抗的DMEM高糖培养液培养RAW264.7巨噬细胞。细胞培养箱条件设置为:温度37 ℃,5%(体积分数)CO2。当细胞增殖达到80%~90%的密度后进行下一步传代和种板。首先,将细胞培养瓶里过期的细胞培养液倒掉,用适量预热的磷酸盐缓冲液(phosphate buffer saline,PBS)溶液洗涤细胞3次。然后用移液枪吹落瓶底和瓶壁上附着的细胞,混匀,收集细胞悬液。对细胞悬液适当稀释,在显微镜下用细胞计数板进行细胞计数,根据不同实验要求取相应细胞数进行种板。
1.3.2 CCK8法检测巨噬细胞增殖率
采用CCK8法检测细胞增殖率。将处于对数生长期的RAW264.7 细胞按1×104/孔的密度接种至96孔板中,过夜孵育24 h后,倒掉上清液。空白组每孔加入200 μL完全培养液。实验组则根据实验方案设置,每孔分别加入200 μL牡蛎肽稀释培养液(质量浓度梯度设置为:100、200、300、400、600、700、800、900、1 000 μg/mL),每组实验复孔数设置为6个。在细胞培养箱孵育24 h,用预热的PBS洗3次,加入质量浓度为0.5 mg/mL CCK8的培养液100 μL于每孔中,在37 ℃条件下孵育4 h至出现蓝紫色沉淀。避光取出96孔板并在酶标仪中振荡3 min。最终,在450 nm波长下检测吸光度值。细胞增殖率计算如公式(1)所示:
细胞增殖率![]()
(1)
1.3.3 中性红法检测巨噬细胞吞噬能力
将处于对数生长期RAW264.7细胞按1×104/孔密度接种至96孔板,过夜培养后弃上清液,按如下实验分组分别进行不同实验处理,并根据中性红法测定巨噬细胞吞噬能力。实验分组:空白组、模型组(LPS终质量浓度为2 μg/mL)和不同浓度的牡蛎肽处理组。细胞孵育24 h后,弃上清液,每孔加入200 μL含有浓度为0.075%的中性红生理盐水,继续培养4 h。用预热PBS溶液洗涤细胞3遍,每孔加入200 μL酸乙醇(包括50%乙醇,1%乙酸和49%超纯水,体积分数)。置于4 ℃条件下静置过夜,通过酶标仪在540 nm处测量溶液吸光度值,并根据公式(2)计算中性红吞噬率:
中性红吞噬率![]()
(2)
1.3.4 一氧化氮分泌水平测定
将RAW264.7细胞按3×105/孔数量接种至6孔板,过夜培养后弃上清液。根据如下分组进行实验处理:(1)空白组:只加入DMEM完全培养基;(2)模型组:加入含有LPS质量浓度为2 μg/mL的完全培养液;(3)牡蛎肽低剂量组:加入含有OP质量浓度为100 μg/mL的完全培养液;(4)牡蛎肽中剂量组:加入含有OP质量浓度为200 μg/mL的完全培养液;(5)牡蛎肽高剂量组:加入含有OP质量浓度为400 μg/mL的完全培养液。根据试验分组孵育细胞24 h,收集细胞培养上清液。然后在1 500 r/min转速下离心5 min并取上清液,采用一氧化氮试剂盒检测巨噬细胞NO分泌水平[19]。
1.3.5 细胞因子分泌水平测定
实验分组及细胞处理方法同1.3.4节。实验处理24 h后收集细胞培养液,在1 500 r/min条件下离心5 min收集上清液。使用ELISA试剂盒测定细胞培养上清液中炎症因子IL-6、IL-10以及TNF-α的含量。
1.3.6 巨噬细胞炎症相关基因mRNA表达水平测定
将RAW264.7细胞按3×105/孔数量接种至6孔板并过夜培养,弃去上清液。根据1.3.4节进行相同细胞实验分组和处理,孵育24 h后使用胰酶消化并收集细胞。使用PBS溶液漂洗细胞3次,随后转移至无RNA酶的灭菌EP管中。每管分别加入1 mL预冷TRIzol试剂,反复吹打充分裂解细胞,冻存在-80 ℃冰箱用于后续实验。
根据GeneBank查找本实验目的基因的已知完整序列,通过Primer Premier 6.22设计并获得相应特异性上游和下游引物,最后委托上海生物工程公司进行合成。具体目的基因序列如表1所示。将冻存于-80 ℃ 环境的细胞裂解液取出,置于冰上溶解,细胞总RNA的提取采用TRIzol抽提法。分别通过蛋白核酸定量仪测定并记录ODA260/A280、ODA260/A230以及提取RNA浓度,并采用琼脂糖凝胶电泳检测提取RNA质量。随后,已检验纯度并合格的RNA通过采用反转录试剂盒进行反转录,并合成cDNA。根据荧光定量试剂盒说明书进行qPCR反应。反应体系的总体积是20 μL:含有10 μL SYBR Green混合液,0.4 μL ROX II,2.0 μL cDNA样品,6.8 μL Rnase-Free ddH2O,上游引物和下游引物各0.4 μL。按以下程序扩增上述反应体系:在95 ℃温度下预变性30 s;接着进行PCR反应(变性温度为95 ℃,5 s;退火温度为60 ℃,34 s),循环40次。反应结束后,进行定量分析。目的基因相对mRNA表达水平根据2-ΔΔCt公式计算,以 β-actin作为内参基因,每组试验重复3次。
表1 实时荧光定量PCR反应引物序列
Table 1 Real-time quantitative PCR primer sequences

基因登录号引物序列/(5'-3')产物大小/bp退火温度/℃TNF-αNM_013693F:CCCCAAAGGGATGAGAAGTTR:CACTTGGTGGTTTGCTACGA13260IL-6NM_031168F:CCAATGCTCTCCTAACAGATR:TGTCCACAAACTGATATGCT16164IL-10NM_010548F:CAGTCGGCCAGAGCCACATR:CTTGGCAACCCAAGTAAC-CCTT14464IL-1βXM_006498795F:AGGACATGAGCACCT-TCTTTTCCR:ACGTCACACACCAGCAGGT-TAT9460iNOSNM_010927F:GTTCTCAGCCCAACAATA-CAAGAR:GTGGACGGGTCGATGTCAC12760TLR4NM_021297.3F:TTGAATCCCTGCATAGAGG-TAGR:TTCAAGGGGTTGAAGCT-CAGAT12560β-actinNM_007393F:AGTGTGACGTTGACATCCGTR:GCAGCTCAGTAACAGTCCGC29860
注:IL-1β:白细胞介素-1β(interleukin-1β,IL-1β);iNOS:诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS);TLR4:Toll样受体4(toll-like receptor 4,TLR4)。
1.3.7 牡蛎肽对巨噬细胞NF-κB通路的影响
将细胞按2×106/孔数量接种到6孔板并过夜培养。然后将细胞与不同浓度牡蛎肽以及质量浓度为2 μg/mL的LPS溶液孵育24 h。孵育结束后,用预热PBS溶液漂洗3次,并收集各组巨噬细胞置于离心管中,以1 500 r/min转速离心2 min。弃上清液后,将细胞沉淀置于冰上,使用Western-blot检测NF-κB通路蛋白表达量。
a)总蛋白样品制备和定量:使用前,根据试剂盒说明书配制裂解液,并进行总蛋白的提取。每管取4 μL蛋白提取液,采用BCA法进行总蛋白浓度的定量。其余总蛋白提取液分别按比例加入蛋白上样缓冲液,混匀并煮沸,置于-80 ℃冰箱保存备用。
b)SDS-PAGE电泳分析及转膜:配制浓缩胶和分离胶。每个上样孔加入60 μg蛋白样品,并加入上样缓冲液补体积。先后在60 V和80 V恒压下跑胶。电泳结束后,根据靶蛋白分子质量以及对应的蛋白条带,切取分离胶。将PVDF膜置于甲醇中浸泡,然后转移到Tris-Glycine转移缓冲液中平衡;SDS-PAGE凝胶在Tris-Glycine转移缓冲液平衡;安装转膜夹,排气泡后压紧置于转膜液中,以100 V恒压全湿转膜。转膜结束后将PVDF膜正面朝上放于封闭盒中,用含5% BSA的 TBST(tris buffered saline with Tween-20,TBST)溶液封闭。封闭结束,用TBST溶液洗涤。
c)抗体孵育:将一抗以适当比例溶于TBST溶液(含3% BSA),并和PVDF膜在4 ℃孵育过夜,使用TBST溶液洗涤。将二抗以适当比例溶于TBST溶液(含3% BSA),和PVDF膜在室温下振荡孵育1 h;使用TBST溶液洗涤。
d)化学发光,显影和灰度值测定:临用前,根据ECL化学发光试剂盒说明书,按比例将A液和B液混匀,制备显影液。将PVDF转印膜浸于显影液中室温孵育1 min后吸尽余液体,使用化学发光成像仪显影并观察拍照。最后采用Image J软件计算分析各蛋白条带的灰度值,重复3次。
1.4 数据处理
实验数据用均值±标准差(Mean±SD)表示,使用SPSS 25.0软件进行单因素方差分析(one-way ANOVA)。不同组间釆用LSD法进行多重比较检验,P<0.05代表数据具有显著性差异。
2 结果与分析
2.1 牡蛎肽对RAW264.7细胞增殖率的影响
采用CCK8法测定牡蛎肽对RAW264.7巨噬细胞增殖能力的影响。除去空白组,在96孔板中分别加入质量浓度100、200、300、400、600、700、800、900、1 000 μg/mL牡蛎肽培养液并孵育24 h,并根据增殖率计算公式得到RAW264.7巨噬细胞的相对增殖率。结果如图1所示,与空白组相比,质量浓度范围在100~900 μg/mL的牡蛎肽对RAW264.7细胞的增殖率没有显著性影响(P>0.05)。本实验结果表明,在一定范围内,牡蛎肽对巨噬细胞增殖没有毒性影响,可以进行后续实验。

图1 不同质量浓度牡蛎肽对RAW264.7细胞增殖率的影响
Fig.1 Effect of different concentrations of OP on the index of RAW264.7 cells proliferation
注:图中不同字母代表显著性差异(P<0.05)(下同)。
2.2 牡蛎肽对RAW264.7细胞吞噬作用的影响
不同质量浓度牡蛎肽对小鼠巨噬细胞吞噬功能影响如图2所示。吞噬作用是吞噬细胞如RAW264.7细胞消灭外源性致病菌和内源性凋亡细胞的有效方法。LPS通过激活巨噬细胞并诱导其分化成熟,增强单核细胞-巨噬细胞的吞噬作用,但也可能使吞噬功能性细胞产生过度活化,导致炎症发生。中性红吞噬实验结果显示,使用2 μg/mL的LPS刺激RAW264.7细胞24 h后,可显著增强巨噬细胞的吞噬作用(P<0.05)。与空白组比较,加入质量浓度为100、200、300、400、600、700、800、900 μg/mL的牡蛎肽,可显著提高巨噬细胞的吞噬能力(P<0.05),并在一定范围内(100~600 μg/mL)呈现剂量依赖性关系。但其对细胞吞噬的刺激效果低于单独给予LPS造模组。
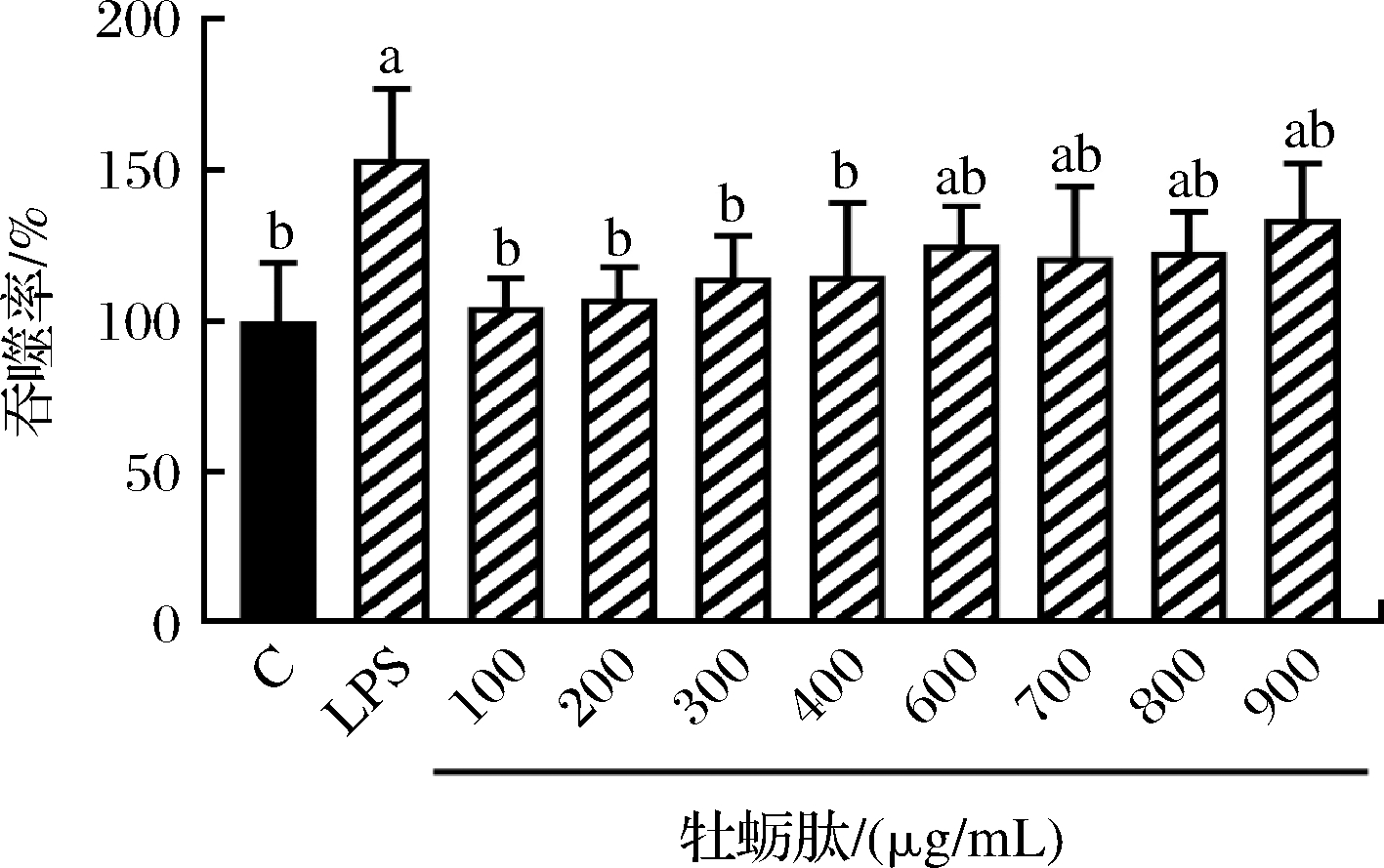
图2 不同质量浓度牡蛎肽对RAW264.7细胞吞噬能力的影响
Fig.2 Effect of different concentrations of OP on the phagocytosis of RAW264.7 cells
2.3 牡蛎肽对RAW264.7细胞NO分泌水平的影响
NO的释放量是反应巨噬细胞抗炎活性的常见指标,抑制NO的过量产生可以治疗并缓解某些炎症性疾病。不同浓度牡蛎肽对RAW264.7巨噬细胞NO分泌水平结果如图3所示。结果显示,与空白组比较,单独给予LPS造模组NO的分泌水平显著提高(P<0.05),说明LPS导致RAW264.7巨噬细胞产生了炎症反应。与LPS模型组比较,不同浓度牡蛎肽的处理使巨噬细胞的NO分泌水平显著降低(P<0.05),并且具有一定剂量依赖性。
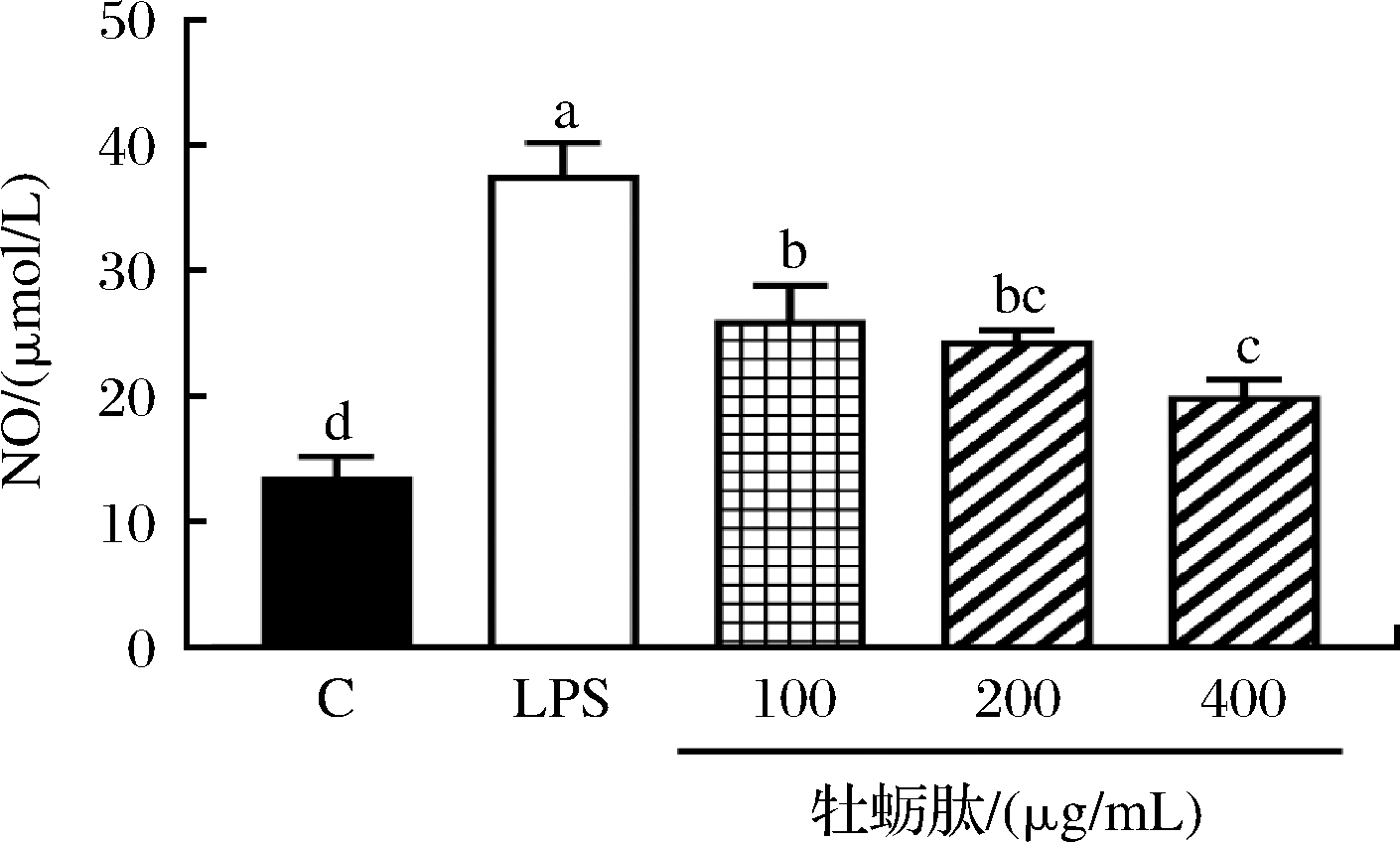
图3 不同质量浓度牡蛎肽对RAW264.7巨噬细胞NO 分泌水平的影响
Fig.3 Effect of different concentrations of OP on the NO secretion of RAW264.7 cells
2.4 牡蛎肽对RAW264.7细胞炎症因子分泌水平的影响
巨噬细胞常见炎症指标主要有TNF-α、IL-6和IL-10,不同浓度牡蛎肽对RAW264.7细胞炎症因子分泌水平的影响见图4。如图4-A和图4-C所示,牡蛎肽处理RAW264.7细胞24 h后,与空白组比较,仅用LPS处理的RAW264.7细胞产生的IL-6和TNF-α含量显著升高,提示RAW264.7细胞产生炎性反应。与单独给予LPS处理组相比,加入质量浓度为100、200、400 μg/mL的牡蛎肽使RAW264.7细胞IL-6和TNF-α分泌水平全部显著降低(P<0.05),具有浓度依赖效应。图4-B结果表明,与空白组相比,LPS模型组RAW264.7细胞的IL-10分泌水平显著上升(P<0.05)。使用牡蛎肽处理炎症RAW264.7巨噬细胞24 h后,质量浓度为100 μg/mL的牡蛎肽使RAW264.7细胞IL-10分泌水平下降,但没有显著性影响(P>0.05)。然而牡蛎肽质量浓度分别为200、400 μg/mL时,RAW264.7细胞的IL-10分泌水平显著降低(P<0.05),且具有剂量依赖性。

A-IL-6;B-IL-10;C-TNF-α
图4 不同质量浓度牡蛎肽对RAW264.7细胞IL-6,IL-10和TNF-α分泌水平的影响
Fig.4 Effects of different concentrations of OP on secretion levels of IL-6, IL-10 and TNF-α in RAW264.7 cells
2.5 牡蛎肽对RAW264.7细胞炎症相关基因表达水平的影响
为了进一步探讨牡蛎肽对LPS诱导的细胞炎症的保护作用,使用RT-PCR法测定了一氧化氮合酶和炎症相关基因mRNA的相对表达水平,结果如图5所示。与空白组相比,LPS处理组的RAW264.7细胞IL-1β、TNF-α、IL-6、IL-10、iNOS以及TLR4的mRNA表达量都显著增加(P<0.05)。分别用质量浓度为100、200、400 μg/mL的牡蛎肽处理LPS造模后的RAW264.7细胞。给药24 h后,与LPS组相比,RAW264.7细胞IL-1β、TNF-α、IL-6、IL-10、iNOS以及TLR4 mRNA表达水平都显著下降(P<0.05),且呈剂量依赖性关系。其中,高浓度的牡蛎肽使巨噬细胞中TLR4、IL-6、IL-1β和IL-10 mRNA相对表达显著下降(P<0.05),其分泌水平与空白组相比无显著性差异(P>0.05)。

A-IL-1β;B-TNF-α;C-IL-6;D-IL-10;E-TLR4;F-iNOS
图5 不同质量浓度牡蛎肽对RAW264.7 细胞IL-1β、TNF-α、IL-6、IL-10、TLR4和iNOS mRNA表达水平的影响
Fig.5 Effects of different concentrations of OP on the mRNA expression levels of IL-1β, TNF-α, IL-6, IL-10, TLR4 and iNOS in RAW264.7 cells
2.6 牡蛎肽对RAW264.7细胞NF-κB信号通路的影响
为了探究牡蛎肽对巨噬细胞NF-κB信号通路的作用,通过Western-blot法测定巨噬细胞IκBα和p65的蛋白磷酸化水平。结果如图6所示,与空白组比较,LPS和牡蛎肽均能促进p65和IκBα发生磷酸化。LPS处理巨噬细胞24 h后,RAW264.7细胞中p-p65/p65和p-IκBα/IκBα比值显著升高(P<0.05)。牡蛎肽处理巨噬细胞24 h后,与LPS模型组比较,p65和IκBα蛋白磷酸化水平随着牡蛎肽浓度的增加而降低,具有剂量依赖性。其中,浓度为400 μg/mL的牡蛎肽处理组显著降低了p-p65/p65和p-IκBα/IκBα比值(P<0.05),但都略高于空白组。结果提示,牡蛎肽对巨噬细胞起的免疫保护作用可能通过激活NF-κB信号通路实现。
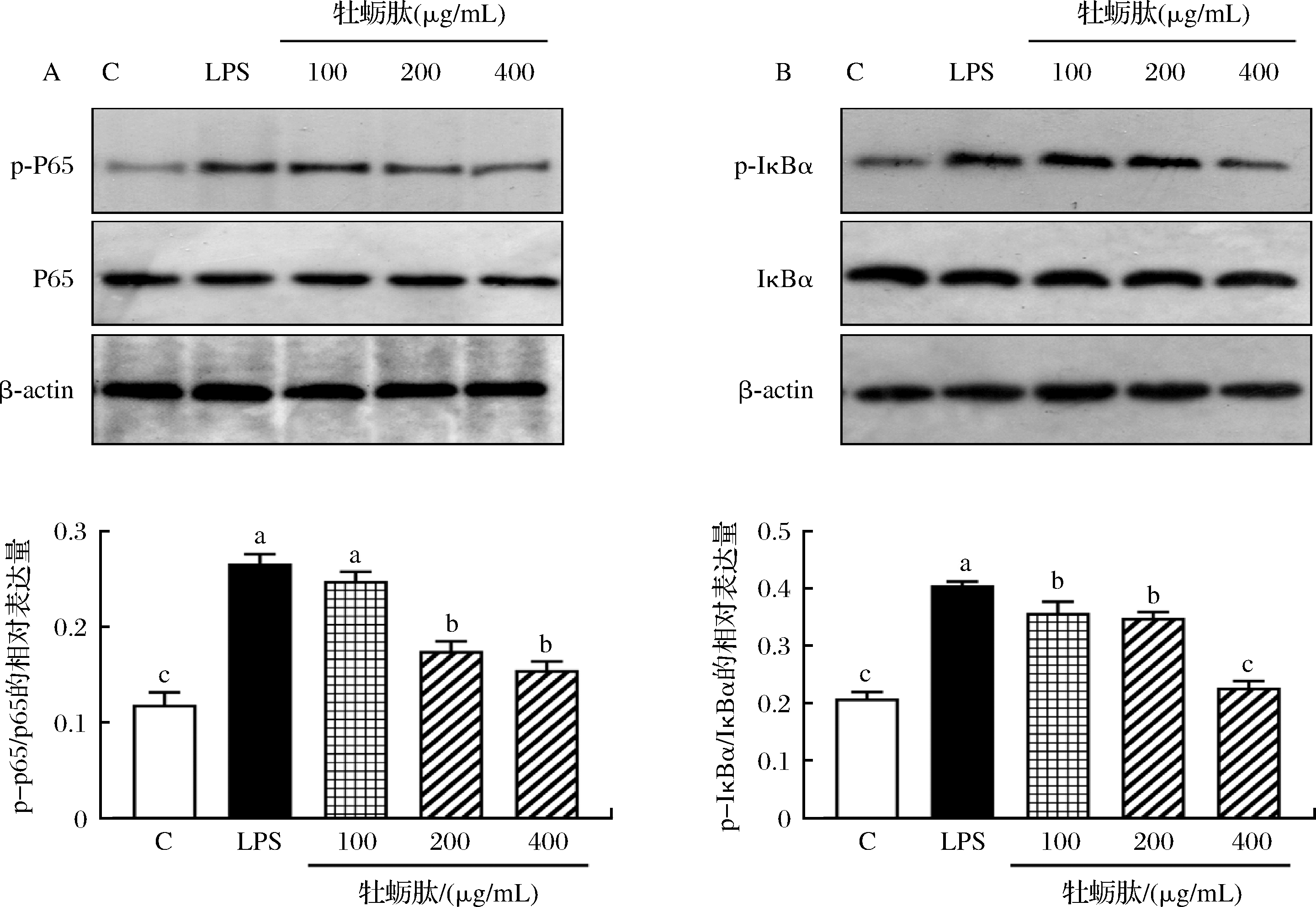
A-p-p65/p65的相对表达水平;B-p-IκBα/IκBα的相对表达水平
图6 不同质量浓度牡蛎肽对RAW264.7细胞NF-κB信号通路蛋白表达水平的影响
Fig.6 Effects of different concentrations of OP on protein expression levels of NF-κB signaling pathway in RAW264.7 cells
3 讨论
巨噬细胞在许多疾病中发挥重要作用,也是机体先天免疫应答的主要参与者。巨噬细胞可以有效抵御细菌及病毒的感染,在自身免疫性疾病、细菌感染和炎症反应中起着决定性的关键作用[19]。病原微生物侵入机体时,通过识别抗原表面的受体来激活自身,并分泌促炎因子和抗炎因子来清除病原体,控制疾病进程[20]。在本试验中,CCK8试验和中性红试验结果显示,牡蛎肽质量浓度为100~900 μg/mL时,对RAW264.7巨噬细胞的增殖率没有显著影响,并且可以提高巨噬细胞的吞噬能力。猴头菇多糖在质量浓度为100~1 000 μg/mL时,也可以显著增强RAW264.7细胞吞噬作用[21]。在体外试验中,通常使用特定浓度LPS建立炎症巨噬细胞模型。LPS可以通过TLR4途径促使巨噬细胞活化,并刺激巨噬细胞分泌各种炎症因子和炎症介质[22]。NO是巨噬细胞分泌的主要炎症介质之一,也是细胞毒性效应物。NO可以参与调控哺乳动物细胞的各项功能,主要通过1-精氨酸催化后由iNOS合成。NO不仅参与巨噬细胞杀伤外来病毒以及寄生虫等过程,而且还参与细胞因子分泌的调节,特别是与炎症相关的细胞因子,是巨噬细胞发挥其免疫功效的前提条件[23]。因此,NO的分泌水平是观察巨噬细胞免疫活性的常见指标。
巨噬细胞根据其功能特点和诱导的Th1或Th2免疫反应类型可分为M1和M2型。其中,TNF-α和IL-1β是M1型巨噬细胞的标志性细胞因子,可直接杀伤肿瘤细胞。IL-6和IL-10是M2型巨噬细胞的标志性细胞因子。炎症因子如TNF-α、IL-6、IL-10是调节免疫应答的主要细胞因子,这些细胞因子的表达和调控是相互作用、相互协调的[24]。TNF-α是非常典型的促炎细胞因子,通过刺激中性粒细胞和巨噬细胞从而直接介导机体炎症反应,并可促进其他炎症因子的分泌,有助于刺激机体的正常免疫功能,抵抗感染[25]。然而,TNF-α的过量产生会对机体产生负面影响,造成不同程度的损伤。IL-6不仅起促炎作用,还具有一定的抗炎作用[25]。IL-10在体内主要起抗炎作用,控制炎症反应程度[26]。本研究中,LPS处理RAW264.7细胞后,OP干预显著降低了NO、IL-6、TNF-α和IL-10的分泌水平。同时,随着OP剂量的增加(100、200、400 μg/mL),RAW264.7细胞分泌产生的NO以及炎症因子IL-6、TNF-α和IL-10含量逐渐下降,提示OP有助于缓解LPS刺激RAW264.7细胞所引起的炎症反应,其效果呈剂量依赖性。此外,在分子水平上检测到的细胞因子mRNA表达水平与ELISA结果一致,进一步证明OP通过调节炎性基因表达来调控相应细胞因子的分泌水平,从而对LPS刺激的RAW264.7细胞发挥一定的保护作用。
HWANG等[27]发现牡蛎水解到的牡蛎肽可能通过NF-κB通路对由LPS诱导的RAW264.7细胞炎症有抗炎作用。LI等[28]发现青蛤蛋白肽通过激活NF-κB通来增强RAW 264.7细胞巨噬细胞吞噬功能。为进一步探讨牡蛎肽对RAW264.7细胞的免疫调节机制,研究采用蛋白免疫印迹法检测NF-κB信号通路主要蛋白的表达情况。研究表明,TLR4能够识别外来入侵物质,并通过下游信号分子MyD88转导胞内信号,MyD88通过激活NF-κB信号通路,在宿主先天免疫应答中释放TNF-α、IL-1β等细胞因子[29]。NF-κB信号通路是调节肠道上皮细胞生物学、黏膜炎症和感染的重要转录系统,是调节促炎酶和细胞因子基因表达的重要转录调控因子[30]。它可以介导参与细胞代谢和免疫应答的特定基因的表达,调控NF-κB的表达活化也是治疗多种炎症相关疾病的有效方法。NF-κB的活化途径最终是通过降解磷酸化IκBα蛋白,并解除NF-κB的抑制状态来完成的。在细胞受到外界各种因素(如LPS和细胞因子)刺激后,IκBα激酶在激活后参与p65的磷酸化反应,并激活NF-κB信号通路[31]。随后,IL-6、TNF-α和IL-10等与免疫应答相关的基因得到表达。本研究结果表明,采用高剂量OP处理不仅显著降低了RAW264.7细胞中p-p65/p65比值,而且降低了p-IκBα/IκBα比值。OP通过调控NF-κB信号通路,降低RAW264.7细胞的炎症反应,具体表现在抑制TNF-α、IL-6和IL-10的分泌,以及TNF-α、IL-6和IL-10的下游mRNA表达。本实验结论与HWANG等[27]之前报道的牡蛎肽可以缓解RAW264.7细胞炎症的结果一致。
综上所述,牡蛎活性肽可以提高RAW264.7巨噬细胞的吞噬能力,并提高了巨噬细胞NO、TNF-α、IL-6、IL-1β以及IL-10分泌水平以及相应的mRNA表达量。提示OP可恢复巨噬细胞Th1/Th2免疫平衡,起到一定的免疫保护作用,并且其影响机制可能与NF-κB信号通路的激活有关。
[1] DING X A, LI J A, HOU Y L, et al.Comparative analysis of macrophage transcriptomes reveals a key mechanism of the immunomodulatory activity of Tricholoma matsutake polysaccharide[J].Oncology Reports, 2016, 36(1):503-513.
[2] YU Q, NIE S P, LI W J, et al.Macrophage immunomodulatory activity of a purified polysaccharide isolated from Ganoderma atrum[J].Phytotherapy Research, 2013, 27(2):186-191.
[3] VAN LEEUWEN L P M, GEURTSVANKESSEL C H, ELLERBROEK P M, et al.Immunogenicity of the mRNA-1273 COVID-19 vaccine in adult patients with inborn errors of immunity[J].The Journal of Allergy and Clinical Immunology, 2022, 149(6):1949-1957.
[4] MARQUANT Q, LAUBRETON D, DRAJAC C, et al.The microbiota plays a critical role in the reactivity of lung immune components to innate ligands[J].The FASEB Journal, 2021, 35(4):e21348.
[5] XUE H Y, HAN J J, HE B Y, et al.Bioactive peptide release and the absorption tracking of casein in the gastrointestinal digestion of rats[J].Food &Function, 2021, 12(11):5157-5170.
[6] NIRMAL N P, SANTIVARANGKNA C, RAJPUT M S, et al.Valorization of fish byproducts:Sources to end-product applications of bioactive protein hydrolysate[J].Comprehensive reviews in Food Science and Food Safety, 2022, 21(2):1803-1842.
[7] HUANG F F, ZHAO S S, YU F M, et al.Protective effects and mechanism of Meretrix meretrix oligopeptides against nonalcoholic fatty liver disease[J].Marine Drugs, 2017, 15(2):31.
[8] 阮晓慧, 韩军岐, 张润光, 等.食源性生物活性肽制备工艺、功能特性及应用研究进展[J].食品与发酵工业, 2016, 42(6):248-253.
RUAN X H, HAN J Q, ZHANG R G, et al.Progress in preparation, functional properties and application of food-derived bioactive peptides[J].Food and Fermentation Industries, 2016, 42(6):248-253.
[9] XIANG X W, ZHENG H Z, WANG R, et al.Ameliorative effects of peptides derived from oyster (Crassostrea gigas) on immunomodulatory function and gut microbiota structure in cyclophosphamide-treated mice[J].Marine Drugs, 2021, 19(8):456.
[10] 董晓伟, 姜国良, 李立德, 等.牡蛎综合利用的研究进展[J].海洋科学, 2004, 28(4):62-65.
DONG X W, JIANG G L, LI L D, et al.Research progress on comprehensive utilization of oyster[J].Marine Science, 2004, 28(4):62-65.
[11] 郭玉华, 曾名勇, 刘尊英, 等.牡蛎食品的研究进展[J].食品与发酵工业, 2007, 33(3):91-95.
GUO Y H, ZENG M Y, LIU Z Y, et al.Research progress on oyster food[J].Food and Fermentation Industry, 2007, 33(3):91-95.
[12] UMAYAPARVATHI S, MEENAKSHI S, VIMALRAJ V, et al.Antioxidant activity and anticancer effect of bioactive peptide from enzymatic hydrolysate of oyster (Saccostrea cucullata)[J].Biomedicine &Preventive Nutrition, 2014, 4(3):343-353.
[13] 方磊, 李国明, 徐珊珊, 等.牡蛎肽和三文鱼皮胶原肽低致敏性和抗过敏活性研究[J].食品与发酵工业, 2018, 44(9):91-97.
FANG L, LI G M, XU S S, et al.Studies on the hypoallergenic and antiallergenic activities of oyster peptides and salmon skin collagen peptides[J].Food and Fermentation Industries, 2018, 44(9):91-97.
[14] ALDAIRI A F, OGUNDIPE O D, PYE D A, et al.Antiproliferative activity of glycosaminoglycan-like polysaccharides derived from marine molluscs[J].Marine Drugs, 2018, 16(2):63.
[15] WANG X Q, YU H H, XING R E, et al.Hepatoprotective effect of Oyster peptide on alcohol-induced liver disease in mice[J].International Journal of Molecular Sciences, 2022, 23(15):8081.
[16] 俞萍, 张晓光, 陈学礼, 等.人参牡蛎复合肽固体饮料的配方研究[J].食品与发酵工业, 2022, 48(5):193-199.
YU P,ZHANG X G, CHEN X L, et al.Formulation of ginseng and oyster compound peptide solid beverage[J].Food and Fermentation Industries, 2022, 48(5):193-199.
[17] SIREGAR A S, NYIRAMANA M M, KIM E J, et al.Oyster-derived Tyr-Ala (YA) peptide prevents lipopolysaccharide/D-galactosamine-induced acute liver by suppressing inflammatory, apoptotic, ferroptotic, and pyroptotic signals[J].Marine Drugs, 2021, 19(11):614.
[18] 方磊, 张瑞雪, 陈亮, 等.牡蛎肽对TM3细胞性功能的影响[J].中国食品学报, 2021, 21(5):140-147.
FANG L, ZHANG R X, CHEN L, et al.Effects of oyster peptides on the sexual function of TM3 cells[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(5):140-147.
[19] 耿华, 袁小林. 巨噬细胞的研究进展[J]. 国际免疫学杂志, 2013, 36(6): 450-454.
GENG H, YUAN X L, et al. Advances in the study of macrophages[J]. International Journal of Immunology,2013, 36(6): 450-454.
[20] WANG T T, HE C Q, et al. TNF-α and IL-6: The link between immune and bone system[J]. Current Drug Targets-The International Journal for Timely in-depth Reviews on Drug Targets, 2020, 21(3): 213-227.
[21] 谌淑平, 李明智, 董楠, 等. 不同食用菌多糖复配物对RAW264.7巨噬细胞的免疫调节作用[J]. 食品工业科技, 2021, 42(17): 366-372.
CHEN S P, LI M Z, DONG N, et al. Immunomodulatory effects of polysaccharides from different edible fungi on RAW264.7 macrophages[J]. Science and Technology of Food Industry, 2021, 42(17): 366-372.
[22] GAO R C, SHU W H, SHEN Y, et al. Peptide fraction from sturgeon muscle by pepsin hydrolysis exerts anti-inflammatory effects in LPS-stimulated RAW264.7 macrophages via MAPK and NF-κB pathways[J]. Food Science and Human Wellness, 2021, 10(1): 103-111.
[23] ABUBAKAR S D, LHIM S A, FARSHCHI A, et al. The role of TNF-α and anti-TNF-α agents in the immunopathogenesis and management of immune dysregulation in primary immunodeficiency diseases[J]. Immunopharmacology and Immunotoxicology, 2022, 44(2): 147-156.
[24] AJA-PEREZ I, STÉPHANIE K, HORNEDO-ORTEGA R, et al. Stilbenes at low micromolar concentrations mitigate the NO, TNF-α, IL-1β and ROS production in LPS-stimulated murine macrophages[J]. Journal of Biologically Active Products from Nature, 2021, 11(3): 212-222.
[25] 叶盛旺, 杨最素, 李维, 等. 青蛤酶解多肽对RAW264.7巨噬细胞的免疫调节作用[J]. 食品科学, 2019,40(7):185-191.
YE S W, YANG Z S, LI W, et al. Immunomodulatory effects of peptides hydrolyzed from cyclina sinensis on RAW264.7 macrophages [J]. Food Science, 2019, 40(7): 185-191.
[26] CHAI Y S, CHEN Y Q, LIN S H, et al. Curcumin regulates the differentiation of naïve CD4+T cells and activates IL-10 immune modulation against acute lung injury in mice[J]. Biomedicine &Pharmacotherapy, 2020, 125: 109946.
[27] HWANG D, KANG M G, JO M J, et al. Anti-inflammatory activity of β-thymosin peptide derived from pacific Oyster (Crassostrea gigas) on NO and PGE2 production by down-regulating NF-κB in LPS-induced RAW264.7 macrophage Cells[J]. Marine Drugs, 2019, 17(2): 129.
[28] LI W, YE S W, ZHANG Z W, et al. Purification and characterization of a novel pentadecapeptide from protein hydrolysates of Cyclina sinensis and its immunomodulatory effects on RAW264.7 Cells[J]. Marine Drugs, 2019, 17(1): 30.
[29] GUO H K, LI M, LIU H M, et al. Selenium-rich yeast peptide fraction ameliorates imiquimod-induced psoriasis-like dermatitis in mice by inhibiting inflammation via MAPK and NF-κB signaling pathways[J]. International Journal of Molecular Sciences, 2022, 23(4): 2112-2112.
[30] YUE Y Y, LIU X C, LI Y, et al. The role of TLR4/MyD88/NF-κB pathway in periodontitis-induced liver inflammation of rats[J]. Oral diseases, 2021, 27(4): 1012-1021.
[31] YANG L Y, ZHENG W W, XIN S Y, et al. MicroRNA-122 regulates NF-κB signaling pathway by targeting IκBα in miiuy croaker, Miichthys miiuy[J]. Fish & Shellfish Immunology, 2022, 122: 345-351.