芽孢是细菌营养体在特殊条件下形成的休眠态,对食物有致腐败作用[1]。因此如何高效地杀灭芽孢是食品杀菌领域中的一个研究热点。
高压热杀菌处理(high-pressure thermal sterilization, HPTS)是一种新型杀菌技术,由超高压(400~900 MPa)和中温(50~90 ℃)协同处理,能更好地灭活芽孢[2]。溶菌酶作为食品添加剂,对各类食品中的微生物有抑制和灭活作用[3]。研究表明,超高压与溶菌酶具有协同杀菌作用[4]。且比热杀菌技术更好地保留了食品的营养和感官品质[5-6]。ARAS等[7]发现溶菌酶协同650 MPa、50 ℃处理对解淀粉和嗜热芽孢杀灭作用是显著的。
通过构建杀菌动力学模型,可以对杀菌效果进行预测,目前常用的杀菌动力学模型主要有一级动力学模型和Weibull模型[8]。RAMASWAMY等[9]在研究HPTS杀灭梭状杆菌芽孢时发现一级动力学模型能很好地拟合其灭活动力学曲线,郭全友等[10]在研究枯草杆菌芽孢在热、Nisin和ε-聚赖氨酸处理下的灭活动力学时,发现Weibull模型能很好拟合其失活过程,而线性模型难以描述其失活动力学。目前关于HPTS结合溶菌酶灭活枯草杆菌芽孢的动力学尚无研究报道。
芽孢内膜具有高度不通透性,是保护芽孢的一层关键结构[11],内膜的损伤和变化是引起芽孢死亡的主要原因[12-13]。当内膜受损时,细胞的内容物会泄漏到膜外,如一些大分子核酸和蛋白。通常用OD600值来表征芽孢内容物释放量[14],用OD260值和OD280值分别表征核酸与蛋白物泄漏情况[15]。探讨芽孢灭活量与芽孢悬浮液OD600、OD260、OD280值之间的相关性可用于快速估计杀菌效果[16],但目前尚无相关研究报道。
本文研究了HPTS结合溶菌酶对枯草杆菌芽孢的灭活动力学并探讨了芽孢灭活量与芽孢悬浮液OD600、OD260、OD280值之间的相关性,可为HPTS结合溶菌酶在食品杀菌技术中的应用提供参考。
1 材料与方法
1.1 实验材料
枯草芽孢杆菌(Bacillus subtilis),中国普通微生物菌种保藏管理中心;营养琼脂,广东环凯微生物科技有限公司;硫酸锰,江苏源之源生物科技有限公司;溶菌酶,北京索莱宝科技有限公司;TSA-YE培养基,上海研生生化试剂有限公司。
1.2 仪器与设备
BXM-30R型高压灭菌锅,上海博迅医疗生物仪器股份有限公司;TGL-10B型离心机,上海安亭科学仪器厂;754PC紫外可见分光光度计,西安华辰乐天实验室设备有限公司;DZ-500/2G型落地式真空包装机,西安星火包装机械有限公司;LRH-250型生化培养箱,青岛明博环保科技有限公司;UV-9000S型双光束紫外可见分光光度计,上海元析仪器有限公司;超高压设备,包头科发高压科技有限公司。
1.3 实验方法
1.3.1 枯草杆菌芽孢悬浮液的制备
参考刘月[17]的方法并稍加改进来制备枯草杆菌的菌悬液。将活化3代的枯草杆菌芽孢划线接种至斜面培养,37 ℃培养7 d,用无菌水洗涤芽孢并收集于离心管中,在4 ℃、9 000 r/min、15 min的条件下洗涤芽孢3次,将其浓度调整为约1.5×109 CFU/mL,4 ℃保存。使用前调节芽孢悬浮液浓度为1.5×108 CFU/mL。
1.3.2 HPTS结合溶菌酶处理
将一定量的枯草杆菌芽孢悬浮液加入到离心管中,离心15 min(4 ℃、9 000 r/min),弃去上清液,加入配制好的同等体积溶菌酶溶液(质量分数0.05%、0.10%、0.30%),充分振荡接触。用无菌聚乙烯真空袋将处理后的芽孢悬浮液真空包装,放入超高压加压釜中。设定压力为600 MPa,处理温度为65、75 ℃,保压时间分别为5、10、15、20、25 min。考虑到升压时每100 MPa水的升温约3 ℃,在进行600 MPa-65 ℃、600 MPa-75 ℃处理前,对高压处理腔内水的温度进行预调控,600 MPa-65 ℃处理前用水浴夹套将腔内水预热到50 ℃左右,600 MPa-75 ℃处理前用水浴夹套将腔内水预热到60 ℃左右;然后进行升压处理,升压到600 MPa,此时实际处理温度在64~66 ℃、74~76 ℃;在保压过程中高压处理腔外的恒温水浴夹套仍进行工作,以使得高压处理腔内的温度维持在一个较稳定的水平。采用计算机控制压力、时间和温度。在加压过程中,K型热电偶测量高压处理腔中水的温度。卸压后冷却,随即放入4 ℃冰箱保存。
1.3.3 平板计数
参照MENG等[18]的方法进行平板计数。将处理前后的菌悬液梯度稀释,并将1 mL的稀释菌液和15~20 mL的TSA-YE注入培养皿中,37 ℃下恒温培养48 h,对存活的芽孢进行计数。计数时,取3个相同稀释度的平均值。
1.3.4 动力学模型及模型拟合度比较
本实验所用HPTS设备升压到600 MPa约需3 min,为排除升压过程对实验结果的干扰。我们首先做了升压到600 MPa后立即泄压的实验,测定升压过程对样品的菌落总数、OD600、OD260和OD280值的影响,后续实验结果均先减除了升压过程的影响,然后进行动力学模型拟合和相关性分析。
1.3.4.1 一级动力学模型
该模型表示芽孢的灭活量和处理时间的变化是一种线性关系[19],其表达式如公式(1)所示:
(1)
式中:N0,初始芽孢的数量,CFU/mL;Nt,处理t时间后芽孢的存活数量,CFU/mL;D,灭活90%的芽孢所需的时间,min;t,处理时间,min。
1.3.4.2 Weibull一级动力学模型
Weibull模型是一种用于描述各种线性和凹凸型曲线的非线性模型[20]。其表达式如公式(2)所示:
(2)
式中:N0,初始芽孢菌落数量;Nt,时间t时芽孢的菌落数量;b,比例因子;n,形状系数;t,时间。
1.3.4.3 动力学模型拟合度比较
用决定系数R2、准确因子Af、偏差因子Bf、均方根误差(root mean square error, RMSE)等相关评估指标对模型拟合度进行评估。R2为实测值与预测值进行线性拟合得到的回归系数。其中,精确因子Af为实测值与预测值之间的一致性,偏差因子Bf代表实测值与预期值偏差的程度,RMSE描述模型的可靠程度。研究表明,决定系数R2越大,RMSE越小,Af越小且Bf越接近1,模型的拟合度愈好[21-22];公式(3)~公式(5)为Af、Bf、RMSE的计算方法:
(3)
(4)
(5)
式中:n为试验次数。
1.3.5 OD600值的测定
将芽孢悬浮液振荡均匀,在600 nm波长处测定处理前后枯草杆菌芽孢悬浮液的吸光度[23]。
1.3.6 紫外吸收物质泄漏量的测定
将处理前后的芽孢悬浮液于4 ℃、9 000 r/min离心15 min,上清液为工作液,以无菌水为空白对照测定260 nm波长(核酸)和280 nm波长(蛋白质)处的吸光度[24]。
1.4 数据处理与分析
用均值±标准误差表示实验结果。采用SPSS 26.0软件进行方差分析,P<0.05为显著差异的标准。采用Origin 2019.0软件进行统计分析并作图。所有实验至少重复3次。
2 结果与分析
2.1 HPTS结合溶菌酶灭活枯草杆菌芽孢效果分析
图1为不同条件下的HPTS结合溶菌酶对枯草杆菌芽孢灭活效果的关系曲线。由图1可知,在600 MPa-65 ℃下,处理时间为5、10、15、20、25 min时,枯草杆菌芽孢的灭活量分别为1.06、2.17、2.90、3.28、3.43 lg CFU/mL,保持温压不变,600 MPa-65 ℃-25 min相较于600 MPa-65 ℃-5 min芽孢灭活量高2.37 lg CFU/mL。当保压时间为25 min时,在600 MPa-75 ℃下,芽孢的灭活量为5.14 lg CFU/mL,比600 MPa-65 ℃高1.71 lg CFU/mL,表明在一定的压力和保压时间下,温度升高能促进芽孢失活。在600 MPa-65 ℃-0.05%溶菌酶处理5~25 min后,枯草杆菌芽孢的灭活量分别为1.28、2.38、2.91、3.68、3.96 lg CFU/mL,在相同温压和处理时间下,经过0.30%溶菌酶处理后,其灭活量分别增加至1.67、3.06、4.11、4.44、4.83 lg CFU/mL,表明提高溶菌酶的浓度,进一步增强对枯草杆菌芽孢的灭活作用。在600 MPa-75 ℃-0.30%溶菌酶处理5~25 min后,枯草杆菌芽孢的灭活量分别增加至2.44、4.41、5.68、6.09、6.36 lg CFU/mL,相较于600 MPa-65 ℃-0.30%溶菌酶处理芽孢的灭活量分别提高了0.77、1.35、1.57、1.65、1.53 lg CFU/mL。总体上,灭活曲线呈现由快到慢的降低速率,表明芽孢的灭活率随保压时间的增加而降低,芽孢灭活曲线出现拖尾现象,研究发现拖尾现象可能是由于部分芽孢具有极强的抗性[25-26]。
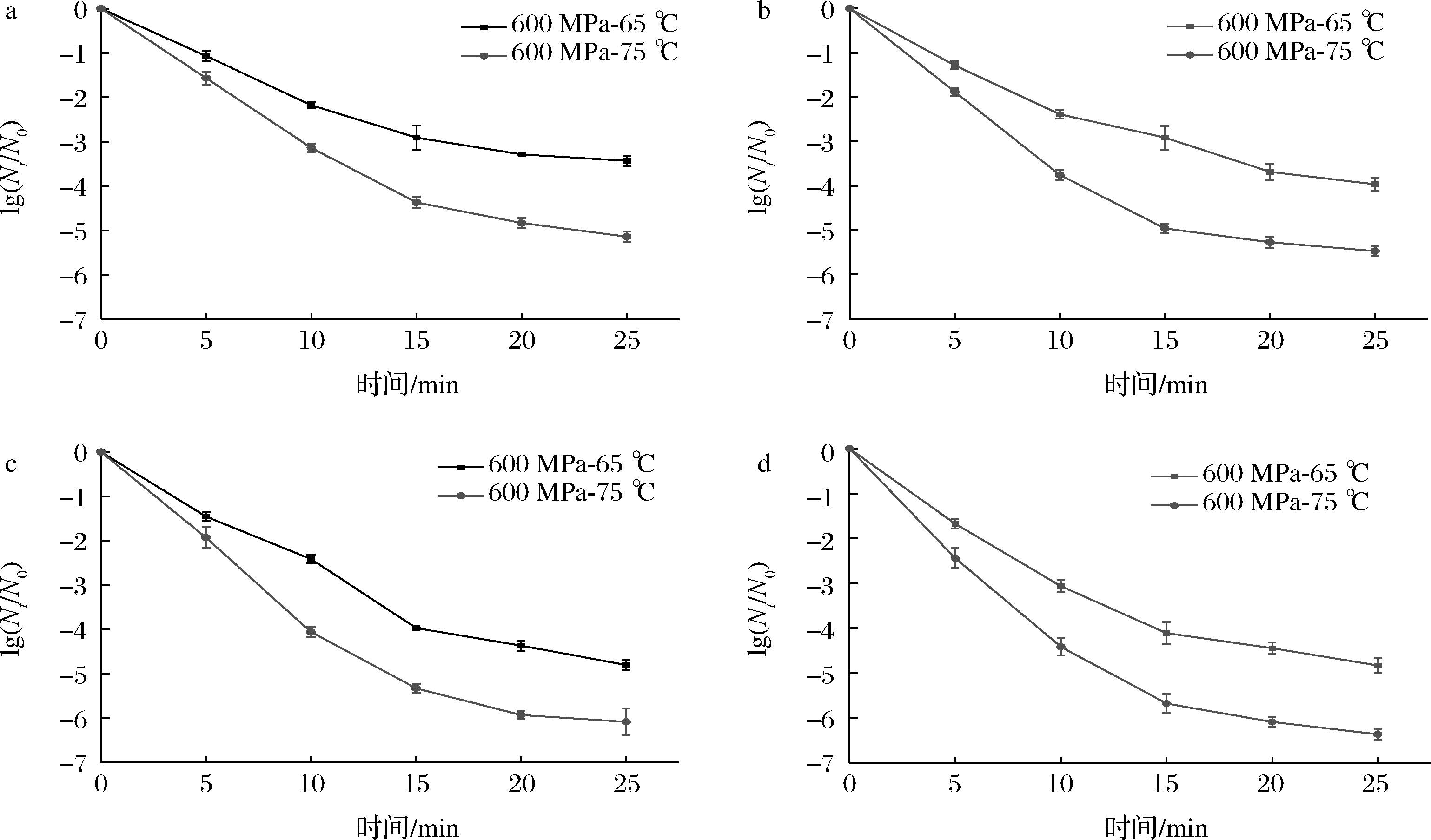
a-未添加溶菌酶;b-0.05%溶菌酶;c-0.10%溶菌酶;d-0.30%溶菌酶
图1 不同条件下HPTS结合溶菌酶对枯草杆菌芽孢的灭活效果
Fig.1 Inactivation effect of HPTS combining with lysozyme on Bacillus subtilis spores under different conditions
2.2 动力学模型拟合度分析
一级动力学模型与Weibull模型的模型参数和模型评价参数如表1、表2所示。用决定系数R2、准确因子Af、偏差因子Bf、RMSE等相关评估指标对模型拟合度进行评价[27]。
表1 不同处理条件下一级动力学、Weibull模型的模型参数
Table 1 Model parameters of the-first order kinetic and Weibull models under various treatment conditions

压力/MPa溶菌酶质量分数/%温度/℃一级动力学型Weibull模型Dbn60000.050.100.30656.1860.4960.620754.1670.7030.635655.5710.5030.651753.7810.9850.554654.6090.5140.708753.4300.9680.593654.4270.7760.581753.2521.2690.519
表2 一级动力学模型和Weibull模型评价参数
Table 2 The-first order kinetic model and Weibull model evaluation parameters
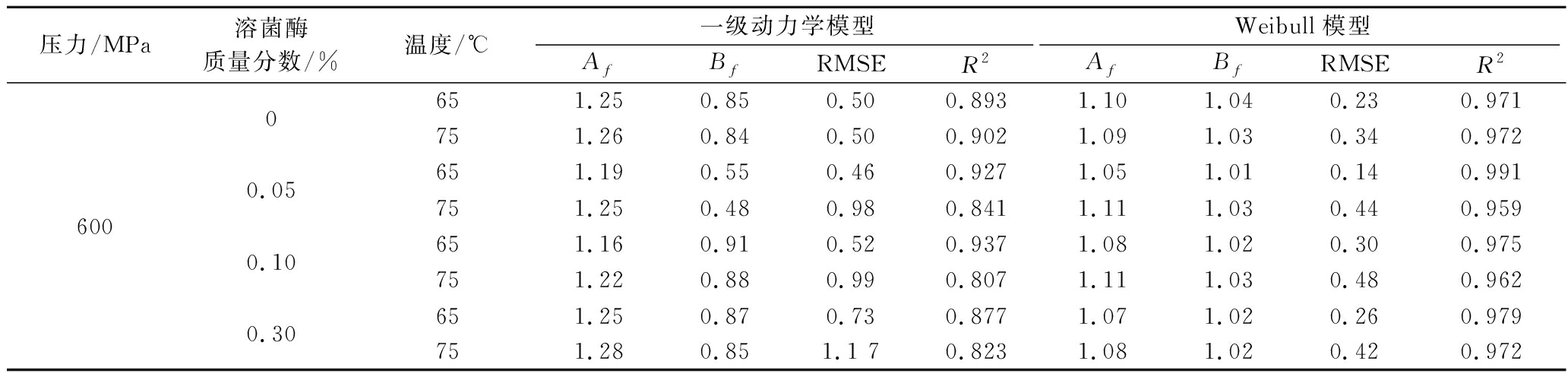
压力/MPa溶菌酶质量分数/%温度/℃一级动力学模型Weibull模型AfBfRMSER2AfBfRMSER260000.050.100.30651.250.850.500.8931.101.040.230.971751.260.840.500.9021.091.030.340.972651.190.550.460.9271.051.010.140.991751.250.480.980.8411.111.030.440.959651.160.910.520.9371.081.020.300.975751.220.880.990.8071.111.030.480.962651.250.870.730.8771.071.020.260.979751.280.851.1 70.8231.081.020.420.972
在本研究中,一级动力学模型的平均决定系数R2=0.875,Af为1.16~1.28,Bf为0.48~0.91,RMSE为0.46~1.17;Weibull模型的平均决定系数R2=0.972,Af为1.05~1.11,Bf为1.02~1.04,RMSE为0.14~0.48。与一级动力学模型相比,Weibull模型的RMSE更小,Af更小,Bf和R2更接近1,Weibull模型对于HPTS结合溶菌酶处理下枯草杆菌芽孢的灭活情况的拟合更可靠。WANG等[28]研究表明Weibull模型对70、80 ℃的温度协同400~600 MPa处理下凝结芽孢杆菌芽孢灭活曲线的拟合效果更佳。COLLADO等[29]在研究高温对蜡样芽孢杆菌灭活动力学时也发现Weibull模型可较好描述灭活动力学过程。VAN BOEKEL[30]对55组微生物的热失活动力学模型进行了研究,结果发现仅有2条符合一级动力学模型,而大部分的存活曲线呈非线性的凹形,Weibull模型可用于拟合非线性灭活曲线。
2.3 模型的验证
实测值和预测值的一致性可用来衡量模型的可靠性,常用线性拟合得到的决定系数R2来表征。拟合方程的截距越靠近0,且斜率越接近1,实测值和预测值的一致性越高。如图2所示,Weibull模型的决定系数R2为0.964,截距为-0.215,斜率为0.945;一级动力学模型的决定系数R2为0.848,截距为0.742,斜率为1.10。Weibull模型对HPTS结合溶菌酶灭活枯草杆菌芽孢效果的动力学拟合效果更好。

a-一级动力学模型;b-Weibull模型
图2 一级动力学模型与Weibull模型预测值和实测值的相关性
Fig.2 Correlation between predicted and measured values of the-first order kinetic model and Weibull model
2.4 HPTS结合溶菌酶处理对芽孢悬浮液OD600值的影响
通过测定样品在600 nm处的吸光度来确定芽孢的内容物释放量。芽孢悬浮液的OD600值与其折光性相关,芽孢量释放量越大,其折射性越低,吸光度值越小[31-32]。图3为HPTS结合溶菌酶处理后枯草杆菌芽孢样品OD600值的变化情况。

a-600 MPa-65 ℃;b-600 MPa-75 ℃
图3 不同处理时间下HPTS结合溶菌酶处理后 OD600值的变化曲线
Fig.3 Change cures of OD600 treated by HPTS combining with lysozyme under different time conditions
如图3所示,15 min前的OD600值曲线比较陡,表明吸光度值快速下降,15 min后的吸光度值下降缓慢。在HPTS结合溶菌酶处理下,随着保压时间从5 min到25 min,OD600值均下降,表明延长保压时间可以促进芽孢内容物释放。当处理时间为25 min,600 MPa-65 ℃下OD600值为0.65,600 MPa-75 ℃下的OD600值为0.50,升高温度其OD600值变小,表明升高温度可以促进内容物释放。在600 MPa-75 ℃-25 min下,当溶菌酶质量分数为0.05%、0.10%、0.30%时,OD600值分别为0.44、0.40、0.38,表明随着溶菌酶浓度的增大,内容的物释放量也随之升高。
2.5 HPTS结合溶菌酶处理对紫外吸收物质泄漏的影响
细菌在经过灭菌后,往往细胞中的物质会泄漏,所以常以紫外线吸收物质的泄漏来反映细胞的损害程度。通过测定样品在260 nm/280 nm处的紫外吸收强度来确定芽孢的核酸、蛋白质泄漏量。图4为HPTS结合溶菌酶处理后枯草杆菌芽孢样品OD260值和OD280值的变化情况。
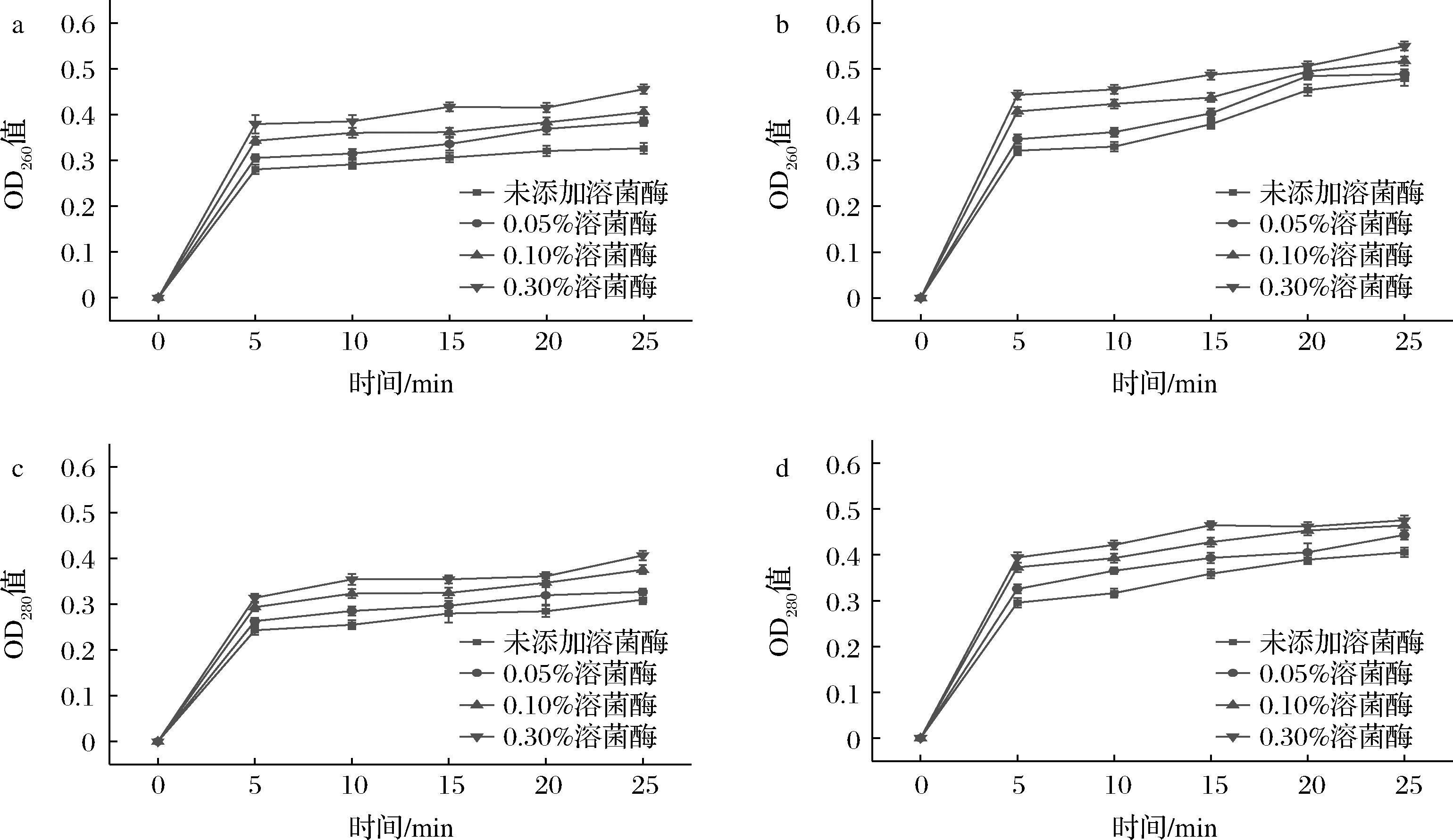
a-600 MPa-65 ℃ OD260值;b、d-600 MPa-75 ℃ OD260值;c-600 MPa-65 ℃ OD280值;d-600 MPa-75 ℃ OD280值
图4 不同处理时间下HPTS结合溶菌酶处理后OD260、OD280值的变化曲线
Fig.4 Change cures of OD260, OD280 treated by HPTS combining with lysozyme under different time conditions
如图4所示,在HPTS与溶菌酶协同作用下,枯草杆菌芽孢的OD260、OD280值均随保压时间的延长而升高,表明芽孢的紫外线吸收物质泄漏量有所增大。在600 MPa-75 ℃-25 min下,溶菌酶质量分数由0.05%升高至0.30%,OD260值分别为0.48、0.51、0.54,OD280值分别为0.44、0.46、0.47,表明在一定的保压时间下,紫外吸收物质的泄漏量随溶菌酶浓度的提高而增大。
2.6 相关性分析
如表3所示,芽孢灭活量与芽孢悬浮液OD600值之间呈极显著负相关(P<0.01),相关系数为-0.972,与核酸及蛋白泄漏量之间呈极显著正相关(P<0.01),相关系数分别为0.828、0.848,表明在芽孢灭活量增加的同时,OD600值降低,芽孢内容物释放量增加,且紫外吸收物质泄漏量随其灭活量的增加而增大。但芽孢悬浮液OD600值与芽孢灭活量之间的相关性更显著,可以更好地预测芽孢的灭活量。这是因为虽然核酸和蛋白质在260、280 nm波长处有最大的吸收峰,但是其他物质也可能在此处有吸收峰,从而产生干扰。另一方面溶菌酶本身也是蛋白质,在280 nm波长处也存在吸收峰,也会对结果产生干扰。以上原因使芽孢灭活量与OD260、OD280值相关性降低。
表3 芽孢灭活量与各指标的皮尔逊相关性分析结果
Table 3 Pearson correlation analysis results of Bacillus subtilis spore inactivation and each index

指标相关系数OD600值-0.972**OD260值0.828**OD280值0.848**
注:**表示在0.01级别(双尾),相关性极显著。
3 结论
HPTS结合溶菌酶能更好地灭活枯草杆菌芽孢。Weibull模型对杀菌曲线的动力学拟合效果优于一级动力学模型。Weibull模型的参数n值均小于1,失活曲线出现明显拖尾现象,芽孢杀菌抗性存在异质性,有小部分芽孢的杀菌抗性更强。随着杀菌处理时间的延长,芽孢悬浮液OD600、OD260、OD280值也不断变化,统计分析结果表明芽孢悬浮液OD600、OD260、OD280值与芽孢灭活量之间都呈极显著相关,但芽孢悬浮液OD600值与芽孢灭活量之间的相关性更显著,芽孢悬浮液OD600值简单易测,可快速准确地预测杀菌效果。本文可为HPTS结合溶菌酶在食品杀菌中的应用提供参考。
[1] LIU Y, ZHANG Z, CHEN L E, et al.High pressure thermal sterilization and ε-polylysine synergistically inactivate Bacillus subtilis spores by damaging the inner membrane[J].Journal of Food Protection, 2022, 85(3):390-397.
[2] FEKRAOUI F, FERRET É, PANIEL N, et al.Cycling versus continuous high pressure treatments at moderate temperatures:Effect on bacterial spores?[J].Innovative Food Science &Emerging Technologies, 2021, 74:102828.
[3] IRKIN R, ESMER O K.Novel food packaging systems with natural antimicrobial agents[J].Journal of Food Science and Technology, 2015, 52(10):6095-6111.
[4] NAKIMBUGWE D, MASSCHALCK B, ANIM G, et al.Inactivation of gram-negative bacteria in milk and banana juice by hen egg white and lambda lysozyme under high hydrostatic pressure[J].International Journal of Food Microbiology, 2006, 112(1):19-25.
[5] SEVENICH R, MATHYS A.Continuous versus discontinuous ultra-high-pressure systems for food sterilization with focus on ultra-high-pressure homogenization and high-pressure thermal Sterilization:A review[J].Comprehensive Reviews in Food Science and Food Safety, 2018, 17(3):646-662.
[6] EVELYNE E, SILVA F V.Heat assisted HPP for the inactivation of bacteria, moulds and yeasts spores in foods:Log reductions and mathematical models[J].Trends in Food Science &Technology, 2019, 88(8):143-156.
[7] ARAS S, KABIR N, WADOOD S, et al.Synergistic Effects of nisin, lysozyme, lactic acid, and CitricidalTM for enhancing pressure-based inactivation of Bacillus amyloliquefaciens, Geobacillus stearothermophilus, and Bacillus atrophaeus endospores[J].Microorganisms, 2021.9(3):653.
[8] 王春芳. 超高压与温度的协同杀菌效应及其动力学研究[D].杭州:浙江大学, 2019.
WANG C F.Synergistic inactivation effect of high pressure and temperature and related kinetic studies[D].Hangzhou:Zhejiang University, 2019.
[9] RAMASWAMY H S, SHAO Y W, ZHU S M.High-pressure destruction kinetics of Clostridium sporogenes ATCC 11437 spores in milk at elevated quasi-isothermal conditions[J].Journal of Food Engineering, 2010, 96(2):249-257.
[10] 郭全友, 刘玲, 李保国, 等.Nisin、ε-聚赖氨酸和温度对枯草芽孢杆菌失活动力学的影响[J].食品与发酵工业, 2019, 45(11):58-64;70.
GUO Q Y, LIU L, LI B G, et al.Effects of nisin,ε-polylysine, and temperature on inactivation kinetics of Bacillus subtilis[J].Food and Fermentation Industries, 2019, 45(11):58-64;70.
[11] LOISON P, HOSNY N A, GERVAIS P, et al.Direct investigation of viscosity of an atypical inner membrane of Bacillus spores:A molecular rotor/FLIM study[J].Biochimica et Biophysica Acta:Biomembranes, 2013, 1828(11):2436-2443.
[12] INOKUCHI T, ARAI N.Relationship between water permeation and flip-flop motion in a bilayer membrane[J].Physical Chemistry Chemical Physics, 2018, 20(44):28155-28161.
[13] ALDRETE-TAPIA J A, TORRES J A.Enhancing the inactivation of bacterial spores during pressure-assisted thermal processing[J].Food Engineering Reviews, 2020, 13(3):431-441.
[14] TEHRI N, KUMAR N, RAGHU H V, et al.Biomarkers of bacterial spore germination[J].Annals of Microbiology, 2018, 68(9):513-523.
[15] 吕瑞玲. 超声波技术灭活蜡样芽胞杆菌芽胞机制研究[D].杭州:浙江大学, 2020.
LYU R L.Effect and mechanism of ultrasound in the inactivation of Bacillus cereus spores[D].Hangzhou:Zhejiang University, 2020.
[16] 刘玲, 郭全友, 李保国, 等.虾源枯草芽孢杆菌生长动力学与抑制效应评价[J].食品与发酵工业, 2019, 45(4):7-12.
LIU L, GUO Q Y, LI B G, et al.Growth kinetics and inhibitory factors of shrimp-originated Bacillus subtilis[J].Food and Fermentation Industries,2019, 45(4):7-12.
[17] 刘月. HPTS结合溶菌酶灭活枯草杆菌芽孢的作用研究[D].银川:宁夏大学, 2022.
LIU Y.Study on the combined effects of HPTS and lysozyme on the inactivation of Bacillus subtilis spores[D].Yinchuan:Ningxia University, 2022.
[18] MENG J, GONG Y, QIAN P, et al.Combined effects of ultra-high hydrostatic pressure and mild heat on the inactivation of Bacillus subtilis[J].LWT, 2016, 68:59-66.
[19] 高芳, 李兴民, 马鹏飞, 等.超高压协同温度处理对绿色魏斯氏菌的失活动力学[J].食品科学, 2018, 39(15):38-47.
GAO F, LI X M, MA P F, et al.Inactivation kinetics of Weissella viridescens under ultra-high pressure thermal sterilization treatment[J].Food Science, 2018, 39(15):38-47.
[20] 迟媛, 弓敏, 马艳秋, 等.超声协同次氯酸钠杀灭腐败菌效果与动力学研究[J].农业机械学报, 2020, 51(7):372-381.
CHI Y, GONG M, MA Y Q, et al.Bactericidal effect of three typical strains by ultrasonic combined with sodium hypochlorite[J].Transactions of the Chinese Society for Agricultural Machinery, 2020, 51(7):372-381.
[21] 刘雅夫, 符腾飞, 刘宸成, 等.低温等离子体对金黄色葡萄球菌和铜绿假单胞菌的杀菌效果及动力学特性[J].现代食品科技, 2021, 37(12):127-135.
LIU Y F, FU T F, LIU C C, et al.Bactericidal efficacy and kinetics of cold plasma against Staphylococcus aureus and Pseudomonas aeruginosa[J].Modern Food Science and Technology, 2021, 37(12):127-135.
[22] 周良付, 雷玉洁, 李宇坤, 等.多酚氧化酶的射频加热灭活效果及动力学分析[J].现代食品科技, 2016, 32(9):161-166.
ZHOU L F, LEI Y J, LI Y K, et al.Inactivation effect of radio frequency heating on polyphenol oxidase and the analysis of kinetics[J].Modern Food Science and Technology, 2016, 32(9):161-166.
[23] 陈乐, 章中, 郭家俊, 等.热结合Nisin处理对枯草杆菌芽孢的杀灭效果[J].农业工程学报, 2020, 36(20):320-325.
CHEN L, ZHANG Z, GUO J J, et al.Effects of heat combining with Nisin treatment on the sterilization of Bacillus subtilis spores[J].Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(20):320-325.
[24] 尚彬玲. 葡萄糖对HPTS杀灭枯草杆菌芽孢的作用效果研究[D].银川:宁夏大学, 2021.
SHANG B L.Study on the Effect of glucose on the killing of Bacillus subtilis spores treated by HPTS[D].Yinchuan:Ningxia University, 2021.
[25] CERF O.A review tailing of survival curves of bacterial spores[J].Journal of Applied Bacteriology, 1977, 42(1):1-19.
[26] TOLA Y B, RAMASWAMY H S.Combined effects of high pressure, moderate heat and pH on the inactivation kinetics of Bacillus licheniformis spores in carrot juice[J].Food Research International, 2014, 62:50-58.
[27] 钱静亚. 脉冲磁场对枯草芽孢杆菌的灭活作用及其机理研究[D].镇江:江苏大学, 2013.
QIAN J Y.Inactivation of Bacillus subtilis by pulsed magnetic field and its mechanisms[D].Zhenjiang:Jiangsu University, 2013.
[28] WANG B S, LI B S, ZENG Q X, et al.Inactivation kinetics and reduction of bacillus coagulans spore by the combination of high pressure and moderate heat[J].Journal of Food Process Engineering, 2009, 32(5):692-708.
[29] COLLADO J, FERN NDEZ A, RODRIGO M, et al.Kinetics of deactivation of Bacillus cereus spores[J].Food Microbiology, 2003, 20(5):545-548.
NDEZ A, RODRIGO M, et al.Kinetics of deactivation of Bacillus cereus spores[J].Food Microbiology, 2003, 20(5):545-548.
[30] VAN BOEKEL M A J S.On the use of the Weibull model to describe thermal inactivation of microbial vegetative cells[J].International Journal of Food Microbiology, 2002, 74(1-2):139-159.
[31] NGUYEN THI MINH H, DANTIGNY P, PERRIER-CORNET J M, et al.Germination and inactivation of Bacillus subtilis spores induced by moderate hydrostatic pressure[J].Biotechnology and Bioengineering, 2010, 107(5):876-883.
[32] FARKAS J, ANDR SSY E, SIMON A, et al.Effecte of pasteurizing levels of high hydrostatic pressure on Bacillus subtilis luxAB spores[J].Acta Alimentaria, 2003, 32(4):373-381.
SSY E, SIMON A, et al.Effecte of pasteurizing levels of high hydrostatic pressure on Bacillus subtilis luxAB spores[J].Acta Alimentaria, 2003, 32(4):373-381.