餐厨垃圾是指居民在日常生活和消费过程中产生的生活废弃物,是城市固体废弃物的主要组成。随着我国人民生活水平的提高和城市化进程的发展,餐厨垃圾约占全国垃圾的10%~60%[1]。餐厨垃圾具有成分复杂、有机物含量高、含水率高等特点,可以通过微生物将其降解并回收甲烷、氢气等能源[2]。此外,基于国内垃圾分类的普及以及国家“碳达峰,碳中和”目标要求,餐厨垃圾的资源化处理成为重要的处置途径[3]。厌氧发酵技术是一种被广泛使用的处理方式,可用于餐厨垃圾的处置以及生产高价值附加产品。
由于餐厨垃圾组成复杂,因此其对厌氧发酵体系的影响因素较多,如氨氮和挥发性脂肪酸抑制等[4-5]。随着研究的深入,更多厌氧发酵的其他影响因素被发现,近年来有学者研究了餐厨垃圾中的辣素对厌氧发酵的影响。DU等[6]研究发现辣椒素浓度的提高降低了餐厨垃圾厌氧产甲烷,这可能是因为辣椒素通过改变关键酶活性,降低细胞内NAD+/NADH比值使得细胞死亡,对水解、产酸和产甲烷有抑制作用。针对此类抑制效应,预处理方法可以缓解辣素的影响,提高复杂底物的降解率,从而提升甲烷产量。辣素可以分为多种具体成分,包含大蒜素、辣椒素和姜辣素等,其中姜辣素是生姜中所有辣味物质的总称,6-姜酚是姜辣素中的主要代表活性物质。但是目前对姜辣素在餐厨垃圾厌氧发酵产甲烷中的影响及其抑制解除的研究还较少。采用预处理方式解除姜辣素对餐厨垃圾厌氧消化的抑制非常必要。YUE等[7]采用过碳酸钠/紫外线产生的自由基降解辣椒素,提高脂质和餐厨垃圾厌氧发酵甲烷产量。史进程等[8]发现在25、60 ℃热处理条件下,可以改变6-姜酚浓度。本文选取热解、超声和光催化氧化3种预处理手段,这些方式具有可操作性强、技术成熟和效果好等优势。
本文以餐厨垃圾厌氧发酵为研究对象,研究了不同浓度的姜辣素对餐厨垃圾厌氧发酵的影响。对比分析了高温、超声和TiO2联合紫外光催化氧化3种预处理方法,研究了不同预处理方式解除姜辣素对餐厨垃圾厌氧发酵抑制的效果。
1 材料与方法
1.1 实验材料
餐厨垃圾中每1 kg餐厨垃圾分别有400 g大米、350 g卷心菜、200 g猪肉和50 g豆腐;所有食材煮熟后按照比例进行混合;厌氧颗粒污泥取自无锡市某食品厂的厌氧发酵池;接种污泥和底物的性质如表1所示。由于6-姜酚为姜辣素主要代表成分,本文选取6-姜酚为研究对象,6-姜酚(纯度96%),成都普瑞法科技有限公司。
表1 接种污泥和餐厨垃圾的主要特性
Table 1 Characterizations of the inoculated sludge and food waste
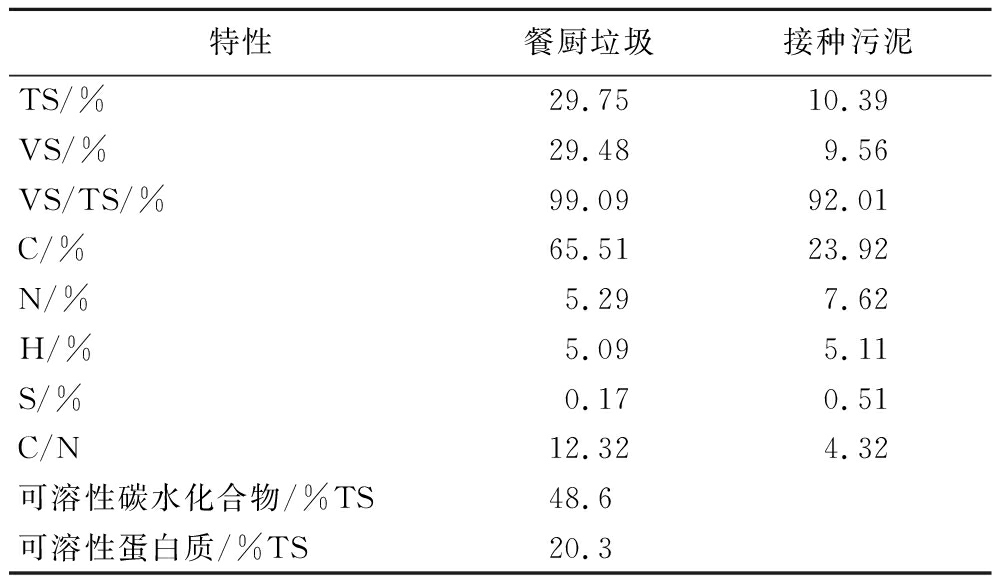
特性餐厨垃圾接种污泥TS/%29.7510.39VS/%29.489.56VS/TS/%99.0992.01C/%65.5123.92N/%5.297.62H/%5.095.11S/%0.170.51C/N12.324.32可溶性碳水化合物/%TS48.6可溶性蛋白质/%TS20.3
注:TS为总固体(total solid);VS为挥发性固体(volatile solid);C、H、N、S分别为元素碳、氢、氧、氮、硫;C/N为碳氮比。
1.2 实验设计
1.2.1 不同浓度姜辣素对餐厨垃圾厌氧发酵影响实验
实验在工作容积为400 mL的500 mL血清瓶中进行,反应温度为(37±0.5) ℃。实验开始前,利用葡萄糖驯化取自食品厂的厌氧污泥7 d,底物与接种污泥的比例为1∶1.5(VS比)[9]。每个反应瓶中加入8 g VS餐厨垃圾和12 g VS接种污泥,每1 g总VS餐厨垃圾中加入不同量的6-姜辣素(4、8、12、16、20 mg),实验组分别标记为B1、B2、B3、B4、B5。不添加6-姜辣素的试验作为空白组,标记为CK。采用NaHCO3和3 mol/L氢氧化钠或盐酸溶液将各组的初始pH值调节为8.0。
1.2.2 不同预处理条件下餐厨垃圾厌氧发酵产甲烷实验
实验中污泥的驯化和接种比同1.2.1节。由1.2.1节的实验结果发现B4组浓度有显著的抑制影响,根据B4组的比例浓度,每个反应瓶中加入6 g VS餐厨垃圾、9 g VS接种污泥和16 mg/g总挥发性固体姜辣素进行解抑制实验。上述物质混合后分别在60 ℃下处理1 h[8]、超声功率为20 000 Hz下处理1 h[10]、1.25 g/L TiO2和紫外灯联合处理1 h[11],这3种预处理的反应瓶分别标记为A1、A2、A3,其中对照组标记为K1。在反应开始前,用NaHCO3和3 mol/L的氢氧化钠或盐酸溶液调节反应体系的初始pH值为8.0。
1.3 实验分析方法
TS、VS采用重量法测定,溶解性化学需氧量(soluble chemical oxygen demand, SCOD)测定根据《国家水和废水监测分析方法》[12]。C、N、H、S、O采用元素分析仪测定,pH采用pH计测定。挥发性脂肪酸(total volatile fatty acid, TVFAs)浓度采用气相色谱仪(日本岛津GC-2010 PLUS)测定。甲烷产量采用AMPTS测定[13]。蛋白质利用凯式定氮法[14]测定,可溶性碳水化合物采用苯酚-硫酸法测定[15]。根据试剂盒方法测定乙酸激酶(acetokinase,ACK),碱性蛋白酶(alkaline protease,AKP),脱氢酶(dehydrogenase,DHA)活性,通过分光光度法测定辅酶F420活性[16]。反应结束后的污泥胞外聚合物(extracellular polymeric substances, EPS)采用ZHANG等[17]的方法进行提取,利用荧光分光光度计对松散型EPS(loosely bound EPS, LB-EPS)和紧密型EPS(tightly bound EPS, TB-EPS)进行激发-发射矩阵(excitation-emission matrix,EEM)光谱分析。扫描速度为12 000 nm/min,电压为500 V。激发波长(excitation wavelength,Ex)为200~450 nm,发射波长(emission wavelength,Em)为250~550 nm,Ex和Em的狭缝和采样间隔设置为5 nm,仪器的光谱校正被设定为自动校正。
1.4 微生物群落分析
取1.2.2节反应结束后各组的污泥放入不同离心管中,以4 000 r/min的速度旋转5 min。丢弃上清液,剩余的沉淀物保存在无菌离心管中,并保存在干冰上,送到测序公司进行分析。利用特异性引物扩增细菌16S rRNA基因在V3~V4区。细菌的引物为806R(5′-GGACTACHVGGGTWTCTAAT-3′) 和338F(5′- ACTCCTACGGGAGGCAGCAG-3′)。古菌引物为MLfF(5′-GGTGGTGTMGGATTCACACARTAYGCWAC AGC-3′)和MLrR(5′-TTCATTGCRTAGTTWGGRTAG TT-3′),提取样品基因组后,测定DNA的产率和纯度,PCR扩增后对产物进行纯化,利用IlluminaMiseq进行高通量测序。
2 结果与分析
2.1 不同预处理方式对甲烷产量变化的影响
如图1-a所示,在不同姜辣素添加情况下,餐厨垃圾厌氧发酵产气量各有不同。反应初期各组产气量增加,空白组在第20天以后产气趋于平缓,但是实验组在第30天后累积产气量仍然增加。这说明添加姜辣素后,微生物需要一定的时间适应环境体系。当姜辣素浓度提高到8 mg/g VS时,餐厨垃圾的最大产甲烷量为578.00 mL/g VS。但是当姜辣素浓度提高到16 mg/g VS时,餐厨垃圾的厌氧发酵受到严重抑制,最终累积甲烷产量仅为164.76 mL/g VS,是空白组的34%。最终的累积产气量从大到小分别为B2>B1>B3>CK>B4>B5。这表明一定浓度的姜辣素会抑制产甲烷过程,可能是因为姜辣素的加入会影响微生物的群落组成,降低物质传输速率,从而降低甲烷产量[6]。
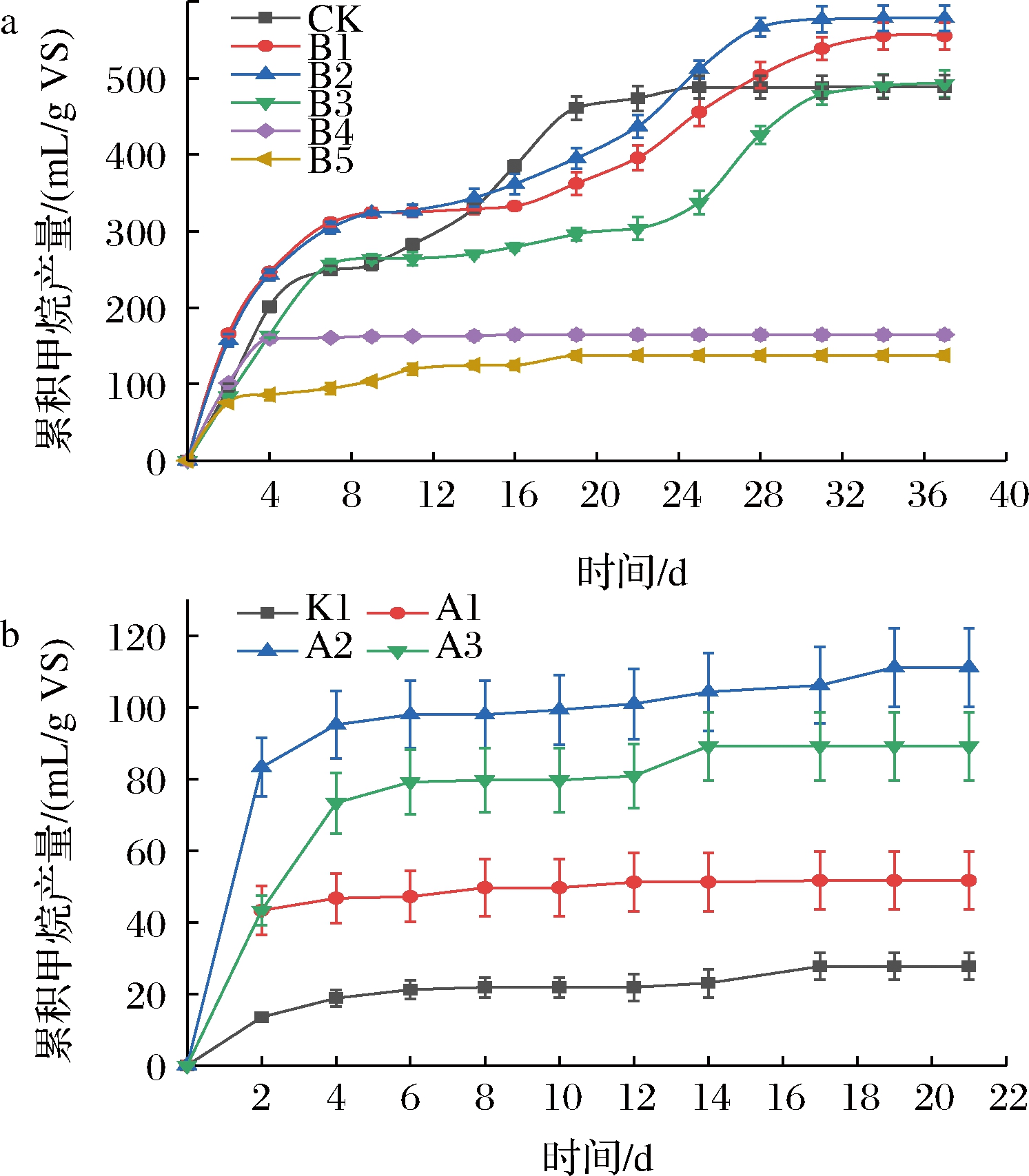
a-不同浓度下累积甲烷产量;b-不同条件下累积甲烷产量
图1 不同浓度姜辣素的甲烷累计产量和不同预处理 条件下甲烷累积产量变化
Fig.1 Cumulative methane yield at different concentration of gingerol and change in cumulative methane yield under different pretreatment conditions
与对照组相比,预处理组累积产气量有明显提高(图1-b),这说明实验组的预处理方式能够解除姜辣素对餐厨垃圾厌氧发酵的抑制。最终的累积产气量从大到小分别为A2>A3>A1>K1。其中超声预处理效果最好,最终累积产甲烷量为111.17 mL/g VS,比对照组提高了3.12倍,提高效果优于YUE等[18]的研究结果,这可能是因为超声处理过程中的空化过程会破坏姜辣素的结构,减少姜辣素对微生物的抑制,从而促进产气[19]。其次是光催化氧化预处理组,最终累积产甲烷量为89.17 mL/g VS,比对照组提高了2.22倍,这可能是因为光催化氧化产生的羟基基团破坏了姜辣素的化学键。A1组反应结束时的累积产甲烷量为51.67 mL/g VS,是对照组的1.87倍。
2.2 不同预处理方式对pH、TVFAs和SCOD变化的影响
如图2-a所示,pH值总体呈现先下降后上升的趋势,pH在前期下降是因为餐厨垃圾中的大分子有机物被微生物降解为小分子有机物而释放到液相中,小分子有机物被产酸菌利用生成挥发性有机酸,由于酸量的积累导致溶液中pH下降,K1、A1、A2、A3组的最低pH分别为6.65、6.92、6.94和6.76,由于NaHCO3的缓冲作用pH维持在适宜产甲烷菌生长的范围(6.5~7.5)。图2-b为反应过程中TVFAs的变化情况,反应前10 d总酸浓度迅速提高,在反应最后10 d趋于稳定。反应结束时各组的最终酸质量浓度分别为9.145(K1)、10.56(A1)、10.482(A2)和9.26(A3) g/L。图2-c为SCOD的变化情况,餐厨垃圾中的大分子有机物被水解菌降解为小分子有机物后使得SCOD迅速升高到12 000 mg/L左右,但从第10天后SCOD浓度缓慢下降,这是因为有机质在被降解利用。在第14天以后,有机物浓度逐渐上升。在反应结束时,SCOD维持在12 000~15 000 mg/L。
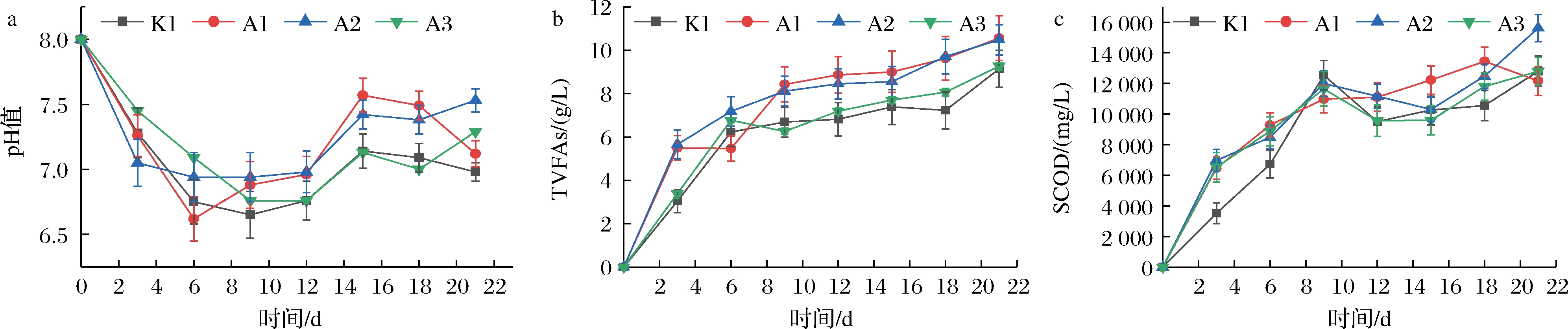
图2 不同预处理条件下pH值、TVFAs和SCOD变化情况
Fig.2 Change of pH, TVFAs and SCOD under different pretreatment conditions
2.3 不同预处理方式对可溶性蛋白质和碳水化合物变化的影响
整个反应过程中蛋白质浓度整体呈现上升趋势(图3-a),在反应开始时蛋白质浓度迅速上升,反应结束时实验组的蛋白质浓度都高于对照组。结束时A1、A2、A3组的蛋白质质量浓度分别为1 146.17、1 119.4、872.72 mg/L,而对照组的蛋白质质量浓度为833.01 mg/L。这可能是因为预处理能够促进蛋白质从固相释放到液相中。

a-可溶性蛋白质;b-可溶性碳水化合物
图3 不同预处理条件下可溶性蛋白质和 碳水化合物变化情况
Fig.3 Change of soluble protein and carbohydrate under different pretreatment conditions
可溶性碳水化合物的变化如图3-b所示,反应初期有机物不断水解,碳水化合物浓度迅速上升,在第12天左右下降到100~150 mg/L,在第15天左右小幅上升。反应结束时K1、A1、A2、A3组碳水化合物质量浓度分别为99.52、128.33、172.05、115.31 mg/L,实验组的浓度比对照组高,这可能是因为预处理方式促进了碳水化合物的水解。ELBESHBISHY等[20]发现超声预处理可以使可溶性蛋白增加约20%,可溶性碳水化合物提高17%,这与本文研究结果较一致。
2.4 不同预处理方式对污泥LB-EPS和TB-EPS变化的影响
通过3DEEM分析各组反应结束时污泥中LB-EPS和TB-EPS溶液中有机物的情况,检测主要官能团,荧光强度用于表征溶液中有机物的分布。根据报道,有机物的3DEEM荧光光谱可分为2个区域,在这些区域诱导信号的物质分别为芳香蛋白物质I(Ex/Em:200~240/300~380 nm),可溶性微生物副产物的Ⅱ区(Ex/Em:250~280/280~380 nm)[21]。如图4所示,峰A(Ex/Em:200~240/300~380 nm)对应芳香蛋白质类物质,峰B(Ex/Em:250~280/280~380 nm)代表可溶性微生物副产物。LB-EPS中的荧光强度峰要强于TB-EPS,这说明与紧密的胞外聚合物相比,松散的胞外聚合物中的有机物含量更高。A1组的荧光强度最大,这可能是因为热解预处理能有效地刺激微生物分泌胞外聚合物。A2和A3组的荧光强度较弱,这说明超声和光催化氧化对微生物的影响较小。TAO等[22]研究了大蒜素对餐厨垃圾和活性污泥共发酵体系的影响,在发酵液的三维荧光分析中有机质和酪氨酸类有机物两个峰的荧光强度分别从1 956和2 010提高到2 816和2 802。但本研究中A1组两个峰荧光强度仅为500.28和484.08,小于TAO等[22]的研究结果,这可能是因为处理的底物组成差异而引起的。

图4 不同预处理条件下污泥LB-EPS和TB-EPS的3D EEM图
Fig.4 3D EEM diagram of LB-EPS and TB-EPS in anaerobic sludge under different pretreatment conditions
2.5 不同预处理方式对酶活性的影响
图5为反应结束后各体系酶活性情况。总体上实验组的酶活性都高于对照组,这说明预处理能够提高细胞中各种酶的活性,促进物质的传输速度。ACK是发酵过程中控制乙酸生成的关键酶。乙酸激酶活性分别为对照组的103%(A1)、187.66%(A2)和157%(A3),比对照组都有提高。DHA是指能催化物质进行氧化还原反应的酶[23],实验组的脱氢酶活性分别比对照组提高108.45%、179.27%和102.22%。AKP是能够在碱性条件下水解蛋白质肽键的酶,A1、A2、A3组的碱性蛋白酶活性分别为对照组的146.12%、157.89%和103.51%。辅酶F420是一种产甲烷菌酶,主要参与CH4的生成过程[24],实验组中辅酶F420活性较对照组分别提高了3.0%、45.83%和37.92%,这表明预处理方式可提高辅酶F420的活性,促进甲烷的生成。NEUMANN等[25]发现经过超声预处理后样品的蛋白酶活性比空白提高1.8~4.3倍,这与本文的结果较一致。

图5 不同预处理条件下ACK、AKP、DHA和F420变化情况
Fig.5 Change of ACK, AKP, DHA, and F420 under different pretreatment conditions
2.6 不同预处理方式对微生物菌群变化的影响
如图6-a所示,细菌群落在门水平上分布的优势菌以Bacteroidetes、Firmicutes、Synergistota和Actinobacteria为主。对照组污泥中丰度最大的是Bacteroidetes(21.66%)、Firmicutes(22.41%)和Actinobacteria (19.70%)。经过预处理后,污泥中的微生物结构发生了变化。Bacteroidetes和Actinobacteria是厌氧发酵过程主要的产酸菌,对碳水化合物具有降解作用,其相对丰度的提高也会导致挥发性脂肪酸浓度的提高,A1组相比对照组Firmicutes和Chloroflexi的丰度增加,Chloroflexi能够降解餐厨垃圾中的多糖和单糖,并能够促进乙酸的生成从而为产甲烷菌提供底物。LI等[26]研究表明,Chloroflexi参与厌氧发酵过程,有利于促进水解发酵的进行。A2组中Caldatribacteriota和Proteobacteria丰度增加,Proteobacteria的类型多样,不仅能利用葡萄糖、丙酸和丁酸等小分子化合物,而且能在水解酸化中利用有机物产生乙酸为产甲烷菌提供底物。A3组的Firmicutes丰度较高,Firmicutes可以分泌多种胞外酶降解大分子物质,如蛋白质和脂类等。因此,Firmicutes相对丰度的提高加快了有机物的降解,为产甲烷菌提供营养。实验组和对照组的微生物群落结构差异说明预处理可以改变微生物结构,促进甲烷的生成。

图6-b为反应结束后各体系污泥中古菌群落在属水平上的变化。优势菌是Methanothrix、Methanobacterium、Methanolinea,其中,Methanothrix属于嗜乙酸型产甲烷菌,Methanobacterium和Methanolinea属于嗜氢型产甲烷菌。与对照组接种污泥相比,实验组中的Methanothrix在厌氧发酵体系内有所变化,分别提高了6.0%、8.0%、1.0%,说明预处理手段能够提高嗜乙酸型产甲烷菌的生长。然而,与对照组相比,Methanobacterium由41%下降到18%~24%。此外,与实验组相比,对照组Methanolinea的相对丰度较小,这表明经过预处理后能促进微生物从嗜氢型产甲烷菌向嗜乙酸型产甲烷菌演替,LI等[27]认为,Methanobacterium可以利用H2和CO2转化为CH4。而与K1相比,实验组2种嗜氢型产甲烷菌的相对丰度较低,这表明预处理可以促进嗜乙酸型产甲烷菌的富集,从而加快乙酸向CH4的转化。
a-细菌门水平相对丰度;b-古菌属水平相对丰度
图6 细菌门水平和古菌属水平的相对丰度
Fig.6 Relative abundances of bacterial phylum and archaeal genus
3 结论
研究表明姜辣素浓度大于16 mg/g总挥发性固体时,对餐厨垃圾厌氧发酵产甲烷有影响。姜辣素的预处理对解除餐厨垃圾厌氧发酵的产气抑制具有较好的效果。其中超声预处理后餐厨垃圾的产气量最高,是对照组的4.12倍。光催化氧化预处理下的产气量为对照组的3.22倍,热解预处理效果最差,最终产气量是对照组的1.87倍。与对照组相比,实验组的可溶性有机物含量较高,预处理可以促进有机质的释放。预处理还提升了ACK、AKP、DHA和辅酶F420的活性。预处理可以改变微生物群落结构,促进Firmicutes、Chloroflexi和Proteobacteria菌的生长,同时产甲烷古菌从嗜氢型向嗜乙酸型演替。本文研究结果可为餐厨垃圾厌氧发酵的抑制解除提供借鉴,但本研究为批式反应,后续需要在连续处理情况下,深入研究姜辣素对餐厨垃圾的影响及其解除方式。
[1] ASSIS T I, GONÇALVES R F.Valorization of food waste by anaerobic digestion:A bibliometric and systematic review focusing on optimization[J].Journal of Environmental Management, 2022, 320:115763.
[2] 闵海华, 刘凯丽, 吕龙义, 等.餐厨垃圾厌氧共消化研究进展[J].环境工程学报, 2022, 16(8):2457-2466.
MIN H H, LIU K L, LYU L Y, et al.Research progress and performance improvement strategies of anaerobic co-digestion of food waste[J].Chinese Journal of Environmental Engineering, 2022, 16(8):2457-2466.
[3] ZHANG D J, WEI Y D, WU S Y, et al.Consolidation of hydrogenotrophic methanogenesis by sulfidated nanoscale zero-valent iron in the anaerobic digestion of food waste upon ammonia stress[J].Science of the Total Environment, 2022, 822:153531.
[4] 刘健峰. 不同氮素对厌氧消化系统的影响及其转化机制研究[D].昆明:云南师范大学, 2022.
LIU J F.Effect of different nitrogen forms on the anaerobic digestion system and conversion mechanism[D].Kunming:Yunnan Normal University, 2022.
[5] 黄召亮, 乔杰, 庞晓怡, 等.餐厨垃圾厌氧消化系统酸化调控研究进展[J].四川环境, 2022, 41(2):262-266.
HUANG Z L, QIAO J, PANG X Y, et al.Research progress on acidification regulation of food waste anaerobic digestion system[J].Sichuan Environment, 2022, 41(2):262-266.
[6] DU M T, LIU X R, WANG D B, et al.Understanding the fate and impact of capsaicin in anaerobic co-digestion of food waste and waste activated sludge[J].Water Research, 2021, 188:116539.
[7] YUE L C, CHENG J, HUA J J, et al.A sodium percarbonate/ultraviolet system generated free radicals for degrading capsaicin to alleviate inhibition of methane production during anaerobic digestion of lipids and food waste[J].Science of The Total Environment, 2021, 761:143269.
[8] 史进程, 彭宁, 黄雪松.温度和酒度对姜酒中6-姜酚的影响[J].广东农业科学, 2011, 38(14):92-93.
SHI J C, PENG N, HUANG X S.Effects of heating temperature and alcohol content on the 6-gingerol in ginger liquor[J].Guangdong Agricultural Sciences, 2011, 38(14):92-93.
[9] FAGBOHUNGBE M O, HERBERT B M J, LI H, et al.The effect of substrate to inoculum ratios on the anaerobic digestion of human faecal material[J].Environmental Technology &Innovation, 2015, 3:121-129.
[10] NYANG′AU J O, MØLLER H B, SØRENSEN P.Effects of electrokinetic and ultrasonication pre-treatment and two-step anaerobic digestion of biowastes on the nitrogen fertiliser value by injection or surface banding to cereal crops[J].Journal of Environmental Management, 2023, 326(Part A):116699.
[11] KI S J, JEON K J, PARK Y K, et al.Improving removal of 4-chlorophenol using a TiO2 photocatalytic system with microwave and ultraviolet radiation[J].Catalysis Today, 2017, 293-294:15-22.
[12] 国家环境保护总局. 水和废水监测分析方法[M].北京:中国环境科学出版社, 2002.
STATE ENVIRONMENTAL PROTECTION ADMINISTRATION.Methods for Monitoring and Analysis of Water and Wastewater[M].Beijing:China Environmental Science Press, 2002.
[13] HIMANSHU H, VOELKLEIN M A, MURPHY J D, et al.Factors controlling headspace pressure in a manual manometric BMP method can be used to produce a methane output comparable to AMPTS[J].Bioresource Technology, 2017, 238:633-642.
[14] HALL N G, SCHÖNFELDT H C.Total nitrogen vs.amino-acid profile as indicator of protein content of beef[J].Food Chemistry, 2013, 140(3):608-612.
[15] DUBIOS M, GILLES K A, HAMILTON J K, et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry, 1956, 28(3):350-356.
[16] XUE S X, QIU L, GUO X H, et al.Effect of liquid digestate recirculation on biogas production and enzyme activities for anaerobic digestion of corn straw[J].Water Science and Technology, 2020, 82(1):144-156.
[17] ZHANG W J, CAO B D, WANG D S, et al.Influence of wastewater sludge treatment using combined peroxyacetic acid oxidation and inorganic coagulants re-flocculation on characteristics of extracellular polymeric substances(EPS)[J].Water Research, 2016, 88:728-739.
[18] YUE L C, CHENG J, TANG S Q, et al.Ultrasound and microwave pretreatments promote methane production potential and energy conversion during anaerobic digestion of lipid and food wastes[J].Energy, 2021, 228:120525.
[19] BOUGRIER C, ALBASI C, DELGEN S J P, et al.Effect of ultrasonic, thermal and ozone pre-treatments on waste activated sludge solubilization and anaerobic biodegradability[J].Chemical Engineering and Processing:Process Intensification, 2006, 45(8):711-718.
S J P, et al.Effect of ultrasonic, thermal and ozone pre-treatments on waste activated sludge solubilization and anaerobic biodegradability[J].Chemical Engineering and Processing:Process Intensification, 2006, 45(8):711-718.
[20] ELBESHBISHY E, NAKHLA G.Comparative study of the effect of ultrasonication on the anaerobic biodegradability of food waste in single and two-stage systems[J].Bioresource Technology, 2011, 102(11):6449-6457.
[21] LIU J W, ZANG N N, GAO L T, et al.A modified packed anaerobic baffled reactor based on phase separation for the treatment of decentralized wastewater:Performance and microbial communities[J].Biochemical Engineering Journal, 2022, 183:108455.
[22] TAO Z, CHEN C, YANG Q, et al.Understanding the impact of allicin for organic matter release and microorganism community in anaerobic co-digestion of food waste and waste activated sludge[J].Science of The Total Environment, 2021, 776:145598.
[23] YUAN T G, SUN R, SHAO M S, et al.Biochar regulates enzymes activity and interspecies electron transfer to promote bioenergy recovery from a continuous two-stage food waste anaerobic digestion process[J].Journal of Cleaner Production, 2023, 385:135690.
[24] SHAO Z J, CHEN H Y, ZHAO Z Z, et al.Combined effects of liquid digestate recirculation and biochar on methane yield, enzyme activity, and microbial community during semi-continuous anaerobic digestion[J].Bioresource Technology, 2022, 364:128042.
[25] NEUMANN P, GONZ LEZ Z, VIDAL G.Sequential ultrasound and low-temperature thermal pretreatment:Process optimization and influence on sewage sludge solubilization, enzyme activity and anaerobic digestion[J].Bioresource Technology, 2017, 234:178-187.
LEZ Z, VIDAL G.Sequential ultrasound and low-temperature thermal pretreatment:Process optimization and influence on sewage sludge solubilization, enzyme activity and anaerobic digestion[J].Bioresource Technology, 2017, 234:178-187.
[26] LI P C, LIU Z Y, ZHAO M X, et al.Enhanced methane generation from anaerobic tridigestion of organic solid wastes by direct interspecies electron transfer stimulation[J].ACS Sustainable Chemistry &Engineering, 2021, 9(36):12323-12331.
[27] LI P C, LIU Z Y, ZHAO M X, et al.Evaluation of biogas performance and process stability from food, kitchen, and fruit/vegetable waste by mono-, co-, and tridigestion[J].Energy &Fuels, 2020, 34(10):12734-12742.