草菇(Volvariella volvacea),又名稻草菇、中国蘑菇,是一种生长在热带、亚热带地区的高温型食用菌,是我国主要的栽培食用菌之一[1]。草菇味道鲜美,含有丰富的多糖、蛋白质、不饱和脂肪酸等营养成分,具有降血压、降胆固醇、预防癌症等功效[2-3],深受消费者的喜爱。
在生产过程中,草菇菌种退化会导致菌丝活力降低、子实体品质和产量减少等现象,是制约草菇发展的重要因素[4]。低温保藏法可有效减慢菌丝生长速度、降低基因变异的发生,是延缓菌种衰退的有效措施[5]。然而草菇不耐低温贮藏,4 ℃下菌丝在48 h内自溶死亡[6]。故相较于其他食用菌,草菇菌种退化现象的发生更为频繁。寻找一种有效的退化菌种复壮方法是草菇产业亟需解决的难题。
丝氨酸(serine, Ser)是构成蛋白质的基本单位,不仅参与生物体的一系列代谢过程,还能够通过自身及其代谢产物调节机体的生理功能[7]。在细胞膜的制造加工、肌肉组织和包围神经细胞的鞘的合成中,Ser也发挥着重要作用[8]。GARCIA等[9]发现营养液中添加Ser后显著增加了植物叶片的矿物质含量。ZHANG等[10]在水培液中添加Ser后显著提高了番茄幼苗的生长速度。
课题组前期通过添加20种氨基酸复壮草菇退化菌种,结果表明,Ser可有效提高草菇退化菌株的菌丝特性[11]。本文在此研究基础上,测定草菇退化菌株在外源添加Ser后的生产性状、营养成分等指标的变化,进一步明确Ser对草菇退化菌种的影响,为草菇及其他食用菌退化菌种的复壮研究提供理论参考和技术支持。
1 材料与方法
1.1 菌种
草菇V844原种(D0),保藏于甘肃农业大学食品科学与工程学院。
退化菌株(D1~D3):由课题组前期通过连续组织分离继代的方式获得[12]。D1:连续组织分离继代6次;D2:连续组织分离继代12次;D3:连续组织分离继代19次。
1.2 试剂与仪器
1.2.1 试剂
葡萄糖、琼脂粉、浓硫酸、无水乙醇、苯酚、牛血清蛋白标准品、没食子酸标准品、芦丁、福林酚、液氮、考马斯亮蓝G250、KH2PO4、MgSO4、NaCl、Na2CO3、NaOH、Ser,上海源叶生物科技有限公司;棉籽壳、废棉、麸皮、石灰、石膏,广东锐一食用菌栽培基地;以上试剂均为分析纯,试验用水均为蒸馏水。
1.2.2 仪器与设备
YM75L立式压力蒸汽灭菌锅,上海高精密仪器有限公司;SW-CJ-080D超净工作台,苏州安泰技术有限公司;HWS-600W恒温恒湿培养箱,常州恒隆有限公司;SPX-1000生化培养箱,常州金坛良友仪器有限公司;AL201-MTL电子分析天平,梅特勒-托利仪器有限公司;DW-86L80超低温保存箱,浙江捷胜低温设备有限公司;SUP-20-J优普系列超纯水机,山东汀兰科技有限公司;101-3B烘箱,上海联鲸仪器有限公司;LINKS游标卡尺,长春市哈辛刃具有限公司;HWS-26电热恒温水浴锅,济南欧莱堡生物技术;RE-3000A蒸发浓缩仪,江苏穹宇机械科技有限公司;HE-CS350超声波清洗机,济宁亨达超声设备有限公司;novAA® 400P火焰原子吸收光谱仪,德国耶拿分析仪器股份公司;8L0-0031-LA8080全自动氨基酸分析仪,日立(HITECHI)。
1.3 实验方法
1.3.1 培养基的制备
对照组(CK):PDA培养基组成(质量分数)为马铃薯 20%,葡萄糖 2%,琼脂粉 2%,KH2PO40.1%,MgSO4 0.1%。栽培种培养基组成(质量分数)为棉籽壳88%,麸皮10%,石膏1%,石灰1%,含水量约65%,pH 8~9。栽培培养基组成(质量分数)为废棉95%,石灰5%,含水量约 65%,pH 9~10。
处理组(Ser):在PDA和栽培种培养基的基础上,添加0.2%(质量分数)Ser。栽培过程中,将喷洒用水替换成0.2%(质量分数)的Ser水溶液。
1.3.2 草菇菌丝体生理性状测定
菌落形态:统一活化D0~D3菌株,在第3天时拍照记录。
菌丝生长速度:参照安学明等[12]的方法测定。将 D0~D3 菌株统一活化并培养72 h后,在培养皿上通过十字交叉法划线标记草菇菌落直径,计算菌丝生长速度。
1.3.3 生产性状的测定
以D0~D3为试验菌株,参照余昌霞等[13]的方法,进行栽培试验。测定以下指标:
原基形成时间(d):记录从栽培开始到第1个原基形成所需的时间。
生产周期(d):记录从栽培开始到子实体蛋形期所需的时间。
平均单菇质量(g):从每个栽培框中随机摘取5个蛋形期子实体,分别称重,计算平均值。
生物学效率计算[14]如公式(1)所示:
生物学效率![]()
(1)
1.3.4 营养指标的测定
水分采用GB 5009.3—2016《食品安全国家标准 食品中水分的测定》中“第一法 直接干燥法”进行测定;灰分采用GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》中“第一法 食品中总灰分的测定”进行测定;粗多糖的测定参照温文娟等[15]的方法;粗蛋白的测定参照杨静华[16]的方法;粗纤维的测定参照耿丹萌[17]的方法;粗脂肪的测定参照谢福泉等[18]的方法;黄酮的测定参照李剑梅等[19]的方法;多酚的测定参照吴亮亮等[20]的方法。氨基酸采用GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》进行测定;矿物质含量测定参照张雪红等[21]的方法,采用火焰原子吸收光谱仪测定。
1.4 数据分析
数据统计整理采用Excel 2019处理,采用Origin 2018和TBtools作图,数据显著性分析采用SPSS 26.0处理。
2 结果与分析
2.1 Ser对草菇菌丝体生理性状的影响
将D0~D3菌株统一活化并培养3 d后,观察菌落形态和菌丝生长速度,结果如图1所示。随着菌株继代次数的增加,菌落直径和菌丝生长速度均呈现先上升后下降的趋势。添加Ser后,D0~D3菌株的菌落直径均有不同程度的增加,菌丝生长速度较CK组分别提高了4.67%、4.43%、12.00%和12.18%。Ser处理组的D2、D3菌株的菌丝生长速度显著高于CK组(P<0.05)。

a-菌丝密度;b-菌丝生长速度
图1 外源Ser对草菇菌丝体的影响
Fig.1 Effects of exogenous serine of V.volvacea
注:图中数值为平均值±标准差,n=3;*表示同组内差异 显著(P<0.05)(下同)。
2.2 Ser对草菇生产性状的影响
对D0~D3菌株进行栽培试验,结果如图2所示,D0、D1、D2菌株均可顺利出菇,D3菌株仅能形成原基,但不能长成子实体。经Ser处理后,D0、D1、D2菌株的子实体数量有不同程度的增加,不能出菇的D3菌株恢复了出菇能力。

图2 草菇栽培
Fig.2 V.volvacea cultivation
由图3可知,和D0相比,D1菌株的生产性状没有明显差异。而D2菌株的平均单菇重和生物学效率较D0分别降低了10.75%和49.00%,原基形成时间和生产周期较D0分别增加了14.29%和6.25%;D3菌株的原基形成时间较D0延长了28.57%。
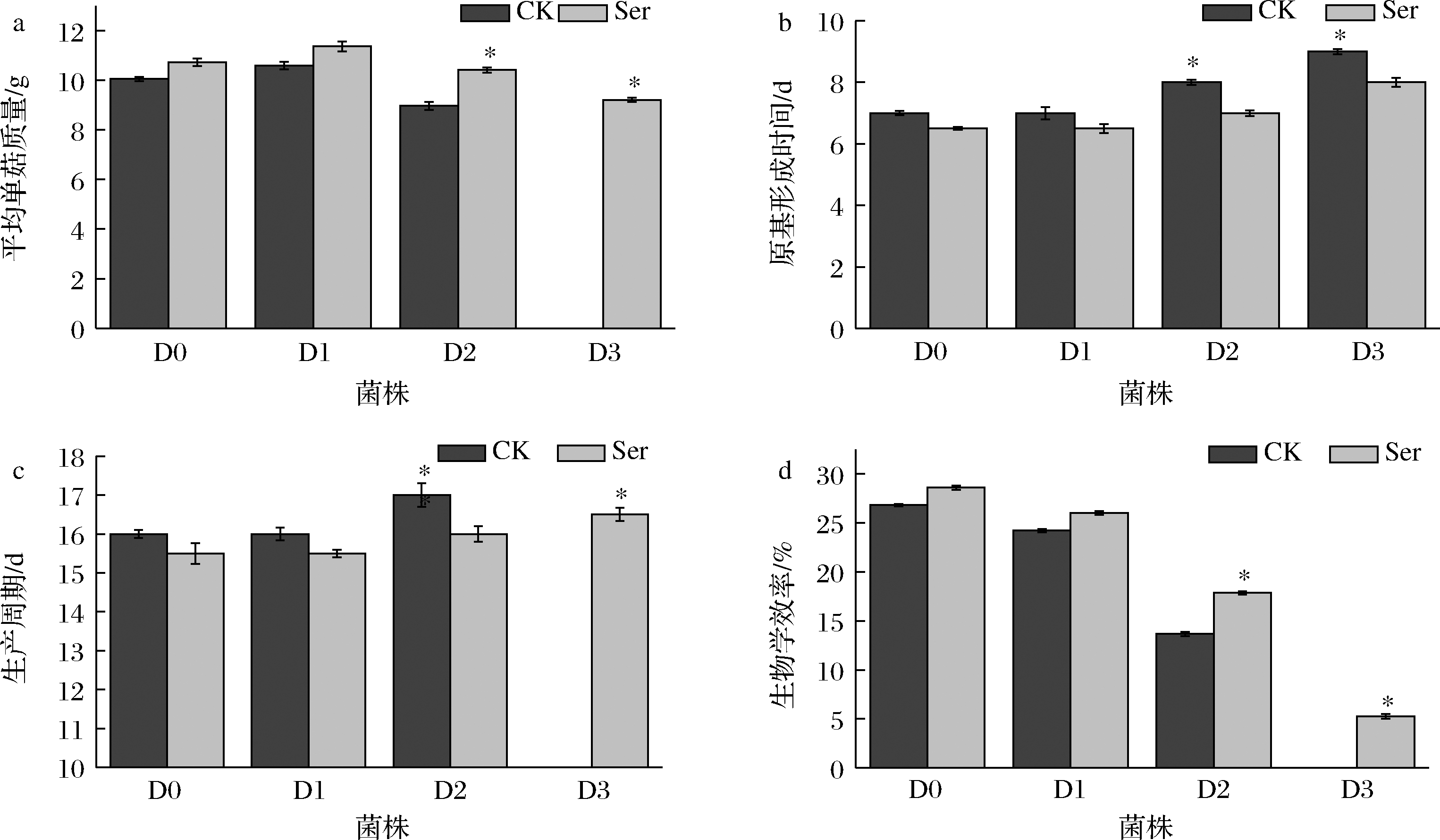
a-平均单菇质量;b-原基形成时间;c-生产周期;d-生物学效率
图3 外源Ser对草菇生产性状的影响
Fig.3 Effect of exogenous serine on agronomic traits of V.volvacea
外源添加Ser处理后,对D0、D1菌株的生产性状影响不显著。D2菌株的平均单菇重和生物学效率较CK组分别提高了了16.05%和30.56%,原基形成时间和生产周期较D0分别减少了12.5%和5.88%。Ser处理使不能出菇的D3菌株重新长出子实体,生产周期和生物学效率分别为16.5 d和5.26%。
2.3 Ser对草菇营养成分的影响
对D0~D3菌株的营养成分含量进行测定,结果如表1所示。随着继代次数的增加,D0~D3菌株的粗多糖、粗蛋白、灰分含量都随着继代时间的延长而显著降低,与D0相比,D3菌株的粗多糖、粗蛋白、灰分含量分别降低了43.36%、14.42%、29.7%。而粗纤维、粗脂肪、水分则随继代次数的增加呈先上升后下降的趋势。外源添加Ser处理后,D0和D1菌株的各营养成分含量变化不显著;D2菌株的粗多糖、粗蛋白、粗纤维、灰分含量较CK组分别提高了11.00%、40.69%、6.91%和23.75%;D3菌株较CK组分别提高了20.71%、65.87%、17.36%和42.25%;粗脂肪和水分含量较CK组无显著变化。
表1 Ser对草菇营养成分的影响 单位:mg/g
Table 1 Effect of Ser on nutritional components of Volvariella volvacea

营养成分D0D1D2D3CKSerCKSerCKSerCKSer粗多糖45.51±0.97a47.81±0.84a39.44±1.02a41.55±1.25a30.22±0.67b33.54±0.85a25.78±0.79b31.12±0.70a粗蛋白32.95±0.89a33.82±0.75a30.59±0.63a37.73±0.52a28.41±0.70b39.98±0.67a28.20±0.60b46.77±0.60a粗纤维1.44±0.02a1.50±0.03a1.51±0.05a1.52±0.04a1.22±0.00a1.29±0.02a0.98±0.03b1.15±0.02a灰分1.01±0.04a1.05±0.04a0.91±0.03a1.01±0.03a0.8±0.02b0.99±0.02a0.71±0.03b1.01±0.01a粗脂肪2.14±0.06a2.09±0.06a2.23±0.07a2.29±0.05a2.09±0.01a2.18±0.04a2.1±0.05b2.14±0.08a水分91.44±0.07a91.15±0.06a91.51±0.00a91.71±0.07a91.22±0.01a91.54±0.04a90.78±0.06a91.12±0.07a黄酮0.13±0.00a0.13±0.00a0.13±0.00a0.13±0.00a0.10±0.00b0.12±0.01a0.09±0.00b0.11±0.00a多酚1.82±0.01a1.83±0.00a1.71±0.00a1.72±0.00a1.56±0.00a1.70±0.00a1.55±0.02b1.69±0.00a
注:表中数值为平均值±标准差,n=3;同一行不同字母代表同一菌株的数值差异显著(P<0.05)(下同)。
草菇菌株的黄酮和多酚含量随继代时间的延长呈下降的趋势。D3菌株的黄酮和多酚含量较D0分别降低了28.00%和15.47%。外源添加Ser后,D0和D1菌株的黄酮和多酚含量较CK组无显著变化。D2、D3菌株黄酮含量比CK组分别升高了16.66%、15.86%;多酚含量较CK组分别升高了8.94%和9.92%。
2.4 Ser对草菇氨基酸含量的影响
对草菇的氨基酸含量进行检测,结果如图4所示。D0~D3菌株的CK组和Ser组中均检测到17种氨基酸,其中谷氨酸(glutamate, Glu)含量最高,D0菌株的Glu含量为3.35 g/100 g。随着继代次数的增加,草菇的氨基酸含量均呈下降趋势,其中,脯氨酸(proline, Pro)含量下降最多;较D0菌株,D3菌株降低了54.84%;精氨酸(arginine, Arg)含量降低最少,较D0菌株,D3菌株降低了15.57%。
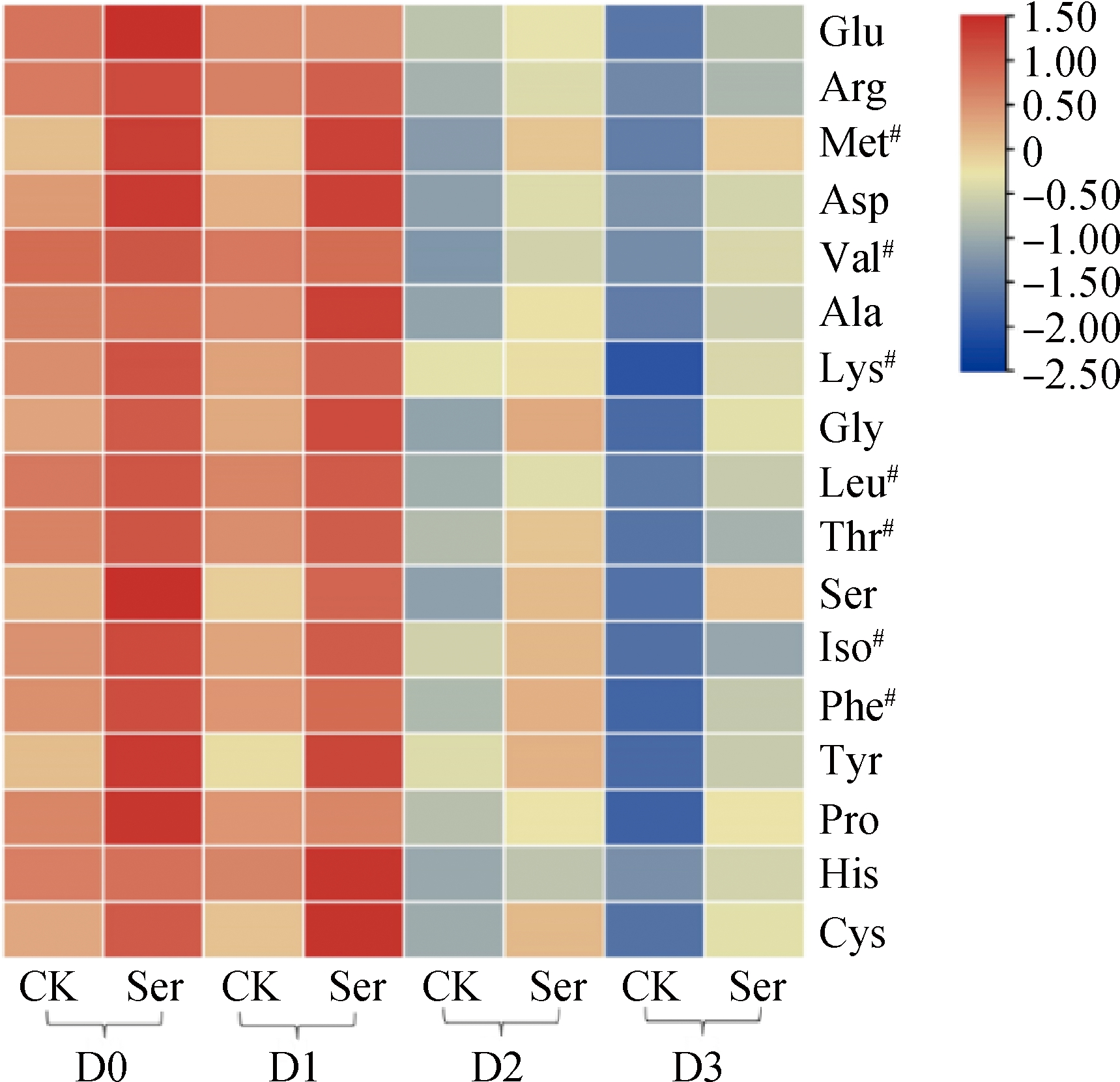
图4 外源Ser对草菇氨基酸含量的影响
Fig.4 Effect of exogenous Ser on amino acid content of V.volvacea
注:#表示必需氨基酸。
外源添加Ser处理后,D0~D3菌株的各氨基酸均有不同程度的升高。Ser处理组的D0~D3菌株氨基酸总量较CK组分别提高了9.19%、9.71%、13.45%和18.22%。其中,半胱氨酸(cysteine, Cys)的提高幅度最大,D0~D3菌株的Cys含量分别较CK组分别提高了20.93%、42.5%、51.85%和84.21%;甲硫氨酸(methionine, Met)次之,较CK组分别提高了15.63%、16.93%、18.75%和24.34%。D0~D3菌株的Ser含量分别较CK组提高了13.86%、11.22%、16.28%和23.75%。
2.5 Ser对草菇矿物质含量的影响
对草菇的矿物质含量进行检测,结果如表2所示。各菌株的矿物质含量的大小顺序均为K>Ca>Mg>Na>Fe>Cu>Zn>Mn。随着继代次数的增加,继代菌株对矿物质的富集作用逐渐减弱,各矿物质含量均随继代时间的延长呈下降趋势。D3菌株的矿物质总量较D0降低了15.51%。Zn含量降低最多,D3菌株比D0中的Zn含量降低了87.96%。K含量降低最少,D3比D0菌株中的K含量降低了13.19%。
表2 Ser对草菇矿物质含量的影响 单位:mg/kg
Table 2 Effect of Ser on mineral content of V.volvacea

矿物质D0D1D2D3CKSerCKSerCKSerCKSerK855.98±0.88a904.59±2.87a805.62±1.57a863.02±2.22a775.95±0.46b873.72±1.79a723.10±3.58b837.85±3.21aCa270.69±3.34a275.29±1.37a245.67±2.92a257.81±1.17a245.13±2.31a258.64±1.41a233.06±2.15a235.35±2.33aMg100.62±3.99a115.79±1.16a92.89±0.06a95.59±1.32a83.49±0.40b95.96±1.47a75.34±1.51b78.15±2.52aFe53.63±0.34a55.04±0.39a47.01±0.90a51.99±0.55a39.37±0.09a46.47±2.61a36.63±1.66a39.10±0.33aNa13.37±2.90a13.90±0.47a12.45±1.19a13.61±0.31a10.82±0.76a12.34±1.82a9.54±0.64a11.06±1.17aCu13.54±0.32a18.06±0.74a13.12±0.07a18.26±0.15a11.41±0.28b17.22±0.72a9.14±2.02b18.13±0.10aMn2.46±0.46a2.78±0.06a2.35±0.32a2.85±0.12a2.20±0.18b2.83±0.20a1.90±0.01b2.35±0.01aZn2.53±0.56a2.73±1.84a0.98±1.14a1.94±1.66a0.31±0.94b0.76±0.10a0.31±0.01b0.71±0.10a总量1 309.82±3.57a1 388.19±2.01a1 217.08±2.62a1 305.07±4.09a1 166.69±2.50b1 307.14±4.17a1 088.03±4.38b1 229.69±4.35a
经Ser处理后,D0~D3菌株中的矿物质总量较CK组分别提高了5.74%、6.97%、11.76%和12.92%。D0~D3菌株Ca、Fe、Na含量以及D0、D1菌株的K、Mg含量和CK组相比均无显著差异(P>0.05)。D2、D3菌株的K、Mg含量较CK组显著升高(P<0.05),分别升高了12.60%、14.94%和15.87%、13.01%;D2菌株的Mn、Zn含量,较CK组升高了28.66%、144.57%;D3菌株的Cu含量较CK组升高了122.63%。
3 讨论
菌种退化现象制约着食用菌产业的发展,关于食用菌退化菌种的复壮研究报道有很多。王殿振等[22]用组织分离法复壮北虫草,有效缩短了北虫草退化菌株的满瓶天数和出草天数,提高了菌种产量。马宏等[23]采用菌丝尖端分离技术对退化的香菇菌株进行复壮,使复壮菌株的出菇时间提前了15 d,子实体产量提高了12.6%。此外,改变培养基配方也是复壮食用菌退化菌种的重要手段。毛宁等[24]在培养基中添加抗生素对蛹虫草进行复壮,其菌丝的生长速度约为复壮前的8倍。程志虹等[25]通过更换培养基碳源,显著提高草菇的木质纤维素分解能力,恢复了草菇退化菌株的菌丝性状。马元伟等[26]在培养基中添加组氨酸和赖氨酸,有效恢复了绿僵菌和蛹虫草退化菌株的产孢能力。本文通过在培养基中外源添加Ser,显著提高了草菇继代菌株D2的生物学效率,且使不能出菇的D3菌株恢复了出菇能力,对草菇退化菌种有较好的复壮效果。
氨基酸作为有机氮源,是食用菌合成核酸、碳水化合物、蛋白质和酶类的原料。同时,作为一种重要的生长因子,氨基酸对微生物的生长和代谢产物的产生起着重要作用。KAWAGISHI等[27]研究发现在培养基中添加异亮氨酸对松茸菌丝的生长有显著促进作用;李长喜等[28]发现,培养料中添加氨基酸后,平菇鲜菇品质得到改善,产量比对照增加了31.6%。YAMANAKA等[29]研究发现在培养基中添加缬氨酸和谷氨酰胺能够提高栎松口蘑孢子的形成率。JO等研究[30]发现,在培养基中添加谷氨酸能够提高广叶绣球菌的菌丝生物量和γ-氨基丁酸的产量。本研究表明,外源Ser处理能提高草菇退化菌株菌丝体营养成分的含量,改善其生产性状。
活性氧(reactive oxygen species,ROS)是生物体正常代谢过程中产生的含氧物质,参与细胞生长发育、信号传导及各种生化反应[31]。但当ROS过量积累时,会导致生物体的氧化损伤[32]。一些研究发现,菌种退化与ROS的过度积累有关[33]。为了避免过量的ROS对机体造成伤害,生物体内形成多糖、酚类、肽类等抗氧化物质。在本研究中,外源添加Ser处理后,草菇体内的各种氨基酸含量均发生不同程度的变化。特别是Met和Cys的含量显著提高,这两种氨基酸均有较好的抗氧化能力。CAMPBELL等[34]研究发现在培养基中添加Met能有效降低酿酒酵母细胞内的氧化应激,减少细胞损伤。ALI等[35]报道了Cys处理荔枝果皮后,能提高果皮的总酚含量和DPPH自由基清除活性。作为一种功能性氨基酸,Ser能够进入一碳循环,生成一碳单位如甲基等,参与了嘌呤等重要物质的合成,也影响着各种氨基酸和其他营养物质的转化[36]。本研究中,外源添加Ser后,菌丝体内的黄酮、多酚等抗氧化物质的含量也显著提高。这些抗氧化物质均能有效清除草菇退化菌株体内多余的ROS,这可能是草菇的菌丝生长速度的子实体产量提高的原因。
矿物质在生物体代谢活动中起着重要作用,它们有的是酶的活性因子,有的参与激素的生理作用[37]。本研究发现,在培养基中外源添加Ser后,D0~D3菌株中的各种矿质元素含量均不同程度的增加,特别是Mn、Cu、Zn的含量显著提高。超氧化物歧化酶(superoxide dismutase,SOD)是酶促系统中重要的酶,也是生物体内清除ROS的第一道防线。在草菇中存在Cu/Zn-SOD和Mn-SOD两类SOD[38]。POURSAEID等[39]研究发现在平菇栽培时添加Zn有助于提高平菇的菌丝生物量和子实体产量。高昆等[40]研究发现,低浓度的Cu可有效促进粉葛幼苗的生长。刘丹阳等[41]研究发现,适当浓度的Mn可影响甜菜体内抗氧化酶系统及膜脂质过氧化作用。本研究通过外源Ser提高了草菇退化菌株中Mn、Cu、Zn的含量,可能促进了SOD的活力,增强了菌株的ROS清除能力,从而有效恢复了草菇退化菌株的生产性状。Ser影响草菇中各营养成分变化的具体机制,还有待于进一步的研究。
[1] YELLA V K, CHADRAPATI A, KURI A, et al.Cultivation technology and spawn production of Volvariella volvacea: Paddy Volvariella volvacea[J].Journal of Pharmaceutical Innovation,2021,10:1184-1190.
[2] KISHIDA E, KINOSHITA C, SANE Y, et al.Structures and antitumor activities of polysaccharides isolated from mycelium of Volvariella volvacea[J].Bioscience, Biotechnology, and Biochemistry,1992,56(8):1308-1309.
[3] 戴玉成, 杨祝良.中国药用真菌名录及部分名称的修订[J].菌物学报, 2008, 27(6):801-824.
DAI Y C, YANG Z L.A revised checklist of medicinal fungi in China[J].Mycosystema, 2008, 27(6):801-824.
[4] LI P, HU C, LI Y J, et al.The cold-resistance mechanism of a mutagenic Volvariella volvacea strain VH3 with outstanding traits revealed by transcriptome profiling[J].BMC microbiology, 2021, 21(1):336.
[5] 陈志宏, 郑铃, 刘新锐, 等.草菇菌种不同保藏方法的效果比较[J].食药用菌, 2012,20(6):337-338.
CHEN Z H, ZHENG L, LIU X R, et al.Comparison of the effects of different preservation methods of Volvariella volvacea strains[J].Edible and Medicinal Mushrooms,2012,20(6):337-338.
[6] 赵妍, 查磊, 陈明杰, 等.草菇4 ℃贮藏期间的品质及生理生化研究[J].分子植物育种, 2018, 16(21):7179-7186.
ZHAO Y, ZHA L, CHEN M J, et al.Morphological and physiological indexes of Volvariella volvacea during storage at 4 ℃[J].Molecular Plant Breeding, 2018, 16(21):7179-7186.
[7] PARKER S J, METALLO C M.Chasing one-carbon units to understand the role of serine in epigenetics[J].Molecular cell, 2016, 61(2):185-186.
[8] ESCH B M, LIMAR S, BOGDANOWSKI A, et al.Uptake of exogenous serine is important to maintain sphingolipid homeostasis in Saccharomyces cerevisiae[J].PLoS genetics, 2020, 16(8):e1008745.
[9] GARCIA A L, MADRID R, GIMENO V, et al.The effects of amino acids fertilization incorporated to the nutrient solution on mineral composition and growth in tomato seedlings[J].Spanish Journal of Agricultural Research, 2011, 9(3):852.
[10] ZHANG S J, HU F, LI H X, et al.Influence of earthworm mucus and amino acids on tomato seedling growth and cadmium accumulation[J].Environmental Pollution, 2009, 157(10):2737-2742.
[11] 孔梓璇, 王巧莉, 程志虹, 等.外源氨基酸对草菇退化菌种复壮的影响[J].食品与发酵工业, 2021, 47(20):30-36.
KONG Z X,WANG Q L,CHENG Z H, et al.Effect of exogenous amino acids on the rejuvenation of degraded strains of Volvariella volvacea[J].Food and Fermentation Industries, 2021, 47(20):30-36.
[12] 安学明, 陈超, 刘小霞, 等.草菇继代培养中菌种退化对子实体营养成分的影响[J].菌物学报, 2020, 39(2):390-397.
AN X M, CHEN C, LIU X X, et al.Effects of degeneration of cultivated strains on fruiting body nutrients of Volvariella volvacea during subculture[J].Mycosystema, 2020, 39(2):390-397.
[13] 余昌霞, 李正鹏, 查磊, 等.不同光质对草菇菌丝生长及子实体性状的影响[J].食用菌学报, 2021, 28(3):72-77.
YU C X, LI Z P, ZHA L, et al.Effects of different light quality on mycelial growth and fruiting body characteristics of Volvariella volvacea[J].Acta Edulis Fungi, 2021, 28(3):72-77.
[14] 钟丽娟, 赵新海.漏斗多孔菌液体菌种培养基及其栽培条件[J].菌物学报, 2021, 40(12):3118-3128.
ZHONG L J, ZHAO X H.Liquid culture medium and cultivation conditions of Polyporus arcularius[J].Mycosystema, 2021, 40(12):3118-3128.
[15] 温文娟, 刘珊, 黄远丽.苯酚硫酸法与蒽酮硫酸法测定香菇多糖含量比较[J].现代食品, 2020(21):177-179.
WEN W J, LIU S, HUANG Y L.Comparison of phenol sulfuric and anthrone sulfuric method for determination of lentinan[J].Modern Food, 2020(21):177-179.
[16] 杨静华. 考马斯亮蓝法测定苦荞麦中可溶性蛋白的含量[J].山西医药杂志, 2018, 47(2):206-207.
YANG J H.Determination of soluble protein in tartary buckwheat by Coomassie brilliant blue method[J].Shanxi Medical Journal, 2018, 47(2):206-207.
[17] 耿丹萌. 河北省主产区黑木耳品比研究及菌糠综合利用[D].保定:河北大学, 2019.
GENG D M.Study on the ratio of black fungus and its comprehensive utilization in Hebei province[D].Baoding:Hebei University, 2019.
[18] 谢福泉, 羿红, 兰家细, 等.金顶侧耳子实体营养成分分析[J].食用菌学报, 2007, 14(2):81-85.
XIE F Q, YI H, LAN J X, et al.Major nutritional components of four Pleurotus citrinopileatus strains[J].Acta Edulis Fungi, 2007, 14(2):81-85.
[19] 李剑梅, 张疏雨, 于广丰, 等.珍稀药用真菌桑黄菌丝体粉中黄酮含量测定[J].食用菌, 2020, 42(3):72-74.
LI J M, ZHANG S Y, YU G F, et al.Determination of flavonoids content in mycelia powder of rare medicinal fungus Phellinus igniarius[J].Edible Fungi, 2020, 42 (3):72-74.
[20] 吴亮亮, 葛静波, 王浩东, 等.双孢蘑菇水提物抗氧化活性研究[J].中国野生植物资源, 2018, 37(4):18-20;24.
WU L L, GE J B, WANG H D, et al.Antioxidative activities of water extracts from Agaricus bisporus[J].Chinese Wild Plant Resources, 2018, 37(4):18-20;24.
[21] 张雪红, 王明剑, 刘蒙玲.蔗糖基聚合物对双孢蘑菇中矿物质含量的影响[J].中国食用菌, 2010, 29(4):35-37.
ZHANG X H, WANG M J, LIU M L.Effects of sucrose-based polymers on the contents of mineral substance in Agaricus bisporus[J].Edible Fungi of China, 2010, 29(4):35-37.
[22] 王殿振, 贺晓龙, 赵瑞华, 等.北虫草菌种复壮方法的比较[J].北方园艺, 2016(17):137-139.
WANG D Z, HE X L, ZHAO R H, et al.Comparison of Cordyceps militaris spawn rejuvenation method[J].Northern Horticulture, 2016(17):137-139.
[23] 马宏, 张根伟, 刘昆昂, 等.香菇灵仙1号菌株提纯复壮[J].食用菌学报, 2017, 24(4):19-24.
MA H, ZHANG G W, LIU K A, et al.Rejuvenation of a degenerate Lentinula edodes cultivar[J].Acta Edulis Fungi, 2017, 24(4):19-24.
[24] 毛宁, 柯轶.蛹虫草菌株的复壮方法[P].福建:CN102090270A, 2011-06-15.
MAO N, KE Y.Rejuvenation methods of Cordyceps militaris strains[P].Fujian:CN102090270A, 2011-06-15.
[25] 程志虹, 王文沛, 谭强飞, 等.外源甘露醇复壮草菇退化菌株的研究[J].食品与发酵工业, 2022, 48(11):30-35.
CHENG Z H, WANG W P, TAN Q F, et al.Degraded strains of Volvariella volvacea rejuvenated by exogenous mannitol[J].Food and Fermentation Industries, 2022, 48(11):30-35.
[26] 马元伟, 王荣, 高强, 等.外源氨基酸的添加对恢复或预防丝状真菌退化的研究[J].生物学杂志, 2017, 34(2):108-111.
MA Y W, WANG R, GAO Q, et al.Rejuvenation and preventing degradation of filamentous fungi by adding exogenous amino acids[J].Journal of Biology, 2017, 34(2):108-111.
[27] KAWAGISHI H, HAMAJIMA K, TAKANAMI R, et al.Growth promotion of mycelia of the Matsutake mushroom Tricholoma matsutake by D-isoleucine[J].Bioscience, biotechnology, and biochemistry, 2004, 68(11):2405-2407.
[28] 李长喜, 李巨, 王文成, 等.含氨基酸水溶肥用于发酵料栽培平菇的效果实验[J].中国食用菌, 2016, 35(6):67-68.
LI C X, LI J, WANG W C, et al.Effect of amino acid containing water soluble fertilizer on cultivation of Pleurotus ostreatus with fermented materials[J].Edible Fungi of China, 2016, 35(6):67-68.
[29] YAMANAKA T, KONNO M, KAWAI M, et al.Improved chlamydospore formation in Tricholoma bakamatsutake with addition of amino acids in vitro[J].Mycoscience, 2019, 60(6):319-322.
[30] JO H G, SHIN H J.Effect of addition amino acids on the mycelial growth and the contents of β-glucan and γ-aminobutyric acid (GABA) in Sparassis latifolia[J].Journal of Mushroom, 2017, 15(1):38-44.
[31] ![]() M, LUHOV
M, LUHOV L,
L, ![]() M.On the origin and fate of reactive oxygen species in plant cell compartments[J].Antioxidants, 2019, 8(4):105.
M.On the origin and fate of reactive oxygen species in plant cell compartments[J].Antioxidants, 2019, 8(4):105.
[32] ZHU J, WU F L, YUE S N, et al.Functions of reactive oxygen species in apoptosis and ganoderic acid biosynthesis in Ganoderma lucidum[J].FEMS Microbiology Letters, 2019, 366(23):fnaa015.
[33] ZHAO F Y, LIU X X, CHEN C, et al.Successive mycelial subculturing decreased lignocellulase activity and increased ROS accumulation in Volvariella volvacea[J].Frontiers in Microbiology, 2022, 13:997485.
[34] CAMPBELL K, VOWINCKEL J, KELLER M A, et al.Methionine metabolism alters oxidative stress resistance via the pentose phosphate pathway[J].Antioxidants and Redox Signaling, 2016, 24(10):543-547.
[35] ALI S, KHAN A S, MALIK A U.Postharvest L-cysteine application delayed pericarp browning, suppressed lipid peroxidation and maintained antioxidative activities of litchi fruit[J].Postharvest Biology and Technology, 2016, 121:135-142.
[36] ROS R, MU OZ-BERTOMEU J, KRUEGER S.Serine in plants:Biosynthesis, metabolism, and functions[J].Trends in plant science, 2014, 19(9):564-569.
OZ-BERTOMEU J, KRUEGER S.Serine in plants:Biosynthesis, metabolism, and functions[J].Trends in plant science, 2014, 19(9):564-569.
[37] 梁淑轩, 孙汉文.石墨炉原子吸收光谱法分析药用植物中微量营养元素的含量[J].光谱学与光谱分析, 2002, 22(5):847-849.
LIANG S X, SUN H W.Determination of six nutritional elements in Chinese herbal medicines by graphite furnace atomic absorption spectrometry[J].Spectroscopy and Spectral Analysis, 2002(5):847-849.
[38] YAN J J, ZHANG L, WANG R Q, et al.The sequence characteristics and expression models reveal superoxide dismutase involved in cold response and fruiting body development in Volvariella volvacea[J].International Journal of Molecular Sciences, 2015, 17(1):34.
[39] POURSAEID N, AZADBAKHT A, BALALI G R.Improvement of zinc bioaccumulation and biomass yield in the mycelia and fruiting bodies of Pleurotus florida cultured on liquid media[J].Applied biochemistry and biotechnology, 2015, 175(7):3387-3396.
[40] 高昆, 冀中英.铜胁迫对粉葛幼苗生长及生理指标的影响[J].陕西农业科学, 2021, 67(10):1-8.
GAO K, JI Z Y.Effect of copper stress on growth and physiological indexes of Pueraria thomsonii Benth seedlings[J].Shaanxi Journal of Agricultural Sciences, 2021, 67(10):1-8.
[41] 刘丹阳, 刘钰, 於丽华, 等.锰对甜菜幼苗形态及生理生化指标的影响[J].黑龙江大学工程学报, 2021, 12(1):90-96.
LIU D Y, LIU Y, YU L H, et al.Effects of manganese on the morphological, physiological and biochemical indexes of sugar beet seedlings[J].Journal of Engineering of Heilongjiang University, 2021, 12(1):90-96.