牛肝营养丰富,含有多种矿物质和活性物质等,易被吸收利用,具有增强人体免疫力、预防贫血、癌症等功效,是一种优质的资源[1-2]。随着消费者生活水平的提高,人们对牛肝产品提出了更高的要求。牛肝腥味物质的存在给牛肝加工利用带来了不利的影响[3-4]。因此,牛肝的脱腥技术成为制约牛肝深加工利用的重要因素。
目前的脱腥方法,主要有物理法、化学法、生物法和复合法。化学脱腥法易产生化学残留,故不宜在食品中应用[5]。物理脱腥技术主要分为:超滤法、掩盖法、辐照法、微胶囊技术等,其中,掩盖法较为常见,主要通过干扰离子的存在状态来去除腥味。周若琳等[6]研究发现,鱼与生姜提取液料液比为1∶3,15 ℃浸泡30 min时,对草鱼的去腥效果最佳。生物脱腥法是利用微生物将腥味化合物代谢转化为无腥味化合物,被认为是一种较低成本脱腥的方法[7]。于学萍等[8]研究表明,酵母添加量为 1.2%,在35 ℃下发酵45 min,对豪猪肝的脱腥效果最好。段振华等[9]研究表明,罗非鱼碎肉酶解液以2.5%酵母,在35 ℃发酵30 min;然后加入2.5% β-环糊精,在65 ℃反应30 min复合法处理的脱腥效果最好。在超声处理中,超声的空化效应会破坏腥味物质与肉的结合,加速腥味物质的脱除[10]。张坦等[11]对牡蛎ACE肽采用壳聚糖进行脱腥研究,可达到显著的脱腥脱脂和杂质去除效果。然而,关于探究牛肝脱腥的技术缺乏系统性的报道,且超声+多糖复合法脱腥对于脱腥效果尚未见报道。
本研究以新鲜牛肝为研究对象,分别采用葱-姜提取液掩盖法、面包酵母发酵法、活性干酵母+β-环糊精复合法及超声+壳聚糖复合法对牛肝进行脱腥处理,采用感官评价协同硫代巴比妥酸(thiobarbituric acid,TBA)值作为牛肝脱腥效果的评价指标,并以GC-MS技术对不同处理的牛肝进行挥发性成分分析,解析牛肝样品间挥发性组成差异,以期对牛肝原料腥味的风味组成进行探究,为牛肝的风味改善技术和深加工利用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
新鲜牛肝,购自张掖市万禾草畜产业科技开发有限责任公司,源于随机选取生长发育良好、健康无病、3岁体重质量(550±50) kg左右的西门塔尔杂交肉牛6头。
无水乙醇、氯化钠、三氯乙酸等均为分析纯,成都科隆化工厂;仲-辛醇(色谱纯,GC≥99.5%),北京索莱宝科技有限公司;面包酵母、高活性干酵母,安琪酵母股份有限公司;β-环糊精、壳聚糖,上海源叶生物科技有限公司。
1.2 仪器与设备
AUW220D电子天平,岛津仪器(苏州)有限公司;UV-6100S紫外可见分光光度计,上海美谱达仪器有限公司;WE-H4-21KR高速冷冻离心机,苏州威尔实验用品有限公司;HUAXI-1000D超声波破碎仪,上海华玺科学仪器有限公司;7890A-5975C气相色谱-质谱联用仪,美国安捷伦公司;HS-SPEM装置、50/30 μm二乙基苯/碳分子筛/聚二甲基硅萃取头,美国Supelco公司;OV-1701色谱柱,美国Agilent Technologies公司。
1.3 实验方法
1.3.1 样品采集及前处理
试验牛宰前均按照《牛羊屠宰产品品质检验规程》(GB 18393—2001),禁食24 h和禁水3 h处理后,通过宰前检验检疫合格后,依据《畜禽屠宰操作规程 牛》(GB/T 19477—2018)进行屠宰。屠宰后1 h内取样,用蒸馏水冲洗表面的血液,剔除筋膜外的脂肪,沥干水分后,放入聚乙烯包装袋内于-18 ℃条件下贮藏备用。
1.3.2 四种不同脱腥方法的条件
1.3.2.1 葱-姜提取液掩盖法脱腥
葱、姜提取液的制备:参考王珺等[12]的方法,并稍做修改。
葱、姜提取液掩盖法脱腥:采用葱-姜提取液掩盖法对牛肝脱腥处理,研究不同提取液配比(体积比3∶1~1∶3)、浸泡时间(20~40 min)和料液比(1∶1~1∶5)对牛肝脱腥效果的影响。
1.3.2.2 面包酵母发酵法脱腥
采用面包酵母对牛肝脱腥处理,研究不同添加量(0.6%~1.4%)、发酵温度(25~45 ℃)、发酵时间(30~50 min)对牛肝脱腥效果的影响。
1.3.2.3 活性干酵母+β-环糊精复合法脱腥
采用活性干酵母+β-环糊精复合对牛肝脱腥处理,研究活性干酵母不同添加量(0.6%~1.4%)、发酵温度(20~40 ℃)、时间(30~50 min)、β-CD的添加量(0.6%~1.4%)和反应温度(25~45 ℃)对牛肝脱腥效果的影响。
1.3.2.4 超声+壳聚糖复合法脱腥
壳聚糖溶液的制备:参考张坦等[11]的方法。
研究不同的超声功率(200~600 W)、超声时间(4~12 min)、料液比(1∶8~1∶12)、壳聚糖溶液(3 g/L)与牛肝质量比(1∶1~1∶5)和反应时间(25~45 min)对牛肝脱腥效果的影响。
1.3.3 TBA值的测定
参考 FIEGO等[13]的方法并稍做修改。
1.3.4 腥味值
参考于学萍等[8]的方法并稍做修改。由10位食品专业的感官评价员(5男、5女)组成评定小组,将腥味程度分成6个等级,以双蒸水作为参照(分值为0分)。腥味值为10人评定小组的平均得分。具体评价标准见表1。
表1 牛肝脱腥值感官评价表
Table 1 Sensory evaluation of bovine liver deodorization value

腥味值/分腥味程度0无腥味1~2略有腥味3~4腥味较弱5~6腥味一般7~8腥味偏重9~10腥味很重
1.3.5 挥发性风味物质的测定
参考师希雄等[14]的方法并稍做修改,准确称取10 g样品、2 g NaCl于40 mL配有硅胶密封垫圈的玻璃瓶内,在90 ℃水浴锅中平衡10 min。然后插入SPEM萃取头,顶空萃取30 min,萃取完成后,于250 ℃的GC-MS进样口解吸5 min。
GC条件:使用毛细管色谱柱 OV-1701(30 m×0.25 mm,0.25 μm),起始温度35 ℃,保持5 min,以5 ℃/min 的速率上升至250 ℃保持10 min,运行58 min;载气(He),流速1.0 mL/min,不分流进样。
MS条件:EI 离子源:70 eV,离子源温度230 ℃,传输线温度为250 ℃,四级杆温度为150 ℃,扫描质量m/z为40~600,全扫描模式。
1.3.6 挥发性风味物质分析
定性分析:根据所得谱图与NIST 14 谱库检索比对定性分析。
定量分析:采用内标法进行半定量分析,内标为2-辛醇,质量浓度为88.01 μg /L。风味物质含量计算如公式(1)所示:
挥发性物质含量/(μg/kg)=
(1)
1.3.7 相对气味活度值(relative ordor activity value,ROAV)计算
参考刘登勇等[15]的方法,ROAV值计算如公式(2)所示:
(2)
式中:Ci和Cmax分别表示各挥发性组分和对样品总体风味贡献最大挥发性组分的相对含量,%;Ti和Tmax表示各挥发组分和对样品总体风味贡献最大组分的挥发性组分的感觉阈值,μg/L。
1.3.8 感官评价
参考ZHU等[16]研究并略作修改。采用描述性感官分析方法,从食品科学与工程学院招募了10 名成员(5名男性,5名女性,20~30 岁),均通过了符合ISO 8586—1标准(1993)的筛选测试。在培训后,“酯味”、“果味”、“草味”、“金属味”和“异味”被确定为5种感官属性的描述词。这5 种被定义为感官属性的参照物如下:酯味(14.42 g/L 己酸乙酯溶液)、水果味(切碎的橘子、柠檬、椰子和黄瓜)、青草味(新割的青草)、金属味(0.10%氯化钾溶液)、和异味(1.0%丙二醇中的二甲基二硫化物)。这些属性按10分制进行评价(从最低强度0到最高强度10)。所有的样品都以一式三份进行评估。
1.4 数据分析与处理
所有实验均至少3次重复,所有数据采用Microsoft Office Excel 2019和SPSS 20.0软件进行处理和显著性分析,用Origin 2021软件进行绘图,所有数据以![]() 表示。
表示。
2 结果与分析
2.1 葱-姜提取液掩盖法脱腥
由表2可知,随着葱-姜提取液配比、浸泡时间和料液比的逐渐增加,TBA值和腥味值均呈先下降后上升的趋势,当葱-姜提取液的配比为1∶1(体积比)、浸泡时间为30 min和料液比为1∶3时,TBA值和腥味值均达到最小值。这与周若琳等[6]认为生姜提取液以固液比1∶3浸泡30 min,对草鱼的去腥效果最佳结果一致。掩盖法是采用葱、姜中的有机成分与腥味物质反应,达到去腥增香的作用。但当浸泡时间过长或料液比过高时,TBA值和腥味值会随之增大,这可能是由于其中的有机成分逐渐减少,与腥味物质相互作用减弱或活性降低,不能很好地脱除或掩盖腥味。
表2 葱-姜提取液对牛肝脱腥效果的影响
Table 2 The effect of shallot-ginger extract on the deodorization effect of bovine liver
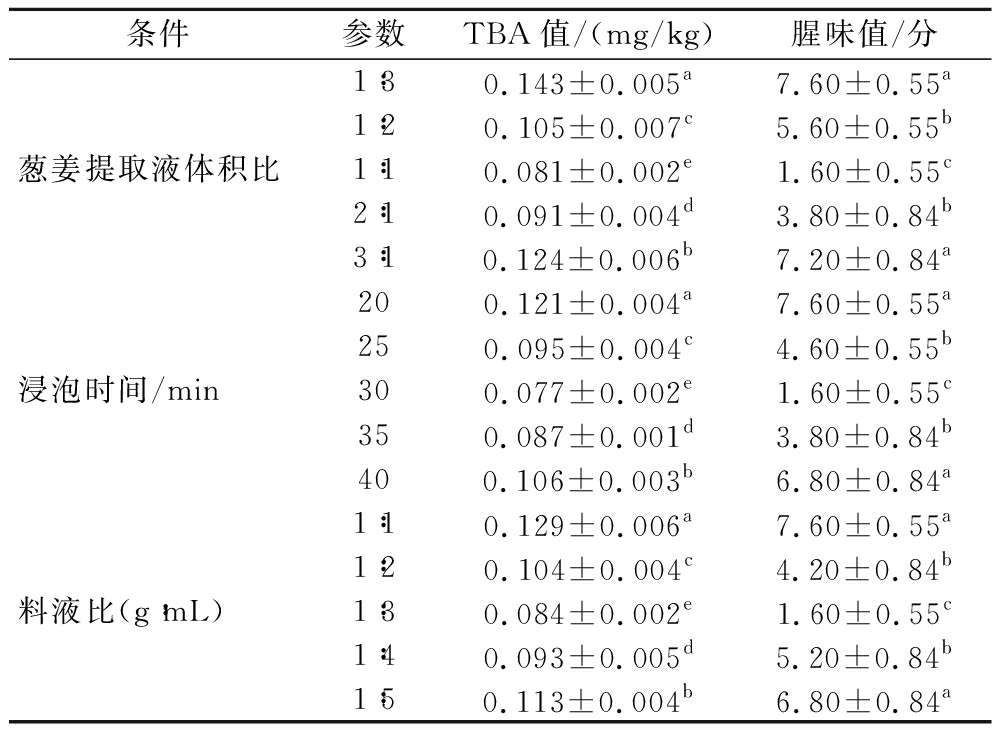
条件参数TBA值/(mg/kg)腥味值/分1∶30.143±0.005a7.60±0.55a1∶20.105±0.007c5.60±0.55b葱姜提取液体积比1∶10.081±0.002e1.60±0.55c2∶10.091±0.004d3.80±0.84b3∶10.124±0.006b7.20±0.84a200.121±0.004a7.60±0.55a250.095±0.004c4.60±0.55b浸泡时间/min300.077±0.002e1.60±0.55c350.087±0.001d3.80±0.84b400.106±0.003b6.80±0.84a1∶10.129±0.006a7.60±0.55a1∶20.104±0.004c4.20±0.84b料液比(g∶mL)1∶30.084±0.002e1.60±0.55c1∶40.093±0.005d5.20±0.84b1∶50.113±0.004b6.80±0.84a
注:同列小写字母不同表示差异显著(P<0.05),下同。
2.2 面包酵母发酵法脱腥
由表3可知,随着酵母添加量的逐渐增加,TBA值和腥味值呈先下降后上升的趋势,当酵母添加量为1.0% 时,TBA值和腥味值均达到最小值,与于学萍等[8]实验结果一致。当酵母添加量过高时,易产生异味;过低时,不能充分与腥味物质发生反应,从而达不到脱腥效果。随着发酵温度的逐渐升高,TBA值和腥味值呈先下降后上升的趋势,当酵母发酵温度为35 ℃时,TBA值和腥味值均达到最小值,与付湘晋[17]实验结果一致,这是因为酵母发酵需要适宜的温度,温度过低酵母活性受到抑制,温度过高时酵母活性受到破坏而导致脱腥效果变差。随着发酵时间的延长,TBA值和腥味值呈先下降后上升的趋势,当酵母发酵时间为40 min时,TBA值和腥味值均达到最小值。当发酵时间大于40 min时,则使酵母灭活或过度发酵导致异味物质增加而不是减少[18]。综上可知,牛肝酵母脱腥的最佳工艺为:酵母添加量为1.0%、发酵温度为35 ℃、发酵时间为40 min。
表3 面包酵母对牛肝脱腥效果的影响
Table 3 Effect of baker′s yeast on the deodorization effect of bovine liver

条件参数TBA值/(mg/kg)腥味值/分0.60.137±0.006a7.00±0.71a0.80.100±0.006b4.80±0.84b酵母添加量/%1.00.063±0.007c1.40±0.55d1.20.074±0.005c3.60±0.55c1.40.110±0.006b5.40±0.55b250.115±0.006b6.80±0.84a300.080±0.006c4.40±0.55c发酵温度/℃350.074±0.005d1.40±0.55d400.085±0.007c3.60±0.55c450.110±0.008a5.40±0.55b300.122±0.003b6.60±0.55a350.101±0.006c4.20±0.84bc发酵时间/min400.081±0.006d1.40±0.55d450.094±0.007c3.40±0.55c500.133±0.004a5.00±0.71b
2.3 活性干酵母+β-环糊精复合法脱腥
由表4 可知,随着β-CD添加量、处理温度的增加,TBA值和腥味值均呈先降低后上升的趋势,当添加量为1.0%时,TBA值和腥味值均达到最小值,与林日高等[19]的研究结果一致;当处理温度为35 ℃时,TBA值和腥味值均达到最小值,故选择处理温度为35 ℃。活性干酵母+β-环糊精复合脱腥处理的TBA值和腥味值显著低于面包酵母发酵法(P<0.05),可能是由于在酵母的作用下腥味物质浓度降低;然后通过β-CD 的分子包埋作用,进一步降低了腥味物质的含量, 同时,包埋酵母本身气味和部分代谢产物, 达到了更好的脱腥效果。综上可知,牛肝活性干酵母+β-环糊精复合脱腥的最佳工艺为:酵母添加量为1.0%、发酵温度为35 ℃、发酵时间为40 min、β-环糊精添加量为1.0%、处理温度为35 ℃。
表4 活性干酵母+β-环糊精复合处理对牛肝脱腥效果的影响
Table 4 Effect of combined treatment of active dry yeast+β-CD on deodorization effect of bovine liver
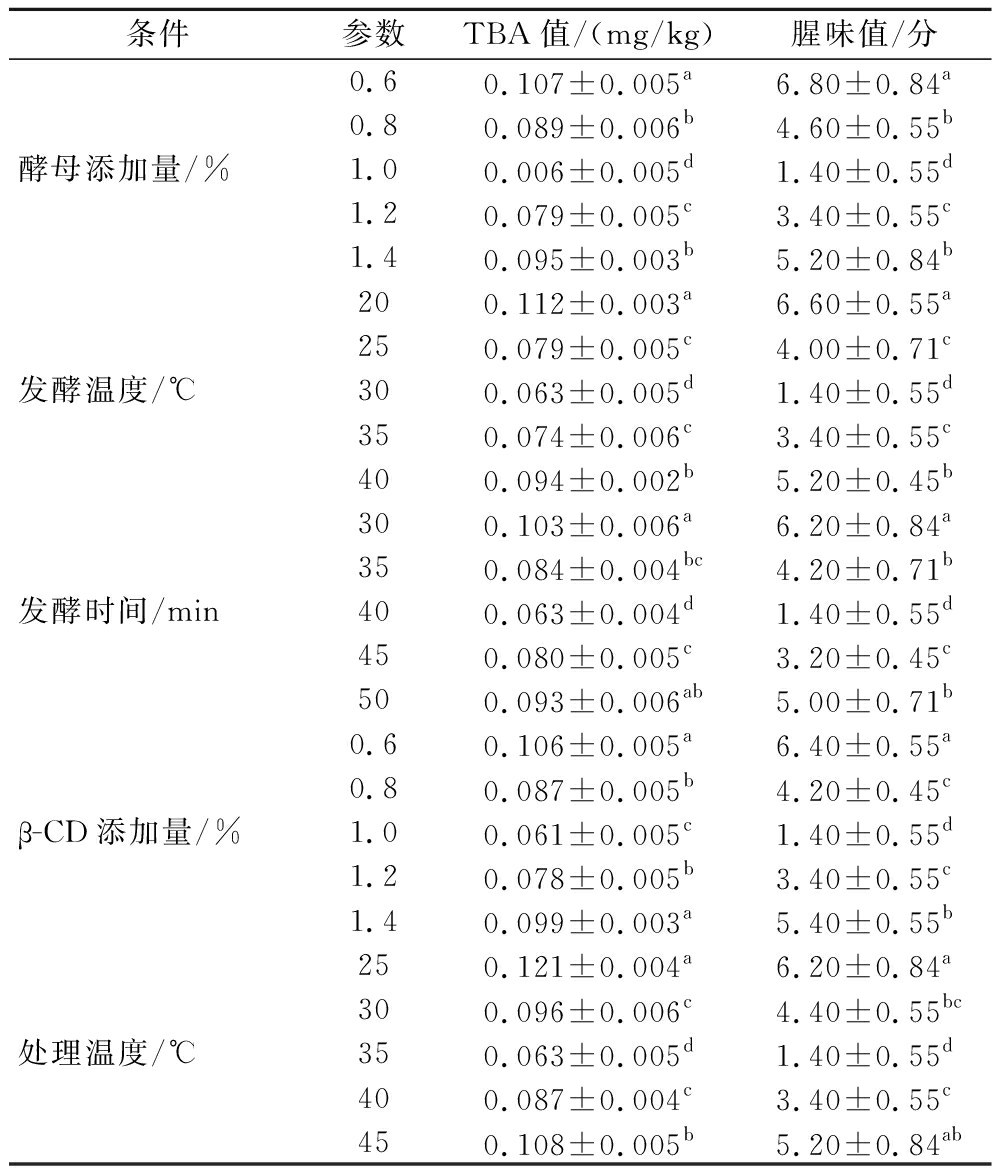
条件参数TBA值/(mg/kg)腥味值/分0.60.107±0.005a6.80±0.84a0.80.089±0.006b4.60±0.55b酵母添加量/%1.00.006±0.005d1.40±0.55d1.20.079±0.005c3.40±0.55c1.40.095±0.003b5.20±0.84b200.112±0.003a6.60±0.55a250.079±0.005c4.00±0.71c发酵温度/℃300.063±0.005d1.40±0.55d350.074±0.006c3.40±0.55c400.094±0.002b5.20±0.45b300.103±0.006a6.20±0.84a350.084±0.004bc4.20±0.71b发酵时间/min400.063±0.004d1.40±0.55d450.080±0.005c3.20±0.45c500.093±0.006ab5.00±0.71b0.60.106±0.005a6.40±0.55a0.80.087±0.005b4.20±0.45cβ-CD添加量/%1.00.061±0.005c1.40±0.55d1.20.078±0.005b3.40±0.55c1.40.099±0.003a5.40±0.55b250.121±0.004a6.20±0.84a300.096±0.006c4.40±0.55bc处理温度/℃350.063±0.005d1.40±0.55d400.087±0.004c3.40±0.55c450.108±0.005b5.20±0.84ab
2.4 超声+壳聚糖复合法脱腥
由表5 可知,随着超声功率、时间和料液比的增加,TBA值和腥味值均呈先下将后上升的趋势,当超声功率为500 W、超声时间为8 min时,TBA值和腥味值均最小。这可能是由于超声功率过高或时间过长,易导致水溶性蛋白溶出,营养价值降低;超声功率过低或时间过短,脱腥作用不明显。当料液比为1∶10时,TBA值和腥味值均最小。这是因为当料液比过小时,产品熟化较快,产品品质不易控制;若过多,则易造成能源浪费。随着壳聚糖添加量增加、反应时间的延长,TBA值和腥味值均呈先下降后上升的趋势,当添加量为1∶3时,TBA值和腥味值均最小,与张坦等[11]研究结果一致。当反应时间为35 min时,TBA值和腥味值均最小,当反应时间大于35 min时,TBA值差异不显著(P>0.05),故选择最佳反应时间为35 min。综上可知,牛肝超声+壳聚糖复合脱腥的最佳工艺为:超声功率为500 W、超声时间为8 min、料液比为1∶10、壳聚糖溶液(质量浓度3 g/L)与牛肝质量比1∶3、反应时间为35 min。
表5 超声+壳聚糖复合处理对牛肝脱腥效果的影响
Table 5 Effect of ultrasound + chitosan combination treatment on deodorization effect of bovine liver
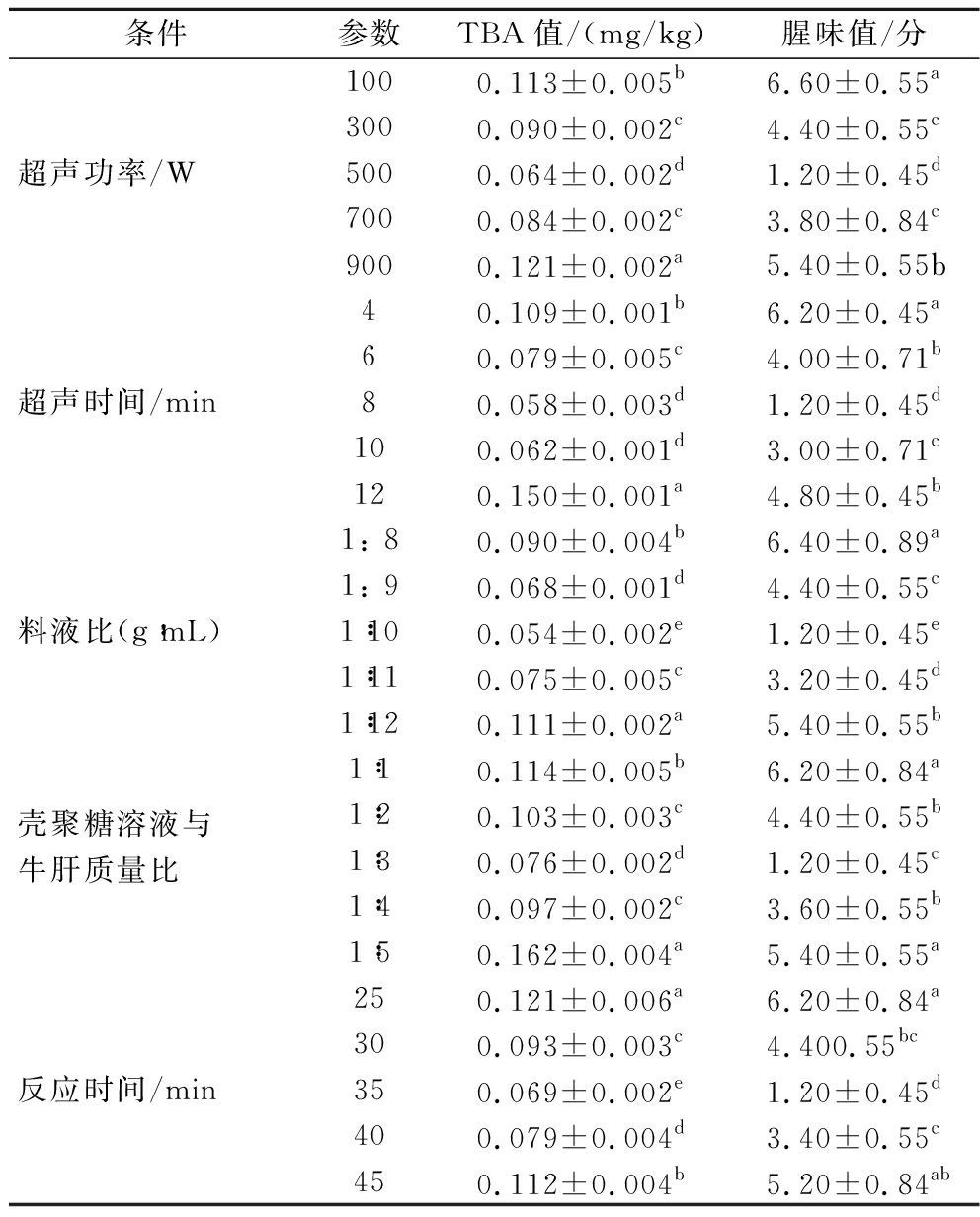
条件参数TBA值/(mg/kg)腥味值/分1000.113±0.005b6.60±0.55a3000.090±0.002c4.40±0.55c超声功率/W5000.064±0.002d1.20±0.45d7000.084±0.002c3.80±0.84c9000.121±0.002a5.40±0.55b40.109±0.001b6.20±0.45a60.079±0.005c4.00±0.71b超声时间/min80.058±0.003d1.20±0.45d100.062±0.001d3.00±0.71c120.150±0.001a4.80±0.45b1: 80.090±0.004b6.40±0.89a1: 90.068±0.001d4.40±0.55c料液比(g∶mL)1∶100.054±0.002e1.20±0.45e1∶110.075±0.005c3.20±0.45d1∶120.111±0.002a5.40±0.55b1∶10.114±0.005b6.20±0.84a壳聚糖溶液与1∶20.103±0.003c4.40±0.55b牛肝质量比1∶30.076±0.002d1.20±0.45c1∶40.097±0.002c3.60±0.55b1∶50.162±0.004a5.40±0.55a250.121±0.006a6.20±0.84a300.093±0.003c4.400.55bc反应时间/min350.069±0.002e1.20±0.45d400.079±0.004d3.40±0.55c450.112±0.004b5.20±0.84ab
综合4种不同的脱腥处理,超声处理后TBA值显著下降(P<0.05),可能归因于超声处理对蛋白质结构的影响和DLV蛋白表面还原位氨基酸残基的暴露,类似于超声处理的蛋白对肉制品脂肪氧化的延迟效应[20]。同时,壳聚糖还具有抑菌作用,在一定程度上可延长产品的贮藏期。
2.5 牛肝及脱腥后挥发性风味物质的组成分析
由图1 可知,原料和 4 种不同脱腥方法处理的牛肝中分别检测到35、23、24、28、20 种挥发性风味物质。在原料中检测到的挥发性风味物质主要是醛类、酸类、醇类、酯类和酮类,含量分别为47.50、5.34、10.71、102.92、12.36 μg/kg;葱-姜提取液掩盖法检测到的风味物质主要是醛类、酸类、醇类和酯类,含量分别为9.36、11.33、7.08、19.53 μg/kg;面包酵母发酵法检测到的风味物质主要是醛类、酯类和酮类,含量分别为24.13、48.75、4.86 μg/kg;活性干酵母+β-CD复合法检测到的风味物质主要是醛类、酯类和酮类,含量分别为21.44、67.84、11.71 μg/kg;超声+壳聚糖复合法检测到的风味物质主要是醛类、酯类和酮类,含量分别为12.03、46.22、3.47 μg/kg。相较于原料,经4种不同脱腥处理的牛肝中醛类、醇类和酮类的含量均呈现下降趋势,但葱-姜提取液掩盖法处理的牛肝中的酸类含量略高于原料,这可能是由于葱、生姜原料中含有较高的草酸,且经其他3种不同脱腥处理的牛肝中均未检出酸类物质。

图1 牛肝及脱腥后挥发性风味物质组成及含量
Fig.1 Composition and content of volatile flavor substances in bovine liver and after deodorization
2.6 牛肝及脱腥后挥发性风味物质的含量变化
如图2所示,所有样品中共检测出45种挥发性风味物质,主要由醛类、酸类、醇类、烃类、酯类等化合物组成。醛类物质主要是由多种不饱和脂肪酸氧化产生的氢过氧化物裂解形成的,其阈值较低,且研究发现在低阈值浓度的时醛类物质具有加和作用[21-22]。在原料中共检出11种醛类,其中正己醛、苯甲醛、E-2-辛烯醛、壬醛和癸醛为主要成分,正己醛、苯甲醛、E-2-辛烯醛、壬醛和癸醛等也被认为是肉制品主要的腥味物质[23-24]。同时,经4种不同的方法脱腥后牛肝中正己醛、苯甲醛、E-2-辛烯醛、壬醛和癸醛含量均较少,尤其经超声+壳聚糖复合法脱腥后的牛肝中E-2-辛烯醛、壬醛、癸醛、反式-2,4-癸二烯醛等均未检出。

图2 挥发性风味物质含量变化热图及聚类分析
Fig.2 Heatmap and cluster analysis of volatile flavor compounds
酸类物质主要是由肌肉中脂肪酸甘油酯和磷脂酶解或加热氧化产生,这也是造成肉制品腥味的主要原因之一[25]。在原料中共检出5种酸类,分别为丁酸、己酸、辛酸、2-甲基戊酸和壬酸,丁酸、己酸、辛酸等,呈强烈的汗水味、青草味。经4种不同的方法脱腥后牛肝中,仅在葱-姜提取液掩盖法处理的牛肝中检测到草酸,这可能是由于葱、生姜原料中含有草酸所致,经其他3种方法脱腥后的牛肝中均未检测到酸类物质。醇类物质主要由肌肉中的亚油酸被脂肪氧合酶和氢过氧化物酶降解产生,其阈值一般较高,具有提升产品风味的作用[26]。在原料中共检出3种醇类,分别为正己醇、苯乙醇、壬醇,仅掩盖法处理的牛肝中正己醇、壬醇的含量显著降低,在其他3种方法中均未检出;苯乙醇的含量变化不显著。烃类物质的阈值较高,对腥味的产生贡献很小,但因其种类繁多,且部分烯烃类化合物在一定条件下可形成醛或酮,也是产生腥味的潜在因素[27],与原料相比,经4种不同的方法脱腥后牛肝中,除超声+壳聚糖复合法处理的牛肝中烃类含量显著降低(P<0.05),其他3种处理的牛肝与新鲜原料的牛肝无显著差异(P>0.05)。酯类物质是由游离脂肪酸与脂肪氧化生成的醇相互作用生成,大多具有果香味。在原料中共检出8种酯类,酯类在所有风味成分中含量最高,这可能与牛肝在加工过程中产生强烈的甘甜味有关。经4种不同的方法脱腥后牛肝中,仅有葱-姜提取液掩盖法处理的牛肝中酯类物质的含量降低,这可能与提取液中强烈的辛辣味有关,与其他3种方法脱腥后的牛肝中酯类物质的含量和种类无显著差异(P>0.05)。
2.7 牛肝及脱腥后挥发性风味物质的ROAV
ROAV可以衡量挥发性风味物质中对整体风味物质由主要贡献的物质。ROAV≥1 的物质为关键风味物质,0.1≤ROAV<1的物质对整体风味有重要的修饰作用[28]。由表6可知,正己醛、(E,E)-2,4-壬二烯醛、E-2-辛烯醛、壬醛、癸醛、十二醛、壬醇、对甲酚、己酸乙酯对原料整体风味贡献较大,这些物质主要具有青草味、脂肪味、坚果味、蜡质味、鲜花味、水果味、柑橘味及刺激性烟味。根据ROAV和描述性气味,推断正己醛、(E,E)-2,4-壬二烯醛、E-2-辛烯醛、壬醛、癸醛、十二醛、壬醇可能是造成牛肝产生腥味的主要物质。掩盖法处理的牛肝,正己醛、(E,E)-2,4-壬二烯醛、E-2-辛烯醛、壬醛、癸醛、十二醛、壬醇、己酸乙酯对整体风味贡献较大,但含量和ROAV值与原料相比均减小,对甲酚未检出。发酵法处理的牛肝,正己醛、(E,E)-2,4-壬二烯醛、壬醛、癸醛、反式-2,4-癸二烯醛、十二醛、对甲酚、己酸乙酯对样品整体风味贡献较大,但含量和ROAV值与原料、掩盖法处理的样品相比均减小,且E-2-辛烯醛、壬醇未检出,表明发酵法比掩盖法对牛肝脱腥更有效果。活性干酵母+β-CD复合法处理的牛肝,正己醛、E-2-辛烯醛、壬醛、癸醛、反式-2,4-癸二烯醛、十二醛、苯乙醛、对甲酚、己酸乙酯、2-正戊基呋喃对整体风味贡献较大,含量和ROAV相较发酵法脱腥的牛肝均减小,说明脱腥效果优于发酵法,这与TBA值和腥味值结果一致。超声+壳聚糖复合法处理的牛肝,正己醛、十二醛、苯乙醛、苯乙醇、庚醇、己酸乙酯、辛酸乙酯对整体风味贡献较大,主要呈脂肪味、青草味、鲜花味、柑橘味、果香味等,含量和ROAV较原料和其他 3 种方法脱腥的牛肝均减少,(E,E)-2,4-壬二烯醛、E-2-辛烯醛、壬醛、癸醛、壬醇、对甲酚均未检出,这也说明超声+壳聚糖复合法对牛肝的脱腥效果和风味改善相更优于其他 3 种方法。
表6 牛肝及其脱腥后挥发性风味物质含量及ROAV
Table 6 Contents and ROAV of volatile flavor compounds in bovine liver before and after deodorization

中文名称分子式CAS号阈值/(μg/kg)气味描述含量/(μg/kg)ROAV新鲜原料葱-姜提取液掩盖法面包酵母发酵法酵母+β-CD复合法超声+壳聚糖复合法新鲜原料葱-姜提取液掩盖法面包酵母发酵法酵母+β-CD复合法超声+壳聚糖复合法正己醛C6H12O66-25-14.5青草、脂肪5.62±0.48a0.93±0.06d3.35±0.57b3.47±0.73b2.04±0.16c9.092.114.529.0764.17(E,E)-2,4-壬二烯醛C9H14O5910-87-20.09脂肪、蜡、青草0.42±0.04b0.88±0.06a0.14±0.02cNDND34.22100.009.63——苯甲醛C7H6O100-52-7350杏仁、焦糖3.96±0.57a3.44±0.26ab2.93±0.14bc2.83±0.13c0.78±0.06d0.080.100.050.100.32E-2-辛烯醛C8H14O2548-87-03青草、坚果、脂肪0.77±0.11ab0.65±0.07b0.45±0.04c0.86±0.06aND1.862.220.913.36—壬醛C9H18O124-19-61脂肪、柑橘、绿色1.42±0.25a0.45±0.13b0.64±0.16b1.51±0.09aND10.334.553.8717.71—癸醛C10H20O112-31-20.1鲜花、蜡1.37±0.73ab0.84±0.07b1.65±0.07a0.85±0.09bND100.0085.77100.00100.00—反式-2,4-癸二烯醛C10H16O25152-84-50.7油炸、蜡、脂肪ND0.88±0.06b1.26±0.14a1.44±0.10aND—12.8110.9524.24—十二醛C12H24O112-54-92百合、脂肪、柑橘1.08±0.15ab0.73±0.19bc1.37±0.23a0.87±0.41bc0.45±0.09c3.933.734.165.0931.87十一醛C11H22O112-44-7140油性、辛辣、甜味3.53±0.97a0.56±0.07b1.28±0.04b0.48±0.04bND0.180.040.060.04—苯乙醛C8H8O122-78-14鲜花、水果NDNDND1.60±0.28b2.82±0.15a———4.70100.00丁酸C4H8O2107-92-6240奶酪、汗水0.84±0.12NDNDNDND0.03————己酸C6H12O2142-62-13 000汗臭味1.37±0.19NDNDNDND0.03————辛酸C8H16O2124-07-2800汗水、奶酪1.50±0.34NDNDNDND0.01————正己醇C6H14O111-27-3250树脂、鲜花、绿色2.15±0.52a1.75±0.08bNDNDND0.060.07———苯乙醇C8H10O60-12-886玫瑰花2.45±0.57b3.26±0.18a1.46±0.11c1.24±0.10c1.65±0.09c0.210.390.100.172.72壬醇C9H20O143-08-82脂肪、绿色6.12±0.97a1.84±0.45bNDNDND22.279.37———庚醇C7H16O111-70-65.4蘑菇NDNDNDND0.25±0.05————6.53对甲酚C7H8O106-44-518药品、刺激性烟雾6.07±0.88aND4.96±0.07b4.61±0.19bND2.45—1.683.01—棕榈酸乙酯C18H36O2628-97-72 000蜡、果爵、奶油45.32±0.61a3.78±0.16c34.37±1.79bNDND0.160.020.10—0.13己酸乙酯C8H16O2123-66-01水果0.86±0.15a0.37±0.07b0.74±0.27ab0.54±0.26ab0.64±0.08ab6.233.764.516.2991.38辛酸乙酯C10H20O2106-32-126白兰地酒2.39±0.74aNDNDND0.64±0.10b0.67———3.502-正戊基呋喃C9H14O3777-69-35.8青豆、黄油NDNDND0.65±0.08ND———1.32—
注:每行上标字母不同代表差异显著,P<0.05;ND代表未检出;-表示无法计算。
2.8 感官评价
通过描述性感官评价对5种样品的酯味、水果味、青草味、金属味和异味5个呈香属性进行评价和比较,结果如图3所示。不同处理的牛肝样品具有不同的气味强度,其中原料牛肝较其他处理组这5种描述性气味存在显著差异(P<0.05)。原料表现出最弱的酯味和水果味及最强的异味、金属味和青草味,这往往可能是制约消费者选择牛肝原料作为食品原料的主要因素。掩盖法较原料酯味和水果味明显增强,而异味、金属味和青草味却明显减弱,这可能是由于提取液中的有机成分的作用,使得原料的风味得到改善;发酵法相较掩盖法对牛肝整体风味有较大程度的改善,这可能是由于酵母含有多种酶能与腥味物质反应,从而达到脱腥效果;但单一的酵母发酵只能使部分腥味物质发生转化,结合 β-CD可进一步降低腥味物质的含量,还可以包埋酵母本身气味和部分代谢产物, 因此,酵母+β-CD复合法对牛肝的脱腥效果优于单一发酵法;超声+壳聚糖复合法表现出最强的酯味和水果味及最弱的青草味和异味,金属味未检出,这主要是由于超声过程中的空化效应与壳聚糖脱腥脱脂的作用相结合,使得牛肝的整体风味得到最大程度的改善,最容易被小组成员接受。

图3 不同脱腥处理对牛肝的感官评价雷达图
Fig.3 Radar plot of sensory evaluation of bovine liver by different deodorization treatments
3 结论
采用葱-姜提取液掩盖法、面包酵母发酵法、活性干酵母+β-CD复合法和超声+壳聚糖复合法对牛肝进行脱腥处理,以感官评价协同TBA值为评价指标,确定在超声功率为500 W、超声时间为8 min、料液比为1∶10(g∶mL)、壳聚糖溶液(质量浓度3 g/L)与牛肝质量比1∶3、反应时间为35 min时对牛肝的脱腥效果最好,且对牛肝的脱腥效果依次为:超声+壳聚糖复合法>活性干酵母+β-CD复合法>面包酵母发酵法>葱-姜提取液掩盖法。牛肝腥味物质可能是正己醛、(E,E)-2,4-壬二烯醛、E-2-辛烯醛、壬醛、癸醛、十二醛、壬醇等。因此,超声+壳聚糖复合法对牛肝的脱腥效果最佳,可为牛肝的风味改善和深加工利用提供了理论参考。
[1] ERCANP, EL S N.Changes in content of coenzyme Q10 in beef muscle, beef liver and beef heart with cooking and in vitro digestion[J].Journal of Food Composition and Analysis, 2011, 24(8):1136-1140.
[2] LAI J F, DOBBS J, DUNN M A.Evaluation of clams as a food source of iron:Total iron, heme iron, aluminum, and in vitro iron bioavailability in live and processed clams[J].Journal of Food Composition and Analysis, 2012, 25(1):47-55.
[3] MULLEN A M,  LVAREZ C,
LVAREZ C, ![]() M, et al.Classification and target compounds.In:Galanakis C, editor.Food Waste Recovery:Processing Technologies and Industrial Techniques[M].Amsterdam:Elsevier, Academic Press (2015).
M, et al.Classification and target compounds.In:Galanakis C, editor.Food Waste Recovery:Processing Technologies and Industrial Techniques[M].Amsterdam:Elsevier, Academic Press (2015).
[4] 郭兆斌,郭文瑞,曹晖,等.不同牛种肝脏挥发性化合物含量分析[J].中国畜牧杂志,2015,51(S1):164-167.
GUO Z B, GUO W R, CAO H, et al.Analysis of volatile compounds in liver of different cattle breeds[J].Chinese Journal of Animal Science, 2015, 51(S1):164-167.
[5] 冯怡,汪薇,任文彬,等.鱼制品脱腥方法的研究进展[J].中国酿造,2014, 33(12):16-18.
FENG Y, WANG W, REN W B, et al.Research progress on deodorization of fish products[J].China Brewing, 2014, 33(12):16-18.
[6] 周若琳,胡盛本,姚磊,等.草鱼不同部位挥发性成分分析及生姜脱除草鱼腥味物质的工艺研究[J].食品工业科技,2017, 38(20):177-182.
ZHOU R L, HU S B, YAO L, et al.Volatiles from different parts of grass carp and the process of ginger in removing fishy smell[J].Science and Technology of Food Industry, 2017, 38(20):177-182.
[7] ARORA A, DAMODARAN S.Competitive binding of off-flavor compounds with soy protein and β-cyclodextrin in a ternary system:a model study[J].Journal of the American Oil Chemists′ Society, 2010, 87(6):673-679.
[8] 于学萍,童群义.发酵法脱腥对豪猪肝挥发性风味的影响[J].食品与发酵工业,2016,42(2):41-47.
YU X P, TONG Q Y.Effect of fermentation method deodorization on volatile flavor of porcupine liver[J].Food and Fermentation Industries, 2016, 42(2):41-47.
[9] 段振华,易美华,汪菊兰,等.罗非鱼碎鱼肉酶解液的脱腥技术及其机理探讨[J].食品工业科技,2007(2):65-67.
DUAN Z H, YI M H, WANG J L, et al.Deodorization technology of tilapia minced fish enzymatic solution and its mechanism[J].Science and Technology of Food Industry, 2007(2):65-67.
[10] WANG T, NING Z X, WANG X P, et al.Effects of ultrasound on the physicochemical properties and microstructure of salted‐dried grass carp (Ctenopharyngodon idella)[J].Journal of Food Process Engineering, 2018, 41(1):e12643.
[11] 张坦,梁山泉,杨敏,等.壳聚糖对牡蛎ACE抑制肽的脱腥工艺研究[J].食品研究与开发,2019,40(8):114-120.
ZHANG T, LIANG S Q, YANG M, et al.Study on the depurination process of oyster ACE inhibitory peptides by chitosan[J].Food Research and Development, 2019, 40(8):114-420.
[12] 王珺,吴晓,霍乃蕊.大蒜、生姜复配提取液抑菌防腐及其对果蔬保鲜效果的研究[J].现代农业科技,2011(2):363;367.
WANG J, WU X, HUO N R.Study on The antimicrobial and antiseptic effects of the extraction mixture from garlic and ginger and its effect of fresh-keeping on fruits and vegetables[J].Modern Agricultural Science and Technology, 2011(2):363;367.
[13] FIEGO D P L, SANTORRO P, MACCHIONI P, et al.The effect of dietary supplementation of vitamins C and E on the α-tocopherol content of muscles, liver and kidney, on the stability of lipids, and on certain meat quality parameters of the longissimus dorsi of rabbits[J].Meat Science, 2004, 67(2):319-327.
[14] 师希雄,魏晋梅,田甲春,等.应用HS-SPME和GC/MS技术检测陇西腊肉中的风味物质[J].食品与发酵工业,2012,38(5):176-179.
SHI X X, WEI J M, TIAN J C, et al.Application of HS-SPME and GC/MS techniques for the determination of flavor substances in Longxi bacon[J].Food and Fermentation Industries, 2012, 38(5):176-179.
[15] 刘登勇,周光宏,徐幸莲.确定食品关键风味化合物的一种新方法:“ROAV”法[J].食品科学,2008(7):370-374.
LIU D Y, ZHOU G H, XU X L.“ROAV” method:A new method for determining key odor compounds of rugao Ham[J].Food Science, 2008(7):370-374.
[16] ZHU Y Z, KLEE H J, SARNOSKI P J.Development and characterization of a high quality plum tomato essence[J].Food Chemistry, 2018,267:337-343.
[17] 付湘晋.白鲢鱼脱腥及其低盐鱼糜制备的研究[D].无锡:江南大学, 2009.
FU X J.Removing the off-flavor of silver carp and the preparation of low salt surimi[D].Wuxi:Jiangnan University, 2009.
[18] GAO R C, LI X, LIU H J, et al.Optimization of removal of off-odor in mullet (Channa argus) head soup by yeast using response surface methodology and variations of volatile components during fermentation[J].Journal of Food Processing and Preservation, 2021, 45(11):e15920.
[19] 林日高,潘玉华.鳙鱼蛋白水解液脱腥效果研究[J].中国调味品,2014,39(6):5-8.
LIN R G, PAN Y H.Study on deodorization effect of protein hydrolysates of bighead carp[J].China Condiment, 2014, 39(6):5-8.
[20] RODRIGUEZ-TURIENZO L, COBOS A, DIAZ O.Effects of edible coatings based on ultrasound-treated whey proteins in quality attributes of frozen Atlantic salmon (Salmo salar)[J].Innovative Food Science &Emerging Technologies, 2012, 14:92-98.
[21] MEYNIER A, NOVELLI E, CHIZZOLINI R, et al.Volatile compounds of commercial Milano salami[J].Meat Science, 1999, 51(2):175-183.
[22] CAYHAN G G, SELLI S.Characterization of the key aroma compounds in cooked grey mullet (Mugil cephalus) by application of aroma extract dilution analysis[J].Journal of Agricultural and Food Chemistry, 2011, 59(2):654-659.
[23] PURRIO S L, BERM
S L, BERM DEZ R, FRANCO D, et al.Development of volatile compounds during the manufacture of dry-cured “Lacón,” a spanish traditional meat product[J].Journal of Food Science, 2011, 76(1):C89-C97.
DEZ R, FRANCO D, et al.Development of volatile compounds during the manufacture of dry-cured “Lacón,” a spanish traditional meat product[J].Journal of Food Science, 2011, 76(1):C89-C97.
[24] 周慧敏,赵冰,吴倩蓉,等.黑白胡椒腊肠贮藏期中气味活性物质演变及异味分析[J].食品科学,2020, 41(24):162-171.
ZHOU H M, ZHAO B, WU Q R, et al.Changes in odor-active compounds and analysis of off-flavor compounds in Chinese sausage added with black and white pepper during storage[J].Food Science, 2020, 41(24):162-171.
[25] 杨媛丽,沙坤,孙宝忠,等.不同养殖模式对牦牛背最长肌挥发性风味物质及脂肪酸组成的影响[J].肉类研究,2020, 34(4):46-52.
YANG Y L, SHA K, SUN B Z, et al.Effects of different feeding systems on volatile flavor and fatty acid composition of yak longissimus dorsi[J].Meat Research, 2020, 34(4):46-52.
[26] MA Q L, HAMID N, BEKHIT A E D, et al.Evaluation of pre-rigor injection of beef with proteases on cooked meat volatile profile after 1 day and 21 days post-mortem storage[J].Meat Science, 2012, 92(4):430-439.
[27] 杨华,娄永江,杨震峰.GC-MS法分析养殖大黄鱼脱腥前后挥发性成分的变化[J].中国食品学报,2008,8(3):147-151.
YANG H, LOU Y J, YANG Z F.Analysis of volatile compounds of cultured and deodorized pseudosciaena crocea by chromatography-mass spectrometry[J].Journal of Chinese Institute of Food Science and Technology, 2008,8(3):147-151.
[28] OLIVARES A, NAVARRO J L, FLORES M.Establishment of the contribution of volatile compounds to the aroma of fermented sausages at different stages of processing and storage[J].Food Chemistry, 2009, 115(4):1464-1472.