L-丝氨酸在医药、食品和化妆品等领域具有广泛的应用前景,是化学和材料领域最有吸引力的30个骨架化合物之一[1-2];然而L-丝氨酸却是世界氨基酸行业中工业化生产难度较大的氨基酸,与L-精氨酸、L-组氨酸、L-色氨酸并称为四大瓶颈氨基酸,市场价格居高不下(25~30万元人民币/t)。目前,酶法转化法、化学合成法、蛋白水解法是L-丝氨酸主要的3种生产方法。其中酶法转化法采用最为普遍,但因为前体昂贵(甘氨酸,2~3万元人民币/t)使其生产成本较高。化学合成法受限于产物分离困难和污染严重等问题[3]。蛋白水解法过程复杂且需要大量的酸碱液进行洗脱,洗脱液的处理需耗费大量的人力物力[4]。所以利用廉价的糖质原料发酵生产L-丝氨酸成为当前研究热点[1-4]。
利用廉价的糖质原料发酵生产L-丝氨酸的菌株有谷氨酸棒杆菌及大肠杆菌,谷氨酸棒杆菌是美国食品药品监督管理局(Food and Drug Administration,FDA)认可的生产食品及药品安全的菌株,所以利用谷氨酸棒杆菌发酵生产L-丝氨酸具有重要的研究意义。PETERS-WENDISCH等[5-6]在Corynebacterium glutamicum ATCC13032中敲除了3-磷酸甘油酸脱氢酶(3-phosphoglycerate dehydrogenase,PGDH)碳端的197个氨基酸,有效地解除了L-丝氨酸的反馈抑制;然后加强表达L-丝氨酸合成途径3个关键基因serA、serB和serC,同时弱化L-丝氨酸降解成甘氨酸途径关键基因glyA的表达,得到一株可以积累16 mmol/L L-丝氨酸的基因工程菌株。STOLZ等[7]研究发现丝氨酸羟甲基转移酶(serine hydroxymethyltransferase,SHMT)催化的L-丝氨酸流向甘氨酸的途径对菌株积累L-丝氨酸有重要作用,他们通过敲除调控叶酸合成途径中关键酶编码基因pabAB和pabC,降低了SHMT活性,得到的重组菌株L-丝氨酸产量达到36 g/L。
本研究团队以利用蔗糖的野生型谷氨酸棒杆菌SYPS-062为出发菌株,对该菌株进行多轮随机诱变得到菌株SYPS-062-33a[8]。在此基础上,利用基因工程手段提高L-丝氨酸产量,策略包括敲除及弱化L-丝氨酸反馈抑制和降解途径等,最终获得高产L-丝氨酸的谷氨酸棒杆菌A[9]。但当以葡萄糖为碳源时,谷氨酸棒杆菌A的L-丝氨酸产量与蔗糖为碳源时存在显著差异;探索谷氨酸棒杆菌A在不同碳源中生产L-丝氨酸的能力,挖掘提高L-丝氨酸产量的关键因素,可为加快L-丝氨酸工业化过程奠定基础。利用代谢组学可以定量分析菌株代谢产物的变化,揭示合成产物过程的关键代谢物的差异,为进一步提高目标产物的产量提供新思路。曹鹏等[10]利用比较代谢组学的分析方法揭示不同培养基条件下合成阿维菌素的关键代谢物,再通过理性优化发酵培养基,提高了阿维菌素产量。
本文采用GC-MS技术,利用比较代谢组学的方法分析谷氨酸棒杆菌A在葡萄糖和蔗糖为碳源时胞内代谢产物的差异;探究菌株在不同碳源培养条件下碳代谢途径[糖酵解途径(embden-meyerhof-parnas pathway,EMP pathway),三羧酸循环(tricarboxylic acid cycle, TCA cycle)]和氨基酸生物合成途径中相关代谢物的变化情况,挖掘L-丝氨酸合成的限制因素;在此基础上,提出理性添加关键代谢物发酵生产L-丝氨酸的策略,从而提高菌株生产L-丝氨酸的能力。
1 材料与方法
1.1 菌株
产L-丝氨酸的谷氨酸棒杆菌A为实验室前期构建并保藏[9]。
1.2 培养基及培养方法
1.2.1 培养基
LB培养基(g/L):酵母粉5,蛋白胨10,NaCl 10,琼脂粉20(固体)。
种子培养基(g/L)[9]:葡萄糖20,MgSO4·7H2O 0.5,(NH4)2SO4 10,脑心浸液37,K2HPO4 0.2,NaH2PO4 0.3。
发酵培养基(g/L)[9]:蔗糖(葡萄糖)100,MgSO4·7H2O 0.5,KH2PO4 3,(NH4)2SO4 30,MnSO4·H2O 0.02,FeSO4·7H2O 0.02,生物素5×10-5,盐酸硫胺素4.5×10-4,原儿茶酸0.03,CaCO3 60,葡萄糖分消后加入。
1.2.2 发酵方法
从保菌管中取少许菌液,于种子平板上划三区,再于30 ℃培养箱培养3 d,挑取单菌落在种子平板进行二次活化,活化后的菌落全部接种至种子液体培养基中,于30 ℃,120 r/min往复式摇床培养12~14 h,至对数生长期(生物量OD562=20~25),将种子液接种至发酵培养基中,使发酵培养基的初始OD562值为1,进行发酵,每隔12 h取样,发酵周期为120 h。
1.3 分析方法
1.3.1 生物量测定:
取适量的发酵液,用1 mol/L的盐酸稀释至适当倍数,采用紫外分光光度计于562 nm处测定OD562值作为生物量。
1.3.2 糖浓度测定
发酵液中蔗糖浓度利用HPLC进行测定[11]。采用Hypersil APS-2 (5 μm,4.6 mm×250 mm)色谱柱,示差折光检测器,流动相为75%的乙腈,柱温35 ℃,检测器温度40 ℃,流速1 mL/min。发酵液中葡萄糖浓度利用SBA-40型葡萄糖测定仪测定[9]。
1.3.3 氨基酸浓度测定
利用HPLC测定氨基酸浓度,HPLC程序参考文献[12]。
1.4 样品处理及GC-MS检测
GC-MS样品预处理及检测方法参考文献[13-15]。
1.5 数据处理
GC-MS所得到的数据导入MSD ChemStation软件,再利用R的XCMS程序得到质核比、保留时间峰面积等参数。对数据进行适当权重变换,再将处理后的数据导入SIMCA-P(v13.0)软件进行多元统计分析[主成分分析(principal component analysis, PCA)和偏最小二乘判别分析(partial least squares-discriminant analysis, PLS-DA)][16-17]。
2 结果与分析
2.1 谷氨酸棒杆菌A以蔗糖和葡萄糖为碳源时发酵表型的差异
将谷氨酸棒杆菌A分别接种于以蔗糖和葡萄糖为唯一碳源的培养基中,发酵培养120 h,每12 h取样,测定菌株发酵过程中的生物量、残糖浓度和主要氨基酸的浓度,发酵结果如图1及表1所示。
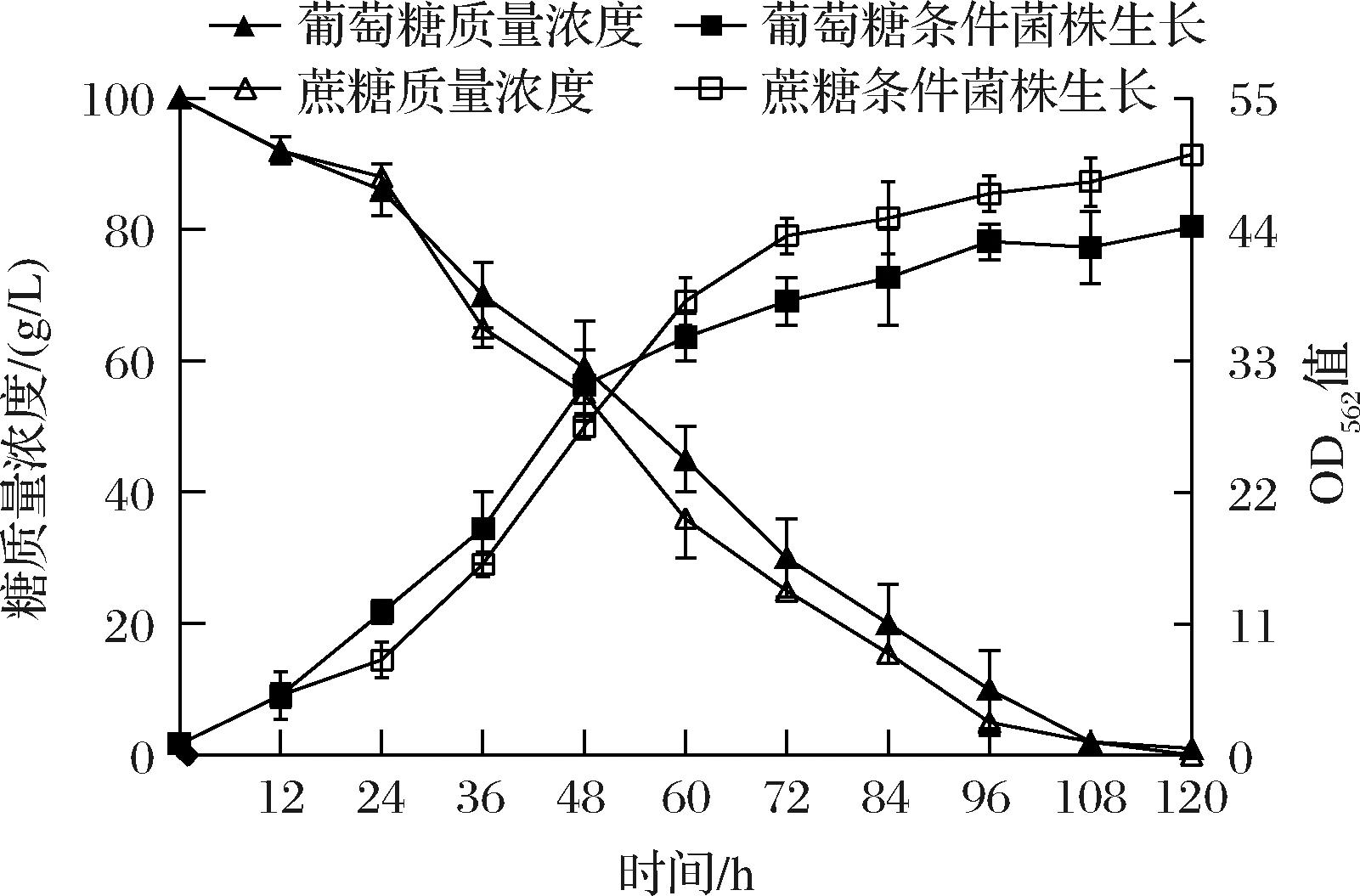
图1 谷氨酸棒杆菌A利用蔗糖和葡萄糖发酵过程 生长和残糖浓度曲线
Fig.1 Growth and sugar consumption of C.glutamicum A on sucrose or glucose
由图1可知,谷氨酸棒杆菌A以葡萄糖为碳源发酵时,在12~48 h期间表现出较快的生长速率,但48 h后菌株在蔗糖培养基中生长速率更高。当以葡萄糖为碳源发酵时生物量OD562值达到44.27,相比于蔗糖培养时的OD562值(50.30)下降12.0%。从图1还可以看出,菌株利用蔗糖的速率明显高于葡萄糖。此外,由表1可知,在蔗糖培养基中,菌株A发酵120 h,L-丝氨酸产量达到20.01 g/L;而以葡萄糖为碳源时,菌株A在发酵120 h L-丝氨酸产量为16.06 g/L,较蔗糖下降19.9%,副产物L-脯氨酸和L-丙氨酸变化不大,而L-缬氨酸在葡萄糖为碳源时提高62.7%。谷氨酸棒杆菌可以利用蔗糖和葡萄糖等作为碳源,KIEFER等[18]发现谷氨酸棒杆菌21526利用葡萄糖为碳源时生物量较高。NIE等[19]构建的谷氨酸棒杆菌SO30利用葡萄糖为碳源时生物量和L-鸟氨酸产量均较高。而我们以自然界筛选的谷氨酸棒杆菌SYPS-062为出发菌株,通过诱变及代谢工程改造后获得的谷氨酸棒杆菌A则以蔗糖为碳源时生物量和L-丝氨酸产量较高。为探讨谷氨酸棒杆菌A以蔗糖和葡萄糖为碳源时代谢过程中的差异,采用代谢组学方法进行下一步研究。
表1 菌株利用葡萄糖和蔗糖时胞外主要氨基酸积累情况 单位:g/L
Table 1 Extracellular accumulation of major amino acids in glucose and sucrose

碳源L-丝氨酸L-脯氨酸L-丙氨酸L-缬氨酸葡萄糖16.06±0.841.23±0.151.27±0.444.28±0.57蔗糖 20.01±0.701.21±0.061.24±0.302.63±0.35
2.2 基于GC-MS的谷氨酸棒杆菌A在不同碳源发酵过程代谢轮廓比较
采用GC-MS对谷氨酸棒杆菌A在以蔗糖和葡萄糖为碳源时的代谢图谱进行分析,共检测到171种胞内代谢物,对其中的81种物质进行了定性和定量分析。由图2-a可知,这些代谢物包括了糖类、氨基酸、脂肪酸、有机酸、磷酸化合物、多元醇、核苷酸类。图2-b为2种培养条件下代谢物随时间变化的热图,它直接显示了每一个代谢物的变化情况。由图2-b可知,在谷氨酸棒杆菌A在不同碳源发酵过程中细胞代谢图谱具有显著的差异。在蔗糖培养条件下,EMP途径中6-磷酸果糖、6-磷酸蔗糖等关键物质含量较高,而TCA循环的相关物质含量则较低,说明菌株在蔗糖培养条件下可能有更多的碳流向L-丝氨酸。
2.3 谷氨酸棒杆菌A在不同碳源发酵过程中代谢组差异分析
曹鹏等[10]和许娟等[20]分别利用代谢组学结合多元统计方法分析了阿维链霉菌和谷氨酸棒杆菌13032在不同培养条件下胞内代谢物的差异,并进一步通过发酵实验验证了改变胞内关键代谢物可以提高目标产物的产量。本文将谷氨酸棒杆菌A在以蔗糖和葡萄糖为碳源时的代谢组学数据进行PCA,获得PCA得分图(图3)。

a-GC-MS检测到的胞内代谢物分类;b-谷氨酸棒杆菌A以 蔗糖和葡萄糖为碳源时的热图
图2 谷氨酸棒杆菌A在以蔗糖和葡萄糖为碳源时的代谢图谱
Fig.2 Metabolic map of C.glutamicum A with sucrose and glucose as carbon sources
如图3-a所示,图中R2X是模型的可解释度,通常情况下,R2高于0.5较好,且两者差值不应过大,R2最大值为1。以蔗糖和葡萄糖为碳源时的样本处于不同的聚类区域,每个样品的平行样本分布集中,说明相同实验组内样品重复性优异。不同组间样本点离散现象十分明显,说明在不同碳源的培养条件下胞内物质存在显著差异。同时,所有样本点基本都处于95%置信区间内,说明该PCA模型可信度较高[21]。
图3-b是不同培养基条件下胞内代谢物的PCA载荷图,从图3-b可以看出,分析了81种代谢物,其中19种代谢物变化较大,其余物质变化较小。
图3-c为样品的PLS-DA,图中R2X是模型X变量(自变量)的可解释度,R2Y为模型Y变量(因变量)的可解释率,Q2是模型的可预测度,通常情况下,R2与Q2高于0.5较好,且两者差值不应过大,R2和Q2最大值为1。从图3-c可以说明不同碳源培养时胞内代谢物的差异可能是导致L-丝氨酸产量发生变化的主要原因。
PLS-DA的变量重要性投影(variable importance in projection,VIP)图如图4所示,一般认为,VIP≥1则关联性强。VIP值越大则表明相关性越强,对L-丝氨酸合成的贡献越大[22]。图4中15种物质与L-丝氨酸合成最为相关,按相关程度从高到低排序,它们分别为葡萄糖、6-磷酸葡萄糖、3-磷酸甘油酸、丙酮酸、6-磷酸果糖、丙氨酸、琥珀酸、富马酸、柠檬酸、苹果酸、苯丙氨酸、色氨酸、脯氨酸、甘氨酸以及蛋氨酸。
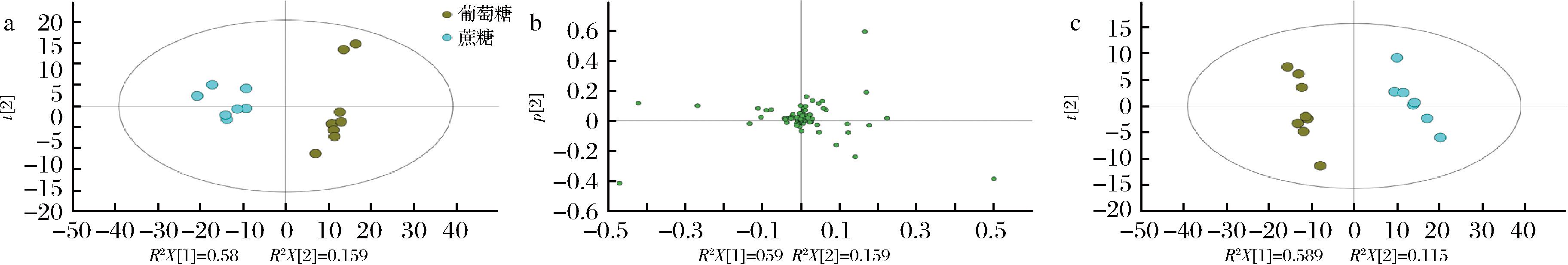
a-不同培养条件下L-丝氨酸合成PCA得分图;b-不同培养条件下PCA结果;c-不同培养条件下PLS-DA结果
图3 谷氨酸棒杆菌A在以蔗糖和葡萄糖为碳源时的代谢组学数据主成分分析
Fig.3 Principal component analysis of metabolomics data of C.glutamicum A with sucrose and glucose as carbon sources
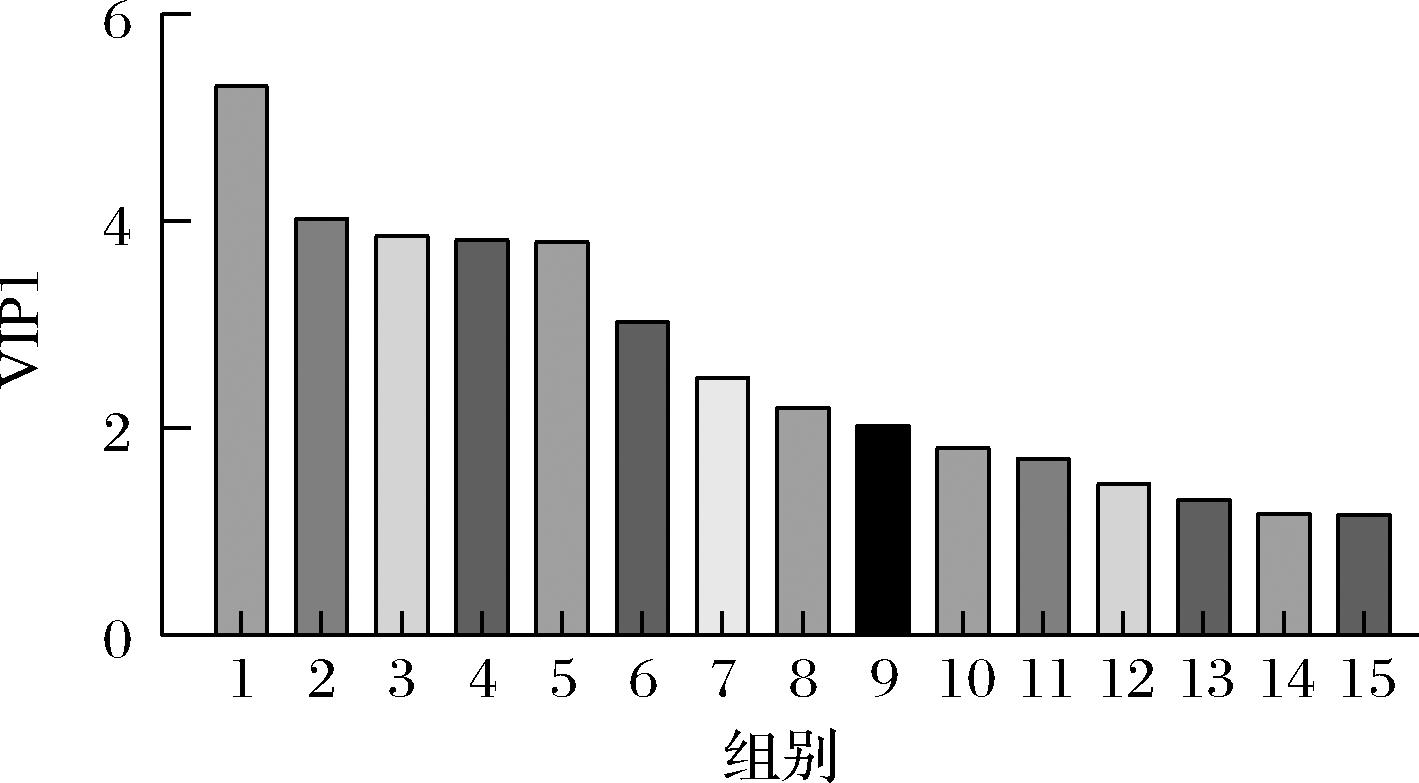
1-葡萄糖;2-6-磷酸葡萄糖;3-3-磷酸甘油酸;4-丙酮酸; 5-6-磷酸果糖;6-丙氨酸;7-琥珀酸;8-富马酸;9-柠檬酸;10-苹 果酸;11-苯丙氨酸;12-色氨酸;13-脯氨酸;14-甘氨酸;15-蛋氨酸
图4 胞内代谢物第一主成分VIP图
Fig.4 Correlation size analysis of intracellular metabolites for L-serine synthesis by PLS-DA
2.4 结合代谢网络分析不同碳源下谷氨酸棒杆菌代谢特征
为阐明关键代谢物与关键代谢途径之间相互作用的关系,结合PLS-DA结果,计算并分析了谷氨酸棒杆菌A在不同碳源培养下胞内代谢物含量的相对比值,分析包含了EMP、TCA及氨基酸代谢等生物合成途径。
2.4.1 与EMP途径相关的关键代谢物变化
谷氨酸棒杆菌A采用蔗糖和葡萄糖发酵时与EMP途径相关的关键代谢物变化如图5-a所示。谷氨酸棒杆菌A在蔗糖培养条件下6-磷酸葡萄糖(glucose 6-phosphate,G-6-P)和6-磷酸果糖(fructose 6-phosphate,F-6-P)的含量是葡萄糖培养时的9.51、8.75倍,说明蔗糖培养条件下EMP途径相关酶活性可能更高,这与ZHANG等[23]强化EMP途径可提高谷氨酸棒杆菌生物合成L-丝氨酸的研究结果相一致。从图5-a还可以看出,在蔗糖培养条件下,合成L-丝氨酸的前体物质3-磷酸甘油含量很低,说明3-磷酸甘油被充分用于L-丝氨酸合成。SAWADA等[24]通过敲除谷氨酸棒杆菌13032的基因pyK减少了磷酸烯醇式丙酮酸(phosphoenolpyruvic acid,PEP)流向丙酮酸,使更多的碳流量流向L-谷氨酸的合成,提高了L-谷氨酸的产量。本文中以葡萄糖为碳源时,胞内丙酮酸含量是蔗糖培养条件下的1.84倍,说明葡萄糖培养条件下更多的碳流向了丙酮酸合成途径。
2.4.2 与TCA循环相关的关键代谢物变化
乔郅钠等[25]通过转录组学研究发现磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxylase,PEPC)对谷氨酸合成十分关键,并通过加强该酶的表达使EMP途径更多的碳流流向TCA循环,从而提高了谷氨酸棒杆菌G01的谷氨酸产量。MAN等[26]通过代谢工程改造EMP途径将碳流量更多地引入到TCA循环,使得谷氨酸棒杆菌SYPA5-5生长和L-精氨酸的产量均得到提高。谷氨酸棒杆菌A在蔗糖和葡萄糖发酵条件下与TCA循环相关的关键代谢物变化如图5-b所示,菌株在葡萄糖培养条件下,TCA循环中富马酸、琥珀酸、α-酮戊二酸、苹果酸和柠檬酸这5种关键代谢物浓度比在蔗糖培养条件下分别提高了5.02、1.98、1.22、3.76、2.71倍;说明有更多的碳流进入TCA循环,从而使流向合成丝氨酸途径的碳流量发生了下降。这与谷氨酸棒杆菌A在蔗糖培养基发酵时具有更高的产量相符,由此后续实验考虑添加富马酸、苹果酸、琥珀酸、α-酮戊二酸,提高L-丝氨酸产量。
2.4.3 与氨基酸代谢相关的关键代谢物变化
蔗糖和葡萄糖发酵条件下与氨基酸代谢相关的关键代谢物变化如图5-c所示。当以葡萄糖为碳源时,蛋氨酸、苯丙氨酸、丙氨酸、脯氨酸和色氨酸分别提高了2.97、2.23、1.66、1.52、1.21倍,甘氨酸、苏氨酸、半胱氨酸和高半胱氨酸则下降。其中脯氨酸的提高可能由于菌株在葡萄糖培养下,TCA循环中间代谢物浓度的提高从而合成了更多的α-酮戊二酸,前体的增加也就导致了更多脯氨酸的生成。从图5还可以看出,在蔗糖培养条件下,副产物丙氨酸的浓度有所下降,可能由于胞内更多的碳流量流向了丝氨酸的合成途径。

a-糖酵解途径(PYR-丙酮酸;F6P-果糖-6-磷酸;G6P-葡萄糖-6-磷酸;3GP-3-磷酸甘油);b-三羧酸循环; c-氨基酸代谢途径(Met-蛋氨酸;Phe-苯丙氨酸;Ala-丙氨酸;Pro-脯氨酸;Try-色氨酸;Gly-甘氨酸;Thr-苏氨酸;Cys-半胱氨酸;Hom-高半胱氨酸)
图5 以蔗糖和葡萄糖为碳源时菌株A的代谢物变化
Fig.5 Levels of intracellular metabolites of key pathways during sucrose and glucose fermentation
2.5 理性强化TCA循环提高L-丝氨酸产量
通过以上分析,我们在蔗糖培养基中分别添加TCA循环差异代谢物(富马酸、苹果酸、柠檬酸、α-酮戊二酸、琥珀酸),考察强化TCA循环对L-丝氨酸产量的影响。设置添加质量浓度为0.5、1、1.5、2、2.5 g/L,发酵结果如图6所示,从图6-a和图6-b可以看出,添加适量的α-酮戊二酸和苹果酸虽然促进了菌株的生长,但L-丝氨酸产量变化不大。由图6-c可以看出,外源添加柠檬酸会同时抑制菌株的生长与产酸水平。从图6-d和图6-e可以看出,添加富马酸
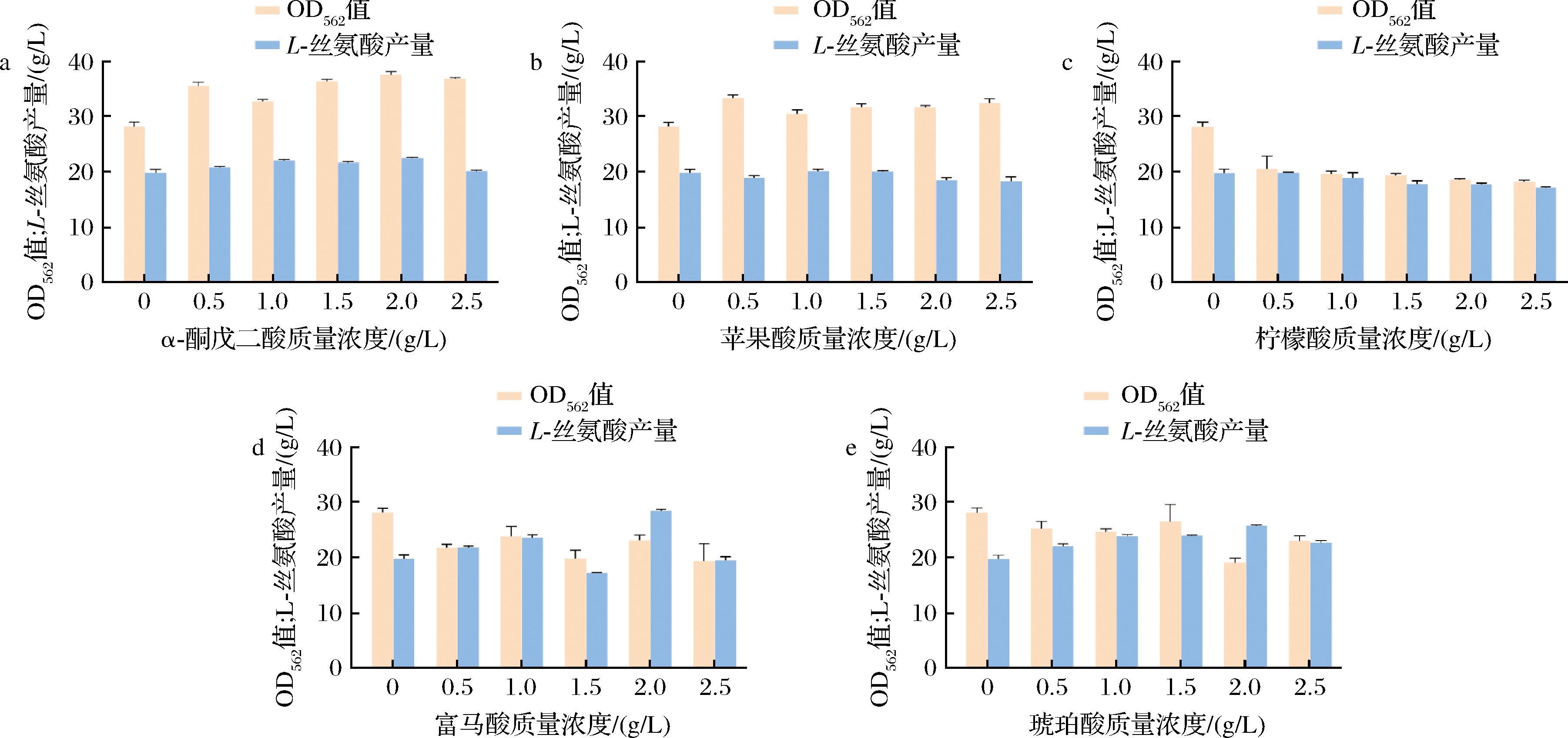
a-添加α-酮戊二酸;b-添加苹果酸;c-添加柠檬酸;d-添加富马酸;e-添加琥珀酸
图6 外源添加三羧酸循环关键代谢物对菌株发酵影响
Fig.6 Effect of exogenous addition of key metabolites of tricarboxylic acid cycle on fermentation of strain
会抑制菌株的生长,其中添加2.5 g/L的富马酸对菌株生长抑制最明显,生物量下降了33.9%。添加富马酸虽然抑制菌株生长,但有利于菌株产L-丝氨酸。其中添加2 g/L的富马酸时L-丝氨酸产量提高最为显著,提高29.8%。同时发现添加2.5 g/L的琥珀酸对菌株生长抑制最明显,菌株生物量下降了32%。添加琥珀酸虽然抑制了菌株生长,但有利于产酸,其中添加2 g/L的琥珀酸L-丝氨酸产量提高最为显著,提高了24.6%。吴洁琴[27]通过强化TCA循环,提高了重组菌株L-精氨酸的产量。许娟等[20]利用代谢组学挖掘分析影响谷氨酸棒杆菌13032 L-瓜氨酸产量的关键代谢物,再通过外源添加的手段使得L-瓜氨酸产量提高了12.8%。这些研究表明TCA循环对菌株生长及产物生产影响较大,通过分析影响目标产物的关键代谢物,进一步通过外源添加关键代谢物等策略可以提高目标产物的产量。
3 结论
通过对谷氨酸棒杆菌A在蔗糖和葡萄糖培养条件下进行比较代谢组学分析,发现谷氨酸棒杆菌A在蔗糖培养条件下TCA循环及氨基酸代谢的整体水平高于葡萄糖,这种差异可能是菌株在蔗糖培养基中L-丝氨酸产量更高的原因。通过多元统计分析,推测是胞内6-磷酸葡萄糖、3-磷酸甘油酸、葡萄糖、6-磷酸果糖、丙酮酸、丙氨酸、琥珀酸、高半胱氨酸、柠檬酸、苹果酸、苯丙氨酸、色氨酸、脯氨酸、甘氨酸、蛋氨酸含量的差异,导致了L-丝氨酸产量的差异。其中富马酸、琥珀酸、苹果酸、α-酮戊二酸对TCA循环代谢途径的影响较大,通过增加这些物质,可能会改善菌株的发酵性能。本文通过比较代谢组学分析对L-丝氨酸合成具有促进效应的关键代谢物,再通过提高关键代谢物的浓度进而使代谢途径向有利于产物生成的方向进行,在此基础上提出了蔗糖培养基的改进策略。结果表明,当外源添加2 g/L的富马酸时,L-丝氨酸产量提高了29.8%。表明基于比较代谢组学分析理性优化培养基的方法可以提高L-丝氨酸的产量。
[1] ZHANG X M, XU G Q, SHI J S, et al.Microbial production of L-serine from renewable feedstocks[J].Trends in Biotechnology, 2018, 36(7):700-712.
[2] 朱林江, 李崎.L-丝氨酸的微生物法制备研究进展[J].食品与发酵工业, 2015,41(1):181-185. ZHU L J, LI Q.Microbial production of L-serine[J].Food and Fermentation Industries, 2015, 41(1):181-185.
[3] WENDISCH V F.Metabolic engineering advances and prospects for amino acid production[J].Metabolic Engineering, 2020, 58:17-34.
[4] RENNIG M, MUNDHADA H, WORDOFA G G, et al.Industrializing a bacterial strain for L-serine production through translation initiation optimization[J].ACS Synthetic Biology, 2019, 8(10):2347-2358.
[5] PETERS-WENDISCH P, NETZER R, EGGELING L, et al.3-Phosphoglycerate dehydrogenase from Corynebacterium glutamicum:the C-terminal domain is not essential for activity but is required for inhibition by L-serine[J].Applied Microbiology and Biotechnology, 2002, 60(4):437-441.
[6] PETERS-WENDISCH P, STOLZ M, ETTERICH H, et al.Metabolic engineering of Corynebacterium glutamicum for L-serine production[J].Applied and Environmental Microbiology, 2005, 71(11):7139-7144.
[7] STOLZ M, PETERS-WENDISCH P, ETTERICH H, et al.Reduced folate supply as a key to enhanced L-serine production by Corynebacterium glutamicum[J].Applied and Environmental Microbiology, 2007, 73(3):750-755.
[8] 徐国强, 窦文芳, 许泓瑜, 等.直接发酵法生产L-丝氨酸高产菌株的选育[J].食品与生物技术学报, 2014, 33(11):1191-1195. XU G Q, DOU W F, XU H Y, et al.Breeding of high-yield L-serine producing strains which can ferment sugar directly[J].Journal of Food Science and Biotechnology, 2014, 33(11):1191-1195.
[9] 赖联贺. 改造谷氨酸棒杆菌非磷酸转移酶葡萄糖转运途径高产L-丝氨酸[D].无锡:江南大学, 2017. LAI L H.Engineering of the non-PTS glucose transport system for enhancing L-serine production by Corynebacterium glutamicum[D].Wuxi:Jiangnan University, 2017. [10] 曹鹏, 胡栋, 张君, 等.基于比较代谢组学的理性优化方法提高阿维菌素产量[J].微生物学报, 2017, 57(2):281-292. CAO P, HU D, ZHANG J, et al.Enhanced avermectin production by rational feeding strategies based on comparative metabolomics[J].Acta Microbiologica Sinica, 2017, 57(2):281-292.
[11] 冯鑫, 程睿, 王珮玥, 等.电喷雾检测器、蒸发光散射检测器与示差折光检测器测定食品中5种糖成分的方法比较[J].食品安全质量检测学报, 2021, 12(4):1513-1518. FENG X, CHENG R, WANG P Y, et al.Comparison of determination of 5 carbohydrates in food by charged aerosol detector, evaporative light scattering detector and refractive index detector[J].Journal of Food Safety and Quality, 2021, 12(4):1513-1518.
[12] CHEN Q, WANG Q, WEI G Q, et al.Production in Escherichia coli of poly (3-hydroxybutyrate-co-3-hydroxyvalerate) with differing monomer compositions from unrelated carbon sources[J].Applied and Environmental Microbiology, 2011, 77(14):4886-4893.
[13] PINU F, VILLAS-BOAS S, AGGIO R, et al.Analysis of intracellular metabolites from microorganisms:Quenching and extraction protocols[J].Metabolites, 2017, 7(4):53.
[14] WANG J B, PU S B, SUN Y, et al.Metabolomic profiling of autoimmune hepatitis:The diagnostic utility of nuclear magnetic resonance spectroscopy[J].Journal of Proteome Research, 2014, 13(8):3792-3801.
[15] KIEFFER D A, PICCOLO B D, VAZIRI N D, et al.Resistant starch alters gut microbiome and metabolomic profiles concurrent with amelioration of chronic kidney disease in rats[J].American Journal of Physiology-Renal Physiology, 2016, 310(9):F857-F871.
[16] HASPEL J A, CHETTIMADA S, SHAIK R S, et al.Circadian rhythm reprogramming during lung inflammation[J].Nature Communications, 2014, 5:4753.
[17] RAO G D, SUI J K, ZHANG J G.Metabolomics reveals significant variations in metabolites and correlations regarding the maturation of walnuts (Juglans regia L.)[J].Biology Open, 2016, 5(6):829-836.
[18] KIEFER P, HEINZLE E, ZELDER O, et al.Comparative metabolic flux analysis of lysine-producing Corynebacterium glutamicum cultured on glucose or fructose[J].Applied and Environmental Microbiology, 2004, 70(1):229-239.
[19] NIE L B, XU K X, ZHONG B, et al.Enhanced L-ornithine production from glucose and sucrose via manipulation of the fructose metabolic pathway in Corynebacterium glutamicum[J].Bioresources and Bioprocessing, 2022, 9(1):11.
[20] 许娟, 许琳, 郝宁.代谢组学分析提高谷氨酸棒杆菌L-瓜氨酸产量[J].生物加工过程, 2018, 16(4):8-15. XU J, XU L, HAO N.Improve L-citrulline production in Corynebacterium glutamicum by metabolomics analysis[J].Chinese Journal of Bioprocess Engineering, 2018, 16(4):8-15.
[21] JIA S S, WANG Y, HU J H.et al.Mineral and metabolic profiles in tea leaves and flowers during flower development[J].Plant Physiology and Biochemistry, 2016, 106:316-326.
[22] RAO, J, CHENG F, HU C Y, et al.Metabolic map of mature maize kernels[J].Metabolomics, 2014, 10(5):775-787.
[23] ZHANG X M, YAO L P, XU G Q, et al.Enhancement of fructose utilization from sucrose in the cell for improved L-serine production in engineered Corynebacterium glutamicum[J].Biochemical Engineering Journal, 2017, 118:113-122.
[24] SAWADA K, ZEN-IN S, WADA M, et al.Metabolic changes in a pyruvate kinase gene deletion mutant of Corynebacterium glutamicum ATCC 13032[J].Metabolic Engineering, 2010, 12(4):401-407.
[25] 乔郅钠, 徐美娟, 龙梦飞, 等.TCA循环关键节点对L-谷氨酸合成的影响[J].生物工程学报, 2020, 36(10):2113-2125. QIAO Z N, XU M J, LONG M F, et al.Effect of key notes of TCA cycle on L-glutamate production[J].Chinese Journal of Biotechnology, 2020, 36(10):2113-2125.
[26] MAN Z W, XU M J, RAO Z M, et al.Systems pathway engineering of Corynebacterium crenatum for improved L-arginine production[J].Scientific Reports, 2016, 6:28629.
[27] 吴洁琴. 代谢工程改造大肠杆菌强化乙酰辅酶A合成L-精氨酸的研究[D].无锡:江南大学, 2022. WU J Q.Metabolic engineering of Escherichia coil to enhance the synthesis of L-arginine by acetyl-CoA[D].Wuxi:Jiangnan University, 2022.