蛋白酶水解可以通过降低分子质量、改变极性基团性质和暴露疏水基团来修饰蛋白质的构象和结构,从而改善蛋白质的功能特性(溶解性、氨基酸组成、泡沫和乳化性质等)和营养性质[1-3]。不同蛋白酶水解位点不同,其水解产物结构特性也不同[4]。WANG等[5]研究了不同蛋白酶水解对牡丹籽蛋白理化性质和抗氧化性能的影响,表明水解可使原有的蛋白结构变得松散,暴露掩埋在内部的亲水基团,降低蛋白的平均粒径和表面疏水性,从而提高水解物在水中的分散性。![]() 等[6]发现不同蛋白酶水解物表面疏水性的差异会体现在其泡沫性质上,水解度高的产物具有优异的溶解性。NYO等[7]的研究发现不同蛋白酶水解得到的花生蛋白水解物的起泡性、泡沫稳定性、乳化性等功能特性的差异更多取决于蛋白酶的类型而不是水解度。林冰洁等[8]用4种蛋白酶水解藜麦麸皮后发现抗氧化活性、α-葡萄糖苷酶抑制活性及酪氨酸酶抑制率方面各有优势。
等[6]发现不同蛋白酶水解物表面疏水性的差异会体现在其泡沫性质上,水解度高的产物具有优异的溶解性。NYO等[7]的研究发现不同蛋白酶水解得到的花生蛋白水解物的起泡性、泡沫稳定性、乳化性等功能特性的差异更多取决于蛋白酶的类型而不是水解度。林冰洁等[8]用4种蛋白酶水解藜麦麸皮后发现抗氧化活性、α-葡萄糖苷酶抑制活性及酪氨酸酶抑制率方面各有优势。
汉麻蛋白作为新兴植物蛋白资源之一,汉麻蛋白和多肽的功能特性及生物活性逐渐成为研究热点,目前关于汉麻蛋白肽抗氧化活性、降血压活性、降血糖活性、抑菌性、抗神经炎活性等方面已有相关研究[9-11]报道。YIN等[12]发现胰蛋白酶水解汉麻分离蛋白(hemp protein isolate,HPI)后,水解物的溶解度显著提高,持水性和持油性显著降低。TANG等[13]研究不同蛋白酶处理不同时间后HPI水解物的DPPH自由基清除能力与Fe2+螯合能力与它们的可溶性肽含量及表面疏水性呈相关性。TEH等[14]探讨甲胎蛋白酶、HT蛋白水解物浓缩液、免疫球蛋白G降解酶、猕猴桃蛋白酶和生姜蛋白酶处理HPI后水解物的抗氧化活性及血管紧张素(angiotensin converting enzyme,ACE)抑制活性均有所增加。综上,针对汉麻蛋白肽的研究主要集中于生物活性方面,而对于不同蛋白酶酶解所得汉麻蛋白水解物的结构、功能特性方面的研究较少。
本文中以HPI为原料,研究不同蛋白酶(木瓜蛋白酶、风味蛋白酶、胃蛋白酶、胰蛋白酶、中性蛋白酶、碱性蛋白酶)的酶解程度、酶解产物结构(二级结构、三级结构、粒径分布、Zeta电位)、界面性质(泡沫性质、乳化能力)以及抗氧化活性的变化,为HPI及其水解产物在食品领域中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
汉麻籽,广西巴马;木瓜蛋白酶(800 000 U/g)、风味蛋白酶(30 000 U/g)、胃蛋白酶(10 000 U/g)、胰蛋白酶(250 000 U/g)、中性蛋白酶(50 000 U/g)、碱性蛋白酶(200 000 U/g),Solarbio科技有限公司;所有分析用试剂均为国产分析纯。
1.2 仪器与设备
BS224S型分析天平,赛多利斯科学有限公司;HH-S4型恒温水浴锅,巩义市予华仪器有限公司;PCE-E3000型恒温振荡器,苏州凯特尔仪器设备有限公司;Marvin 3000型马尔文激光粒度仪,英国马尔文仪器有限公司;TG16-WS型离心机,湘仪实验室仪器开发有限公司;XHF-DY型高速分散机、722E型分光光度计,上海圣科仪器设备有限公司;pH-20型pH计,杭州杰源仪器科技有限公司;Lambda365型紫外光谱仪、Spectrum Two型红外光谱仪,美国铂金埃尔默股份有限公司。
1.3 实验方法
1.3.1 汉麻分离蛋白的制备
汉麻分离蛋白的制备参考朱秀清等[15]的方法。将脱脂汉麻籽与蒸馏水以1∶20(g∶mL)的比例混合,调节pH值为9.0,振荡浸提3 h后4 000 r/min离心20 min,保留上清液,调节上清液pH值至4.7,静置2 h 后4 000 r/min离心20 min,收集沉淀,溶于水后调节pH值至7.0,冷冻干燥后得到HPI,保存备用。
1.3.2 汉麻分离蛋白水解物的制备
汉麻分离蛋白水解物(hemp protein hydrolysate,HPH)的制备参照TANG等[13]的方法并稍作修改。配制质量浓度为50 g/L的HPI溶液,在90 ℃下水浴15 min,降温至反应温度,按表1中的条件调节pH值、加入蛋白酶反应。反应完成后,沸水浴灭酶10 min,冷却后8 000 r/min离心10 min,保留上清液,分别制得木瓜蛋白酶水解物(hemp protein hydrolysate-papain,HPH-PA)、风味蛋白酶水解物(hemp protein hydrolysate-flavor,HPH-F)、胃蛋白酶水解物(hemp protein hydrolysate-pepsin,HPH-P)、胰蛋白酶水解物(hemp protein hydrolysate-trypsin,HPH-T)、中性蛋白酶水解物(hemp protein hydrolysate-neutral,HPH-N)、碱性蛋白酶水解物(hemp protein hydrolysate-alkaline,HPH-A)样品,保存备用。
表1 六种蛋白酶的酶解条件
Table 1 Enzymolysis conditions of six kinds of proteases
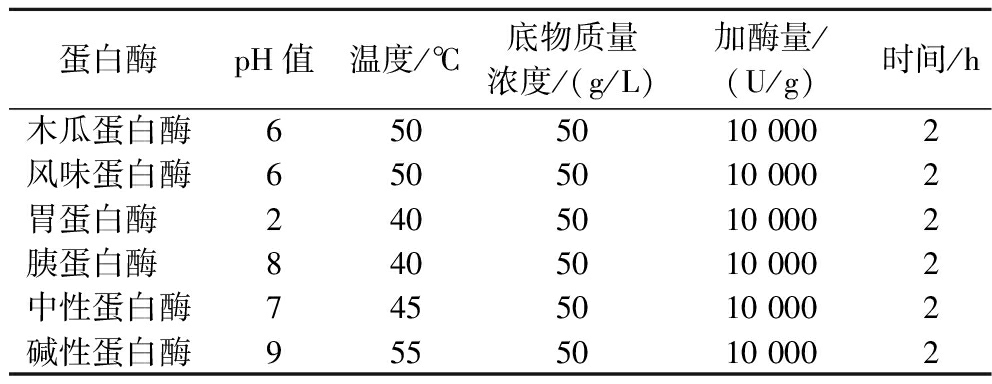
蛋白酶pH值温度/℃底物质量浓度/(g/L)加酶量/(U/g)时间/h木瓜蛋白酶6505010 0002风味蛋白酶6505010 0002胃蛋白酶 2405010 0002胰蛋白酶 8405010 0002中性蛋白酶7455010 0002碱性蛋白酶9555010 0002
1.3.3 水解度的测定
采用甲醛滴定法测定水解度(degree of hydrolysis,DH)[16]。取10 mL HPH与60 mL蒸馏水,混匀后用NaOH溶液滴定至pH值为8.2;向溶液中加入10 mL中性甲醛,用NaOH溶液继续滴定,当pH值为9.2时停止,记录NaOH消耗的体积为V。空白实验中,记录NaOH消耗的体积为V0。水解度的计算如公式(1)所示:
(1)
式中:C为NaOH溶液浓度,mol/L;V为消耗NaOH溶液的体积,mL;V0为空白消耗NaOH溶液体积,mL;M为样品中总氮质量,g。
1.3.4 可溶性肽含量的测定
采用TCA-双缩脲法测定水解物的肽含量[17]。取5 mL HPH与5 mL的0.4 mol/L的TCA溶液混合均匀,以4 000 r/min的转速离心10 min,吸取上清液1 mL与双缩脲试剂4 mL混合均匀,静置10 min,测定其在540 nm处的吸光值。依据标准曲线计算TCA-可溶性肽含量。
1.3.5 十二烷基硫酸钠-聚丙烯酰胺(sodium dodecyl sulfate-polyacrylamide,SDS-PAGE)凝胶电泳
采用的浓缩胶和分离胶的浓度分别为5%和20%,将样品与上样缓冲液以4∶1的比例混合后沸水浴煮沸5 min,每孔上样量为20 μL。电泳结束后,用染色液染色30 min,然后用脱色液脱色直至条带清晰无背景色。
1.3.6 粒径分布、Zeta电位、PDI值的测定
参考AI等[18]的方法用马尔文激光粒度仪对HPI及6种HPH的粒径、Zeta电位、PDI(polymer dispersity index)值进行测定。配制样品质量浓度3 mg/mL的溶液,用0.45 μm滤膜过滤除去不溶物,放入反应皿内对上述指标进行测定。
1.3.7 傅里叶红外光谱分析
取冻干后的样品适量,用傅里叶红外光谱仪进行4 000~400 cm-1波段扫描,每个样品进行3次平行实验。
1.3.8 紫外可见光谱分析
取适量样品配制成质量浓度为2 mg/mL的溶液,测定溶液在190~400 nm紫外吸收光谱。
1.3.9 溶解度的测定
称取10 mg样品于10 mL水中,于室温下搅拌30 min,10 000 r/min离心10 min后采用考马斯亮蓝法测定上清液中蛋白含量。溶解度的计算如公式(2)所示:
溶解度![]()
(2)
1.3.10 起泡性与泡沫稳定性的测定
取15 mL样品置于量筒中,记录此时体积V0,在高速分散器中8 000 r/min处理1 min后立即转移至量筒中,记录此时的体积V1及静置30 min后的体积V2,样品的起泡性(foaming characteristic,FC)和泡沫稳定性(foaming stability,FS)的计算如公式(3)、公式(4)所示:
(3)
(4)
1.3.11 乳化活性与乳化稳定性的测定
参考WANG等[19]的方法并稍作修改进行样品的乳化活性及乳化稳定性的测定。样品与大豆油按体积比3∶1加入到离心管中,在高速分散器中10 000 r/min处理2 min,立即在离心管底部吸取20 μL乳状液,加入到5 mL 0.1%的SDS溶液中,以0.1%的SDS溶液作为空白样品,在500 nm的波长下测定其吸光值。样品乳化活性(emulsifying activity,EAI)的计算如公式(5)所示:
(5)
式中:T为2.303;N为稀释倍数,250;C为乳化液未形成前蛋白质溶液的质量浓度,g/mL;φ为油相体积分数;A0为0 min时吸光值。
将制成的乳状液静置30 min后,以上述同样方法进行样品乳化稳定性的测定。样品乳化稳定性(emulsion stability,ESI)的计算如公式(6)所示:
(6)
式中:A30为30 min时吸光值;t为30 min。
1.4 数据处理与分析
所有实验重复3次,采用Excel软件对数据进行统计分析,结果取平均值,采用SPSS 26进行显著性分析并用Origin 2019软件进行绘图。
2 结果与分析
2.1 不同蛋白酶水解HPI水解度、可溶性肽含量对比
由图1可知,DH及肽含量受蛋白酶类型的影响较大,HPH-A具有最高的DH(24.7±0.46)%,HPH-PA次之,为(24.4±0.34)%;HPH-A的肽含量最高,为(13.43±0.26) mg/mL,HPH-PA的肽含量为(12.96±0.23) mg/mL。由于碱性蛋白酶是一种深度内切酶[20],具有广泛的特异性,而木瓜蛋白酶可以水解蛋白质或多肽中精氨酸、赖氨酸的羧基端,SHEN等[21]的研究指出HPI中谷氨酸、精氨酸和天冬氨酸含量高,而脱壳后HPI中含有更多的精氨酸、组氨酸,因此,碱性蛋白酶、木瓜蛋白酶可更有效地将HPI分解为可溶性的小分子肽或氨基酸,具有更高的水解度。

图1 不同蛋白酶水解HPI水解度、可溶性肽含量比较
Fig.1 Hydrolysis degree and soluble peptide content of HPI hydrolyzed by different proteases
注:不同小写字母表示差异显著(P<0.05),下同。
2.2 SDS-PAGE凝胶电泳
为了表征不同蛋白酶处理后的水解物组成,对其进行SDS-PAGE凝胶电泳分析。由图2可以看出分子质量约为48 kDa的麻仁球蛋白、35 kDa左右的酸性亚基(acidic subunits,AS)、20 kDa左右的碱性亚基(basic subunits,BS)和10~15 kDa的白蛋白为HPI的主要组成部分[21],水解后发现4条蛋白带的强度变弱或部分消失,并出现分子质量<17 kDa的小分子组分,其中HPH-PA、HPH-F、HPH-P具有更多的小分子肽。胃蛋白酶的水解效果最好,出现的均为小于17 kDa的小分子肽。TANG等[13]的研究结果表明在很低的pH环境下,所有的蛋白质可能被解离,球形结构展开。HPH-A的电泳图上也并未出现麻仁球蛋白的条带,证明碱性蛋白酶对麻仁球蛋白具有很好的水解能力。

图2 HPI及不同蛋白酶水解物的电泳图
Fig.2 Electrophoretic map of HPI and different protease hydrolysates
2.3 不同蛋白酶水解HPI粒径、PDI值对比
图3-a表明水解对HPI粒径分布的影响。水解后HPH粒径体积分布与HPI相比均有所降低,HPH-A的平均粒径最小,这是由于碱性蛋白酶可以将HPI水解成更多的短肽或氨基酸,这一结果与前文HPH-A具有较高的水解度一致。由图3-b可以看出,所有水解物的PDI值较HPI均呈现减小的趋势,可以说明蛋白酶水解提高了水解物的分散性[18],其中HPH-P和HPH-A在水中的分散性低于其他水解物,HPH-N的PDI值最大。这是由于中性蛋白酶的水解位点为亮氨酸、苯丙氨酸、酪氨酸等疏水氨基酸的肽键[22],酶水解后会产生具有相同末端的氨基酸或带有相同电荷的肽段[23],会暴露出更多疏水性氨基酸,导致水解物在水中的分散性弱于其他水解物。
2.4 不同蛋白酶水解HPI Zeta电位值对比
由图4可知,各水解物的Zeta电位值较HPI有所增加,这是由于水解过程可以暴露出掩埋在蛋白质分子内部的氨基和羧基,使其数量增加[16],从而提高水解物的Zeta电位值。HPH-A、HPH-PA较高的Zeta电位绝对值表明在水解过程中可以产生更多的氨基和羧基,从而增加了HPI的表面电荷;同时,Zeta电位绝对值升高导致分子内和分子间的静电排斥作用增大,可以促进蛋白质结构的展开,破坏现有的蛋白质聚集体或阻止聚集体的进一步形成,从而提高样品在溶液中的稳定性。
2.5 不同蛋白酶水解HPI二级结构对比
3 500~3 000 cm-1的特征吸收峰主要与多肽骨架上的氢键有关,氢键可以维持蛋白质二级结构的稳定性[5],不同蛋白酶水解产物的峰强度和峰宽较HPI降低,说明蛋白酶水解会破坏蛋白质分子间的氢键,从而改变蛋白结构的稳定性。由图5-a可以看出HPI在2 924 cm-1处的峰与不对称CH2伸展有关,这通常发生在蛋白质的脂肪侧链中[24],不同HPI水解物的—CH2谱带均由2 924 cm-1移动到2 932 cm-1,且峰强度明显减弱。这些结果表明,蛋白酶水解改变了HPI的脂肪侧链,破坏了HPI的疏水区。

a-不同蛋白酶水解物的粒径分布;b-不同蛋白酶水解物的PDI值
图3 不同蛋白酶水解HPI粒径分布及PDI值比较
Fig.3 Particle size distribution and PDI value of HPI hydrolyzed by different proteases

图4 不同蛋白酶水解HPI Zeta电位值比较
Fig.4 Zeta potentials of HPI hydrolyzed by different proteases
由图5-b可以看出,酶水解对HPI的二级结构有影响,不同蛋白酶水解产物的二级结构不同。与HPI相比,HPH的α-螺旋变化不明显,β-转角、无规卷曲比例增加,β-折叠比例降低,表明蛋白酶酶解会使蛋白质的有序结构变得无序,分子结构变得更加松散。刘瑾[25]的研究表明,β-折叠比例的降低说明HPH的疏水性降低,溶解性增加,有利于提高水解物在水中的分散性;水解物的β-转角含量升高表明它们具有更加灵活的二级结构。总之,酶水解会使蛋白结构变得更加松散,具有更灵活的二级结构,提高蛋白溶解度。
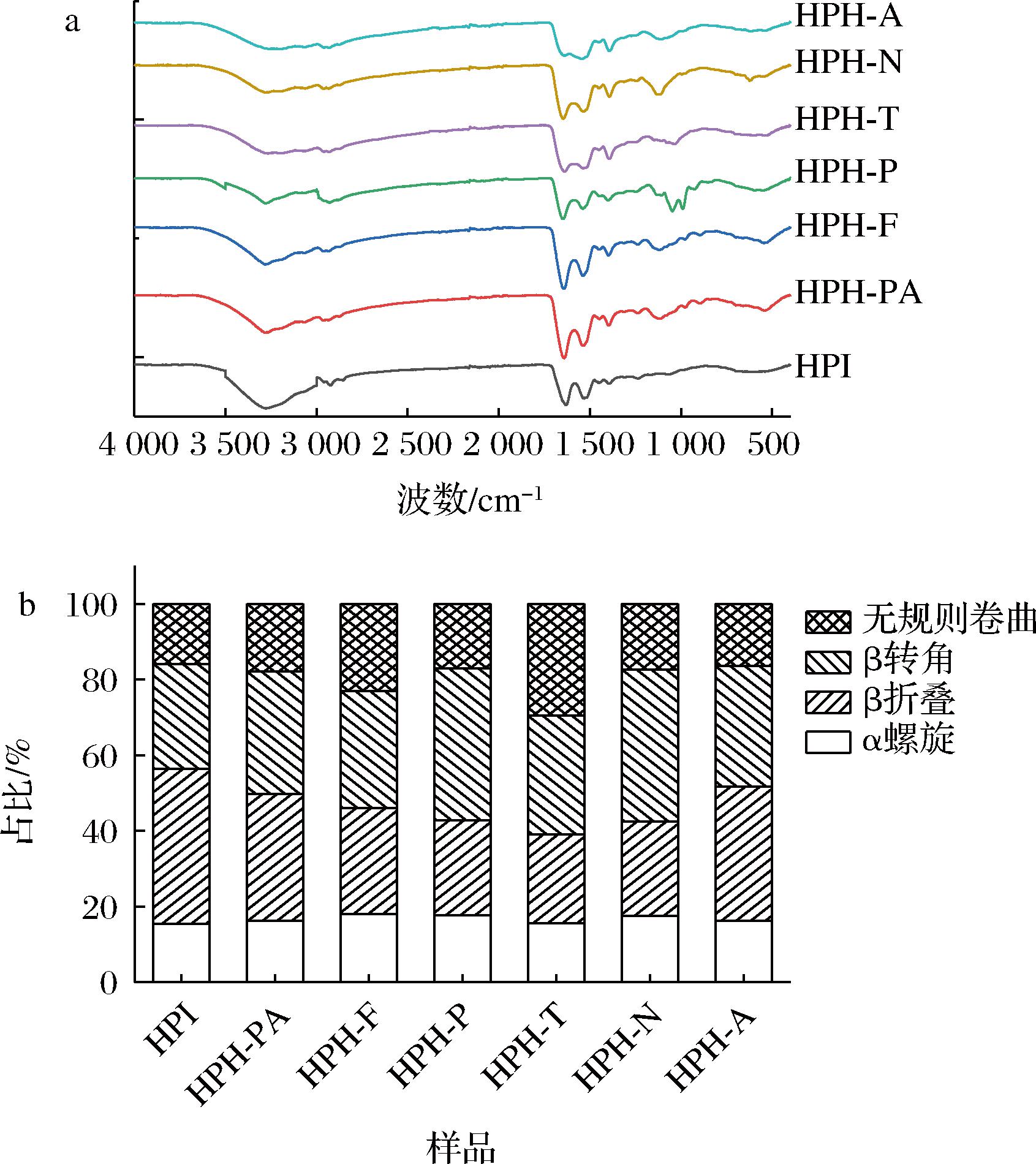
a-不同蛋白酶水解HPI的傅里叶变换红外光谱; b-不同蛋白酶水解HPI的二级结构组成
图5 不同蛋白酶水解HPI傅里叶变换红外光谱及 二级结构组成比较
Fig.5 Fourier transform infrared spectroscopy and secondary structure of HPI hydrolyzed by different proteases
2.6 不同蛋白酶水解HPI三级结构对比
由图6可以看出,所有HPH荧光发射光谱的λmax出现在272~274 nm,较HPI发生了红移,同时,这些水解物的最大荧光强度也有所增加。对紫外吸收光谱进行二阶导数得到的光谱可以用于分析紫外区域复杂的蛋白谱图迁移信息,经计算得到HPI、HPH-PA、HPH-F、HPH-P、HPH-T、HPH-N、HPH-A的r值分别为1.354、2.295、1.915、1.953、1.991、2.151、2.217。所有HPH的r值增大,表明蛋白酶水解打开了HPI的三级结构,暴露了芳香氨基酸及内部的亲水基团,导致其红移[26]。
2.7 不同蛋白酶水解HPI溶解度对比
HPI在中性条件下溶解性差,蛋白酶水解会破坏其分子空间结构,一些包埋在蛋白质分子内部的亲水性区域暴露出来,提高汉麻蛋白的溶解性。由图7可知,HPH-P的溶解度最好,这可能是由于胃蛋白酶水解能进一步将原本因疏水而易絮凝沉淀的蛋白分解成更小分子肽段,使其溶解于水中,进而提高了水解产物的溶解性。同时,多肽链分子质量减小、肽段增多,增大了亲水性基团与水的接触,从而达到提高溶解度的目的,这也与研究发现蛋白酶水解后金苹果螺水解物的溶解度有所提高的趋势一致[27]。

a-不同蛋白酶水解HPI的紫外吸收光谱; b-不同蛋白酶水解HPI的二阶导数紫外光谱
图6 不同蛋白酶水解HPI紫外吸收光谱及二阶 导数紫外光谱比较
Fig.6 UV absorption spectra and second derivative UV spectra of HPI hydrolyzed by different proteases
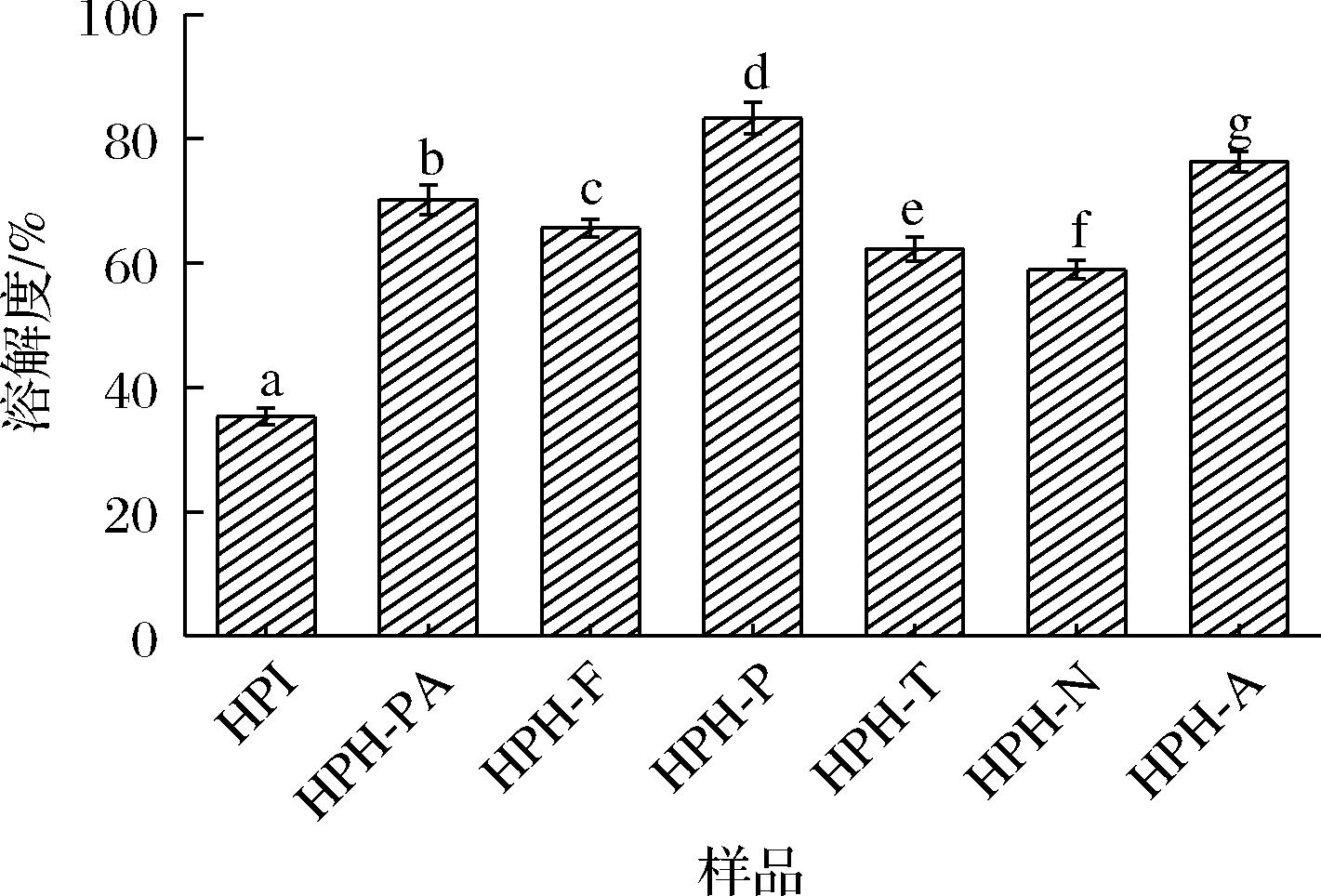
图7 不同蛋白酶水解HPI溶解度比较
Fig.7 Solubility of HPI hydrolyzed by different proteases
2.8 不同蛋白酶水解HPI界面性质对比
由图8-a可知,蛋白酶处理可以提高HPI的起泡性,这可能是由于小分子肽能够降低溶液黏度与表面张力,更好地增加蛋白质表面净电荷数目,增加多肽链的交联和片层的黏度,从而提高了起泡性。其中,HPH-PA、HPH-A的FC较高,这可能是由于水解物表面带有更多的电荷所导致的,这也与前文Zeta电位的结论一致。蛋白酶处理后HPI的泡沫稳定性有所提升,这也与PUTRA等[27]指出的低分子质量肽的数量越多,水解物的起泡稳定性越好一致。
由图8-b可以看出,蛋白酶处理后HPH的乳化活性及乳化稳定性较HPI均有所降低。水解过程中蛋白质分子部分展开,更多的亲水基团暴露出来,使蛋白质在油-水界面重排,改善了疏水-亲水平衡,从而降低乳液的乳化活性,而中性蛋白酶特定的水解位点使水解物具有更多的疏水基团,从而具有相对好的乳化能力。蛋白酶水解使HPI分子肽链逐渐缩短,产生的小肽失去了与水和非水相相互作用的能力,难以形成良好的界面膜,不能有效地防止油滴的聚集。有研究表明较高的表面疏水性和较大的多肽颗粒有助于提高蛋白质水解物的乳化能力[28],因此水解后小分子肽含量的增加会导致水解物乳化性变差。

a-不同蛋白酶水解HPI起泡能力比较; b-不同蛋白酶水解HPI乳化能力比较
图8 不同蛋白酶水解HPI界面性质比较
Fig.8 Interface property of HPI hydrolyzed by different proteases
3 结论与讨论
HPI在6种蛋白酶(木瓜蛋白酶、风味蛋白酶、胃蛋白酶、胰蛋白酶、中性蛋白酶、碱性蛋白酶)作用下进行水解,可以显著改善HPI的结构及理化性质。不同蛋白酶水解物结构和性质差异较大,这种差异可归因于单个酶的切割模式,水解物的功能特性更多依赖于蛋白酶的类型而不是水解度。水解会产生更多的小分子肽,使蛋白质的有序结构变得无序,使内部的亲水基团暴露出来,分散性提高。其中HPH-A具有良好的水解度、肽含量,HPH-N的乳化性最好,HPH-PA的泡沫性质最好,HPH-P的溶解度最好。汉麻分离蛋白被不同蛋白酶水解后结构及功能特性的变化,为后续研究汉麻蛋白及其水解物的在食品中的应用及其生物活性奠定了理论基础。
[1] DO EVANGELHO J A, VANIER N L, PINTO V Z, et al.Black bean (Phaseolus vulgaris L.) protein hydrolysates:Physicochemical and functional properties[J].Food Chemistry, 2017, 214:460-467.
[2] FENG X, ZHU Y Y, LIU Q, et al.Effects of bromelain tenderisation on myofibrillar proteins, texture and flavour of fish balls prepared from golden pomfret[J].Food and Bioprocess Technology, 2017, 10(10):1918-1930.
[3] SADEGHI S, JALILI H, SIADAT S O R, et al.Anticancer and antibacterial properties in peptide fractions from hydrolyzed spirulina protein[J].Journal of Agricultural Science &Technology, 2018, 20(4):673-683.
[4] 杨振宇, 闫家凯, 段艳华, 等.高乳化特性大米蛋白酶解产物的结构与性能研究[J].食品工业科技, 2022, 43(19):129-136. YANG Z Y, YAN J K, DUAN Y H, et al.Study on structure and properties of hydrolyzed rice protein with high emulsification properties[J].Science and Technology of Food Industry, 2022, 43(19):129-136.
[5] WANG Y Y, WANG C Y, WANG S T, et al.Physicochemical properties and antioxidant activities of tree peony (Paeonia suffruticosa Andr.) seed protein hydrolysates obtained with different proteases[J].Food Chemistry, 2021, 345:128765.
[6] ![]() A
A ![]() B D, et al.Influence of ultrasound probe treatment time and protease type on functional and physicochemical characteristics of egg white protein hydrolysates[J].Poultry Science, 2018, 97(6):2218-2229.
B D, et al.Influence of ultrasound probe treatment time and protease type on functional and physicochemical characteristics of egg white protein hydrolysates[J].Poultry Science, 2018, 97(6):2218-2229.
[7] NYO M K, NGUYEN L T.Value-addition of defatted peanut cake by proteolysis:Effects of proteases and degree of hydrolysis on functional properties and antioxidant capacity of peptides[J].Waste and Biomass Valorization, 2019, 10(5):1251-1259.
[8] 林冰洁, 薛鹏, 荆金金, 等.不同蛋白酶制备藜麦麸皮多肽及其活性研究[J].食品与发酵工业, 2021, 47(3):114-119;127. LIN B J, XUE P, JING J J, et al.Activity of polypeptides from Chenopodium quinoa husks prepared with different proteases[J].Food and Fermentation Industries, 2021, 47(3):114-119;127.
[9] REN Y, LIANG K, JIN Y Q, et al.Identification and characterization of two novel α-glucosidase inhibitory oligopeptides from hemp (Cannabis sativa L.) seed protein[J].Journal of Functional Foods, 2016, 26:439-450. [10] RODRIGUEZ-MARTIN N M, MONTSERRAT-DE LA PAZ S, TOSCANO R, et al.Hemp (Cannabis sativa L.) protein hydrolysates promote anti-inflammatory response in primary human monocytes[J].Biomolecules, 2020, 10(5):803.
[11] GIRGIH A T, UDENIGWE C C, ALUKO R E.In vitro antioxidant properties of hemp seed (Cannabis sativa L.) protein hydrolysate fractions[J].Journal of the American Oil Chemists Society, 2011, 88(3):381-389.
[12] YIN S W, TANG C H, CAO J S, et al.Effects of limited enzymatic hydrolysis with trypsin on the functional properties of hemp (Cannabis sativa L.) protein isolate[J].Food Chemistry, 2008, 106(3):1004-1013.
[13] TANG C H, WANG X S, YANG X Q.Enzymatic hydrolysis of hemp (Cannabis sativa L.) protein isolate by various proteases and antioxidant properties of the resulting hydrolysates[J].Food Chemistry, 2009, 114(4):1484-1490.
[14] TEH S S, BEKHIT A E A, CARNE A, et al.Antioxidant and ACE-inhibitory activities of hemp (Cannabis sativa L.) protein hydrolysates produced by the proteases AFP, HT, Pro-G, actinidin and zingibain[J].Food Chemistry, 2016, 203:199-206.
[15] 朱秀清, 李美莹, 孙冰玉, 等.复合酶分步水解法制备汉麻多肽及其抗氧化特性研究[J].食品工业科技, 2021, 42(2):161-169. ZHU X Q, LI M Y, SUN B Y, et al.Preparation of polypeptides from hemp by two-step enzymatic hydrolysis with complex enzymes and its antioxidant properties[J].Science and Technology of Food Industry, 2021, 42(2):161-169.
[16] 李皖光, 汪桃花, 王新文, 等.4种大米蛋白水解度测定方法比较[J].粮食科技与经济, 2017, 42(5):35-37. LI W G, WANG T H, WANG X W, et al.The comparison of four methods in testing degree of hydrolysis[J].Grain Science and Technology and Economy, 2017, 42(5):35-37.
[17] JANG A, LEE M.Purification and identification of angiotensin converting enzyme inhibitory peptides from beef hydrolysates[J].Meat Science, 2005, 69(4):653-661.
[18] AI M M, TANG T, ZHOU L D, et al.Effects of different proteases on the emulsifying capacity, rheological and structure characteristics of preserved egg white hydrolysates[J].Food Hydrocolloids, 2019, 87:933-942.
[19] WANG Y S, LIU C Q, MA T Y, et al.Physicochemical and functional properties of γ-aminobutyric acid-treated soy proteins[J].Food Chemistry, 2019, 295:267-273.
[20] ATHIRA S, MANN B, SHARMA R, et al.Preparation and characterization of iron-chelating peptides from whey protein:An alternative approach for chemical iron fortification[J].Food Research International, 2021, 141:110133.
[21] SHEN P Y, GAO Z L, XU M W, et al.Physicochemical and structural properties of proteins extracted from dehulled industrial hempseeds:Role of defatting process and precipitation pH[J].Food Hydrocolloids, 2020, 108:106065.
[22] ZHU B Y, HE H, HOU T.A comprehensive review of corn protein-derived bioactive peptides:Production, characterization, bioactivities, and transport pathways[J].Comprehensive Reviews in Food Science &Food Safety, 2019, 18(1):329-345.
[23] ACHOVRI A, WANG Z, XU S Y.Enzymatic hydrolysis of soy protein isolate and effect of succinylation on the functional properties of resulting protein hydrolysates[J].Food Research International, 1998, 31(9):617-623.
[24] GOUDA M, ZU L L, MA S M, et al.Influence of bio-active terpenes on the characteristics and functional properties of egg yolk[J].Food Hydrocolloids, 2018, 80:222-230.
[25] 刘瑾. 酶法改善大豆分离蛋白起泡性和乳化性的研究[D].无锡:江南大学, 2008. LIU J.Enhancing the foaming and emulsifying properties of soybean protein isolate by enzymatic modification[D].Wuxi:Jiangnan University, 2008.
[26] HE S D, SIMPSON B K, NGADI M O, et al.pH stability study of lectin from black turtle bean (Phaseolus vulgaris) as influenced by guanidinium-HCl and thermal treatment[J].Protein &Peptide Letters, 2014, 22(1):45-51.
[27] PUTRA S N K M, ISHAK N H, SARBON N M.Preparation and characterization of physicochemical properties of golden apple snail (Pomacea canaliculata) protein hydrolysate as affected by different proteases[J].Biocatalysis and Agricultural Biotechnology, 2018, 13:123-128.
[28] AVRAMENKO N A, LOW N H, NICKERSON M T.The effects of limited enzymatic hydrolysis on the physicochemical and emulsifying properties of a lentil protein isolate[J].Food Research International, 2013, 51(1):162-169.