我国水产资源丰富,水产品肉鲜味美、营养丰富,深受消费者喜爱。但水产品内源酶活性高,且携带多种来自水体的微生物,易腐败变质,因此冷藏是水产品重要的贮藏方式。此外高效、低毒的生物防腐剂也常用于食品保鲜。GB 2760—2014《食品安全国家标准 食品添加剂使用标准》仅允许抑制革兰氏阳性菌(G+)的生物防腐剂即乳酸链球菌素应用于水产食品保鲜,但其在偏中性的环境下稳定性较差,也易被酶水解[1]。而在冷藏水产品中,除了存在部分G+葡萄球菌属[2]、芽孢杆菌属[3]等腐败微生物,革兰氏阴性菌(G-)气单胞菌属、假单胞菌属、希瓦氏菌属微生物是货架期终点最常见的优势腐败菌[4-6]。水产品加工废弃物本身富含天然的抗菌蛋白,若将其应用于水产品保鲜,既能提高食品安全性,又充分利用了水产资源。
cystatins属于一类半胱氨酸蛋白酶抑制因子,具有专一性抑制半胱氨酸蛋白酶的活性,包含cystatin C、cystatin D、cystatin E/M等形式,是一类低分子质量(约13 kDa)蛋白质。在水产品加工废弃物鱼卵、鱼皮、鱼肝脏等组织,均发现了cystatins活性。目前已发现陆生动植物源cystatins具有抑菌活性[7-8],而对鱼源cystatins抑菌研究有限。本团队首先发现了鲢鱼卵cystatin C能抑制冷藏鲢鱼肉片中的G-假单胞菌J-4[9],之后发现其对G-铜绿假单胞菌[10]、草莓假单胞菌和荧光假单胞菌也有抑菌效果[11]。此外,仅YU等[12]报道了牙鲆重组cystatin C对鱼病相关的G-病原菌,以及G+金黄色葡萄球菌、枯草芽孢杆菌有抑制作用。鱼源cystatin C作为一种对部分G-及G+有抑菌活性的天然抗菌蛋白,在pH 4~9稳定性好[13],且能抵抗半胱氨酸蛋白酶的水解,有望被开发为水产食品生物防腐剂。因此阐明鱼源cystatin C的抑菌活性及作用机制,具有一定的理论和现实意义。一般认为小分子的抗菌蛋白或抗菌肽,主要与细菌细胞膜相互作用,从而导致菌体裂解死亡[14]。目前仅BLANCA等[15]从形态学上观察了重组人唾液cystatin C对G+粪肠球菌和变形链球菌的抑制作用。而鱼源cystatins抑制G+及G-的相关机制未见报道。
为此,本文在团队前期研究基础上,通过测定抑菌圈直径(diameter of inhibition zone,DIZ)、最低抑菌浓度(minimal inhibitory concentration,MIC)和最低杀菌浓度(minimum bactericidal concentration,MBC),评价鲢鱼(Hypophthalmichthys molitrix)重组cystatin C(HmCystatin C)对从冷藏水产品中分离的腐败希瓦氏菌、中间气单胞菌、荧光假单胞菌、腐生葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌的抑菌活性;分析了HmCystatin C对两株敏感受试菌生长曲线的影响,并从HmCystatin C与菌体及其细胞壁成分的结合、对细胞壁和细胞质膜通透性影响方面,初步探究HmCystatin C的抑菌机理。
1 材料与方法
1.1 材料与试剂
HmCystatin C根据实验室前期确定的方法制备[16],由转入鲢鱼cystatin-pet-30a的工程菌大肠杆菌(Esherichia coli BL(DE3)进行原核表达、纯化,微滤除菌后保存。纯度为95%,比活性为1 428.57 unit/mg。
G-:腐败希瓦氏菌(Shewanella putrefaciens)、荧光假单胞菌(Pseudomonas fluorescens)、铜绿假单胞菌(Pseudomonas aeruginosa)、中间气单胞菌(Aeromonas media)以及G+:腐生葡萄球菌(Staphylococcus saprophyticus)、枯草芽孢杆菌(Bacillus subtilis),由四川农业大学食品学院水产品科学研究室分离并保存。
脂多糖(lipopolysaccharide, LPS)(来源于铜绿假单胞菌ATCC 27316,纯度≥98%),北京索莱宝科技有限公司;肽聚糖(peptidoglycan, PGN)(来源于金黄色葡萄球菌,BR级),上海源叶生物科技有限公司;Anti-His tag Antibody,武汉博士德生物工程有限公司;辣根过氧化物酶标记山羊抗小鼠IgG(H+L),碧云天生物技术有限公司;EL-TMB显色试剂盒、N-苯基-1-萘胺(N-phenyl-1-naphthylamine, NPN),生工生物工程(上海)股份有限公司;重组鼠硫氧还原蛋白(Trx-His-tag),上海钰博生物科技有限公司;碱性磷酸酶试剂盒,南京建成生物科技有限公司;NB、NA培养基,青岛海博生物技术有限公司。
1.2 仪器与设备
THZ-98AB恒温振荡培养箱、LRH-250生化培养箱,一恒科学仪器(上海)有限公司;TGL-18M高速冷冻离心机,上海卢湘仪离心机仪器有限公司;Varioskan Flash荧光酶标仪,美国赛默飞世尔科技公司;DDS-307电导率仪,上海仪电科学仪器股份有限公司;DYCN-40G转印电泳仪,北京六一生物科技有限公司。
1.3 实验方法
1.3.1 受试菌的活化及菌悬液的制备
将受试菌接种于NA培养基过夜培养,挑取单菌落接种至NB培养基,扩大培养24 h(37 ℃,150 r/min),以1%接种量接种至新鲜NB培养基,培养至对数生长期,用平板计数法确定菌液浓度后,适当稀释备用。
1.3.2 DIZ的测定
滤纸片扩散法[17]测定HmCystatin C对6株受试菌的DIZ。HmCystatin C用无菌磷酸盐缓冲液(phosphate buffered saline,PBS)溶解至3.75 mg/mL,取40 μL 滴加在含菌培养皿表面的滤纸片上,3个平行。以无菌PBS做阴性对照,测定DIZ值。并选择抑制效果突出的受试菌,滴加40 μL不同质量浓度(0.937 5、1.875、3.75、7.5 mg/mL)的HmCystatin C溶液,以确定剂量依赖关系。
1.3.3 MIC和MBC的测定
采用二倍稀释法[18]测定HmCystatin C对6株受试菌的MIC和MBC。将14 mg/mL的HmCystatin C分别稀释至7、3.5、1.75、0.875 mg/mL。酶标孔中加HmCystatin C溶液和菌悬液各100 μL,各孔加入20 μL 的0.01%刃天青溶液(蓝色)显色。以空白培养基为阴性对照,不含HmCystatin C的菌液作为阳性对照。37 ℃培养24 h后,以不变色的蓝色微孔中样品的最小质量浓度为MIC。在各试验组中取蓝色微孔中菌液100 μL,平板涂布后培养并观察,以无菌生长的HmCystatin C最小质量浓度为MBC。
1.3.4 HmCystatin C对典型受试菌生长曲线的影响
选择HmCystatin C抑制效果最好的G-和G+各一株作为典型受试菌。菌悬液(OD600=0.6)中加入HmCystatin C至终浓度为1× MIC,以仅含受试菌组为对照,每2 h取样测定24 h内600 nm处吸光度。
1.3.5 HmCystatin C与典型受试菌的结合
参考CHEN等[19]方法,测定HmCystatin C与G-和G+典型受试菌的结合情况。菌悬液离心(3 500×g,5 min)后收集菌体沉淀,用无菌PBS洗涤并重悬至OD600=0.8,加入HmCystatin C至终浓度为1× MIC,室温孵育1 h后离心,并用适量无菌PBS洗涤菌体沉淀,3次重复后收集菌体沉淀和最后一次的菌体洗涤液。阳性对照为HmCystatin C组,阴性对照以Trx-His-tag替代HmCystatin C,进行SDS-PAGE以及Western blot检测HmCystatin C与细菌的结合情况。
1.3.6 HmCystatin C与LPS及PGN结合
采用ELISA法[19]测定HmCystatin C与LPS和PGN的结合情况。酶标板中加入适量LPS和PGN溶液过夜包被,再加入终浓度分别为0,0.5×MIC,1×MIC,1.5×MIC,2× MIC的HmCystatin C。先后经小鼠抗His-tag抗体和辣根过氧化物酶标记的山羊抗小鼠IgG (H+L)孵育并洗涤,用TMB试剂显色后于450 nm处检测吸光度。以等量无菌PBS溶液替代LPS或PGN溶液作阴性对照。
1.3.7 HmCystatin C对典型受试菌细胞完整性影响
1.3.7.1 典型受试菌G-细胞外膜渗透性测定
参考HELANDER等[20]方法,评估HmCystatin C对典型受试菌G-铜绿假单胞菌细胞外膜的破坏程度。将各浓度(0,0.5×MIC,1×MIC,1.5×MIC,2×MIC)的HmCystatin C分别与受试菌混合,以等量BSA代替HmCystatin C为对照组,加入20 μL的0.25 mmol/L NPN溶液,用荧光酶标仪于激发波长350 nm、发射波长420 nm下检测荧光强度。
1.3.7.2 典型受试菌G+细胞壁渗透性测定
取典型受试菌G+腐生葡萄球菌测定其碱性磷酸酶(alkaline phosphatase,AKP)含量。在受试菌中加入HmCystatin C使其终浓度分别为0.5× MIC和1× MIC,37 ℃,150 r/min培养,以仅含菌悬液组作为对照,5 h内定时取样,离心后取上清液参考试剂盒方法测定AKP含量。
1.3.7.3 HmCystatin C对典型受试菌细胞内膜通透性影响
参考HELANDER等[20]方法,测定胞内泄露物β-半乳糖苷酶含量变化,反映HmCystatin C对典型受试菌(G-及G+)细胞内膜通透性影响。受试菌悬液中加入等体积的邻硝基苯-β-D-半乳糖苷(2-nitrophenyl β-D-galactopyranoside,ONPG)溶液及HmCystatin C(0.5× MIC、1× MIC),阴性对照组以等量0.5%(质量分数)NaCl溶液代替HmCystatin C。于酶标仪420 nm处测定100 min内各时间点的吸光值。
1.3.7.4 典型受试菌菌液电导率的测定
参考TAO等[21]方法。离心收集G-及G+典型受试菌菌体沉淀,PBS洗涤后重悬至1×106 CFU/mL,加入HmCystatin C使终浓度分别为0.5×MIC,1×MIC。37 ℃,150 r/min培养,5 h内定时取样,离心后取上清液测定电导率。以仅含菌悬液作为对照组。以各培养时间点与0 h点对应的电导率值之差表示电导率增值。
1.3.8 数据统计分析
采用Origin 2017软件进行绘图,SPSS Statistics 27进行数据统计分析,实验重复3次,取测定结果的平均值,数据用平均值±标准误差表示。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 HmCystatin C对受试菌DIZ、MIC和MBC的测定
HmCystatin C对6株受试菌的DIZ、MIC和MBC如表1及图1所示。除G+枯草芽孢杆菌外,HmCystatin C对G-腐败希瓦氏菌、荧光假单胞菌、铜绿假单胞菌、中间气单胞菌以及G+腐生葡萄球菌均有抑制效果。对腐生葡萄球菌的DIZ[(15.4±0.02) mm]最大,其次是铜绿假单胞菌[(12.7±0.04) mm],而对腐败希瓦氏菌的DIZ[(10.3±0.1) mm]最小。且腐生葡萄球菌、铜绿假单胞菌、中间气单胞菌和荧光假单胞菌对HmCystatin C有相似的敏感性,MIC均为3.5 mg/mL。结合腐生葡萄球菌、铜绿假单胞菌、中间气单胞菌MBC值(3.5 mg/mL)可知,HmCystatin C对这3株菌的抑制效果最好;对腐败希瓦氏菌的抑菌效果较弱,其MIC和MBC均为7 mg/mL。该结果与抑菌圈直径的趋势符合。腐败希瓦氏菌是有氧冷藏海水鱼中特定的腐败微生物[6],因此淡水鲢鱼来源的cystatin C可能对其抑菌效果有限。从HmCystatin C剂量依赖实验(表2、图2)可知,随着HmCystatin C浓度增加,铜绿假单胞菌、中间气单胞菌及腐生葡萄球菌的DIZ依次增加。尤其腐生葡萄球菌在HmCystatin C质量浓度为1.875 mg/mL时仍呈现明显的抑菌圈。冷藏水产品中常见的优势腐败菌,如假单胞菌属、气单胞菌属和希瓦氏菌属,产尸胺和腐胺的能力强[4-5],G+腐生葡萄球菌也是水产品中典型产组胺的优势菌[2],严重影响水产品品质;HmCystatin C对除G+枯草芽孢杆菌外的受试G-和G+腐败菌均有明显抑制作用,因此其作为水产品保鲜剂具有潜在优势。
表1 HmCystatin C对6株受试菌的DIZ、MIC及MBC
Table 1 DIZ, MIC, and MBC of HmCystatin C against six tested bacteria

指标铜绿假单胞菌中间气单胞菌荧光假单胞菌腐败希瓦氏菌腐生葡萄球菌枯草芽孢杆菌DIZ/mm12.7±0.04Bb12.3±0.03Bb12.2±0.02Bb10.3±0.1Cc15.4±0.02Aa-MIC/(mg/mL)3.53.53.573.5-MBC/(mg/mL)3.53.5773.5-
注:“-”表示无抑菌作用,对不同组之间进行方差分析,各数据点上标记的大写和小写字母分别代表0.01和0.05水平上的差异。

a-铜绿假单胞菌;b-中间气单胞菌;c-荧光假单胞菌; d-腐败希瓦氏菌;e-腐生葡萄球菌;f-枯草芽孢杆菌
图1 HmCystatin C对6株受试菌的抑菌活性
Fig.1 Antibacterial activity of HmCystatin C against six tested bacteria
表2 不同浓度HmCystatin C对3株受试菌DIZ的影响 单位:mm
Table 2 Effect of different concentrations of HmCystatin C on DIZ of three tested bacteria
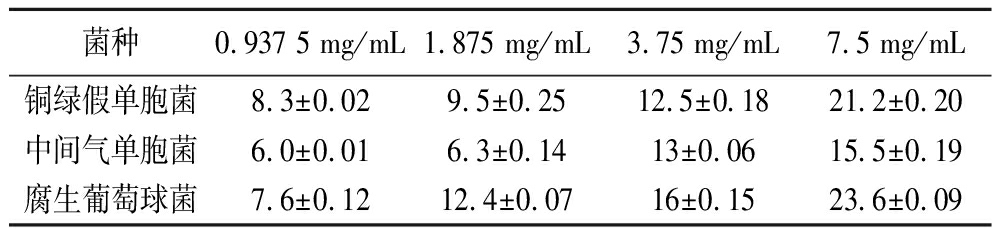
菌种0.937 5 mg/mL1.875 mg/mL3.75 mg/mL7.5 mg/mL铜绿假单胞菌8.3±0.029.5±0.2512.5±0.1821.2±0.20中间气单胞菌6.0±0.016.3±0.1413±0.0615.5±0.19腐生葡萄球菌7.6±0.1212.4±0.0716±0.1523.6±0.09
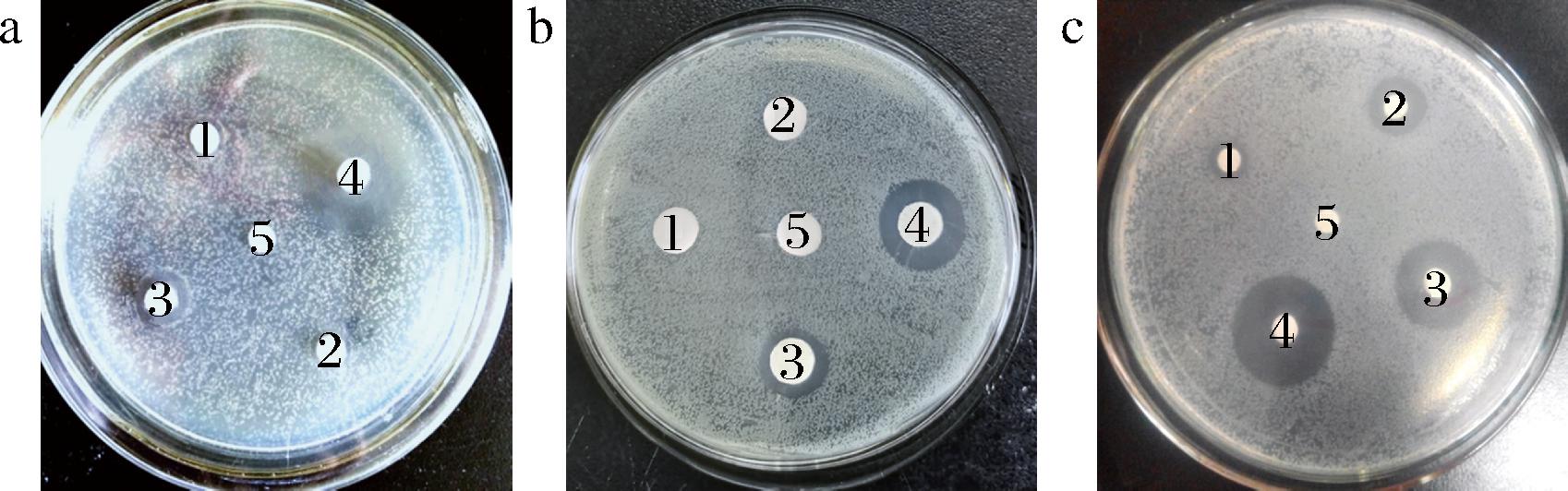
1-0.937 5 mg/mL;2-1.87 5 mg/mL;3-3.75 mg/mL; 4-7.5 mg/mL;5-PBS a-铜绿假单胞菌;b-中间气单胞菌;c-腐生葡萄球菌
图2 不同浓度HmCystatin C对3株受试菌的抑菌效果
Fig.2 Antibacterial effect of different concentrations of HmCystatin C on three tested bacteria
2.2 HmCystatin C对典型受试菌生长曲线的影响
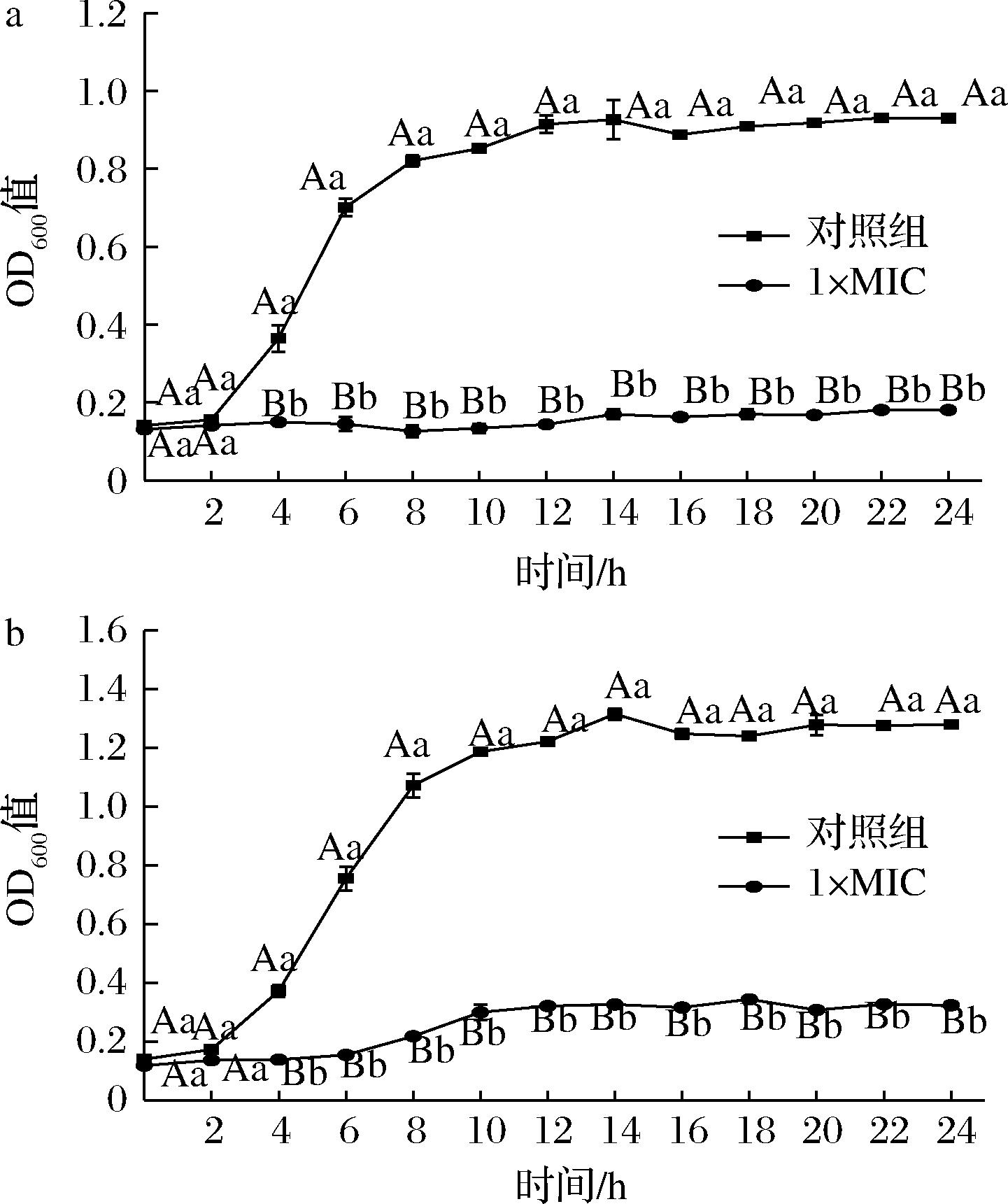
以抑制效果最好的G-铜绿假单胞菌和G+腐生葡萄球为典型受试菌,测定HmCystatin C对其生长曲线的影响(图3)。相比对照组典型的细菌生长模式,HmCystatin C在1× MIC水平下,对两株受试菌的生长都表现明显抑制(P<0.01);铜绿假单胞菌培养24 h 内无增殖迹象(图3-a);腐生葡萄球菌培养6 h后OD600值稍有增加,但增殖速度极显著低于对照组(P<0.01)(图3-b);结果表明,鲢鱼重组HmCystatin C在1× MIC下能够抑制受试菌对数生长期快速分裂增殖,表现出显著的生长抑制效果。
2.3 HmCystatin C与典型受试菌菌体结合
由图4可知,阳性对照组及两实验组均有明显的条带,阴性对照组和最后一次菌体洗涤液组均未显色,说明HmCystatin C与菌体孵育后,能结合到G-铜绿假单胞菌和G+腐生葡萄球菌菌体表面。此外铜绿假单胞菌实验组比腐生葡萄球菌实验组的条带更明显,说明HmCystatin C与G-铜绿假单胞菌结合能力更强。HmCystatin C(Genebank序列号:AGW15355.1)氨基酸序列中富含带正电荷的Lys,这可能有利于其利用N端带正电荷的序列与细菌表面的负电荷发生静电吸引[22]。此外,BROGDEN[23]认为抗菌肽能结合到细胞表面,主要是与G+细胞壁中带负电荷的磷壁酸质相互作用,这种结合使得抗菌肽能够通过细胞壁(壁磷壁酸和膜磷壁酸)并与细菌质膜相互作用,从而发挥抑菌作用。尽管目前尚未知HmCystatin C与细菌细胞壁结合的具体方式和位点,但可推测HmCystatin C能够结合到细菌表面是其进一步发挥抑菌作用的前提。
a-铜绿假单胞菌;b-腐生葡萄球菌
图3 HmCystatin C对铜绿假单胞菌和腐生葡萄球菌 生长曲线的影响
Fig.3 The effect of HmCystatin C on the growth curves of P.aeruginosa and S.saprophyticus
注:对不同组之间进行方差分析,各数据点上标记的大写和 小写字母分别代表0.01和0.05水平上的差异(下同)。
1-HmCystatin C阳性对照;2-腐生葡萄球菌实验组; 3-腐生葡萄球菌阴性对照;4-腐生葡萄球菌最后一次洗涤液; 5-铜绿假单胞菌实验组;6-铜绿假单胞菌阴性对照组; 7-铜绿假单胞菌最后一次洗涤液
图4 HmCystatin C与铜绿假单胞菌和腐生葡萄球菌 结合的Western blot分析
Fig.4 Western blot analysis of HmCystatin C binding to P.aeruginosa and S.saprophyticus
2.4 HmCystatin C与LPS和PGN结合
LPS和PGN分别是G-和G+细胞壁的主要成分。ELISA检测发现,HmCystatin C能与LPS和PGN结合(图5),其与LPS的亲和性强于PGN,并且随着蛋白浓度增大,与LPS的结合趋势增强。结合Western blot检测结果,推测HmCystatin C结合在菌体表面,很可能涉及与细胞壁主要成分LPS和PGN的相互作用,是进一步突破细胞壁屏障发挥抑菌作用的前提。BLANCA等[15]通过透射电镜也观察到,G+粪肠球菌和变形链球菌经重组人cystatin C在37 ℃处理24 h后,肽聚糖层被破坏,cystatin C穿透细胞壁。
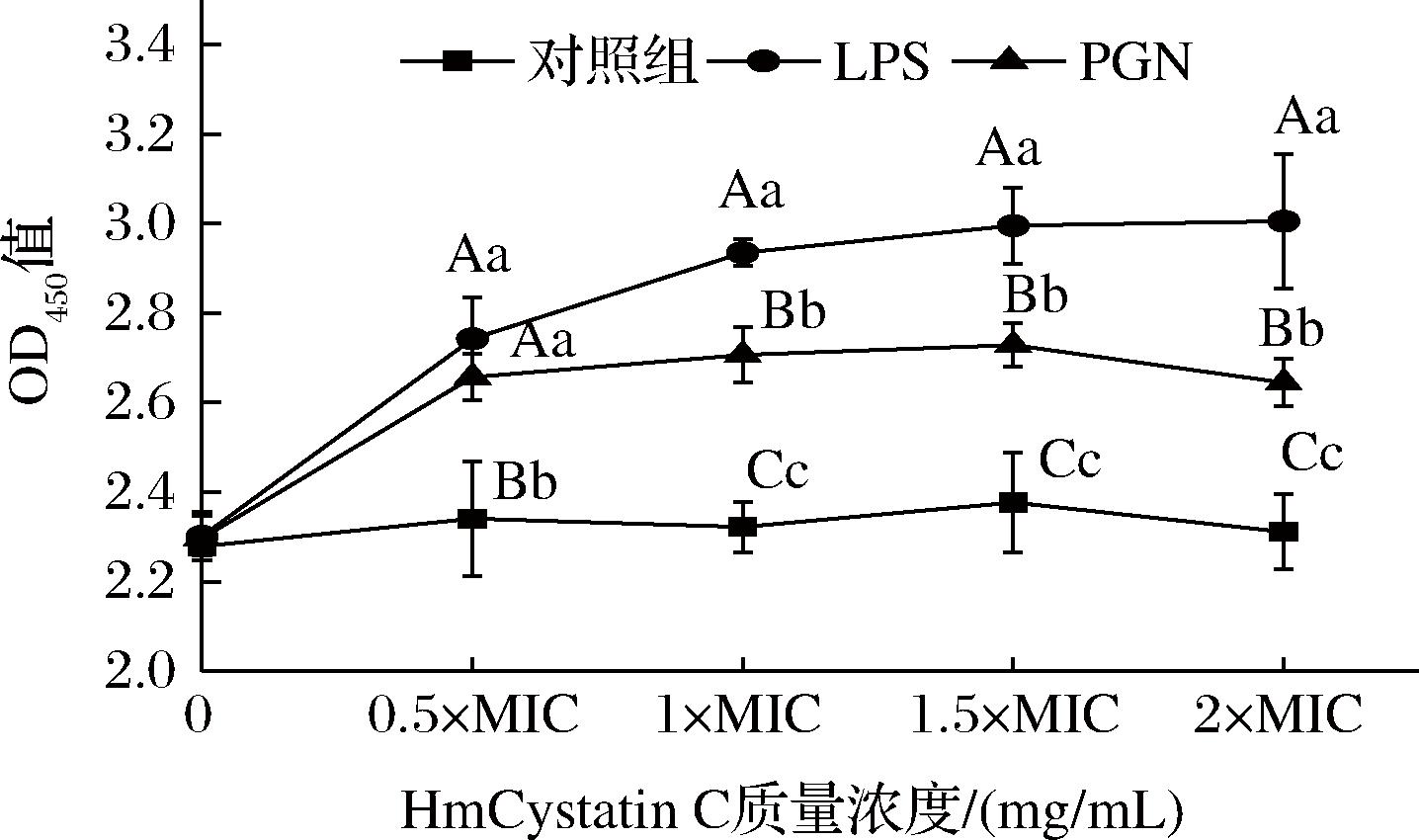
图5 HmCystatin C与LPS和PGN的结合
Fig.5 Binding of HmCystatin C to LPS and PGN
2.5 HmCystatin C对典型受试菌细胞完整性的影响
2.5.1 HmCystatin C对典型受试菌细胞壁通透性的影响
2.5.1.1 HmCystatin C对G-铜绿假单胞菌细胞外膜的影响
G-细胞壁由细胞外膜和细胞间质层组成。当G-细胞外膜被破坏,NPN可进入胞内疏水介质中,发出强烈的荧光。在各浓度的HmCystatin C作用下,铜绿假单胞菌的荧光强度值相比对照组极显著增加(P<0.01),尤其在1× MIC的HmCystatin C浓度范围内,菌液的荧光强度迅速升高,此后趋缓(图6)。上述结果说明HmCystatin C破坏了G-铜绿假单胞菌细胞壁,破坏程度与HmCystatin C浓度呈正相关。而通常G-细胞壁的渗透性与其外膜层的LPS密切关系[24]。这与上述HmCystatin C对LPS具有较强亲和性的结果一致。推测HmCystatin C通过与细胞壁表面的LPS吸附结合,可能破坏并穿透铜绿假单胞菌细胞壁外膜层,继而发挥抑菌作用。
2.5.1.2 HmCystatin C对G+腐生葡萄球菌细胞壁的影响
AKP存在于细胞壁与细胞膜之间,当细胞壁被破坏后,AKP泄露。HmCystatin C对细菌细胞壁的影响程度,可通过AKP含量变化来衡量。由图7可知,腐生葡萄球菌对照组中,在5 h内AKP的含量没有明显变化,而在HmCystatin C的两个处理组中,AKP有不同程度外泄。随着HmCystatin C浓度的增加和作用时间的延长,泄露的AKP含量升高。说明HmCystatin C对G+腐生葡萄球菌细胞壁具有破坏作用。BLANCA等[15]从形态学上观察到,重组人cystatin C也能够使G+粪肠球菌和变形链球菌细胞壁断裂。
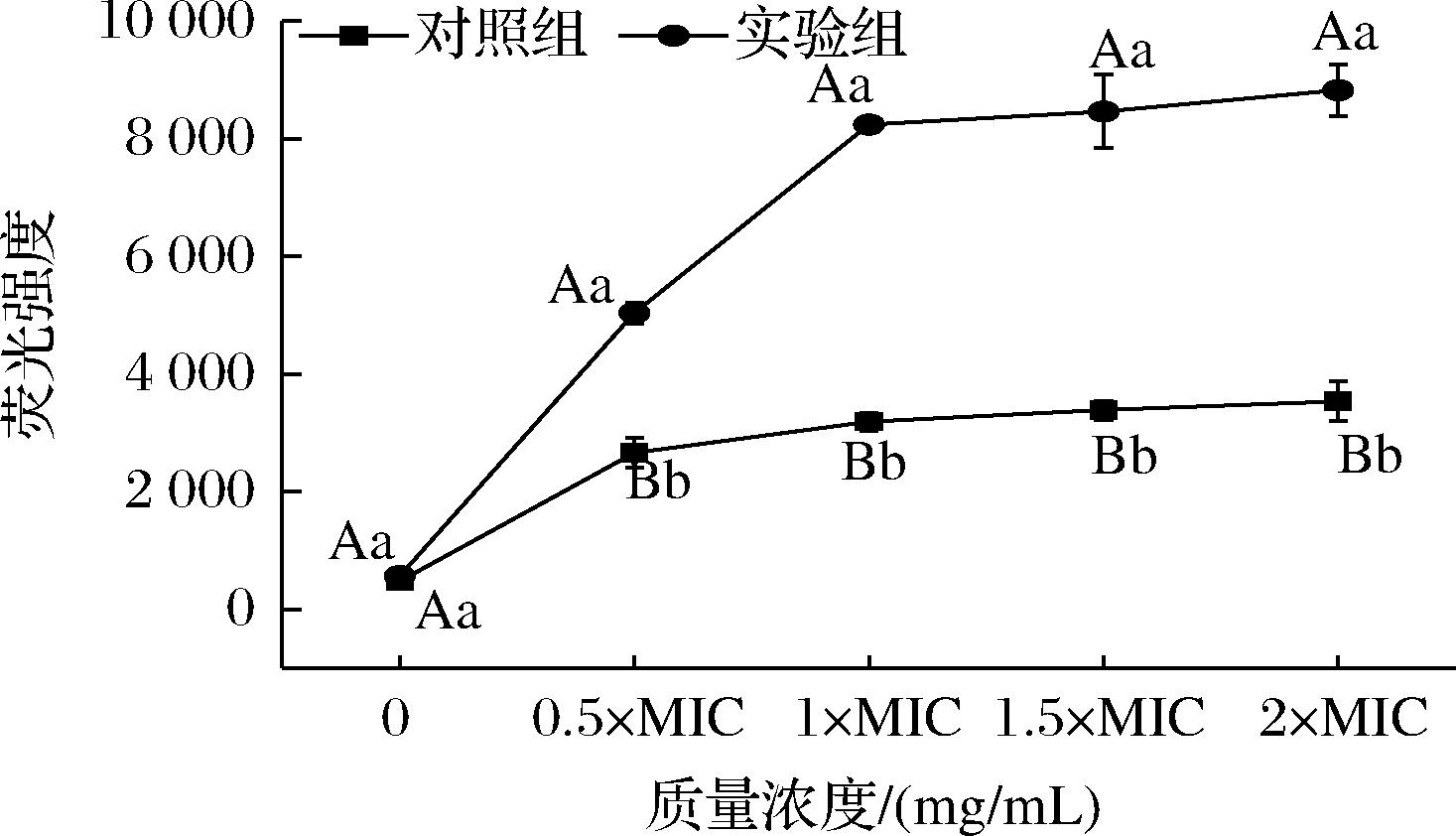
图6 HmCystatin C对铜绿假单胞菌细胞壁通透性的影响
Fig.6 The effect of HmCystatin C on cell wall permeability of P.aeruginosa
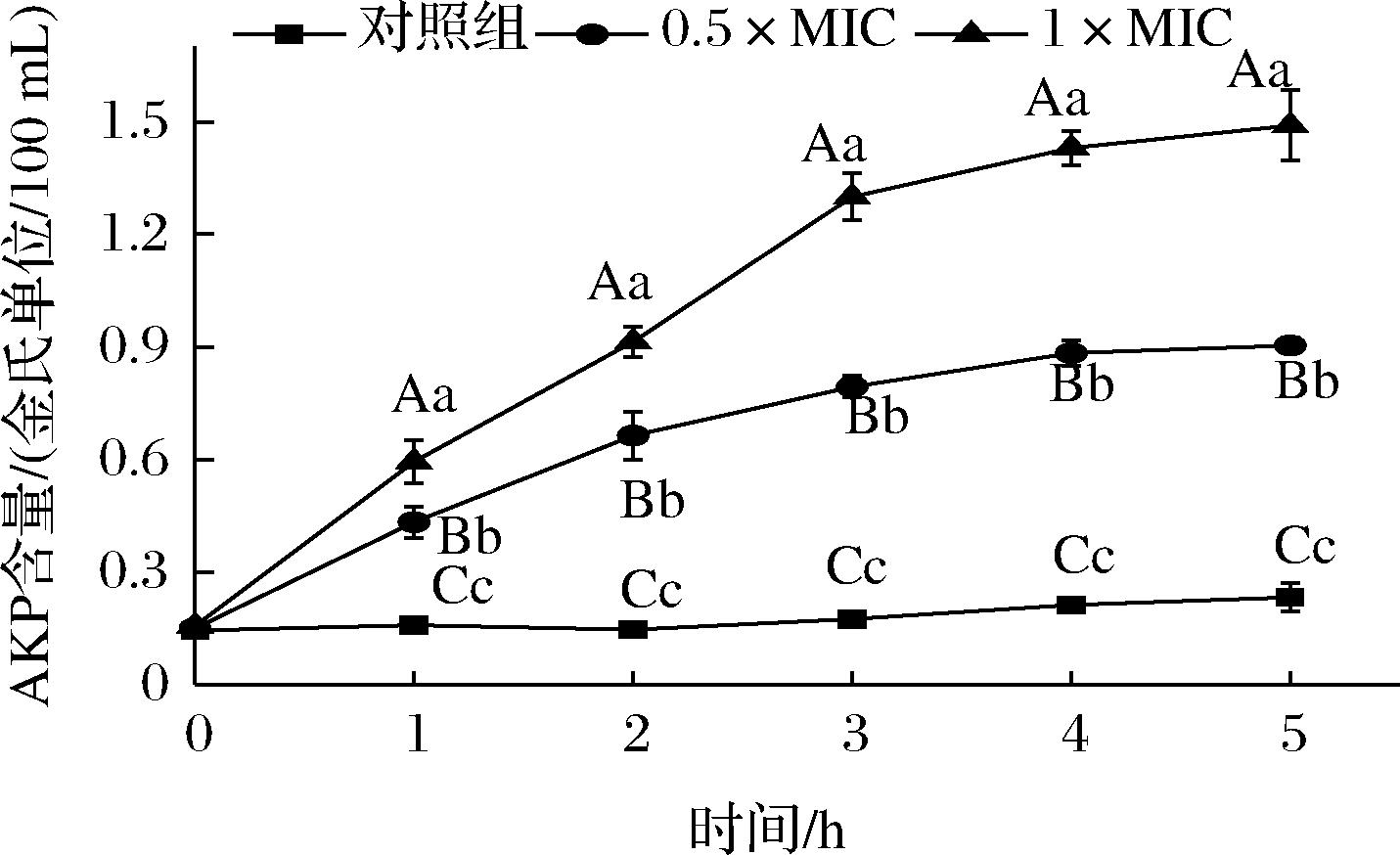
图7 HmCystatin C对腐生葡萄球菌细胞壁通透性的影响
Fig.7 The effect of HmCystatin C on cell wall permeability of S.saprophyticus
2.5.2 HmCystatin C对典型受试菌细胞质膜通透性的影响
2.5.2.1 HmCystatin C对典型受试菌细胞内膜的影响
当受试菌细胞内膜被破坏,胞内的β-半乳糖苷酶渗出,因此其含量变化反映受试菌细胞内膜通透性的变化[25]。在HmCystatin C作用下,铜绿假单胞菌(图8-a)和腐生葡萄球菌(图8-b)OD420值均比对照组大(P<0.01),且随着HmCystatin C浓度增加而增大。上述结果说明,经HmCystatin C处理后,G-铜绿假单胞菌和G+腐生葡萄球菌细胞内膜被破坏,影响菌体正常生长。BLANCA等[15]从形态学上也观察到,重组人cystatin C能够使G+粪肠球菌和变形链球菌细胞质膜断裂,细胞质内容物渗出。
2.5.2.2 HmCystatin C对典型受试菌电导率的影响
当抗菌物质作用于细菌,细胞膜被破坏,胞内电解质泄露,培养液的电导率上升,因此菌液电导率的变化反映了细菌细胞质膜通透性的变化[26]。
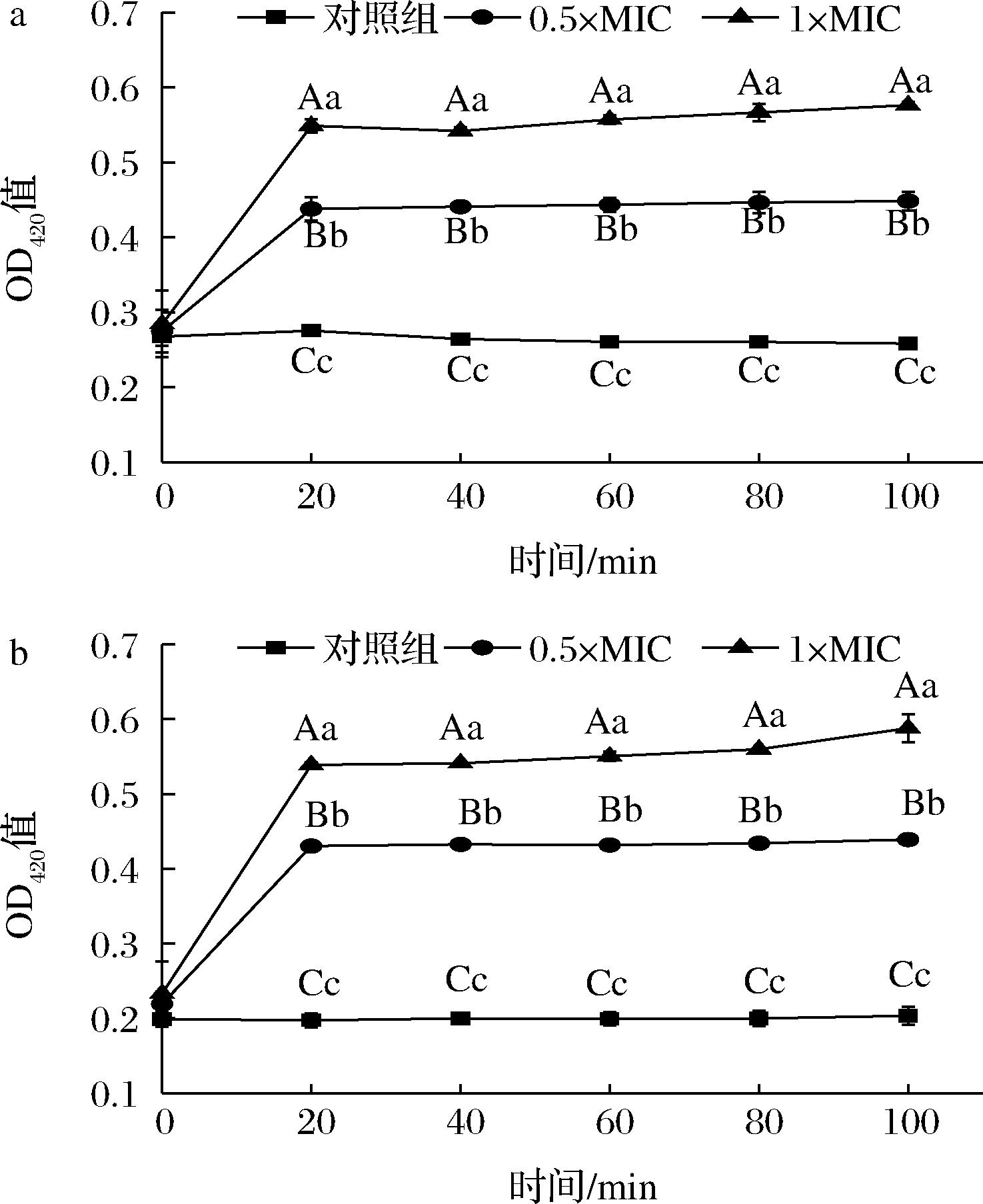
a-铜绿假单胞菌;b-腐生葡萄球菌
图8 HmCystatin C对铜绿假单胞菌和腐生葡萄球菌 内膜通透性的影响
Fig.8 The effect of HmCystatin C on the inner membrane permeability of P.aeruginosa and S.saprophyticus
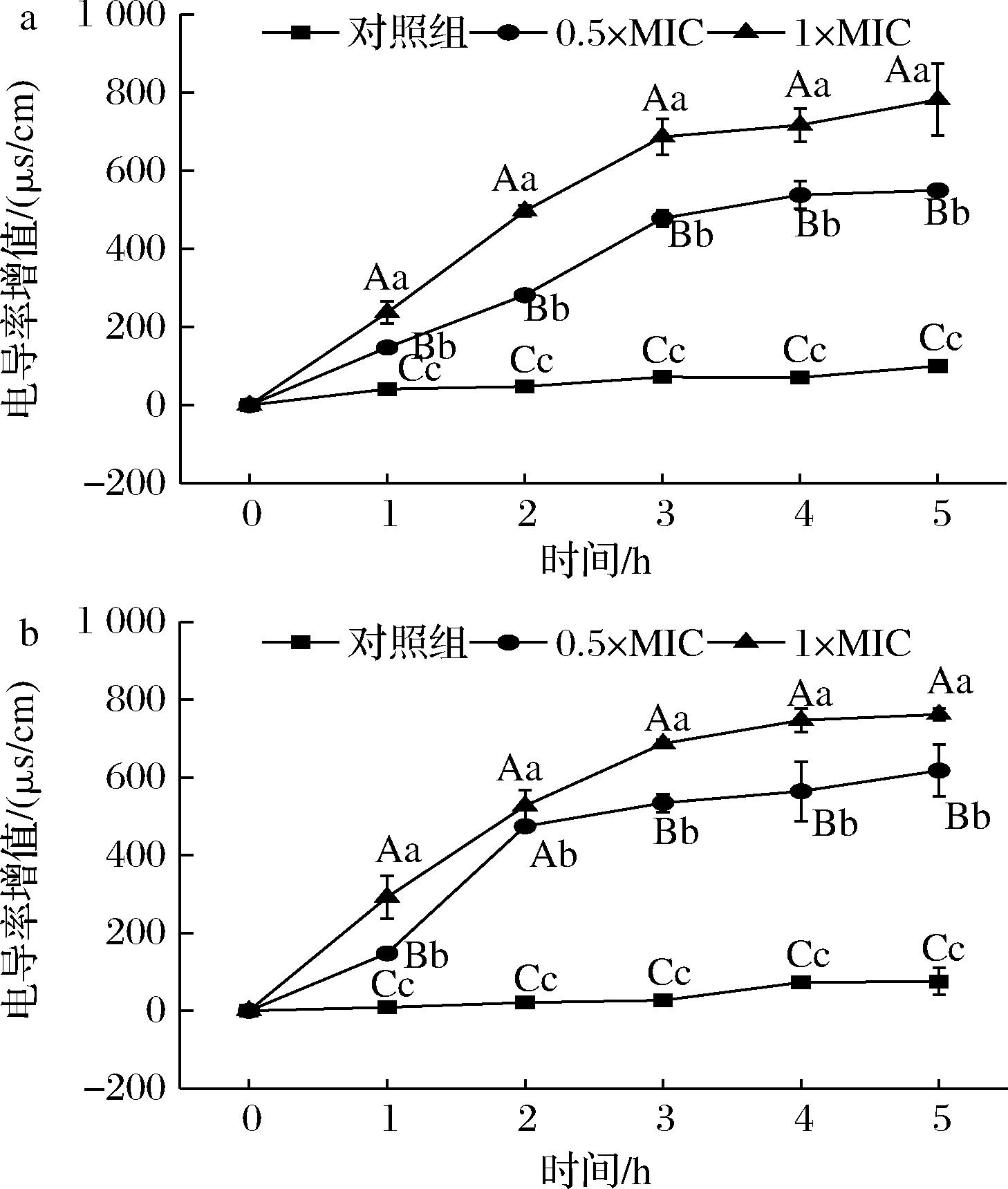
a-铜绿假单胞菌;b-腐生葡萄球菌
图9 HmCystatin C对铜绿假单胞菌和腐生葡萄球菌 菌液电导率的影响
Fig.9 The effect of HmCystatin C on conductivity of P.aeruginosa and S.saprophyticus suspension
经HmCystatin C处理后,两种受试菌的电导率增值均极显著高于对照组(P<0.01),且与HmCystatin C浓度呈正相关(图9)。这与对受试菌细胞壁通透性影响结果一致,也与抑菌圈表现出HmCystatin C剂量依赖关系相符。该结果可进一步验证HmCystatin C能够破坏铜绿假单胞菌和腐生葡萄球菌细胞质膜的完整性,使细胞膜通透性增强。
3 结论
本文研究了HmCystatin C对水产品腐败菌的抑菌活性和抑菌机制。除枯草芽孢杆菌外,HmCystatin C对其余5株受试菌均有抑菌效果,且腐生葡萄球菌、铜绿假单胞菌、中间气单胞菌对HmCystatin C更敏感。1× MIC的HmCystatin C即能抑制铜绿假单胞菌和腐生葡萄球菌对数生长期快速分裂增殖,抑菌效果显著。Western blot结果表明,HmCystatin C能与G-和G+典型受试菌菌体结合,且与G-典型受试菌铜绿假单胞菌体结合能力更强。ELISA分析进一步发现,HmCystatin C能与G-和 G+细胞壁成分即LPS和PGN发生结合,且与LPS的结合能力更强。因此HmCystatin C结合到细菌表面,可能是其发挥抑菌作用的必要前提。此外,HmCystatin C作用后,G-和G+典型受试菌细胞壁和细胞膜通透性明显增加,细胞内电解质、AKP和β-半乳糖苷酶出现不同程度的泄漏。综上结果,我们推测HmCystatin C可能首先吸附到菌体表面并与细胞壁成分结合,进而破坏了细胞完整性,导致细胞壁和细胞膜通透性增加,细胞内容物外泄,最终造成菌体死亡,但HmCystatin C对G-和G+的作用方式和机制可能有所差异,相关抑菌机理待进一步研究。HmCystatin C对水产品中常见的G-和G+优势腐败菌均表现良好的抑制作用,具有作为高效生物防腐剂的潜在优势,本文研究结果对今后鱼源cystatin C应用于水产品防腐保鲜具有指导意义。
[1] 李红, 赵春燕.乳酸链球菌素的研究进展[J].食品科技, 2006, 31(1):75-78. LI H, ZHAO C Y.Research and development of nisin[J].Food Science and Technology, 2006, 31(1):75-78.
[2] 吴佳佳, 王思齐, 戴志远.咸鳓鱼中产组胺菌的分离与鉴定[J].食品与发酵工业, 2019, 45(3):71-76. WU J J, WANG S Q, DAI Z Y.Isolation and identification of histamine-producing bacteria in salted Chinese herring[J].Food and Fermentation Industries, 2019, 45(3):71-76.
[3] 熊善柏. 水产品保鲜储运与检验[M].北京:化学工业出版社, 2007. XIONG B S. Preservation, Transportation and Inspection of Aquatic Products[M]. Beijing: Chemical Industry Press, 2007.
[4] WANG H, LUO Y K, HUANG H P, et al.Microbial succession of grass carp (Ctenopharyngodon idellus) filets during storage at 4 ℃ and its contribution to biogenic amines' formation[J].International Journal of Food Microbiology, 2014, 190:66-71.
[5] ZHUANG S, TIAN L, LIU Y Y, et al.Amino acid degradation and related quality changes caused by common spoilage bacteria in chill-stored grass carp (Ctenopharyngodon idella)[J].Food Chemistry, 2023, 399:133989.
[6] 罗庆华. 水产品特定腐败菌研究进展[J].食品科学, 2010, 31(23):468-472. LUO Q H.Research advances on specific spoilage organisms of aquatic products[J].Food Science, 2010, 31(23):468-472.
[7] KOLACZKOWSKA A, KOLACZKOWSKI M, SOKOLOWSKA A, et al.The antifungal properties of chicken egg cystatin against Candida yeast isolates showing different levels of azole resistance[J].Mycoses, 2010, 53(4):314-320.
[8] POPOVIC M, ANDJELKOVIC U, BURAZER L, et al.Biochemical and immunological characterization of a recombinantly-produced antifungal cysteine proteinase inhibitor from green kiwifruit (Actinidia deliciosa)[J].Phytochemistry, 2013, 94:53-59.
[9] 任阳阳. 鲢鱼卵类Cystatin的鉴定及其对冷藏鲢鱼肉片中假单胞菌J-4的抑制作用研究[D].雅安:四川农业大学, 2013. REN Y Y.Characterization of like-cystatin from silver carp egg and its bactericidal action to pseudomnas J-4 from refrigeration silver carp sliced meat[D].Yaan:Sichuan Agricultural University, 2013. [10] 陈海, 姜海洋, 吴睿, 等.鲢鱼重组Cystatin的原核表达、鉴定及对铜绿假单胞菌的抑制作用[J].食品科学, 2014, 35(21):133-137. CHEN H, JIANG H Y, WU R, et al.Prokaryotic expression and identification of recombinant cystatin of Hypophthalmichthys molitrix and antibacterial activity on Pseudomonas aeruginosa[J].Food Science, 2014, 35(21):133-137.
[11] 钟海霞, 李冉, 李树红, 等.重组Cystatin对冷藏鲢鱼的抑菌效果[J].食品与生物技术学报, 2019, 38(5):111-118. ZHONG H X, LI R, LI S H, et al.Study on bacteriostasis of the cystatin from chilled silver carp[J].Journal of Food Science and Biotechnology, 2019, 38(5):111-118.
[12] YU H Y, XU X, ZHANG Q Q, et al.Molecular characterization, expression and functional analysis of cystatin C in Japanese flounder (Paralichthys olivaceus)[J].Fish &Shellfish Immunology, 2019, 86:695-701.
[13] 金羽. 鲢鱼卵重组Cystatin的制备及其在抑制鱼糜凝胶软化中的应用研究[D].雅安:四川农业大学, 2013. JIN Y.Studies on preparation of silver carp eggs recombinant cystatin and its application in the inhibition of surimi gel weakening[D].Ya′an:Sichuan Agricultural University, 2013.
[14] LUO Y, SONG Y Z.Mechanism of antimicrobial peptides:Antimicrobial, anti-inflammatory and antibiofilm activities[J].International Journal of Molecular Sciences, 2021, 22(21):11401.
[15] BLANCA B, DE LOURDES L M, FELIPE J L, et al.Study of the ultrastructure of Enterococcus faecalis and Streptococcus mutans incubated with salivary antimicrobial peptides[J].Clinical and Experimental Dental Research, 2021, 7(3):365-375.
[16] LI R, TAN X Q, LI S H, et al.Cloning, expression, characterization, and tissue distribution of cystatin C from silver carp (Hypophthalmichthys molitrix)[J].Journal of Agricultural and Food Chemistry, 2021, 69(17):5144-5154.
[17] WESIERSKA E, SALEH Y, TRZISZKA T, et al.Antimicrobial activity of chicken egg white cystatin[J].World Journal of Microbiology and Biotechnology, 2005, 21(1):59-64.
[18] 况弯弯. 紫苏挥发油微囊的制备与表征、抑菌活性研究[D].南昌:江西中医药大学, 2020. KUANG W W.Preparation and characterizon of Perilla frutescens essential oil microcapsules and its antibacterial activity[D].Nanchang:Jiangxi University of Traditional Chinese Medicine, 2020.
[19] CHEN L, YAN J, SUN W P, et al.A zebrafish intelectin ortholog agglutinates both Gram-negative and Gram-positive bacteria with binding capacity to bacterial polysaccharide[J].Fish &Shellfish Immunology, 2016, 55:729-736.
[20] HELANDER I M, MATTILA-SANDHOLM T.Fluorometric assessment of gram-negative bacterial permeabilization[J].Journal of Applied Microbiology, 2000, 88(2):213-219.
[21] TAO Y, QIAN L H, XIE J.Effect of chitosan on membrane permeability and cell morphology of Pseudomonas aeruginosa and Staphyloccocus aureus[J].Carbohydrate Polymers, 2011, 86(2):969-974.
[22] AGARWALA K L, KAWABATA S I, HIRATA M, et al.A cysteine protease inhibitor stored in the large granules of horseshoe crab hemocytes:Purification, characterization, cDNA cloning and tissue localization[J].The Journal of Biochemistry, 1996, 119(1):85-94.
[23] BROGDEN K A.Antimicrobial peptides:Pore formers or metabolic inhibitors in bacteria?[J].Nature Reviews Microbiology, 2005, 3(3):238-250.
[24] 马鹏. 埃希氏大肠杆菌脂多糖与其细胞外膜特性关系的研究[D].无锡:江南大学, 2011. MA P.The effect of LPS on the outer membranes of Escherichia coli cell[D].Wuxi:Jiangnan University, 2011.
[25] 赵广旭. 基于疏水性和螺旋性对膜活性多肽的设计与活性研究[D].长春:吉林大学, 2017. ZHAO G X.Design and study of membrane active peptides and biological activities based on hydrophobicity and helicity[D].Changchun:Jilin University, 2017.
[26] 刘昊, 赵自冰, 吴丹丹, 等.黄芩苷对大肠杆菌细胞通透性的影响[J].中国畜牧兽医, 2017, 44(6):1890-1894. LIU H, ZHAO Z B, WU D D, et al.Effect of baicalin on cell permeability of Escherichia coli[J].China Animal Husbandry &Veterinary Medicine, 2017, 44(6):1890-1894.