盐池滩羊是生长在我国宁夏盐池县境内的一种特有的绵羊品种,其肉质细嫩鲜美、营养丰富且不膻不腥[1]。2019年以来,其饲养量稳定在320万只以上,羊肉产量达到2.75万t,产值达12亿元,同时每年产生大约5 000 t加工副产物——滩羊尾[2],由于其深加工不足造成资严重源浪费,制约了滩羊产业链的有效延伸。因此深入开展对滩羊尾脂的精深加工具有重要的经济、环境和社会意义。
滩羊尾脂不仅风味独特、胆固醇含量低,还富含共轭亚油酸(conjugated linoleic acid, CLA)、油酸等功能性营养成分。研究表明,CLA有提高免疫力[3]、降血压[4]、抑制肿瘤[5]、抗氧化[6]、抗动脉粥样硬化[7]以及减肥[8]等功能。我国对CLA的研究起步较晚,大多是从植物和微生物中提取或转化。刘芸[9]利用碱法异构法从黄秋葵种子中成功制备出CLA,并发现CLA-Arg对DPPH自由基和ABTS阳离子自由基的半抑制清除率IC50为2.76、1.43 mg/mL。赵俊[10]从茶油中合成了CLA,并利用A+硅胶层析柱对CLA进行了纯化,使其纯度由53.45%提高到了90.4%,CLA-Arg对DPPH自由基、ABTS阳离子自由基、羟自由基的IC50值分别为2.82、1.37、3.47 mg/mL。李垚等[11]利用嗜乳酸杆菌转化成菜籽油并转化CLA,通过响应面实验优化,CLA产量可达到(230.12±7.52) μg/mL。目前,国内外有关从动物体内提取功能性油脂多为鱼油二十碳五烯酸、二十二碳六烯酸的研究,但以羊脂肪为原料提取CLA的报道较少。
有研究发现,CLA主要存在于反刍动物体内,其中羔羊的CLA含量最高,达到4.3~19 mg/g[12]。于洋等[13]用短程分子蒸馏法提取滩羊尾脂CLA,但由于设备价格昂贵、对材料密封及技术要求较高,初期投入比较大,生产能力有限,不利于工业化提取。本文以滩羊尾脂CLA的制备和生物活性分析为目标,以得率和纯度为考察指标,首先采用低温结晶和尿素包合法通过单因素试验和正交试验优化提取工艺,进而探索对优化条件下获得的滩羊尾脂CLA的抗氧化活性和降胆固醇活性差异,旨在为今后滩羊尾脂CLA工业化提取及活性应用方面的研究提供理论指导。
1 材料与方法
1.1 材料与试剂
滩羊尾,宁夏盐池县大夏牧场食品有限公司;CLA标品,美国Sigma公司;石油醚(30~60 ℃)、正己烷、丙酮、氢氧化钠、盐酸、浓硫酸、甲醇(均为分析级),国药集团化学试剂有限公司;DPPH、ABTS,北京酷来搏科技有限公司;邻苯三酚,上海贤鼎生物科技有限公司;Tris-HCl、无水乙醇、无水硫酸钠、氯化钠、胆酸钠,上海易恩化学技术有限公司;抗坏血酸,中国烟台市双双化工有限公司;过硫酸钾,阿拉丁试剂(上海)有限公司;胆固醇标品、牛磺胆酸钠、油酸、甘氨胆酸钠,上海源叶生物科技有限公司。
1.2 仪器与设备
UV-1100紫外分光光度计,豪沃生物科技(上海)有限公司;DF-101S集热式恒温加热磁力搅拌器,上海力辰邦西仪器科技有限公司;脂肪提取器,腰庄玻璃仪器制造厂;旋转蒸发仪,上海秋佐科学仪器有限公司;TGL-16D冷冻高速离心机,常州中捷实验仪器制造有限公司;电热鼓风干燥箱,上海一恒科学仪器有限公司。
1.3 实验方法
1.3.1 滩羊尾粗脂肪的提取
参考于洋等[13]方法,并略作修改。将斩拌好的滩羊尾脂称取20 g并用滤纸包扎好,按照料液比1∶30倒入石油醚使其不断回流抽提10 h,在45 ℃下旋转蒸发直至完全蒸出石油醚,称重计算粗脂肪提取率。
粗脂肪提取率的计算如公式(1)所示:
(1)
式中:X,粗脂肪提取率,%;m1,抽提后粗脂肪质量,g;m2,样品质量,g。
1.3.2 滩羊尾脂CLA测定
1.3.2.1 标准曲线的绘制
准确称取CLA标准样品0.050 7 g,用正己烷定容至50 mL得到CLA标准样品溶液,稀释500倍,在紫外区200~300 nm扫描,确定CLA的最大吸收波长为233 nm。再分别吸取0.1~0.6 mL标准样品溶液用正己烷定容至50 mL备用,在233 nm处测其吸光度,以CLA浓度(μg/mL)为横坐标,吸光值为纵坐标,绘制CLA标准曲线。得到的线性回归方程为Y=0.044 41x-0.005 79,相关系数为R2=0.999 23,线性范围为1~12 μg/mL,检出限为2 μg/mL。
1.3.2.2 样品中CLA含量的测定
称取一定量待测样品,用正己烷进行稀释,采用紫外分光光度计在233 nm处测其吸光值,利用标准曲线计算其含量,计算如公式(2)和公式(3)所示:
(2)
(3)
式中:X1,滩羊尾脂CLA得率,mg/g;X2,CLA纯度,mg/g;c,滩羊尾脂CLA质量浓度,mg/mL;n,稀释倍数;V,反应后CLA体积,mL;mi为反应前CLA质量,g;m0为反应后样品质量,g。
1.3.3 混合脂肪酸的制备
将粗脂肪、NaOH、乙醇按照1∶0.4∶10(g∶mL∶g)的比例进行皂化,用水溶解后调节pH值为1~2,加入适量石油醚萃取2~3次,合并有机相,加入适量无水硫酸钠脱水,过滤,旋转蒸发除去有机溶剂即得混合脂肪酸。
1.3.4 低温结晶单因素试验
取适量混合脂肪酸与有机溶剂混合,不断搅拌直到完全溶解。然后将混合物在一定温度下结晶,直到形成絮凝沉淀,取出后迅速抽滤,并旋蒸除去残留溶剂。测定CLA纯度和得率。
按照上述方法,探究不同有机溶剂(石油醚、丙酮、无水乙醇、正己烷),不同料液比(1∶9、1∶12、1∶15、1∶18,g∶mL),不同结晶时间(6、9、12、15 h),不同结晶温度(4、-20、-40、-80 ℃)对滩羊尾脂CLA得率和纯度的影响。初始条件有机溶剂为无水乙醇,料液比为1∶12,结晶时间为9 h,结晶温度为-20 ℃。所有单因素试验参数的优化均进行3组平行实验。
1.3.5 低温结晶正交试验优化
参考单因素试验结果,选取结晶温度(A),结晶时间(B),混合脂肪酸与无水乙醇加量比(g∶mL)(C)为考察因素,采用正交表L9(33)进行正交试验设计,以CLA纯度为指标进一步研究各因素对低温结晶纯化滩羊尾脂CLA最优工艺的影响,实验因素和水平如表1所示。
表1 低温结晶正交试验因素水平表
Table 1 Low temperature crystallization orthogonal experiment factor level table
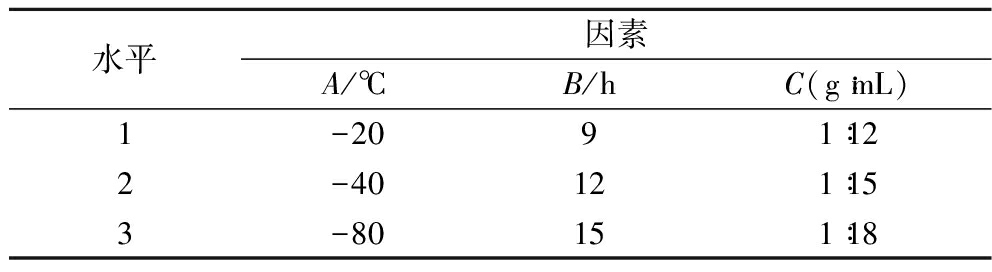
水平因素A/℃B/hC(g∶mL)1-2091∶122-40121∶153-80151∶18
1.3.6 尿素包合单因素试验
在冷冻结晶法纯化基础上选择最优条件进一步采用尿素包合的方法提纯以得到纯度更高的CLA。
参照李慧美[14]方法并略作修改。按一定配比使尿素和混合脂肪酸溶于乙醇中,并在70 ℃下回流30 min,最后放于适宜温度下包合一定时间。包合结束后真空抽滤,并调节pH值为1~2,最后用石油醚萃取2~3次经旋转蒸发仪除去有机溶剂后,即得纯化后的滩羊尾脂CLA[15]。测定CLA纯度和得率。
按照上述方法,探究包合温度(25、4、-20、-40、-80 ℃),包合时间(6、12、18、24、30 h),脂肪酸与尿素质量比(1∶1、1∶2、1∶3、1∶4、1∶5),尿素与乙醇料液比(1∶3、1∶4、1∶5、1∶6、1∶7,g∶mL)对滩羊尾脂CLA得率和纯度的影响。初始条件为包合温度为4 ℃,包合时间为12 h,脂肪酸与尿素质量比为1∶3,尿素与乙醇料液比为1∶5。所有单因素试验参数的优化均进行3组平行实验。
1.3.7 尿素正交试验优化
参考单因素试验结果,选取包合温度(A),包合时间(B),脂肪酸与尿素质量比(C),尿素与乙醇料液比(D)为考察因素,采用正交表L9(34)进行正交试验设计,以CLA纯度为指标进一步研究各因素对尿素包合纯化滩羊尾脂CLA最优工艺的影响,实验因素和水平如表2所示。
表2 尿素包合正交试验因素水平表
Table 2 Factor level table of orthogonal experiment of urea inclusion

水平因素A/℃B/hCD125101∶21∶424121∶31∶53-20141∶41∶6
1.3.8 滩羊尾脂CLA的抗氧化活性
1.3.8.1 DPPH自由基清除能力的测定
参考LAI等[16]的方法,并略作修改。分别取2 mL不同浓度的样品与2 mL浓度为0.1 mmol/L的DPPH溶液振荡摇匀,常温避光反应30 min后在517 nm处测定吸光值,以维生素C为阳性对照,每个样品测定3次,DPPH自由基清除率的计算如公式(4)所示:
DPPH自由基清除率![]()
式中:A0,无水乙醇+DPPH溶液吸光值;A1,样品溶液+DPPH溶液吸光值;A2,样品溶液+无水乙醇吸光值。
1.3.8.2 ABTS阳离子自由基清除能力的测定
参考刘芸[9]的方法。
1.3.9 滩羊尾脂CLA的降胆固醇活性
1.3.9.1 模拟胆汁胶束法
参照高婕[17]的方法,以胆固醇浓度为横坐标,吸光度为纵坐标绘制标准曲线,得回归方程为Y=0.073 58x-0.008 74(R2=0.999 25)。
1.3.9.2 体外结合胆酸盐法
参照刘晓静[18]的方法,以CLA浓度为横坐标,胆酸盐结合率为纵坐标。得到牛磺胆酸钠标准曲线方程为:Y=0.262 69x-0.001 79,R2=0.999 45;甘氨胆酸钠标准曲线方程为:Y=0.284 09x+0.011 19,R2=0.999 15;胆酸钠标准曲线方程为:Y=0.267 35x-0.013 08,R2=0.994 47。
1.4 数据处理
所有实验均设置3个平行组,实验结果以平均值±标准差表示,采用SPSS 26和正交软件助手对实验数据进行显著性分析和方差分析,(P<0.05为差异显著),绘图采用Origin 2021软件。
2 结果与分析
2.1 低温结晶单因素分析
2.1.1 不同溶剂对滩羊尾脂CLA得率和纯度的影响
由图1-a可以看出,4种溶剂对混合脂肪酸进行低温结晶后,样品中CLA含量都显著提高(P<0.05);当无水乙醇和石油醚作为溶剂时其纯度变化并不显著(P>0.05),考虑到石油醚有煤油气味、易燃易爆,且无水乙醇作为溶剂时得率最高为(8.61±0.53) mg/g,并对人体伤害较小、价格低廉、容易获得,所以选择相对安全的无水乙醇作为有机溶剂进行单因素试验的研究。
2.1.2 不同结晶温度对滩羊尾脂CLA得率和纯度的影响
在低温结晶纯化多不饱和脂肪酸过程中,温度是非常重要的参数之一。由图1-b可知,随着温度从4 ℃下降到-80 ℃,其纯度越来越高,这一趋势与MORALES-MEDINA等[19]的研究相似。当结晶温度在4 ℃时,CLA得率达到最高为(10.88±0.61) mg/g,这主要是由于在温度降低的过程中,饱和与单不饱和脂肪酸在乙醇中溶解度也随之降低,导致其结晶析出,最终使样品中CLA的含量升高。因此,从CLA的得率和纯度都达到最优的角度考虑,选取-40 ℃作为最佳处理温度,此时得率和纯度分别为(8.74±0.87)、(15.12±0.58) mg/g。
2.1.3 不同结晶时间对滩羊尾脂CLA得率和纯度的影响
油脂的冷冻结晶是一个缓慢的过程,碳链越长,结晶速度越慢,为使结晶充分析出,必须要保证足够的结晶时间。由图1-c可知,结晶时间在12 h时CLA的纯度最高为(17.78±0.78) mg/g,但CLA得率在逐渐降低,可能是随着结晶时间的延长多不饱和脂肪酸析出导致。当结晶时间为6 h时,CLA的得率显著高于(P<0.05)结晶时间为9、12和15 h的得率,这可能是因为冷冻时间太短,形成的晶核中的液体还没有完全移动出来[14]。结晶时间由12 h增加到15 h时,其纯度变化并不显著(P>0.05),综合纯度和得率的最佳情况以及经济成本来看,选择结晶时间为12 h为最佳处理时间。
2.1.4 不同料液比对滩羊尾脂CLA得率和纯度的影响
当体系中溶剂过少时,溶液黏度较大,结晶会包裹着大量的多不饱和脂肪酸,降低CLA得率,当溶剂过多时,会影响CLA纯度,并增加溶剂的回收成本[20]。由图1-d可以看出,当混合脂肪酸与无水乙醇料液比为1∶9时,CLA得率比较低,但纯度最高,为(15.95±0.67) mg/g。随着溶剂含量的增加,CLA得率提高,但纯度却降低,这一趋势与李慧美[14]的研究结果基本一致。当料液比为1∶15和1∶18时,其纯度和得率变化并不显著(P>0.05),综合考虑纯度以及经济效益和环保问题等因素,可以选择料液比为1∶15作为后续工艺优化。
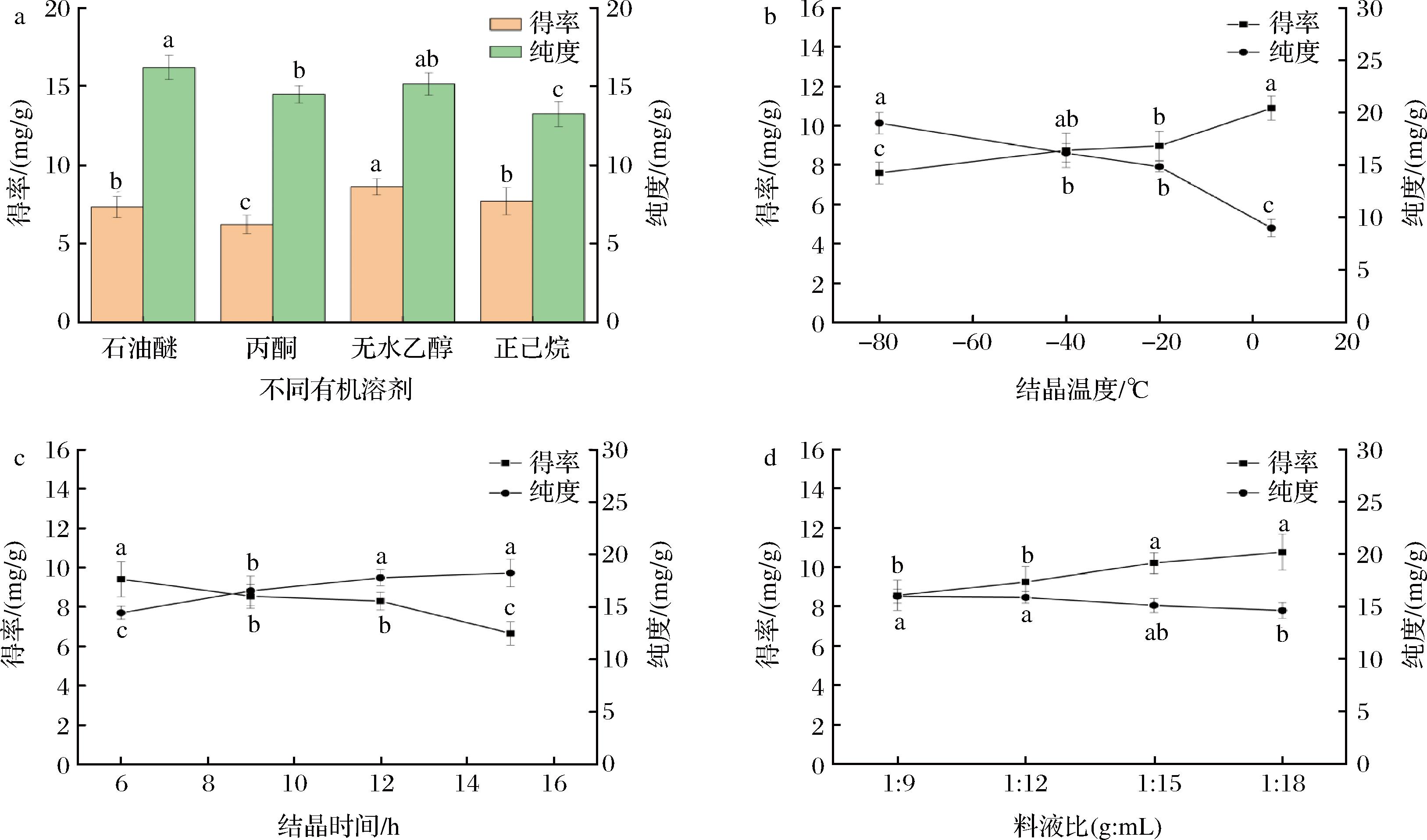
a-不同有机溶剂;b-结晶温度;c-结晶时间;d-混合脂肪酸与无水乙醇料液比
图1 不同单因素条件对低温结晶滩羊尾脂CLA得率和纯度的影响
Fig.1 Effects of different single factor conditions on the yield and purity of low temperature crystalline Tan sheep tail fat CLA
注:小写字母表示不同单因素条件下各样品之间存在显著性差异(P<0.05)(下同)。
2.2 低温结晶正交试验分析
正交试验直观分析中因素极差值越大,则该因素对实验结果的影响程度就越大,某一水平k值越大,则优水平为该水平。由表3可知,各因素对低温结晶滩羊尾脂中CLA纯度的影响次序为C>B>A,各因素的最佳组合水平为A1B2C1,即结晶温度为-20 ℃,结晶时间为12 h,混合脂肪酸与无水乙醇料液比为1∶12。通过3次实验验证,在此条件下所得CLA纯度为(18.62±0.51) mg/g,高于正交表中最高值(17.88±1.12) mg/g。
2.3 尿素包合单因素分析
2.3.1 不同包合温度对滩羊尾脂CLA得率和纯度的影响
尿素包合反应是放热反应,包合温度的降低有利于反应向正方向进行[21],但温度过低时,乙醇和包合物凝固,严重阻碍包合反应的进行,使得CLA纯度下降且逐渐趋于稳定。由图2-a可见,包合温度由-80 ℃增加到4 ℃时,CLA得率和纯度随温度的上升而增加,这与吴明一[22]尿素包合纯化不饱和脂肪酸中包合温度优化结果一致。在4 ℃时CLA纯度最高达到(26.96±0.57) mg/g,此时尿素分子能够较好地包合单不饱和脂肪酸和饱和脂肪酸,从而使多不饱和脂肪酸留在溶液内。因此选取4 ℃为最佳处理温度。
2.3.2 不同包合时间对滩羊尾脂CLA得率和纯度的影响
实验结果显示(图2-b),当包合时间由6 h延长至30 h时,样品中CLA的得率也随之从(3.89±0.81) mg/g下降至(2.24±0.53) mg/g,这可能是随着包合时间的延长,少量尿素以晶体的形式析出,并携带少量的CLA[21]。当包合时间≥12 h,样品中CLA纯度和得率变化并不显著(P>0.05),达到了动态平衡。这是因为脂肪酸与尿素的包合反应是饱和和游离达到动态平衡的过程,反应正好达到平衡的时间为最佳尿素包合时间。所以选取12 h作为最佳包合时间。
表3 低温结晶正交试验极差分析表
Table 3 Range analysis table of low temperature crystallization orthogonal experiment

处理组A/℃B/hC(g∶mL)纯度/(mg/g)111113.96±0.56212214.88±1.32313316.22±1.7142119.68±0.25522315.21±0.73623217.88±1.1273138.87±0.46832115.66±1.3693329.19±0.28K115.02010.83715.833K214.25715.25011.250K311.24014.43013.433R3.7804.4134.583
2.3.3 低温结晶CLA与尿素质量比对滩羊尾脂CLA得率和纯度的影响
饱和脂肪酸与单不饱和脂肪酸容易与尿素分子形成稳定的晶体包合物,而多不饱和脂肪酸由于双键较多,有一定的空间构型,不易被尿素包合[23]。由图2-c可以看出,随着尿素添加量的不断增加,CLA纯度逐渐增大,在1∶3时升高为(25.98±0.76) mg/g,之后趋于平缓。这一趋势与孙潇辉[24]用尿素包合法纯化瓜蒌籽油中多不饱和脂肪酸的研究结果一致。当脂肪酸与尿素质量比为1∶3和1∶4时,其纯度差异不显著(P>0.05)且1∶3时得率较高,综合考虑经济成本及得率,选择1∶3为脂肪酸与尿素的最佳质量比。
2.3.4 尿素与无水乙醇料液比对滩羊尾脂CLA得率和纯度的影响
当无水乙醇用量过低时,体系黏度较大,不能有效包合多不饱和脂肪酸,但随着无水乙醇用量的不断增加,尿素浓度不断降低,包合效果变差,使得率下降[25]。由图2-d可知,当尿素和乙醇的料液比大于1∶5时,CLA得率缓慢下降。这一趋势与曾俊等[21]的研究结果一致。当其质量比为1∶5时得率达到最大,为(2.85±0.83) mg/g,纯度为(25.67±1.17) mg/g。因此为了保证所得CLA产物具有较好的纯度及得率,本实验选取尿素与无水乙醇料液比为1∶5。

a-包合温度;b-包合时间;c-低温结晶CLA与尿素质量比;d-尿素与无水乙醇料液比
图2 不同单因素条件对尿素包合滩羊尾脂CLA得率和纯度的影响
Fig.2 Effect of different single factor conditions on the yield and purity of urea inclusion Tan sheep tail fat CLA
2.4 尿素包合正交试验分析
由表4可知,各因素对尿素包合滩羊尾脂中CLA对纯度的影响次序为A>C>D>B,最佳组合水平为A1B3C1D2,即包合温度为25 ℃,包合时间为14 h,脂肪酸与尿素质量比为1∶2,尿素与乙醇质量比为1∶5。通过3次实验验证,在此条件下所得CLA纯度为(28.23±2.36) mg/g,高于正交表中最高值(26.71±1.58) mg/g。比候建军等[26]研究羊腰部脂肪中CLA含量高22.35%。
表4 尿素包合正交实验极差分析表
Table 4 Range analysis of urea inclusion orthogonal experiment

处理组A/℃B/hCD纯度/(mg/g)1111126.21±2.972122226.71±1.583133319.57±2.624211320.11±1.335223115.17±1.756232225.69±2.127313212.21±1.438321315.72±0.969332113.48±1.25K124.16319.51022.54018.287K220.32319.20020.10021.537K313.80319.58015.65018.467R10.3600.3806.8903.250
2.5 滩羊尾脂CLA生物活性的测定
2.5.1 滩羊尾脂CLA抗氧化活性测定结果
清除自由基是评价食品、药品抗氧化能力的一个重要指标[27]。由图3可以看出,CLA对DPPH自由基和ABTS阳离子自由基的清除能力都存在剂量效应关系,但表现出差异。本研究结果显示,当CLA质量浓度为6 mg/mL时,CLA对DPPH自由基和ABTS阳离子自由基的清除率分别为(35.94±4.07)%、(51.76±5.57)%,这与陈丽敏[27]在研究山核桃油中CLA对DPPH自由基清除率的结果基本一致。KIM等[28]研究表明CLA对ABTS阳离子自由基的清除能力高于DPPH自由基,本研究结果与其一致。这可能是因为ABTS阳离子是两亲性物质,能够同时溶于水相和有机相,而DPPH自由基只能溶解在有机相中,所以ABTS阳离子自由基对抗氧化剂的反应要比DPPH自由基敏感。而当维生素C质量浓度为40 μg/mL时,对DPPH自由基和ABTS阳离子自由基的抑制率接近100%,继续增大浓度抑制率变化不显著(P>0.05),CLA的自由基清除率要远低于维生素C。本实验结果表明,CLA对ABTS阳离子自由基有一定的清除能力,而对DPPH自由基的清除能力较低。
2.5.2 滩羊尾脂CLA降胆固醇活性测定结果
LEE等[29]等使用混合CLA异构体喂养兔子22周,根据组织切片和主动脉胆固醇定量评估,CLA喂养组的总胆固醇、低密度脂蛋白和甘油三酯显著降低。KRITCHEVSKY等[30]通过向高胆固醇饮食兔子的日粮中添加0.05%~1% CLA混合物的实验发现,CLA可通过有效降低兔子体内总胆固醇和高密度脂蛋白含量改善兔子血浆脂蛋白减轻其动脉粥样硬化进程。大量动物实验表明,CLA有降胆固醇活性的功能。本实验通过模拟胆汁胶束法和体外结合胆酸盐法初步检测经提纯后的滩羊尾脂CLA的降胆固醇活性。

a-ABTS阳离子自由基清除能力;b-DPPH自由基清除能力
图3 不同质量浓度滩羊尾脂CLA对自由基清除能力的影响
Fig.3 Effects of different concentrations of Tan sheep tail fat CLA on the scavenging ability of free radicals
由图4可知,随着CLA质量浓度的增加,胆固醇胶束抑制率呈明显的上升趋势,当CLA质量浓度从1 mg/mL增加到3 mg/mL时,胆固醇抑制率由(2.86±1.32)%增加到了(34.76±5.67)%,抑制程度显著(P<0.05);当CLA质量浓度为6 mg/mL时,其抑制率为(60.33±5.88)%,说明滩羊尾脂CLA能有效降低胆固醇质量浓度。由图5可以看出,随着CLA质量浓度的增加,与3种胆酸盐结合率均呈上升趋势。CLA对甘氨胆酸钠的结合率最高,胆酸钠次之,牛磺胆酸钠最低,这一趋势与廖坤梅等[31]研究的高良粗多糖体外结合胆酸盐能力趋于一致,这可能是因为牛磺胆酸钠是结合型胆酸钠,相对于其他2种胆酸盐来说不易被吸附[32]。当CLA质量浓度为6 mg/mL时,基本达到了最高的结合率,此时CLA对牛磺胆酸钠的结合率为(16.11±4.01)%,对甘氨胆酸盐的结合率为(37.56±3.17)%,对胆酸盐的结合率为(25.11±4.82)%。说明滩羊尾脂CLA有一定的胆酸盐结合能力。
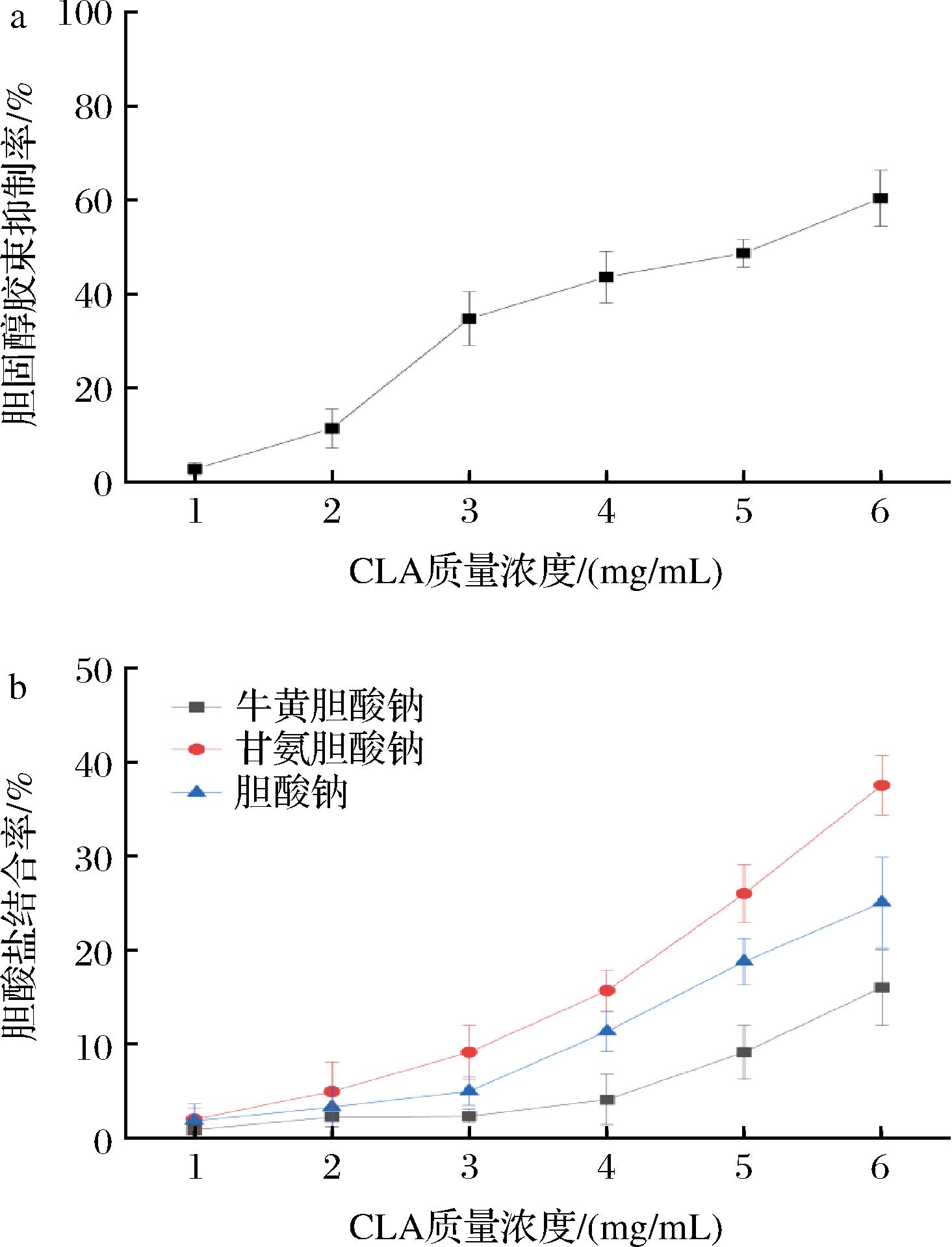
a-胆固醇胶束抑制率;b-胆酸盐结合率
图4 不同质量浓度滩羊尾脂CLA对降胆固醇活性的影响
Fig.4 Effect of different concentrations of Tan sheep tail fat (CLA) on cholesterol lowering activity
3 结论
本研究采用低温结晶法联合尿素包合法提取滩羊尾脂中的CLA,使其纯度大大提高,且具有良好的抗氧化活性和降胆固醇活性。结果表明,采用低温结晶法在有机溶剂为无水乙醇,结晶温度为-20 ℃,结晶时间为12 h,混合脂肪酸与无水乙醇料液比为1∶12(g∶mL)条件下提取效果最优,在此条件下,滩羊尾脂CLA纯度为(18.62±0.51) mg/g。在此基础上联合尿素包合法得到的最优条件为包合温度25 ℃,包合时间14 h,脂肪酸与尿素质量比1∶2,尿素与乙醇料液比1∶5(g∶mL),此时滩羊尾脂CLA纯度为(28.23±2.36) mg/g。在不同浓度下经尿素包合后的CLA表现出良好的抗氧化活性和降胆固醇能力,当CLA质量浓度为6 mg/mL时,对DPPH自由基和ABTS阳离子自由基的清除率分别为(35.94±4.07)%、(51.76±5.57)%,对胆固醇胶束抑制率为(60.33±5.88)%,对牛磺胆酸钠、甘氨胆酸钠和胆酸钠的结合率分别为(16.11±4.01)%、(37.56±3.17)%和(25.11±4.82)%。研究结果为今后滩羊尾脂CLA工业化提取及活性应用方面的研究提供了基本的科学依据,对滩羊尾副产物的深入研究与开发利用具有重要意义。
[1] 马梦斌, 罗瑞明, 李亚蕾.基于矿物元素指纹差异的不同产地滩羊肉判别[J].食品科学, 2020, 41(6):316-321. MA M B, LUO R M, LI Y L.Discrimination of different geographical origins of Tan sheep meat based on mineral element fingerprints[J].Food Science, 2020, 41(6):316-321.
[2] 于洋, 逄晓阳, 岳彩娟, 等.宁夏滩羊羊尾油手工皂生产工艺优化研究[J].宁夏农林科技, 2020, 61(9):57-59;66. YU Y, PANG X Y, YUE C J, et al.Optimization of production technology of Tan sheep′s oil soap[J].Ningxia Journal of Agriculture and Forestry Science and Technology, 2020, 61(9):57-59;66.
[3] ALBERS R, VAN DER WIELEN R P J, BRINK E J, et al.Effects of cis-9, trans-11 and trans-10, cis-12 conjugated linoleic acid (CLA) isomers on immune function in healthy men[J].European Journal of Clinical Nutrition, 2003, 57(4):595-603.
[4] ZHAO W S, ZHAI J J, WANG Y H, et al.Conjugated linoleic acid supplementation enhances antihypertensive effect of ramipril in Chinese patients with obesity-related hypertension[J].American Journal of Hypertension, 2009, 22(6):680-686.
[5] CHUJO H, YAMASAKI M, NOU S, et al.Effect of conjugated linoleic acid isomers on growth factor-induced proliferation of human breast cancer cells[J].Cancer Letters, 2003, 202(1):81-87.
[6] HUANG Y S, LIN Z D, RONG H A, et al.Effects of conjugated linoleic acid on growth, body composition, antioxidant status, lipid metabolism and immunity parameters of juvenile Chu′s croaker, Nibea coibor[J].Aquaculture Research, 2018, 49(1):546-556.
[7] DEN HARTIGH L J, HAN C Y, WANG S R, et al.10E,12Z-conjugated linoleic acid impairs adipocyte triglyceride storage by enhancing fatty acid oxidation, lipolysis, and mitochondrial reactive oxygen species[J].Journal of Lipid Research, 2013, 54(11):2964-2978.
[8] IP C, DONG Y, IP M M, et al.Conjugated linoleic acid isomers and mammary cancer prevention[J].Nutrition and Cancer, 2002, 43(1):52-58.
[9] 刘芸. 黄秋葵籽油中共轭亚油酸的制备及其抗氧化活性的研究[D].杭州:浙江大学, 2016. LIU Y.Preparation of conjugated linoleic acid from okra seed oil and the study of its anti-oxidant activity[D].Hangzhou:Zhejiang University, 2016. [10] 赵俊. 茶油制备共轭亚油酸及其抗氧化活性的研究[D].广州:华南理工大学, 2019. ZHAO J.Preparation of conjugated linoleic acid from Camellia oleifera seed oil and its antioxidant activity[D].Guangzhou:South China University of Technology, 2019.
[11] 李垚, 徐尔尼, 杨欣, 等.嗜酸乳杆菌转化菜籽油生成共轭亚油酸条件的优化[J].食品与发酵工业, 2013, 39(3):32-37. LI Y, XU E N, YANG X, et al.Optimization of the conditions for conversion of colza oil into conjugated linoleic acid by rapeseed oil by Lactobacillus acidophilus[J] Food and Fermentation Industries, 2013, 39(3):32-37.
[12] BESSA R J B, SANTOS-SILVA J, RIBEIRO J M R, et al.Reticulo-rumen biohydrogenation and the enrichment of ruminant edible products with linoleic acid conjugated isomers[J].Livestock Production Science, 2000, 63(3):201-211.
[13] 于洋, 冯毅, 宋宏立, 等.短程分子蒸馏提取滩羊尾脂共轭亚油酸的研究[J].食品研究与开发, 2020, 41(19):1-7. YU Y, FENG Y, SONG H L, et al.Study on extraction of conjugated linoleic acid from Tan sheep tail lipid by short-range molecular distillation[J].Food Research and Development, 2020, 41(19):1-7.
[14] 李慧美. 黄油中共轭亚油酸对DMBA诱导小鼠乳腺癌的抑制作用及机理研究[D].南昌:南昌大学, 2019. LI H M.Inhibitory effect and mechanism of conjugated linoleic acid in butter on DMBA-induced breast cancer in mice[D].Nanchang:Nanchang University, 2019.
[15] MA D W L, WIERZBICKI A A, FIELD C J, et al.Preparation of conjugated linoleic acid from safflower oil[J].Journal of the American Oil Chemists′ Society, 1999, 76(6):729-730.
[16] LAI P, LI K Y, LU S, et al.Phytochemicals and antioxidant properties of solvent extracts from Japonica rice bran[J].Food Chemistry, 2009, 117(3):538-544.
[17] 高婕. 具有降胆固醇活性的亚麻籽肽的制备及其对大鼠降胆固醇作用的研究[D].呼和浩特:内蒙古农业大学, 2018. GAO J.A novel hypocholesterolemic peptide derived from flaxseed protein and its effect on hyperlipidemic rats[D].Hohhot:Inner Mongolia Agricultural University, 2018.
[18] 刘晓静. 亚麻籽肽降胆固醇作用的研究[D].呼和浩特:内蒙古农业大学, 2020. LIU X J.Study on the cholesterol-lowering effect of flaxseed peptide[D].Hohhot:Inner Mongolia Agricultural University, 2020.
[19] MORALES-MEDINA R, DE LE N G, MUNIO M, et al.Mass transfer modeling of sardine oil polyunsaturated fatty acid (PUFA) concentration by low temperature crystallization[J].Journal of Food Engineering, 2016, 183:16-23.
N G, MUNIO M, et al.Mass transfer modeling of sardine oil polyunsaturated fatty acid (PUFA) concentration by low temperature crystallization[J].Journal of Food Engineering, 2016, 183:16-23.
[20] 安腾奇, 成取林, 余成山, 等.溶剂结晶和尿素包合法提高油酸纯度的研究[J].中国油脂, 2016, 41(9):64-68. AN T Q,CHENG Q L,YU C S,et al.Improvement of oleic acid purity by solvent crystallization and urea adduction[J].China Oils and Fats, 2016, 41(9):64-68.
[21] 曾俊, 岳杨, 任小娜, 等.尿素包合法从葡萄籽油中富集高纯度亚油酸甲酯的研究及包合物表征分析[J].中国油脂,2022,47(12):25-30. ZENG J, YUE Y, REN X N, et al.Preparation of high purity methyl linoleate from grape seed oil by urea adduction and characterization of adduction complexes[J].China Oil and Fat, 2022,47(12):25-30.
[22] 吴明一. 尿素包合法纯化不饱和脂肪酸的研究[D].天津:天津大学, 2007. WU M Y.Research on purification of unsaturated fatty acids by urea inclusion fractionation[D].Tianjin:Tianjin University, 2007.
[23] 郭莹莹, 刘玉兰, 梁绍全, 等.尿素包合法富集文冠果油中神经酸的研究[J].中国油脂, 2018, 43(7):119-123. GUO Y Y, LIU Y L, LIANG S Q, et al.Enrichment of nervonic acid from Xanthoceras sorbifolia Bunge.oil by urea inclusion fractionation[J].China Oils and Fats, 2018, 43(7):119-123.
[24] 孙潇辉. 瓜蒌籽油提取及多不饱和脂肪酸的富集与微胶囊制备[D].合肥:安徽农业大学, 2013. SUN X H.The extraction of Trichosanthes kirilowii Maxim.seed oil and the enrichment and encapsulation of polyunsaturated fatty acid[D].Hefei:Anhui Agricultural University, 2013.
[25] 王晓宇, 杜国荣, 李华.抗氧化能力的体外测定方法研究进展[J].食品与生物技术学报, 2012, 31(3):247-252. WANG X Y, DU G R, LI H.Progress of analytical methods for antioxidant capacity in vitro[J].Journal of Food Science and Biotechnology, 2012, 31(3):247-252.
[26] 侯建军, 陈存社, 张甜甜, 等.羊腰部脂肪中共轭亚油酸提取及热稳定性[J].食品科学技术学报, 2013, 31(1):60-63;82. HOU J J, CHEN C S, ZHANG T T, et al.Study on extraction and thermal stability of conjugated linoleic acid from sheep waist fat[J].Journal of Food Science and Technology, 2013, 31(1):60-63;82.
[27] 陈丽敏. 山核桃亚油酸分离及共轭亚油酸制备技术研究[D].合肥:安徽农业大学, 2013. CHEN L M.Study on the separation of linoleic acid in Carya cathayensis Sarg.and synthesis technology of conjugated linoleic acids[D].Hefei:Anhui Agricultural University, 2013.
[28] KIM Y J, LEE K W, LEE H J.Total antioxidant capacity of arginine-conjugated linoleic acid (CLA) complex[J].Journal of Agricultural and Food Chemistry, 2004, 52(3):439-444.
[29] LEE K N, KRITCHEVSKY D, PARIZAA M W.Conjugated linoleic acid and atherosclerosis in rabbits[J].Atherosclerosis, 1994, 108(1):19-25.
[30] KRITCHEVSKY D, TEPPER S A, WRIGHT S, et al.Conjugated linoleic acid isomer effects in atherosclerosis:Growth and regression of lesions[J].Lipids, 2004, 39(7):611-616.
[31] 廖坤梅, 白天禾, 陈楚华, 等.高良姜粗多糖体外降胆固醇效果研究[J].农产品加工, 2017(10):4-6;17. LIAO K M, BAI T H, CHEN C H, et al.Research on the effect of cholesterol lowering in vitro of alpinia officinarum hance crude polysaccharide[J].Farm Products Processing, 2017(10):4-6;17.
[32] DEBRUYNE P R, BRUYNEEL E A, LI X D, et al.The role of bile acids in carcinogenesis[J].Mutation Research/Fundamental &Molecular Mechanisms of Mutagenesis, 2001, 480-481:359-369.