乳酸菌是一类革兰氏阳性,过氧化氢酶一般呈阴性,形态包含球形或者杆状的微生物菌群,它们能发酵碳水化合物产生有机酸。如果是同型发酵乳酸菌,则以乳酸为主要产物,如果是异型发酵乳酸菌,除了乳酸外还能产生乙酸或酒精、CO2[1]。因此,富含乳酸菌的发酵食品如鲊广椒和泡菜等都有浓郁爽口的酸味。一些乳酸菌被公认为安全的(Generally Recognized as Safe,GRAS),可以用于发酵食品的制作。目前应用较多的有植物乳植物杆菌(Lactiplantibacillus plantarum)、发酵粘液乳杆菌(Limosilactobacillus fermentum)、德氏乳杆菌(Lactobacillus delbrueckii)等[2]。我国有许多具有民族特色的发酵蔬菜,它们往往通过自然发酵方式制成,未添加人工发酵剂,因此发酵过程中的微生物往往来自制作环境以及制作原料。鲊广椒就是这类发酵食品中的代表,其原料中含有丰富的碳水化合物,并且制作过程往往处于缺氧状态,因此微生物菌群组成极为复杂,且其优势菌群往往为乳酸菌[3]。
鲊广椒又叫鲊辣椒,鲊海椒,在我国重庆、湖北、湖南等多个省区被制作和食用。不同地区的鲊广椒受到制作工艺和环境的影响,其滋味和气味有所差别。但是研究发现,不同地区的鲊广椒中均富含乳酸菌,包括伴生乳杆菌属(Companilactobacillus)、乳植物杆菌属(Lactiplantibacillus)、乳杆菌属(Lactobacillus)、明串珠菌属(Leuconostoc)、促生乳杆菌属(Levilactobacillus)、片球菌属(Pediococcus)和魏斯氏菌属(Weissella)等优势菌属,可能还含有一些特异的菌群,且不同地区乳酸菌的比例有所不同[4-6]。重庆地区简称“渝”,位于青藏高原与长江中下游平原过渡地带的长江上游地区。前期调查发现,重庆巫山和奉节地区的鲊广椒目前仍然保留着固态自然发酵,不接种发酵剂,发酵原料和容器不消毒杀菌的特点。由于不同地区的鲊广椒菌群结构受制作原料与环境影响而存在差异,因此,该地区鲊广椒可能蕴藏着丰富多样的乳酸菌资源,且可能含有一些特异的菌群。
近年来,随着测序技术的发展,以Illumina HiSeq为代表的高通量测序技术成本不断下降,测序通量不断提高,且该技术准确度与精确度均较高,测序周期短,能规避分离鉴定方法受培养基和培养条件限制的短板[7],因此,被广泛的应用到包括食品在内的各个领域的科学研究中。但是如果想要研究发酵食品中某种微生物的发酵特性或者开发菌种资源,还需要结合分离鉴定方法。因此,本研究从重庆市奉节和巫山县收集了自然发酵制作的鲊广椒样品,通过高通量测序方法分析其微生物多样性,同时结合分离鉴定方法从收集的样品中分离、纯化和鉴定乳酸菌,以期为鲊广椒产业提供基础数据支撑以及乳酸菌菌种资源。
1 材料与方法
1.1 材料与试剂
鲊广椒样品:从重庆市奉节和巫山地区的农贸市场分别采集6个鲊广椒样品(不同样品由不同家庭制作),编号分别为FJ1~6与WS1~6,后续分析分别将两个地区的样品标记为FJ和WS。所采集的鲊广椒样品滋味和气味均正常,无腐败味。每个样品收集200 g左右,分成2份,分别装入无菌样品袋,放入保温箱迅速带回实验室,其中一份放入-70 ℃冰箱,用于高通量测序,另一份立即用于乳酸菌的分离与纯化。
试剂和耗材:引物338F和806R(引物338带有样品特异性标签),上海桑尼生物科技有限公司;dNTPs Mix和DNA聚合酶Ex PremierTM DNA Polymerase,宝生物工程大连有限公司;E.Z.N.A.®food DNA试剂盒,美国Omega Bio-tek公司;GK1072细菌总DNA提取试剂盒,上海捷瑞生物工程有限公司;MRS肉汤培养基,北京索莱宝科技有限公司。
1.2 仪器与设备
EDC-810型黑金刚基因扩增仪,北京东胜创新生物科技有限公司;WD-9413B型凝胶成像分析系统和DYY-6C型电泳仪电源,北京六一生物科技有限公司;K5800H自动检测超微量分光光度计,北京凯奥科技发展有限公司;HITACHI CT 4D高速离心机,日本日立公司;OxoidTM AG0025A厌氧罐,赛默飞世尔科技公司。
1.3 实验方法
1.3.1 PCR扩增与高通量测序
首先使用试剂盒E.Z.N.A.®food DNA对鲊广椒中总DNA进行提取,并检测提取的DNA含量与纯度后,参照GUO等[8]方法对细菌16S rRNA基因V3~V4区进行PCR扩增。随后,将PCR产物送至上海美吉生物医药科技有限公司,基于Illumina HiSeq 4000平台进行高通量测序,确保每个样品的测序量超过5万个tags。
1.3.2 生物信息学分析
高通量测序后的下游分析使用QIIME v1.9.0[9]进行。参照GUO等[6]的方法,首先对双末端测序序列进行质控和双末端序列的合并,然后按照97%的阈值划分分类操作单元(operational taxonomic unit,OTU)[10]。随后使用RDP分类器[11]基于最新的数据库v2.1.3(https://github.com/rdpstaff/classifier)进行物种注释。使用QIIME自带脚本计算鲊广椒样品的α多样性指数,使用vegan分析鲊广椒样品的β多样性,最后提取门和属的分类单元相对含量,使用威尔科克森符号秩检验进行组间分析。最后,使用使用在线服务器分析(http://huttenhower.sph.harvard.edu/galaxy/)的线性判别分析效应值(linear discriminant analysis effect size,LEfSe)[12]分析地区间鲊广椒的生物标志物,分析中线性判别分析(linear discriminant analysis,LDA)值设置为3.0[12]。
1.3.3 乳酸菌的分离
乳酸菌属于微好氧菌,通过设置微好氧条件对鲊广椒中的乳酸菌进行分离[13]。参照GUO等[8]的方法进行乳酸菌的分离,首先进行梯度稀释:称取10 g鲊广椒样品与90 mL无菌生理盐水充分混合均匀,为10-1样品稀释液。后续使用装有无菌生理盐水(0.85 g/L)的试管进行梯度稀释,每次稀释10倍,最后取10-3~10-6的样品稀释液均匀涂布到提前倒好,且表面干燥的MRS平板(含1%碳酸钙),最后放入厌氧罐中,设置温度为30 ℃进行培养。厌氧罐通过厌氧产气袋除去其中的多数O2,保持微好氧环境。待菌落长好后,挑取具有透明圈的典型菌落,同样使用MRS培养基划线纯化。将纯菌进行革兰氏染色,镜检以及过氧化氢酶检测后,使用含有25%甘油的MRS液体培养基重悬,保存到-70 ℃冰箱待用。
1.3.4 乳酸菌的鉴定
基于细菌16S rRNA基因序列进行菌株鉴定。将纯化过的待鉴定菌活化后,收集菌体,使用GK1072细菌总DNA提取试剂盒进行提取后,作为模板,使用引物27F和1495R扩增细菌的16S rRNA基因[14]。将获得的PCR产物进行TA克隆:先将PCR产物与克隆载体PMD18-T连接,然后将连接产物转化大肠杆菌Top 10 感受态细胞,使用含氨苄青霉素钠(100 μg/mL)的LB培养基筛选阳性克隆子,并对克隆子使用引物M13-47和/M13-48进行PCR验证后,送至上海桑尼生物科技有限公司进行测序。待序列返回后,将双端测序结果合并,并去掉引物和载体序列,在NCBI与模式菌数据库进行比对,获得待鉴定菌的分离信息。使用待鉴定菌的16S rRNA序列与通过Blastn匹配到的模式菌序列使用Mafft v7.475比对(https://github.com/GSLBiotech/mafft),然后使用MEGA构建系统进化树[15],以确定分离到的微生物的系统分类地位。
1.3.5 统计分析
组间分类单元相对含量的统计分析通过威尔科克森符号秩检验(Wilcoxon test)使用R包ggpubr完成(https://cran.r-project.org/web/packages/ggpubr/);数据清洗使用tidyverse包(https://github.com/tidyverse)完成;文中作图使用R软件包ggpubr或者ggplot(https://github.com/tidyverse/ggplot2)或者origin v8.5完成。
2 结果与分析
2.1 鲊广椒微生物多样性分析
使用Illumina Hiseq平台测序技术对采集自重庆市巫山县和奉节县的鲊广椒样品细菌V3~V4区域进行了双端测序。对双端测序基于重叠区进行了组装,在过滤掉低质量序列后,共得到441 218个高质量序列。按照97%的分类阈值,将这些序列共分成3 060个OTU。随机提取代表性序列进行注释后,共得到19个细菌门,35个细菌纲,67个细菌目,149个细菌科和324和细菌属。相对来说,奉节地区的分类单元数量小于巫山地区(表1)。
随机抽取每个样品的29 010个序列,使用QIIME分析平台自带脚本计算了两个地区的α多样性指数,包括Chao1指数,发现物种指数(observed species index),香浓指数(Shannon index)与辛普森指数(Simpson index),并进行统计分析,结果见图1。重庆市巫山和奉节两个地区的鲊广椒样品,无论是丰富度还是多样性均无显著差异(P>0.05)。
表1 奉节和巫山地区鲊广椒样品序列与微生物多样性
Table 1 Sequence abundance and microbial diversity of zha-chili samples from Fengjie and Wushan County
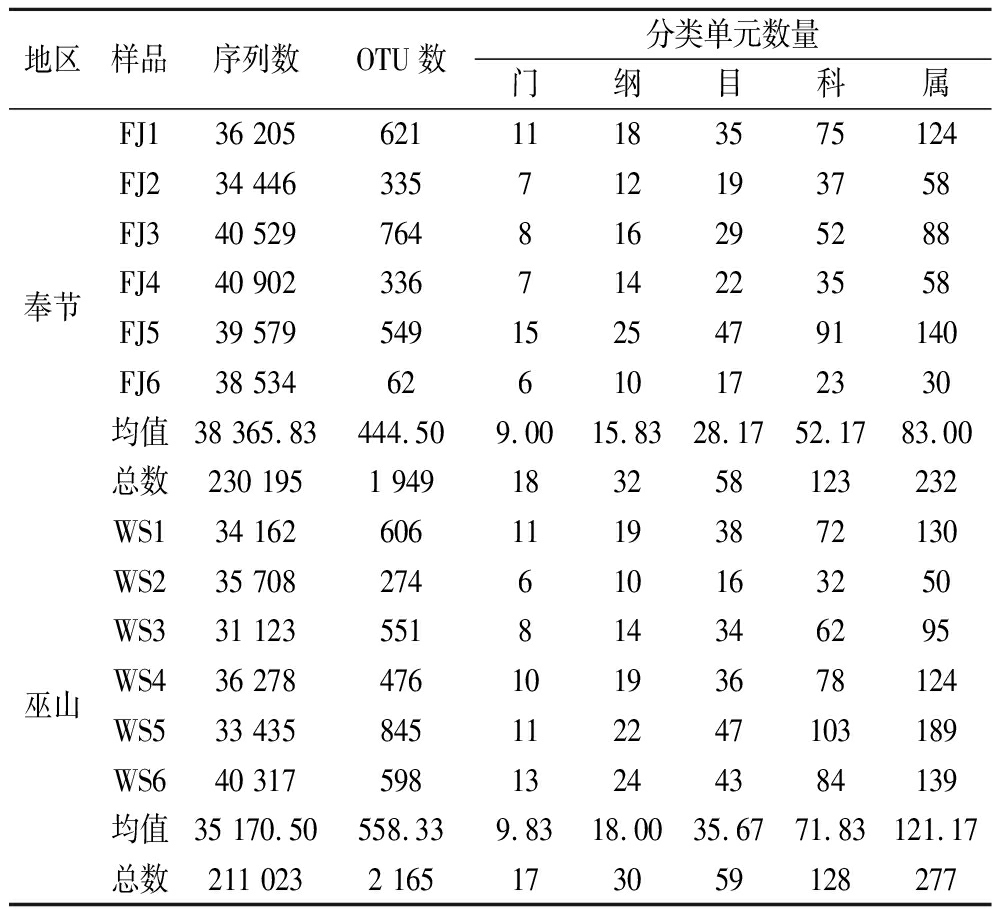
地区样品序列数OTU数分类单元数量门纲目科属奉节FJ136 20562111183575124FJ234 446335712193758FJ340 529764816295288FJ440 902336714223558FJ539 57954915254791140FJ638 53462610172330均值38 365.83 444.509.0015.8328.1752.1783.00总数230 1951 949183258123232巫山WS134 16260611193872130WS235 708274610163250WS331 123551814346295WS436 27847610193678124WS533 435845112247103189WS640 31759813244384139均值35 170.50 558.339.8318.0035.6771.83121.17总数211 0232 165173059128277

图1 奉节和巫山鲊广椒α多样性分析
Fig.1 Analysis of α diversity of zha-chili that collected from Fengjie and Wushan County
另外,为进一步分析来自重庆市两个地区的鲊广椒样品之间的关系,还进行了β-多样性分析,结果见图2。无论是基于布雷柯蒂斯距离(Bray-Curtis Distance)还是欧式距离(Euclidean Distance),PCoA1和PCoA2均能解释50%以上的总体变量,因此β多样性结果能很好的反映样品之间的关系。此外,基于两种距离的结果都显示,来自巫山和奉节两个地区的鲊广椒样品在图中交叠较少,基本是分别各自聚集在一起,显示出两个地区之间的鲊广椒样品菌群结构存在较大差异。

A-布雷柯蒂斯(Bray-Curtis Distance)的PCoA图; B-基于欧氏距离(Euclidean Distance)的PCoA图
图2 奉节和巫山地区鲊广椒样品β多样性分析
Fig.2 CoA analysis of zha-chili samples from Fengjie and Wushan County
2.2 鲊广椒菌群结构分析
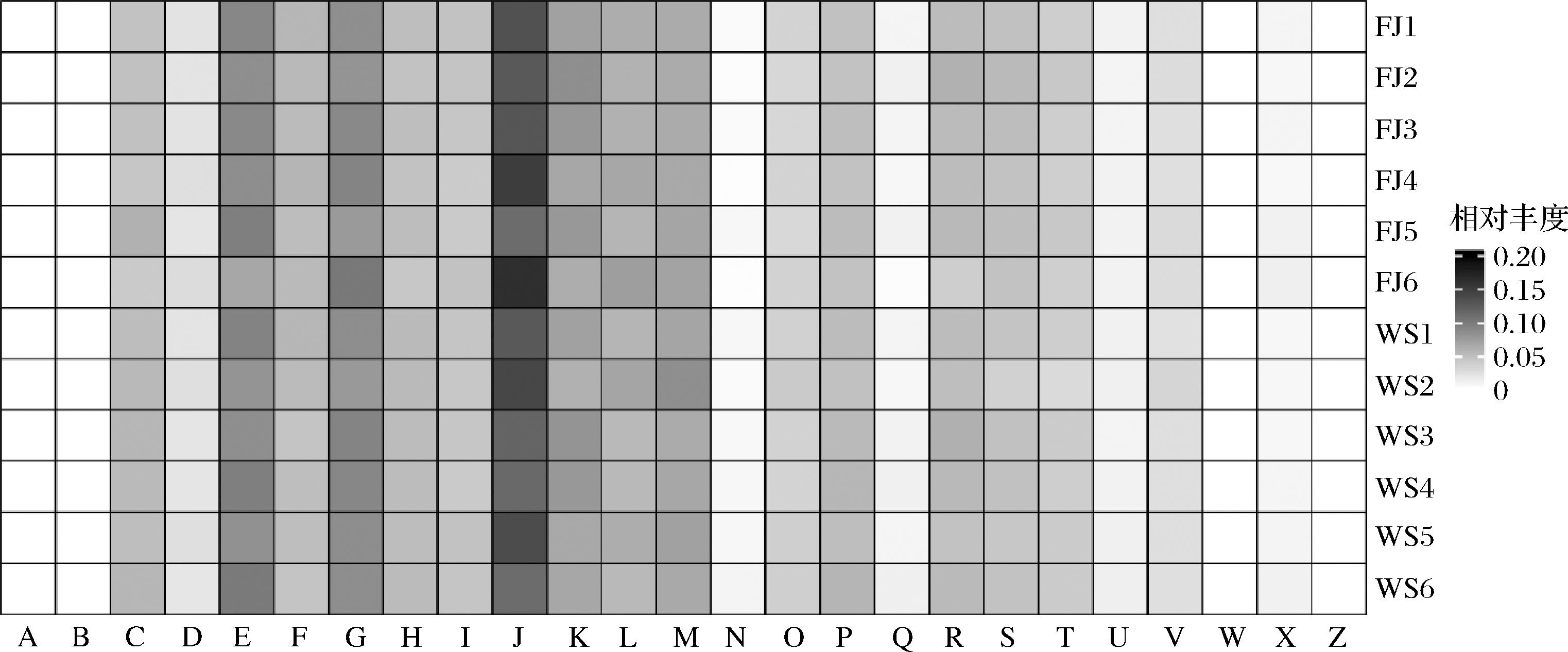
提取各样品门与属两个水平的物种组成,对重庆市两个地区的鲊广椒菌群结构进行了比较与分析,将菌群相对含量>1%的物种定义为优势类群。提取到的优势菌门和优势菌属如图3所示。由图3-A可知,重庆鲊广椒样品共检测到4个优势菌门,分别是厚壁菌门(Firmicutes,82.09%),变形菌门(Proteobacteria,8.54%),拟杆菌门(Bacteroidetes,6.94%),放线菌门(Actinobacteria,1.45%)。经统计分析表明,厚壁菌门在奉节鲊广椒的相对含量显著高于巫山鲊广椒(P<0.01),与之相反的是,另一个优势菌门拟杆菌门在在奉节鲊广椒的相对含量显著低于巫山鲊广椒(P<0.01),而其他两个优势菌门在两个地区的鲊广椒中无显著差异(P>0.05)。
进一步的,在属水平上分析了两个地区来源的鲊广椒菌群结构(图3-B)。结果显示,共检测到11个优势属,分别是乳杆菌属(Lactobacillus,25.69%),促生乳杆菌属(Levilactobacillus,17.50%),迟缓乳杆菌属(Lentilactobacillus,9.68%),伴生乳杆菌属(Companilactobacillus,8.03%),魏斯氏菌属(Weissella,6.11%),普雷沃菌属(Prevotella,5.93%),乳植物杆菌属(Lactiplantibacillus,4.08%),克雷伯菌属(Klebsiella,3.03%),肇源腐败乳杆菌(Loigolactobacillus,2.66%),粘液乳杆菌属(Limosilactobacillus,1.38%)和棒状杆菌属(Corynebacterium,1.06%)。通过统计分析将两个地区的菌群进行比较,仅优势属中的普雷沃菌属在两个地区间的相对含量存在显著差异(P<0.05):该属在巫山鲊广椒中相对含量显著较高。促生乳杆菌属普遍存在于多个地区的鲊广椒中[4-6,16],研究显示,重庆地区鲊广椒中相对含量最为丰富的3个优势属之一——促生乳杆菌可能与鲊广椒的滋味品质密切相关。GUO等[6]研究表明,促生乳杆菌属促进了鲊广椒酸味酸味,并与鲊广椒的丰厚度和后味B呈负相关。另外,值得注意的是,贵州松桃和湖南怀化鲊广椒富含伴生乳杆菌,而重庆鲊广椒中该属相对含量较少。另外,贵州和湖南鲊广椒中富含泛菌属(Pantoea),而该属在重庆鲊广椒中的相对含量低于1%。另个一个隶属于变形菌门的克雷伯氏菌属(Klebsiella)被检测出相对含量超过了1%,而该属在贵州与湖南鲊广椒中的相对含量低于1%。这些分析表明,尽管不同地区的鲊广椒物种组成相近,但是菌群组成的相对含量具有差异,且不同地区有一些特有的优势菌群。
另外,为寻找能区分这两个地区鲊广椒的生物标志物,使用LEfSe进行了进一步分析。如图4所示,除了普雷沃菌属以外,另外还有5个非优势属在巫山鲊广椒样品中显著富集,分别是Cutibacterium,梭菌属(Clostridium),热单胞菌属(Thermomonas),青枯菌属(Ralstonia)和另枝菌属(Alistipes);此外,在奉节县鲊广椒中富集的微生物有塔特姆菌属(Tatumella)和乳杆菌科(Lactobacillaceae)。由于普雷沃菌属和塔特姆菌属的LDA值最高,因此可以分别作为巫山和奉节鲊广椒的生物标志属。而乳杆菌科与乳杆菌目在奉节鲊广椒中的显著富集,也是厚壁菌门富集的直接原因。

A-优势细菌门;B-优势细菌属
图3 奉节和巫山鲊广椒优势微生物平均相对含量组成
Fig.3 Average relative abundance of dominant microbial taxa of zha-chili samples from Fengjie and Wushan County
此外,普雷沃菌为革兰氏阴性杆菌,能定植在人类口腔和肠道,其部分种与人类疾病有关,属于条件致病菌;但是也有一些普雷沃菌能预防牛瘤胃酸中毒,对牲畜养殖有益[17]。然而,很少在发酵食品中检测到普雷沃菌属。有研究表明,普雷沃菌能表达与植物衍生多糖降解相关的酶[18],如外切-β-1,4-木聚糖酶、木聚糖-1,4-β-木糖苷酶、α-L-阿拉伯呋喃糖苷酶等,这可能是该属菌群能在重庆地区鲊广椒中存活的一个原因。尽管梭菌属在鲊广椒中的相对含量未超过1%,但是其在巫山鲊广椒中显著富集,且反映其富集程度的LDA值大于3.5。梭菌属由革兰氏阳性、嗜温和厌氧的菌种组成,一些种具有促进植物生长作用,一些种还在工业过程中有应用,涉及生物氢、丙酮、生物丁醇、生物燃料等的生产[19]。部分梭菌种如艰难梭菌、破伤风梭菌、产气荚膜梭菌等致病菌,也在一些食品环境检出中;还有一些梭菌种对食品风味有益,如一些梭菌与白酒的主体风味物质前体己酸形成有关[20]。然而,限于所用技术,本研究未能在种水平上对普雷沃菌属和梭菌属的菌群组成进行分析。
2.3 鲊广椒菌群功能分析
使用PICRUSt2软件包基于蛋白质COG数据库,对重庆鲊广椒的微生物菌群功能进行了预测和分析。结果如图5所示,发现预测到的菌群COGs分别属于26个功能大类。一般来说,发酵食品的风味物质与碳水化合物、脂质和氨基酸的代谢有关。本研究注释到属于J(翻译、核糖体结构和生物发生)、E(氨基酸运输和代谢)和G(碳水化合物的运输和代谢)的COGs类别丰度最高,表明采集到的鲊广椒样品中菌群的氨基酸与糖类代谢活性较强,很可能这些菌群通过氨基酸与糖类的代谢形成了鲊广椒的气味与滋味物质。与之相反,菌群属于其他类别的COGs丰度较低。

A-LDA得分图;B-进化分支图
图4 基于LEfSe的奉节和巫山鲊广椒生物中 生物标志物分析
Fig.4 Biomarker of zha-chili from Fengjie and Wushan County based on LEfSe analysis
2.4 乳酸菌分离与鉴定
微好氧条件下,通过MRS固体培养基,从重庆两个地区的12个鲊广椒样品共分离到18株菌。经划线纯化、革兰氏染色与镜检,发现细胞形态呈球形或者椭球型共有5株,而细胞形态呈杆状或者短杆状的菌株有13株。镜检结果显示,所有分离得到的菌株均为革兰氏阳性。进一步通过16S rRNA基因序列分析对分离到的18株菌株进行了鉴定,并基于获得16S rRNA基因序列构建了系统发生树,结果见图6。
由图6可知,分离到的18株菌被鉴定为8个属,分别为伴生乳杆菌属,包含3株食品伴生乳杆菌(Companilactobacillus alimentarius);乳植物杆菌属,包括1株斯特拉斯堡乳植物杆菌(Lactiplantibacillus argentoratensis)和3株植物乳植物杆菌(Lactiplantibacillus plantarum);迟缓乳杆菌属,包括1株布氏迟缓乳杆菌(Lentilactobacillus buchneri);明串珠菌属(Leuconostoc),共3株肠膜明串珠菌(Leuconostoc mesenteroides);促生乳杆菌属,包括2株短促生乳杆菌(Levilactobacillus brevis);片球菌属(Pediococcus),包括1株戊糖片球菌(Pediococcus acidilactici);葡萄球菌属(Staphylococcus),包括1株木糖葡萄球菌(Staphylococcus xylosus);魏斯氏菌属,包括1株希腊魏斯氏杆菌(Weissella hellenica)和2株泰国魏斯氏菌(Weissella thailandensis)。因此,基于16S rRNA的分子鉴定表明,所分离到的18株菌均为乳酸菌。
结合高通量测序结果和分离鉴定方法获得的乳酸菌菌群结果,可以将重庆地区含量最高的3个优势属中的两个鉴定为短促生乳杆菌和布氏迟缓乳杆菌,遗憾的是,未分离到属于另一个相对含量最高的属(乳杆菌属)的菌株。隶属于相对含量最高的3个属的乳酸菌同样也出现在贵州松桃县和湖南怀化的鲊广椒中[6]。不同的是,贵州松桃和湖南怀化鲊广椒中促生乳杆菌还包括副短促生乳杆菌(Levilactobacillus parabrevis)和昂仁促生乳杆菌(Levilactobacillus angrenensis),而迟缓乳杆菌属还包括了类谷糠迟缓乳杆菌(Lentilactobacillus parafarraginis),未在重庆鲊广椒中分离得到这些菌;同样的,在重庆鲊广椒及贵州和湖南鲊广椒中,均未分离到隶属于乳杆菌属的乳酸菌。
值得注意的是,在重庆鲊广椒样品中还分离到了一株可用于食品加工的葡萄球菌属菌株木糖葡萄球菌。该类微生物不运动,不产孢,过氧化氢酶阳性,属于兼性厌氧菌。该类菌可在常见的发酵肉制品如香肠中检测到,被认为能产生脂肪酶和蛋白酶,因此能将原料中的蛋白质和脂肪降解产生氨基酸和游离脂肪酸,并进一步代谢产生一些小分子风味物质[21]。添加木糖葡萄球菌作为发酵剂制作的香肠,其pH显著降低,硬度和咀嚼型增加,质构和色泽得到改善,因此该类菌是目前商业肉品发酵剂中的常用菌种[22],然而,该类菌在植物基的发酵食品中较为少见。
A- RNA加工和修饰;B-染色质结构和动力学;C-能源生产和转换;D-细胞周期控制,细胞分裂,染色体分割;E-氨基酸运输和代谢; F-核苷酸转运和代谢;G-碳水化合物的运输和代谢;H-辅酶转运和代谢;I-脂质运输和代谢;J-翻译、核糖体结构和生物发生;K-转录; L-复制、重组和修复;M-细胞壁/膜/包膜生物发生;N-细胞能动;O-翻译后修饰,蛋白质周转,伴侣蛋白;P-无机离子转运和代谢;Q-次生代 谢物的生物合成、运输和分解代谢;R-一般功能预测预测;S-未知功能;T-信号转导机制;U-细胞内运输、分泌和囊泡运输;V- 防御机制 W-外细胞结构;X-原噬菌体,转座子;Y-细胞核结构;Z-细胞骨架
图5 奉节和巫山地区不同来源鲊广椒菌群功能差异分析
Fig.5 Functional analysis of zha-chili flora from Fengjie and Wushan County

图6 奉节和巫山鲊广椒来源乳酸菌系统发育树
Fig.6 Phylogenetic tree of lactic acid bacteria from zha-chili from Fengjie and Wushan County
3 结论
重庆地区巫山县与奉节县来源的鲊广椒富含乳酸菌,优势属为乳杆菌属、促生乳杆菌属和迟缓乳杆菌属等11个菌属,其中普雷沃菌属和塔特姆菌属分别在巫山和奉节鲊广椒中富集,因此可以分别用来区分这两个地区的鲊广椒样品。通过分离鉴定方法得到的18株菌均被鉴定为乳酸菌,它们包括伴生乳杆菌属、乳植物杆菌属和迟缓乳杆菌属等。结合高通量测序技术与分离鉴定方法,可将重庆地区鲊广椒的优势属鉴定为短促生乳杆菌和布氏迟缓乳杆菌,前者属于能在食品加工中使用的乳酸菌菌种。总的来看,重庆地区自然发酵制作的鲊广椒中乳酸菌占绝对优势,但是也含有有害菌如克雷伯氏菌。本研究预期能为鲊广椒的产业化发展提供菌株资源与数据支撑。
[1] DE SOUZA E L, DE OLIVEIRA K  , DE OLIVEIRA M E.Influence of lactic acid bacteria metabolites on physical and chemical food properties[J].Current Opinion in Food Science, 2023, 49:100981
, DE OLIVEIRA M E.Influence of lactic acid bacteria metabolites on physical and chemical food properties[J].Current Opinion in Food Science, 2023, 49:100981
[2] 姚粟, 王鹏辉, 白飞荣, 等.中国传统发酵食品用微生物菌种名单研究(第二版)[J].食品与发酵工业, 2022, 48(1):272-307. YAO S, WANG P H, BAI F R, et al.Research on the inventory of microbial food cultures in Chinese traditional fermented foods (2nd edition)[J].Food and Fermentation Industries, 2022, 48(1):272-307.
[3] 陈坚, 汪超, 朱琪, 等.中国传统发酵食品研究现状及前沿应用技术展望[J].食品科学技术学报, 2021, 39(2):1-7. CHEN J, WANG C, ZHU Q, et al.Research status and application prospect of frontier technology of traditional fermented food in China[J].Journal of Food Science and Technology, 2021, 39(2):1-7.
[4] CAI W C, WANG Y R, HOU Q C, et al.PacBio sequencing combined with metagenomic shotgun sequencing provides insight into the microbial diversity of Zha-chili[J].Food Bioscience, 2021, 40:100884.
[5] CAI W C, WANG Y R, HOU Q C, et al.Rice varieties affect bacterial diversity, flavor, and metabolites of Zha-chili[J].Food Research International, 2021, 147:110556.
[6] GUO Z, WANG Y R, XIANG F S, et al.Evaluating the flavor and divergent bacterial communities in corn-based Zha-chili[J].Food Bioscience, 2022, 46:101563.
[7] 吴成, 王春晓, 王晓丹,等.高通量测序技术在酿酒微生物多样性研究中的应用[J].食品科学, 2019, 40(3):348-355. WU C, WANG C X, WANG X D, et al.A review of the application of high-throughput sequencing technology in analysis of the diversity of microbial communities involved in the fermentation of alcoholic beverages[J].Food Science, 2019, 40(3):348-355.
[8] GUO Z, WANG Y R, XIANG F S, et al.Bacterial diversity in pickled Cowpea (Vigna unguiculata[Linn.] Walp) as determined by Illumina MiSeq sequencing and culture-dependent methods[J].Current Microbiology, 2021, 78(4):1286-1297.
[9] CAPORASO J G, KUCZYNSKI J, STOMBAUGH J, et al.QIIME allows analysis of high-throughput community sequencing data[J].Nature Methods, 2010, 7(5):335-336. [10] EDGAR R C.Search and clustering orders of magnitude faster than BLAST[J].Bioinformatics, 2010, 26(19):2460-2461.
[11] COLE J R, WANG Q, FISH J A, et al.Ribosomal Database Project:Data and tools for high throughput rRNA analysis[J].Nucleic Acids Research, 2014, 42(D1):D633-D642.
[12] SEGATA N, IZARD J, WALDRON L, et al.Metagenomic biomarker discovery and explanation[J].Genome Biology, 2011, 12(6):R60.
[13] LASLO V, PINZARU S C, ZAGU A G, et al.Synergic effect of selenium nanoparticles and lactic acid bacteria in reduction cadmium toxicity[J].Journal of Molecular Structure, 2022, 1247:131325.
A G, et al.Synergic effect of selenium nanoparticles and lactic acid bacteria in reduction cadmium toxicity[J].Journal of Molecular Structure, 2022, 1247:131325.
[14] OSBORNE C A, GALIC M, SANGWAN P, et al.PCR-generated artefact from 16S rRNA gene-specific primers[J].FEMS Microbiology Letters, 2005, 248(2):183-187.
[15] KUMAR S, STECHER G, LI M, et al.MEGA X:Molecular evolutionary genetics analysis across computing platforms[J].Molecular Biology and Evolution, 2018, 35(6):1547-1549.
[16] 李娜, 崔梦君, 马佳佳, 等.基于Illumina MiSeq测序和传统可培养方法的洪湖鲊广椒乳酸菌多样性研究[J].食品与发酵工业, 2021, 47(4):110-115;122. LI N, CUI M J, MA J J, et al.Lactic acid bacterial diversity of Zha-chili in Honghu County based on Illumina Miseq sequencing and traditional culture method[J].Food and Fermentation Industries, 2021, 47(4):110-115;122.
[17] SHARMA G, GARG N, HASAN S, et al.Prevotella:An insight into its characteristics and associated virulence factors[J].Microbial Pathogenesis, 2022, 169:105673.
[18] AAKKO J, PIETIL S, TOIVONEN R, et al.A carbohydrate-active enzyme (CAZy) profile links successful metabolic specialization of Prevotella to its abundance in gut microbiota[J].Scientific Reports, 2020, 10:12411.
S, TOIVONEN R, et al.A carbohydrate-active enzyme (CAZy) profile links successful metabolic specialization of Prevotella to its abundance in gut microbiota[J].Scientific Reports, 2020, 10:12411.
[19] WANG J, YIN Y.Clostridium species for fermentative hydrogen production:An overview[J].International Journal of Hydrogen Energy, 2021, 46:34599-34625.
[20] 勾文君, 田源, 孔小勇, 等.洋河酒窖泥细菌群落结构与菌株产酸能力分析[J].微生物学通报, 2020, 47(6):1651-1661. GOU W J, TIAN Y, KONG X Y, et al.Bacterial composition in pit mud of Yanghe liquor and identification of acid producing bacteria[J].Microbiology China, 2020, 47(6):1651-1661.
[21] KHUSRO A, AARTI C.Metabolic heterogeneity and techno-functional attributes of fermented foods-associated coagulase-negative staphylococci[J].Food Microbiology, 2022, 105:104028.
[22] 刘玥. 木糖葡萄球菌干粉保护剂的研究及其在发酵香肠中的应用[D].扬州:扬州大学, 2020. LIU Y.Study on dry powder protective agent of Staphylococcus xylose and its application in fermented sausage[D].Yangzhou:Yangzhou University, 2020.