壳寡糖(chitosan oligosaccharide,COS)是一种由氨基葡萄糖组成的多糖类物质,聚合度在2~20,具有抗菌、抗氧化等多种生物活性功能[1-4]。壳寡糖可由壳聚糖降解制得,与壳聚糖相比,壳寡糖具有更低的黏度和更高的水溶性,有利于其在食品、药理学和生物医学等领域的广泛应用[4-8]。本课题组前期对虾源壳聚糖的酶解工艺进行优化,得到高抗氧化活性的壳聚糖酶解物[1],但是该酶解产物包含的壳寡糖分子质量较宽泛,而不同分子质量的壳寡糖抗菌抗氧化活性有较大差异,因此有必要对该酶解产物进行乙醇分级沉淀以得到不同分子质量的壳寡糖,并探究其抗菌抗氧化特性,以提高目标酶解产物的利用率。有较多学者采用乙醇沉淀这一方法对壳寡糖进行提纯,舒德海等[9]使用体积分数为75%的乙醇沉淀壳寡糖,得到主要成分为2~4糖的壳寡糖产品;孙婷[10]使用75%和87.5%的乙醇沉淀壳寡糖,分别得到主要聚合度9以上和聚合度7以上的壳寡糖;张青[11]使用体积分数为60%、75.0%、87.5%的乙醇对壳寡糖进行分级沉淀以获得不同数均分子质量的壳寡糖。综合前人的研究,本实验拟采用体积分数为50%、60%、70%的乙醇对目标酶解产物进行分级沉淀,以获得相应的目标产物。
关于壳寡糖的分子质量与其抗菌抗氧化特性的关系,学者们有不同的见解[5,12-13]。对于抗菌活性,张青[11]认为分子质量小的蝇蛆源壳寡糖抗菌效果更佳,而S NCHEZ
NCHEZ 等[12]则认为分子质量大的蜘蛛蟹源壳寡糖抗菌效果更好;对于抗氧化活性,普遍认为分子质量小的壳寡糖抗氧化效果更佳[5,11],但也有学者发现壳寡糖的超氧自由基清除活性随着分子质量的增加而增加[13],因此,壳寡糖的分子质量与其抗菌抗氧化活性之间的特性与壳寡糖的来源、微生物的种类、抗氧化的指标等息息相关。本课题拟研究虾源壳寡糖分子质量与其抗菌抗氧化活性之间的相关性,获得抗菌抗氧化特性良好的优选壳寡糖。
等[12]则认为分子质量大的蜘蛛蟹源壳寡糖抗菌效果更好;对于抗氧化活性,普遍认为分子质量小的壳寡糖抗氧化效果更佳[5,11],但也有学者发现壳寡糖的超氧自由基清除活性随着分子质量的增加而增加[13],因此,壳寡糖的分子质量与其抗菌抗氧化活性之间的特性与壳寡糖的来源、微生物的种类、抗氧化的指标等息息相关。本课题拟研究虾源壳寡糖分子质量与其抗菌抗氧化活性之间的相关性,获得抗菌抗氧化特性良好的优选壳寡糖。
1 材料与方法
1.1 材料与仪器
虾源壳聚糖(批号:200820,脱乙酰度>85%),山东海得贝生物科技有限公司;木瓜蛋白酶(固体,800 u/mg,CAS:9001-73-4),上海瑞永生物科技有限公司;D-盐酸氨基葡萄糖标准品,中国药检;抗坏血酸,Sigma Aldrich公司。
ALYE G3-旋转蒸发器,Heidolph公司;LGJ-10型真空冷冻干燥机,北京松源华兴科技发展有限公司;THERMO Varioskan Flash全自动酶标仪,赛默飞世尔科技公司;PHS-3E型pH计,上海雷磁;84-1A磁力搅拌器,上海司乐仪器有限公司。
1.2 四种不同分子质量壳寡糖产品的制备
参照文献[1]的最优酶解条件制备壳聚糖酶解物。将虾源壳聚糖溶解于醋酸缓冲溶液中,调节pH值至4.80,按酶底比20%加入木瓜蛋白酶,于48.00 ℃温度条件下水浴1 h,沸水浴10 min灭酶活,于冰水中快速冷却,8 000 r/min离心,上清液为壳聚糖酶解物,然后进行真空浓缩,得到壳聚糖酶解物浓缩液。
参照张青[11]的方法进行乙醇分级沉淀。在壳聚糖酶解物浓缩液中加入等体积的无水乙醇,使溶液中乙醇体积分数为50%,于4 ℃静置沉淀6 h,离心分离沉淀和上清液,沉淀为50%乙醇沉淀壳寡糖(COS50)。上清液继续加入0.25倍体积的无水乙醇,使溶液中乙醇体积分数为60%,4 ℃静置6 h后离心,沉淀为50%~60%乙醇沉淀壳寡糖(COS60)。上清液继续加入0.33倍体积的无水乙醇,使溶液中乙醇体积分数为70%,4 ℃静置6 h后离心,沉淀为60%~70%乙醇沉淀壳寡糖(COS70),上清液为70%乙醇的上清壳寡糖(COS70 s),COS70 s经真空旋蒸后冷冻干燥,其余组分进行冷冻干燥,一共获得4种壳寡糖产品(COS50、COS60、COS70和COS70 s)。
1.3 四种壳寡糖产品数均分子质量和产量的测定
参照文献[1]的方法测定4种壳寡糖产品的数均分子质量和产量。
1.4 四种壳寡糖产品抗菌活性的测定
1.4.1 牛津杯法测定4种壳寡糖产品的抑菌圈
参照文献[14]中的牛津杯法测定4种壳寡糖产品对5种指示菌[大肠杆菌(Escherichia coli,菌种号:ATCC28922)、枯草芽孢杆菌(Bacilus subtilis,菌种号:CMCC63501)、金黄色葡萄球菌(Staphylococcus aureus,菌种号:ATCC29213)、假单胞菌(Pseudomonas)和希瓦氏菌(Shewanella)(来源于广东海洋大学水产品质量安全实验室保藏的南美白对虾腐败菌分离株)]的抗菌活性。
1.4.2 试管二倍稀释法测定4种壳寡糖产品的最低抑菌浓度(minimum inhibitory concentration,MIC)和最低杀菌浓度(minimum bactericidal concentration,MBC)
参照文献[15]中的二倍试管稀释法测定4种壳寡糖产品对5种指示菌的MIC。将浓度等于或高于MIC的试管继续培养24 h,吸取培养液涂布于固体培养基,恒温培养24 h,观察平板上有无菌落生长,无菌生长对应的最低浓度为MBC。
1.5 比色法测定4种壳寡糖产品的抗氧化活性
参照文献[1]的方法测定4种壳寡糖产品的DPPH自由基清除率和总还原力。
1.6 数据分析
采用WPS office对数据进行整理和绘制图表,采用SPSS 22进行显著性分析。
2 结果与分析
2.1 四种壳寡糖产品的数均分子质量和产量
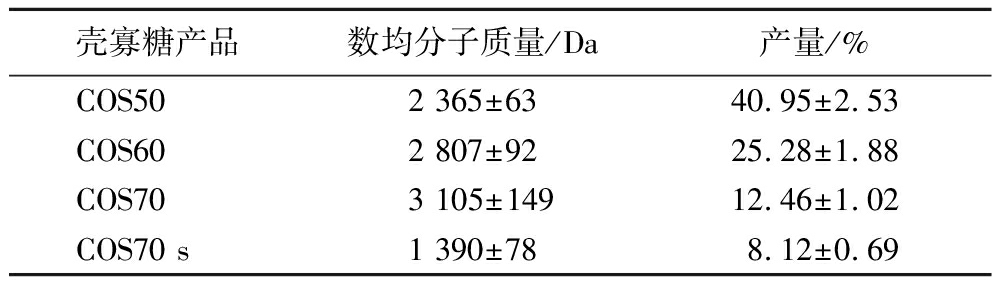
由于多糖不溶于乙醇,因此将乙醇逐步加入壳聚糖酶解物,壳多糖会逐步沉淀析出,进而得到不同分子质量的壳寡糖[16]。采用乙醇分级沉淀法获得的4种壳寡糖产品的数均分子质量分别为2 365、2 807、3 105、1 390 Da,产量分别为40.95%、25.28%、12.46%、8.12%(表1)。
表1 四种壳寡糖产品的数均分子质量和产量
Table 1 Average molecular weight and yield of four chitosan oligosaccharides
壳寡糖产品数均分子质量/Da产量/%COS502 365±6340.95±2.53COS602 807±9225.28±1.88COS70 3 105±14912.46±1.02COS70 s1 390±788.12±0.69
2.2 四种壳寡糖产品的抗菌活性比较
2.2.1 四种壳寡糖产品的抑菌效果
表2显示4种壳寡糖产品对5种指示菌的抑菌效果。其中壳寡糖产品COS50、COS60、COS70对5种指示菌均有抑菌效果,而COS70 s在实验浓度下仅对希瓦氏菌有抑菌效果,对其余4种菌则无抑菌效果,表明COS70 s较其余3种壳寡糖的抑菌效果弱。对大肠杆菌,在10.00 mg/mL质量浓度下,COS60的抑菌圈显著大于COS50和COS70(P<0.05),随着壳寡糖浓度的降低,3种壳寡糖的抑菌圈大小的差异性减少,抑制效果:COS60>COS50>COS70;对枯草杆菌,COS50和COS60的抑菌效果没有显著性差异(P>0.05),但显著优于COS70的抑菌效果(P<0.05);对金黄色葡萄球菌,在壳寡糖质量浓度为2.50 mg/mL时,COS50的抑菌效果显著优于COS60和COS70(P<0.05),特别是COS50在质量浓度为1.25 mg/mL时仍有抑菌效果,而其余壳寡糖没有抑菌效果;对假单胞菌,在壳寡糖质量浓度为0.62 mg/mL时,COS50的抑菌效果显著优于COS60和COS70(P<0.05);对希瓦氏菌,4种壳寡糖产品在质量浓度为0.31 mg/mL浓度下对希瓦氏菌即有抑菌效果,所需浓度远低于上述4种指示菌,表明壳寡糖对希瓦氏菌有更强的抑制活性,在壳寡糖质量浓度为0.62 mg/mL时,COS50的抑菌效果显著优于COS60、COS70和COS70 s(P<0.05)。
表2 四种壳寡糖产品的抑菌效果
Table 2 Antibacterial effect of four chitosan oligosaccharides

细菌种类壳寡糖质量浓度/(mg/mL)抑菌圈大小/mmCOS50COS60COS70COS70 s大肠 杆菌 10.0011.32±0.20b12.77±0.07a11.31±0.21b-5.0010.38±0.28a10.66±0.89a10.49±0.25a-2.509.25±0.11ab9.35±0.17a9.05±0.07b-1.25----枯草芽孢杆菌5.0010.95±0.45a11.28±0.74a9.88±0.02b-2.509.49±0.13a9.42±0.10a9.04±0.16b-1.258.55±0.29a8.60±0.06a--0.62----金黄色葡萄 球菌 5.0011.63±0.15a11.40±0.26a10.49±0.11b-2.5010.14±0.18a9.64±0.10b9.21±0.05 c-1.258.45±0.31---0.62----假单 胞菌 2.5011.46±1.12a10.62±0.50ab9.48±0.08b-1.259.17±0.15a9.20±0.12a9.15±0.41a-0.628.89±0.05a8.61±0.09b8.52±0.18b-0.31----希瓦 氏菌 0.6210.17±0.05a9.72±0.12b9.62±0.20b9.80±0.04b0.318.98±0.06ab9.03±0.17a8.75±0.15b8.45±0.09c0.168.55±0.23a8.38±0.38a8.67±0.15a-0.08----
注:同一行中数据右上角不同上标字母表示同一浓度下各壳寡糖产品的抑菌圈大小存在显著性差异(P<0.05);-表示无抑菌效果(下同)。
2.2.2 四种壳寡糖的MIC和MBC
表3分别为4种壳寡糖产品对5种指示菌的MIC和MBC,MIC值和MBC值越小,表明该物质的抑菌效果越强。对于大肠杆菌,壳寡糖产品COS50、COS60和COS70的MIC值和MBC值一样,表明3种壳寡糖对大肠杆菌的抑菌效果一样强;对于枯草杆菌,COS50和COS60的MIC和MBC值小于COS70,表明这2种壳寡糖的对枯草杆菌的抑菌效果强于COS70;对于金黄色葡萄球菌,COS50的MIC和MBC值小于COS60和COS70,表明COS50对金黄色葡萄球菌的抑菌效果强于其他2种;对于假单胞菌,3种壳寡糖的MIC值一致,但COS50和COS60的MBC值小于COS70,表明COS70对假单胞菌的抑菌效果弱于其他2种壳寡糖;对于希瓦氏菌,4种壳寡糖产品对其均有抑菌效果,其中乙醇沉淀的3种壳寡糖的抑菌效果强于COS70 s。上述结果表明,COS50、COS60和COS70对5种细菌均有抑菌效果,总体而言抑菌效果:COS50>COS60>COS70,即这3种壳寡糖的抑菌活性随着壳寡糖分子质量的增加而减弱。
表3 四种壳寡糖产品对指示菌的MIC/MBC 单位:mg/mL
Table 3 MIC/MBC of four chitosan oligosaccharides on indicator bacteria

壳寡糖产品大肠杆菌枯草芽孢杆菌金黄色葡萄球菌假单胞菌希瓦氏菌COS502.50/5.001.25/1.251.25/1.250.62/0.620.16/0.31COS602.50/5.001.25/1.252.50/5.000.62/0.620.16/0.31COS702.50/5.002.50/2.502.50/2.500.62/1.250.16/0.31COS70 s-/--/--/--/-0.31/0.62
2.3 四种壳寡糖产品的抗氧化活性比较
对于DPPH自由基,样品的IC50值越小表明其对DPPH自由基的抗氧化能力越强,结果表明4种壳寡糖产品对于DPPH自由基的抗氧化能力:COS50>COS70 s>COS60>COS70,其中COS50的抗氧化能力约为COS70 s的1.5倍(图1)。对于总还原力,COS70 s>COS50>COS60>COS70,其中COS70 s的总还原力约为COS50的2.5倍(图1)。总体而言,4种壳寡糖产品的抗氧化能力强弱排序为:COS70 s>COS50>COS60>COS70,即壳寡糖的抗氧化能力随着分子质量的增加而减弱。

图1 四种壳寡糖产品的抗氧化活性比较
Fig.1 Comparison of antioxidant activity of four chitosan oligosaccharides
3 讨论
壳寡糖是一种碱性多糖,具有抗菌抗氧化等生物活性,多项研究表明壳寡糖的生物活性与其分子质量相关[7]。本研究使用乙醇将目标酶解产物进行分级沉淀,得到4种不同分子质量的壳寡糖(COS50、COS60、COS70、COS70 s),并对其抗菌抗氧化活性进行探究,发现乙醇沉淀的3种壳寡糖产品(COS50、COS60、COS70)对5种细菌均有抑制效果,表明这3种壳寡糖对细菌具有广谱抑菌性,与前人发现壳寡糖可抑菌多种细菌生长的结果相一致[17];COS70 s(数均分子质量为1 390 Da)在同样实验浓度下只对希瓦氏菌有抑制效果,对其余指示菌没有抑菌效果,这可能是由于该壳寡糖含有的抑菌有效成分较少,研究表明,对于壳1~5糖,聚合度低的壳寡糖抑菌效果更弱,长于六聚体的的壳寡糖抑菌效果更佳[18-19],而COS70 s的数均分子质量与其他3种壳寡糖相比,降低了40%~55%,含有壳6糖以上的抑菌有效成分更低,因此需要更高的浓度才可达到抑制菌种生长的效果,这也是该壳寡糖在相同实验浓度下对某些实验菌种没有抑菌活性的原因。
乙醇沉淀的3种壳寡糖对5种指示菌均有抑菌效果,从MIC值上看,抑菌效果:COS50>COS60>COS70,即壳寡糖的抑菌活性随着壳寡糖分子质量的增加而减弱,这与张青[11]认为分子质量小的壳寡糖抑菌活性更强的结论相一致,这可能是由于较低分子质量的壳寡糖除了能在细菌细胞膜的负电荷成分结合外,还能够进入细菌细胞内,吸附DNA,阻断RNA转录和蛋白质合成,从而达到抗菌的效果[3,20]。
壳寡糖的来源对其抗菌活性也有影响。张青[11]对蝇蛆壳聚糖酶解液进行乙醇分级沉淀,发现70.0%~87.5% EP-COS(数均分子质量为1 093 Da)对大肠杆菌的抑制效果最好,pH=5.0条件下的MIC为5 mg/mL。COS50(数均分子质量为2 365 Da)的分子质量比70.0%~87.5% EP-COS大,理论上其对大肠杆菌的抗菌活性会比它弱,但本研究却发现其在pH=7.0条件下的MIC仅为2.5 mg/mL,说明虾源壳寡糖的抑菌效果更好。
对于抗氧化活性,本研究发现壳寡糖的总还原力随着分子质量的增加而减弱(COS70 s>COS50>COS60>COS70),与前人的研究结论一致[5,11,17],出现这种规律可能是由于较高的分子质量的壳寡糖具有更强的分子内氢键,导致结构更紧凑,进而削弱了羟基和氨基的活性,限制了它们的还原能力[17]。对于壳寡糖的自由基清除能力,本研究发现COS50>COS70 s>COS60>COS70,有人认为是不稳定的自由基与壳寡糖的氨基和羟基反应形成相对稳定的自由基[21],进而起到清除自由基的作用;由此可见壳寡糖的氨基和羟基外展的越多,清排自由基能力越强,一般认为分子质量越小,裸露的氨基和羟基越多。但本研究发现,分子质量小的COS70 s比分子质量大的COS50对DPPH自由基的清除能力弱,可能是由于COS70 s中存在彻底降解的单糖(氨基葡萄糖),能与自由基有效结合的氨基和羟基减少,表现出抗氧化性更强的壳寡糖有效成分更少,本研究结果进一步说明壳寡糖的功能并不是简单认为分子质量越小越优。
本研究所用的木瓜蛋白酶与底物比为1∶5,酶的用量过大,酶解产物中可能存在木瓜蛋白酶自身水解产生的蛋白肽。但是,迄今为止没有关于木瓜蛋白酶分解得到的多肽具有抗菌抗氧化活性的任何佐证,而且若存在多肽,在乙醇沉淀过程中多肽也会析出,特别是本课题组前期研究发现随着pH值的降低,蛋白质水解更严重,若分解出的多肽存在抗氧化活性,那么pH越小,水解出来的产物抗氧化能力应该更强,但试验结果却表明,在pH 4.8时酶解所得产物抗氧化活性更强[1],这也间接说明了木瓜蛋白酶酶解法制备壳聚糖的抗菌抗氧化活性与酶自身水解的蛋白肽无关。
本研究对具有自主知识产权的4种壳寡糖产品进行抗菌抗氧化活性研究,发现数均分子质量适中的壳寡糖抑菌效果更强(抗菌效果排序为:COS50>COS60>COS70>COS70 s);壳寡糖的抗氧化能力随着数均分子质量的增加而减弱(抗氧化效果排序为:COS70 s>COS50>COS60>COS70);综合考虑抗菌抗氧化效果,认为COS50(数均分子质量为2 365 Da)为同时拥有抗菌抗氧化性能的优选壳寡糖。本研究可为虾源壳寡糖的开发应用提供理论参考。
[1] 黄晓月, 毕思远, 区家豪, 等.木瓜蛋白酶法制备抗氧化活性壳寡糖的工艺优化[J].生物学杂志, 2022, 39(1):104-109. HUANG X Y, BI S Y, OU J H, et al.Process optimization of preparation of antioxidant chitooligosaccharides by papain[J].Journal of Biology, 2022, 39(1):104-109.
[2] KHOUSHAB F, YAMABHAI M.Chitin research revisited[J].Marine Drugs, 2010, 8(7):1988-2012.
[3] NAVEED M, PHIL L, SOHAIL M, et al.Chitosan oligosaccharide (COS):An overview[J].International Journal of Biological Macromolecules, 2019, 129:827-843.
[4] BENCHAMAS G, HUANG G L, HUANG S Y, et al.Preparation and biological activities of chitosan oligosaccharides[J].Trends in Food Science &Technology, 2021, 107:38-44.
[5] HUANG J, ZHAO D K, HU S, et al.Biochemical activities of low molecular weight chitosans derived from squid pens[J].Carbohydrate Polymers, 2012, 87(3):2231-2236.
[6] YUAN X B, ZHENG J P, JIAO S M, et al.A review on the preparation of chitosan oligosaccharides and application to human health, animal husbandry and agricultural production[J].Carbohydrate Polymers, 2019, 220:60-70.
[7] ABD EL-HACK M E, EL-SAADONY M T, SHAFI M E, et al.Antimicrobial and antioxidant properties of chitosan and its derivatives and their applications:A review[J].International Journal of Biological Macromolecules, 2020, 164:2726-2744.
[8] 高晓冉, 刘程惠, 陈立国, 等.壳寡糖与茶多酚复合保鲜剂对冷鲜牛肉的保鲜效果[J].食品与发酵工业, 2019, 45(11):172-178. GAO X R, LIU C H, CHEN L G, et al.Preservative effects of chitosan oligosaccharide and tea polyphenol together on chilled beef[J].Food and Fermentation Industries, 2019, 45(11):172-178.
[9] 舒德海, 钱俊青, 吴薇.过氧化氢制备壳寡糖的工艺[J].食品与发酵工业, 2009, 35(6):121-125. SHU D H, QIAN J Q, WU W.The oxidation method to prepare chitosan oligosaccharide[J].Food and Fermentation Industries, 2009, 35(6):121-125. [10] 孙婷. 纤维素酶降解壳聚糖的研究[D].无锡:江南大学, 2009. SUN T.Studies on the depolymerization of chitosan by cellulase[D].Wuxi:Jiangnan University, 2009.
[11] 张青. 蝇蛆壳寡糖的制备及其性能研究[D].广州:华南理工大学, 2018. ZHANG Q.Preparation and performance research of chito-oligosaccharides from fly maggot[D].Guangzhou:South China University of Technology, 2018.
[12] S NCHEZ
NCHEZ , MENG
, MENG BAR M, RIVERA-RODR
BAR M, RIVERA-RODR GUEZ G, et al.The effect of preparation processes on the physicochemical characteristics and antibacterial activity of chitooligosaccharides[J].Carbohydrate Polymers, 2017, 157:251-257.
GUEZ G, et al.The effect of preparation processes on the physicochemical characteristics and antibacterial activity of chitooligosaccharides[J].Carbohydrate Polymers, 2017, 157:251-257.
[13] LI K C, XING R E, LIU S, et al.Separation of chito-oligomers with several degrees of polymerization and study of their antioxidant activity[J].Carbohydrate Polymers, 2012, 88(3):896-903.
[14] 陈全毅. 海洋源抗菌活性乳酸菌筛选与细菌素分离及对单增李斯特菌作用效应的研究[D].湛江:广东海洋大学, 2021. CHEN Q Y.Screening of marine source antimicrobial active lactic acid bacteria and bacteriocin isolation and their effects on Listeria monocytogenes[D].Zhanjiang:Guangdong Ocean University, 2021.
[15] 贾爱荣, 张永刚, 夏雪奎, 等.不同处理方法对中国明对虾贮藏中腐败微生物的影响[J].食品工业, 2015, 36(9):96-100. JIA A R, ZHANG Y G, XIA X K, et al.Effects of different approaches on spoilage microorganisms in Chinese shrimp (Fenneropenaeus chinensis) during storage[J].The Food Industry, 2015, 36(9):96-100.
[16] 王新. 灵芝多糖的提取及抗氧化活性研究[D].镇江:江苏大学, 2007. WANG X.Study on extraction and antioxidation of polysaccharide from Ganoderma lucidum[D].Zhenjiang:Jiangsu University, 2007.
[17] AFFES S, ARANAZ I, HAMDI M, et al.Preparation of a crude chitosanase from blue crab viscera as well as its application in the production of biologically active chito-oligosaccharides from shrimp shells chitosan[J].International Journal of Biological Macromolecules, 2019, 139:558-569.
[18] LIAQAT F, ELTEM R.Chitooligosaccharides and their biological activities:A comprehensive review[J].Carbohydrate Polymers, 2018, 184:243-259.
[19] 周萌. 壳聚糖的氧化降解及壳寡糖的分离纯化[D].广州:华南理工大学, 2013. ZHOU M.The oxidative degradation of chitosan and the purification of oligochitosan[D].Guangzhou:South China University of Technology, 2013.
[20] 杨焕蝶, 张翔, 亚历山大·苏沃洛夫, 等.壳聚糖与壳寡糖抑菌保鲜研究进展[J].山东农业科学, 2020, 52(2):167-172. YANG H D, ZHANG X, ALEXANDER S, et al.Research progress of chitosan and chitooligosaccharide in bacteriostasis and preservation[J].Shandong Agricultural Sciences, 2020, 52(2):167-172.
[21] ZOU P, YANG X, WANG J, et al.Advances in characterisation and biological activities of chitosan and chitosan oligosaccharides[J].Food Chemistry, 2016, 190:1174-1181.