柠檬(Citrus limon)富含柠檬酸、类黄酮、维生素和矿物质等多种营养物质,具有降低胆固醇、预防心血管疾病、护肤美容和抗肿瘤等功效,是继柑和橙之后的第三大柑橘品种, 在全世界范围内有广泛的栽培。重庆市万州区白羊镇作为全国柠檬三大主产区之一,被誉为“重庆市柠檬之乡”,柠檬年产量可达6万t,但目前销售模式多以鲜销为主,加之柠檬加工产业起步较晚,加工产品单一,附加值较低,造成丰产不丰收的现状[1]。因此,开发多样化的柠檬加工产品是增加柠檬经济效益亟需解决的问题。
精油是从植物中提取的天然化合物,具有抗炎、抑菌、抗氧化、抗焦虑等作用[2-3],其成分及生物活性越来越受到人们的关注[4-5]。有学者[6-8]对柠檬果皮精油进行气相色谱-质谱联用(gas chromatography-mass spectrometer,GC-MS)分析发现,不同方法提取的柠檬果皮精油其挥发性成分均以烯类为主,醇类、酯类和醛类等含氧化合物次之。目前柠檬精油的研究和应用主要集中于芳香理疗或改善神经系统作用和膜材料的制备[9-10],随着一些活性成分生理活性的发现,柠檬精油作为功能食品及药品化妆品的原料具有广阔的应用和开发前景[11-12],需求将日益增加。为响应国家号召,坚持因地制宜、循序渐进的绿色发展理念和乡村振兴的战略方针,本研究以万州区白羊镇尤力克柠檬果皮为原料,通过单因素、响应面实验优化提取工艺获取柠檬精油,并探究柠檬精油的抑菌、抗氧化及抗肿瘤活性,以期为万州柠檬深加工产业以及废渣利用的发展提供理论依据。
1 材料与设备
1.1 材料与试剂
万州尤力克柠檬,重庆市万州区白羊镇;结直肠癌细胞SW620、HCT116、胶质瘤细胞U87、U251,宫颈癌细胞Hela、头颈癌细胞SCC15、胰腺癌细胞BXPC-3、前列腺癌细胞PC3、人正常结直肠上皮细胞FHC,重庆文理学院创新靶向药物国际研究院提供;金黄色葡萄球菌、副溶血性弧菌、嗜水气单胞菌、维氏气单胞菌,重庆三峡学院生物与食品工程学院实验室培养。
DPPH;碘化丙啶 (propidium iodide,PI)、核糖核酸酶(ribonuclease,RNase);噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT);二甲基亚砜 (dimethyl Sulfoxide,DMSO);RPMI-1640 (roswell park memorial institute-1640)液体培养基、DMEM(dulbecco′s modified eagle medium)液体培养基、F12K液体培养基、无支原体胎牛血清、胰蛋白酶;抗体CDK1、CyclinB、LC3B、α-Tubulin;荧光二抗。
1.2 仪器与设备
GI80T高压蒸汽灭菌锅,上海跃进医疗器械有限公司;MINI G S25/Eppendorf AG轻小型离心机,德国艾本德股份公司;1-16K高速冷冻离心机,重庆市瑞利电子仪器设备有限公司;5K43734倒置显微镜,日本Olympus 公司;F2215-185A-460细胞计数器,赛默飞世尔科技;XB70-FZ/R34A制冰机,东南科仪有限公司;PowerPacTM Basic蛋白电泳/转膜仪,美国BIO-RAD公司;Cycation 5多功能酶标仪,美国BIO-TEK公司;ODYSSEY CLX LI-COR Odeyssey激光扫描仪,美国Gene limited company基因有限公司。
1.3 实验方法
1.3.1 柠檬精油提取工艺流程
柠檬精油提取工艺流程如下:
新鲜柠檬→清洗→切皮、去白瓤→破碎→超声→蒸馏→无水硫酸钠干燥→精油
1.3.2 超声波辅助水蒸气蒸馏法提取柠檬精油
新鲜柠檬皮去除白瓤,高速粉碎机研磨1 min,称取30 g粉碎后的新鲜柠檬皮置于1 000 mL圆底烧瓶中,按照对应比例加入适量蒸馏水,超声一定时间后,连接挥发油提取装置,蒸馏一定时间,计算精油的提取率,提取率计算如公式(1)所示:
(1)
式中:c,提取率,%;v1,柠檬精油体积,mL;m2,新鲜柠檬果皮质量,g。
1.3.3 单因素及响应面实验优化提取工艺
结合文献[13-15],分别以液料比3∶1~15∶1(mL∶g),蒸馏时间30~210 min,超声时间10~60 min,氯化钠添加2~15 g/L为基础,进行单因素实验。在单因素实验的基础上,以液料比(mL∶g)、超声时间(min)、蒸馏时间(min)、氯化钠添加量(g/L)为自变量,柠檬精油提取率(%)为响应值,按照B-Behnken Design原理[16]设计4因素3水平(表1),采用Design-Expert 8.0 软件进行响应面实验,根据实验结果进行优化分析,以得到最优提取工艺。
表1 响应面因素水平表
Table 1 Level of response surface experimental factors
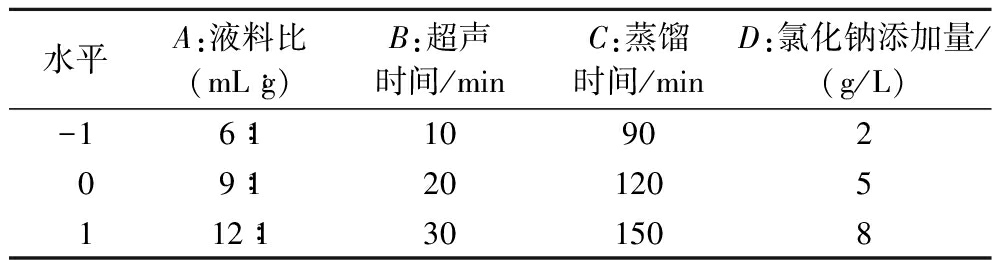
水平A:液料比(mL∶g)B:超声时间/minC:蒸馏时间/minD:氯化钠添加量/(g/L)-16∶11090209∶1201205112∶1301508
1.3.4 GC-MS 分析柠檬精油成分
a)样品预处理:取提取的柠檬精油用二氯甲烷稀释 10 倍,经0.22 μm微孔滤膜过滤,待测。
b)气相色谱条件:色谱柱为 HP-5MS(30 m×0.25 μm×0.25 mm),载气为高纯氦气(99.999%),流速为0.91 mL/min,不分流进样。进样口温度为250 ℃,进样量 0.4 μL。采用程序升温模式:柱温 80 ℃,保持3 min,再以 8 ℃/min升温至280 ℃,保持23 min。
c)质谱条件:离子源温度230 ℃,接口温度250 ℃,溶剂延迟2 min,EI电子源,电子能量70 eV,m/z扫面范围1.5~1 090 amu。检索库为NIST库。
1.3.5 抗氧化活性测定
称取0.01 g DPPH,溶解于无水乙醇并定容至250 mL,配制成0.1 mmol/L DPPH溶液;取2 mL 0.1 mmol/L的DPPH溶液和2 mL不同质量浓度(3、105、185、264、343 mg/mL)的柠檬精油溶液,混合均匀,避光静置30 min,在517 nm波长下测定其吸光度值A1;取2 mL无水乙醇溶液和2 mL不同浓度的柠檬精油溶液分别混合,避光静置30 min,在517 nm波长下测定其吸光度值A2;取2 mL无水乙醇溶液与2 mL 0.1 mmol/L的DPPH溶液混合,避光静置30 min,在517 nm波长下测定其吸光度值A0;维生素C为阳性对照,所有样品平行测定3次取平均值,根据公式(2)计算清除率(E):
(2)
1.3.6 抑菌活性测定
分别挑取金黄色葡萄球菌、副溶血性弧菌、嗜水气单胞菌、维氏气单胞菌4种细菌单菌落,于LB液体培养基中37 ℃恒温振荡培养12 h,菌液浓度稀释至106~107 CFU。分别取4种待测菌悬液100 μL涂布于LB固体培养基,待其完全吹干,将灭菌后的滤纸片呈“品”字型贴3片于培养基表面,每片滤纸滴加10 μL柠檬精油,同时要以相同的操作以无菌水代替柠檬精油做空白实验,以庆大霉素为阳性对照,37 ℃培养24 h后用游标卡尺测量抑菌圈的直径并记录,实验重复3次,结果取平均值[7]。
1.3.7 细胞培养
取出冻存于液氮罐中的肿瘤细胞进行常规复苏,即在37 ℃水浴锅中迅速完全融化,于800 r/min离心5 min,弃去上清液。分别将结直肠癌细胞SW620,宫颈癌细胞Hela,胶质瘤细胞U87、U251和头颈癌细胞SCC15 接种于含10%(体积分数)胎牛血清的DMEM培养基,胰腺癌细胞BXPC-3接种于含10%胎牛血清的RPMI 1640培养基,前列腺癌细胞PC3接种于含10%胎牛血清的F12K培养基,结直肠癌细胞HCT116接种于含10%胎牛血清的McCoy′s 5a培养基,人正常结直肠上皮细胞FHC接种于含10%胎牛血清的F12K+DMEM混合培养基,置于培养箱中常规培养(37 ℃、5%体积分数CO2、饱和湿度),定期换液,待细胞生长融合达80%~90%时,取对数生长期的细胞进行实验。
1.3.8 MTT法检测细胞增殖活性
9种细胞均分为不同质量浓度柠檬精油组(850、425、213、106、53、26、13、6.6、3.3 μg/mL)、阴性对照组为添加DMSO。分别取对数生长期的9 种细胞的细胞悬液200 μL(1×103个/孔)接种于 96 孔板,置于37 ℃、5%CO2培养箱中培养,待细胞贴壁后,加入不同浓度的柠檬精油和DMSO(阴性对照),并将9 种细胞继续培养48 h后,每孔加入5 mg/mL MTT溶液20 μL继续培养4 h,取出各组细胞,弃上清液后每孔加入200 μL DMSO,摇床10 min,酶标仪设定波长为570 nm,记录吸光度值并计算柠檬精油对细胞增殖的抑制率,每组设6个复孔[17]。细胞增殖抑制率计算如公式(3)所示:
细胞增殖抑制率![]()
(3)
1.3.9 蛋白免疫印迹
取对数生长期的细胞2×106个接种于6 cm培养皿中,培养12 h待细胞贴壁且变形后,分别加入柠檬精油,使得终质量浓度为595、425、255 μg/mL,并以DMSO溶剂为对照组,培养24 h后收集细胞。使用Western及IP裂解液(含蛋白酶抑制剂)分别提取细胞的总蛋白质,并用BCA蛋白质检测试剂盒进行蛋白质定量。上样20 μg总蛋白质,进行10%~15% SDS-PAGE 胶电泳;采用湿转方法(100 V,120 min)将PAGE胶上的蛋白质转印至聚偏二氟乙烯膜上,再用5%(体积分数)脱脂牛奶室温封闭2 h,TBST洗涤5次,每次5 min;相应的一抗按照推荐稀释浓度4 ℃孵育过夜,TBST 洗涤3次,每次10 min;IRDye标记二抗稀释比例为1∶15 000,室温孵育1 h,TBST洗涤3次,每次5 min;采用LI-COR Odeyssey激光扫描仪检测目的条带,并分析检测结果[18]。
1.4 数据处理
响应面模型的设定和分析采用Design Expert 8.0,SPSS、GraphPad Prism 5软件进行统计处理及作图,所有实验结果均重复3次。数据结果均以![]() 表示,*表示P<0.05,**表示P<0.01,***表示P<0.001 表示具有统计学差异[18]。
表示,*表示P<0.05,**表示P<0.01,***表示P<0.001 表示具有统计学差异[18]。
2 结果与分析
2.1 单因素试验结果与分析
液料比、蒸馏时间、超声时间及氯化钠添加量均对柠檬精油的提取率有较大的影响,柠檬精油的提取率随液料比的增加呈现先增后减的变化趋势(图1-a),当液料比达到1∶9左右时柠檬精油的提取率曲线出现峰值,即提取率达到最大值,表明柠檬精油在此时达到饱和,继续增加液料比反而会使蒸馏时间延长,从而延长受热时间,使精油发生分解,提取率下降。因此,确定液料比在1∶9左右时为最佳。
蒸馏时间在120 min之内时,提取率随着时间的延长呈稳步上升的趋势,120 min左右时,提取率达到最大,之后随着时间的延长,提取率不断下降(图1-b)。蒸馏时间过长会引起精油分解,导致提取率降低,说明蒸馏时间过长不利于提取的顺利进行,因此最佳蒸馏时间应保持在120 min左右。
超声波辅助提取利用超声波的空化效应增加溶剂穿透力[19],提高柠檬精油的溶出速度和溶出量,从而提高柠檬精油的提取率。而超声波也可以增加物质成分的扩散,若超声时间过长,反而会使柠檬精油中的一些组分被破坏或成分挥发,甚至加剧乳化,降低柠檬精油的得率。因此本实验选取超声20 min左右为宜(图1-c)。
随着氯化钠添加量的增加,柠檬精油的提取效果呈现先上升后下降趋势,其中当氯化钠添加量在6 g/L左右时,提取率达到最高值,此时的提取效果最佳(图1-d)。
2.2 响应面实验优化柠檬精油提取工艺
采用Design-Expert.V8.0.6软件对数据进行拟合分析[6](表2),得到了柠檬精油提取率与液料比(A)、超声时间(B)、蒸馏时间(C)、氯化钠添加量(D)的二次回归方程模型:
Y=2.58+0.034A+0.10B+0.037C-0.047D+0.38AB+0.21AC+0.18AD+0.067BC+0.065BD+0.20CD-0.26A2-0.19B2-0.33C2-0.43D2
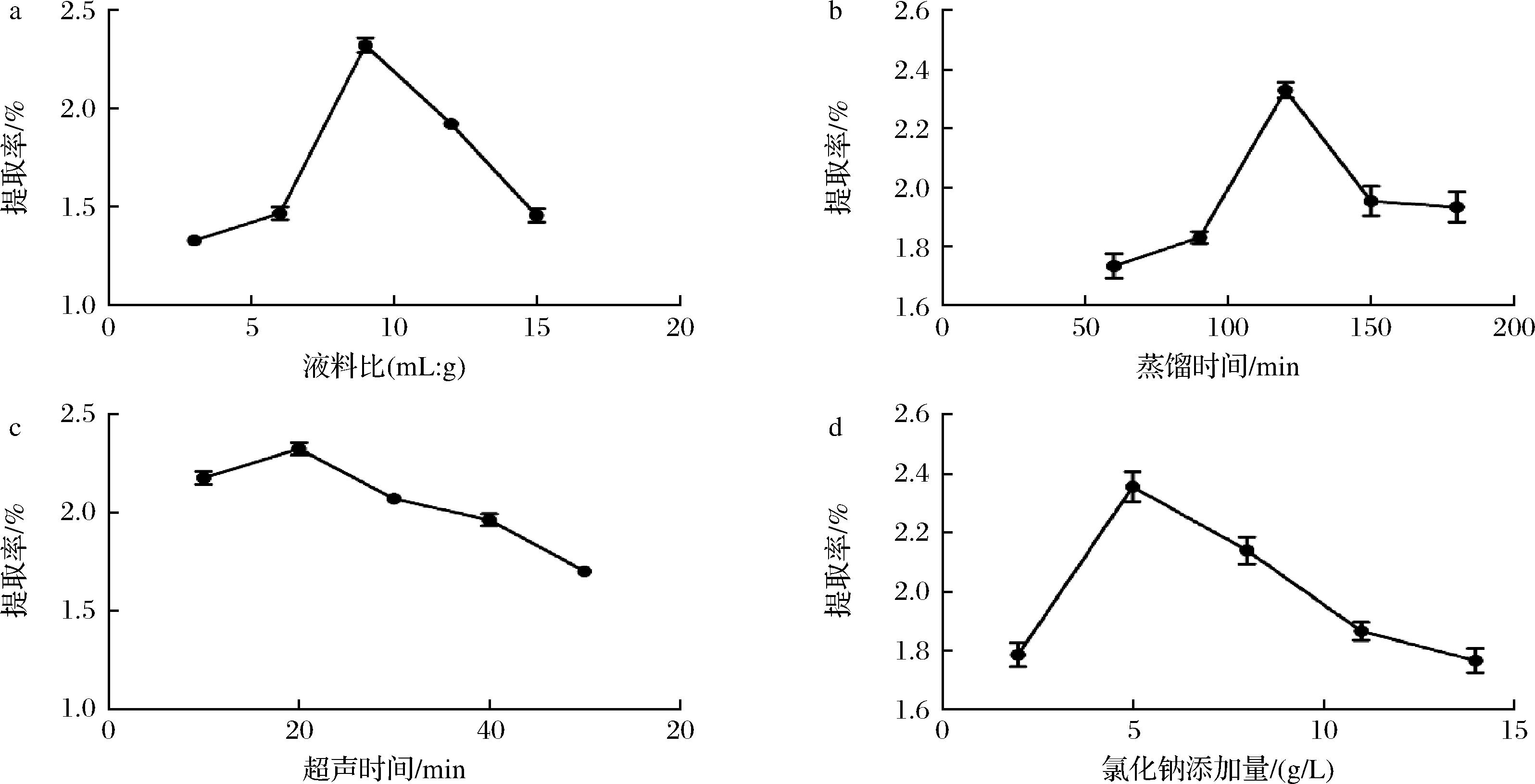
a-液料比;b-蒸馏时间;c-超声时间;d-氯化钠添加量
图1 液料比、蒸馏时间、超声时间及氯化钠添加量对柠檬精油提取率的影响
Fig.1 Effects of liquid-solid ratio, distillation time, ultrasonic time and sodium chloride addition amount on the extraction yield of lemon essential oil
表2 响应面实验设计
Table 2 Response surface experimental design
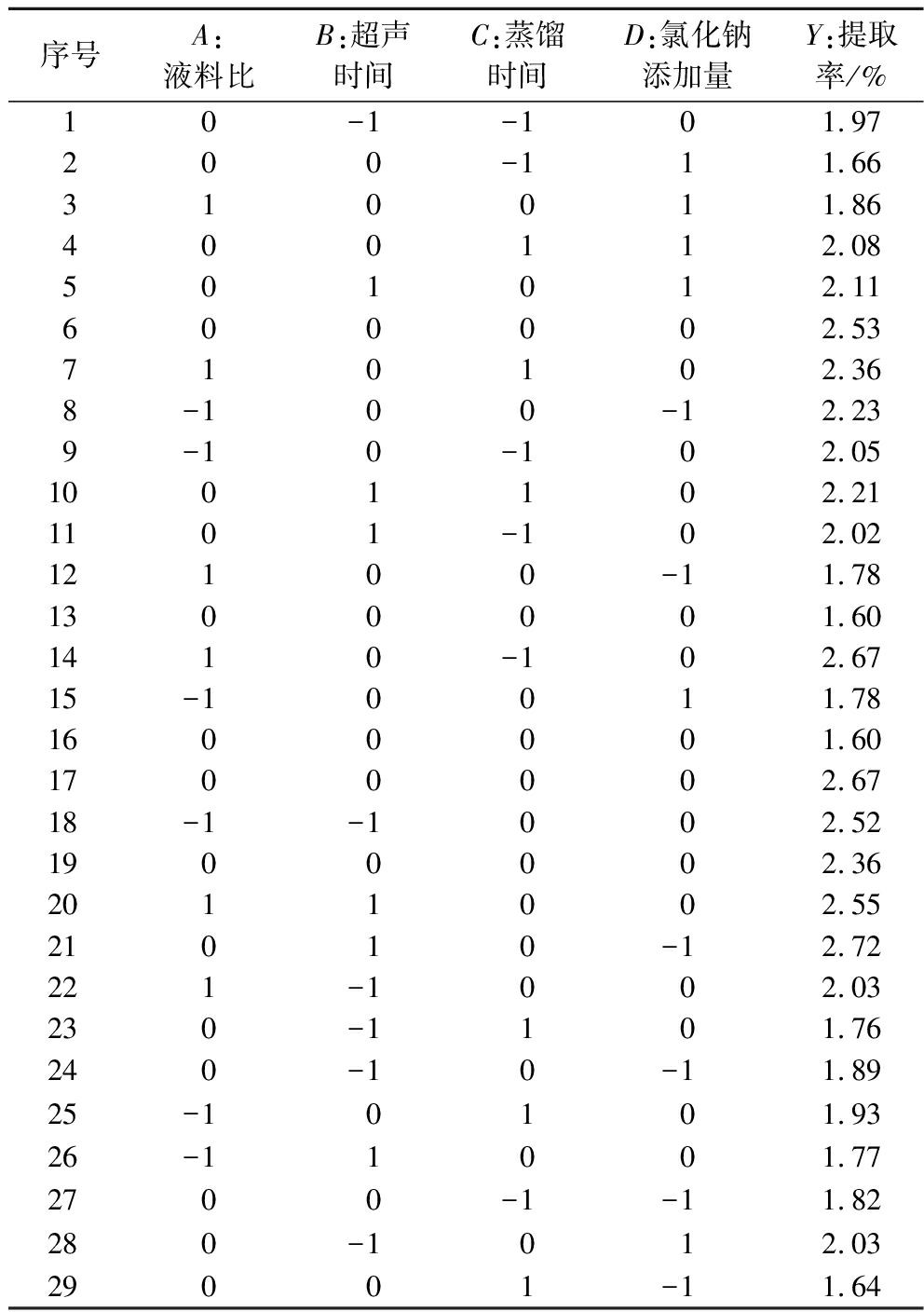
序号A:液料比B:超声时间C:蒸馏时间D:氯化钠添加量Y:提取率/%10-1-101.97200-111.66310011.86400112.08501012.11600002.53710102.368-100-12.239-10-102.051001102.211101-102.0212100-11.781300001.601410-102.6715-10011.781600001.601700002.6718-1-1002.521900002.362011002.5521010-12.72221-1002.03230-1101.76240-10-11.8925-10101.9326-11001.772700-1-11.82280-1012.0329001-11.64
该模型的F=21.75,P<0.000 1(表3),表明该模型具有极显著性,失拟项中P=0.185 6,说明仅有18.56%可能会因为各种因素影响导致模型不吻合,因而该模型拟合程度较好,实验误差小,可用此模型对柠檬精油提取率进行预测和分析。一次项中B(超声时间)的P<0.05,说明超声时间对柠檬精油提取率的影响显著。二次项中C2、D2的P值均小于0.000 1,A2<0.01,B2<0.05,结合F值可知,各因素对柠檬精油提取率的影响大小依次为B(超声时间)>D(氯化钠添加量)>C(蒸馏时间)>A(液料比)。各因子交互作用的响应面中,两两交互作用的响应面都呈弧形(图2),说明它们对响应值都具有显著作用[20],根据响应面不难看出各因素对响应值的影响程度从大到小依次为B(超声时)>D(氯化钠添加)>C(蒸馏时间)>A(液料比),与方差分析中结果基本一致,进一步验证了其结果。
表3 回归模型的方差分析及显著性结果
Table 3 Analysis of variance and significance results of regression model

模型来源SSdfMSFP-value显著性模型3.04140.22021.75<0.000 1∗∗A0.01410.0141.400.416 0B0.13010.13013.030.046 2∗C0.01610.0161.620.510 9D0.02610.0262.620.333 5AB0.56010.56056.310.000 1∗∗AC0.18010.18018.510.006 1∗∗AD0.13010.13013.340.008 1∗∗BC0.01810.0181.820.449 0BD0.01710.0171.690.409 7CD0.16010.16016.420.013 3∗A20.43010.43042.830.000 7∗∗B20.24010.24024.520.001 6∗∗C20.72010.72072.04<0.000 1∗∗D21.20011.200120.39<0.000 1∗∗残差0.140149.990×10-3失拟项0.120100.0122.590.185 6误差0.01944.670×10-3总和3.1828
注:**表示影响极其显著P<0.01,*表示影响显著P<0.05。
通过响应面结果分析确定了最佳工艺的参数为液料比12∶1、超声时间29.01 min、蒸馏时间133.21 min、氯化钠添加量5.20 g/L,在此条件下预测柠檬精油提取率可达2.72%。为方便实验操作,调整工艺参数:液料比12∶1、超声时间29 min、蒸馏时间133 min、氯化钠添加量5.20 g/L,重复3次,柠檬精油的提取率为(2.61±0.12)%,与回归模型预测值2.72%相近,说明该工艺条件可行。
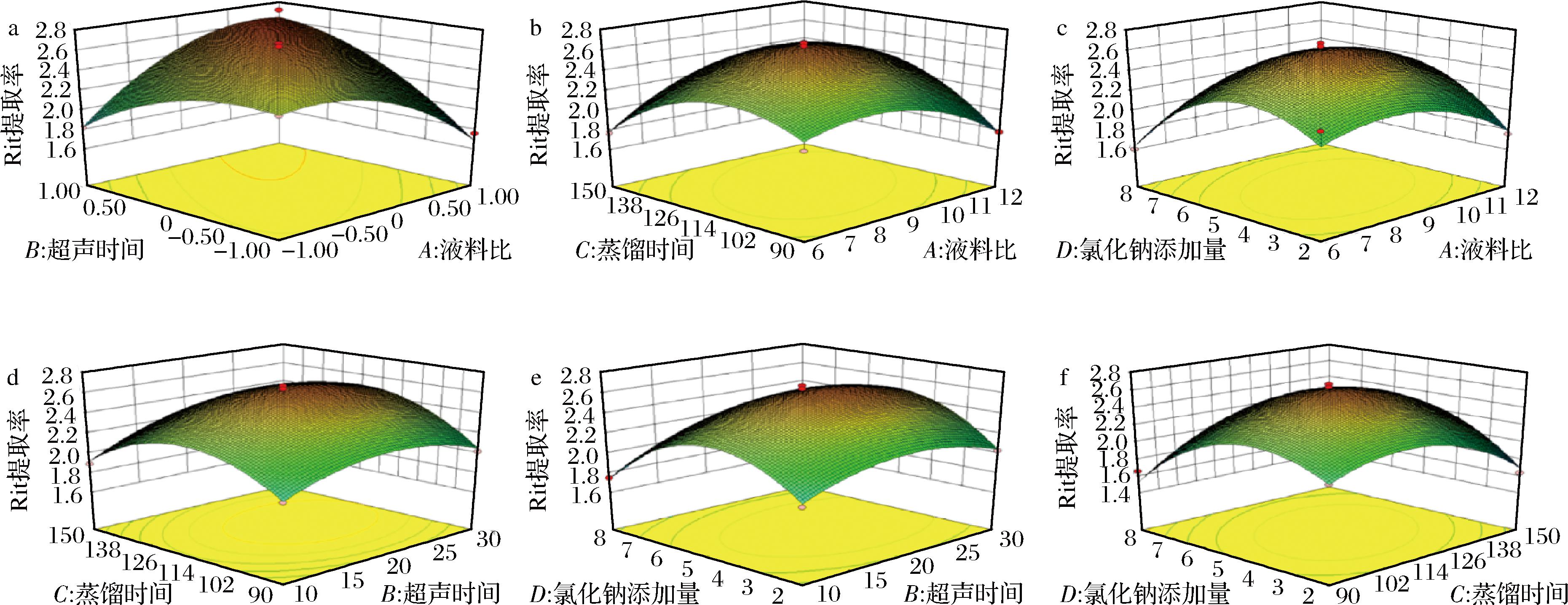
图2 两因子交互作用对提取率影响的响应面图
Fig.2 Response surface plot of the effect of two-factor interaction on extraction yield
2.3 柠檬精油组成成分分析
采用GC-MS对超声波辅助水蒸气蒸馏法提取的柠檬精油进行定性分析后,得到柠檬精油挥发性成分的总离子流图(图3)。柠檬精油成分保留时间集中在8.2~13.3 min,出峰数占总峰数的比例为48%。从尤力克柠檬果皮精油中共得到102种化合物(表4),其中相对含量较大的主要成分有1-甲基-5-(1-甲基乙烯基)环己烯(17.26%)、桧烯(10.62%)、β-蒎烯(9.91%)、左旋-α-蒎烯(6.93%)、γ-松油烯(6.11%)、(E)-3,7-二甲基-2,6-辛二烯醛(5.5%)、柠檬醛(4.39%)、柠檬醇(3.09%)。
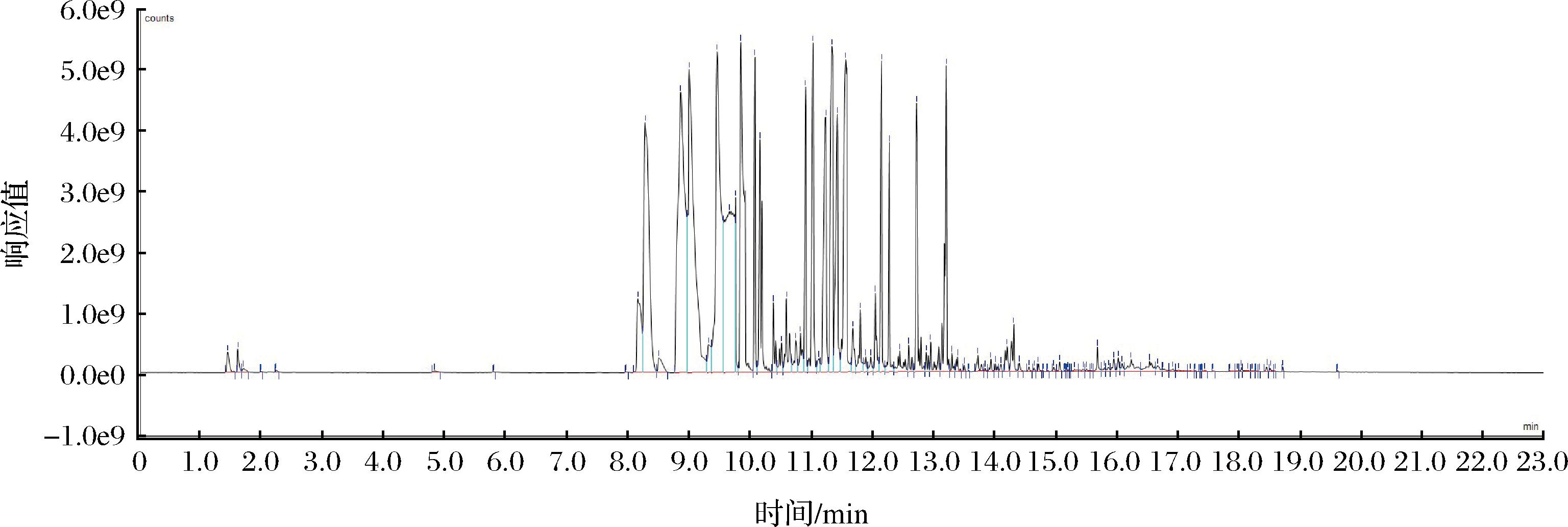
图3 柠檬精油挥发成分总离子流图
Fig.3 Total ion diagram of volatile constituents extracted from lemon essential oil
2.4 柠檬精油具有抗氧化活性
柠檬精油清除DPPH自由基的原理是DPPH有单电子,其醇溶液呈紫色,在517 nm处有最大吸收峰,当存在自由基清除剂时能够与其单电子结合而使溶液颜色变浅[21]。柠檬精油对DPPH自由基的清除率随质量浓度的增加而增大,当质量浓度达343 mg/mL时有最大的清除率92.68%(图4)。与维生素C相比,柠檬精油对DPPH自由基的清除效果稍差一些,但随着质量浓度的增加,柠檬精油清除DPPH自由基的效果逐渐接近维生素C。由此可确定柠檬精油具有一定的抗氧化活性。
表4 尤力克柠檬精油的化学组分
Table 4 Composition of essential oil from Eureka lemon

化合物种类化合物数量化合物相对含量/%烯类化合物3462.89醇类化合物3017.51醛类化合物811.94酯类化合物114.82烷类化合物91.68酸类化合物10.16酮类化合物10.06酚类化合物10.05其他化合物70.87
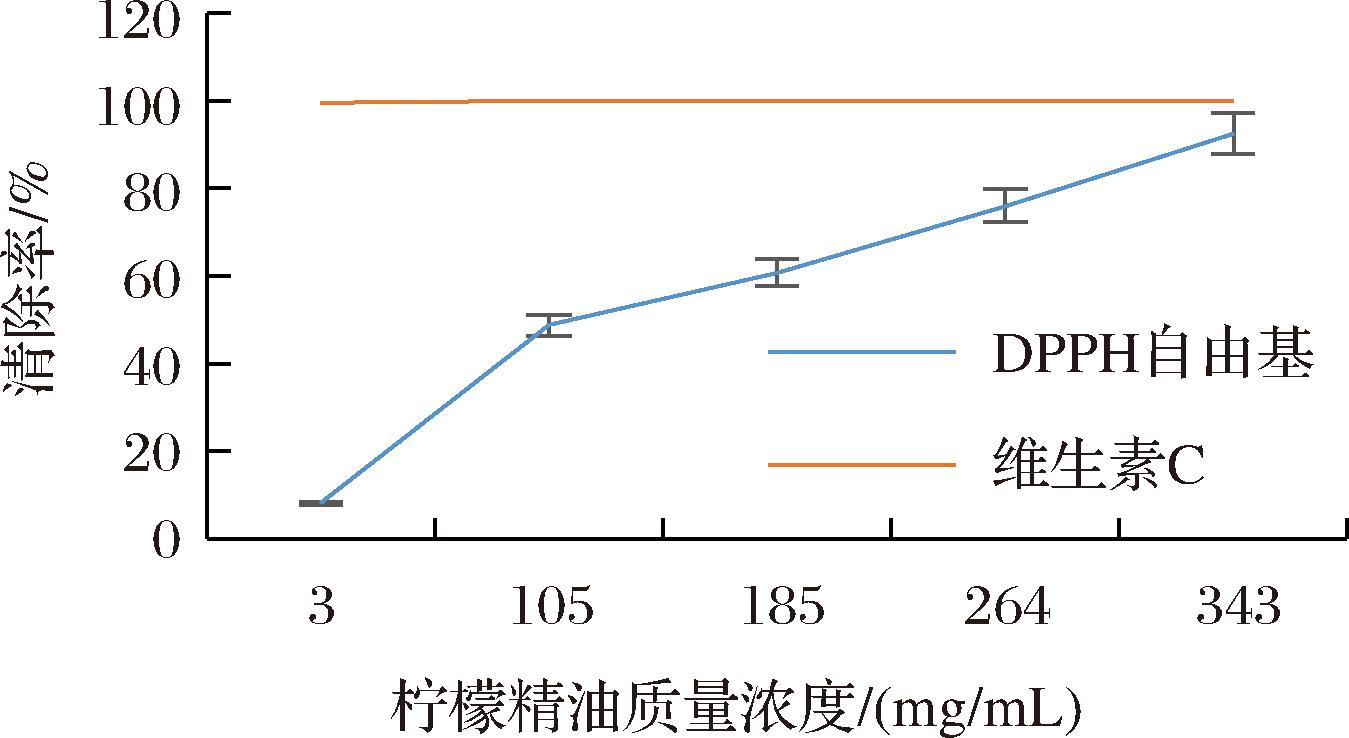
图4 柠檬精油有效清除DPPH自由基
Fig.4 DPPH radical scavenging effect of lemon essential oil
2.5 柠檬精油具有抑菌活性
柠檬精油对金黄色葡萄球菌、副溶血性弧菌、嗜水气单胞菌、维氏气单胞菌均具有一定的抑菌效果(表5),且维氏气单胞菌对柠檬精油最敏感,嗜水气单胞菌、金黄色葡萄球菌次之,副溶血性弧菌对柠檬精油敏感性最差。
表5 柠檬精油对4 种受试菌的抑菌活性
Table 5 Antibacterial activity of lemon essential oil against four tested bacteria

受试菌抑菌圈大小/mm柠檬精油无菌水庆大霉素金黄色葡萄球菌10.48±0.836.00±0.0028.83±0.07副溶血性弧菌7.89±0.676.00±0.0021.43±0.97嗜水气单胞菌11.25±1.106.00±0.0026.38±1.26维氏气单胞菌12.57±0.876.00±0.0028.90±1.37
2.6 柠檬精油具有抗肿瘤活性
2.6.1 柠檬精油抑制肿瘤细胞的增殖
为了评价柠檬精油的抗肿瘤活性,测定了柠檬精油对8种肿瘤细胞的细胞活力。柠檬精油在不同浓度(850、425、213、106、53、26、13、6.6、3.3 μg/mL)分别作用于(结直肠癌细胞SW620、HCT116、宫颈癌细胞Hela、胶质瘤细胞U87、U251、头颈癌细胞SCC15、胰腺癌细胞BXPC-3、前列腺癌细胞PC3)8种肿瘤细胞和1种人正常结直肠上皮细胞FHC,48 h后测定细胞存活率。结果发现,随着柠檬精油质量浓度的增加,细胞活力下降,抑制率显著升高(图5-a)。在人正常结直肠上皮细胞FHC中,IC50显著高于肿瘤细胞,表明柠檬精油不影响人正常细胞的活力(图5-b)。由此可见,柠檬精油增加细胞抑制率呈浓度依赖性,且具有抗多种肿瘤细胞的活性。

图5 柠檬精油抑制肿瘤细胞增殖
Fig.5 Inhibition of lemon essential oil on tumor cell proliferation
注:***表示P<0.001。
2.6.2 柠檬精油诱导结直肠癌细胞周期阻滞
为分析柠檬精油抑制结直肠癌细胞增殖的机理,利用western blotting(WB)分析细胞周期相关蛋白表达情况(图5-c),结果发现细胞周期蛋白Cyclin B1、细胞周期蛋白依赖性激酶CDK1随柠檬精油质量浓度的增加而被显著下调,表明柠檬精油可导致HCT116、SW620细胞周期发生阻滞,进而抑制细胞增殖。
2.6.3 柠檬精油促进结直肠癌细胞自噬
自噬在肿瘤细胞的生长过程中发挥重要作用,对自噬标志性蛋白进行WB检测发现(图5-d),柠檬精油促进结直肠癌细胞自噬,可见柠檬精油可以通过促进自噬抑制细胞增殖。
3 结论与讨论
本研究通过超声波辅助水蒸汽蒸馏法提取万州尤力克柠檬精油,并通过单因素及响应面确定最佳工艺条件为:液料比12∶1(mL∶g)、蒸馏时间29 min、超声时间133 min、氯化钠添加量5.2 g/L,提取率达到2.72%。因氯化钠溶于水不溶于油,可增大水的极性,且添加氯化钠后,盐水的密度增大,加速油层和水层的分离,进而提高了精油的提取率,该工艺方法比肖娟等[22]的水蒸气蒸馏法的提取率高出0.75%,因此该工艺方法可以视为一种有效的提取方法。GC-MS测定组成成分发现万州尤力克柠檬精油中烯类化合物居多,相对含量达62.89%,醇类、醛类、酯类化合物的相对含量次之,这与邓红梅等[7]和秦轶等[8]的研究结果相吻合。
万州尤力克柠檬精油有较好的DPPH自由基清除能力,与现有的研究结果一致[21,23],证明其具有较强的抗氧化能力。已有研究表明柠檬精油对金黄色葡萄球菌、大肠埃希菌、白色念珠菌、枯草芽孢杆菌、大肠杆菌等抑制显著,其抑菌作用主要是因为醇类、醛类、酚类和萜烯类等化合物的存在[3,24],本研究验证了柠檬精油对本实验室现有的金黄色葡萄球菌、副溶血性弧菌、嗜水气单胞菌、维氏气单胞菌4种受试菌的抑制作用,且发现对维氏气单胞菌抑制效果最明显,表明万州尤力克柠檬精油同样具有良好的抑菌活性。
本研究发现柠檬精油具有抗多种肿瘤细胞活性,可能是因为含有丰富的烯类化合物,已有研究表明,烯类化合物具有一定的抗肿瘤作用[25]。它们能够通过阻滞细胞周期,诱导细胞发生凋亡或自噬等方式来抑制并杀死肿瘤细胞[26]。本研究发现柠檬精油通过诱导结直肠癌细胞阻滞及促进自噬抑制细胞增殖。
综上所述,通过本研究所优化的提取工艺,万州尤力克柠檬可获得更高的精油产量,有利于柠檬深加工产品及废渣的开发与利用。此外,柠檬精油具有明显的体外抗肿瘤作用,但还需要用更多技术指标进行完整的体内、体外评价,此方面的研究工作正在深入进行中。
[1] 章斌, 秦轶, 邓其海, 等.柠檬果皮精油的应用研究进展[J].食品研究与开发,2013,34(21):119-122. ZHANG B, QIN Y, DENG Q H, et al.Progress in application research of lemon peel essential oil[J].Food Research and Development,2013,34(21):119-122.
[2] LIAO L K, YANG S T, LI R Y, et al.Anti-inflammatory effect of essential oil from Amomum Tsaoko Crevost et Lemarie[J].Journal of Functional Foods, 2022,93:105087.
[3] 王木岭, 马旋垒, 偰栖, 等.柠檬精油的GC-MS分析及其抗炎、抗菌活性研究[J].粮食与油脂,2021,34(7):56-61. WANG M L, MA X L, XIE Q, et al.GC-MS analysis of lemon essential oil and its anti-inflammatory and antibacterial activities[J].Gereals &Oils,2021,34(7):56-61.
[4] AIT BABAHMAD R, AGHRAZ A, BOUTAFDA A, et al.Chemical composition of essential oil of Jatropha curcas L.leaves and its antioxidant and antimicrobial activities[J].Industrial Crops and Products, 2018,121:405-410.
[5] RAKMAI J, CHEIRSILP B, MEJUTO J C, et al.Antioxidant and antimicrobial properties of encapsulated guava leaf oil in hydroxypropyl-beta-cyclodextrin[J].Industrial Crops and Products, 2018,111:219-225.
[6] MIYAKE Y, HIRAMITSU M.Isolation and extraction of antimicrobial substances against oral bacteria from lemon peel[J].Journal of Food Science and Technology, 2011,48(5):635-639.
[7] 邓红梅, 乐敏柔, 王春.不同方法提取的柠檬精油挥发性成分比较及其抑菌性研究[J].中国食品添加剂,2018(9):56-61. DENG H M, LE M R, WANG C.Comparison of different extraction methods on volatile components and antimicrobial activities of lemon essential oil[J].China Food Additives,2018(9):56-61.
[8] 秦轶, 侯小桢, 章斌, 等.柠檬精油的化学成分分析及其抗氧化活性研究[J].食品与机械,2014,30(3):169-173. QIN Y, HOU X Z, ZHANG B,et al.Study on chemical composition analysis and antioxidant activities of lemon peel essential oil[J].Food &Machinery,2014,30(3):169-173.
[9] LIU B N, KOU J Y, LI F Y,et al.Lemon essential oil ameliorates age-associated cognitive dysfunction via modulating hippocampal synaptic density and inhibiting acetylcholinesterase[J].Aging (Albany NY), 2020,12(9):8622-8639. [10] KAADE W, GÜELL C, BALLON A, et al.Dynamic membranes of tunable pore size for lemon oil encapsulation[J].LWT, 2020,123:109090.
[11] 蔡诗鸿, 曾晓房, 韩珍, 等.柠檬精油功效及其在芳香理疗中的运用[J].农产品加工,2018(14):56-59. CAI S H, ZENG X F, HAN Z, et al.Effect of lemon essential oil and its application in aromatic physiotherapy[J].Farm Products Processing,2018(14):56-59.
[12] RAUT J S, KARUPPAYIL S M.Bioprospecting of Plant Essential Oils for Medicinal Uses[M].Environment and Sustainable Development.New Delhi:Springer, 2014:59-76.
[13] DAO T P, TRAN T H, NGUYEN P T N, et al.Optimization of microwave assisted hydrodistillation of essential oil from lemon (Citrus aurantifolia) leaves:Response surface methodology studies[J].IOP Conference Series:Materials Science and Engineering, 2020, 736(2):022038.
[14] 王晓萌, 李祯, 刘和月, 等.柠檬精油提取技术研究进展[J].山东化工,2019, 48(20):82;84. WANG X M, LI Z, LIU H Y, et al.Research progress of lemon essential oil extraction technology[J].Shandong Chemical Industry, 2019,48(20):82;84.
[15] 谢雨, 廖鹏, 吴漫晔, 等.基于水蒸气蒸馏法的艾草精油提取工艺研究[J].科技经济市场,2020(4):13-14. XIE Y, LIAO P, WU M H, et al.Study on extraction technology of tsao essential oil based on steam distillation[J].Science &Technology Ecnony Market,2020(4):13-14.
[16] 张莉, 刘汉斌, 昝军民, 等.响应面法优化酶法制备马铃薯汁工艺[J].中国食品添加剂,2019,30(3):133-139. ZHANG L, LIU H B, ZAN J M, et al.Optimization of enzymatic preparation of potato juice by response surface methodology[J].China Food Additives,2019,30(3):133-139.
[17] 潘静, 杨人泽, 钟斌.苦竹叶多糖体外抗肿瘤活性研究[J].药品评价,2021,18(23):1432-1435. PAN J, YANG R Z, ZHONG B.Study on the antiproliferative effect of polysaccharide from Pleioblastus amarus leaves[J].Drug Evaluation,2021,18(23):1432-1435.
[18] 唐艳, 谢学琴, 黄玖红, 等.肌动蛋白样6A抑制Hippo/YAP信号通路促进肺腺癌细胞对顺铂的耐受[J].中国生物化学与分子生物学报,2021,37(10):1336-1344. TANG Y, XIE X Q, HUANG J H, et al.ACTL6A induces cisplatin resistance in the lung adenocarcinoma by inhibiting the hippo/yap signaling pathway[J].Chinese Journal of Biochemistry and Molecular Biology,2021,37(10):1336-1344.
[19] 冯飞, 葛永杰, 代容, 等.超声波辅助提取技术研究进展[J].食品工业,2022,43(4):239-243. FENG F, GE Y J, DAI R, et al.Research progress of ultrasonic assisted extraction technology[J].The Food Industry,2022,43(4):239-243.
[20] 范培.响应面优化超声辅助提取莲房中色素的工艺研究[J].安徽化工,2022,48(4):31-34;42. FAN P.Optimization of ultrasonic assisted extraction of pigment from lotus pod by response surface methodology[J].Anhui Chemical Industry,2022,48(4):31-34;42.
[21] 肖娟.柠檬果皮精油的提取及其抗氧化和清除亚硝酸盐的作用研究[J].雅安:四川农业大学,2019. XIAO J.Study of extraction essential oil from lemon peel and its antioxidant and scavenging effect of nitrite[D].Yaan:Sichuan Agricultural University, 2019.
[22] 肖娟, 周康, 胡滨, 等.超声波辅助水蒸气提取柠檬精油工艺优化及成分分析[J].食品与机械,2018,34(9):172-178;190. XIAO J, ZHOU K, HU B, et al.Ultrasonic-assisted extraction essential oil of lemon and chemical composition analysis[J].Food &Machinery, 2018,34(9):172-178;190.
[23] 沈达英.柠檬精油提取工艺优化及抗氧化性测定[J].化工设计通讯,2018,44(9):99-100. SHEN D Y.Extraction process optimization and antioxidation of essential oil of lemon[J].Chemical Engineering Design Communications,2018,44(9):99-100.
[24] 许泽文, 李环通, 王绮潼, 等.柠檬草精油成分分析、抑菌性及对巨峰葡萄保鲜研究[J].食品研究与开发,2020,41(1):51-59. XU Z W, LI H T, WANG Q T, et al.Analysis of volatile components,antibacterial activity and perseveration on kyoho grapes of lemongrass essential oil[J].Food Research and Development,2020,41(1):51-59.
[25] 任澎, 范宁, 田淼, 等.植物精油药物作用研究进展[J].中华中医药杂志,2018,33(6):2507-2511. REN P, FAN N, TIAN M, et al.Research progress on medical effects of essential oils[J].China Journal of Traditional Chinese Medicine and Pharmacy,2018,33(6):2507-2511.
[26] 刘玮璐, 徐若霆, 赵明. 天然药物抗肿瘤作用机制的研究进展[J]. 医学综述, 2015, 21(10):1778-1780. LIU W L, XU R T, ZHAO M. Research progress in anti-tumor mechanism of natural medicine[J]. Medical Recapitulate, 2015, 21(10):1778-1780.