随着全球人口的增长,粮食安全已经成为不容忽视的挑战。肉蛋白的摄入继续增加,会加剧环境污染和健康相关问题。并且在肉制品的加工和贮藏过程中,肌原纤维蛋白(myofibrillar protein,MP)容易受到外界环境影响,如冷冻、加热等,在这些外部条件的影响下,MP的溶解度、乳化特性减弱,肉制品的品质也会受到影响[1]。根据肉类蛋白的溶解性进行分类,可大致分为肌浆蛋白、MP和肌质蛋白三大类[2]。MP主要存在于动物肌肉中,由肌球蛋白、肌动蛋白、原肌球蛋白等蛋白构成。
有研究认为,在肉制品生产过程中,MP有一部分将被用于脂肪的乳化以减少脂肪和水分的流失,这就造成了MP的不足,以及后续加工形成MP网络结构的不稳定性。MP的乳化性会影响肉制品的质构、保水性等,对加工过程中水分和油脂的保持起重要作用。研究表明,在肉制品加工中,添加非肉蛋白一方面在降低成本的同时能保证产品质量,提高经济效益,另一方面添加非肉蛋白可以改变肉制品中MP的乳化性,肉制品的品质也会受到影响[3]。因此,本研究以猪肉MP为研究对象,分别添加不同种类的非肉蛋白,研究非肉蛋白对MP乳化性、流变特性以及热力学特性的影响,旨在为非肉蛋白改善肉制品品质提供理论指导。
1 材料与方法
1.1 材料与试剂
纯种丹麦系长白猪里脊肉(宰后48 h,猪龄6个月)与猪肥膘,南京孝陵卫菜市场;血球蛋白(spray-dried blood cells,SBC)、大豆分离蛋白(soybean protein isolate,SPI)、蛋清蛋白(egg white protein,EWP)、猪血浆蛋白(porcine plasma protein,PPP),秦皇岛金海食品有限公司;其余各试剂均为分析纯,南京建成生物工程研究所有限公司;猪肉剔除表面结缔组织和筋膜后待用。
1.2 仪器与设备
Direct-Q3uv超纯水机,美国Millipore公司;FL-4600荧光分光光度计,日本日立高新技术公司;UV-6100紫外分光光度计,上海美普达仪器有限公司;T-25数显匀浆机,德国IKA公司;ZEN3600纳米激光粒度仪,英国马尔文仪器公司;Q20差示扫描量热仪,美国TA仪器公司;UncenMR台式冷冻离心机,英国Hero Lab公司;MCR02流变仪,德国安东帕公司。
1.3 实验方法
1.3.1 肌原纤维蛋白的提取
参考ZHOU等[4]的方法,称取10 g生肉,剁成肉泥,添加4倍体积预冷的提取缓冲溶液A(0.1 mol/L NaCl,2 mmol/L MgCl2,1 mmol/L EGTA,6.1 mmol/L Na2HPO4·12H2O,3.9 mmol/L NaH2PO4·2H2O,pH 7.0),在冰浴条件下10 000 r/min匀浆60 s,匀浆过后离心(4 ℃、2 000×g、15 min),收集沉淀,重复2次。将沉淀用8倍体积、pH值为6.25的缓冲溶液B(0.1 mol/L NaCl,1 mmol/L NaN3)冰浴匀浆后离心(条件同上),取沉淀重复该操作2次,最后一次离心前需对均质液进行过滤除去杂质。上述获得的沉淀溶于缓冲溶液C(0.6 mol/L NaCl,15 mmol/L PIPES,pH值6.25),双缩脲法测定其蛋白浓度[5],以牛血清白蛋白作为标准蛋白。
1.3.2 MP-非肉蛋白混合体系的制备
用缓冲液C将MP溶液质量浓度调整为40 mg/mL,分别加入质量分数为4%的非肉蛋白,对照组不添加非肉蛋白。使用高速匀浆机在冰浴条件下均质3次(10 000 r/min),每次20 s,后置冷冻离心机中低速离心5 min(500 r/min),去除蛋白溶液中的气泡,贮存在0~4 ℃环境中。
1.3.3 复合蛋白组分分析
参考YOUSSEF等[6]的方法,使用12%(体积分数)分离凝胶和5%(体积分数)浓缩凝胶,上样量为20 μL。使用Coomassie Brilliant Blue G-250对凝胶进行染色,通过脱色液(质量分数为10%的醋酸,质量分数为40%的乙醇)对凝胶进行脱色直到背景清晰。图像采用Quantity One软件进行扫描和分析。
1.3.4 复合蛋白荧光光谱的测定
调节蛋白质量浓度为0.5 mg/mL,内源性荧光光谱参数设定:激发波长设定为280 nm,光谱扫描范围设定为300~500 nm,狭缝宽度设定为5.0 nm,扫描5次,扫描速率设定为1 200 nm/min,将缓冲液C设为空白对照组。
1.3.5 复合蛋白粒径的测定
参照HU等[7]的方法并作适当修改。向不同非肉蛋白处理的蛋白复合液中添加缓冲液C,使最终蛋白液质量浓度为0.5 mg/mL,分散介质的折射率设定为1.361,蛋白质的折射率为1.472。连续检验3次后进行数据采集,采集3次。
1.3.6 复合蛋白静态流变的测定
参考GUO等[8]的实验方法并进行修改,使用锥形传感器(间隙0.105 mm,C50~1,直径为35 mm,角度2°)和测量板盖(MPC35,222-1549)进行剪切应力/剪切速率旋转斜坡测试。在25 ℃条件下,待测样品放于流变仪放置板平衡10 min。剪切速率设定为1 s~500 s~1 s,测量不同处理下MP溶液的流变性能,测定3次。曲线上行部分为剪切速率从0.1 s~1 s增大到500 s~1 s,曲线下行部分为500 s~1 s降低到0.1 s~1 s。将上行曲线和下行曲线结合进行判断蛋白溶液触变性的依据。
1.3.7 复合蛋白变性温度的测定
取复合蛋白的冻干样品0.5 g至干净的坩埚内并密封。差示扫描量热仪主要参数设定,温度设定:20~80 ℃,升温速率:10 ℃/min,测得最大变性温度,以空坩埚为空白对照。
1.3.8 复合蛋白表面疏水性的测定
参照楼宵玮等[9]的实验方法,样品制备,不同处理下的复合蛋白溶液,取1 mL质量浓度为5 mg/mL的MP溶液与溴酚蓝溶液(取0.2 mL,1 mg/mL)混匀,在25 ℃下振荡反应10 min,随后离心(4 ℃,5 000 r/min,10 min),取上清液,稀释10倍,放于595 nm波长处,测定其吸光值,用溴酚蓝结合量反应蛋白质表面疏水性能,以缓冲液C作为空白对照。表面疏水性按公式(1)计算得到:
溴酚蓝结合量![]()
(1)
式中:A0,空白对照吸光度;A1,样品吸光度。
1.3.9 复合蛋白总巯基的测定
参考GAO等[10]的实验方法,用缓冲液C配制5 mg/mL的混合蛋白溶液。首先向0.5 mL蛋白质溶液中添加5.0 mL 0.2 mol/L Tris-HCl缓冲液(含有8 mol/L尿素、10 mmol/L EDTA和2% SDS,pH值8.0),然后将混合物与100 μL Ellman试剂混合,在40 ℃下静置25 min。于412 nm处测定其吸光度值,总巯基的含量利用分子吸光系数13 600 L/(mol·cm)计算,如公式(2)所示:
巯基含量![]()
(2)
式中:A412表示样品溶液在412 nm处的吸光值;D为稀释倍数;C为蛋白样品的质量浓度(mg/mL)。
1.3.10 乳化活性及乳化稳定性的测定
MP的乳化活性(emulsifying activity index,EAI)和乳化稳定性(emulsifying stability index,ESI)的测定参考SHEN等[11]所描述的方法并稍加修改。将10 mg/mL的MP溶液与大豆油4∶1(g∶mL)在一个直径40 mm的长玻璃筒内混合,利用碎冰对玻璃筒进行降温,用Ultraturrax T25高速分散器均质2次(10 000 r/min),每次均质30 s,间隔30 s,得到MP乳液。然后,迅速在玻璃筒底部取0.05 mL的新鲜乳液加入到5 mL的SDS溶液(20 mmol/L Na2HPO4/NaH2PO4,0.6 mol/L NaCl,pH值7.0)中,旋涡震荡30 s。读取500 nm处的吸光值A。乳化活性的计算如公式(3)所示:
(3)
式中:A为500 nm处测定的吸光值;N为样品稀释倍数;c为测定复合蛋白液浓度,g/mL;Φ为乳液中大豆油的体积分数,%。
样品处理10 min后,测定玻璃筒底部的乳液在500 nm处的吸光值A10。乳化稳定性的计算如公式(4)所示:
(4)
式中:t为时间间隔,10 min;A10为10 min后500 nm处的吸光度值。
1.4 数据处理
采用SPSS 24.0软件(IBM公司)进行方差分析,应用Origin 8.5软件(Origin Lab公司)绘制图表,数据以平均值±标准差表示,采用Tukey检验用于多重比较,P<0.05表示差异显著。
2 结果与分析
2.1 复合蛋白组分分析
SDS-PAGE是近些年来用于分离蛋白质及其组分的主要方法,根据不同分子质量的情况,可推测出在凝胶形成过程中各组分所起到的作用。MP分子质量分别为:肌球蛋白重链(myosin heavy chain,MHC)约为200~220 kDa,原肌球蛋白约为38 kDa[12]。肌球蛋白是肉制品维持良好加工特性(乳化性、凝胶性、保水性和质构特性等)的重要保障[13]。肌球蛋白的亚基结合成亲水螺旋杆(尾部)和疏水球形头部。从图1可以看出,SBC和PPP组样品中肌球蛋白重链的条带强度增强明显,可能是非肉蛋白与肉蛋白交联导致MHC含量提高[14]。SPI和EWP添加组肌球蛋白重链含量变化不明显,说明非肉蛋白仅有少部分交联。添加非肉蛋白后原肌球蛋白含量也均有增多,说明非肉蛋白可以引起活性氨基酸残基及蛋白质构象发生变化,促进后续加工过程中MP的凝胶化作用[15]。
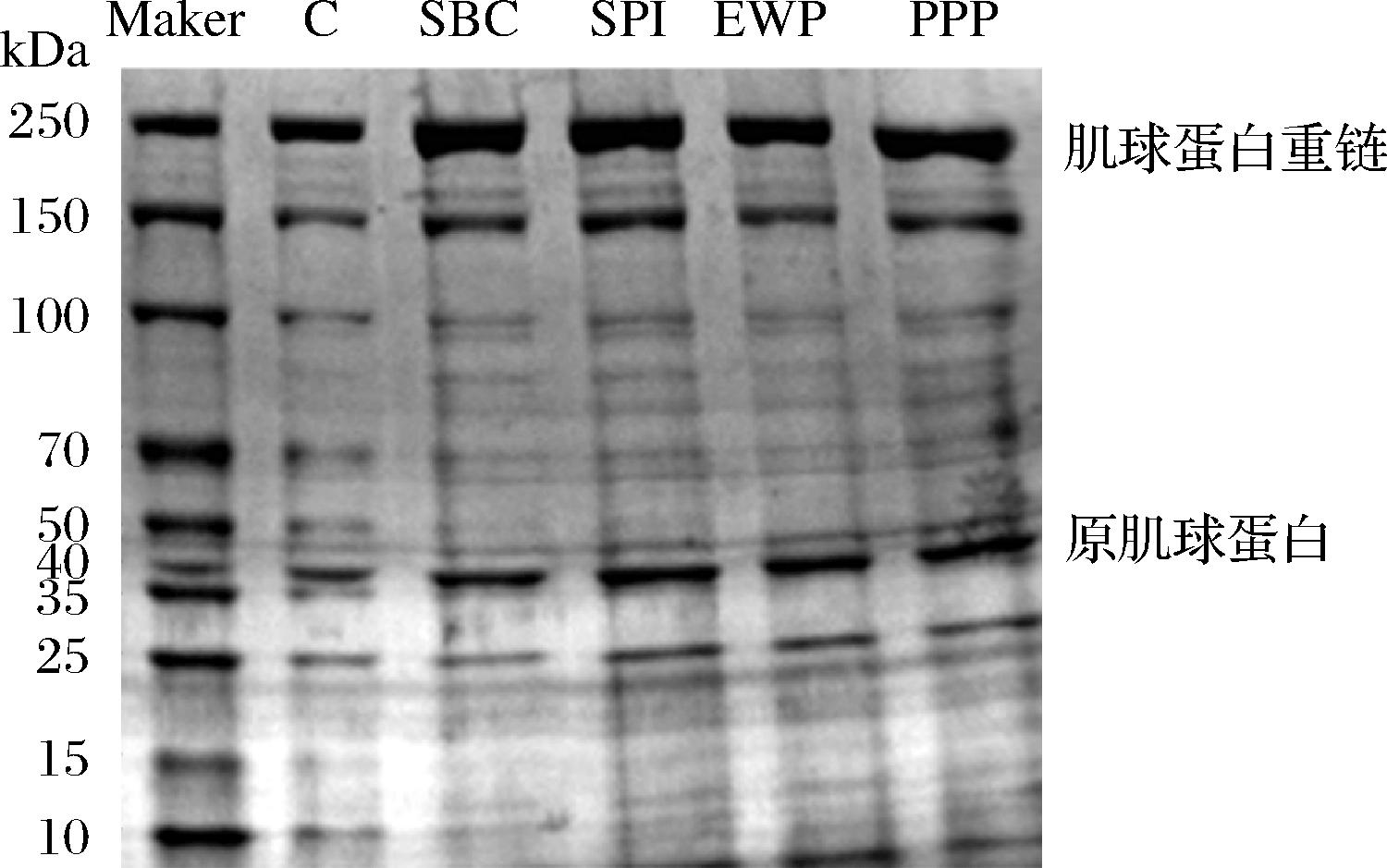
图1 不同非肉蛋白处理对MP组分的影响
Fig.1 Effect of different non-meat protein treatments on MP fractions
2.2 荧光光谱分析
荧光光谱可以测定蛋白质中能够产生荧光的氨基酸残基含量,从而判断蛋白质构象的变化趋势。由图2可知,在330~340 nm处的荧光强度最高,EWP和PPP添加组荧光强度显著提高,原因是分子间作用力遭到破坏,暴露出色氨酸残基,从而使荧光强度上升。SBC添加组随荧光强度显著降低,可能是SBC促进了MP结构展开[16]。SPI添加几乎没有改变MP荧光强度,所有非肉蛋白处理最大发射波长均略微红移,这可能是由于蛋白质分子间作用力发生了荧光猝灭作用[17]。通过测量色氨酸的荧光猝灭作用也可对疏水基团暴露进行经验评估[18],构象转变导致色氨酸残基暴露从而影响色氨酸的荧光发射[19]。结果表明添加不同非肉蛋白可以改变MP分子的高级构象[20]。
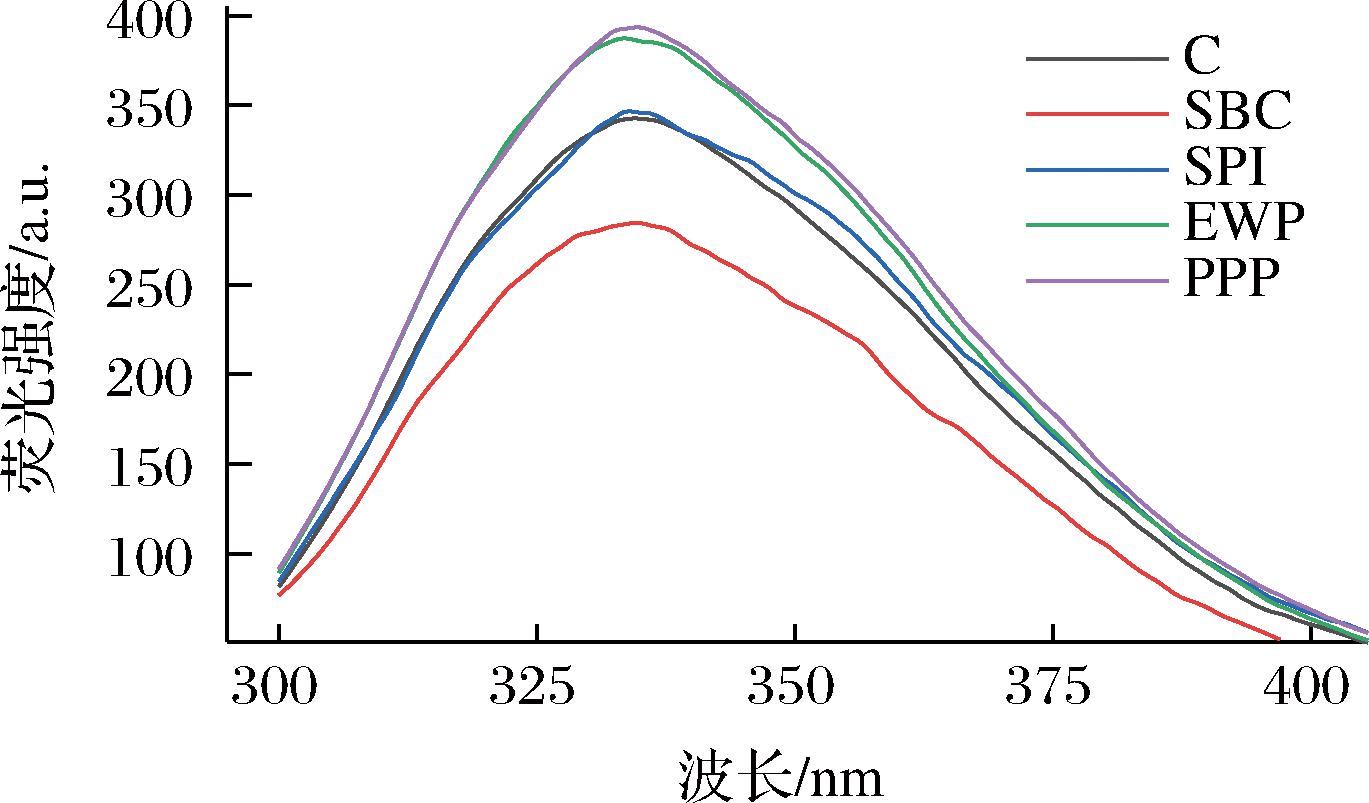
图2 不同非肉蛋白处理对MP荧光光谱的影响
Fig.2 Effect of different non-meat protein treatments on MP fluorescence spectra
2.3 非肉蛋白添加对蛋白粒径的影响
蛋白微观聚集状态和其相互之间的静电效应决定了蛋白质颗粒大小的变化。如图3所示,非肉蛋白处理组粒径均显著大于对照组,这可能是由于离子键作用增强,使静电斥力降低,蛋白分子间相互靠近,从而形成更大粒径。与对照组相比,SBC、SPI、EWP、PPP组平均粒径分别增大74.10%、72.02%、59.58%、111.19%,由于蛋白结构的展开,促进了蛋白之间的聚集,导致其分子粒径增大[16]。其中PPP粒径增加最显著,这能在一定程度上解释PPP与MP相互作用形成聚集体。非肉蛋白引起粒径增大也可能是由于静电相互作用,或者分子内/间的交联等所导致的蛋白质分子聚集[21]。
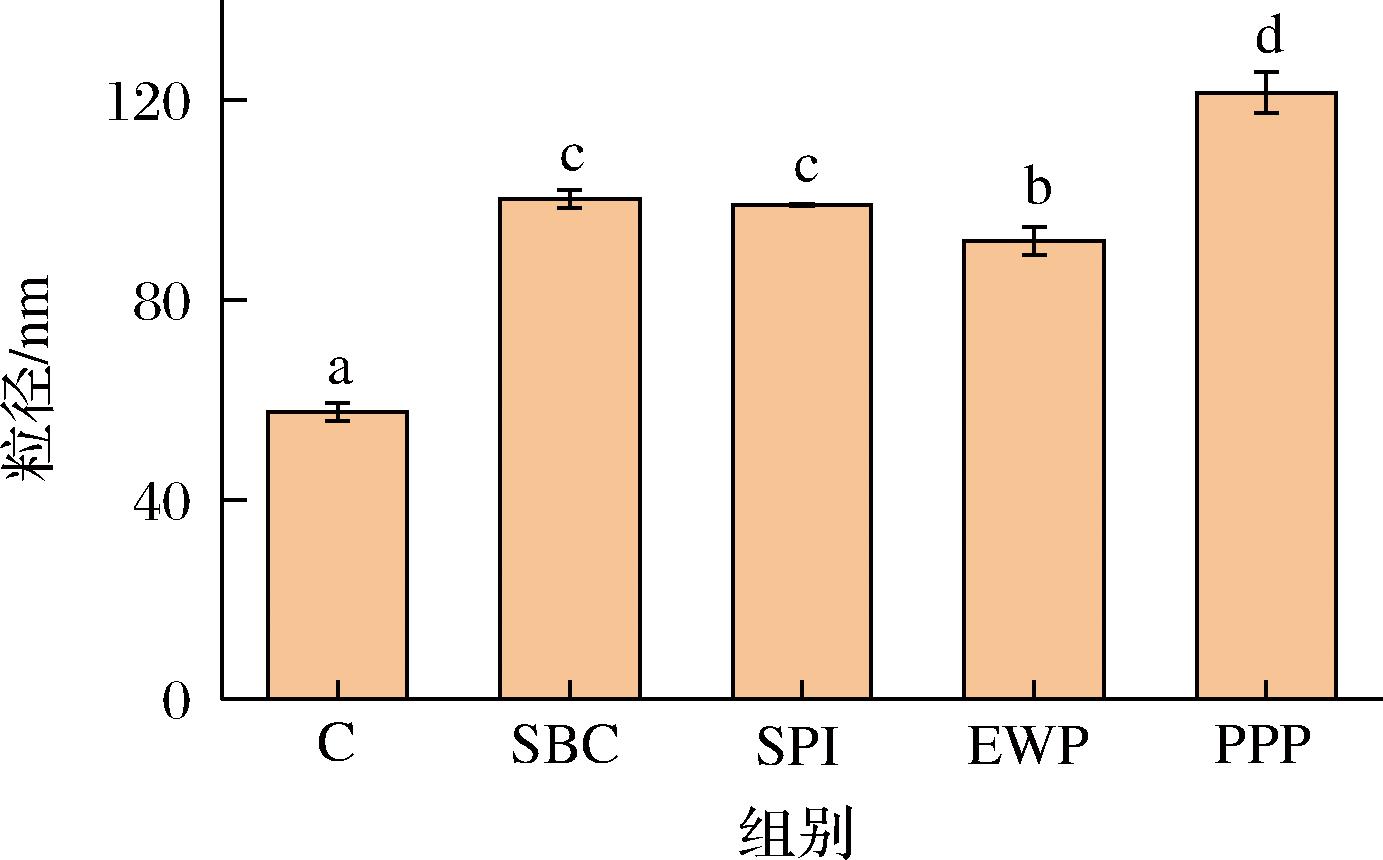
图3 不同非肉蛋白添加对肌原纤维蛋白平均粒径的影响
Fig.3 Effect of different non-meat protein additions on mean size of myofibrillar proteins
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.4 非肉蛋白添加对静态流变的影响
在食品工业中,静态流变一般用于大分子溶液在外力作用下运动状态的表征。不同种类非肉蛋白对MP溶液表观黏度的影响曲线如图4所示,实验中,增加剪切应力,表观黏度都呈现下降趋势。这是因为蛋白分子间的次级键被破坏,即使在剪切速率非常低的条件下,表观黏度也会急剧降低[22]。当剪切应力达到一定值后,表观黏度会呈现稳定状态,并不会因为剪切速度的增加而改变。相比于对照组,添加非肉蛋白后MP的表观黏度均显著提高,表明非肉蛋白使MP的抗剪切能力和剪切稀化程度得到增强,其中添加了SBC和PPP组相比于其他最为显著,由于SBC与MP交联最为充分,液体流动方向运动的阻碍液随之增加。PPP的溶解度较高,在处理过程中能够和更多的蛋白分子结合,蛋白分子间交联缠结现象明显,更易形成聚集体,使混合体系的黏度高于其他组,添加SPI的表观黏度也有所提高。在中性条件下EWP带有负电荷,存在大量排斥力,不利于蛋白质相互作用发展,因此混合蛋白体系黏度较其他3种非肉蛋白低。
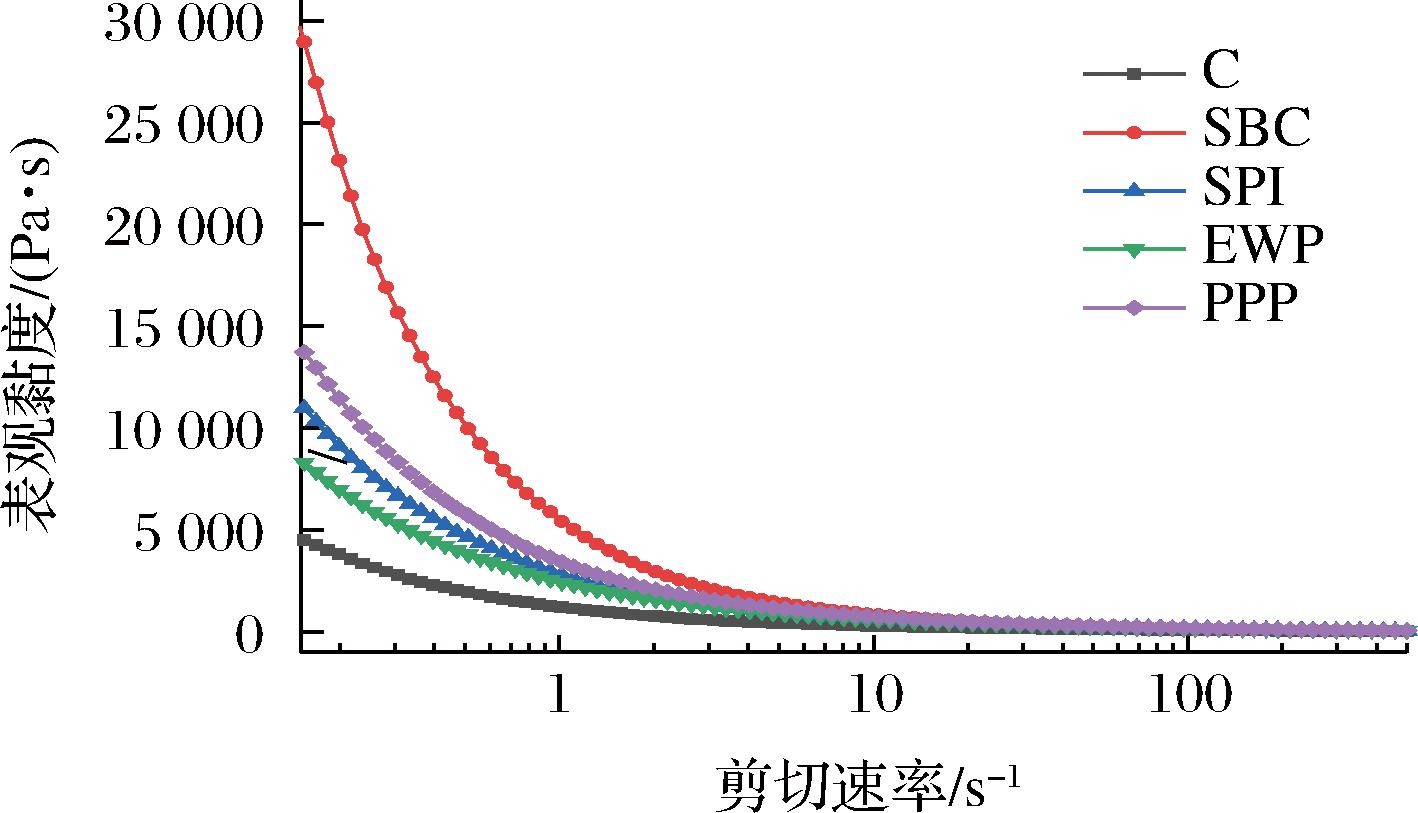
图4 非肉蛋白添加对MP溶液黏度的影响
Fig.4 Effect of non-meat protein addition on the viscosity of MP solutions
如图5所示,在不同处理条件下,在剪切应力与剪切速率之间的流动曲线形成了滞后环。在剪切应力逐渐增强条件下,蛋白溶液体系内部结构被破坏,减小剪切应力,蛋白溶液体系结构要恢复至初始水平,由于蛋白溶液恢复速率远低于被破坏速率,就会产生滞后环。滞后环面积大小通常与示样品的触变性正相关,结构被破坏后恢复速率越慢[23-24]。EWP和PPP添加组触变环面积增加最显著,原因是蛋白混合体系交联作用相对复杂,分子间氢键作用由于受到剪切力作用,被破坏程度相对较大,导致其结构不易恢复,滞后环面积增大。SPI本身结构相对稳定,所以SPI相对于其他3种非肉蛋白添加组触变环面积小。
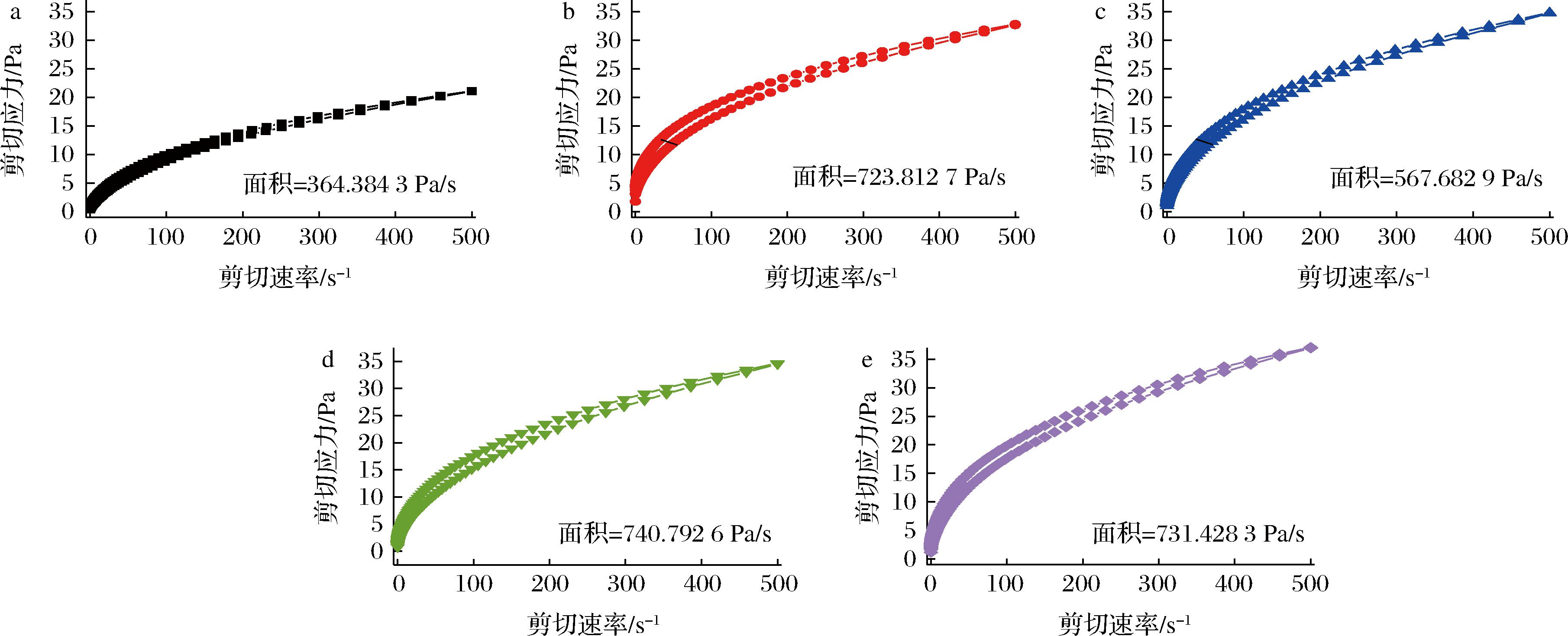
a-C;b-SBC;c-SPI;d-EWP;e-PPP
图5 混合蛋白体系的触变性
Fig.5 Thixotropy of mixed protein systems
2.5 非肉蛋白添加对蛋白热稳定性的影响
差示扫描量热法(differential scanning calorimetry,DSC)表明蛋白质结构破坏过程中热焓值变化趋势。非肉蛋白对MP热稳定性的影响见图6和表1。不同非肉蛋白处理的都只有一个特征峰,并且发现除SPI添加组,其他非肉蛋白处理均可以降低热变性温度。与不添加非肉蛋白组相比,添加SPI峰值温度下降了0.28 ℃,因为SPI分子对温度更加敏感。各蛋白复合MP的变性温度与对照组相比,EWP和SBC复合的MP变性温度分别位移至59.89、59.82 ℃。PPP提高MP热稳定性的效果最明显,综合本文其他指标分析得出PPP与MP交联最好,可在一定程度上缓解高温对蛋白结构的破坏。蛋白质热稳定性的提高,可能是由于非肉蛋白的参与,增强了蛋白质之间的相互作用。
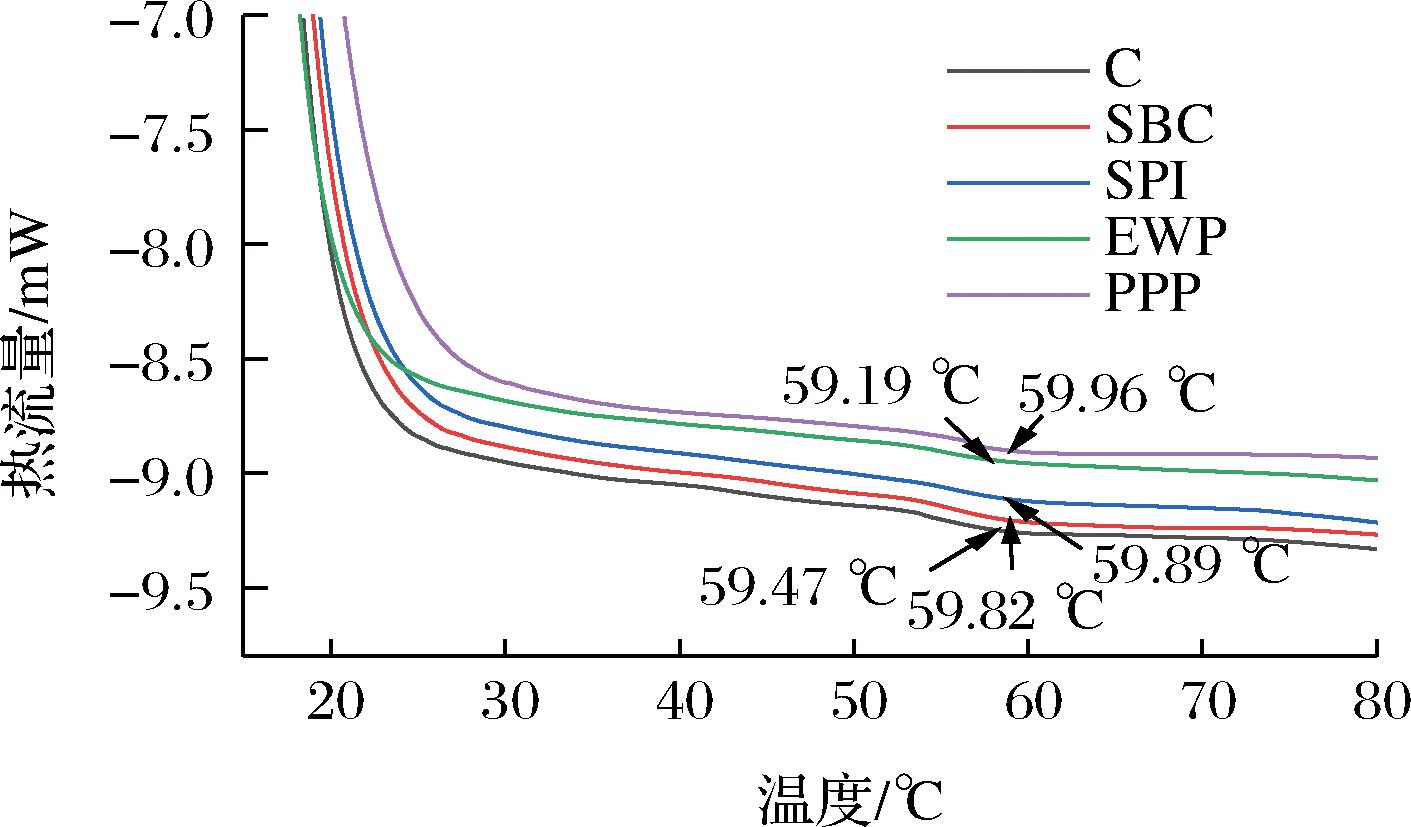
图6 不同非肉蛋白处理对MP热稳定性的影响
Fig.6 Effect of different non-meat protein treatments on thermal stability of MP
表1 非肉蛋白对MP的起始热变性温度及焓值(ΔH)的影响
Table 1 Effects of non-meat protein on the initial thermal denaturation temperature and enthalpy value (ΔH) of MP

组别变性温度/℃Tmax1/℃Tmax2/℃ΔH/(J/g)C53.37±0.28bc70.80±0.14c0.186 2±0.02SBC53.63±0.19b71.24±0.12ab0.190 4±0.01SPI53.09±0.10c71.58±0.21a0.208 2±0.01EWP53.24±0.24bc71.07±0.19bc0.172 1±0.03PPP55.84±0.13a71.02±0.25bc0.181 8±0.01
注:同一指标同列字母不同表示差异显著(P<0.05)。
2.6 非肉蛋白添加对肌原纤维蛋白疏水性的影响
蛋白疏水性是评定蛋白质暴露程度的一项重要指标,蛋白质都含有非极性氨基酸侧链和极性氨基酸侧链,它们分别分布在蛋白质分子的内部的疏水环境和外部的亲水环境中,因此蛋白质具有很强的两亲性。有研究表明,表面疏水性越强的蛋白质,其水溶液的溶解度越低[25-26]。疏水作用通过共价键的方式存在于配位体之间,是维持蛋白构象稳定性和功能性的重要因素。如图7所示,与对照组相比,除EWP外其他复合凝胶疏水性均有所提高,其中SPI组和PPP组显著提高。由于蛋白分子间的相互交联作用,使其内部苯丙氨酸残基、色氨酸等疏水性氨基酸残基暴露,疏水性位点增多。另外SPI中的大豆球蛋白碱性多肽间具有疏水相互作用。SBC添加对混合蛋白溶液疏水性影响不显著,EWP添加使混合蛋白溶液疏水性显著降低可能是由于蛋白相互作用导致MP构象变化,具有亲水性的肌球蛋白头部暴露出来[19]。综上,蛋白质颗粒之间疏水相互作用是肌原纤维蛋白颗粒纤维状结构形的主要驱动力。此外本研究还发现,乳化能力与疏水性显著性相关。
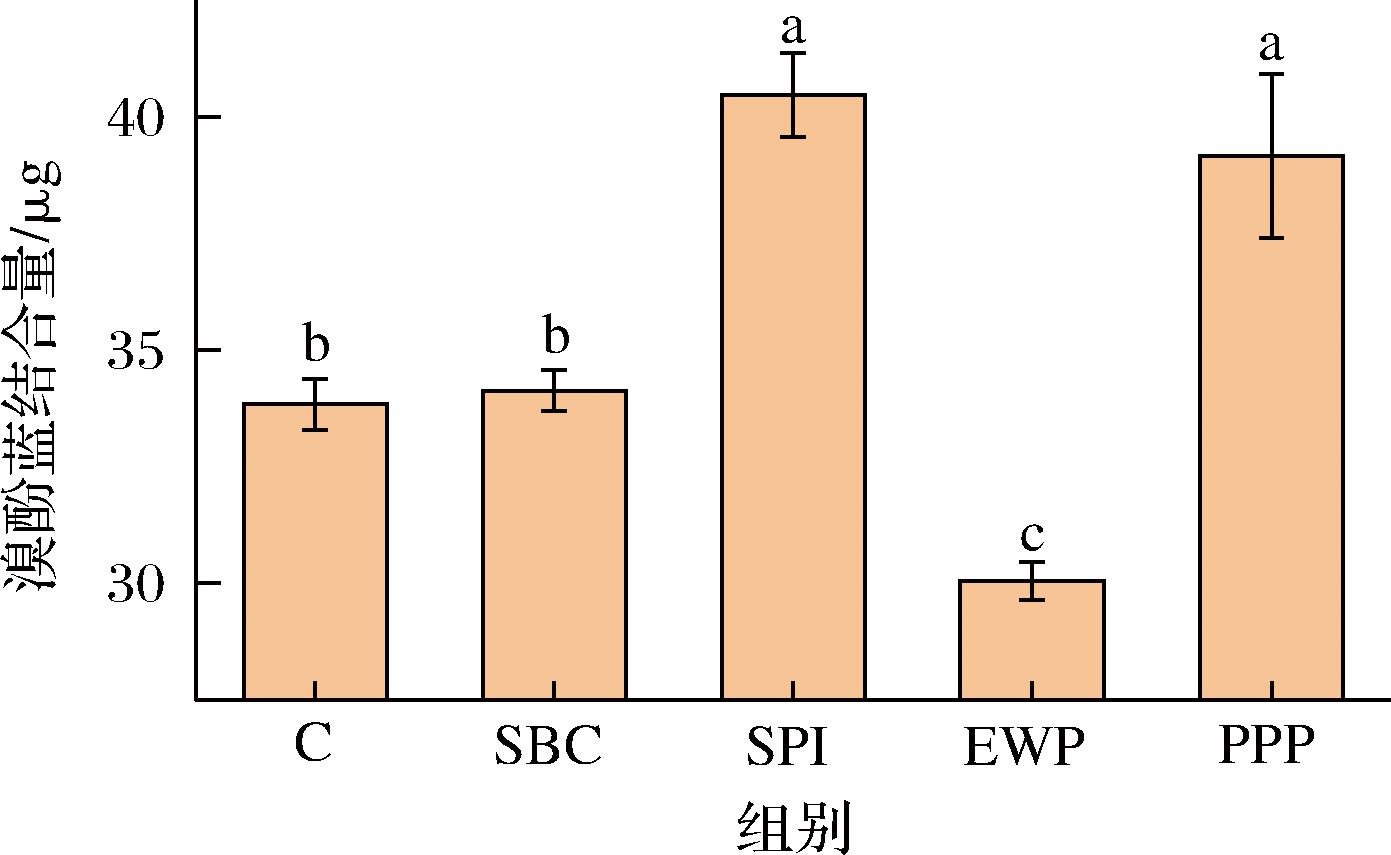
图7 不同非肉蛋白处理对表面疏水性的影响
Fig.7 Effect of different non-meat protein treatments on surface hydrophobicity
2.7 总巯基
MP主要组成成分肌球蛋白和肌动蛋白中均含有巯基且不含二硫键,其中肌球蛋白中巯基含量较高[27],巯基不稳定,易遭受羟自由基攻击,易形成二硫键使蛋白质发生交联聚合反应。如图8所示,(P<0.05)。未经过非肉蛋白处理的肌原纤维蛋白巯基含量为63.22 mmol/mg蛋白,添加PPP后含量上升至66.49 mmol/mg蛋白,上升了5.17%。根据上文疏水性分析结果可知,PPP使得MP疏水性增加,导致其不易接触溶液中的羟自由基从而减少了巯基向二硫键的转化。相较于对照组,SBC添加组总巯基含量显著下降,表明添加SBC使MP巯基被氧化生成二硫键,这是MP氧化聚集的主要途径。EWP含有巯基,所以添加EWP可一定程度上提高混合蛋白溶液中总巯基含量。此外SPI巯基含量在一定程度上抑制了巯基的损失,但效果并不显著(P>0.05)。
2.8 乳化活性及乳化稳定性的测定
乳化肉制品的质量和口感受肉中蛋白质的乳化性质影响。由图9可知,添加非肉蛋白的EAI均显著高于对照组,表明乳化能力和蛋白分子的数量呈现显著正相关性[28]。蛋白质间的相互作用能够影响其乳化性,PPP组的溶解度较高,能参与乳化的蛋白分子数量也较多,导致其乳化能力也高于其他组。SBC添加组乳化活性显著提高,可能是由于添加了SBC后,在脂肪滴表面形成了蛋白膜,有效降低了溶液体系的表面张力。MP中的肌球蛋白和肌动球蛋白被证明具有良好的乳化能力,可以维持乳液的稳定性[29-30]。SPI和EWP添加组EAI提高主要与肌球蛋白和肌动球蛋白增多有关,与上文蛋白组分分析结果一致。
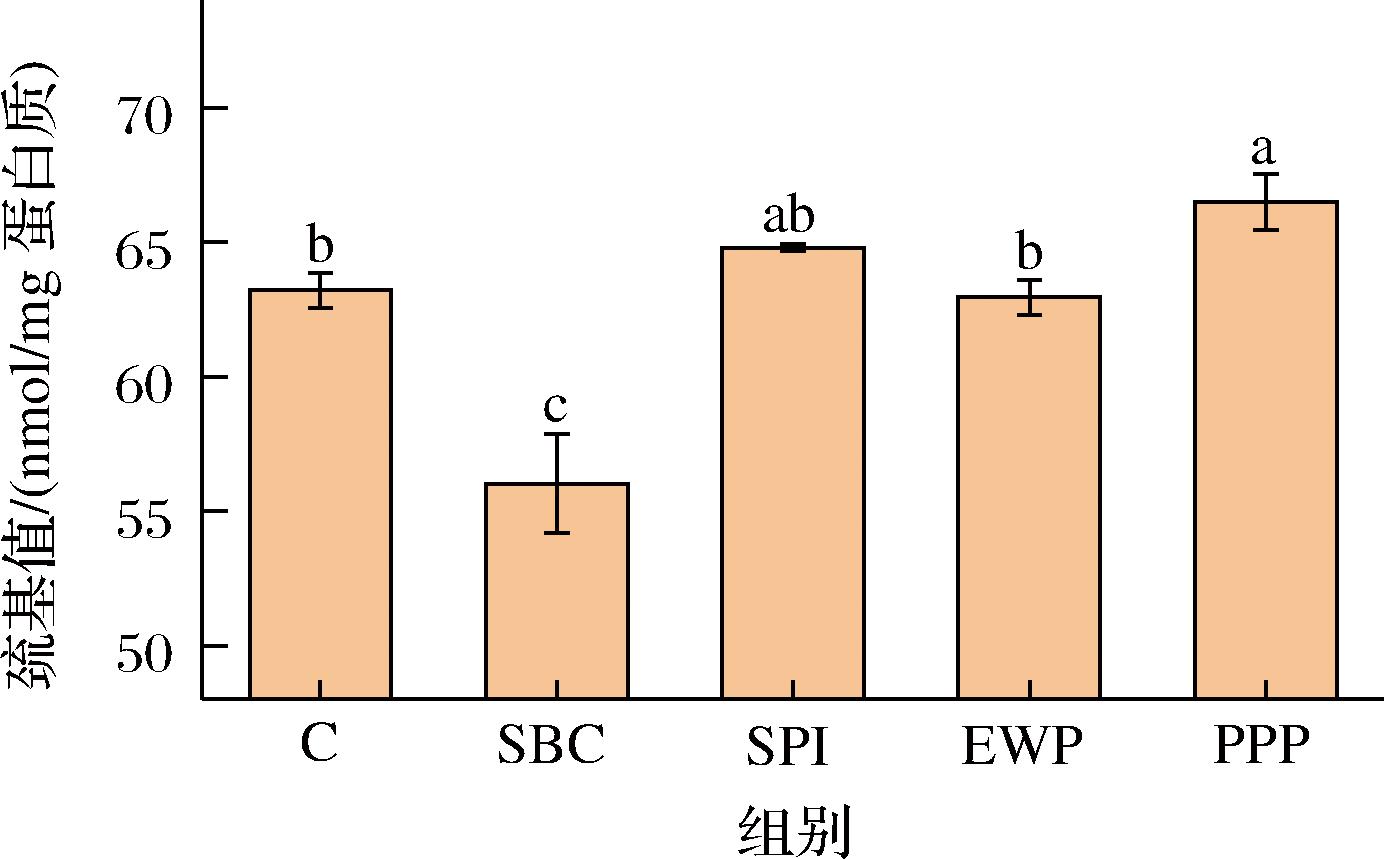
图8 不同非肉蛋白添加对肌原纤维蛋白巯基含量的影响
Fig.8 Effect of different non-meat protein additions on thiol content of myofibrillar proteins

图9 不同非肉蛋白处理对MP乳化性的影响
Fig.9 Effect of different non-meat protein treatments on EAI of MP
ESI反应了肉制品加工过程中蛋白质维持乳液体系稳定的能力[31]。由图9可知,空白MP乳液的ESI值为10.14。表明添加非肉蛋白能够显著提升猪肉MP乳液的稳定性,并在添加PPP时ESI指数相对较高且稳定。分析结果表明,乳化稳定性指数和样品黏度呈现显著正相关性。利用Stokes理论分析黏度与ESI指数的关系,相同浓度下,PPP乳状液的相分离的速率最慢,黏度反而最大,因此其ESI指数最高,经过测定,对照样品的黏度相比于其他组是最低的,这也导致了其乳状液ESI指数低于其他组。有学者研究表明,乳化活性的明显区别和蛋白种类密切相关[32]。因此,蛋白质的特异性差异,也可能导致本研究中不同非肉蛋白处理的MP乳化活性有明显区别的原因。
3 结论
分析结果表明SBC和PPP均能增加肌球蛋白重链含量,EWP、PPP可显著提高复合蛋白荧光强度。此外PPP与MP的交联最好,提高了复合蛋白的热稳定性,对其乳化特性也有积极影响。非肉蛋白复配均对MP表观黏度、乳化活性、乳化稳定性有促进作用,其中EWP和PPP处理后触变环面积分别增加了103.30%、100.70%。与对照组相比,SBC、SPI、EWP、PPP组平均粒径分别增大74.10%、72.02%、59.58%、111.19%。除EWP外其他复合凝胶疏水性均有所提高,其中SPI组和PPP组分别提高了19.61%、15.70%。总巯基实验结果显示,SBC添加组总巯基显著下降。该研究结果表明几种非肉蛋白,尤其是PPP能改善MP的性质,在肉制品加工中具有广阔的应用前景。
[1] ALI S, ZHANG W G, RAJPUT N, et al.Effect of multiple freeze-thaw cycles on the quality of chicken breast meat[J].Food Chemistry, 2015, 173:808-814.
[2] LAWRIE R A. Meat Science[M]. Preface to the fourth edition. Amsterdam: Elsevier, 1985: vii.
[3] UTRERA M, PARRA V, EST VEZ M.Protein oxidation during frozen storage and subsequent processing of different beef muscles[J].Meat Science, 2014, 96(2):812-820.
VEZ M.Protein oxidation during frozen storage and subsequent processing of different beef muscles[J].Meat Science, 2014, 96(2):812-820.
[4] ZHOU F B, ZHAO M M, SU G W, et al.Gelation of salted myofibrillar protein under malondialdehyde-induced oxidative stress[J].Food Hydrocolloids, 2014, 40:153-162.
[5] GORNALL A G, BARDAWILL C J, DAVID M M. Determination of serum proteins by means of the biuret reaction[J]. The Journal of Biological Chemistry, 1949, 177(2):751-766.
[6] YOUSSEF M K, BARBUT S.Fat reduction in comminuted meat products-effects of beef fat, regular and pre-emulsified canola oil[J].Meat Science, 2011, 87(4):356-360.
[7] HU H, CHEUNG I W Y, PAN S Y, et al.Effect of high intensity ultrasound on physicochemical and functional properties of aggregated soybean β-conglycinin and glycinin[J].Food Hydrocolloids, 2015, 45:102-110.
[8] GUO J J, ZHOU Y H, YANG K, et al.Effect of low-frequency magnetic field on the gel properties of pork myofibrillar proteins[J].Food Chemistry, 2019, 274:775-781.
[9] 楼宵玮, 蒋娅婷, 潘道东, 等.氯化钠对肌原纤维蛋白与风味物质相互作用的影响[J].食品科学, 2017, 38(5):74-79. LOU X W, JIANG Y T, PAN D D, et al.Effect of NaCl on the interaction of flavor compounds with myofibrillar proteins[J].Food Science, 2017, 38(5):74-79. [10] GAO X, XIE Y R, YIN T, et al.Effect of high intensity ultrasound on gelation properties of silver carp surimi with different salt contents[J].Ultrasonics Sonochemistry, 2021, 70:105326.
[11] SHEN X, FANG T Q, GAO F, et al.Effects of ultrasound treatment on physicochemical and emulsifying properties of whey proteins pre- and post-thermal aggregation[J].Food Hydrocolloids, 2017, 63:668-676.
[12] 刘光明, 余惠琳, 黄秀秀, 等.加工处理方式对蟹类原肌球蛋白的消化稳定性和过敏原性的影响[J].中国食品学报, 2011, 11(4):14-22. LIU G M, YU H L, HUANG X X, et al.Effects of processing methods on digestibility and allergenicity of crab tropomyosin[J].Journal of Chinese Institute of Food Science and Technology, 2011, 11(4):14-22.
[13] COFRADES S, CARECHE M, CARBALLO J, et al.Thermal gelation of chicken, pork and Hake (Merluccius merluccius, L) actomyosin[J].Meat Science, 1997, 47(1-2):157-166.
[14] ZHANG D J, YANG X, WANG Y C, et al.Proanthocyanidin B2 and transglutaminase synergistically improves gel properties of oxidized myofibrillar proteins[J].Food Chemistry, 2022, 391:133262.
[15] SHEN Q W, SWARTZ D R.Influence of salt and pyrophosphate on bovine fast and slow myosin S1 dissociation from actin[J].Meat Science, 2010, 84(3):364-370.
[16] 韩馨蕊, 李颖, 刘苗苗, 等.安石榴苷与焦磷酸钠对肌原纤维蛋白氧化稳定性及凝胶性能的影响[J].食品科学, 2022, 43(8):15-21. HAN X R, LI Y, LIU M M, et al.Effect of punicalagin combined with sodium pyrophosphate on the oxidative stability and gel properties of myofibrilar protein[J].Food Science, 2022, 43(8):15-21.
[17] 王晓霞, 李松波, 马力通, 等.三维荧光光谱法和圆二色谱法研究氨基比林与牛血清白蛋白分子的相互作用[J].中国测试, 2017, 43(9):74-80. WANG X X, LI S B, MA L T, et al.Study on the interaction between aminopyrine and bovine serum albumin by three-dimensional fluorescence spectrometry and circular dichroism spectrum[J].China Measurement &Test, 2017, 43(9):74-80.
[18] CAO Y G, XIONG Y L.Chlorogenic acid-mediated gel formation of oxidatively stressed myofibrillar protein[J].Food Chemistry, 2015, 180:235-243.
[19] ZOU Y, YANG H, ZHANG M H, et al.The influence of ultrasound and adenosine 5′-monophate marination on tenderness and structure of myofibrillar proteins of beef[J].Asian-Australasian Journal of Animal Sciences, 2019, 32(10):1611-1620.
[20] ZHOU C S, MA H L, YU X J, et al.Pretreatment of defatted wheat germ proteins (by-products of flour mill industry) using ultrasonic horn and bath reactors:Effect on structure and preparation of ACE-inhibitory peptides[J].Ultrasonics Sonochemistry, 2013, 20(6):1390-1400.
[21] ZHANG Z Y, YANG Y L, ZHOU P, et al.Effects of high pressure modification on conformation and gelation properties of myofibrillar protein[J].Food Chemistry, 2017, 217:678-686.
[22] LONG Z, ZHAO M M, ZHAO Q Z, et al.Effect of homogenisation and storage time on surface and rheology properties of whipping cream[J].Food Chemistry, 2012, 131(3):748-753.
[23] LIANG Q, ZHANG J S, XU C J, et al.Influence of temperature, pH, and ionic strength on the rheological properties of oviductus ranae hydrogels[J].African Journal of Biotechnology, 2014, 13(24):2435-2444.
[24] SIKORA M, ADAMCZYK G, KRYSTYJAN M, et al.Thixotropic properties of normal potato starch depending on the degree of the granules pasting[J].Carbohydrate Polymers, 2015, 121:254-264.
[25] RAIKOS V.Effect of heat treatment on milk protein functionality at emulsion interfaces.A review[J].Food Hydrocolloids, 2010, 24(4):259-265.
[26] KATO A, NAKAI S.Hydrophobicity determined by a fluorescence probe method and its correlation with surface properties of proteins[J].Biochimica et Biophysica Acta (BBA-Protein Structure), 1980, 624(1):13-20.
[27] XIA X F, KONG B H, XIONG Y L, et al.Decreased gelling and emulsifying properties of myofibrillar protein from repeatedly frozen-thawed porcine longissimus muscle are due to protein denaturation and susceptibility to aggregation[J].Meat Science, 2010, 85(3):481-486.
[28] LAMSAL B P, KOEGEL R G, GUNASEKARAN S.Some physicochemical and functional properties of alfalfa soluble leaf proteins[J].LWT-Food Science &Technology, 2007, 40(9):1520-1526.
[29] GALLUZZO S J, REGENSTEIN J M.Role of chicken breast muscle proteins in meat emulsion formation:Myosin, actin and synthetic actomyosin[J].Journal of Food Science, 1978, 43(6):1761-1765.
[30] NEELAKANTAN S, FRONING G W.Studies on the emulsifying characteristics of some intracellular turkey muscle proteins[J].Journal of Food Science, 1971, 36(4):613-615.
[31] SUN Y J, CHEN J H, ZHANG S W, et al.Effect of power ultrasound pre-treatment on the physical and functional properties of reconstituted milk protein concentrate[J].Journal of Food Engineering, 2014, 124:11-18.
[32] ZORBA Ö, KURT  , GENÇCELEP H.The effects of different levels of skim milk powder and whey powder on apparent yield stress and density of different meat emulsions[J].Food Hydrocolloids, 2005, 19(1):149-155.
, GENÇCELEP H.The effects of different levels of skim milk powder and whey powder on apparent yield stress and density of different meat emulsions[J].Food Hydrocolloids, 2005, 19(1):149-155.